食物过敏是一种复杂的由过敏原蛋白引起的人体异常或超常的免疫反应[1-2]。据统计,全球有10%的人口受到食物过敏的影响[3-5]。食物过敏原主要分为植物源和动物源两大类,其中,谷物、水果、蔬菜等植物过敏原(如大豆、坚果、芝麻等)是大部分国家和地区范围内常见的致敏物质[6-8]。而在我国,除植物过敏原外,鸡蛋、牛奶等动物源过敏原引发的过敏反应在婴幼儿过敏反应中更加常见[9-10]。过敏原会使过敏患者产生包括荨麻疹、瘙痒、呕吐、腹泻、哮喘和低血压等过敏反应[1-2,6]。降低过敏反应发生率的有效手段之一是避免接触或摄入含有过敏原的食物[7]。GB 7718—2011《预包装食品标签通则》规定要求,无论是用作配料还是在加工过程中直接带入的过敏原成分均需要在食品外包装进行标注[7-8,11]。目前,已建立了多种过敏原成分的检测方法,包括基于核酸检测层面的聚合酶链式反应(polymerase chain reaction,PCR)技术和基于蛋白质检测层面的液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)技术[12-16]。但PCR等传统核酸检测法最多仅可同时检测5~10种过敏原成分,而质谱法对食品的前处理步骤复杂,且要求检测人员具有丰富的专业知识和经验对数据进行分析[17-19]。因此,亟需建立一种高效、操作简单、灵敏度高的方法来检测食品中的多种过敏原成分。
多重连接依赖性探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术是一种特异性强、可实现单次反应多重检测20~50种靶标的技术方法[20-21]。该技术基于两条与靶序列完全互补、且彼此相邻的寡核苷酸片段探针。将两条探针与待测靶标序列杂交,高度特异性的连接酶只能将与靶序列完全互补的两个寡核苷酸探针进行连接得到核苷酸单链;通过使用探针上预设的通用引物对连接得到的核苷酸单链进行PCR扩增,获得特定大小的扩增产物,并进行毛细管电泳分离鉴别[20-24]。由于该技术针对的靶标序列小于PCR产物的长度,因此,非常适用于检测脱氧核糖核酸(deoxyribonucleic acid,DNA)高度片段化的深加工食品中过敏原成分[20-22]。目前,基于多重连接依赖性探针技术已成功研制出了针对多种常见动植物源过敏原成分的检测方法[22-26],但每项研究均只涉及几种过敏原,未能对食品过敏原检测进行系统性研究,不能满足各国法规对标签标识的要求。鉴于某些食品样品可能涉及10种以上过敏原的实际情况,因此需要建立更多靶标的筛查体系。
本研究建立一种可同时检测21种动植物过敏原成分的多重连接依赖性探针扩增(MLPA)技术,并对其进行灵敏度实验,并结合实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-fqPCR)检测技术对38种市售预包装食品中动植物过敏原成分进行比较分析。以期掌握市场上食品的过敏原成分污染情况,为食品过敏原安全筛查与监测提供强有力的技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
植物成分标准品材料:开心果、巴西坚果、芹菜、麸质(小麦、燕麦、大麦、黑麦)、夏威夷果、芝麻、榛子、大豆、花生、葵花籽、核桃、荞麦、腰果、杏仁、芥末、猕猴桃、芒果;动物成分标准品材料:鸡蛋、牛奶、甲壳类、鱼;38份市售预包装食品样本(涵盖市面上常见的可能含过敏原食品种类,包括方便食品、糖果、饼干、婴幼儿辅食、糕点、植物蛋白饮料、巧克力、冰淇淋、调味品等);DNA提取试剂盒(DP326):北京天根生化科技有限公司;NuClean Plant Genomic DNA Kit:江苏康为世纪生物科技有限公司;MLPA探针:武汉擎科生物公司;SALSA MLPA EK5 Reagent kit 100 reactions-FAM:荷兰MRC-Holland公司;毛细管电泳阴阳极缓冲液、POP-7胶、Hi-DiFormamide、GeneScan500 LIZdye Size Standard:美国ABI公司;Premix Ex Taq(Probe qPCR):宝生物工程(大连)公司。
1.2 仪器与设备
LEGEND MICRO 21通风型微量台式离心机:德国Eppendorf公司;C1000 Touch PCR仪、CFX96实时荧光定量PCR仪:美国Bio-Rad公司;A11 basic研磨仪:德国IKA公司;Tissue LyserII组织研磨仪、NanoDrop ONE超微量分光光度计:美国Thermo公司;3500毛细管基因分析仪:美国ABI公司。
1.3 方法
1.3.1 DNA的提取
液体样品在4 ℃条件下离心(4 800 r/min、10 min)后,取沉淀作为DNA提取起始样本;固体样品经研磨粉碎至均一粉末且无明显颗粒状态后,取均匀样品作为DNA提取起始样本。采取试剂盒法提取植物成分材料、动物成分材料及市售预包装食品样品的DNA,提取得到的DNA经NanoDrop ONE超微量分光光度计测定浓度和纯度,A260 nm/A280 nm值为1.7~2.0,DNA质量浓度稀释至为20 ng/μL,-20 ℃备用。
1.3.2 MLPA探针的设计与合成
MLPA技术所用探针包括左探针(left probe oligo,LPO)及右探针(right probe oligo,RPO)。21种过敏原成分中14种植物源过敏原成分的特异性检测探针参照文献[25-26]。本研究参考MRC-Holland公司有关MLPA引物的探针建议,对其余7种过敏原成分(鸡蛋、牛奶、甲壳类、鱼、荞麦、猕猴桃、芒果)的检测进行了设计。植物源性过敏原选择内转录间隔区序列(internal transcribed sequence,ITS)作为探针设计靶标[27];动物源性过敏原选择线粒体DNA作为探针设计靶标[28]。设计完成的探针在美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比例验证,确定探针特异性。新设计的7种过敏原MLPA探针序列见表1。设计合成的7种过敏原MLPA探针同14种植物过敏原MLPA探针混合得到探针混合液,探针混合液总共包括22对探针(其中麸质过敏原有2对探针),探针混合液中各探针含量为2 fmol。
表1 MLPA探针序列
Table 1 Probes and sequence used in MLPA technique

靶标 引物名称 引物序列(5'→3') 片段理论大小/bp片段实际大小/bp鸡蛋牛奶Egg-LPO Egg-RPO Milk-LPO Milk-RPO GGGTTCCCTAAGGGTTGGAgtCCTACATACCGCCGTCGCCAGCCCACCTCTA ATGAAAGAACAACAGTGAGCTCAATAGTCTAGATTGGATCTTGCTGGCAC GGGTTCCCTAAGGGTTGGAgtgtCATATACTCTCCTTGGTGACATGCCGCAACT AGACACGTCAACATGACTGACAATGATCgtgtTCTAGATTGGATCTTGCTGGCAC 102 109 99.44 107.36
续表

注:英文大写加粗为通用引物序列,英文小写加粗为填充序列,英文大写为特异性结合序列。
靶标 引物名称 引物序列(5'→3') 片段理论大小/bp片段实际大小/bp甲壳类114 113.32鱼120 116.98荞麦128 125.93芒果135 133.46猕猴桃Shrimp-LPO Shrimp-RPO Fish-LPO Fish-RPO Buckwheat-LPO Buckwheat-RPO Mango-LPO Mango-RPO Kiwifruit-LPO Kiwifruit-RPO GGGTTCCCTAAGGGTTGGAGGTATTTTGACCGTGCGAAGGTAGCATAATCATTAGT CTTTTAATTGGGGGCTTGTATGAATGGTTGGACAATCTAGATTGGATCTTGCTGGCAC GGGTTCCCTAAGGGTTGGATAACAGCGCAATCCTCTCCCAGAGTCCATATCGACGAG GGGGTTTACGACCTCGATGTTGGATCAGGACATCCTAATTCTAGATTGGATCTTGCTGGCAC GGGTTCCCTAAGGGTTGGAgtgtgtgtgtgtCAAGGACCACGAACAGAAGCGCGTCCCGAGCCT CCCGGTCGGCGTCGCGTCGTTTCTACGAAACAGAAgtgtgtTCTAGATTGGATCTTGCTGGCAC GGGTTCCCTAAGGGTTGGAGAAAAACAACCTAGTGATCCTGTCGTGCGGTTGCGTTCTCCCGGCCACGA GCTCTTCGACCCTAGAGACCGGGCAAAAGCtgtgtgtgtgtgtTCTAGATTGGATCTTGCTGGCAC GGGTTCCCTAAGGGTTGGGTTTGGTTTTTATAGCCTACTCTTTCTTCCCTTTGCCGGGTGTGCTCGTGTT GCCCTCTGGGTGACACTCTCATTCCCCGGTCAAATAACGAAgtgtgTCTAGATTGGATCTTGCTGGCAC 140 139.31
1.3.3 MLPA检测
以1.3.1提取的DNA为检测模板,其中动植物成分材料DNA用作MLPA检测体系标准阳性样品;动植物成分材料DNA等比例混匀后得到混合模板;反应条件和程序参照SALSAMLPAEK5Reagent试剂盒说明书和参考文献[20-24],具体步骤如下:
模板变性:5 μL DNA模板95 ℃变性5 min;模板与探针的杂交反应:将变性后的DNA模板5 μL加入1.5 μL探针混合物和1.5 μL SALSA缓冲液混匀,60 ℃杂交16 h;探针连接:杂交产物(8 μL)与连接酶混合液(3 μL缓冲液A,3 μL缓冲液B,25 μL H2O,1 μL Ligase-65)混合,54 ℃连接15 min,98 ℃、5 min灭活连接酶。
连接产物的PCR扩增:连接产物(40 μL)冷却至室温后加入PCR反应混合液(7.5 μL H2O,2 μL PCR primer mix,0.5 μL SALSA聚合酶),进行PCR扩增(95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸0 s,循环35次,72 ℃再延伸20 min)。
扩增产物毛细管电泳分析:取扩增后的PCR产物1 μL,加入9 μL HiDi和0.5 μL GeneScan 500 LIZ dye Size Standard(内参标记质控,用于确认电泳片段大小)混合,进行毛细管电泳分析。采用3500 Series Data Collection Software 3对MLPA检测结果进行分析,判断峰值的有无和大小,横坐标为扩增片段的大小(bp),纵坐标为检测的信号值的高低(相对荧光单位),扩增峰信号值≥1 000相对荧光单位的视为检出,每个检测设置2个平行。
1.3.4 MLPA技术灵敏度实验
为确定新建立的21种过敏原MLPA混合检测体系的最低可检测核酸质量浓度,梯度稀释21种动植物组分DNA等比例混合液,得到终质量浓度为5ng/μL、1ng/μL、0.1ng/μL、0.05 ng/μL的DNA溶液,取不同质量浓度的DNA溶液5 μL按照1.3.3中的方法进行21种过敏原MLPA多重检测,观察21种过敏原成分扩增信号峰,确定21种过敏原成分同时检出的最低可检测核酸质量浓度。
1.3.5 对市售预包装食品过敏原检测
分别采用MLPA、RT-fqPCR技术检测38份市售预包装食品中21种过敏原成分。
MLPA:按照1.3.3的检测方法,将1.3.1提取得到的38份市售预包装食品DNA用于MLPA检测。通过分析MLPA结果中21种过敏原成分扩增信号峰的大小和位置,确定预包装食品中21种过敏原成分是否存在。
RT-fqPCR:采用SN/T1961—2013系列《出口食品过敏原成分检测》、BJS 201707《植物蛋白饮料中植物源性成分鉴定》、BJS 202304《果汁中植物源性成分的测定》和文献报道的引物探针[29-33],对上述21种过敏原成分进行RT-fqPCR测定。反应体系、反应条件及结果判定参考上述标准和文献报道[29-33]。设定检测结果中阈值循环数(cycle threshold,Ct)值≤35的标记为“检出”,Ct值>40.0的标记为“未检出”,若Ct值为35~40,则重复试验1次,再次扩增后Ct值仍>35,则标记为“未检出”,统计分析38份市售样品最终过敏原成分的RT-fqPCR检测结果。
2 结果与分析
2.1 21种过敏原成分MLPA检测技术的建立
将本研究新设计合成的7种过敏原(鸡蛋、牛奶、甲壳类、鱼、荞麦、猕猴桃、芒果)检测探针对与相应过敏原标准阳性样品DNA进行单靶标MLPA检测,筛选得到特异性良好,可产生单一扩增峰的探针对。7种过敏原PCR扩增产物序列测序结果与BLAST核酸数据库比对证实为对应物种靶标序列,同源性均>98%,说明所测物质为目标待测物。
为确认新获得的7种过敏原探针对与原有14种植物源过敏原探针对所组成的混合探针体系进行MLPA检测的特异性和稳定性试验,研究21种过敏原探针对之间是否存在交叉反应。探针混合液与过敏原DNA模板混合物进行MLPA多重检测,21种过敏原MLPA毛细管电泳检测图见图1。由图1可知,21种过敏原成分均可以检测得到,不同过敏原扩增峰不存在相互干扰。21种过敏原成分扩增片段大小如下:开心果为88.18 bp、巴西坚果为90.11 bp、芹菜为94.17 bp、麸质1为95.37 bp、夏威夷果为97.13 bp、鸡蛋为99.44 bp、麸质2为101.79 bp、芝麻为103.16 bp、牛奶为107.36 bp、榛子为110.98 bp、甲壳类为113.32 bp、大豆为115.67 bp、鱼为116.98 bp、花生为119.61 bp、葵花籽为121.63 bp、核桃为123.75 bp、荞麦为125.93 bp、腰果为128.10 bp、杏仁为130.78 bp、芒果为133.46 bp、芥末为135.55 bp、猕猴桃为139.31 bp(检测麸质的探针为麸质1和麸质2,因未筛选获得可检测多种麸质成分的探针[26])。扩增峰实际大小和理论大小相差≤3 bp,目标峰左侧6~8 bp处出现的不规则低峰是由于主峰浓度过高而导致系统过载所致[34]。
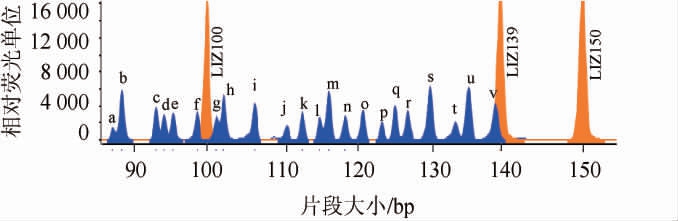
图1 21种过敏原MLPA产物毛细管电泳检测图
Fig.1 Capillary electrophoresis of the MLPA products using a mixture of 21 different allergens
开心果(a)、巴西坚果(b)、芹菜(c)、麸质1(d)、夏威夷果(e)、鸡蛋(f)、
麸质2(g)、芝麻(h)、牛奶(i)、榛子(j)、甲壳类(k)、大豆(l)、鱼(m)、
花生(n)、葵花籽(o)、核桃(p)、荞麦(q)、腰果(r)、杏仁(s)、芒果(t)、
芥末(u)、猕猴桃(v)。下同。
2.2 灵敏度实验结果
制备含有21种动植物组分DNA的梯度模板稀释液,用来确定所建立MLPA过敏原检测体系的灵敏度。不同质量浓度过敏原DNA的MLPA检测结果见图2。由图2可知,当DNA质量浓度为1 ng/μL、5 ng/μL时,21种过敏原成分的22对探针的靶标扩增峰均可检测得到,扩增峰信号大小均>1 000相对荧光单位。但当DNA质量浓度为0.1 ng/μL时,只有部分靶标扩增峰可被检测得到,且存在非特异性杂峰干扰,表明MLPA混合检测体系对待测样品DNA模版的最低可检出限为1 ng/μL,当DNA质量浓度<1 ng/μL时,MLPA检测体系可能无法检出待测物中所有过敏原成分,或出现干扰峰图影响结果判读。
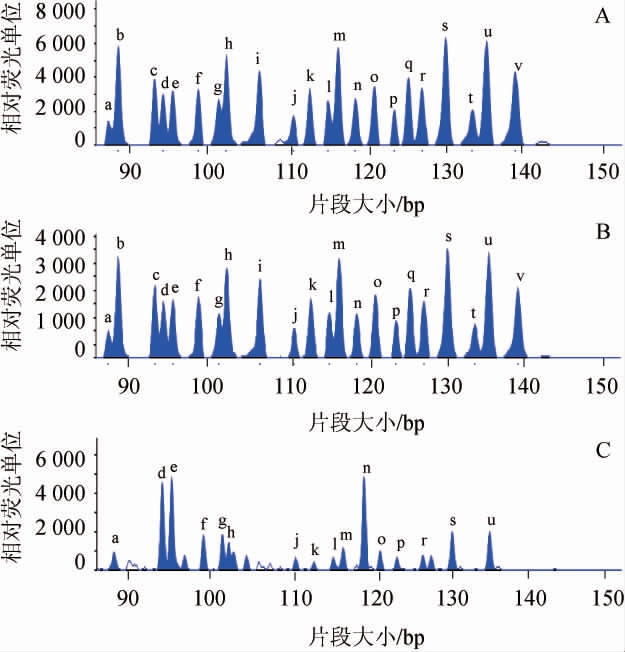
图2 不同质量浓度过敏原脱氧核糖核酸的MLPA产物毛细管电泳检测图
Fig.2 Capillary electrophoresis of MLPA products with different mass concentrations of allergen deoxyribonucleic acid
A、B、C中过敏原DNA质量浓度分别为5 ng/μL、1 ng/μL和0.1 ng/μL。
2.3 市售预包装食品21种过敏原的检测结果和比较分析
为了解市售预包装食品过敏原标注情况是否准确,分别采用MLPA和RT-fqPCR技术对市售38种预包装食品进行检测,可用于判断食品过敏原检测的可行性和准确性。实际样品过敏原标识情况及检测结果见表2。
表2 市售食品过敏原检测结果
Table 2 Allergen determination results of commercially available food

序号 样品名称 标注含有过敏原成分 可能含有过敏原成分 MLPA检测结果 RT-fqPCR检测结果1 2 3 4 5 6烤燕麦花生夹心巧克力软质牛轧糖杏仁夹心糖可可巧克力坚果口味冰淇淋麸质、乳制品花生乳制品、大豆、花生大豆、花生、杏仁麸质、乳制品、大豆乳制品、坚果制品坚果制品、大豆制品麸质芝麻、坚果、蛋制品、麸质乳制品、腰果、芝麻花生、芝麻和坚果花生、麸质、蛋制品麸质1、牛奶、麸质2、鸡蛋、花生、杏仁、大豆花生、牛奶花生、麸质1、鸡蛋、麸质2、芝麻、牛奶花生、杏仁麸质1、巴西坚果、鸡蛋、麸质2、牛奶、芝麻牛奶、杏仁燕麦、杏仁花生牛奶、花生杏仁、花生小麦、大麦、黑麦、牛奶牛奶、杏仁
续表
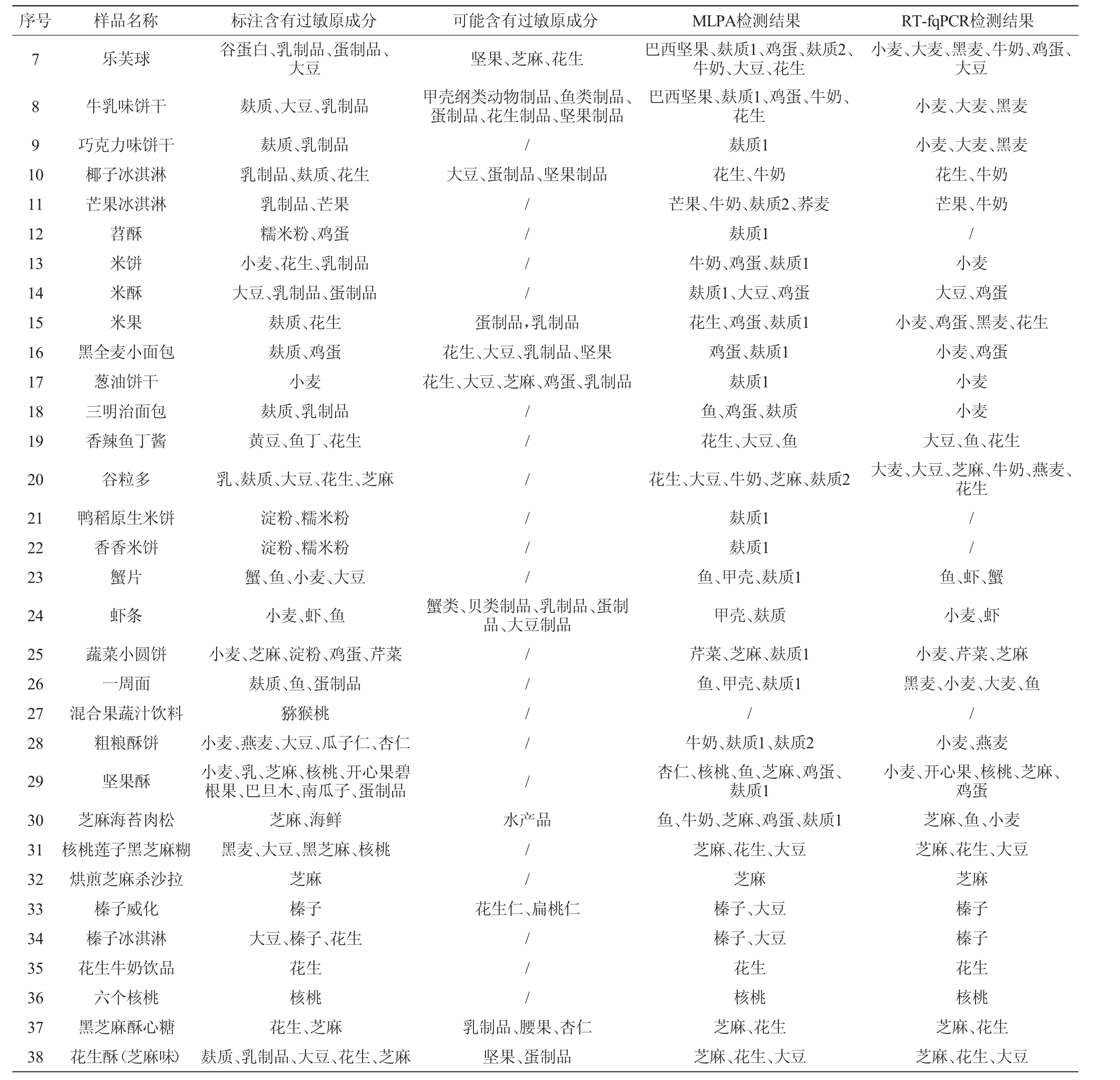
注:“/”表示未检测到任何过敏原成分。
序号 样品名称 标注含有过敏原成分 可能含有过敏原成分 MLPA检测结果 RT-fqPCR检测结果7 8 9 1 0乐芙球 坚果、芝麻、花生甲壳纲类动物制品、鱼类制品、蛋制品、花生制品、坚果制品/大豆、蛋制品、坚果制品小麦、大麦、黑麦、牛奶、鸡蛋、大豆11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38牛乳味饼干巧克力味饼干椰子冰淇淋芒果冰淇淋苕酥米饼米酥米果黑全麦小面包葱油饼干三明治面包香辣鱼丁酱谷粒多鸭稻原生米饼香香米饼蟹片虾条蔬菜小圆饼一周面混合果蔬汁饮料粗粮酥饼坚果酥芝麻海苔肉松核桃莲子黑芝麻糊烘煎芝麻杀沙拉榛子威化榛子冰淇淋花生牛奶饮品六个核桃黑芝麻酥心糖花生酥(芝麻味)谷蛋白、乳制品、蛋制品、大豆麸质、大豆、乳制品麸质、乳制品乳制品、麸质、花生乳制品、芒果糯米粉、鸡蛋小麦、花生、乳制品大豆、乳制品、蛋制品麸质、花生麸质、鸡蛋小麦麸质、乳制品黄豆、鱼丁、花生乳、麸质、大豆、花生、芝麻淀粉、糯米粉淀粉、糯米粉蟹、鱼、小麦、大豆小麦、虾、鱼小麦、芝麻、淀粉、鸡蛋、芹菜麸质、鱼、蛋制品猕猴桃小麦、燕麦、大豆、瓜子仁、杏仁小麦、乳、芝麻、核桃、开心果碧根果、巴旦木、南瓜子、蛋制品芝麻、海鲜黑麦、大豆、黑芝麻、核桃芝麻榛子大豆、榛子、花生花生核桃花生、芝麻麸质、乳制品、大豆、花生、芝麻// / /蛋制品,乳制品花生、大豆、乳制品、坚果花生、大豆、芝麻、鸡蛋、乳制品// / / / /小麦、大麦、黑麦小麦、大麦、黑麦花生、牛奶芒果、牛奶/小麦大豆、鸡蛋小麦、鸡蛋、黑麦、花生小麦、鸡蛋小麦小麦大豆、鱼、花生大麦、大豆、芝麻、牛奶、燕麦、花生//蟹类、贝类制品、乳制品、蛋制品、大豆制品// / / /水产品//花生仁、扁桃仁// /乳制品、腰果、杏仁坚果、蛋制品巴西坚果、麸质1、鸡蛋、麸质2、牛奶、大豆、花生巴西坚果、麸质1、鸡蛋、牛奶、花生麸质1花生、牛奶芒果、牛奶、麸质2、荞麦麸质1牛奶、鸡蛋、麸质1麸质1、大豆、鸡蛋花生、鸡蛋、麸质1鸡蛋、麸质1麸质1鱼、鸡蛋、麸质花生、大豆、鱼花生、大豆、牛奶、芝麻、麸质2麸质1麸质1鱼、甲壳、麸质1甲壳、麸质芹菜、芝麻、麸质1鱼、甲壳、麸质1/牛奶、麸质1、麸质2杏仁、核桃、鱼、芝麻、鸡蛋、麸质1鱼、牛奶、芝麻、鸡蛋、麸质1芝麻、花生、大豆芝麻榛子、大豆榛子、大豆花生核桃芝麻、花生芝麻、花生、大豆鱼、虾、蟹小麦、虾小麦、芹菜、芝麻黑麦、小麦、大麦、鱼/小麦、燕麦小麦、开心果、核桃、芝麻、鸡蛋芝麻、鱼、小麦芝麻、花生、大豆芝麻榛子榛子花生核桃芝麻、花生芝麻、花生、大豆
由表2可知,37个样品标注的过敏原成分可被MLPA法检出(19个样品所有标注过敏原成分被全部检出,检出率为51.4%),34个样品标记的过敏原成分可被RT-fqPCR检出(15个样品所有标注过敏原成分被全部检出,检出率为44.1%),同时,MLPA检测法还在标注了可能含有过敏原成分的6个样品中检测到可能的过敏原成分,说明MLPA检测技术可以同时将不同过敏原检出,对实际食品样品过敏原成分的筛查效率及检出率高于RT-fqPCR法。采用MLPA法在10个样品中检测出了未标记的过敏原成分,其中最多被检出的未标注过敏原成分为鸡蛋,说明可能在食品加工原料或相同生产线上存在部分过敏原成分的混入,亦或生产厂家未关注重视类似鸡蛋类过敏原成分,遗漏标注。有部分食品标注的过敏原成分,采用MLPA和RT-fqPCR法均未检出,如序号为24、25、27等样品,推测其原因可能是在食品生产中以上成分添加量极低或者仅添加食品风味剂。通过比较MLPA和RT-fqPCR的检测结果表明,17个样品的MLPA和RT-fqPCR检测结果完全一致,有3个样品过敏原成分被MLPA法检出,但未被RT-fqPCR法检出,且部分样品中MLPA检测出的过敏原成分多于RT-fqPCR法,说明在实际样品过敏原检测中,MLPA技术的灵敏度更高,对食品DNA可检测质量要求相对较低,更适合对实际样品中存在的过敏原标识及风险成分进行多重检测分析。
3 结论
本研究建立的MLPA检测技术能够同时检测食品中21种动植物食品过敏原。本方法特异性较好、灵敏度高,扩增峰之间不存在交叉干扰,最低可检出的DNA质量浓度为1 ng/μL;与RT-fqPCR法对比,本研究建立的MLPA检测技术检测步骤简单,检测通量大,更适用于加工食物中多重过敏原的检测,且可对商品标注及未标注的潜在过敏原成分同时进行分析,为食品过敏原检测及过敏原标注的市场监管提供了更加高效、准确的技术手段。
[1]SICHERER S H,SAMPSON H A.Food allergy:A review and update on epidemiology,pathogenesis,diagnosis,prevention,and management[J].J Allergy Clin Immunol,2018,141(1):41-58.
[2]LOPES J P, SICHERER S.Food allergy: epidemiology, pathogenesis,diagnosis,prevention,and treatment[J].Curr Opin Immunol,2020,66:57-64.
[3]LOH W,TANG M L K.The epidemiology of food allergy in the global context[J].Int J Environ Res Pub Heal,2018,15(9):2043.
[4]TEDNER S G,ASARNOJ A,THULIN H,et al.Food allergy and hypersensitivity reactions in children and adults-a review[J].J Int Med,2021,291(3):283-302.
[5]FENG H,NAN L,LU Y A,et al.Prevalence of parent-reported food allergy among children in China:A population-based cross-sectional survey[J].Front Immunol,2022,13:982660.
[6]张瑞瑞,赵雪艳.浅析类过敏反应研究概况[J].中外企业家,2019(22):236.
[7]赵婷婷.简述食品过敏原的管控[J].食品安全导刊,2020(22):46-48.
[8]杨若婷,戴智勇,潘丽娜,等.食物过敏原检测标准及标识现状[J].食品工业科技,2022,43(11):1-10.
[9]王晓阳.儿童牛奶蛋白过敏的临床特征及其短期预后的危险因素分析[D].北京:首都儿科研究所,2021.
[10]鞠定金.基于中国鸡蛋过敏人群的主要致敏原表位定位研究[D].南昌:南昌大学,2022.
[11]闫瑞.消费者食品过敏原标签的认知现状与对策研究[D].太原:山西医科大学,2016.
[12]宁亚维,杨正,马梦戈,等.食品中常见过敏原及检测技术研究进展[J].食品科学,2021,42(15):319-328.
[13]杨阳,何欣蓉,何少贵,等.食品中过敏原及其检测方法的研究进展[J].食品安全质量检测学报,2021,12(14):5497-5506.
[14]郭颖慧,霍胜楠,孟静,等.食品过敏原检测技术研究进展[J].食品安全质量检测学报,2019,10(16):5276-5281.
[15]王晶,杨彤,王芳,等.环介导等温扩增技术在食品过敏原检测中的应用[J].食品科技,2022,47(11):249-254.
[16]丁亮,付琳,吴秀莲,等.基于蛋白质和DNA的食品过敏原检测技术的研究进展[J].中国酿造,2017,36(7):157-160.
[17]王玮,韩建勋,吴亚君,等.芥末等8种食物过敏原的多重PCR检测技术[J].食品与发酵工业,2011,37(6):156-160.
[18]曾晓琮,陈茵茵,韩志杰,等.植物类过敏原多重核酸检测技术研究进展[J].现代食品,2022,28(22):43-46.
[19]PAFUNDO S, GULLI M, MARMIROLI N.Multiplex real-time PCR using SYBRR GreenERTM for the detection of DNA allergens in food[J].Anal Bioanal Chem,2010,396(5):1831-1839.
[20]SCHOUTEN J P,MCELGUNN C J,WAAIJER R,et al.Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification[J].Nucleic Acids Res,2002,30(12):57.
[21]王雨萌,周柯,邵春艳,等.多重连接探针扩增技术(MLPA)在病原微生物检测与疾病诊断中的应用[J].农业生物技术学报,2021,29(10):2031-2042.
[22]UNTERBERGER C, LUBER F, DEMMEL A, et al.Simultaneous detection of allergenic fish,cephalopods and shellfish in food by multiplex ligation-dependent probe amplification[J].Eur Food Res Technol,2014,239:559-566.
[23]EHLERT A,DEMMEL A,HUPFER C,et al.Simultaneous detection of DNA from ten food allergens by ligation-dependent probe amplification[J].Food Addit Contam: Part A,2009,26(4):409-418.
[24]LÓPEZ-CALLEJA I M,GARCÍA A,MADRID R,et al.Multiplex ligation-dependent probe amplification(MLPA)for simultaneous detection of DNA from sunflower,poppy,flaxseed,sesame and soy allergenic ingredients in commercial food products[J].Food Control,2017,71:301-310.
[25]王鸣秋,刘艳,李诗瑶,等.基于多重连接探针扩增技术的食品中六重过敏原成分检测[J].食品科学,2023,44(4):300-305.
[26]刘艳,王鸣秋,李诗瑶,等.基于多重连接依赖探针扩增(MLPA)技术检测加工食品中过敏原成分[J].现代食品科技,2023,39(6):290-297.
[27]BESSE P.Nuclear ribosomal RNA genes:ITS region[J].Molecular Plant Taxonomy: Methods and Protocols,2014,1115:141-149.
[28]王文君.物种特异性和保守性DNA序列筛选及其在畜产品种源成分鉴定中的应用[D].武汉:华中农业大学,2019.
[29]贾敏,张银志,张亦凡,等.牛奶β-乳球蛋白质实时荧光定量PCR检测方法的建立[J].食品与生物技术学报,2015,34(6):605-612.
[30]MIYAZAKI A,WATANABE S,OGATA K,et al.Real-time PCR detection methods for food allergens (wheat, buckwheat, and peanuts) using reference plasmids[J].J Agric Food Chem,2019,67(19):5680-5686.
[31]SUH S M,PARK S B, KIM M J, et al.Simultaneous detection of fruit allergen-coding genes in tomato, apple, peach and kiwi through multiplex PCR[J].Food Sci Biotech,2019,28(5):1593-1598.
[32]MARTINA T,PIERBONI E,RONDINI C,et al.Sesame,pistachio,and macadamia nut: development and validation of new allergenic systems for fast real-time PCR application[J].Foods,2020,9(8):1085.
[33]RODER M, FILBERT H, HOLZHAUSER T.A novel, sensitive and specific real-time PCR for the detection of traces of allergenic Brazil nut(Bertholletia excelsa)in processed foods[J].Anal Bioanal Chem,2010,398(5):2279-2288.
[34]MUSTORP S L,DROMTORP S M,HOLCK A L.Multiplex,quantitative, ligation-dependent probe amplification for determination of allergens in food[J].J Agric Food Chem,2011,59(10):5231-5239.