腐乳属于即食食品,是中国传统的经微生物发酵制成的豆制品。腐乳不仅含有黄豆本身的高蛋白质、脂肪和黄豆异黄酮等营养物质[1-3],还有延缓衰老,降低血压水平及胆固醇的保健作用[4-5],深受消费者喜爱。腐乳多采用开放式或半开放式发酵工艺制作,手工操作环节较多,包括前发酵、腌坯、后发酵等环节,这些环节在操作过程中很可能被环境中的微生物杂菌污染:如培菌时可能会被嗜温性芽孢杆菌污染;腌制、拌料、装瓶时可能会被微好氧菌、兼性厌氧菌和专性厌氧菌污染,带来食源性疾病的风险[6-7],这不仅影响产品品质还会给消费者带来安全隐患。
有研究发现,发酵豆制品发酵过程中存在的细菌门主要有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes),真菌门主要有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉亚门(Mucoromycota)等[8-9],这些微生物代谢产生的大量产物可能会对抗生素具有耐药性的效果[10]。联合国粮农组织(Food and Agriculture Organization of the United Nation,FAO)/世界卫生组织(World Health Organization,WHO)指出,长时间使用的益生菌菌株会携带耐药基因并发生转移,即益生菌的抗性基因会转移给致病菌,而其耐药基因则会随食用过程转移给人体,对人体造成损伤[11-14]。
目前,微生物耐药性监测方法主要有牛津杯法、纸片扩散法(K-B法)、琼脂稀释法等[15-16],这些方法不仅耗时长,结果受外界影响大,难于满足快速、准确的要求,而且这些方法是基于可培养的活菌基础上进行的,但腐乳中含有部分不可培养的微生物,因此,建立非培养方式的检测方法是必要的。分子生物学检测方法可以通过分析微生物的基因序列研究食品发酵过程中微生物的多样性和功能性,实现快速高效准确地对大批量样品进行检验,因此,借助分子生物学检测方法在食品检测中得到广泛应用[17-22]。但国内外对于使用非培养方式检测发酵食品中微生物耐药基因的研究报道相对较少[23],且关于腐乳中微生物耐药基因的研究鲜见报道。
本研究根据腐乳中微生物全基因组测序结果中耐药基因的丰度筛选出3种耐药基因(Baca、Emra、Imrp)设计引物,建立一种非培养方式—实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-fqPCR)方法检测不同腐乳样品中微生物可能存在的耐药基因,并对该方法的灵敏度、抗干扰能力及重复性进行检测,最后应用于市售腐乳样品中耐药基因的检测,以期为我国市售腐乳的食品安全风险筛查分析提供理论方法基础。
1 材料与方法
1.1 材料与试剂
当地商场及超市以及线上购买的47批次不同的腐乳,其中包括15批次青方腐乳、16批次白腐乳、16批次红方腐乳,为保障商家及品牌隐私,其中对于青方腐乳的命名为A1~A15、白方方腐乳的命名为B1~B16、红方腐乳的命名为C1~C16。
黄豆基因组脱氧核糖核酸(deoxyribonucleicacid,DNA):保藏于本实验室;十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)裂解液、Tris-乙二胺四乙酸(Tris-ethylene diamine tetraacetic acid,TE)缓冲液、无菌水:实验室自制;蛋白酶K(>30 U/mg)、溶菌酶(≥20 000 U/mg):美国Promega公司;Tris饱和酚(分析纯):生工(上海)股份有限公司;三氯甲烷、异戊醇、无水乙醇(均为分析纯):国药集团化学试剂有限公司;TB Green Premix EX Taq:日本宝生物公司。其他试剂均为国产分析纯。
1.2 仪器与设备
7500 Fast荧光定量PCR仪:美国ABI公司;Milli-Q超纯水机:德国Merck公司;Vortex3000涡旋振荡器:德国Wiggens公司;Eppendorf 5804离心机:德国Eppendorf公司;5430R振荡水浴槽:德国艾本德有限公司;ESCO LA2-4A1生物安全柜:新加坡艺思高公司;DS-11微量紫外分析仪:美国丹诺尔公司。
1.3 方法
1.3.1 腐乳中微生物菌群总基因组脱氧核糖核酸的提取
取三瓶同一生产日期、批号的腐乳样品摇匀,汤汁混匀倒入无菌袋中,取10 mL混合汤汁,3 000 r/min离心5 min,取上清,混匀,重复操作一次;将上清9 000 r/min离心5 min,去上清,沉淀中加入5 mL无菌水,涡旋混匀,再次9 000 r/min离心5 min,去上清,以更好地去除汤汁中含有的糖、盐等物质,重复操作一次。
为更好的水解样品中多余物质得到更多的菌体细胞,预处理样品中加入蛋白酶K和CTAB,然后进行全基因组DNA提取[24],用TE缓冲液溶解,-20 ℃保存,备用。
1.3.2 引物设计
根据腐乳中微生物全基因组测序结果中耐药基因的丰度筛选出3种耐药基因,包括杆菌肽类耐药基因(Baca)、氟喹诺酮类耐药基因(Emra)、四环素类、林可霉素类、链霉素类耐药基因(Imrp),采用primer6设计引物,具体序列信息见表1。
表1 本研究所用耐药基因引物信息
Table 1 Primers of drug resistance genes used in the study

抗生素 耐药基因 引物序列(5'→3') 碱基长度/bp 退火温度/℃杆菌肽类Baca 143 56氟喹诺酮类四环素类、林可霉素类链霉素类Emra 141 54 Imrp F-GGTATTGTTGAAGGCTTGAC R-CCGAGTTGAATGGCATAATC F-ATAGTATCATGGCGAGCATT R-TCAAGCCAAGTTCACCAAT F-TCGATTGACCAAGGACTG R-ACGCCATTGTAAGAACCA 216 54
1.3.3 RT-fqPCR扩增条件
以提取的基因组DNA为模板,选择表2中的引物进行RT-fqPCR,RT-fqPCR扩增体系:TB Green Premix EX Taq 10 μL,上、下游引物(5 μmol/L)各1 μL,DNA模板2.0 μL,无菌水补足至20 μL。RT-fqPCR扩增参数:95 ℃预变性30 s;95 ℃变性30 s,根据耐药基因设定不同温度退火35 s;72 ℃延伸40 s,38个循环;72 ℃再延伸10 min。
表2 实时荧光定量聚合酶链式反应法检测3种耐药基因的灵敏度试验结果
Table 2 Sensitivity test results of real-time fluorescent quantitative PCR method for detecting three kinds of drug resistance genes
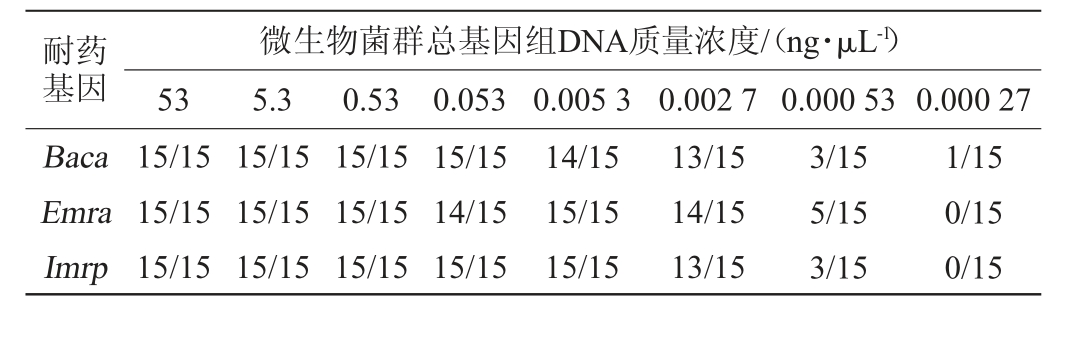
耐药基因Baca Emra Imrp微生物菌群总基因组DNA质量浓度/(ng·μL-1)53 5.3 0.53 0.053 0.005 3 0.002 7 0.000 53 0.000 27 15/15 15/15 15/15 15/15 15/15 15/15 15/15 15/15 15/15 15/15 14/15 15/15 14/15 15/15 15/15 13/15 14/15 13/15 3/15 5/15 3/15 1/15 0/15 0/15
1.3.4 RT-fqPCR方法的方法学考察
灵敏度检测:将腐乳中提取的微生物菌群总基因组DNA梯度稀释为53 ng/μL、5.3 ng/μL、0.53 ng/μL、0.053 ng/μL、0.005 3 ng/μL、0.002 7 ng/μL、0.000 53 ng/μL、0.000 27 ng/μL,分别对3种耐药基因进行RT-fqPCR扩增,每个质量浓度做5个平行,试验重复3次。
抗干扰能力检测:将腐乳中提取的微生物菌群总基因组DNA梯度稀释为53 ng/μL、5.3 ng/μL、0.53 ng/μL、0.053 ng/μL、0.005 3 ng/μL,分别添加0、0.01 ng/μL、0.1 ng/μL、1 ng/μL、10 ng/μL的黄豆基因组DNA,混匀,分别对3种耐药基因进行RT-fqPCR扩增,每个试验重复3次。
重复性测试:选择青方腐乳、白方腐乳和红方腐乳提取的微生物菌群总基因组DNA进行梯度稀释,分别对3种耐药基因进行RT-fqPCR扩增,每种腐乳的3种耐药基因均平行测定7次,计算循环阀值(cycle threshold,Ct)的相对标准偏差(relative standard deviation,RSD),考察该方法的重复性。
1.3.5 市售腐乳样品的检测
采用RT-fqPCR扩增法对市售的47批次腐乳样品中的3种耐药基因进行检测。每个样品3个平行。
1.3.6 数据处理采用统计学软件IBM SPSS Statistics 2.5对数据进行独立样品t检验的差异显著性分析。
2 结果与分析
2.1 RT-fqPCR法检测腐乳耐药基因的灵敏度试验
腐乳中微生物种类多样,除优势菌外还有大量微量菌[25-26],为更好的检测腐乳中微量菌的耐药基因,对RT-fqPCR法的灵敏度进行考察,结果见表2。
由表2可知,Baca、Emra和Imrp 3种耐药基因可被稳定检出的微生物菌群总基因组DNA最低质量浓度均为0.0027 ng/μL,微生物菌群总基因组DNA质量浓度为0.000 53 ng/μL时偶尔也可检出,但检出率低,故确定检测灵敏度为0.002 7 ng/μL,因每次扩增体系中添加2 μL微生物菌群总基因组DNA提取液,故确定建立的RT-fqPCR检测方法的检出限为5.4 pg。
2.2 RT-fqPCR法检测腐乳耐药基因的抗干扰能力试验
腐乳样品中有大量的黄豆,虽然提取的主要是汤汁的DNA,但核酸中避免不了含有一定量的黄豆基因,可能会对扩增有一定的影响。因此,在腐乳提取的微生物菌群总基因组DNA中添加黄豆DNA并进行RT-fqPCR扩增,考察RT-fqPCR法的抗干扰能力,结果见表3。
表3 实时荧光聚合酶链式反应法检测3种耐药基因的抗干扰能力试验结果
Table 3 Anti-interference ability test results of real-time fluorescent quantitative PCR method for detecting three kinds of drug resistance genes
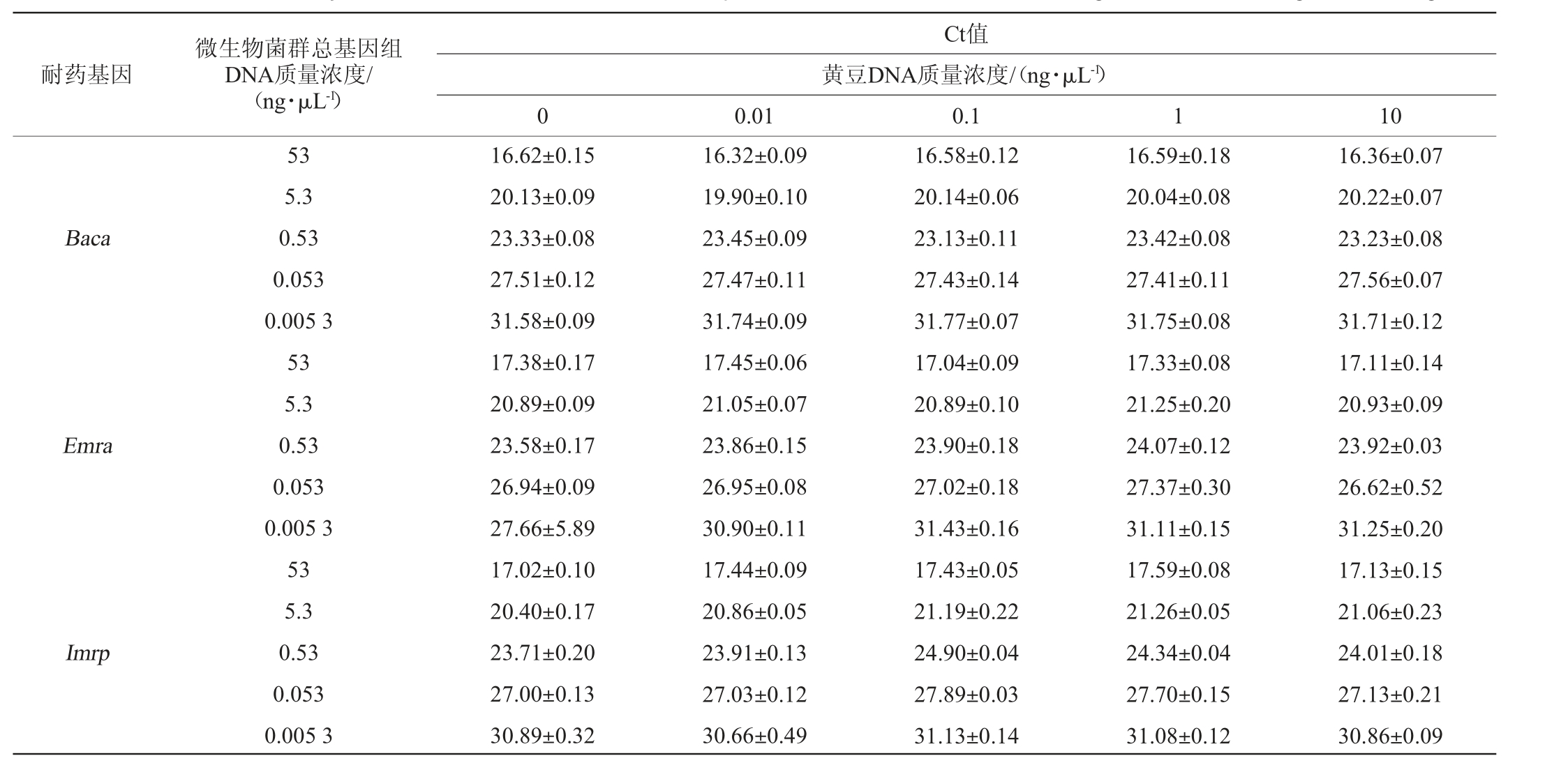
耐药基因Baca Emra Imrp微生物菌群总基因组DNA质量浓度/(ng·μL-1)53 5.3 0.53 0.053 0.005 3 53 5.3 0.53 0.053 0.005 3 53 5.3 0.53 0.053 0.005 3 Ct值黄豆DNA质量浓度/(ng·μL-1)0 0.01 0.1 1 10 16.62±0.15 20.13±0.09 23.33±0.08 27.51±0.12 31.58±0.09 17.38±0.17 20.89±0.09 23.58±0.17 26.94±0.09 27.66±5.89 17.02±0.10 20.40±0.17 23.71±0.20 27.00±0.13 30.89±0.32 16.32±0.09 19.90±0.10 23.45±0.09 27.47±0.11 31.74±0.09 17.45±0.06 21.05±0.07 23.86±0.15 26.95±0.08 30.90±0.11 17.44±0.09 20.86±0.05 23.91±0.13 27.03±0.12 30.66±0.49 16.58±0.12 20.14±0.06 23.13±0.11 27.43±0.14 31.77±0.07 17.04±0.09 20.89±0.10 23.90±0.18 27.02±0.18 31.43±0.16 17.43±0.05 21.19±0.22 24.90±0.04 27.89±0.03 31.13±0.14 16.59±0.18 20.04±0.08 23.42±0.08 27.41±0.11 31.75±0.08 17.33±0.08 21.25±0.20 24.07±0.12 27.37±0.30 31.11±0.15 17.59±0.08 21.26±0.05 24.34±0.04 27.70±0.15 31.08±0.12 16.36±0.07 20.22±0.07 23.23±0.08 27.56±0.07 31.71±0.12 17.11±0.14 20.93±0.09 23.92±0.03 26.62±0.52 31.25±0.20 17.13±0.15 21.06±0.23 24.01±0.18 27.13±0.21 30.86±0.09
由表3可知,在不同质量浓度的腐乳微生物菌群总基因组DNA中分别添加不同质量浓度的黄豆DNA,RT-fqPCR扩增3种耐药基因的Ct值无显著变化(P>0.05),表明建立的RT-fqPCR检测方法抗干扰能力较强。
2.3 RT-fqPCR法检测腐乳耐药基因的重复性试验
对建立的方法进行重复性测试,结果见表4。
表4 实时荧光定量聚合酶链式反应法检测3种耐药基因的重复性试验结果
Table 4 Repeatability tests results of real-time fluorescent quantitative PCR method for detecting three kinds of drug resistance genes
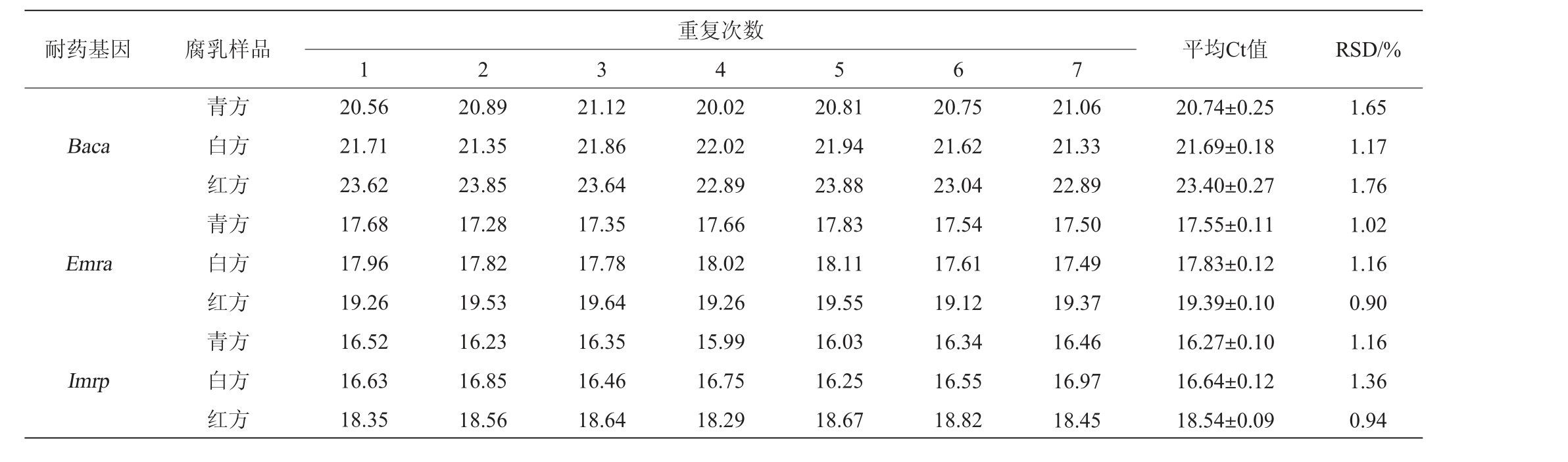
耐药基因 腐乳样品 平均Ct值 RSD/%1 2 3重复次数4 5 6 7 Baca Emra Imrp青方白方红方青方白方红方青方白方红方20.56 21.71 23.62 17.68 17.96 19.26 16.52 16.63 18.35 20.89 21.35 23.85 17.28 17.82 19.53 16.23 16.85 18.56 21.12 21.86 23.64 17.35 17.78 19.64 16.35 16.46 18.64 20.02 22.02 22.89 17.66 18.02 19.26 15.99 16.75 18.29 20.81 21.94 23.88 17.83 18.11 19.55 16.03 16.25 18.67 20.75 21.62 23.04 17.54 17.61 19.12 16.34 16.55 18.82 21.06 21.33 22.89 17.50 17.49 19.37 16.46 16.97 18.45 20.74±0.25 21.69±0.18 23.40±0.27 17.55±0.11 17.83±0.12 19.39±0.10 16.27±0.10 16.64±0.12 18.54±0.09 1.65 1.17 1.76 1.02 1.16 0.90 1.16 1.36 0.94
由表4可知,RT-fqPCR法检测腐乳中3种耐药基因的重复试验结果RSD为0.90%~1.76%,均在可接受范围,证明该检测方法具有很好地重复性。
2.4 市售腐乳样品中3种耐药基因的检测结果
采用RT-fqPCR法检测47批次不同腐乳样品中的3种耐药基因,结果见表5。
表5 市场售腐乳样品中3种耐药基因的检测结果
Table 5 Determination results of three kinds of drug resistance genes in commercial sufu samples

腐乳样品 检出耐药基因样品数/个检出耐药基因数/个Baca Emra Imrp样品总数/个样品阳性率/%青方腐乳白方腐乳红方腐乳耐药基因总数/个耐药基因阳性率/%14 13 15 96.5 10 14 12 141 92.2 14 13 16 97.2 38 40 43 45 48 48 84.4 83.3 89.6
由表5可知,3种耐药基因均被检出,腐乳样品中耐药基因Baca、Emra、Imrp的检出率分别为96.5%、92.2%、97.2%。结果表明,不同腐乳样品中均含有不同量的耐药基因且含量较高(均在90%以上)。由表5亦可知,青方腐乳、白方腐乳、红方腐乳中耐药基因检出率分别为84.4%、83.3%、89.6%。结果表明,不同腐乳样品中含有的耐药基因不同,但3类腐乳样品中耐药基因的检出率均在80%以上。目前,市售的即食食品和酸奶中已经出现耐药基因转移的情况[27-28],腐乳中的耐药基因也可能会通过结合、转化、转导和位移等方式转移给安全菌株,致使腐乳样品中的耐药基因检出率更高。因此,对所测抗生素及其腐乳所含有的耐药基因全方位、多方面的关注不容忽视。
3 结论
腐乳作为具有中国特色的黄豆发酵食品被人们所喜爱,其生产发酵方式意味着其中含有大量的微生物,对其微生物的检测以及微生物可能产生的耐药性检测也成为重中之重。本研究根据腐乳中微生物全基因组DNA测序的耐药基因丰度选择相对丰度较高的3种耐药基因(Baca、Emra、Imrp),根据其基因序列设计扩增引物,建立非培养方式RT-fqPCR检测腐乳耐药基因的方法。通过方法学考察发现,该方法的检测限度较低,3种耐药基因的检出限均在5.4 pg,满足腐乳样品中多数微生物的耐药性检测;添加黄豆基因的抗干扰能力检测结果无显著变化,表明该方法的抗干扰能力较好;重复性试验结果的RSD值为0.90%~1.76%,表明该方法的重复性较好。采用建立RT-fqPCR法对市售的47批次腐乳样品进行检测发现,3种耐药基因Baca、Emra、Imrp在腐乳中的检出率较高,分别为96.5%、92.2%和97.2%;青方腐乳、白方腐乳、红方腐乳3类腐乳含有的耐药基因分别为84.4%、83.3%和89.6%,证明该方法具有很好的应用性。结果表明,建立的RT-fqPCR方法可快速检测不同腐乳中的3种耐药基因。
[1]汪建明,耿媛,胡峰,等.从腐乳中提取大豆异黄酮及含量测定[J].食品与发酵科技,2012,48(5):92-95.
[2]张婷,张琪,罗洁,等.腐乳的营养价值及功能性研究进展[J].食品工业,2019,40(8):258-262.
[3]庄洋,陈露,田成,等.腐乳营养成分与质构特征及其偏相关分析[J].食品科学,2020,41(3):80-85.
[4]JEROME U,DAVID-KINGSLEY O,CHINELO O.Antibiotic resistance in non-enterococcal lactic acid bacteria isolated from yoghurt[J].Sci Int,2016,13(1):1-7.
[5]QIN Y, JIN X N, HEUI D P.Comparison of antioxidant activities in black soybean preparations fermented with various microorganisms[J].Agr Sci China,2010,9(7):1065-1071.
[6]廖新浴,陈信贤,刘东红,等.腐乳生产过程中细菌污染的状况与分析[J].生物加工过程,2019,17(6):657-661.
[7]周毅吉.γ射线对传统特色腐乳品质的影响[D].长沙:湖南农业大学,2021.
[8]陶康,吴凌伟,金晓芳,等.基于高通量基因测序分析腐乳微生物多样性[J].食品科学,2021,42(8):143-149.
[9]石黎琳,牟方婷,李安,等.基于高通量测序技术分析腐乳自然发酵过程微生物多样性[J].中国酿造,2021,40(2):144-149.
[10]WANG H Q, RUI M A, LIU S R.Antibiotics resistance of lactic acid bacteria isolated from yoghurt[J].Chinese J Public Health,2019,8(35):1027-1031.
[11]OUOBA L,LEI V,JENSEN L B.Resistance of potential probiotic lactic acid bacteria and bifidobacteria of African and European origin to antimicrobials:Determination and transferability of the resistance genes to other bacteria[J].Int J Food Microbiol,2008,121(2):217-224.
[12]GUO H, PAN L, LI L, et al.Characterization of antibiotic resistance genes from Lactobacillus isolated from traditional dairy products[J].J Food Sci,2017,82(3):724-730.
[13]JIN X U,LIU X,YANG B,et al.Antimicrobial susceptibility of probiotics[J].J Hyg Res,2008,37(3):354-356.
[14]梁志宏,杨洁彬.微生物耐药性对食品安全性的影响[J].食品科学,2004,25(Z1):288-290.
[15]MATHUR S,SINGH R.Antibiotic resistance in food lactic acid bacteria-a review[J].Int J Food Microbiol,2005,3(105):281-295.
[16]张可欣,李忠海,任佳丽.食源性细菌耐药性检测方法的研究进展[J].食品与机械,2018,34(2):181-184.
[17]王俊丽.运用分子生物学技术进行食品微生物检测[J].食品安全导刊,2022(6):187-189.
[18]徐琼,刘洋,曲勤凤,等.高通量测序分析不同地区红腐乳细菌多样性[J].食品科学,2020,41(10):110-116.
[19]NIE Z Q,WANG M,ZHENG Y.Application of three molecular biotechnologies in microbial diversity of microorganisms from traditional fermented foods[J].Food Sci,2012,23(33):346-350.
[20]姜桂来,郁舒阳,俞莞茜,等.细菌耐药性及耐药基因检测技术和方法的研究进展[J].中国临床新医学,2022,15(10):907-913.
[21]郑玉玺,贾强,董蕾,等.PCR-DGGE结合传统分离培养分析盒装豆腐腐败菌多样性[J].食品与发酵科技,2018,54(5):110-116.
[22]许银叶,许佩勤,庄俊钰,等.实时荧光定量PCR技术检测腐乳中大豆转基因成分[J].江苏调味副食品,2019(2):33-35.
[23]许女,李雅茹,王超宇,等.传统发酵食品中乳酸菌的抗生素耐药性评估及耐药基因分析[J].中国食品学报,2020,20(7):160-171.
[24]张娜娜,徐琼,黎鸿艺.腐乳中菌群基因组DNA提取方法的对比研究[J].中国酿造,2023,42(10):177-181.
[25]WEI G,REGENSTEIN J M,ZHOU P.The aroma profile and microbiota structure in oil furu,a Chinese fermented soybean curd[J].Food Res Int,2021,147(10):1-9.
[26]兰林,段树华,汪晟羽,等.基于高通量测序技术分析豆腐乳中微生物多样性[J].中国酿造,2023,42(1):31-36.
[27]王炜哲,翟征远,郝彦玲.市售酸奶中发酵剂乳酸菌的耐药性及耐药基因研究进展[J].中国乳品工业,2022,50(2):34-37.
[28]韩蓓,梁欢,付桂明,等.市售即食食品中非致病菌的耐药性及耐药基因转移的研究[J].中国食品卫生杂志,2012,24(5):412-416.