猕猴桃(Actinidia chinensis)也称奇异果、基维果、美容果,因其富含维生素、氨基酸、有机酸等营养成分,素有“世界珍果”之称[1]。神农架林区是我国华中地区唯一的原始森林分布区[2],由于常年降水量充足、森林覆盖率超过91%,被誉为“天然冷库”和“生态氧吧”[3]。神农架猕猴桃生长在湖北省神农架林区,得天独厚的生长环境使得其无农药等有害物质且对身体更加有益,但是其果实个小、糖酸比低,导致其鲜销量小且不适于直接食用。因此亟需开发新型猕猴桃加工产品,提高神农架猕猴桃的附加值。神农架猕猴桃有机酸含量丰富,很适合酿制果醋。果醋既保留了水果中的大部分营养和生物活性物质,又具有食醋的风味和品质,广受人们喜爱[4]。
乳酸菌是一类能够将可发酵型碳水化合物转化成乳酸的微生物[5]。乳酸菌拥有丰富的酶系,其代谢物在发酵过程中不仅能合成风味物质,还能减轻由乙酸带来的刺激感[6]。我国传统食醋酿造过程中有多种微生物参与发酵,其中包括乳酸菌,它不仅能产生乳酸,还能促进风味物质的形成。多菌种混合发酵能借助多种菌类彼此间的互利关系来获得更具特色的产品,利用不同微生物发酵代谢提供丰富的代谢产物,赋予发酵产品独特的风味[7-9]。
目前,对猕猴桃果醋的研究主要集中在发酵原料、发酵方式及发酵菌种等方面。钟武等[10]以“金艳”猕猴桃为主要原料,对比了去皮发酵和带皮发酵猕猴桃果醋的差异,结果发现,带皮发酵的果醋的乙酸含量高于去皮发酵的果醋,并且挥发性物质成分的含量和种类也有所增加。猕猴桃果醋的发酵方式多以液态深层发酵为主,即在发酵过程中将氧气引入到发酵体系中,使醋酸菌与底物充分混合,从而提高了生产效率,但是所产果醋风味单一[11-12]。醋酸菌在醋酸发酵过程中起着至关重要的作用,邓丽丽等[13]以猕猴桃为原料,从猕猴桃发酵液中分离、纯化出3株产醋酸菌种,其中菌株L2的产酸率最高,该菌株经过后期进一步的性能测定有希望驯化成适合猕猴桃果醋发酵的醋酸菌菌种。
猕猴桃果醋的酒精发酵阶段多以液态单一菌种发酵为主,微生物种类少,酶系不丰富,果醋风味单一,有关多菌种混合发酵猕猴桃果醋的研究鲜有报道。本研究以神农架猕猴桃为原料,采用多菌种液态发酵制备猕猴桃果醋,在其酒精发酵阶段添加植物乳杆菌(Lactobacillus plantarum)与酵母菌复合发酵,通过单因素及正交试验优化酒精、醋酸发酵工艺条件,并采用氨基酸分析仪及气质联用(gas chromatography mass spectrometry,GC-MS)技术分别分析果醋的氨基酸、挥发性风味物质组成。以期改善猕猴桃果醋风味及品质,为神农架猕猴桃果醋的开发利用提供理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
猕猴桃(可溶性固形物7°Bx,总酸含量为8.90 g/L):神农架绿源天然食品有限责任公司;植物乳杆菌(Lactobacillus plantarum)Lp90:微康益生菌(苏州)股份有限公司;葡萄酒高活性干酵母BV818:安琪酵母股份有限公司;巴氏醋酸杆菌(Acetobacter pasteurianus)(沪酿1.01):中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。
1.1.2 化学试剂
Oxoid LP0021B酵母粉:英国OXOID公司;甲醇(色谱级):美国Thermo-Fisher公司;无水乙醇、氢氧化钠、葡萄糖、酚酞、磷酸二氢铵、磷酸、氯化钠(均为分析纯):国药集团化学试剂有限公司;白砂糖(食品级):武汉市鼎一家有限责任食品公司;乳酸标准品(纯度>98%):上海源叶生物科技有限公司;果胶酶(40 U/mg):北京索莱宝科技有限公司;环己酮(分析纯):上海麦克林生化科技有限公司。
1.1.3 培养基
MRS肉汤培养基:青岛海博生物公司。MRS固体培养基中添加2%的琼脂。
醋酸菌液体培养基:1%葡萄糖,1%酵母粉,115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
WYT-l糖度计:上海沪粤明科学仪器有限公司;板框过滤机:上海信步科技有限公司;AL204电子天平:上海梅特勒-托利多仪器有限公司;CJM-2474酒精计:衡水创纪仪器仪表有限公司;YXQ-LS-30S立式压力蒸汽灭菌锅:昆山超声仪器有限公司;FO510C马弗炉:重庆雅马拓科技有限公司;HPY300恒温培养箱:武汉海声达仪器设备有限公司;DLHR-Q200立式双层全温恒温振荡培养箱:北京东联哈尔仪器制造有限公司;GL-21M高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;Milli-Q超纯水:山东贝徕美生物科技有限公司;5W-EF-2FD无菌操作台:国华电器有限公司;Ultimate 3000高效液相色谱仪:美国Thermo Fisher公司;UV-180型UV-Vis分光光度计:日本SHIMADZU公司;S-433D氨基酸分析仪:塞卡姆(北京)科学仪器有限公司;7000D气相色谱-质谱联用仪:新加坡安捷伦仪器有限公司。
1.3 试验方法
1.3.1 猕猴桃果醋加工工艺流程及操作要点
猕猴桃→清洗→去皮→破碎→打浆→酶解→过滤→猕猴桃果浆→糖度调整→灭菌→酵母菌、乳酸菌活化、醋酸菌活化→接种→酒精发酵→过滤、灭菌→猕猴桃果酒→接种→醋酸发酵→澄清、过滤→灌装→巴氏杀菌→猕猴桃果醋
操作要点:
清洗、去皮:挑选成熟度高、无腐烂的猕猴桃,用清水洗净泥沙、污物,手工去皮。
破碎、打浆:去皮后用打浆机将猕猴桃破碎成浆[14]。
酶解、过滤:采用果胶酶酶解,40 ℃酶解2 h,用量为20 mg/kg[15]。采用板框过滤机进行过滤(滤布为400目)。
糖度调整:调整初始可溶性固形物含量为15~23°Bx。
灭菌:巴氏杀菌75 ℃,30 min。
酵母菌的活化:按接种比例取葡萄酒高活性干酵母,加入含有4%葡萄糖的无菌水中,40 ℃水浴30 min,完成活化。
乳酸菌的活化:乳酸菌菌株经过MRS肉汤培养基活化后,用MRS固体培养基平板进行计数,菌体浓度均达到1×108 CFU/mL,离心收集菌体,用等体积0.9%的无菌生理盐水洗出后制得种子液,按体积比接入种子液发酵。
醋酸菌的活化:用接种环挑取甘油保藏的醋酸菌菌种至经高温高压灭菌后的醋酸菌液体培养基中,置于30 ℃,150 r/min的振荡培养48~50 h,再进行平板计数,菌体浓度均达到1×108 CFU/mL,离心收集菌体,用等体积0.9%的无菌生理盐水洗出后制得种子液,按体积比接入种子液发酵。
接种:经过灭菌猕猴桃果浆中接种一定量的酵母菌(0.1%~0.9%)、乳酸菌(0~9%)。
酒精发酵:发酵温度为24~36 ℃,发酵时间为8 d。
过滤、灭菌:使用3~4 层纱布进行过滤,滤液经121 ℃灭菌15 min[16],即得猕猴桃果酒。
接种:猕猴桃果酒中醋酸菌接种量为6%~14%。
醋酸发酵:发酵温度为26~34 ℃,发酵6~10 d。
澄清、过滤:静置澄清,使用3~4层经121 ℃灭菌15 min的纱布进行过滤。
灌装:将过滤后的果醋分装于瓶中。
巴氏杀菌:将分装后的果醋于75 ℃灭菌30 min,即得猕猴桃果醋成品。
1.3.2 分析检测
(1)理化指标
酒精度的测定:参照GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》[17];总酸的测定:参照GB/T 12456—2021《食品安全国家标准食品中总酸的测定》[18];氨基酸[19]:参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》。
(2)乳酸含量
乳酸含量的测定:采用高效液相色谱法[20]。
样品前处理:将发酵样品用超纯水稀释10倍混合均匀,取1 mL稀释后的发酵液,10 000 r/min冷冻离心15 min,将上清液取出,使用0.45 μm水膜进行过滤。
高效液相色谱条件:Hypersil Gold aQ色谱柱(250 mm×4.6 mm,5 μm),流动相0.02 mol/L磷酸二氢铵(pH 2.4),柱温30 ℃,流速0.6 mL/min,进样量10 μL,配有二极管阵列检测器。
乳酸标准曲线绘制:配制不同质量浓度(0.68 mg/mL、1.36 mg/mL、2.04 mg/mL、2.72 mg/mL、3.40 mg/mL)的乳酸标准品溶液,过0.22 μm滤膜后上机测定,以乳酸质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制乳酸标准曲线,得到标准曲线回归方程y=7.777 9x+0.073 3,相关系数R2=1。样品采用外标法定量,根据保留时间进行定性。
(3)挥发性风味物质含量
挥发性风味物质含量的测定:参考钟武等[21]的方法并稍作修改。
挥发性成分的提取:准确量取5 mL经不同处理的样品于20 mL钳口样品瓶中,加入2 mL饱和食盐水,20 μL内标物环己酮,环己酮的质量浓度为0.946mg/mL,密封后于磁力搅拌器上60℃平衡30min,采用50/30μm DVB/CAR/PDMS萃取头在60℃条件下顶空吸附40min,插入GC进样口解吸5 min。
气相色谱条件:HP-5色谱柱(30 m×0.25 μm×0.25 μm)。升温程序:40 ℃保持3 min,以3 ℃/min升至160 ℃,保持2 min,再以8 ℃/min升至220 ℃,保持3 min,进样口温度250 ℃;不分流进样;载气为高纯氦气(He),流速1.0 mL/min。
质谱条件:离子源温度230 ℃,四极杆温度150 ℃,电子电离(electronic ionization,EI)源,电子能量70 eV,质量扫描范围为30~550 amu。
定性和定量方法:运用美国国家标准技术研究所(national institute of standards and technology,NIST)进行初步检索及资料分析,再结合文献的保留指数(retention index,RI)对化合物进行定性。用内标法进行定量分析。各挥发性风味成分含量计算公式如下:
X=As/Ai×Mi/M
式中:X表示各个化合物含量,mg/L;As表示各个化合物的峰面积;Ai表示内标物质的峰面积;Mi表示内标物的质量,μg;M表示果醋体积,mL。
1.3.3 猕猴桃果醋酒精发酵工艺优化
(1)单因素试验
分别考察乳酸菌接种量(0、1%、3%、5%、7%、9%)、酵母菌接种量(0.1%、0.3%、0.5%、0.7%、0.9%)、初始可溶性固形物含量(15°Bx、17°Bx、19°Bx、21°Bx、和23°Bx)、发酵温度(24 ℃、27 ℃、30 ℃、33 ℃、36 ℃)对酒精发酵阶段的酒精度及乳酸含量影响,当研究其中一个因素时,其余3个因素取各水平中间值。
(2)正交试验
在单因素试验基础上,以酒精度和乳酸含量作为评价指标,选取酵母菌接种量(A)、乳酸菌接种量(B)、初始可溶性固形物(C)和发酵温度(D)为影响因素,进行4因素3水平正交试验,考察各因素对酒精发酵阶段酒精度和乳酸含量的影响。酒精发酵工艺优化正交试验因素与水平见表1。
表1 酒精发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for alcoholic fermentation process optimization

水平 A 酵母菌接种量/%B 乳酸菌接种量/%C 初始可溶性固形物含量/°Bx D 发酵温度/℃1 2 3 0.5 0.7 0.9 3 5 7 17 19 21 27 30 33
1.3.4 猕猴桃果醋醋酸发酵工艺优化
(1)单因素试验
分别考察醋酸菌接种量(6%、8%、10%、12%和14%)、初始酒精度(6%vol、7%vol、8%vol、9%vol、10%vol)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)和发酵时间(6 d、7 d、8 d、9 d、10 d)对醋酸发酵阶段总酸含量的影响,当研究其中一个因素时,其他3个因素取各水平中间值。
(2)正交试验
在单因素试验基础上,以总酸含量作为评价指标,选取醋酸菌接种量(A)、初始酒精度(B)、发酵温度(C)和发酵时间(D)为影响因素,进行4因素3水平正交试验,考察各因素对醋酸发酵阶段总酸含量的影响。醋酸发酵工艺优化正交试验因素与水平见表2。
表2 醋酸发酵工艺条件优化正交试验因素与水平
Table 2 Factors and levels of orthogonal experiments for acetic fermentation process optimization
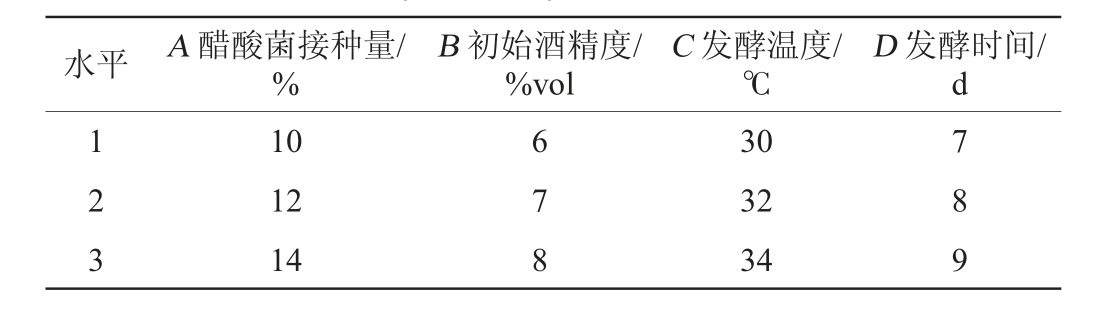
水平 A 醋酸菌接种量/%B 初始酒精度/%vol C 发酵温度/℃D 发酵时间/d 1 2 3 10 12 14 6 7 8 30 32 34 7 8 9
1.3.5 感官评价
感官评价表的制定参考国标GB/T 30884—2014《苹果醋饮料》[22]等稍作修改,感官评价成员由具有食品专业知识背景的10名成员组成(男女各半),对猕猴桃果醋进行感官评价,分别从样品色泽、香气、口感和状态4个方面进行评价。感官评价标准见表3。
表3 猕猴桃果醋感官评价标准
Table 3 Sensory evaluation standards of kiwifruit vinegar
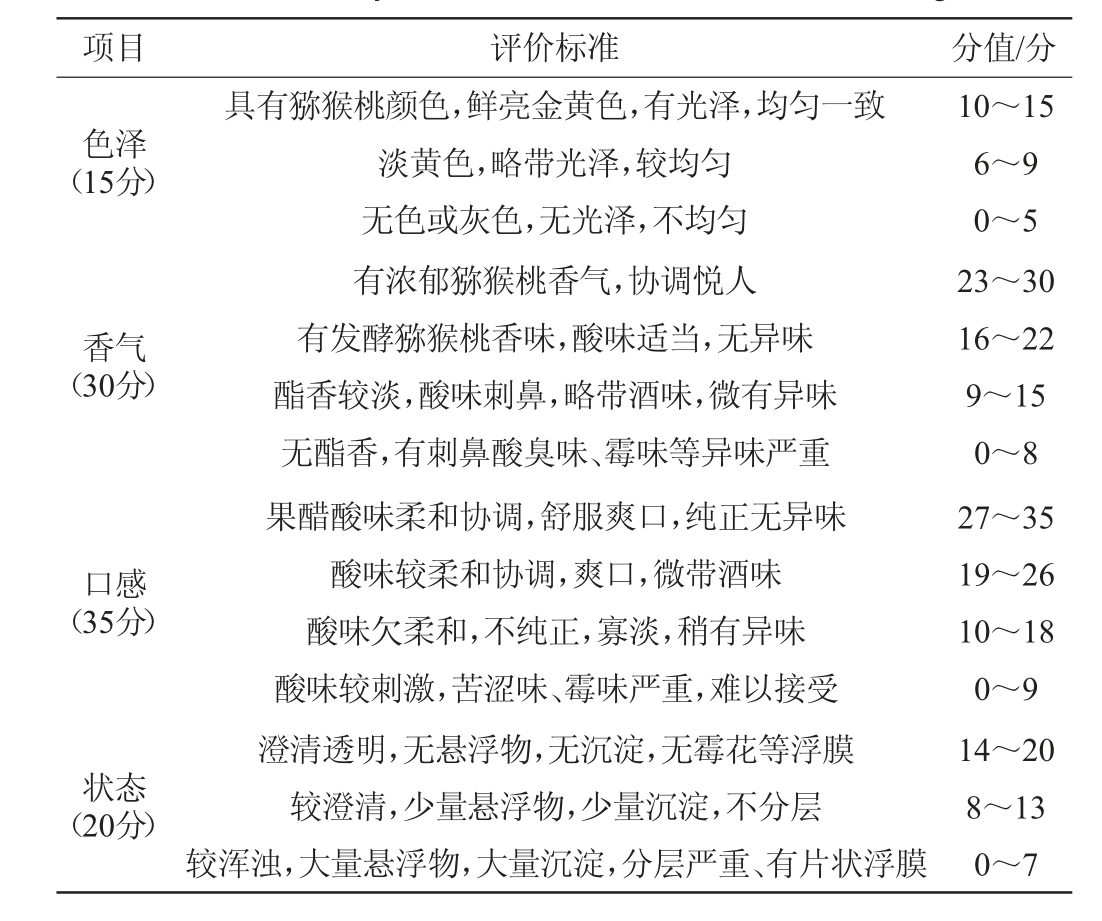
项目 评价标准 分值/分色泽(15分)香气(30分)口感(35分)状态(20分)具有猕猴桃颜色,鲜亮金黄色,有光泽,均匀一致淡黄色,略带光泽,较均匀无色或灰色,无光泽,不均匀有浓郁猕猴桃香气,协调悦人有发酵猕猴桃香味,酸味适当,无异味酯香较淡,酸味刺鼻,略带酒味,微有异味无酯香,有刺鼻酸臭味、霉味等异味严重果醋酸味柔和协调,舒服爽口,纯正无异味酸味较柔和协调,爽口,微带酒味酸味欠柔和,不纯正,寡淡,稍有异味酸味较刺激,苦涩味、霉味严重,难以接受澄清透明,无悬浮物,无沉淀,无霉花等浮膜较澄清,少量悬浮物,少量沉淀,不分层较浑浊,大量悬浮物,大量沉淀,分层严重、有片状浮膜10~15 6~9 0~5 23~30 16~22 9~15 0~8 27~35 19~26 10~18 0~9 14~20 8~13 0~7
1.3.6 数据处理与统计分析
所有试验均设置3组平行,结果以“平均值±标准差”表示,采用SPSS 26.0软件进行统计分析并进行正交试验方差分析,采用Origin 2021软件作图。
2 结果与分析
2.1 猕猴桃果醋酒精发酵阶段工艺优化
2.1.1 单因素试验结果
不同酵母菌接种量、乳酸菌接种量、初始可溶性固形物和发酵温度对酒精度和乳酸含量的影响结果见图1。
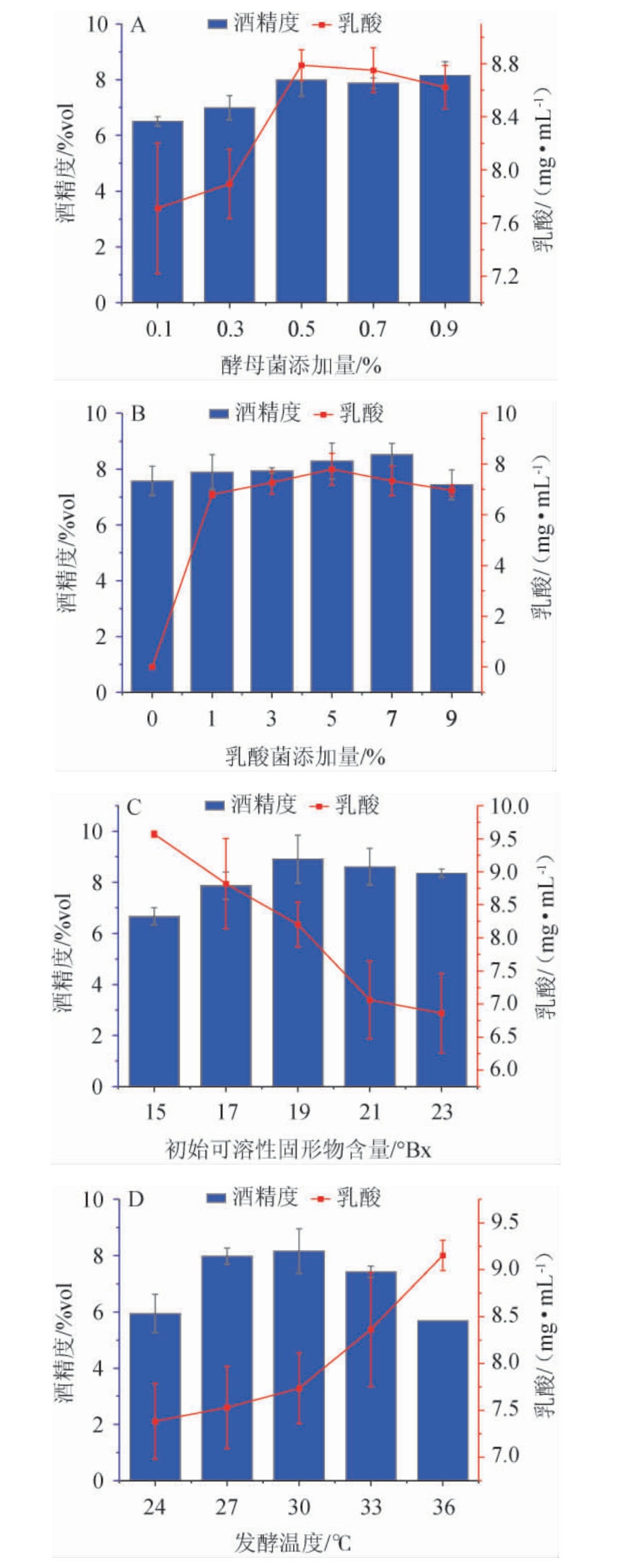
图1 酵母菌接种量(A)、乳酸菌接种量(B)、初始可溶性固形物含量(C)和发酵温度(D)对酒精度和乳酸含量的影响
Fig.1 Effects of yeast inoculum (A), lactic acid bacteria inoculum (B),initial soluble solids (C) and fermentation temperature (D) on alcohol content and lactic acid contents
由图1A可知,酒精度、乳酸含量随着酵母菌接种量在0.1%~0.5%范围内的增加呈上升趋势;酵母菌接种量在0.5%时,乳酸含量最高,为8.79 mg/mL,酒精度为7.99%vol;而当酵母菌接种量>0.5%之后,酵母菌之间竞争激烈,营养物质消耗较快,酵母出现自溶、衰亡等现象,导致后期发酵速度下降,酒精度及乳酸含量随之降低[23]。因此,选取最佳酵母菌接种量为0.5%。
由图1B可知,当乳酸菌接种量在1%~5%时,乳酸含量、酒精度随乳酸菌接种量的增加而增加;当乳酸菌接种量在5%时,乳酸含量最高,为7.79 mg/mL;乳酸菌接种量在7%时,酒精度最高,为8.52%vol;乳酸菌接种量>7%之后,由于接种量过大,乳酸菌在发酵前期大量生长,导致营养物质消耗较快,可能产生有害代谢产物会抑制发酵过程中酵母菌和乳酸菌的生长,导致产生的乳酸和酒精度含量降低[24]。因此,选取最佳乳酸菌接种量为7%。
由图1C可知,随着初始可溶性固形物含量在15~23°Bx范围内的增加,乳酸含量呈下降趋势,酒精度呈现先上升后下降的趋势。当初始可溶性固形物含量为15~19°Bx时,酒精度随之增加;当初始可溶性固形物含量为19°Bx时,酒精度最高,为8.91%vol;当初始可溶性固形物含量>19°Bx之后,酒精度呈下降趋势,可能是因为过高的含糖量导致溶液的渗透压过大,对酵母菌的生长产生了抑制作用[25]。乳酸的含量随初始可溶性固形物含量的增加呈下降趋势,可能是含糖量升高的同时酵母菌生长旺盛,限制了乳酸菌的生长。因此,选取最佳初始可溶性固形物含量为19°Bx。
由图1D可知,随着发酵温度在24~36 ℃范围内的增加,乳酸含量呈上升趋势,酒精度呈现先上升后下降的趋势。当发酵温度为24~30 ℃时,酒精度随温度的上升而增加;当发酵温度为30 ℃时,酒精度最高,为8.16%vol;当发酵温度>30 ℃之后,酒精度有所下降。发酵温度过低时,酵母菌启动发酵慢使发酵不充分,导致酒精度偏低,而发酵温度过高,超过了酵母菌生长的最适温度区间,加速微生物的老化,导致酒精度下降。因此,选取最佳发酵温度为30 ℃。
2.1.2 正交试验结果
在单因素试验结果的基础上,以酒精度和乳酸含量作为评价指标,选取酵母菌接种量(A)、乳酸菌接种量(B)、初始可溶性固形物(C)和发酵温度(D)为影响因素,进行4因素3水平正交试验,考察各因素对酒精发酵阶段酒精度和乳酸含量的影响。猕猴桃果醋酒精发酵工艺优化正交试验结果见表4。
表4 酒精发酵工艺优化正交试验结果与分析
Table 4 Results and analysis of orthogonal experiments for alcoholic fermentation process optimization
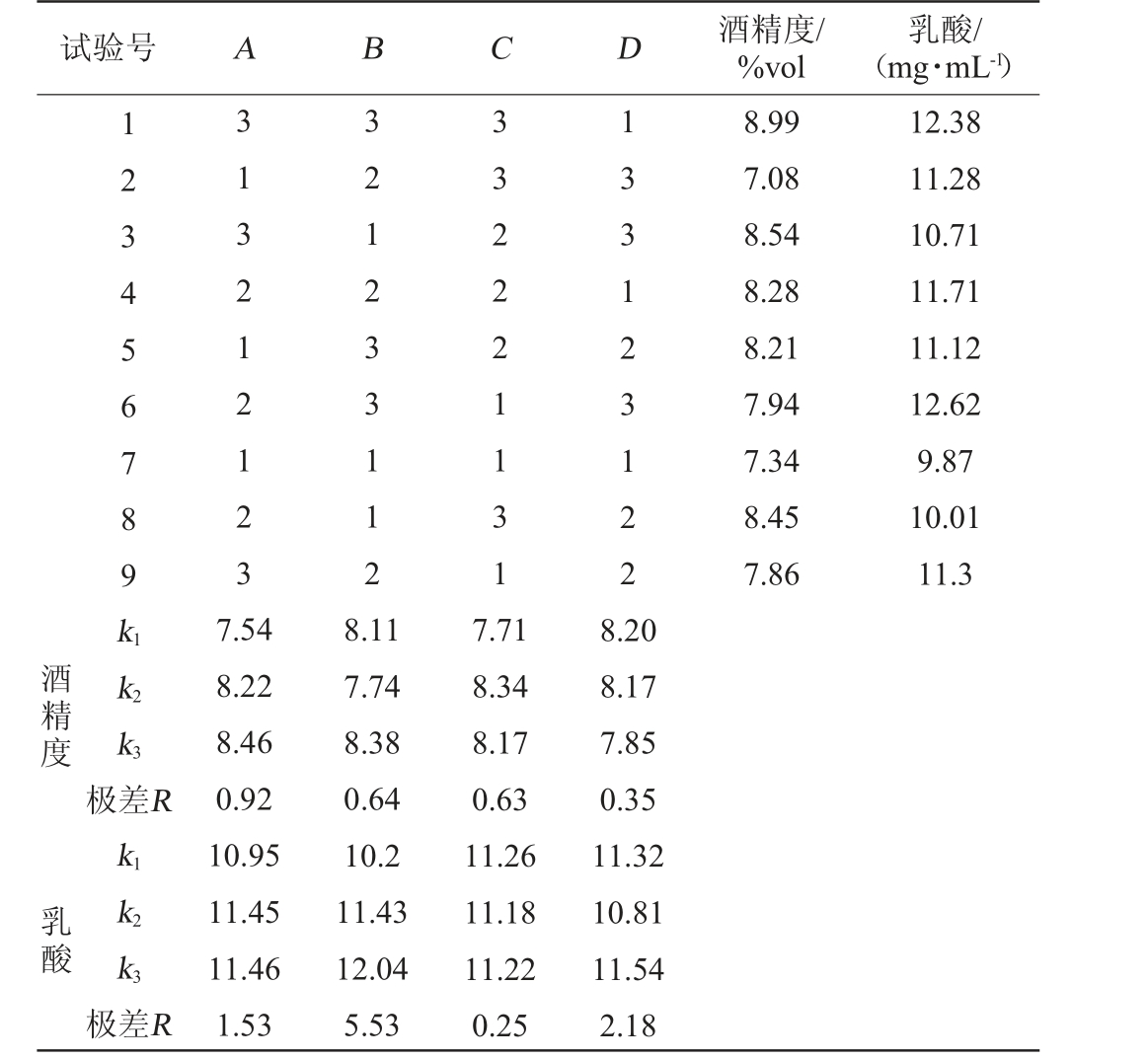
试验号 A B C D 酒精度/%vol乳酸/(mg·mL-1)1 2 3 4 5 6 7 8 9k1 313212123 321 233 112 332221131 133123122 8.99 7.08 8.54 8.28 8.21 7.94 7.34 8.45 7.86 12.38 11.28 10.71 11.71 11.12 12.62 9.87 10.01 11.3酒精度 乳酸k2 k3极差R k1 k2 k3极差R 7.54 8.22 8.46 0.92 10.95 11.45 11.46 1.53 8.11 7.74 8.38 0.64 10.2 11.43 12.04 5.53 7.71 8.34 8.17 0.63 11.26 11.18 11.22 0.25 8.20 8.17 7.85 0.35 11.32 10.81 11.54 2.18
由表4可知,以酒精度为评价指标,各因素对酒精度的影响的主次顺序为:酵母菌接种量>乳酸菌接种量>初始可溶性固形物含量>发酵温度;最佳发酵工艺组合为A3B3C2D1,即酵母菌接种量为0.9%,乳酸菌接种量为7%,初始可溶性固形物为19°Bx,发酵温度为27 ℃。以乳酸含量为评价指标,各因素对乳酸的影响的主次顺序为:乳酸菌接种量>发酵温度>酵母菌接种量>初始可溶性固形物含量;最佳组合方案为A3B3C1D3,即酵母菌接种量为0.9%,乳酸菌接种量为7%,初始可溶性固形物含量为17°Bx,发酵温度为33 ℃。综合酒精度和乳酸含量,确定最佳酒精发酵工艺为:酵母菌接种量为0.9%,乳酸菌接种量为7%,初始可溶性固形物含量为19°Bx,发酵温度为27 ℃。在此优化条件下进行3次平行验证试验,酒精度为(8.82±0.57)%vol,乳酸含量为(12.15±0.73)mg/mL。
2.2 猕猴桃果醋醋酸发酵阶段工艺优化
2.2.1 单因素试验结果
不同醋酸菌接种量、初始酒精度、发酵温度和发酵时间对总酸含量的影响结果见图2。
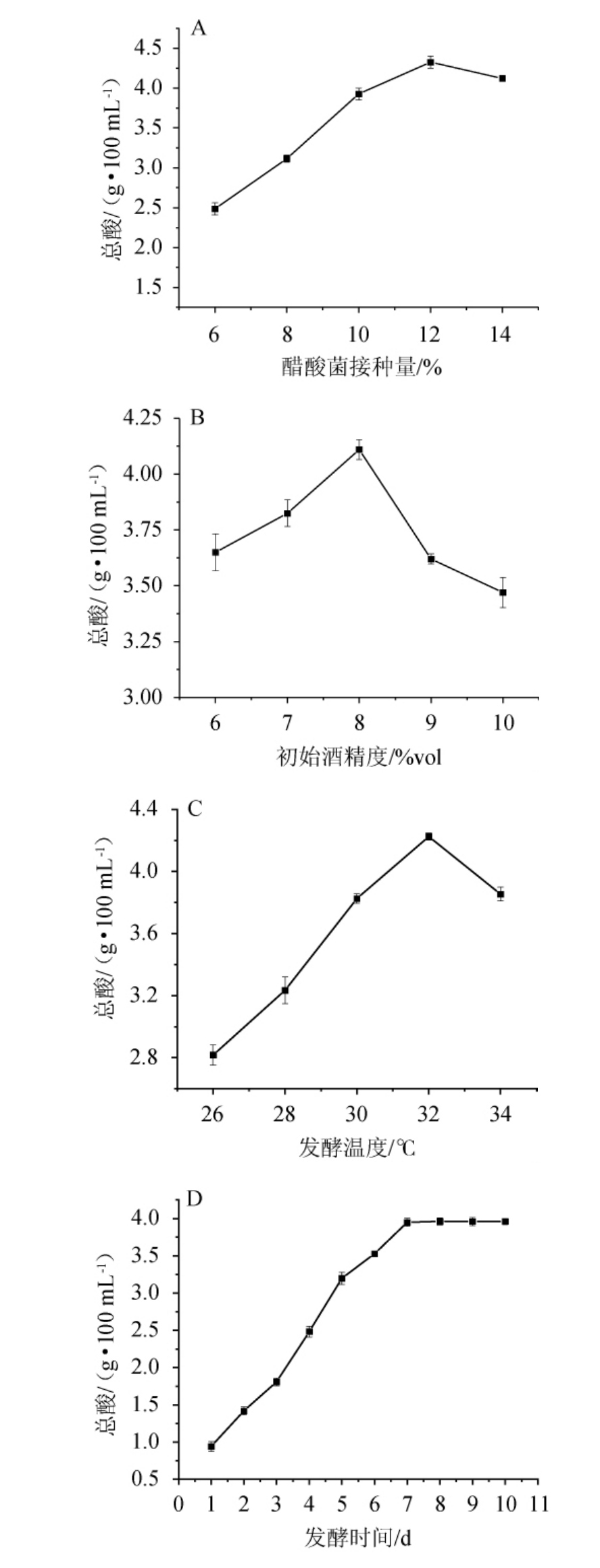
图2 醋酸菌接种量(A)、初始酒精度(B)、发酵温度(C)和发酵时间(D)对总酸含量的影响
Fig.2 Effects of acetobacter inoculum (A), initial alcohol content (B),fermentation temperature (C) and time (D) on total acid contents
醋酸菌的接种量是影响猕猴桃果醋总酸含量的重要因素之一[26]。由图2A可知,当接种量为6%~12%时,总酸含量随醋酸菌接种量的增加而呈上升趋势;当接种量为12%时,总酸含量最大,为4.33 g/100 mL;当醋酸菌接种量>12%之后,总酸含量呈下降趋势。可能是因为醋酸菌接种过量,营养物质被大量消耗,导致菌体自溶。因此,选择最适醋酸菌接种量为12%。
醋酸菌利用乙醇作为发酵底物将其转化为乙酸,所以乙醇含量直接影响到醋酸发酵阶段的总酸含量的高低。由图2B可知,总酸含量随初始酒精度的在6%vol~8%vol范围内的增加而增高;当初始酒精度为8%vol时,总酸含量最高,为4.11 g/100 mL;当初始酒精度>8%vol之后,过高的酒精度反而抑制了醋酸菌的生长[27],发酵不彻底,导致最终的总酸含量值降低。因此,选择最适初始酒精度为8%vol。
发酵温度与醋酸菌的发酵性能密切相关,是影响发酵体系中总酸含量的关键[28]。由图2C可知,当发酵温度为26~32 ℃时,总酸含量随温度的升高而呈上升趋势;当发酵温度为32 ℃时,总酸含量最高,为3.85 g/100 mL;当发酵温度>32 ℃之后,总酸含量开始降低,可能是因为发酵温度过高,抑制了醋酸菌的生长代谢,菌体老化快,酒精转化能力弱[29]。因此,选择最适发酵温度为32 ℃。
发酵产品的品质好坏与发酵时间的长短密切相关。由图2D可知,当发酵时间为1~7 d时,总酸含量随发酵时间延长呈上升趋势;当发酵时间为7 d时,总酸含量最高,为3.95 g/100 mL,当发酵时间>7 d之后,总酸含量趋于平缓。因此,选择最适发酵时间为7 d。
2.2.2 正交试验结果
在单因素试验基础上,以总酸含量作为评价指标,选取醋酸菌接种量(A)、初始酒精度(B)、发酵温度(C)和发酵时间(D)为影响因素,进行4因素3水平正交试验,考察各因素对醋酸发酵阶段总酸含量的影响。醋酸发酵工艺优化正交试验结果与分析见表5。
表5 醋酸发酵工艺优化正交试验结果与分析
Table 5 Results and analysis of orthogonal experiments for acetic fermentation process optimization
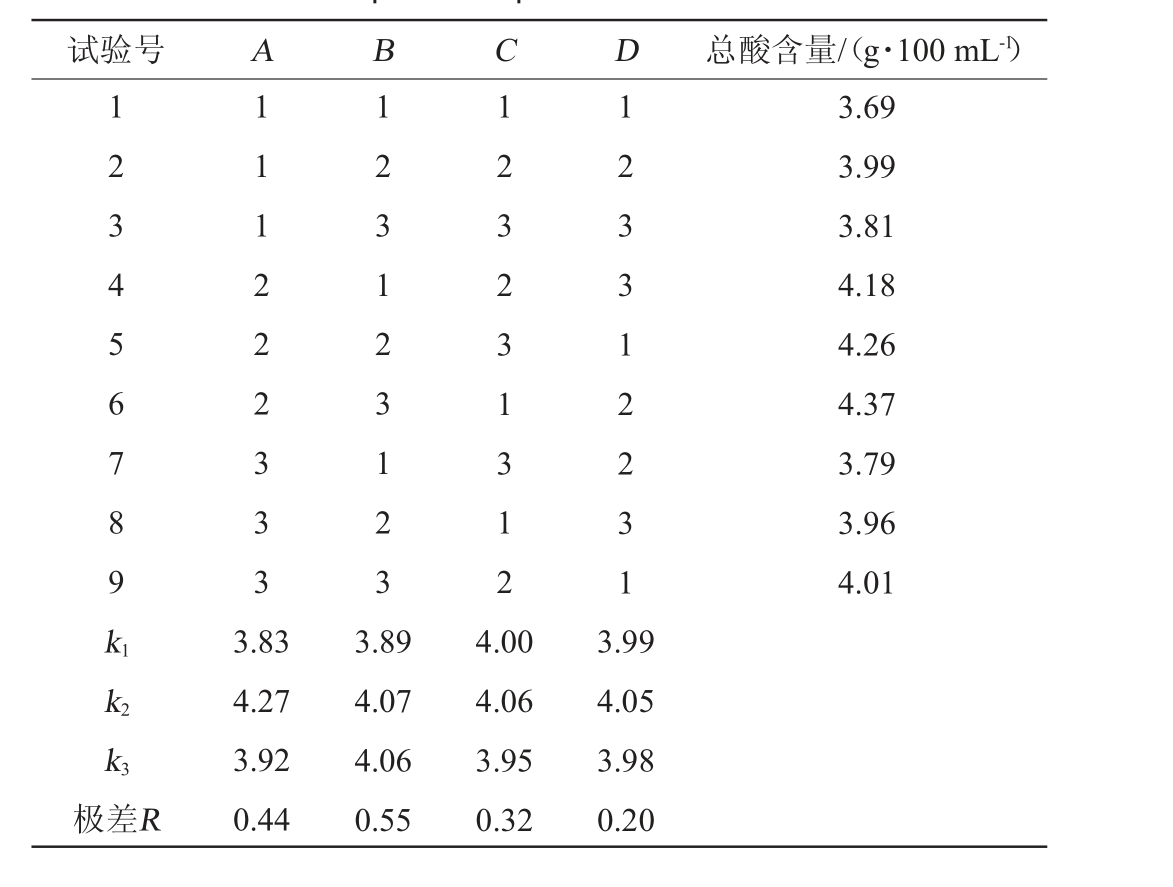
试验号 A B C D 总酸含量/(g·100 mL-1)1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 3.69 3.99 3.81 4.18 4.26 4.37 3.79 3.96 4.01 k2 k3极差R 3.83 4.27 3.92 0.44 3.89 4.07 4.06 0.55 4.00 4.06 3.95 0.32 3.99 4.05 3.98 0.20
由表5可知,以总酸为评价指标,各因素对总酸的影响的主次顺序为初始酒精度>醋酸菌接种量>发酵温度>发酵时间;最佳发酵工艺组合为A2B2C2D2,即醋酸菌接种量12%,初始酒精度7%vol,发酵温度32 ℃,发酵时间8 d。在此最佳工艺进行3次平行验证试验,果醋总酸含量为(4.34±0.17)g/100 mL。
2.3 猕猴桃果醋感官评价结果
对发酵后的多菌株发酵猕猴桃果醋与对照猕猴桃果醋(未添加植物乳杆菌)进行感官评价,结果见表6。
表6 猕猴桃果醋感官评价结果
Table 6 Sensory evaluation results of kiwifruit vinegar
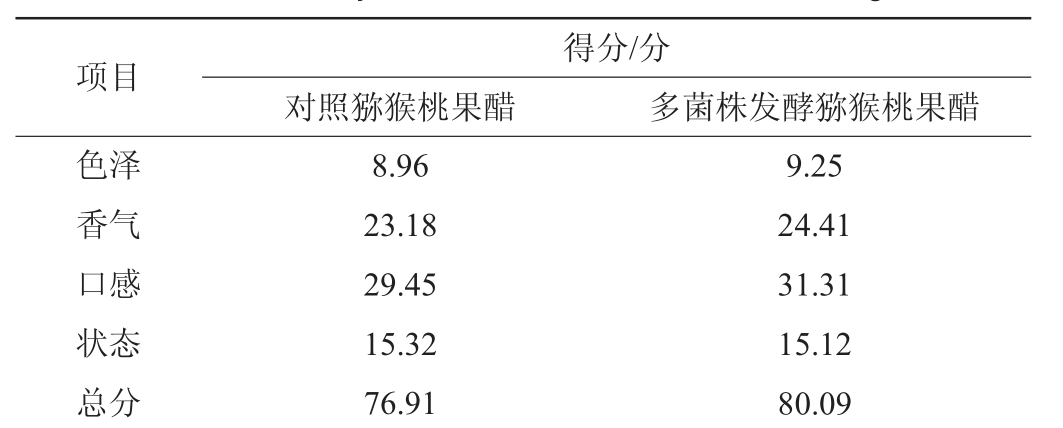
项目色泽香气口感状态总分得分/分对照猕猴桃果醋 多菌株发酵猕猴桃果醋8.96 23.18 29.45 15.32 76.91 9.25 24.41 31.31 15.12 80.09
由表6可知,多菌株发酵猕猴桃果醋的感官评分为80.09分,对照猕猴桃果醋为76.91分,多菌株发酵猕猴桃果醋感官评分优于对照猕猴桃果醋,普遍认为多菌株发酵猕猴桃果醋饮用时口感丰富,有浓郁的醋香味和淡淡的猕猴桃香气,酸味柔和协调,澄清透明无杂质和沉淀,呈金黄色,有光泽,均匀一致。
2.4 猕猴桃果汁、果醋氨基酸含量测定结果
采用氨基酸分析仪对猕猴桃果汁、多菌株发酵猕猴桃果醋和对照猕猴桃果醋(未添加植物乳杆菌发酵)进行氨基酸分析,结果见表7。
表7 猕猴桃果汁及果醋的氨基酸含量测定结果
Table 7 Determination results of amino acid contents of kiwifruit juice and fruit vinegar
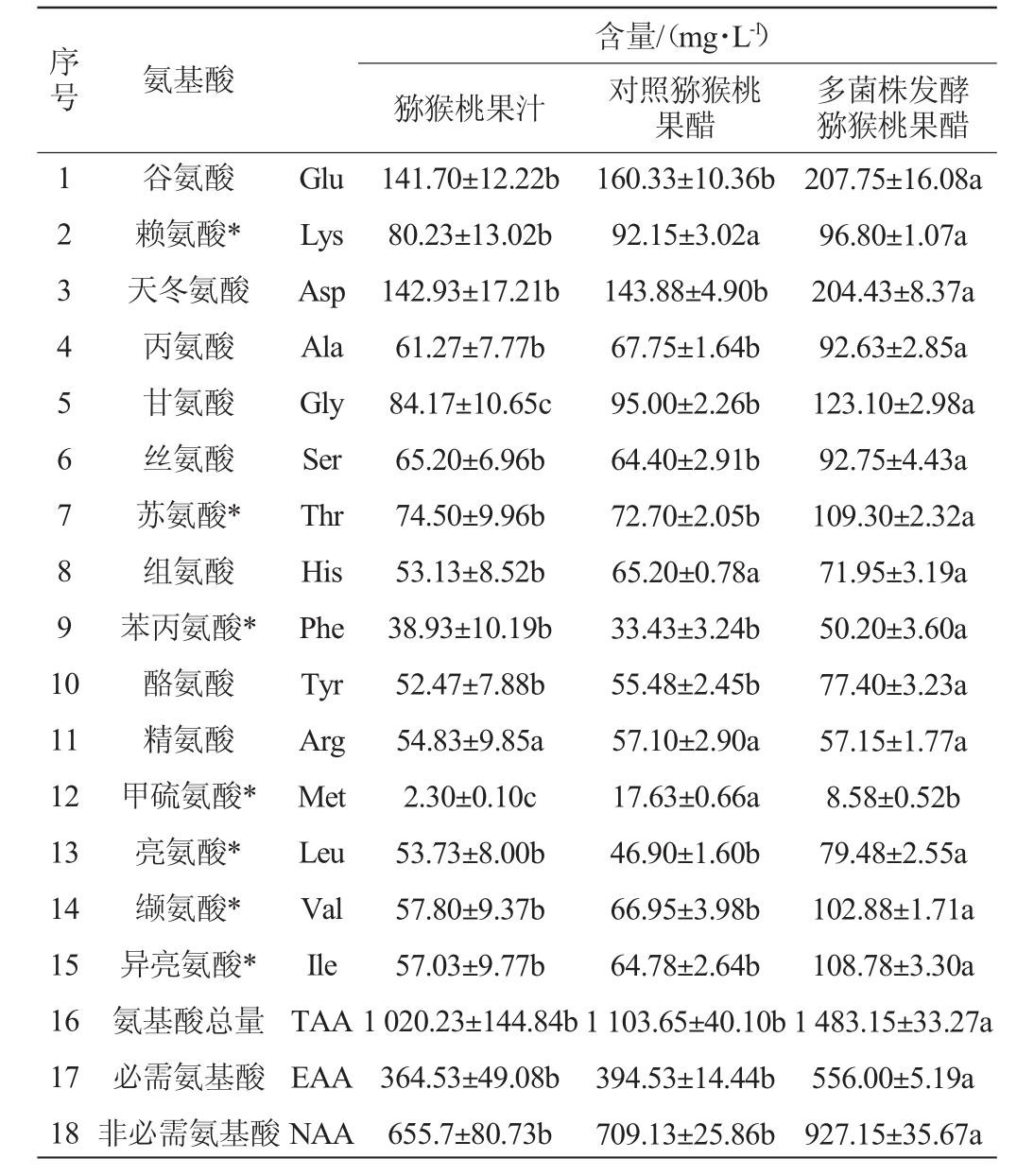
注:小写字母不同表示在P<0.05水平上有显著性差异。“*”表示必需氨基酸。
序号 氨基酸猕猴桃果汁含量/(mg·L-1)对照猕猴桃果醋多菌株发酵猕猴桃果醋1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18谷氨酸赖氨酸*天冬氨酸丙氨酸甘氨酸丝氨酸苏氨酸*组氨酸苯丙氨酸*酪氨酸精氨酸甲硫氨酸*亮氨酸*缬氨酸*异亮氨酸*氨基酸总量必需氨基酸非必需氨基酸Glu Lys Asp Ala Gly Ser Thr His Phe Tyr Arg Met Leu Val Ile TAA EAA NAA 141.70±12.22b 80.23±13.02b 142.93±17.21b 61.27±7.77b 84.17±10.65c 65.20±6.96b 74.50±9.96b 53.13±8.52b 38.93±10.19b 52.47±7.88b 54.83±9.85a 2.30±0.10c 53.73±8.00b 57.80±9.37b 57.03±9.77b 1 020.23±144.84b 364.53±49.08b 655.7±80.73b 160.33±10.36b 92.15±3.02a 143.88±4.90b 67.75±1.64b 95.00±2.26b 64.40±2.91b 72.70±2.05b 65.20±0.78a 33.43±3.24b 55.48±2.45b 57.10±2.90a 17.63±0.66a 46.90±1.60b 66.95±3.98b 64.78±2.64b 1 103.65±40.10b 394.53±14.44b 709.13±25.86b 207.75±16.08a 96.80±1.07a 204.43±8.37a 92.63±2.85a 123.10±2.98a 92.75±4.43a 109.30±2.32a 71.95±3.19a 50.20±3.60a 77.40±3.23a 57.15±1.77a 8.58±0.52b 79.48±2.55a 102.88±1.71a 108.78±3.30a 1 483.15±33.27a 556.00±5.19a 927.15±35.67a
氨基酸的成分和浓度会对发酵产品的味道特征和感官质量产生很大的影响[30],氨基酸被认为是果醋独特味道的重要因素。由表7可知,猕猴桃果汁、果醋中共检出15种氨基酸,并包含7种人体必需氨基酸(essential amino acids,EAA),说明猕猴桃果醋有着较高的营养价值。结果表明,多菌株发酵果醋、对照果醋的总氨基酸(total amino acid,TAA)含量相比果汁分别提升了45%和8%,说明经过微生物发酵增加了果醋中氨基酸总量,且多菌株发酵果醋的TAA、EAA和非必需氨基酸(non-essential amino acids,NAA)含量均显著高于对照果醋(P<0.05),说明添加植物乳杆菌发酵有利于氨基酸的积累[31],丰富发酵果醋的口感和营养价值。
根据氨基酸所呈现出的味道特征,将其分为:苦味、鲜味、芳香族和甜味[32]。鲜味氨基酸(谷氨酸、天冬氨酸、赖氨酸)含量高低为:多菌株发酵果醋(508.98 mg/L)>对照果醋(396.35 mg/L)>果汁(364.86 mg/L);甜味氨基酸(甘氨酸、苏氨酸、丝氨酸、丙氨酸、组氨酸)含量高低为:多菌株发酵果醋(489.72 mg/L)>果汁(388.26 mg/L)>对照果醋(365.05mg/L);芳香族氨基酸(苯丙氨酸、酪氨酸)含量高低分别为:多菌株发酵果醋(127.60 mg/L)>果汁(91.40 mg/L)>对照果醋(88.90 mg/L)。具有鲜味或甜味的氨基酸是增味的关键[33],多菌株发酵果醋的鲜味、甜味和芳香族氨基酸占氨基酸总量的76%,说明在发酵体系中添加乳酸菌有利于改善猕猴桃果醋的口感。果醋中含量最丰富的氨基酸为谷氨酸和天冬氨酸,它们是主要的呈味氨基酸,其中多菌株发酵果醋的谷氨酸和天冬氨酸相比果汁分别提升了47%和43%,相比对照果醋分别提升了13%和0.6%,结果说明添加乳酸菌之后呈味氨基酸含量显著提升(P<0.05)。结果表明,添加植物乳杆菌多菌株发酵对猕猴桃果醋的营养价值和风味产生了积极的影响。
2.5 猕猴桃果汁、果醋挥发性风味物质的测定结果
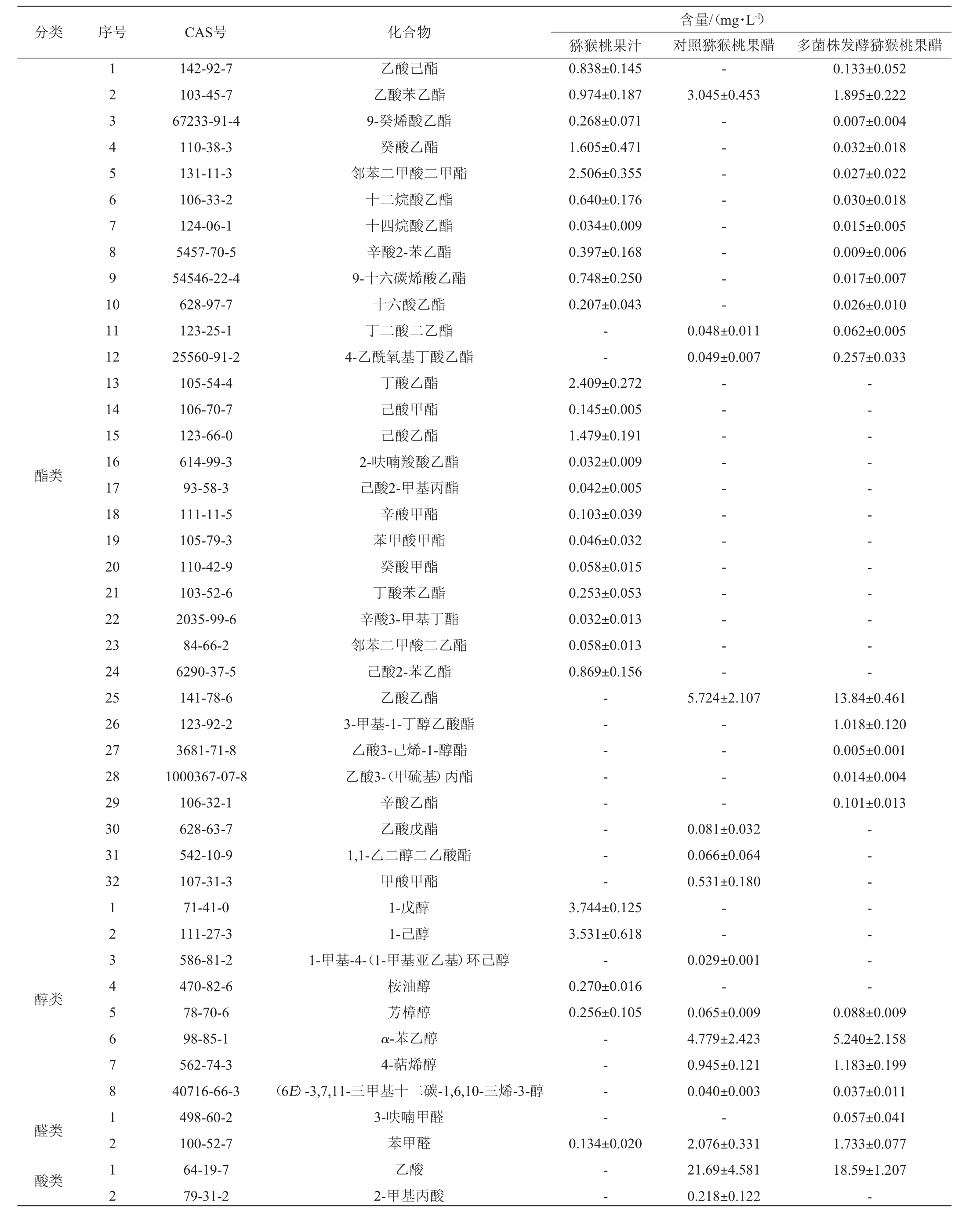
对猕猴桃果汁、多菌株发酵果醋和对照猕猴桃果醋的挥发性风味物质进行检测,结果见表8。由表8可知,对照猕猴桃果醋共检出27种挥发性风味物质,包括酯类7种,酸类5种,醛类1种,酮类4种,苯类4种,醇类5种,酚类1种;多菌株发酵果醋共检出37种挥发性风味物质,包括酯类17种,酸类5种,醛类2种,酮类5种,苯类2种,醇类4种,酚类1种,其他类1种。
表8 猕猴桃果汁及果醋挥发性风味物质含量测定结果
Table 8 Determination results of volatile flavor compounds contents in kiwifruit juice and fruit vinegar
分类 序号 CAS号 化合物1 2 3 4 5 6 7 8 9 1 0酯类11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32醇类乙酸己酯乙酸苯乙酯9-癸烯酸乙酯癸酸乙酯邻苯二甲酸二甲酯十二烷酸乙酯十四烷酸乙酯辛酸2-苯乙酯9-十六碳烯酸乙酯十六酸乙酯丁二酸二乙酯4-乙酰氧基丁酸乙酯丁酸乙酯己酸甲酯己酸乙酯2-呋喃羧酸乙酯己酸2-甲基丙酯辛酸甲酯苯甲酸甲酯癸酸甲酯丁酸苯乙酯辛酸3-甲基丁酯邻苯二甲酸二乙酯己酸2-苯乙酯乙酸乙酯3-甲基-1-丁醇乙酸酯乙酸3-己烯-1-醇酯乙酸3-(甲硫基)丙酯辛酸乙酯乙酸戊酯1,1-乙二醇二乙酸酯甲酸甲酯1-戊醇1-己醇1-甲基-4-(1-甲基亚乙基)环己醇桉油醇芳樟醇α-苯乙醇4-萜烯醇(6E)-3,7,11-三甲基十二碳-1,6,10-三烯-3-醇醛类酸类1 2 3 4 5 6 7 8 1 2 1 2 142-92-7 103-45-7 67233-91-4 110-38-3 131-11-3 106-33-2 124-06-1 5457-70-5 54546-22-4 628-97-7 123-25-1 25560-91-2 105-54-4 106-70-7 123-66-0 614-99-3 93-58-3 111-11-5 105-79-3 110-42-9 103-52-6 2035-99-6 84-66-2 6290-37-5 141-78-6 123-92-2 3681-71-8 1000367-07-8 106-32-1 628-63-7 542-10-9 107-31-3 71-41-0 111-27-3 586-81-2 470-82-6 78-70-6 98-85-1 562-74-3 40716-66-3 498-60-2 100-52-7 64-19-7 79-31-2 3-呋喃甲醛苯甲醛乙酸2-甲基丙酸猕猴桃果汁0.838±0.145 0.974±0.187 0.268±0.071 1.605±0.471 2.506±0.355 0.640±0.176 0.034±0.009 0.397±0.168 0.748±0.250 0.207±0.043--2.409±0.272 0.145±0.005 1.479±0.191 0.032±0.009 0.042±0.005 0.103±0.039 0.046±0.032 0.058±0.015 0.253±0.053 0.032±0.013 0.058±0.013 0.869±0.156-- - - - - - -3.744±0.125 3.531±0.618-0.270±0.016 0.256±0.105-- - -0.134±0.020--含量/(mg·L-1)对照猕猴桃果醋 多菌株发酵猕猴桃果醋-3.045±0.453-- - - - - - -0.048±0.011 0.049±0.007 0.133±0.052 1.895±0.222 0.007±0.004 0.032±0.018 0.027±0.022 0.030±0.018 0.015±0.005 0.009±0.006 0.017±0.007 0.026±0.010 0.062±0.005 0.257±0.033-- - - - - - - - - - --- - - - - - - - - - -5.724±2.107-- - -13.84±0.461 1.018±0.120 0.005±0.001 0.014±0.004 0.101±0.013 0.081±0.032 0.066±0.064 0.531±0.180--0.029±0.001-0.065±0.009 4.779±2.423 0.945±0.121 0.040±0.003-2.076±0.331 21.69±4.581 0.218±0.122-- - - - - -0.088±0.009 5.240±2.158 1.183±0.199 0.037±0.011 0.057±0.041 1.733±0.077 18.59±1.207-
续表
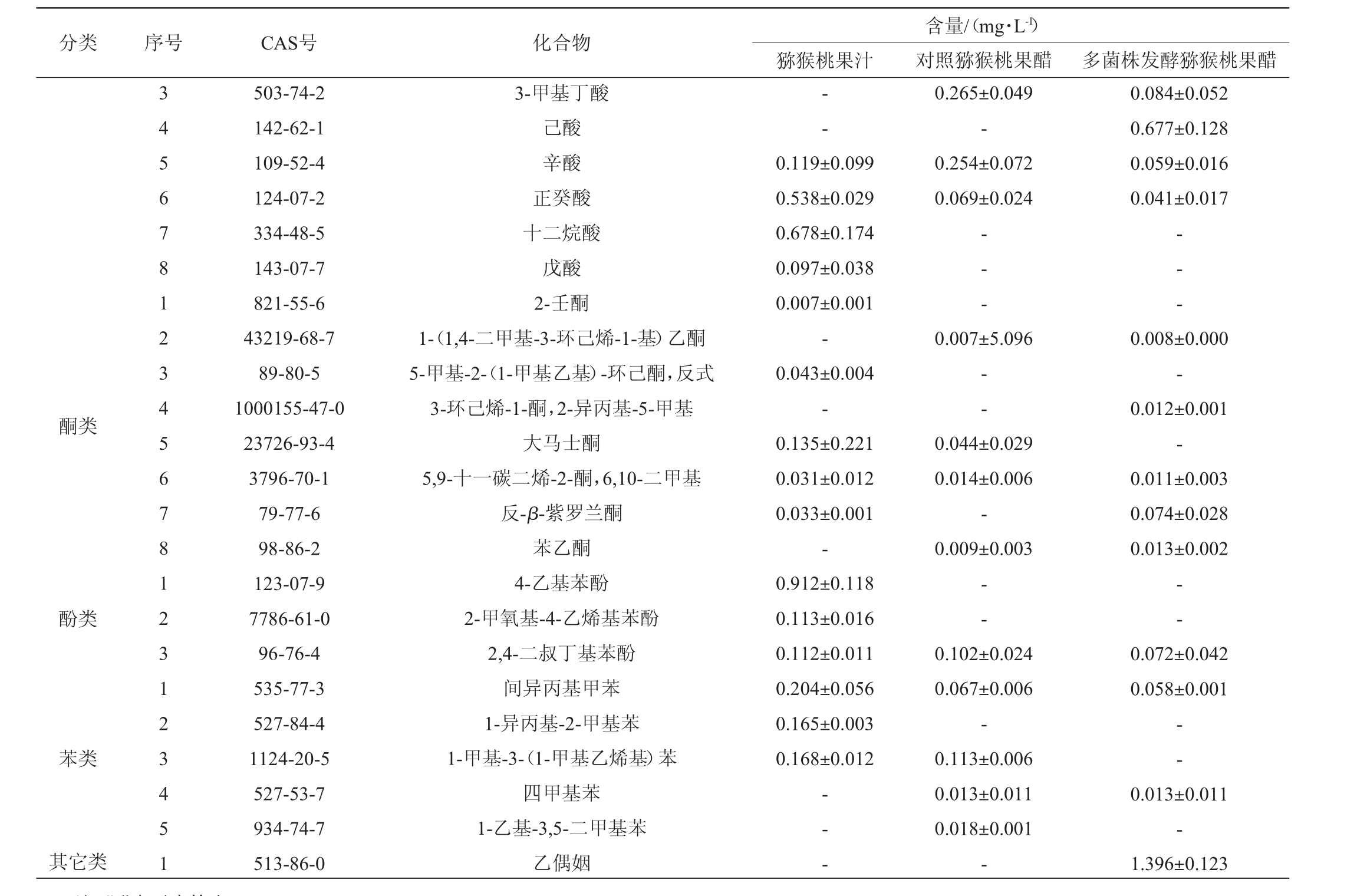
注:“-”表示未检出。
分类 序号 CAS号 化合物酮类酚类苯类其它类3 4 5 6 7 8 1 2 3 4 5 6 7 8 1 2 3 1 2 3 4 5 1 503-74-2 142-62-1 109-52-4 124-07-2 334-48-5 143-07-7 821-55-6 43219-68-7 89-80-5 1000155-47-0 23726-93-4 3796-70-1 79-77-6 98-86-2 123-07-9 7786-61-0 96-76-4 535-77-3 527-84-4 1124-20-5 527-53-7 934-74-7 513-86-0 3-甲基丁酸己酸辛酸正癸酸十二烷酸戊酸2-壬酮1-(1,4-二甲基-3-环己烯-1-基)乙酮5-甲基-2-(1-甲基乙基)-环己酮,反式3-环己烯-1-酮,2-异丙基-5-甲基大马士酮5,9-十一碳二烯-2-酮,6,10-二甲基反-β-紫罗兰酮苯乙酮4-乙基苯酚2-甲氧基-4-乙烯基苯酚2,4-二叔丁基苯酚间异丙基甲苯1-异丙基-2-甲基苯1-甲基-3-(1-甲基乙烯基)苯四甲基苯1-乙基-3,5-二甲基苯乙偶姻猕猴桃果汁--0.119±0.099 0.538±0.029 0.678±0.174 0.097±0.038 0.007±0.001-0.043±0.004-0.135±0.221 0.031±0.012 0.033±0.001-0.912±0.118 0.113±0.016 0.112±0.011 0.204±0.056 0.165±0.003 0.168±0.012-- -含量/(mg·L-1)对照猕猴桃果醋 多菌株发酵猕猴桃果醋0.265±0.049-0.254±0.072 0.069±0.024 0.084±0.052 0.677±0.128 0.059±0.016 0.041±0.017-- --- -0.007±5.096--0.044±0.029 0.014±0.006-0.009±0.003 0.008±0.000-0.012±0.001-0.011±0.003 0.074±0.028 0.013±0.002——0.102±0.024 0.067±0.006-0.113±0.006 0.013±0.011 0.018±0.001-0.072±0.042 0.058±0.001--0.013±0.011-1.396±0.123
挥发性风味物质含量顺序为:多菌株发酵果醋(46.94 mg/L)>对照猕猴桃果醋(40.37 mg/L)>果汁(25.04 mg/L),多菌株发酵果醋的挥发性风味物质含量相比果汁提升了87.46%,而相比对照猕猴桃果醋提升了61.22%,表明添加植物乳杆菌有利于增加果醋的挥发性风味物质含量[34]。
酯类化合物对醋的风味有积极贡献[35]。对照猕猴桃果醋的酯类物质含量相比发酵前降低了30.55%,而多菌株发酵果醋酯类物质的总量相比发酵前增加了27.25%,说明添加乳酸菌有利于酯类物质含量的增加。果醋中的酯类化合物主要为:乙酸乙酯、乙酸苯乙酯、甲酸甲酯和3-甲基-1-丁醇乙酸酯。乙酸乙酯具有宜人的水果香气[36],果汁经过发酵,其含量分别增加了5.72 mg/L(对照猕猴桃果醋)和13.84 mg/L(多菌株发酵果醋)。
醇类物质不仅是助香类物质,也是合成酯类物质的前体物质[37]。果醋中主要的醇类化合物为α-苯乙醇(可赋予果醋玫瑰、茉莉等花香)、4-萜烯醇(呈胡椒香)和芳樟醇(呈铃兰香)。相比对照果醋,多菌株发酵果醋中的α-苯乙醇、4-萜烯醇和芳樟醇含量分别提高了9.62%、24.87%和35.48%。
一般而言,酮被认为是理想的挥发性成分,并有助于产生甜味和果香味[38]。果汁发酵成果醋后新产生了苯乙酮,苯乙酮具有橙子的果香味,其中多菌株发酵果醋的苯乙酮含量相比对照果醋提升了44.44%。反-β-紫罗兰酮具有淡淡的木质香和花香,其中多菌株发酵果醋的反-β-紫罗兰酮含量相比果汁提升了24.24%。
其他类化合物中值得关注的是多菌株发酵果醋中出现了乙偶姻,其含量为1.396 mg/L,其是乳酸菌的一种特殊发酵产物[39]。
3 结论
本研究在猕猴桃果醋发酵过程中添加植物乳杆菌强化发酵,根据单因素及正交试验结果,得到猕猴桃果醋酒精发酵最佳工艺为:酵母菌接种量0.9%,乳酸菌接种量7%,初始可溶性固形物19°Bx,发酵温度27 ℃。在此优化条件下,酒精度为(8.82±0.57)%vol,乳酸含量为(12.15±0.73)mg/mL。猕猴桃果醋醋酸发酵最佳工艺为:发酵时间8 d,醋酸菌接种量12%,初始酒精度7%vol,发酵温度32 ℃。在此优化条件下,醋酸含量为(4.34±0.17)g/100 mL,感官评分为80.09分。多菌株发酵猕猴桃果醋的氨基酸总量、必需氨基酸和非必需氨基酸含量均显著高于果汁(P<0.05),且四种呈味氨基酸含量均高于未添加植物乳杆菌果醋。多菌株发酵猕猴桃果醋共检出挥发性风味物质37种,挥发性风味物质总量为46.94 mg/L,多菌株发酵猕猴桃果醋挥发性成分的种类和含量均大于果汁及未添加植物乳杆菌果醋。综上,添加植物乳杆菌强化发酵可以有效增加猕猴桃果醋中挥发性风味物质,从而提升果醋品质。
[1]LIM Y J, OH C S, PARK Y D, et al.Physiological components of kiwifruits with in vitro antioxidant and acetylcholinesterase inhibitory activities[J].Food Sci Biotechnol,2014,23(3):943-949.
[2]周宇,赵美玉,齐开,等.基于土地利用的神农架生态资产价值研究[J].生态科学,2023,42(2):66-73.
[3]俞琳.珍稀濒危植物长序榆遗传多样性研究[D].杭州:浙江农林大学,2010.
[4]HUANG Z, LI J, ZHANG J, et al.Physicochemical properties enhancement of Chinese kiwifruit(Actinidia chinensis Planch)via chitosan coating enriched with salicylic acid treatment[J].J Food Meas Charact, 2016,11(1):184-191.
[5] CHEN Y, BAI Y, LI D, et al.Improvement of the flavor and quality of watermelon vinegar by high ethanol fermentation using ethanol-tolerant acetic acid bacteria[J].Int J Food Eng,2017,13(4): DOI:10.1515/ijfe-2016-0222.
[6]LIU A,PENG Y,AO X,et al.Effects of Aspergillus niger biofortification on the microbial community and quality of Baoning vinegar[J].LWT-Food Sci Technol,2020,131.
[7]刘小雨,李科,张惟广.纯种发酵和混菌发酵对野木瓜果酒品质的影响[J].食品与发酵工业,2018,44(10):134-140.
[8]曾朝珍,康三江,张辉元,等.混菌发酵产酶活性与苹果酒风味物质构成的相关性分析[J].中国酿造,2020,39(12):74-80.
[9]丁玉萍,王梦泽,刘宇欣,等.单菌与混菌发酵软枣猕猴桃果酒品质比较[J].中国酿造,2023,42(5):145-150.
[10]钟武,王腾腾,张娜威,等.带皮发酵对‘金艳’猕猴桃果醋品质的影响[J].食品科学,2020,41(22):74-78.
[11]缪成鹏,张晓红,张晓敏,等.葡萄酒醋的发酵工艺及风味的研究现状[J].现代食品,2020(19):29-32.
[12]王连润,陶磅,陈霞,等.猕猴桃优异资源果实形态及营养成分分析[J].西南农业学报,2021,34(7):1515-1520.
[13]邓丽丽,刘亚男,喻道军,等.发酵猕猴桃果醋用醋酸菌的筛选与鉴定[J].沈阳医学院学报,2019,21(6):536-539.
[14]张业芳.猕猴桃发酵饮料的研制及生物活性成分分析[D].贵阳:贵州医科大学,2018.
[15]张璐,梁锦,黄天姿,等.单一及混合益生菌发酵猕猴桃果汁的香气成分分析[J].食品科学,2021,42(24):213-220.
[16]王宏,黄炳旗,刘功良,等.橄榄果酒发酵工艺优化与挥发性风味物质分析[J].中国酿造,2023,42(10):214-219.
[17]国家市场监督管理总局,国家卫生健康委员会.GB 12456—2021 食品安全国家标准食品中总酸的测定[S].北京:中国标准出版社,2021.
[18]国家卫生和计划生育委员会.GB 5009.225—2016 食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[19]国家食品药品监督管理总局,国家卫生和计划生育委员会.GB5009.124—2016 食品安全国家标准食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[20]黄宁馨,鲁群,丁士勇,等.复合乳酸菌发酵过程中枸杞果汁品质及抗氧化活性变化[J].华中农业大学学报,2021,40(6):186-194.
[21]钟武,李二虎,郭晓丽,等.利用电子鼻检测6种商业果汁饮料中脂环酸芽孢杆菌的污染[J].现代食品科技,2017,33(12):239-248.
[22]国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 30884—2014 苹果醋饮料[S].北京:中国标准出版社,2014.
[23]胡陆军,胡晋伟,陈晓蝶,等.混菌发酵对百梨百香果复合果酒品质影响的研究[J].中国酿造,2023,42(3):122-128.
[24]白烨.混菌发酵柑橘果醋的研究[D].武汉:湖北工业大学,2016.
[25]顾凡,晏恒,赵存朝,等.葡萄百香果酒的酿造工艺研究[J].中国酿造,2021,40(8):222-226.
[26]杨杰.百香果果醋发酵工艺及发酵过程中的特征化学成分研究[D].柳州:广西科技大学,2021.
[27]孟芳,兰亚杰,冀权,等.响应面法优化枸杞果醋醋酸发酵工艺[J].中国酿造,2023,42(6):218-224.
[28]姬玉丹.青梅果醋优良醋酸发酵菌种筛选及工艺优化[D].无锡:江南大学,2022.
[29]管冠宇.桑葚果醋发酵工艺优化及其果渣色素提取[D].芜湖:安徽工程大学,2019.
[30]TIAN T, SUN J, WU D, et al.Objective measures of greengage wine quality:from taste-active compound and aroma-active compound to sensory profiles[J].Food Chem,2021,340:128179.
[31]GHOSH D, CHATTORAJ D K, CHATTOPADHYAY P.Studies on changes in microstructure and proteolysis in cow and soy milk curd during fermentation using lactic cultures for improving protein bioavailability[J].J Food Sci Technol,2013,50(5):979-985.
[32]SUN M,YANG F,HOU W,et al.Dynamic variation of amino acid contents and identification of sterols in Xinyang Mao Jian green tea[J].Molecules,2022,27(11):3562.
[33]YU H,ZHAO J,LI F,et al.Characterization of Chinese rice wine taste attributes using liquid chromatographic analysis, sensory evaluation,and an electronic tongue[J].J Chromatogr B Anal Technol Biomed Life Sci,2015,997:129-135.
[34]DUAN W,GUAN Q,ZHANG H L,et al.Improving flavor,bioactivity,and changing metabolic profiles of goji juice by selected lactic acid bacteria fermentation[J].Food Chem,2023,408:135155.
[35]ÖZEN M,ÖZDEMIR N,FILIZ B,et al.Sour cherry(Prunus cerasus L.)vinegars produced from fresh fruit or juice concentrate: Bioactive compounds,volatile aroma compounds and antioxidant capacities[J].Food Chem,2020,309:125664.
[36]SU M S,CHIEN P J.Aroma impact components of rabbiteye blueberry(Vaccinium ashei)vinegars[J].Food Chem,2010,119(3):923-928.
[37]石媛媛,胡萍,张珺,等.乳酸菌强化发酵对刺梨果醋风味品质的影响[J].食品与发酵科技,2022,58(2):22-30.
[38]马士成,王梦琪,刘春梅,等.六堡茶挥发性成分中关键香气成分分析[J].食品科学,2020,41(20):191-197.
[39]杨铭,郝晓娜,罗天淇,等.功能基因分析辅助筛选产双乙酰和乙偶姻乳酸菌[J].食品科学,2020,41(10):117-123.