黄酮是一种天然的物质,广泛存在于植物中,是由植物在光合作用过程中产生的次生代谢产物。因此,从植物中提取黄酮是一种较为可行的方法[1]。作为一种功能性成分,黄酮具有多种功效,如保护心脏、抗炎等[2-3]。黄酮类化合物因其具备的生物活性而具有更广泛的用途,如抗衰老、免疫调节、抗癌等[4-6],有着广泛的药理应用潜力[7]。
我国具有丰富的茶叶资源,包括绿茶、红茶、黄茶、白茶、乌龙茶和黑茶等多种品种[8]。广西有着悠久的绿茶种植历史,较为出名的有凌云白毫绿茶[9]、金秀绿茶[10]、三江绿茶[11]等。茶叶含有多种黄酮类化合物,这些化合物是由酚醛植物产生的主要成分,目前已经鉴定出超过6 000种具有C6-C3-C6环结构的黄酮类物质[12-13]。黄酮类化合物被证实具有多种健康益处,包括抗糖尿病、抗心血管疾病和神经保护等作用[14]。这些保健功效的机制涉及黄酮类化合物的酶调节、改善血液循环、调节细胞凋亡、干细胞信号转导和还原性等。国内学者对红茶[15]、普洱茶[16]、绿茶[17]等茶叶进行的研究占据主要研究方向。关于茶叶的抗氧化作用,目前已经有一些研究报道[18-19]。然而有关广西不同地区茶叶的黄酮含量比较研究较为缺乏,特别是对来宾金秀产的茶叶研究报道较少,比较广西不同地区茶叶中黄酮的抗氧化能力的相关文献略有不足。因此,广西地区茶叶的抗氧化作用研究还有待进一步完善,这将有助于推广广西茶叶,并在食品、药品等多个行业中具有一定的经济价值。
本研究以桂北地区、桂中地区、桂南地区的三种绿茶为研究对象,采用微波辅助提取的方法,从中提取黄酮类物质,并测定其含量及抗氧化能力,由此来比较其总黄酮含量之间的差异以及抗氧化能力的大小。
1 材料与方法
1.1 材料与试剂
金秀绿茶:广西金秀瑶族自治县(桂中地区);三江县绿茶:广西三江侗族自治县(桂北地区);凌云白毫茶:广西百色市凌云县(桂南地区)。
芦丁标准品(纯度>98%):合肥博美生物科技有限公司;氢氧化钠、硝酸铝、无水乙醇(均为分析纯):成都市科隆化学品有限公司;亚硝酸钠(分析纯):天津欧博凯化工有限公司;3,5-二硝基水杨酸(分析纯):天津奥普升化工有限公司;硫酸亚铁(分析纯):广东台山化工厂有限公司;过氧化氢(分析纯):成都金山化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
WJX-100高速多功能粉碎机:永康市红太阳机电有限公司;UV-9600紫外-可见分光光度计:上海仪电分析仪器有限公司;XH-100B电脑微波催化合成/萃取仪:北京祥鹄科技发展有限公司;FA2004电子分析天平:上海舜宇横平科学仪器有限公司;GZX-GF101-3BS电热恒温鼓风干燥箱:上海跃进医疗器械有限公司。
1.3 实验方法
1.3.1 绿茶黄酮微波提取工艺
将三种广西不同地区绿茶分别置于恒温烘箱中60 ℃烘干至质量恒定,粉碎过60目筛,密封后备用。称取1.00 g的绿茶粉末,按照一定体积分数的乙醇、料液比、微波功率在微波温度60 ℃、微波时间4 min条件下提取黄酮,抽滤除去滤渣,得到绿茶黄酮提取液[21]。
1.3.2 绿茶黄酮微波提取条件优化单因素试验
(1)微波功率的选择
在料液比1∶30(g∶mL)、乙醇体积分数60%、微波时间4 min和微波温度60 ℃固定条件下,分别用微波功率300 W、400 W、500 W、600 W和700 W提取并测定茶叶粉末中总黄酮的含量。
(2)料液比的选择
在乙醇体积分数60%、微波时间4 min、微波温度60 ℃和微波功率300 W固定条件下,分别使用液料比1∶20、1∶30、1∶40、1∶50和1∶60(g∶mL)提取并测定茶叶粉末中总黄酮的含量。
(3)乙醇体积分数的选择
在料液比1∶30(g∶mL)、微波时间4 min、微波温度60 ℃和微波功率300 W固定条件下,分别使用30%、40%、50%、60%和70%体积分数的乙醇提取并测定茶叶粉末中总黄酮的含量。
1.3.3 绿茶总黄酮微波提取条件优化正交试验设计[20]
在单因素试验的基础上,选择乙醇体积分数(A)、料液比(B)、微波功率(C)作为考察因素,以绿茶总黄酮得率为考察指标,分别设计3因素3水平正交试验对桂北地区、桂中地区、桂南地区绿茶总黄酮微波提取条件进行优化。
1.3.4 总黄酮得率测定
采用分光光度法[22]测定总黄酮含量。配制质量浓度0.2 mg/mL的芦丁标准溶液(称量芦丁10 mg,体积分数为60%的乙醇溶解定容至50 mL),分别移取0 mL、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL上述标准溶液于10 mL试管,加入体积分数为60%的乙醇溶液至3.0 mL。在试管内先后添加0.7 mL 5%NaNO2溶液,0.7 mL 10%Al(NO3)3溶液和5 mL 10%NaOH溶液,每一次添加溶液后均需摇匀,加入体积分数为60%的乙醇溶液至10 mL,静置15 min。以空白试剂为参比溶液,在波长510 nm处测定其吸光度值。以芦丁标准品质量浓度(X)为横坐标,芦丁溶液吸光度值(Y)为纵坐标绘制标准曲线,得到标准曲线回归方程为Y=0.177 29X-0.007 93(R2=0.999 2)。同理测定提取液中总黄酮含量,通过标准曲线的回归方程计算3种茶叶提取液中的总黄酮得率。按公式(1)计算总黄酮得率。
式中:C为待测液总黄酮质量浓度,mg/mL;V为测液定容体积,mL;M为茶叶粉末质量,g;N为待测液的稀释倍数。
1.3.5 羟基自由基清除率的测定
参照孙晓波等[23-24]的方法,分别移取质量浓度为50μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、600 μg/mL、800 μg/mL、1 000 μg/mL的绿茶总黄酮待测液各1.0 mL于10 mL试管中,依次加入6 mmol/L硫酸亚铁溶液0.7 mL、6 mmol/L水杨酸-乙醇溶液0.7 mL、6 mmol/L过氧化氢溶液5 mL,最后将其置于事先预热好的37 ℃恒温水浴锅中反应30 min,在波长为510 nm的分光光度计中测其吸光度值A1。采用上述方法,把过氧化氢溶液置换为等量的蒸馏水,并测量其吸光度值A2,以此作为提取液的本底吸光度值;另取一支试管以不加总黄酮的待测溶液作空白试验的对照,测定其吸光度值A0。按照公式(2)计算羟基自由基的清除率。
1.3.6 DPPH自由基清除率的测定
参照孙晓波等[23-25]的方法,并对其进行适当修改。分别移取质量浓度为1 μg/mL、5 μg/mL、15 μg/mL、25 μg/mL、35 μg/mL、45 μg/mL、55 μg/mL的绿茶总黄酮待测液各2 mL于10 mL试管中,加入2 mL 0.2 mmol/L DPPH溶液,定容摇匀,在室温下避光反应30 min后,在波长517 nm处测定其吸光度值A1;按照上述方法,在不加入DPPH溶液的情况下,对其提取液的本底吸光度值A2进行测定;另取一支试管加入0.2 mmol/L DPPH、无水乙醇溶液各2 mL,定容摇匀后在波长517 nm处测定其吸光度值A0,作为空白试验对照。按照公式(3)计算DPPH自由基清除率。
1.3.7 数据处理
以上所有试验都重复3次;利用Origin2021、Excel 2021等软件进行实验数据处理、分析和绘制。
2 结果与分析
2.1 绿茶总黄酮提取工艺优化单因素试验结果
2.1.1 微波提取功率对绿茶总黄酮得率的影响
由图1可知,随着微波功率不断上升,绿茶总黄酮得率先上升后下降。桂北地区绿茶的总黄酮得率在微波功率600 W时达到峰值,为(10.861±0.639)%;桂中地区绿茶在微波功率500 W时达到峰值,为(12.283±0.563)%;桂南地区绿茶在微波功率600 W时达到峰值,为(14.009±0.753)%。因此选择桂北、桂中、桂南地区绿茶总黄酮微波提取功率分别为600 W、500 W、600 W。这可能是由于微波功率的不断提升,绿茶样品细胞中总黄酮的溶出速度加快,导致溶液温度升高,提高了得率。但是过高的温度使乙醇溶液挥发速度加快,使绿茶样品中的总黄酮分子结构遭到破坏,部分黄酮物质分解,导致总黄酮的得率下降。
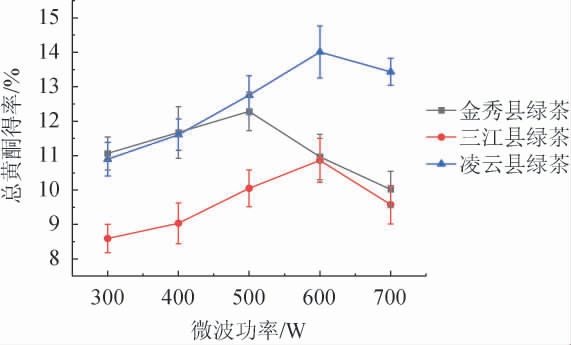
图1 微波提取功率对绿茶总黄酮得率的影响
Fig.1 Effect of microwave extraction power on the yield of total flavonoids of green tea
2.1.2 料液比对绿茶总黄酮得率的影响
由图2可知,在一定料液比范围内总黄酮得率呈现先上升后下降的趋势。其中桂北地区绿茶的总黄酮得率在料液比为1∶50(g∶mL)时达到峰值(10.692±0.374)%,桂中地区绿茶的总黄酮得率在料液比为1∶50(g∶mL)时达到峰值(11.809±0.448)%,桂南地区绿茶的总黄酮得率在料液比为1∶40(g∶mL)时达到峰值(13.806±0.289)%。因此选择桂北、桂中、桂南地区绿茶总黄酮微波提取料液比分别为1∶50、1∶50、1∶40(g∶mL)。可能原因是绿茶样品与乙醇溶液的接触不充分,导致总黄酮的溶出受到影响,尤其是在料液比较低的情况下。其他条件一定时,料液比进一步增大,总黄酮的溶出量降低。随着料液比的增加,绿茶样品中的其他醇溶性成分的溶解性也进一步增加,从而抑制了总黄酮的释放,导致总黄酮的得率下降[23]。
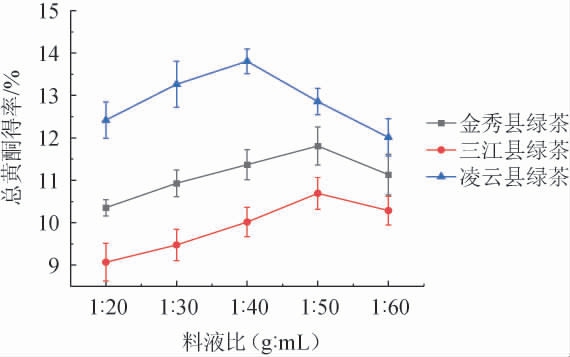
图2 料液比对绿茶总黄酮得率的影响
Fig.2 Effect of solid and liquid ratio on the yield of total flavonoids of green tea
2.1.3 乙醇体积分数对绿茶总黄酮得率的影响
由图3可知,乙醇体积30%~70%范围内,总黄酮得率呈现先上升后下降的趋势。桂北地区绿茶的总黄酮得率在乙醇体积分数为60%时达到峰值(10.150±0.396)%,桂中地区绿茶的总黄酮得率在乙醇体积分数为50%时达到峰值(12.316±0.429)%,桂南地区绿茶的总黄酮得率在乙醇体积分数为50%时达到峰值(14.152±0.244)%。因此选择桂北、桂中、桂南地区绿茶总黄酮微波提取乙醇体积分数分别为60%、50%、50%。乙醇溶液的浓度较低时,绿茶样品中黄酮类物质未完全溶解,导致得率下降,随乙醇体积分数进一步增加,得率逐渐增大;当乙醇体积分数>60%,乙醇体积分数过高溶剂极性降低,绿茶样品中醇溶性非极性物质和色素等其他物质溶出量升高[26],绿茶样品总黄酮溶解效率和得率下降。
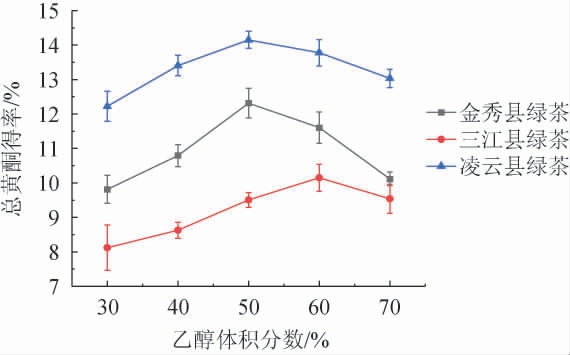
图3 乙醇体积分数对绿茶总黄酮得率的影响
Fig.3 Effect of ethanol volume fraction on the yield of total flavonoids of green tea
2.2 绿茶总黄酮提取工艺优化正交试验结果及分析
广西不同地区绿茶黄酮微波提取条件优化正交试验结果见表1、表2、表3。
表1 桂北地区绿茶总黄酮微波提取条件优化正交试验结果与分析
Table 1 Results and analysis of orthogonal experiments for microwave extraction conditions optimization of total flavonoids in green tea in northern Guangxi
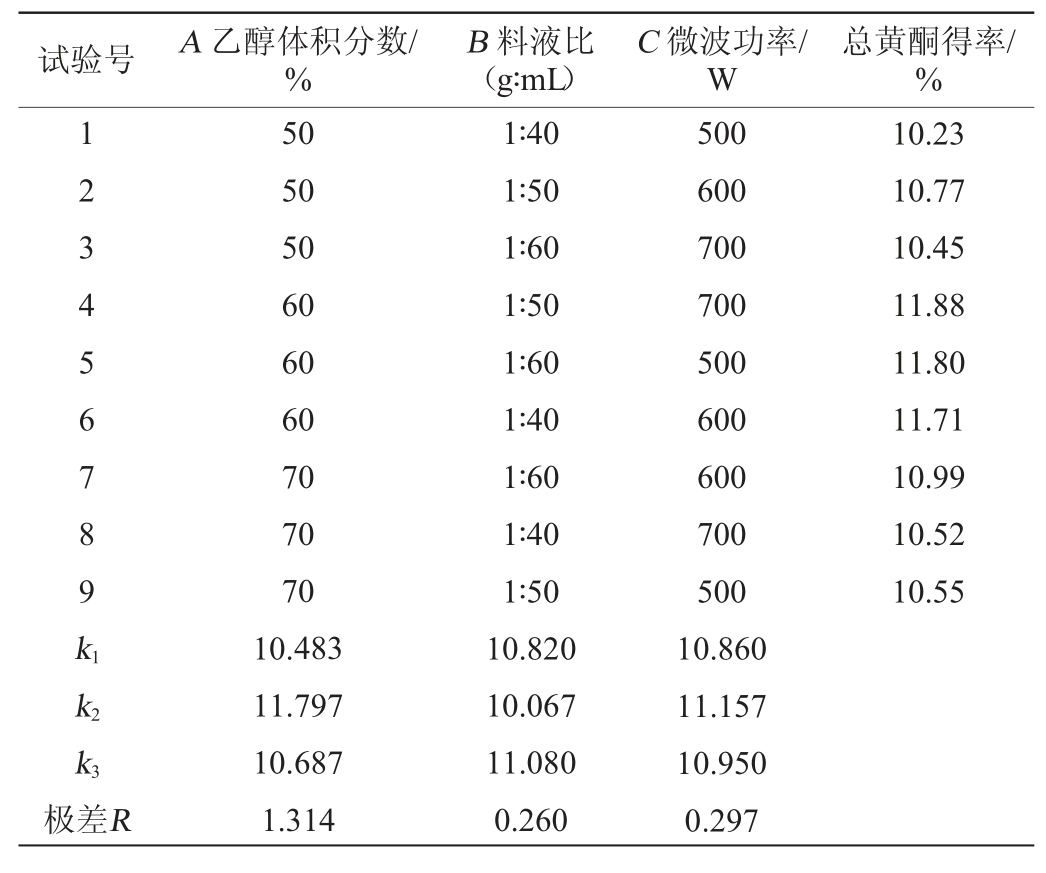
试验号 A 乙醇体积分数/%B 料液比(g∶mL)C 微波功率/W总黄酮得率/%1 234 56789k1 10.23 10.77 10.45 11.88 11.80 11.71 10.99 10.52 10.55 k2 k3极差R 50 50 50 60 60 60 70 70 70 10.483 11.797 10.687 1.314 1∶40 1∶50 1∶60 1∶50 1∶60 1∶40 1∶60 1∶40 1∶50 10.820 10.067 11.080 0.260 500 600 700 700 500 600 600 700 500 10.860 11.157 10.950 0.297
表2 桂中地区绿茶总黄酮微波提取条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for microwave extraction conditions optimization of total flavonoids in green tea in central Guangxi
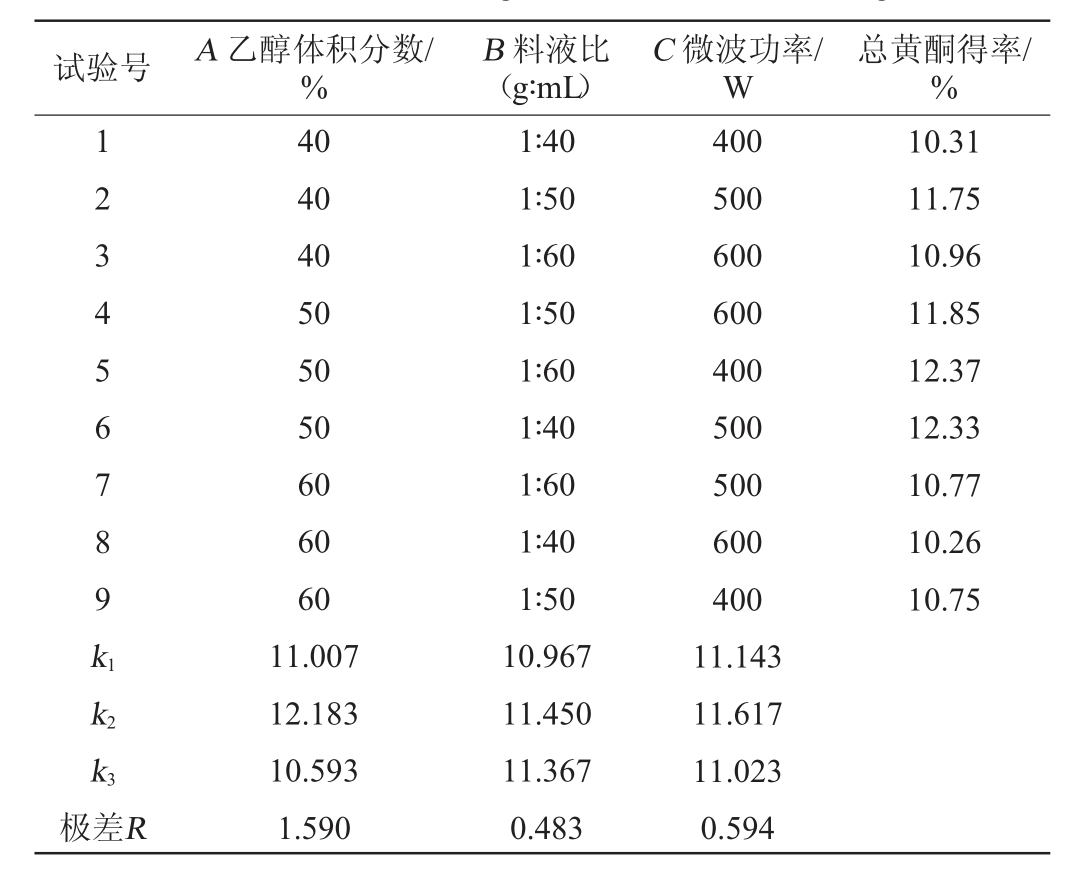
试验号 A 乙醇体积分数/%B 料液比(g∶mL)C 微波功率/W总黄酮得率/%1 23456789k1 10.31 11.75 10.96 11.85 12.37 12.33 10.77 10.26 10.75 k2 k3极差R 40 40 40 50 50 50 60 60 60 11.007 12.183 10.593 1.590 1∶40 1∶50 1∶60 1∶50 1∶60 1∶40 1∶60 1∶40 1∶50 10.967 11.450 11.367 0.483 400 500 600 600 400 500 500 600 400 11.143 11.617 11.023 0.594
表3 桂南地区绿茶总黄酮微波提取条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for microwave extraction conditions optimization of total flavonoids in green tea in southern Guangxi
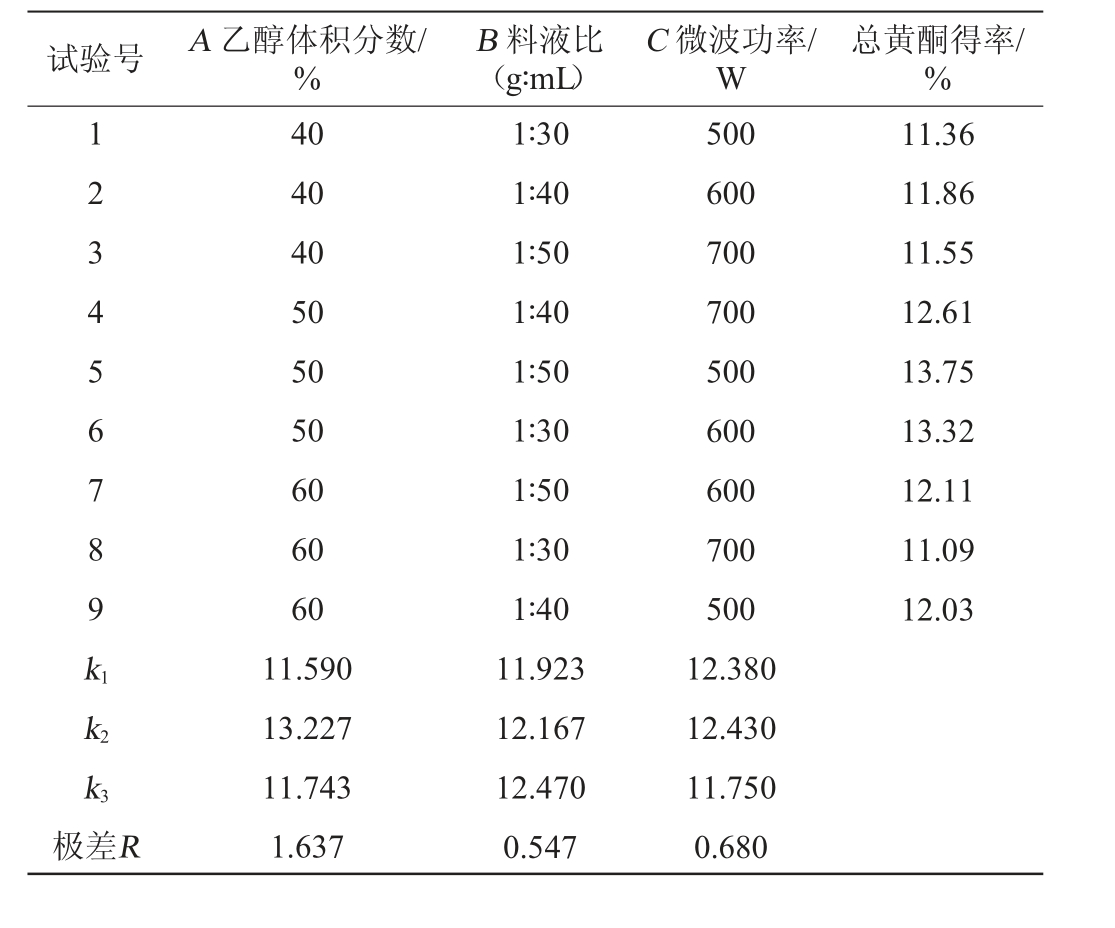
试验号 A 乙醇体积分数/%B 料液比(g∶mL)C 微波功率/W总黄酮得率/%1 2 3 4 5 6 7 8 9 k1 11.36 11.86 11.55 12.61 13.75 13.32 12.11 11.09 12.03 k2 k3极差R 40 40 40 50 50 50 60 60 60 11.590 13.227 11.743 1.637 1∶30 1∶40 1∶50 1∶40 1∶50 1∶30 1∶50 1∶30 1∶40 11.923 12.167 12.470 0.547 500 600 700 700 500 600 600 700 500 12.380 12.430 11.750 0.680
由表1可知,桂北地区绿茶黄酮的最佳微波提取条件组合为A2B3C2,即乙醇体积分数为60%、料液比为1∶60(g∶mL)、微波功率为600 W;由表2可知,桂中地区绿茶总黄酮的最佳微波提取条件组合为A2B2C2,即乙醇体积分数为50%、料液比为1∶50(g∶mL)、微波功率为500 W;由表3可知,桂南地区绿茶黄酮的最佳微波提取条件组合为A2B3C2,即乙醇体积分数为50%、料液比为1∶50(g∶mL)、微波功率为600 W。各因素对黄酮得率的影响大小均为A>C>B,即乙醇体积分数>微波功率>料液比。
根据正交试验结果获得最优提取条件并进行验证试验,在最优提取条件下,桂北地区、桂中地区、桂南地区绿茶黄酮得率分别为(12.29±0.56)%、(12.51±0.39)%、(14.32±0.42)%。
2.3 绿茶总黄酮体外抗氧化能力
2.3.1 羟基自由基清除活性
由图4可知,三种绿茶中的黄酮对羟基自由基均有一定的清除能力。在50~800 μg/mL质量浓度范围内,羟基自由基清除率随着总黄酮的质量浓度增大而增大,当质量浓度>800 μg/mL时,清除率趋于平缓。当总黄酮质量浓度为1 000 μg/mL时,桂北地区绿茶、桂中地区绿茶、桂南地区绿茶所提取出的总黄酮对羟基自由基的清除率分别为(34.68±0.40)%、(43.65±0.23)%、(45.35±0.23)%。其中,桂北地区绿茶的清除效率低于桂南地区绿茶与桂中地区绿茶。
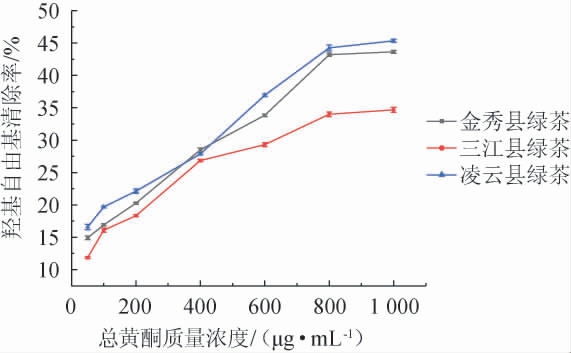
图4 不同质量浓度绿茶总黄酮对羟基自由基的清除率
Fig.4 Scavenging rates of total flavonoids in green tea with different mass concentrations on hydroxyl radicals
2.3.2 DPPH自由基清除活性
由图5可知,在1~50 μg/mL质量浓度范围内,三种绿茶中的黄酮均对DPPH自由基的清除能力呈现良好的线性关系,随着黄酮质量浓度的增大,其对DPPH自由基的清除能力逐渐增强。通过origin线性拟合结果计算得出,桂北地区绿茶、桂中地区绿茶、桂南地区绿茶所提取出的总黄酮对DPPH的半抑制浓度(half inhibitory concentration,IC50)分别为20.33 μg/mL、19.87 μg/mL、12.80 μg/mL,说明三种绿茶对DPPH自由基的清除能力整体呈以下关系:桂南地区绿茶>桂中地区绿茶>桂北地区绿茶。
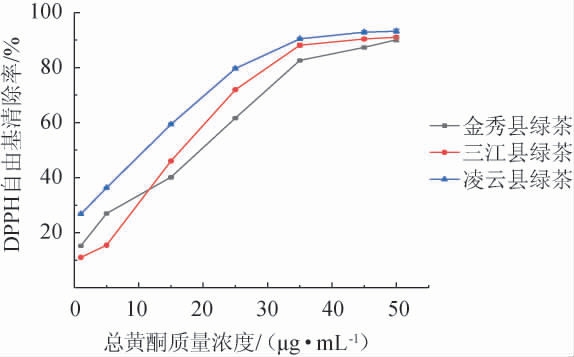
图5 不同质量浓度绿茶总黄酮对1,1-二苯基-2-三硝基苯肼自由基的清除率
Fig.5 Scavenging rates of total flavonoids in green tea with different mass concentrations on 1,1-diphenyl-2-picrylhydrazyl radicals
3 结论
以广西不同地区绿茶为原料,基于单因素试验及正交试验优化,得到桂北地区、桂南地区、桂中地区绿茶黄酮的微波辅助提取最优工艺参数分别为:乙醇体积分数为60%、料液比为1∶60(g∶mL)、微波功率为600 W;乙醇体积分数为50%、料液比为1∶50(g∶mL)、微波功率为500 W;乙醇体积分数为50%、料液比为1∶50(g∶mL)、微波功率为600 W。在此条件下,三种绿茶的总黄酮得率分别为(12.29±0.56)%、(12.51±0.39)%、(14.32±0.42)%。总黄酮对羟基自由基和DPPH自由基的清除能力结果表明,桂北地区绿茶对羟基自由基的清除效率低于桂南地区绿茶与桂中地区绿茶,桂南地区绿茶对DPPH自由基的清除效率最佳,而桂北地区绿茶清除效率最低。证明了绿茶总黄酮具有良好的抗氧化活性。
[1]王璐,邢东辉.茶叶中的功能性成分及其保健功效[J].福建茶叶,2023,45(3):20-22.
[2]LV D L, CHENG X B, TANG L Y, et al.The cardioprotective effect of total flavonoids on myocardial ischemia/reperfusion in rats[J].Biomed Pharmacother,2017,88:277-284.
[3]ZARAGOZÁ C,VILLAESCUSA L,MONSERRAT J,et al.Potential therapeutic anti-inflammatory and immunomodulatory effects of dihydroflavones,flavones,and flavonols[J].Molecules,2020,25(4):1017.
[4]KOPUSTINSKIENE D M,JAKSTAS V,Savickas A,et al.Flavonoids as anticancer agents[J].Nutrients,2020,12:457.
[5]DIAS M C, PINTO D C G, SILVA A M S.Plant flavonoids: Chemical characteristics and biological activity[J].Molecules,2021,26(17):5377.
[6]SAINI N, GAHLAWAT S K, LATHER V.Flavonoids: A nutraceutical and its role as anti-inflammatory and anticancer agent[J].Plant Biotechnol,2017:255-270.
[7]DURGAPAL S D,SOMAN S S,UMAR S,et al.Synthesis and studies of flavone and bis-flavone derivatives[J].Synthetic Commun,2020,50(16):2502-2510.
[8]吴政宗.茶的药用保健及其制作工艺技术[J].当代农机,2023(1):68-70.
[9]农艳芳,郭先寿.凌云白毫茶的品质基础及潜力[J].广西热作科技,1998(2):17-19.
[10]刘初生,李智勇,梁月超,等.“圣山碧玉”茶的生产加工技术及开发应用[J].中国农村小康科技,2008(8):66-67.
[11]石永健,叶艳.浅析三江绿茶品牌化经营发展对策[J].蚕桑茶叶通讯,2009(6):29-30.
[12]祁建宏,董芳旭.黄酮类化合物药理作用研究进展[J].北京联合大学学报,2020,34(3):89-92.
[13]刘海燕,曹藩荣.茶叶中黄酮类化合物对肠道的保护作用的研究概况[J].广东茶业,2021(3):2-7.
[14]高文波,翁国斌.绿茶多酚抗氧化作用及其机制研究进展[J].国际药学研究杂志,2009,36(5):332-335,361.
[15]QU F F,ZENG W C,TONG X,et al.The new insight into the influence of fermentation temperature on quality and bioactivities of black tea[J].LWT-Food Sci Technol,2020,117:108646.
[16]孙世利,刘雅琼,刘瑾,等.不同年份普洱茶体外降糖降脂作用及其物质基础[J].食品研究与开发,2018,39(9):152-158.
[17]齐红革,尹华涛,廖振宇,等.ICP-MS法测定不同产地绿茶中矿物质和微量元素[J].食品研究与开发,2015,36(8):65-67.
[18]ZHAO C N,TANG G Y,CAO S Y,et al.Phenolic profiles and antioxidant activities of 30 tea infusions from green,black,oolong,white,yellow and dark teas[J].Antioxidants,2019,8(7):215.
[19]XIANG G,SUN H P,CHEN Y Y,et al.Antioxidant and hypoglycemic activity of tea polysaccharides with different degrees of fermentation[J].Int J Biol Macromol,2023,228:224-233.
[20]唐晓丹,王玲,崔静玉.不同种类茶叶中总黄酮的提取工艺优化及含量对比研究[J].国际药学研究杂志,2019,46(11):862-866.
[21]吕名秀,董雪茹,赵龙涛,等.微波辅助提取茶叶黄酮的工艺研究[J].河南化工,2017,34(2):20-23.
[22]王丽丽,林清霞,宋振硕,等.分光光度法测定茶叶中总黄酮含量[J].茶叶学报,2021,62(1):1-6.
[23]孙晓波,吴慧贤,王小明,等.蒲桃叶多酚微波辅助提取工艺及抗氧化活性研究[J].中国食品添加剂,2022,33(4):34-42.
[24]傅贤明,卢诗,黄欣,等.超声提取福鼎白茶总黄酮工艺优化及抗氧化能力研究[J].粮食与油脂,2022,35(12):114-118,122.
[25]谷睿,邹蓉,唐健民,等.普通油茶总黄酮提取工艺优化及抗氧化活性比较[J].江苏农业科学,2022,50(4):163-169.
[26]汤兴楠,栾凯文,王荣香,等.微波辅助提取辣木籽总苷工艺优化及其抗氧化活性研究[J].食品工业科技,2022,43(4):246-253.