荞麦(Fagopyrum esculentum Moench.),是蓼科荞麦属的植物[1],作为我国最主要的粮谷类食品之一,其营养价值远超其他杂粮,甚至超过小麦、玉米等主粮[2]。荞麦含有多种人体所必须的营养物质,包括蛋白质、脂类物质、不饱和脂肪酸、膳食纤维、维生素及矿物质、微量元素等[3-5],具有抗菌消炎、抗病毒、促进新陈代谢、降血糖、降血脂、降低胆固醇、降血压[6-9]等功效。我国的酿造食醋历史悠久、品种繁多,根据其酿造中气候环境、发酵原料、工艺设备等条件的不同,出现了众多不同地区、不同酿造方法及不同风味的食醋[10-13]。荞麦醋是一种以荞麦为原料酿造的醋,其独特的风味和营养价值受到人们的喜爱。荞麦醋具有独特的酸度和风味,富含有机酸、维生素和矿物质[14-16]等营养成分,常被用于调味、腌制食物、制作凉菜和酱料等。同时,荞麦醋也被认为具有一定的药用价值[17-19],对改善血液循环、促进消化和健康方面有一定的益处[20-21]。近些年,市场的消费能力及消费品味逐年提高,网络销售、直播带货的销售方式逐渐被消费者接受,这些都促进了食醋市场由过去的中低端产品主导转向健康高端产品主导[22-24]。以荞麦为原料的荞麦醋新产品,作为一种酸性调味剂,不但具有独特的荞麦风味,还有一定的保健功效,受到越来越多人的喜好,其市场具有极高的增长空间[25-26]。
酒精发酵过程是荞麦醋酿造过程中的一个关键环节,其过程主要包括发酵液中糖类物质在无氧条件下,由酿酒酵母代谢产生酒化酶的作用转化为酒精的过程。而酒精作为醋酸发酵的原料,直接决定了醋酸发酵结束后的醋酸产量。宋永强等[27]通过响应面法优化了食醋酿造过程中的酒精发酵工艺,发现在发酵温度34 ℃,醪液初始pH值4.2,发酵时间71 h的发酵条件下,醪液酒精度为9.93%vol,比优化前提升了39.5%;曹冉等[28]利用液态和固态的发酵方式,采用单因素试验和正交试验对荞麦酿造酒工艺进行了优化,确定了最佳的发酵工艺条件:料液比1∶3(g∶mL),酿酒曲添加量0.6%,发酵时间12 d,发酵温度20 ℃。在此条件下,酒精度为12.37%vol。但针对荞麦、高粱等杂粮酿造食醋的酒精工艺研究较少,有待进一步深入探讨。
本研究以荞麦为原料制备荞麦醋,以发酵醪酒精度为响应值,以固液比、酵母接种量、接种温度、发酵温度、发酵时间等因素为自变量,采用单因素试验和响应面试验优化荞麦醋酒精发酵阶段工艺条件,为醋酸发酵及荞麦醋品质提升奠定良好基础。
1 材料与方法
1.1 材料与试剂
荞麦、麸皮、稻壳、谷糠:甘肃万佳现代农牧业发展服务有限公司;浓硫酸(分析纯):天津市化工三厂有限公司;糖化酶(酶活1.0×105 U/g)、α-淀粉酶(高温淀粉酶)(酶活1.0×104 U/g):江苏博立生物制品有限公司;固定化酵母:甘肃省科学院生物研究所;醋酸菌(Acetobacter aceti):济宁玉园生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
AS型干燥箱:北京科伟永兴仪器有限公司;Rotavapor R-3旋转蒸发仪:瑞士BUCHI公司;JA203P型分析天平:常州幸运电子设备有限公司;SW-CJ-2FD型洁净工作台:苏州安泰空气技术有限公司;ZNHW-型数显恒温电热套:郑州华特仪器设备有限公司;RP6L10超高温瞬时灭菌机:上海科劳机械设备有限公司。
1.3 方法
1.3.1 荞麦食醋加工工艺流程及操作要点
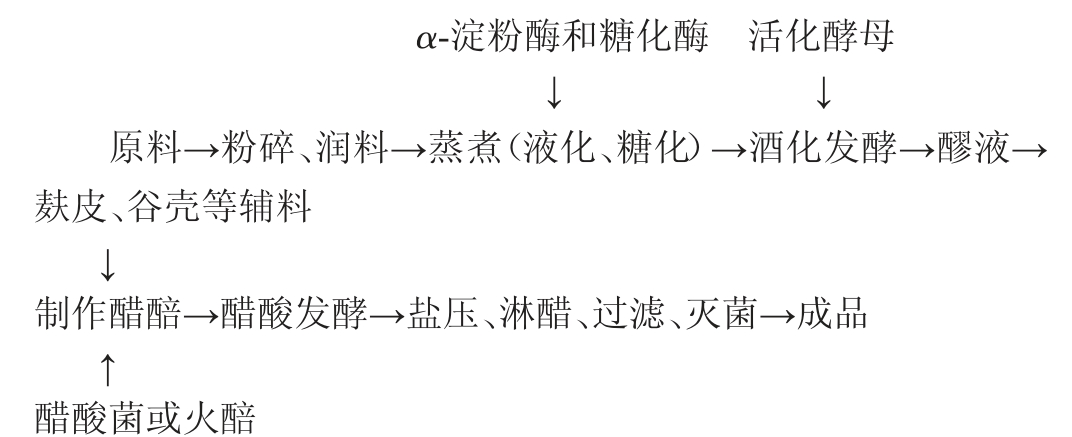
操作要点:
分选、除杂:挑选大小均匀、饱满的荞麦,去除原料中杂质。
粉碎、润料:荞麦粉经粉碎,过40目筛后加入一定量的水,浸润12 h。
糊化、液化、糖化:荞麦、玉米等主粮粉碎、过筛、润料后,通入蒸汽加热至50 ℃左右,加入α-淀粉酶后,缓慢升温至90 ℃左右,并保温1 h进行液化处理;循环水冷处理至65 ℃后,加入糖化酶,于60~65 ℃保温糖化2 h,检测糖液终外观糖度为12~14°Bx。
酵母的活化:首次使用固定化酵母时,必须让固定化酵母充分增殖,以达到其最佳使用状态。具体操作如下:将制备好的糖液(用硫酸调pH值至5.0以下)接入固定化酵母培养罐内,保持罐内温度27 ℃左右,通风搅拌培养24~32 h,当固定化酵母载体全部漂浮到醪液上层,视其表面有凸起小泡,并镜检酵母菌数达到1.0亿个/mL左右时,即为活化酵母液,可连续使用。
酒精发酵:当料液温度降至35 ℃以下时,加入一定量大曲,使物料中淀粉糖化,转化成微生物可利用碳源。继续循环水冷处理至25 ℃,将其泵入酒精发酵罐后,加入一定量的活化酵母进行酒精发酵。过程中控制发酵温度在28 ℃,发酵时间5~9 d,检测发酵液中酒精度至8.5%vol为发酵终点。
醋酸菌的活化:为了激活菌体,提高其发酵活性,提高发酵效率。将醋酸菌接种到5%红糖水中,控制活化pH值为5.5,活化温度为30 ℃,活化时间24~48 h,镜检醋酸菌数达到1.0亿个/mL左右,备用。
醋酸发酵:将酒精发酵结束的醪液,加入130%麸皮、70%稻壳、30%谷糠(均以主粮计),翻拌均匀,接入活化好的醋酸菌,进行醋酸固态发酵。醋醅发酵温度达到40 ℃后,每天翻醅1~2次,为醋酸菌提供充足的氧气,控制发酵温度为34 ℃(<40 ℃),发酵10 d左右,检测醋醅酒精度<0.3%vol,完成醋酸发酵。
盐压:为了终止醋酸发酵,提高出醋率,杀灭发酵过程中的微生物。于上述醋醅中添加1%~2%的粗盐(以醋醅质量计),翻拌均匀,将醋醅置于盐压槽7~10 d,镜检无活性醋酸菌后,完成盐压过程。
淋醋、过滤:为了去除醋液中杂质,提高食醋的清亮度,同时也起到过滤的作用。将完成上述过程的醋醅置于淋醋池中,加入醋醅质量1.5倍的自来水没过醋醅表面,浸泡20~24 h后,使醋液充分溶于水中,就可以淋醋,直至醋液全部淋出。
灭菌:采用超高温瞬时杀菌方法,灭菌条件为灭菌温度115 ℃、时间5 s、流量3 000 L/h,灭菌后即得成品荞麦醋。
1.3.2 荞麦食醋酒精发酵工艺优化
(1)单因素试验
本试验分别考察酒精发酵过程中固液比、酵母接种量、接种温度、发酵温度及发酵时间5个因素对发酵过程中酒精度的影响。其中,设置固液比分别为1∶2、1∶3、1∶4、1∶5、1∶6(g∶mL);酵母接种量分别为15%、23%、30%、37%、45%;接种温度分别为20 ℃、22 ℃、25 ℃、27 ℃、30 ℃;发酵温度分别为20 ℃、24℃、28℃、32℃、36℃;发酵时间分别为3d、5d、7d、9d、11d。
(2)响应面试验
在单因素试验的基础上,固定接种温度为25 ℃,发酵时间为7 d,以酒精发酵过程中的固液比(A)、酵母接种量(B)、发酵温度(C)3个因素为自变量,以酒精度(Y)为响应值,设计3因素3水平响应面试验。Box-Behnken试验设计因素与水平见表1。
表1 酒精发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for alcoholic fermentation technology optimization

水平 A 固液比(g∶mL) B 酵母接种量/% C 发酵温度/℃-1 0 1 1∶3.5 1∶4.0 1∶4.5 28 30 32 26 28 30
1.3.3 酒精度检测
酒精度检测采用蒸馏-酒精计法。取发酵后醪液100 mL置于500 mL圆底烧瓶中,加入100 mL蒸馏水,放入数粒玻璃珠后,于加热套中加热蒸馏,并收集100 mL馏出液至量筒后,分别用酒精计、温度计测定其酒精度、温度,查询酒精计温度与20 ℃酒精度换算表后,得到酒精度。每组数据进行3次平行试验,测定结果取平均值。
1.3.4 数据处理
采用Origin 9.0软件制图,响应面模型拟合采用Design-Expert 10.0.7软件。
2 结果与分析
2.1 荞麦食醋酒精发酵工艺优化单因素试验
2.1.1 固液比对酒精度的影响
由图1可知,当固液比为1∶2~1∶4(g∶mL)时,酒精度逐渐增加;当固液比为1∶4(g∶mL)时,酒精度达到最高,为9.07%vol;当固液比为1∶4~1∶6(g∶mL)时,酒精度逐渐降低。其主要原因可能是,当固液比较低时,由淀粉糖化、发酵产生的酒精度低;当固液比偏高时,一方面由于酿酒酵母转化产生乙醇的能力达到峰值;另一方面由于酒精度升高抑制了酿酒酵母的生长及发酵能力,从而导致酒精度降低。因此,选择最佳固液比为1∶4(g∶mL)。
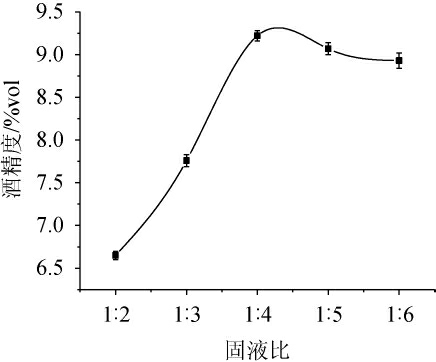
图1 固液比对酒精发酵酒精度的影响
Fig.1 Effect of solid-liquid ratio on alcohol content in alcoholic fermentation
2.1.2 酵母接种量对酒精度的影响
由图2可知,当酵母接种量在15%~30%时,酒精度随之增加;当酵母接种量为30%时,酒精度达到最高,为9.27%vol;当酵母接种量>30%之后,酒精度逐渐降低。其原因可能是,酵母液接种量超过一定量后,其自身的繁殖、代谢需要消耗更多的营养物质,从而导致其代谢产生的乙醇降低;同时随着菌体自适应时间延长、酵母菌增多和发酵时间的推移等因素,酵母菌可能出现老化、自溶的情况,从而导致代谢产生的酒精度降低。因此,选择最佳酵母接种量为30%。
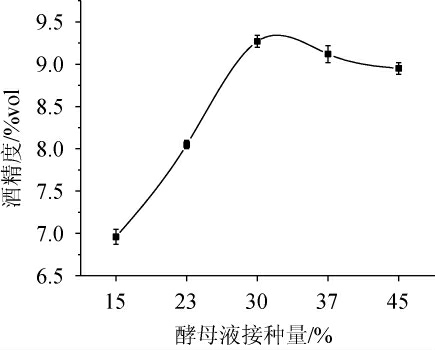
图2 酵母接种量对酒精发酵酒精度的影响
Fig.2 Effect of yeast inoculum on alcohol content in alcoholic fermentation
2.1.3 接种温度对酒精度的影响
由图3可知,当接种温度为20~25 ℃时,酒精度随之增高;当接种温度为25 ℃时,酒精度达到最高,为9.31%vol;当接种温度>25 ℃之后,酒精度逐渐下降。其主要原因可能是,接种温度较低时,酿酒酵母的繁殖和代谢会受到一定程度的抑制,适应时间延长;当接种温度偏高,酵母发酵的启动会加快,但菌种会出现过早失活的情况,从而导致酒精度降低。因此,选择最佳接种温度为25 ℃。
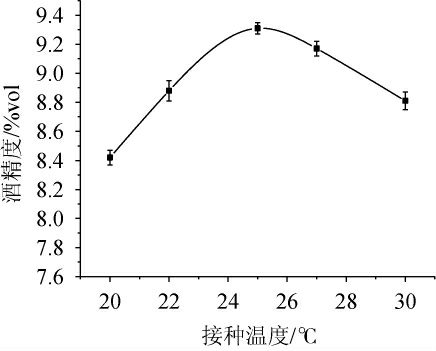
图3 接种温度对酒精发酵酒精度的影响
Fig.3 Effect of inoculum temperature on alcohol content in alcoholic fermentation
2.1.4 发酵温度对酒精度的影响
由图4可知,当发酵温度在23~28 ℃时,发酵酒精度随之升高;当发酵温度为28 ℃时,酒精度达到最高,为9.35%vol;当发酵温度>28 ℃之后,酒精度逐渐下降。其主要原因可能是,酵母菌繁殖最适宜温度为25~28 ℃,较低的发酵温度影响了酵母的生长;随着发酵温度超过最适温度后,酵母会出现老化、疲劳现象,从而影响其代谢产生乙醇的能力。因此,选择最佳发酵温度为28 ℃。

图4 发酵温度对酒精发酵酒精度的影响
Fig.4 Effect of fermentation temperature on alcohol content in alcoholic fermentation
2.1.5 发酵时间对酒精度的影响
由图5可知,当发酵时间在3~7 d时,酒精度随之增加;当发酵时间到达7 d时,酒精度最高,为9.42%vol;当发酵时间>7 d之后,发酵酒精度有所下降。其主要原因可能为,由于酵母在发酵前期营养物质充足,其生长繁殖速率快,乙醇产生的速度也逐渐提高。随着发酵时间的延长,菌体出现老化、自溶等现象,代谢所需营养物质减少,乙醇挥发增加等情况造成发酵酒精度降低。因此,选择最佳发酵时间为7 d。
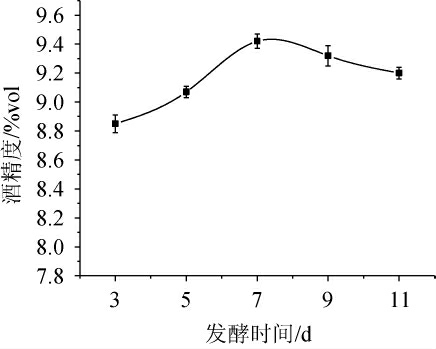
图5 发酵时间对酒精发酵酒精度的影响
Fig.5 Effect of fermentation time on alcohol content in alcoholic fermentation
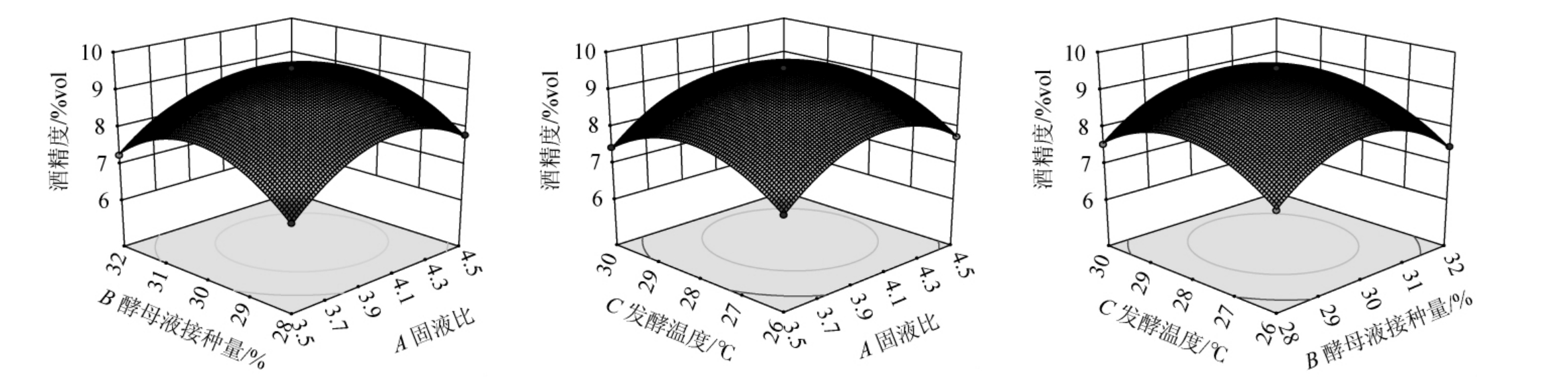
图6 各项因素交互作用对酒精度影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of the interaction between various factors on alcohol content
2.2 荞麦醋酒精发酵工艺优化响应面试验
2.2.1 响应面试验设计结果及分析
在单因素试验的基础上,以酒精度(Y)为响应值,设置发酵时间为7 d,接种温度25 ℃,考察固液比(A)、酵母接种量(B)、发酵温度(C)对酒精度的影响。采用Design-Expert10.0.7软件Box-Behnken试验设计进行3因素3水平的响应面试验设计,每组试验重复3次。Box-Behnken试验结果见表2。
表2 酒精发酵工艺优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for technology optimization of alcoholic fermentation
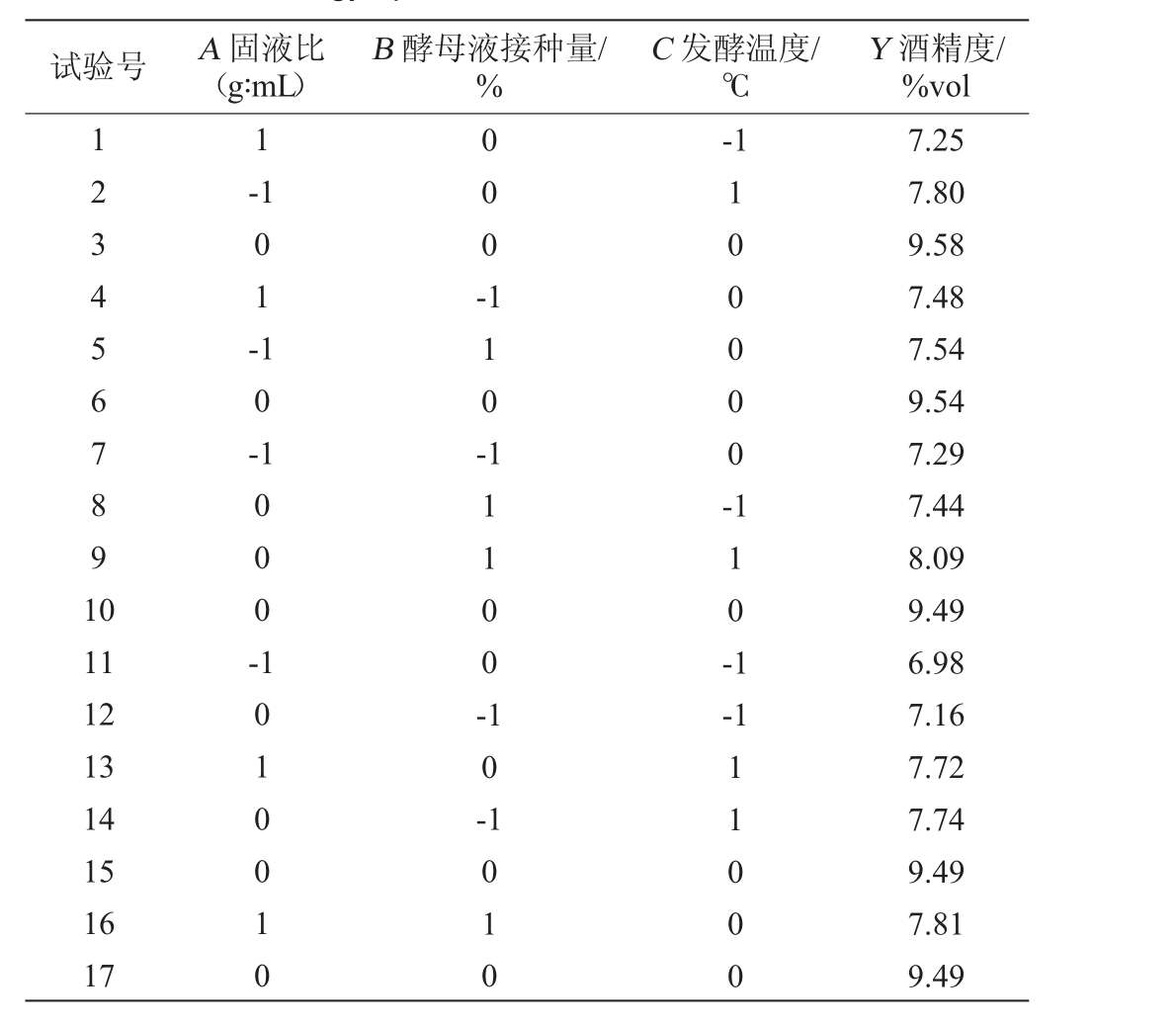
试验号 A 固液比(g∶mL)B 酵母液接种量/%C 发酵温度/℃Y 酒精度/%vol 1234567891 0 1-1-1 01-000-10-110-100000-11 12 13 14 15 16 17 1000-1010010 11100-110-1 10--1 1010 11000 7.25 7.80 9.58 7.48 7.54 9.54 7.29 7.44 8.09 9.49 6.98 7.16 7.72 7.74 9.49 7.81 9.49
2.2.2 响应面试验方差分析
应用Design-Expert 10.0.7软件Box-Behnken试验设计,对表2中的数据进行回归分析,得到酒精度(Y)与固液比(A)、酵母液接种量(B)、发酵温度(C)3因素的二次多项回归方程为:Y=9.52+0.32A+0.081B+0.15C-0.088AB+0.017AC-0.020BC-1A2-1.08B2-0.91C2。
为了验证对荞麦醋乙醇发酵工艺的参数回归模型方程的可靠性,对其表2结果进行方差分析,结果见表3。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
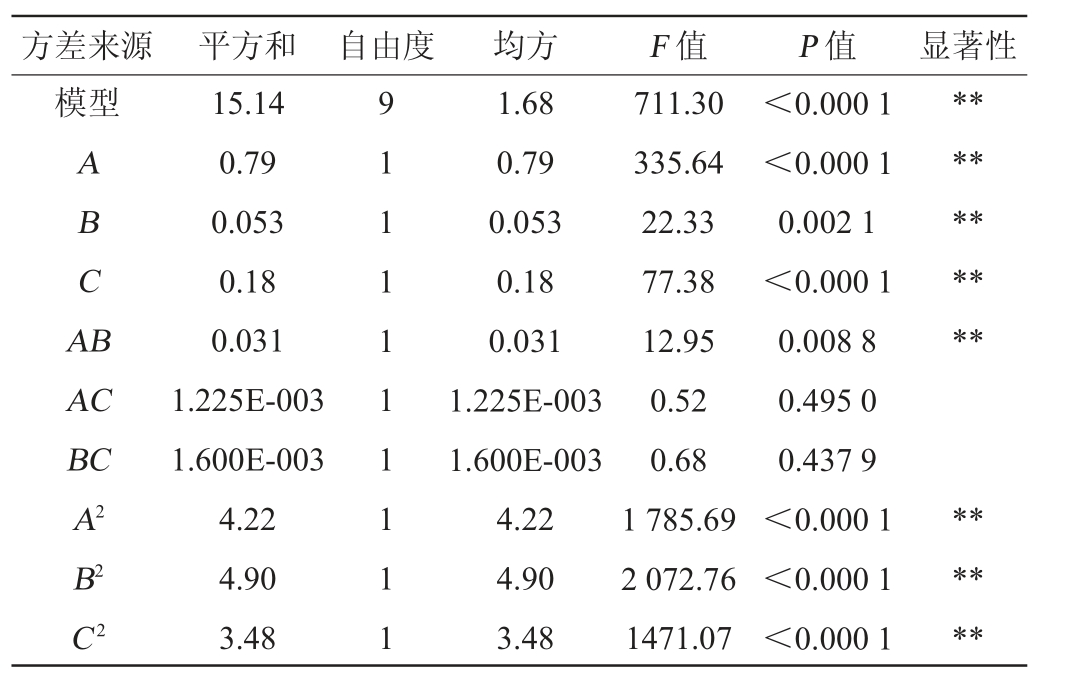
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B**********AC BC A2 B2 C2 15.14 0.79 0.053 0.18 0.031 1.225E-003 1.600E-003 4.22 4.90 3.48 9 1 1 1 1 1 1 1 1 1 1.68 0.79 0.053 0.18 0.031 1.225E-003 1.600E-003 4.22 4.90 3.48 711.30 335.64 22.33 77.38 12.95 0.52 0.68 1 785.69 2 072.76 1471.07<0.000 1<0.000 1 0.002 1<0.000 1 0.008 8 0.495 0 0.437 9<0.000 1<0.000 1<0.000 1******
续表
注:“**”表示对结果影响极显著(P<0.01)。
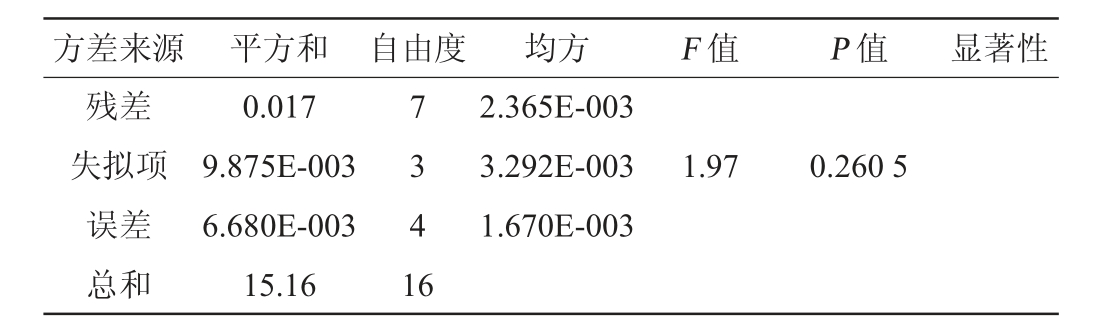
方差来源 平方和 自由度 均方 F 值 P 值 显著性残差失拟项误差总和0.017 9.875E-003 6.680E-003 15.16 7 3 4 1 6 2.365E-003 3.292E-003 1.670E-003 1.97 0.260 5
由表3可知,模型P值<0.000 1,证明该试验采用的二次模型极显著(P<0.01);失拟项不显著(P值=0.260 5>0.05),说明该响应面试验模型高度可靠;信噪比(signal to noise ratio SNR)=68.476>4,说明该响应面试验模型可靠性较高,抗干扰能力较强;模型的变异系数(coefficient of variation,CV)=0.60%,表明模型精密度和准确度均较高;模型决定系数R2=0.998 9,调整决定系数R2Adj=0.997 5,表明该响应面试验模型的拟合度良好,误差较小。由P值可知,一次项A、B、C,交互项AB,二次项A2、B2、C2对Y发酵酒精度影响极显著(P<0.01),其余均为不显著(P>0.05)。由F值可知,各因素对酒精度的影响顺序依次为A(固液比)>C(发酵温度)>B(酵母接种量)。
2.2.3 各因素交互作用影响分析
通过Design-Expert 10.0.7软件对表2的试验数据进行多项二次回归拟合分析,得到各因素交互作用对结果影响的响应面和等高线见图5。响应曲面坡度越陡,等高线越近似于椭圆,说明两者的交互作用越显著。由图5可知,A(固液比)和B(酵母液接种量)的交互作用对发酵酒精度影响显著(P<0.05),A(固液比)和C(发酵温度)的交互作用对发酵酒精度影响不显著(P>0.05),B(酵母液接种量)和C(发酵温度)的交互作用对发酵酒精度影响不显著(P>0.05)。这与方差分析结果一致。
2.3 荞麦食醋酒精发酵工艺优化验证试验
通过Design-Expert 10.0.7软件对模型进行最优值进行分析,得到养麦醋酒精发酵工艺的最佳条件为:固液比为1∶4.07(g∶mL)、酵母接种量30.06%、发酵温度为28.17 ℃,此条件下酒精度理论值为9.55%vol。考虑到实际操作情况,将荞麦醋酒精发酵工艺条件修正为固液比为1∶4(g∶mL)、酵母接种量30%、发酵温度为28 ℃。在此最佳条件下进行3次验证试验,得到酒精度实际平均值为9.53%vol,与响应面模型理论值偏差很小。因此,通过响应面试验模型优化养麦醋乙醇发酵工艺的各因素结果准确可靠,对实际生产有较强的预测指导作用。
3 结论
本研究通过单因素试验结合响应面试验模型建立的方法,优化得到了养麦醋酒精发酵工艺条件为:固液比1∶4(g∶mL)、酵母液接种量30%、酵母液接种温度25 ℃,发酵温度28 ℃,发酵时间7 d。在此优化条件下,酒精度为9.53%vol,比优化前(8.51%vol)提高了11.9%。本研究为食醋生产行业、杂粮食醋生产、荞麦发酵食醋加工企业生产提供了技术指导和预测作用,具有一定的实际应用价值。
[1]沈美荣,李云龙,俞月丽,等.超声辅助双水相体系提取苦荞籽黄酮[J].食品工业科技,2016,37(15):243-248.
[2]杜津昊,季彬,彭轶楠,等.小杂粮食醋营养功能及工艺研究进展[J].食品工业,2023,44(3):247-251.
[3]谢锦明.苦荞醋醋酸发酵工艺及生物活性初探[D].武汉:湖北工业大学,2021.
[4]邱卓.荞麦醋功能性研究[D].杨凌:西北农林科技大学,2014.
[5]SUZUKI T,MORISHITA T,TAKIGAWA S, et al.Effect of sodium bicarbonate on rutin residual ratio in tartary buckwheat (Fagopyrum tataricum Gaertn.)dough[J].Food Sci Technol Res,2020,26(5):597-603.
[6]YIN X Q,LIU S Q,ZHANG X X,et al.Hypoglycemic effects and mechanisms of buckwheat-oat-pea composite flour in diabetic rats[J].Foods,2022,11(23):3938.
[7]郑妍,秦梦洋,岳松烨,等.苦荞麦芦丁提取工艺及抗氧化评价[J].食品安全导刊,2023(24):148-150.
[8]LIANAJ E, AHANCHI N S, DIZDARI H, et al.Buckwheat and cardiometabolic health:A systematic review and meta-analysis[J].J Personalized Med,2022,12(12):1940.
[9]MOLSKA M, REGULA J, GRYGIER A, et al.Effect of the addition of buckwheat sprouts modified with the addition of Saccharomyces cerevisiae var.boulardii to an atherogenic diet on the metabolism of sterols,stanols and fatty acids in rats[J].Molecules,2022,27(14):4394.
[10]王宗敏,白桦,王辛禹,等.食醋中功能物质及其研究进展[J].食品科学,2023,44(11):196-204.
[11]吴子航,张祥龙,刘丹彤,等.中国传统食醋营养健康物质组成研究进展[J].中国酿造,2022,41(12):9-14.
[12]魏世东,王素英,娄婷婷,等.食醋中挥发性风味物质及其检测方法研究进展[J].食品研究与开发,2022,43(24):215-224.
[13]杜大钊,黄静,王瑞,等.四川麸醋及其陈酿过程中挥发性风味物质解析[J].食品与发酵科技,2020,56(5):1-6.
[14]张素云.固稀混合发酵苦荞醋新工艺及其品质研究[D].贵阳:贵州大学,2015.
[15]YU X,YANG M,DONG J L,et al.Comparative analysis of the antioxidant capacities and phenolic compounds of oat and buckwheat vinegars during production processes[J].J Food Sci,2018,83(3):844-853.
[16]杨芙莲,刘旭,武萱.提高荞麦醋黄酮类化合物含量的研究[J].陕西科技大学学报(自然科学版),2013,31(2):93-95.
[17]刘旭.保健型荞麦醋酿造工艺研究[D].西安:陕西科技大学,2013.
[18]杨芙莲,刘旭.荞麦醋发酵过程中芦丁含量变化规律研究[J].中国酿造,2012,31(9):44-46.
[19]卢美欢,马英辉,王银存,等.荞麦醋的抑菌性能及其提取物的抗氧化性研究[J].食品工业科技,2012,33(9):82-84.
[20]李湘,文瑶.响应面法优化荞麦花黄酮提取工艺研究[J].云南化工,2023,50(8):38-41.
[21]熊平文,陈小连,胡利珍,等.金荞麦茎叶粉对赣南藏香猪繁殖性能、免疫和抗氧化功能以及肠道菌群的影响[J].中国畜牧杂志,2023,59(9):269-276.
[22]QIN M M,ZANG J N,MA Y Q,et al.Effects of rice vinegar treatment on the antioxidant activities and protein structures of whole egg liquid before and after gastrointestinal digestion[J].Food Chem, 2023, 404:134574.
[23]刘海坡,阚涛,刘彩霞.食醋酒精发酵阶段非挥发性风味物质及微生物群落结构解析[J].食品与发酵工业,2022,48(19):65-69.
[24]DE LEONARDIS A, MACCIOLA V, IFTIKHAR A, et al.Antioxidant effect of traditional and new vinegars on functional oil/vinegar dressingbased formulations[J].Eur Food Res Technol,2022,248(6):1573-1582.
[25]曹冉.荞麦酿造酒及后处理过程中黄酮类物质变化规律的研究[D].石家庄:河北科技大学,2019.
[26]祁宏山,王治业,彭轶楠,等.响应面法优化荞麦醋醋酸发酵工艺的研究[J].中国酿造,2022,41(6):159-163.
[27]宋勇强,李素岳,胡先望,等.响应面法优化食醋酿造过程中酒精发酵工艺条件[J].中国酿造,2018,37(2):85-90.
[28]曹冉,钟继仁,张晓龙,等.荞麦酿造酒中黄酮类物质含量变化的初步研究[J].中国酿造,2018,37(7):78-82.