植物乳杆菌(Lactobacillus plantarum)为同型发酵乳酸菌[1],是一种益生菌,其代谢产物具有消炎抑菌、降低人体胆固醇、改善免疫性能、抗氧化等活性[2-3]。果蔬经植物乳杆菌发酵,其酵素的抗氧化能力有所增加,这与代谢产生的物质引起总酚和总黄酮等抗氧化活性成分和活性酶增加有关[4-6]。芒果(Mangifera indica L.)果皮或木瓜(Carica papaya L.)果皮等发酵产品提升了原有果皮的生活活性[7],并具有改善肠道菌群活性、降低血糖[8]、抗炎[9]、抗氧化[10]等功效。
金晓帆等[11]研究表明,发酵芒果果皮的总黄酮、总酚和总酸等抗氧化活性成分含量增大,显著提升抗氧化能力。芒果皮汁经酿酒酵母(Saccharomyces cerevisiae)R-HST发酵24 h后,总酚含量增加29.4%,2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethyl-benzothiazoline-6-sulfonic acid),ABTS]自由基清除率增加80%,铜离子络合能力增加13.3%,柠檬酸、琥珀酸含量有所增加。CHEN R H等[12-13]研究表明,发酵木瓜及其副产品(木瓜果皮、木瓜汁和木瓜果渣)是一类极好的抗氧化剂和营养辅助剂。KAUR P等[14]研究表明,三孢布拉霉菌(Blakeslea trispora)MTCC 884发酵木瓜皮,可增强β-胡萝卜素含量和抗氧化活性。
本研究以植物乳杆菌(Lactobacillus plantarum)为发酵菌株,制备青芒果-木瓜混合果皮酵素。在单因素试验基础上,利用响应面法优化其发酵工艺条件,并通过考察1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、ABTS、OH自由基清除率和超氧化物歧化酶(superoxide dismutase,SOD)活力评价其抗氧化性。本研究旨在提高热带水果果渣利用率,减少果皮资源浪费,增加其抗氧化性,为果渣酵素的工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
青芒果、木瓜:海南省海口市南北水果市场;植物乳杆菌(Lactobacillus plantarum):山东中科嘉亿生物工程有限公司。
1.1.2 试剂
抗坏血酸(分析纯):华中药业股份有限公司;无水乙醇、碳酸钠、无水氯化铝、浓盐酸(均为分析纯):国药集团化学试剂有限公司;芦丁标准品(纯度>98%):江西佰草源生物有限公司;亚硝酸钠(分析纯):厦门安永博科技有限公司;没食子酸标准品(纯度>98%):北京索莱宝科技有限公司;福林酚试剂、1,1-二苯基-2-三硝基苯肼(DPPH)、ABTS(均为分析纯):美国Sigma公司;水杨酸(分析纯):泸州化学试剂厂;氢氧化钠、硫酸亚铁(均为分析纯):广州化学试剂厂;过氧化氢、过硫酸钾(均为分析纯):西陇科学股份有限公司;超氧化物歧化酶(SOD)检测试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
TP-214电子天平:赛多利斯科学仪器有限公司;THZ-82A恒温振荡器:金坛市荣华仪器制造有限公司;DHG-9070A电热恒温鼓风干燥箱:上海申贤恒温设备厂;722双光束紫外可见分光光度计:上海箐华科技仪器有限公司;SC-04低速离心机:安徽中科中佳科学仪器有限公司;HH-4数显恒温水浴锅:上海力辰邦西仪器科技有限公司。
1.3 方法
1.3.1 青芒果-木瓜混合果皮酵素的加工工艺流程及操作
要点
青芒果与木瓜→清洗去皮→混合果皮打浆→接种植物乳杆菌→发酵→灭菌→青芒果-木瓜混合果皮酵素成品
操作要点:
原料预处理:挑选果实饱满、无真菌侵染、无虫害、150 g左右大小的青芒果和木瓜,洗净后留皮备用。
打浆:青芒果皮与木瓜果皮以质量比4∶1混合,按料液比1∶2(g∶mL)加去离子水打浆。
接种与发酵:称取果皮质量5%的植物乳杆菌,放入发酵瓶中混合,36 ℃恒温培养箱培养60 h,终止发酵。
灭菌装瓶:78 ℃巴氏杀菌40 min,得到青芒果-木瓜混合果皮酵素成品。冷却后于-80 ℃冰箱保存。
1.3.2 分析检测
(1)总黄酮含量的测定
以三氯化铝显色法测定酵素总黄酮含量[15]。按照芦丁标准曲线回归方程y=0.018x-0.086(相关系数R2=0.989 0)计算酵素样品中总黄酮含量。
(2)总酚含量
参照CISNEROS-YUPANQUI M 等[16]福林酚试剂比色法,根据没食子酸标准曲线回归方程y=0.06x+0.015(相关系数R2=0.992 4)计算酵素样品中总酚含量。
(3)酵素pH值
利用pH计测定酵素pH值。
(4)维生素C含量的测定
参考马宏飞等[17]的方法测定维生素C的含量。以维生素C浓度(x)为横坐标,以波长243 nm处的吸光度值(y)为纵坐标绘制标准曲线,得到维生素C的标准曲线回归方程为y=0.059 6x-0.042 9(相关系数R2=0.995 7),计算酵素的维生素C的含量。
1.3.3 抗氧化能力的测定
DPPH自由基清除能力的测定:参考董墨思等[18]的方法;ABTS自由基清除能力的测定:参考蔡翔等[19]的方法;羟基自由基清除能力的测定:参照MIAO Q等[20]的方法;SOD活力的测定:按照SOD测定试剂盒说明书方法。
1.3.4 青芒果-木瓜混合果皮酵素发酵工艺优化
单因素试验:分别考察发酵温度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃、38 ℃、40 ℃)、发酵时间(20 h、30 h、40 h、50 h、60 h、70 h、80 h)、菌种添加量(2%、3%、4%、5%、6%、7%)、青芒果皮占比(0、20%、40%、60%、80%、100%)对青芒果-木瓜混合果皮酵素总酚含量、pH值和SOD活力的影响。
响应面试验设计:根据单因素试验的结果,选择发酵时间(A)、发酵温度(B)、菌种添加量(C)、青芒果皮占比(D)作为自变量,SOD活力(Y)作为响应值,利用Design-Expert 12.0软件,设计4因素3水平的Box-Behnken响应面试验,确定最佳青芒果-木瓜混合果皮酵素发酵工艺。
表1 发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for fermentation process optimization
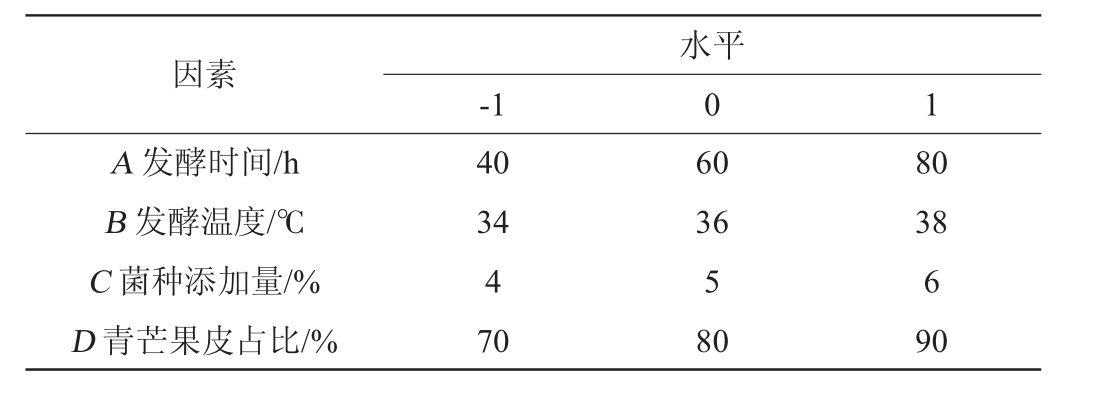
因素A 发酵时间/h B 发酵温度/℃C 菌种添加量/%D 青芒果皮占比/%-1水平0 1 40 34 4 70 60 36 5 80 80 38 6 90
1.3.5 数据处理与统计分析
所有试验均重复进行3次,数据以“平均值±标准差”表示。使用Origin 2018进行绘图;使用SPSS 25.0和Design-Expert 12.0软件,进行数据处理及方差分析。
2 结果与分析
2.1 发酵工艺优化单因素试验
2.1.1 发酵温度对酵素pH值、总酚含量和SOD活力的影响
由图1可知,在不同温度下,酵素总酚含量和SOD活力受发酵温度影响差异显著(P<0.05)。当发酵温度为28~36 ℃时,总酚含量和SOD活力随发酵温度升高而增加,pH值呈先升高后下降趋势;当发酵温度为36 ℃时,总酚含量和SOD活力最高,分别为3.98 mg/mL、3 493.97 U/mL;发酵温度>36 ℃之后,总酚含量和SOD活力随之下降,pH值有所升高。这是由于低发酵温度影响植物乳杆菌生长和代谢导致发酵进程延长;发酵温度太高,植物乳杆菌生长和代谢过于旺盛,菌体老化,且高温不利于产物的积累,导致抗氧化性降低[21];因此,选择最佳发酵温度为36 ℃。

图1 发酵温度对青芒果-木瓜混合果皮酵素pH值、超氧化物歧化酶活力(a)和总酚含量(b)的影响
Fig.1 Effects of fermentation temperature on pH, superoxide dismutase activity (a) and total phenols (b) of Jiaosu with mixed peels of green mango and papaya
2.1.2 发酵时间对酵素pH值、总酚含量和SOD活力的影响
由图2可知,当发酵时间在20~60 h范围内的延长,酵素的总酚含量和SOD活力随之上升;当发酵时间为60 h时,总酚含量、SOD活力最高,分别为4.02mg/mL、3691.32U/mL;当发酵时间>60 h之后,总酚含量、SOD活力有所下降。当发酵时间为20~60 h时,pH值随之下降;当发酵时间>60 h,pH值随之升高。植物乳杆菌与酶对果皮中营养成分的消耗使酵素产生了大量的有机酸的堆积,有机酸与酚类物质发生反应生成酚酸类化合物,总酚含量增加,抗氧化活性增强[22-23]。因此,选择最佳发酵时间为60 h。
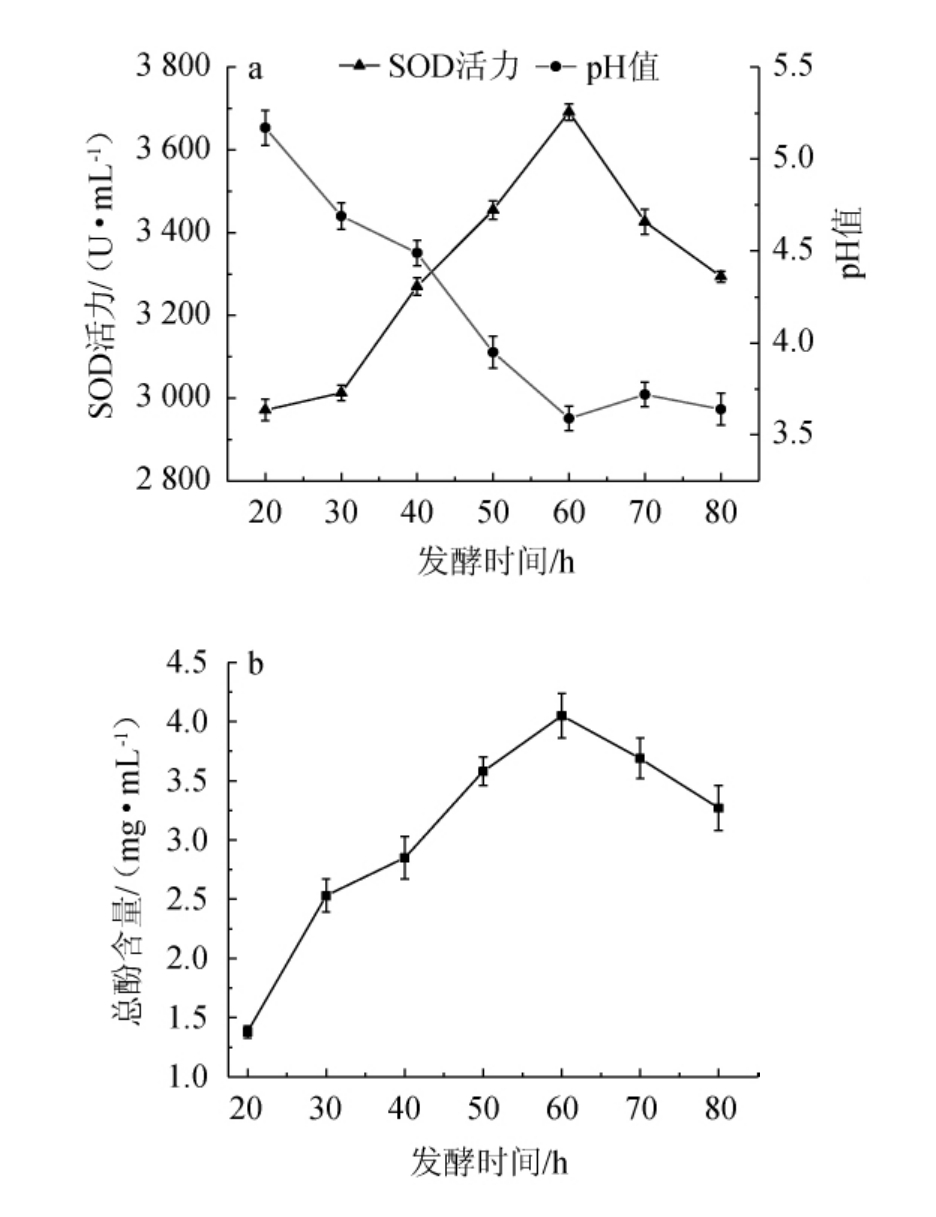
图2 发酵时间对青芒果-木瓜混合果皮酵素pH值、超氧化物歧化酶活力(a)和总酚含量(b)的影响
Fig.2 Effects of fermentation time on pH, superoxide dismutase activity (a) and total phenols (b) of Jiaosu with mixed peels of green mango and papaya
2.1.3 菌种添加量对酵素pH值、总酚含量和SOD活力的影响
由图3可知,当菌种添加量在2%~5%时,酵素的总酚含量和SOD活力随之上升,pH值随之下降;当菌种添加量为5%时,总酚含量、SOD活力最高,分别为4.06 mg/mL 3 352.95 U/mL,pH值最低,为4.39;当菌种添加量>5%之后,总酚含量、SOD活力有所下降,pH值有所上升。接种量较低,植物乳杆菌的生长速度相对较慢,发酵周期相对较长,最终导致总酚含量和SOD活力较低;植物乳杆菌接种量太高,菌体增殖消耗酵素中大部分营养成分,导致总酚含量和SOD活力降低,影响发酵效果[23]。因此,选择最佳菌种添加量为5%。
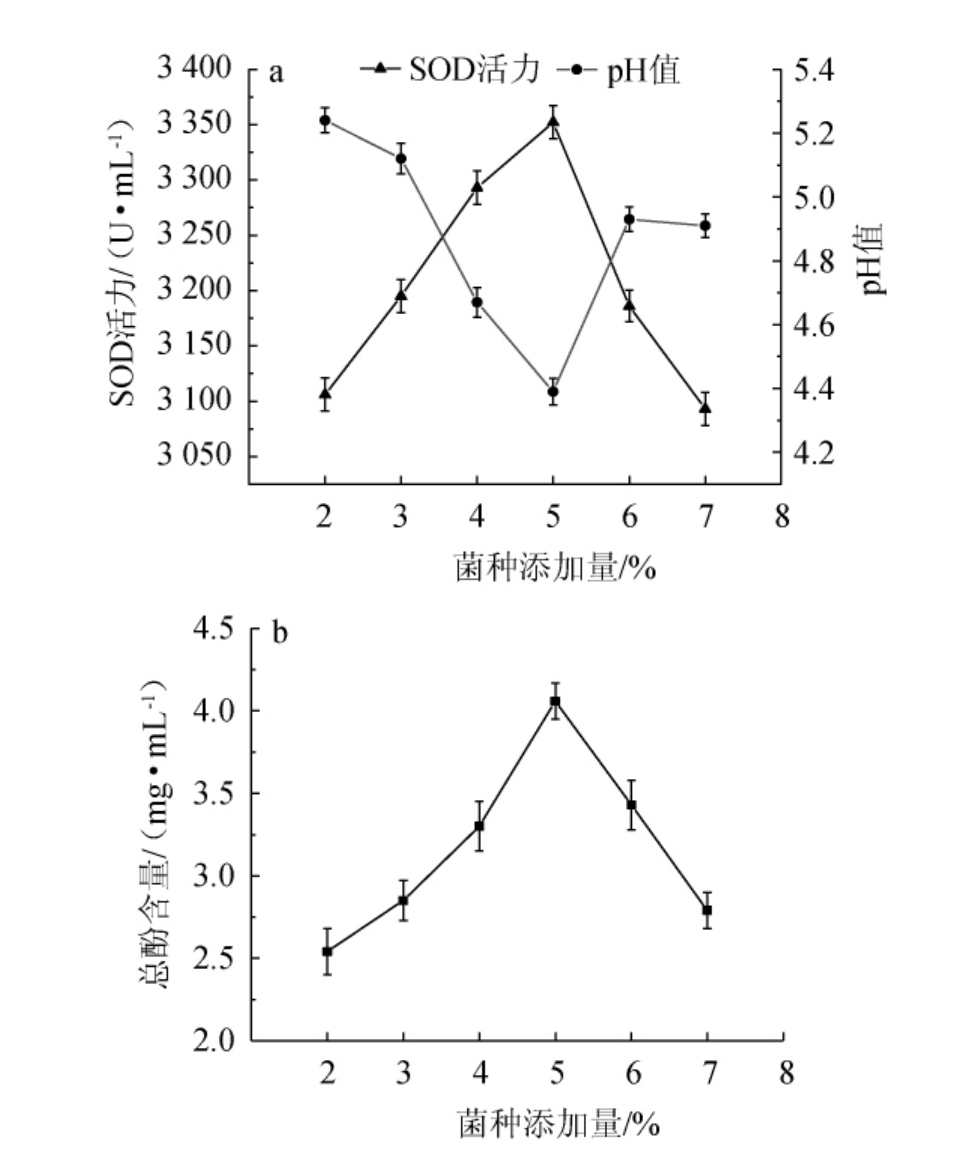
图3 菌种添加量对青芒果-木瓜混合果皮酵素pH值、超氧化物歧化酶活力(a)和总酚含量(b)的影响
Fig.3 Effect of strain addition on pH, superoxide dismutase activity (a) and total phenols (b) of Jiaosu with mixed peels of green mango and papaya
2.1.4 青芒果皮对酵素pH值、总酚含量和SOD活力的影响
由图4可知,当青芒果皮占比为0~80%时,总酚含量、SOD活力随之上升,pH值随之下降;当青芒果皮占比为80%时,酵素的总酚含量、SOD活力最高,分别为4.12 mg/mL、3 693.88 U/mL,pH值最低,为4.05;当青芒果皮占比>80%之后,总酚含量、SOD活力有所下降,pH值有所上升。柳伟等[25]研究表明,芒果皮的抗氧化性强于木瓜果皮,这与本研究结果一致。因此,选择最佳青芒果皮占比为80%。
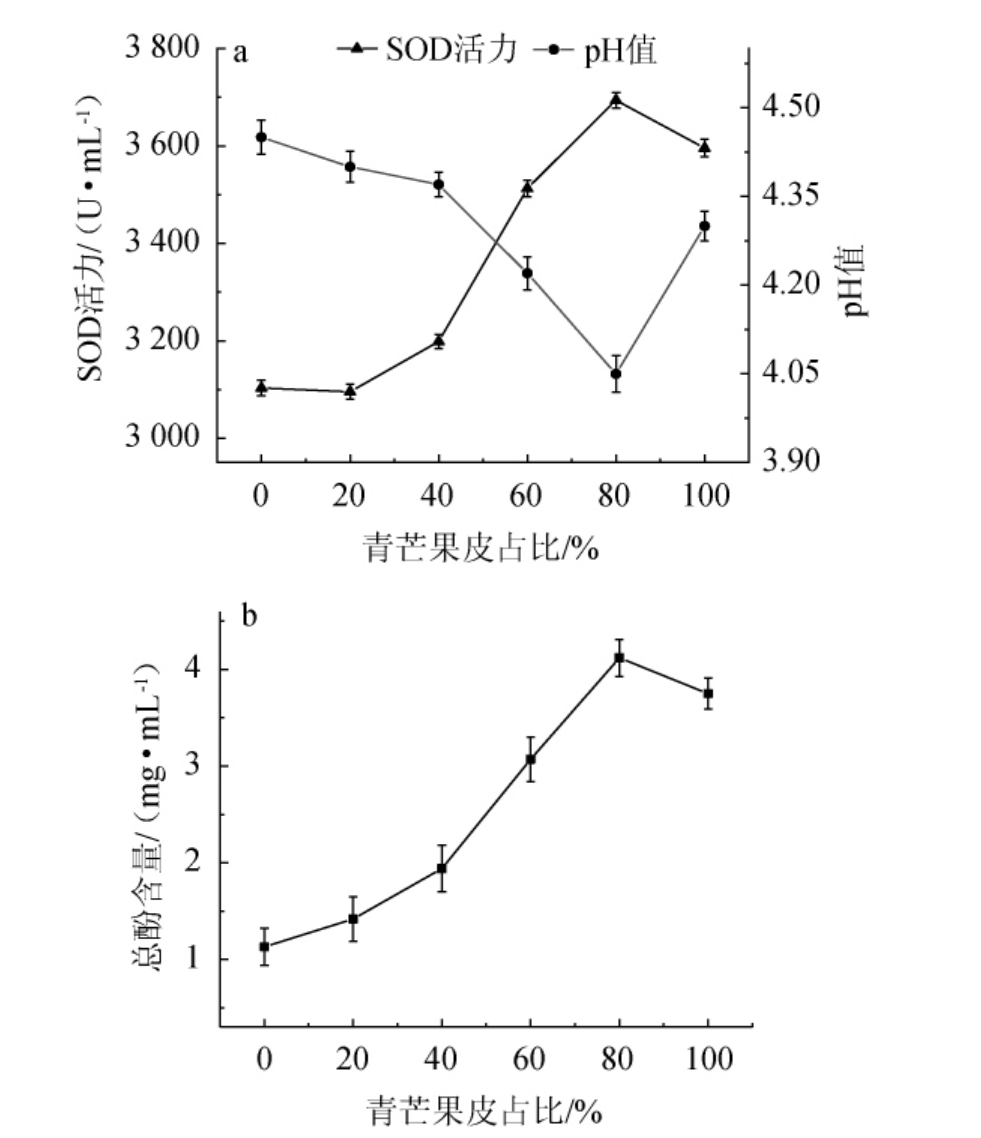
图4 青芒果皮占比对青芒果-木瓜混合果皮酵素pH值、超氧化物歧化酶活力(a)和总酚含量(b)的影响
Fig.4 Effects of the ratio of green mango pericarp on pH, superoxide dismutase activity (a) and total phenols contents (b) of Jiaosu with mixed peels of green mango and papaya
2.2 发酵工艺优化响应面试验
2.2.1 响应面试验设计结果与方差分析
根据单因素试验结果,以发酵时间(A)、发酵温度(B)、菌种添加量(C)、青芒果皮占比(D)作为自变量,SOD活力(Y)作为响应值,利用Design-Expert 12.0软件,设计4因素3水平Box-Behnken试验。Box-Behnken试验设计及结果见表2,回归模型方差分析见表3。
表2 发酵工艺优化Box-Benkhen试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation process optimization
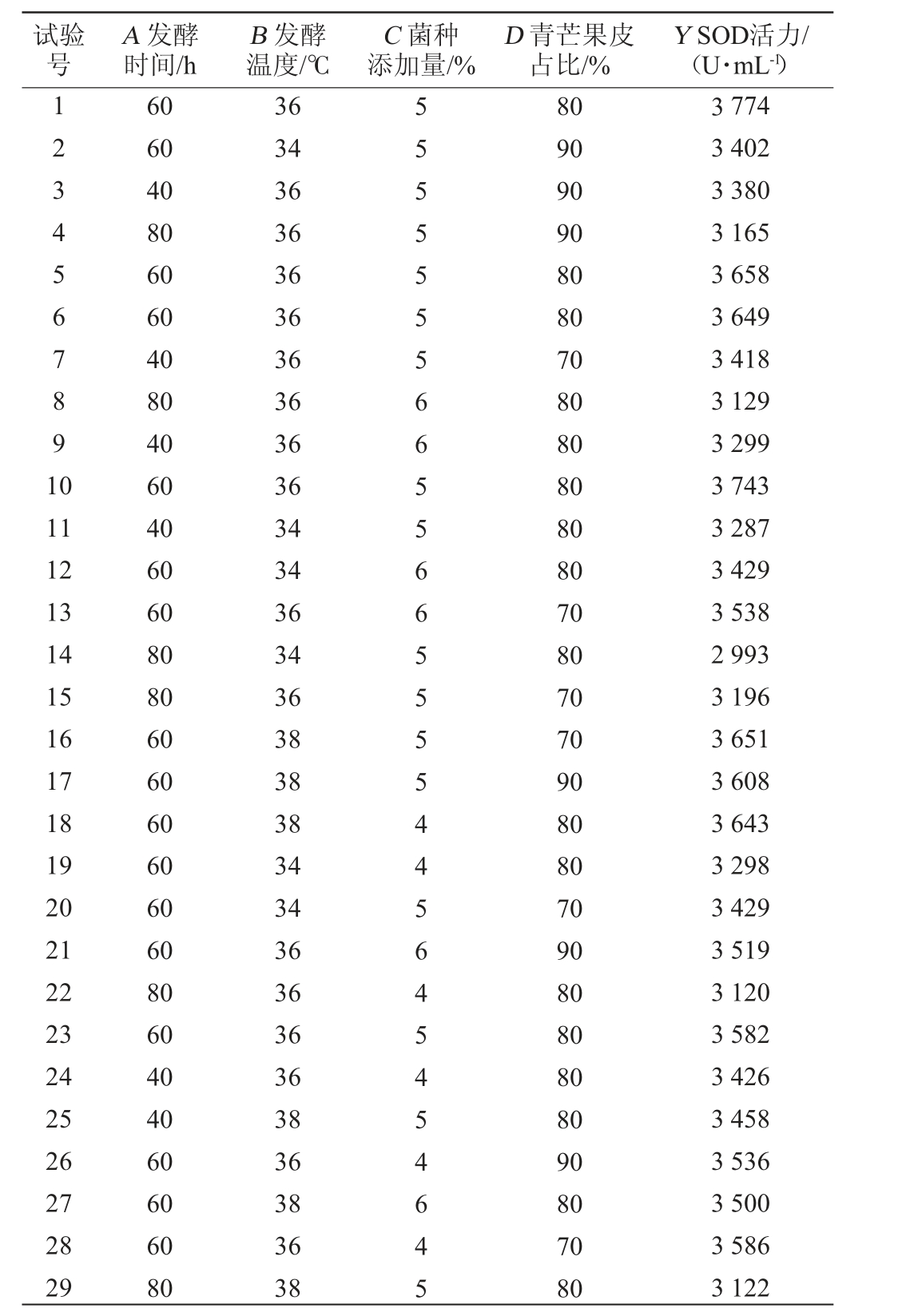
试验号A 发酵时间/h B 发酵温度/℃C 菌种添加量/%D 青芒果皮占比/%Y SOD活力/(U·mL-1)1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 60 60 40 80 60 60 40 80 40 60 40 60 60 80 80 60 60 60 60 60 60 80 60 40 40 60 60 60 80 36 34 36 36 36 36 36 36 36 36 34 34 36 34 36 38 38 38 34 34 36 36 36 36 38 36 38 36 38 55555556655665555445645454645 80 90 90 90 80 80 70 80 80 80 80 80 70 80 70 70 90 80 80 70 90 80 80 80 80 90 80 70 80 3 774 3 402 3 380 3 165 3 658 3 649 3 418 3 129 3 299 3 743 3 287 3 429 3 538 2 993 3 196 3 651 3 608 3 643 3 298 3 429 3 519 3 120 3 582 3 426 3 458 3 536 3 500 3 586 3 122
表3 回归模型方差分析
Table 3 Variance analysis of regression model
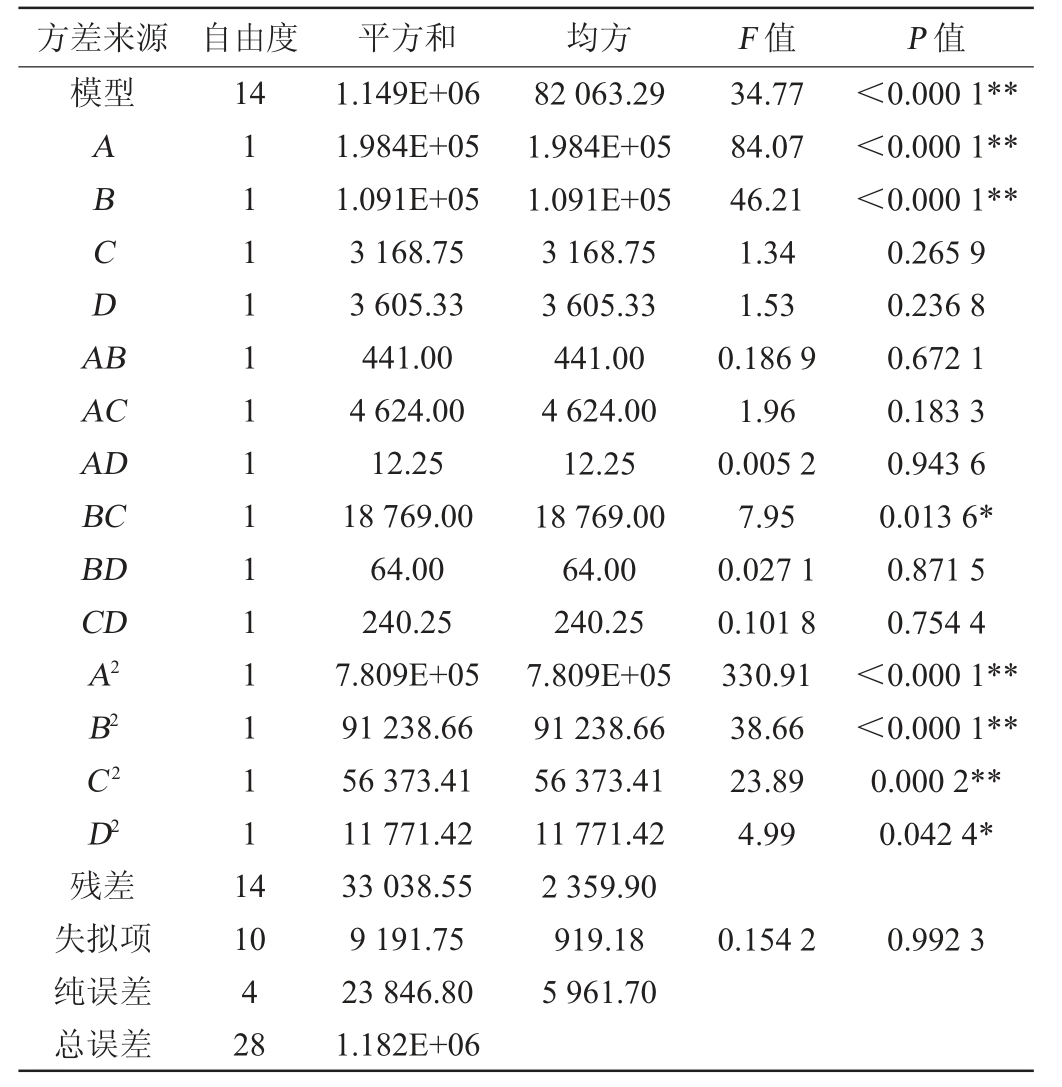
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
方差来源 自由度 平方和 均方 F 值 P 值模型14 ABCDA B AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总误差111111111111111 4 34.77 84.07 46.21 1.34 1.53 0.186 9 1.96 0.005 2 7.95 0.027 1 0.101 8 330.91 38.66 23.89 4.99<0.000 1**<0.000 1**<0.000 1**0.265 9 0.236 8 0.672 1 0.183 3 0.943 6 0.013 6*0.871 5 0.754 4<0.000 1**<0.000 1**0.000 2**0.042 4*10 4 28 1.149E+06 1.984E+05 1.091E+05 3 168.75 3 605.33 441.00 4 624.00 12.25 18 769.00 64.00 240.25 7.809E+05 91 238.66 56 373.41 11 771.42 33 038.55 9 191.75 23 846.80 1.182E+06 82 063.29 1.984E+05 1.091E+05 3 168.75 3 605.33 441.00 4 624.00 12.25 18 769.00 64.00 240.25 7.809E+05 91 238.66 56 373.41 11 771.42 2 359.90 919.18 5 961.70 0.154 2 0.992 3
通过Design-Expert 12.0软件对表3中的数据进行线性拟合得到SOD活力的二次多项式回归方程:

由表3可知,模型的F值=34.77,并且P值<0.000 01,表示所得回归模型极显著。失拟项P值>0.05,不显著,说明回归模型拟合度良好,决定系数R2=0.972 0,调整决定系数R2adj=0.944 1,表明试验值和预测值之间的相关程度较高;此外SOD活力模型的变异系数(coefficient of variation,CV)为1.42%,表明实验值的精确性和可靠性。由P值可知,一次项A、B,二次项A2、B2、C2对结果影响极显著(P<0.01);二次项D2,交互项BC对结果影响显著(P<0.05)。由F值可知,各因素对结果影响顺序为A>B>D>C,即发酵时间>发酵温度>青芒果皮占比>菌种添加量。
2.2.2 各因素间交互作用响应曲面分析
响应面三维立体图由响应面因素与响应值构成,曲面弯曲程度反映了两个响应面因素之间的交互作用强弱,弯曲程度越大,说明该指标的变化对响应值影响越大;弯曲程度越小,说明该指标的变化对响应值影响越小[26-27]。
通过Design-Expert 12.0软件得到4个因素间交互作用对SOD活力影响的响应面曲面及等高线见图5。由图5可知,菌种添加量与青芒果皮占比、发酵温度与发酵时间、发酵时间与菌种添加量、发酵时间与青芒果皮占比、发酵温度与青芒果皮占比形成的响应面图曲面弯曲坡度较小,等高线呈圆形,说明二者交互作用对SOD活力的影响不显著(P>0.05);发酵温度与菌种添加量交互作用形成的响应面图曲面弯曲坡度较大,等高线呈椭圆形,表明对SOD活力影响显著(P<0.05)。这与表3方差分析结果一致。
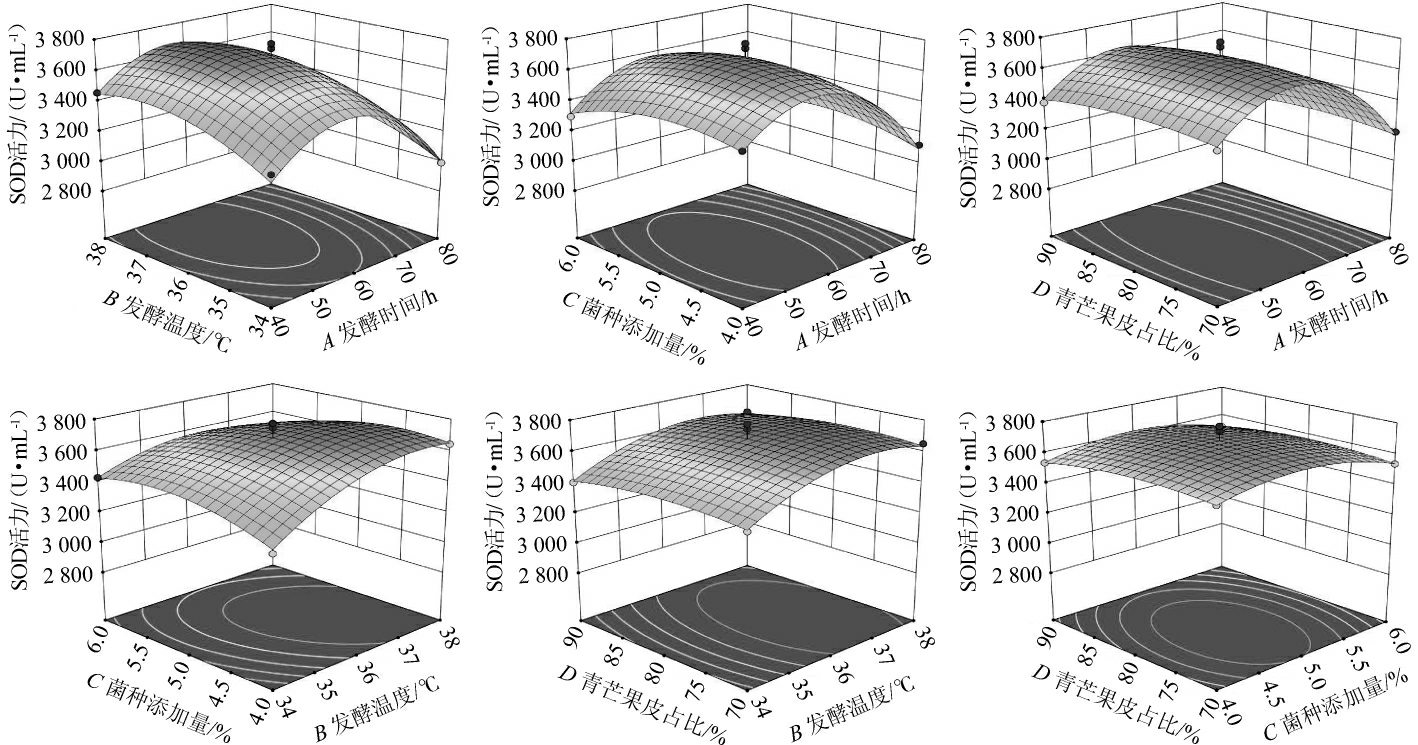
图5 各因素间交互作用对发酵青芒果-木瓜混合果皮酵素的超氧化物歧化酶活力影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on superoxide dismutase activity of Jiaosu with mixed peels of green mango and papaya
2.2.3 最佳发酵工艺条件的确定与验证试验
采用Design-Expert 12.0软件得出最佳发酵工艺条件为:发酵温度36.78 ℃、发酵时间56.89 h、菌种添加量为4.65%、青芒果皮占比78.15%。在此条件下,SOD活力预测值为3 723.81。为方便实际操作,将最佳发酵工艺条件修正为:发酵温度36 ℃、发酵时间60 h、菌种添加量5%、青芒果皮占比80%。在此最佳发酵工艺条件下进行3次平行试验,得到青芒果-木瓜混合果皮酵素SOD活力平均实际值为3 699.87 U/mL,与预测值相近。青芒果-木瓜混合果皮酵素总酚含量为4.09 mg/mL、总黄酮含量为5.10 mg/mL、维生素C含量为2.40 mg/mL,ABTS、DPPH、羟基自由基清除率分别为92.42%、45.49%、69.85%。
3 结论
采用单因素及响应面试验优化青芒果-木瓜混合果皮酵素发酵工艺,结果表明,最佳发酵工艺条件为:发酵温度36 ℃、发酵时间60 h、菌种添加量5%、青芒果皮占比80%。在此优化条件下,酵素ABTS、DPPH、羟基自由基清除率分别为92.42%、45.49%、69.85%,SOD活力为3 699.87 U/mL、总酚含量为4.09 mg/mL、总黄酮含量为5.10 mg/mL、维生素C含量为2.40 mg/mL。结果表明,青芒果-木瓜混合果皮酵素具有良好的抗氧化活性,利用果皮渣制备酵素具有良好的开发前景。
[1]孟宪福,卢保丽,覃朝望.植物乳杆菌功能及其应用进展[J].轻工科技,2023,39(3):52-54.
[2]SEDDIK H A,BENDALI F, GANCEL F, et al. Lactobacillus plantarum and its probiotic and food potentialities[J].Probiotics Antimicro,2017,9(2):111-122.
[3]王紫琳,方冉,赵存朝,等.雪莲果植物乳杆菌发酵饮料的研制[J].中国酿造,2022,41(12):216-222.
[4]GAUR G, GÄNZLE M G.Conversion of (poly) phenolic compounds in food fermentations by lactic acid bacteria: Novel insights into metabolic pathways and functional metabolites[J].Curr Res Food Sci,2023,6:100448.
[5]SHI F F,WANG L,LI S R.Enhancement in the physicochemical properties,antioxidant activity,volatile compounds,and non-volatile compounds of watermelon juices through Lactobacillus plantarum JHT78 fermentation[J].Food Chem,2023,420:136146.
[6]付依依,王永霞,张笑莹,等.植物乳杆菌发酵对沙棘原浆主要成分、抗氧化性及挥发性物质的影响[J].中国酿造,2022,41(2):125-131.
[7]LIU Q T,HUA Z Y,CHEN M,et al.Changes in polyphenols and antioxidant properties of pomegranate peels fermented by urolithin a-producing Streptococcus thermophilus FUA329[J].ACS Food Sci Technol,2023,3(8):1383-1392.
[8]ZHOU H C,WANG S X,LIU W C,et al.Probiotic properties of Lactobacillus paraplantarum LS-5 and its effect on antioxidant activity of fermented sauerkraut[J].Food Biosci,2023,52:102489.
[9]梁婉诗,刘欣桐,麦婉,等.组学技术在植物乳杆菌及其发酵食品中的研究进展[J].现代食品科技,2023,39(5):376-385.
[10]MAYER W,WEIBEL M,DE LUCA C,et al.Biomolecules of fermented tropical fruits and fermenting microbes as regulators of human hair loss,hair quality,and scalp microbiota[J].Biomolecules,2023,13(4):699.
[11]金晓帆,唐明峰,陈卫军,等.酿酒酵母发酵芒果皮汁成分和抗氧化能力变化[J].食品科技,2018,43(9):121-128.
[12]CHEN R H,CHEN W X,CHEN H M,et al.Comparative evaluation of the antioxidant capacities, organic acids, and volatiles of papaya juices fermented by Lactobacillus acidophilus and Lactobacillus plantarum[J].J Food Quality,2018(4):1-12.
[13]LEITÃO M,RIBEIRO T,GARCÍA P A,et al.Benefits of fermented papaya in human health[J].Foods,2022,11(4):563.
[14]KAUR P,GHOSHAL G,JAIN A.Bio-utilization of fruits and vegetables waste to produce β-carotene in solid-state fermentation:characterization and antioxidant activity[J].Process Biochem,2019,76:155-164.
[15]ZAN L X,SONG W T,WANG W W,et al.Purification,antioxidant activities, encapsulation, and release profile of total flavonoids in Peony seed meal[J].Food Sci Nutr,2022,10(4):1051-1057.
[16]CISNEROS-YUPANQUI M,RIZZI C,MIHAYLOVA D,et al.Effect of the distillation process on polyphenols content of grape pomace[J].Eur Food Res Technol,2022,248:929-935.
[17]马宏飞,卢生有,韩秋菊,等.紫外分光光度法测定五种果蔬中维生素C的含量[J].化学与生物工程,2012,29(8):92-94.
[18]董墨思,张雨婷,杨宇峰,等.混合植物果蔬酵素的抗氧化活性及降血糖活性研究[J].中国酿造,2023,42(7):132-136.
[19]蔡翔,胡桂萍,曹红妹,等.桑葚酸奶发酵贮藏过程中活性成分和抗氧化活性变化特征[J].中国乳品工业,2023,51(3):41-45.
[20]MIAO Q,LI Q,TAN W Q,et al.Preparation,anticoagulant and antioxidant properties of glucosamine-heparin salt[J].Marine Drugs,2022,20(10):646.
[21]孟芳,兰亚杰,冀权,等.响应面法优化枸杞果醋醋酸发酵工艺[J].中国酿造,2023,42(6):218-224.
[22]SONMEZ F,SAHIN Z.Comparative study of total phenolic content,antioxidant activities,and polyphenol oxidase enzyme inhibition of quince leaf,peel,and seed extracts[J].Erwerbs-Obstbau,2023,65:745-750.
[23]陈荣豪,陈文学,陈海明,等.乳酸菌发酵过程中番木瓜饮料的主要成分分析与抗氧化活性变化[J].食品科学,2018,39(6):222-229.
[24]WEI M, WANG S Y, GU P, et al.Comparison of physicochemical indexes,amino acids,phenolic compounds and volatile compounds in bog bilberry juice fermented by Lactobacillus plantarum under different pH conditions[J].J Food Sci Technol,2018,55(6):2240-2250.
[25]柳伟,肖雪,葛珊珊,等.12种果皮多酚含量及其抗氧化活性研究[J].食品研究与开发,2016,37(14):25-29.
[26]张珍林,吴进东,李艳.响应面法在食品工业领域的应用[J].中国食品,2023(12):92-94.
[27]ZIADI M,BOUZAIENE T,LAKHAL S,et al.Screening of lactic starter from Tunisian fermented vegetables and application for the improvement of caper(Capparis spinosa)fermentation through an experimental factorial design[J].Ann Microbiol,2019,69:1373-1385.