白酒糟(以下简称酒糟)是白酒酿造过程中产生的重要副产物,是一种可再生生物质资源[1]。我国是一个白酒酿造大国,据统计,仅2022年白酒糟的产量约2 013.6万t[2],而处理方式以饲料为主,甚至直接填埋掉,不仅造成资源的严重浪费,而且还造成环境污染[3-4]。酒糟以纤维素、半纤维素、木质素等成分为主[5],不能被动物有效利用,长期食用也会造成动物食欲不振等不良症状[6-7]。因此,降解酒糟中的纤维素,高值化利用酒糟尤为重要。
纤维素降解的主要有三种方式:酸水解、碱水解和酶解[8-9]。酸、碱水解效率高,常被用于大批量生产,但存在设备腐蚀严重、试剂难回收和产生发酵抑制物等缺点[10]。目前,酶解因安全、降解彻底、不腐蚀设备和对环境友好受到了广泛关注[11],但是传统的酶解法存在产物得率低,纤维素可及性低和成本高等不足[12-13]。对此,国外主要通过氧化预处理的方式去除半纤维素和木质素或将它们在细胞壁中重排,增加纤维素可及性进而提高酶解效率[14]。MORONE A等[15]采用湿式氧化处理,部分纤维素和半纤维素被除去,酶解效率提高了63%,且不释放发酵抑制剂。ANDERSEN S等[16]采用臭氧分解预处理纤维素物质,不溶性木质纤维素被降解,纤维素浓度不变,且结构变得更加无序,甚至可以观察到纤维脱离和孔形成。但是湿式氧化预处理具有使用高反应温度和压力的局限,且反应器投资比较高。国内主要侧重于采用化学试剂[17-18]、微波-超声波[19]、蒸汽爆破[20]等方式改善酶解的效率低的问题。WU D等[21]指出,芬顿试剂预处理显著提高了稻草中有机物和粗纤维的降解,从而提高了木质纤维素的降解效率。XIONG Z Y等[22]研究表明,与超声波相比,芬顿试剂预处理在增加比表面积方面更有效,分别为原稻草的1.8和1.2倍。虽然这些方式可以提高酶解效率,但存在产生发酵抑制物、污染极大、设备成本高及酶解工艺尚未优化完善等问题。因此,寻找合适的处理方法且优化酶解工艺对于提高酶解效率极其重要。
本试验以白酒糟为原料,以还原糖得率为评价指标,采用芬顿试剂预处理辅助纤维素酶降解酒糟纤维素,通过单因素、Plackett-Burman试验和响应面法优化酒糟酶解工艺,并采用扫描电镜(scanning electron microscope,SEM)观察酒糟原料、芬顿试剂预处理酒糟、酶解酒糟的显微结构。旨在探索一种有效提高酒糟纤维素酶解的可行方法,为酒糟高值化利用提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
白酒酒糟(水分含量为47.52%):山西堡子酒业有限公司。
1.1.2 化学试剂
纤维素酶(酶活1.0×105 U/g):上海麦克林生化科技有限公司;硫酸亚铁、亚硫酸钠(均为分析纯):天津凯通化学试剂有限公司;过氧化氢(分析纯):天津市博迪化工有限公司;还原铁粉(分析纯):天津市北辰方正试剂厂;草酸(分析纯):天津市风船化学试剂科技有限公司;柠檬酸、柠檬酸钠、四硼酸钠、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、氢氧化钠、葡萄糖、苯酚、亚硫酸钠、酒石酸钾钠(均为分析纯):天津市科密欧化学试剂有限公司。
1.2 仪器与设备
LDO-101-1D电热恒温鼓风干燥箱:上海龙跃仪器设备有限公司;SC-316低速离心机:安徽中科中佳科学仪器有限公司;DE-200 g多功能告诉粉碎机:浙江红景天工贸有限公司;ST3100实验室pH计:奥豪斯仪器(常州)有限公司;SHB-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;BCE124-1CCN电子天平:塞多莉斯科学仪器(北京)有限公司;UV-2600紫外可见分光光度计:上海昂拉仪器有限公司;HH.S21-6电热恒温水浴锅:上海博讯医疗生物仪器股份有限公司;HNY-200B摇床:天津欧诺仪器股份有限公司;JSM-7500F型扫描电镜:日本电子公司。
1.3 实验方法
1.3.1 酒糟预处理
将新鲜酒糟置于65 ℃条件下干燥至恒质量,冷却至室温后,用粉碎机粉碎,过30目筛,装入透明自封袋密封后置于室温贮藏,备用。
1.3.2 芬顿试剂预处理
由亚铁离子(FeSO4)与过氧化氢(H2O2)组成的体系,也称芬顿试剂,它能生成强氧化性的羟基自由基,在水溶液中与难降解有机物生成有机自由基使之结构破坏,最终氧化分解。
准确称取2 g酒糟于锥形瓶中,加入适量芬顿试剂和pH 4.8的0.05 mol/L的柠檬酸-柠檬酸钠缓冲液,固液比为1∶5(g∶mL),用封口膜包裹并用绳子密封于150 r/min、50 ℃的水浴摇床中预处理24 h,预处理结束之后,使用5 mL 5%的草酸洗涤并用清水彻底冲洗干净,在65 ℃条件下干燥至恒质量。
1.3.3 纤维素酶酶解
准确称取2 g芬顿试剂处理后的残渣加入1 000 U/g纤维素酶和20 mL pH 4.8的0.05 mol/L的柠檬酸-柠檬酸钠缓冲液,用封口膜包裹并用绳子密封于150 r/min、50 ℃摇床中酶解24 h。酶解反应结束后,沸水浴灭酶10 min并快速冷却,然后用真空泵抽滤,并收集滤液。
1.3.4 还原糖的测定
葡萄糖标准曲线的绘制:准确称取1.000 g无水葡萄糖溶解于1 000 mL蒸馏水中,配制1 mg/mL标准葡萄糖溶液。取10支25 mL具塞刻度试管,加入标准葡萄糖溶液0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1.0 mL,分别加入蒸馏水补足至2 mL,分别加入DNS试剂1.5 mL,混匀后于沸水浴加热5 min,取出后立即冷却,定容到25mL,混匀后于波长540 nm处测定吸光度值,以标准葡萄糖溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线,得到标准曲线回归方程y=13.643x-0.023 4,相关系数R2=0.999。
还原糖含量的测定采用DNS法。取样液1 mL(必要时做适当稀释),加入1.5 mL DNS溶液摇匀,沸水浴加热5 min,用冰水冷却后,加水25 mL,摇匀,于波长540 nm处测定其吸光度值,根据标准曲线回归方程计算还原糖含量。还原糖得率计算公式如下[23-24]:
式中:x为还原糖含量,g/mL;v为酶解上清液体积,mL;m为酒糟原料质量,g。
1.3.5 酶解工艺优化
(1)单因素试验
以酒糟还原糖得率为评价指标,采用单因素试验分别考察芬顿试剂构成(2 000 mmol/L H2O2+20 mmol/L FeSO4、2 000 mmol/L H2O2+10 mmol/L FeSO4、2 000 mmol/L H2O2+5 mmol/L FeSO4、2 000 mmol/L H2O2、1 000 mmol/L H2O2+20 mmol/L FeSO4、1 000 mmol/L H2O2+10 mmol/L FeSO4、1 000 mmol/L H2O2+5 mmol/L FeSO4、1 000 mmol/L H2O2、200 mmol/L H2O2+20 mmol/L FeSO4、200 mmol/L H2O2+10 mmol/L FeSO4、200 mmol/L H2O2+5 mmol/L FeSO4、200 mmol/L H2O2、0),芬顿试剂添加量(2 mL、3 mL、4 mL、5 mL、6 mL),预处理时间(12 h、24 h、36 h、48 h),预处理pH(4.3、4.8、5.3、5.8、6.3、6.8),预处理温度(30 ℃、40 ℃、50 ℃、60℃),纤维素酶添加量(0、200U/g、400U/g、600U/g、800U/g、1 000 U/g、1 200 U/g),酶解时间(12 h、24 h、36 h、48 h),酶解pH值(3.8、4.3、4.8、5.3、5.8、6.3)和酶解温度(30 ℃、40 ℃、50 ℃、60 ℃)对酒糟酶解还原糖含量的影响。
(2)Plackett-Burman试验
基于单因素试验结果,将还原糖得率(Y)作为Plackett-Burman试验结果的响应值,以芬顿试剂构成(X1)、芬顿试剂添加量(X2)、预处理时间(X3)、预处理温度(X4)、预处理pH(X5)、纤维素酶添加量(X6)、酶解时间(X7)、酶解温度(X8)、酶解pH(X9)9个因素为自变量进行Plackett-Burman试验,试验因素与水平见表1。
表1 酒糟酶解工艺优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design for distiller's grains hydrolysis conditions optimization
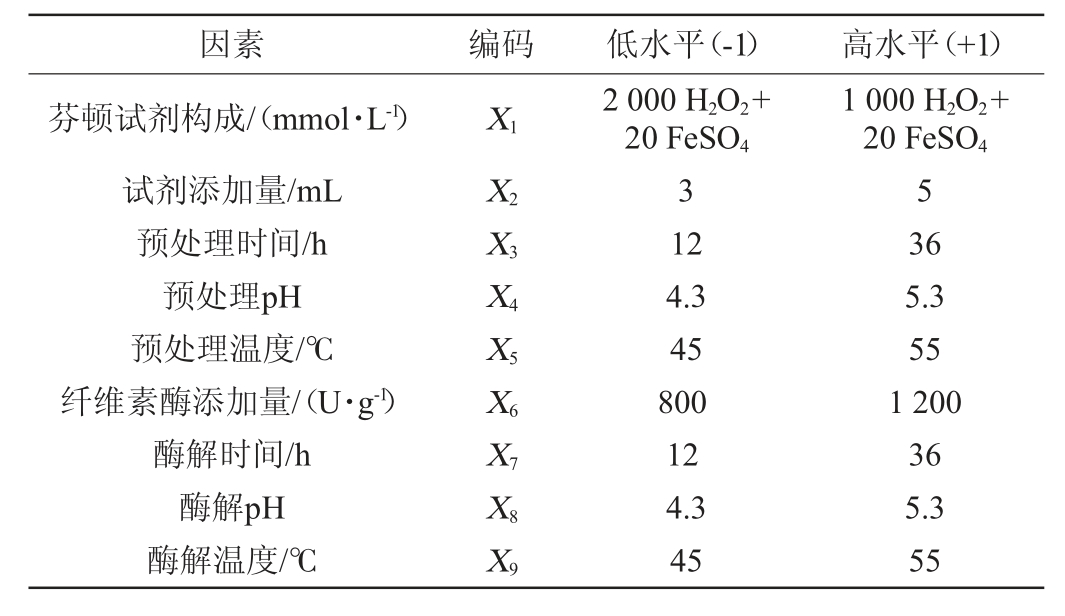
因素 编码 低水平(-1) 高水平(+1)芬顿试剂构成/(mmol·L-1)试剂添加量/mL预处理时间/h预处理pH预处理温度/℃纤维素酶添加量/(U·g-1)酶解时间/h酶解pH酶解温度/℃X1 X2X3X4X5X6X7X8X9 2 000 H2O2+20 FeSO4 3 12 4.3 45 800 12 4.3 45 1 000 H2O2+20 FeSO4 5 36 5.3 55 1 200 36 5.3 55
(3)响应面优化试验
在Plackett-Burman 试验数据结果分析基础上,选择预处理时间(A)、预处理pH(B)、纤维素酶添加量(C)以及酶解pH(D)自变量,还原糖得率(Y)作为响应值,通过Box-Behnken试验设计优化酒糟纤维酶解参数,Box-Behnken试验设计因素与水平见表2。
表2 酒糟酶解工艺优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design for distiller's grains hydrolysis conditions optimization
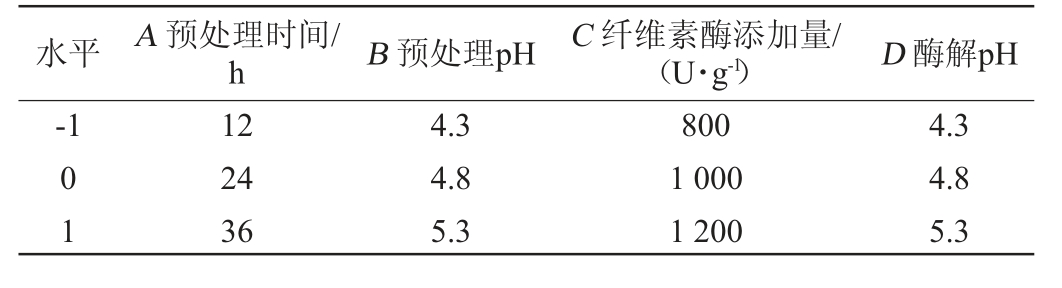
水平 A 预处理时间/h B 预处理pH C 纤维素酶添加量/(U·g-1) D 酶解pH-1 01 12 24 36 4.3 4.8 5.3 800 1 000 1 200 4.3 4.8 5.3
1.3.6 酒糟原料、芬顿试剂预处理后和酶解酒糟的形态观察
采用扫描电镜对酒糟原料、芬顿试剂预处理及酶解酒糟进行扫描电镜观察,研究不同处理之后酒糟内部纤维素的结构变化。将样品(过100目)摆放在载物台上,使用溅射涂膜机喷涂一层厚约10 nm的金,然后在扫描电子显微镜下观察。
1.3.7 数据处理
每个试验重复3次,结果以“平均值±标准差”表示。使用Excel 2019软件进行各个因素试验的数据分析,用Origin 2022作图,各因素水平的差异显著性(P<0.05)采用SPSS 27软件中的Tukey检验法,采用Minitab 21.0软件进行Plackett-Burman 试验数据分析,采用Design Expert 8.0.6软件进行Box-Behnken试验数据分析。
2 结果与分析
2.1 酶解工艺优化单因素试验结果
2.1.1 芬顿试剂构成对酒糟酶解还原糖得率的影响
芬顿试剂的构成比例是影响芬顿反应的重要参数[25],也是影响酶解过程的重要因素之一。芬顿试剂构成对酒糟酶解还原糖得率的影响结果见表3。
表3 芬顿试剂构成对酒糟酶解还原糖得率的影响
Table 3 Effect of Fenton's reagent compositions on reducing sugar yield of distiller's grains enzymatic hydrolysis
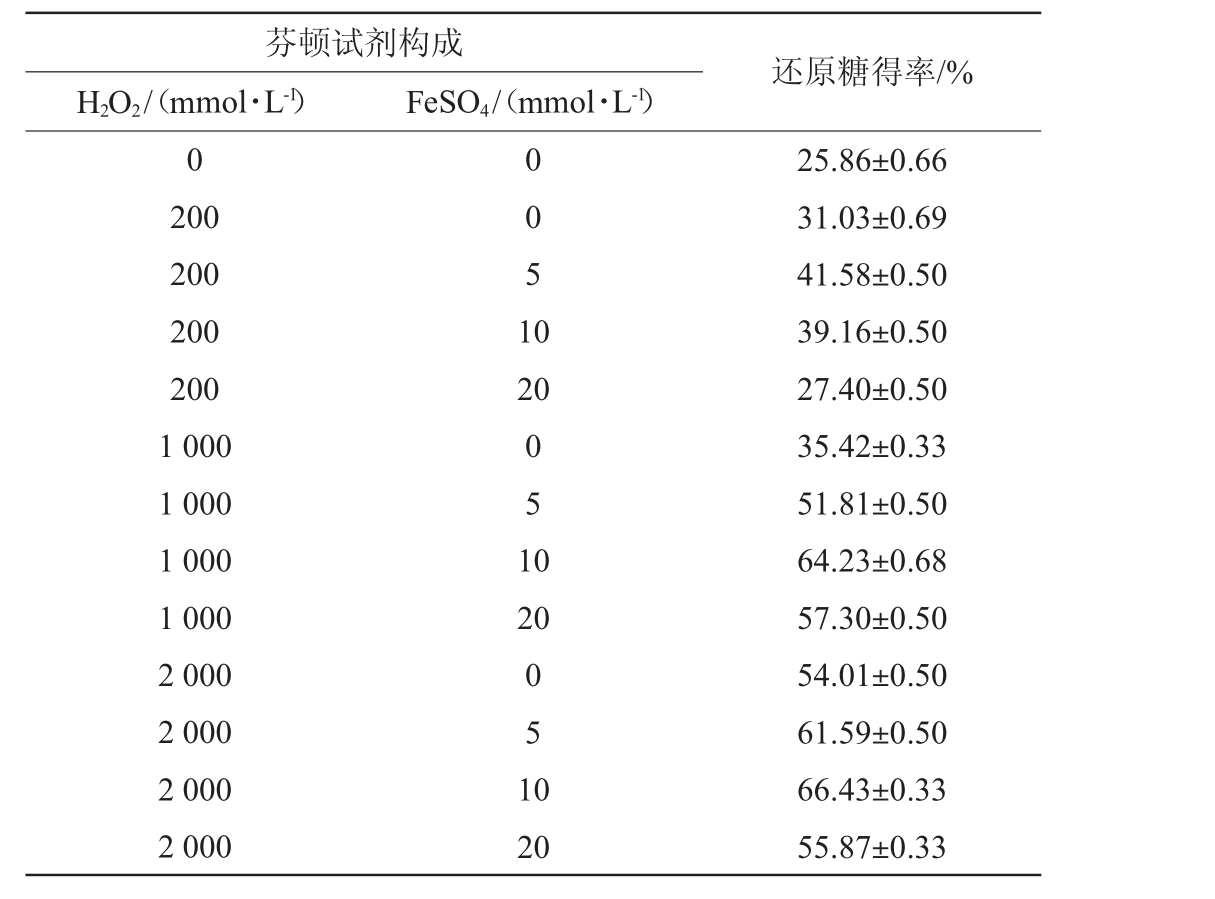
芬顿试剂构成H2O2/(mmol·L-1) FeSO4/(mmol·L-1)还原糖得率/%0 200 200 200 200 1 000 1 000 1 000 1 000 2 000 2 000 2 000 2 000 0051 0 20 051 0 20 051 0 20 25.86±0.66 31.03±0.69 41.58±0.50 39.16±0.50 27.40±0.50 35.42±0.33 51.81±0.50 64.23±0.68 57.30±0.50 54.01±0.50 61.59±0.50 66.43±0.33 55.87±0.33
由表3可知,酒糟还原糖的得率会随着过氧化氢浓度的提升而提升,在添加1 000 mmol/L H2O2和10 mmol/L FeSO4组成的芬顿试剂实验组中,还原糖得率出现峰值,相比较空白组提高了148.37%。其原因可能是芬顿反应过程需要消耗过氧化氢来产生自由基,随着过氧化氢浓度的增加,产生的自由基数量也增加[26],因此,更多的自由基可以用来降解木质素和破坏纤维素的结构;而低浓度的过氧化氢产生的自由基比较少,所以对底物的降解作用不明显。但是值得注意的是,随着二价铁离子的增加,还原糖得率并没有明显增加,这可能是由于当存在大量Fe2+后会迅速催化过氧化氢产生自由基[27],而大量的自由基堆积会相互反应生成水进而被消耗掉,造成了自由基的浪费,使得处理效果降低。因此,最适芬顿试剂构成为1 000 mmol/L H2O2和10 mmol/L FeSO4。
2.1.2 芬顿试剂添加量对酒糟酶解还原糖得率的影响
芬顿试剂添加量对酒糟酶解还原糖得率的影响见图1。
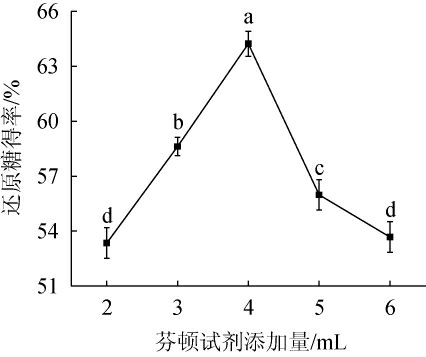
图1 芬顿试剂添加量对酒糟酶解还原糖得率的影响
Fig.1 Effect of Fenton's reagent addition on reducing sugar yield of distiller's grains enzymatic hydrolysis
不同小写字母表示差异显著(P<0.05)。下同。
由图1可知,芬顿试剂添加量在2~4 mL时,还原糖得率随着芬顿试剂的增加而上升;并在芬顿试剂添加量为4 mL时,还原糖得率出现峰值,为64.23%;芬顿试剂添加量>4 mL之后,酒糟还原糖得率反而下降。其原因可能是当添加量<4 mL时,反应未饱和,木质素得不到充分降解;当添加量>4 mL时,芬顿试剂与底物反应过于饱和,反应后Fe2+最终会被氧化成Fe3+。Fe3+氧化碳水化合物的还原端(半缩醛),导致纤维素酶活性纤维素减少,从而抑制纤维素分解,致使还原糖得率下降[28]。因此,最适芬顿试剂添加量为4 mL。
2.1.3 预处理时间对酒糟酶解还原糖得率的影响
预处理时间对酒糟酶解还原糖得率的影响见图2。
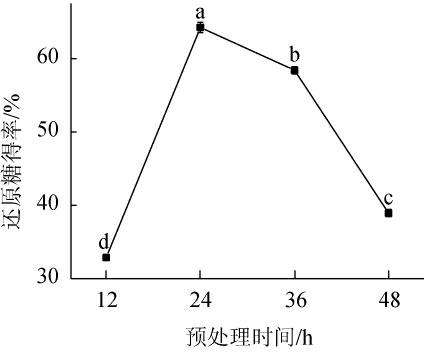
图2 预处理时间对酒糟酶解还原糖得率的影响
Fig.2 Effect of pretreatment time on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图2可知,预处理时间为12~24 h时,还原糖得率快速增大;当预处理时间为24 h时,还原糖得率达到峰值,为64.23%。在预处理时间>24 h 之后,还原糖得率缓慢下降。这说明刚开始时,芬顿反应速度快,H2O2被催化生成·OH,此时降解木质素效果好。随着反应的进行,处理液中的Fe3+量增多,体系中没有足够的·OH产生,氧化反应速率变慢,去除效果下降。因此,最适预处理时间为24 h。
2.1.4 预处理pH对酒糟酶解还原糖得率的影响预处理pH对酒糟酶解还原糖得率的影响见图3。
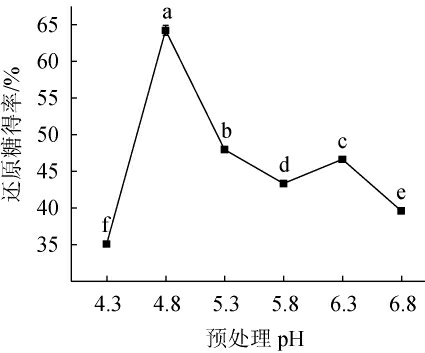
图3 预处理pH对酒糟酶解还原糖得率的影响
Fig.3 Effect of pretreatment pH on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图3可知,在预处理pH值4.3~6.8范围内,还原糖得率呈现先上升后下降再上升再下降的趋势,并在预处理pH值为4.8时,还原糖得率最大,为64.23%。预处理pH值>4.8之后,还原糖得率有所下降。其原因是当溶液中的pH高时,产生的Fe3+不能顺利的被还原成Fe2+,使得Fe2+催化H2O2产生羟基自由基的过程受阻。而预处理pH值过高时,还原糖得率有所下降。Fe2+不能催化H2O2产生羟基自由基,而且会产生氢氧化物而失去催化能力。因此,最适预处理pH值为4.8。
2.1.5 预处理温度对酒糟酶解还原糖得率的影响
温度是影响芬顿反应的重要参数之一。反应温度影响到芬顿反应中的反应物的分子动能,从而影响到相关反应速率,进而影响到芬顿反应所产生的自由基[29]。预处理温度对酒糟纤维素酶解影响见图4。

图4 预处理温度对酒糟酶解还原糖得率的影响
Fig.4 Effect of pretreatment temperature on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图4可知,随着预处理温度在30~50 ℃范围内的提升,酒糟还原糖得率随之升高,并在预处理温度为50 ℃时还原糖得率最大,为64.23%;预处理温度>50 ℃之后,还原糖得率有所下降。可能是温度升高在加速预处理反应的同时也加剧了其他副反应的进行,导致大量过氧化氢浪费,自由基减少,因此,自由基对酒糟的预处理作用下降,最终导致促进效果不明显[30]。因此,最适预处理温度为50 ℃。
2.1.6 纤维素酶添加量对酒糟酶解还原糖得率的影响
纤维素酶添加量对酒糟酶解还原糖得率的影响见图5。
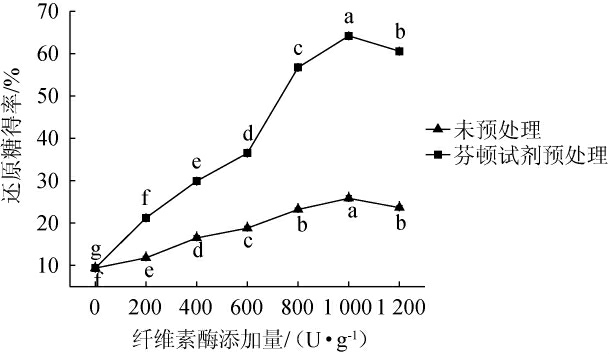
图5 纤维素酶添加量对酒糟酶解还原糖得率的影响
Fig.5 Effect of cellulase addition on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图5可知,纤维素酶的添加量在0~1 000 U/g的范围内,酒糟还原糖得率随着纤维素酶添加量的增加而增加;纤维素酶添加量为1 000 U/g 时,还原糖得率最高,为64.23%;此后继续添加纤维素酶,还原糖得率呈现下降趋势,结果与邢军梅[31]的实验结果一致。可能是因为当纤维素酶添加量>1 000 U/g后,纤维素酶的酶解能力过于饱和,酶解底物被完全水解,导致酶蛋白残留过多,发生抑制作用,使得添加过量的纤维素酶之后酶解效果反而下降。因此,最适纤维素酶添加量为1 000 U/g。
与未用芬顿试剂处理的酶解效果相比,纤维素添加量在1 000 U/g时,酶解效果提高了124.11%;利用芬顿试剂预处理实验组仅添加400 U/g的纤维素酶可超过空白添加1 000 U/g纤维素酶得到的还原糖得率,表明芬顿试剂预处理可降低约60%的用酶量。原因可能是芬顿试剂破坏纤维素的结晶区以及降解木质素,从而在提高底物易降解性的同时,解除了木质素对纤维素酶的吸附作用,从而提高了最终酶解率。
2.1.7 酶解时间对酒糟酶解还原糖得率的影响
酶解时间对酒糟酶解还原糖得率的影响见图6。
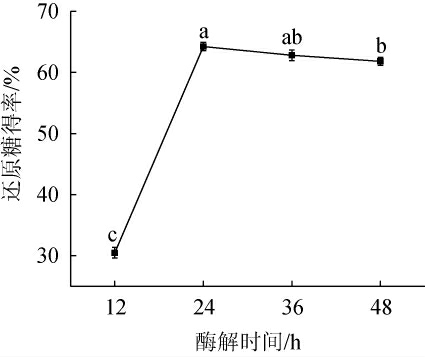
图6 酶解时间对酒糟酶解还原糖得率的影响
Fig.6 Effect of enzymatic hydrolysis time on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图6可知,随着纤维素酶酶解时间在12~24范围内的延长,还原糖得率随之递增;酶解时间为24 h时,还原糖得率最高,为64.23%;酶解时间>24 h之后,还原糖得率稍有下降。可能是因为酶解所得的纤维二糖和葡萄糖反过来对纤维素的酶解产生抑制作用。因此,最适酶解时间为24 h。
2.1.8 酶解pH对酒糟酶解还原糖得率的影响
酶解pH对酒糟酶解还原糖得率的影响见图7。

图7 酶解pH对酒糟酶解还原糖得率的影响
Fig.7 Effect of enzymatic hydrolysis pH on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图7可知,还原糖得率随着酶解pH的增加而先上升后下降。酶解pH为3.8~4.8时,还原糖得率随着酶解pH的增加而升高;酶解pH为4.8时,还原糖得率达到最高,为64.23%;酶解pH>4.8之后,还原糖得率有所下降。酶的活性存在一个最佳pH范围,低于和超过这个范围酶活性都会降低,这是因为pH会影响酶的三维结构,可以改变底物与酶分子的带电状态,影响底物和酶的结合,与此同时,过高或者过低的pH也会引起蛋白的变性[22]。因此,最适酶解pH值为4.8。
2.1.9 酶解温度对酒糟酶解还原糖得率的影响
酶解温度对酒糟酶解还原糖得率的影响见图8。

图8 酶解温度对酒糟酶解还原糖得率的影响
Fig.8 Effect of enzymatic hydrolysis temperature on reducing sugar yield of distiller's grains enzymatic hydrolysis
温度是影响酶活动的一个重要参数之一。由图8可知,随着酶解温度在30~60 ℃范围内的变化,酒糟还原糖得率呈现先上升后下降的趋势。酶解温度在30~50 ℃时,还原糖得率随之上升;酶解温度在50 ℃时,还原糖得率最大,为64.23%;酶解温度>50 ℃之后,还原糖得率有所下降。这是因为随着温度的升高,分子热运动随之加剧,酶与底物的组合速率也被促进,还原糖得率随之提高。但是,当温度超过酶最适温度之后,蛋白质变质,导致酶的活性受到明显的影响甚至失活,从而使得还原糖得率降低。因此,最适酶解温度为50 ℃。
2.2 酶解工艺优化Plackett-Burman设计试验
在单因素试验结果的基础上,以还原糖得率(Y)为响应值,以芬顿试剂构成(X1)、芬顿试剂添加量(X2)、预处理时间(X3)、预处理温度(X4)、预处理pH(X5)、纤维素酶添加量(X6)、酶解时间(X7)、酶解温度(X8)、酶解pH(X9)为自变量,Plackett-Burman试验设计及结果见表5,各因素效应分析见表6。
表5 Plackett-Burman试验设计及结果
Table 5 Design and results of Plackett-Burman experiments
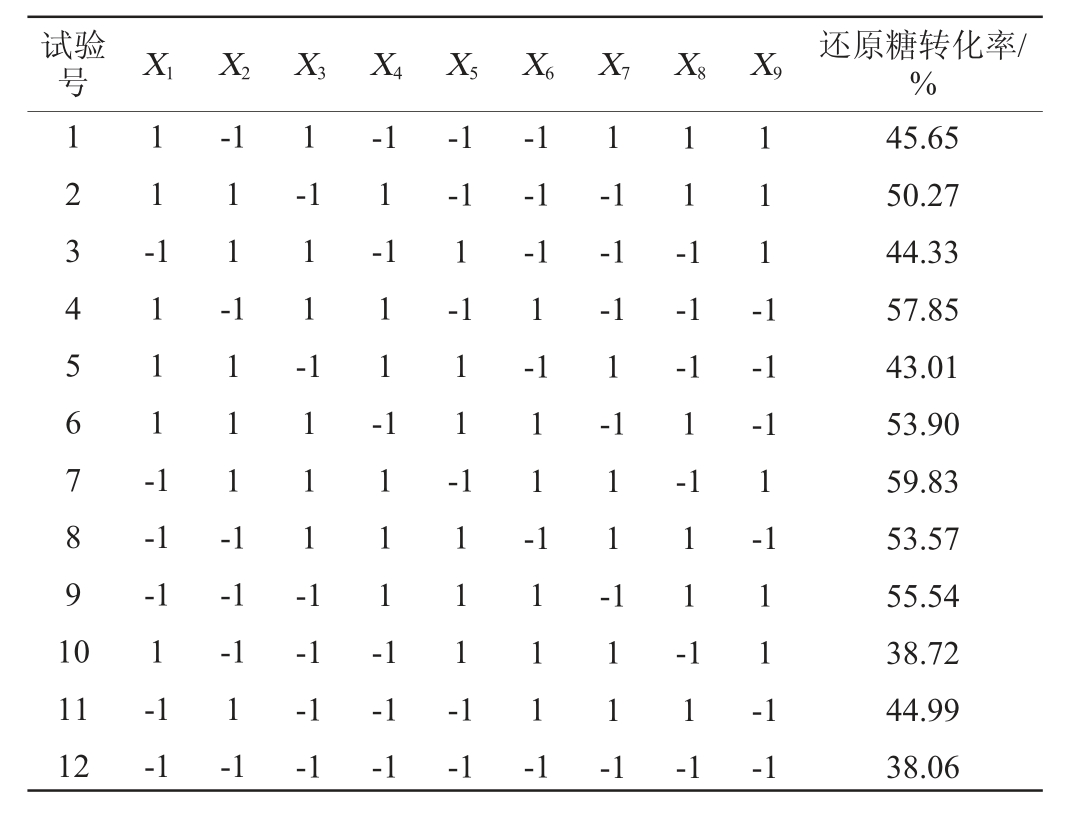
试验号 X1 X2 X3 X4 X5 X6 X7 X8 X9 还原糖转化率/%1234567891 0 1 1 --1 1 1 1 1 --1 1 1 1 1 -1-1 1-1 1 1 --1-1 1-1 1 1 -1 1 1 1 1-1-1-1-1 1-1 1 1 -1 1 1 -1-1-1-1 1-1 1 1 -1 1 --1-1 1-1 1 1 1 1 -1-1-1 1-1 1 1 -1 1 --1-1 1-1-1-1-1 1-1 1 1 1 1 -1 11 12-1-1-1-1-1 1 1 1 1 -1 1 1 -1-1 1 11 1 -1 1 1 1 -1 1 1-1-1 45.65 50.27 44.33 57.85 43.01 53.90 59.83 53.57 55.54 38.72 44.99 38.06
表6 Plackett-Burman试验各因素效应评价
Table 6 Effect evaluation of various factors of Plackett-Burman experiments
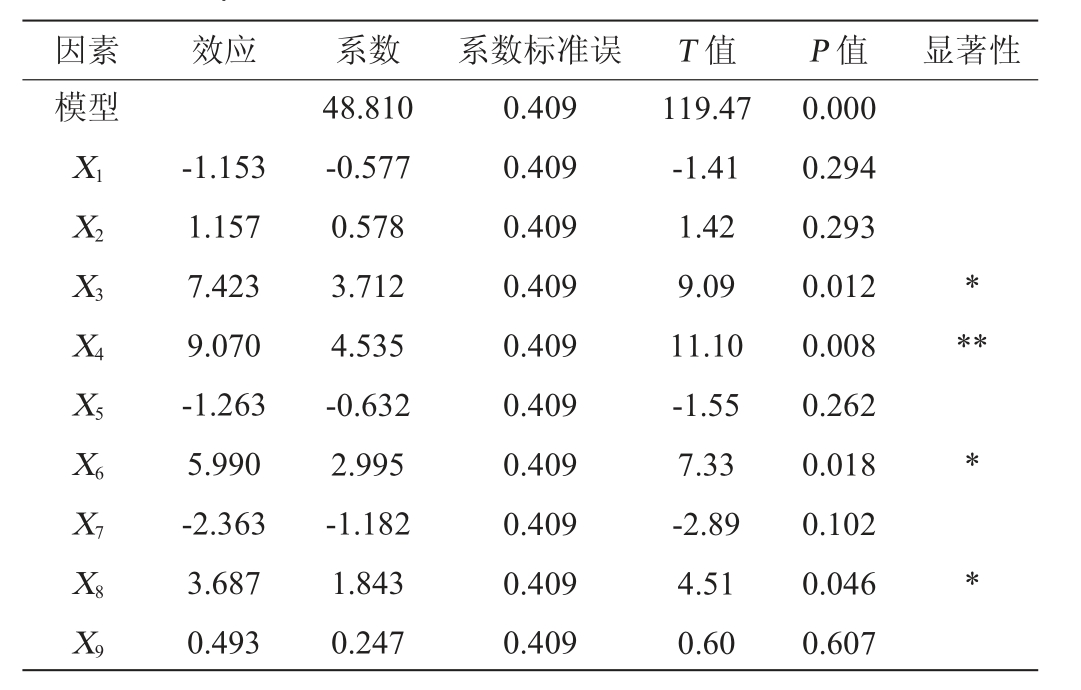
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。下同。
因素 效应 系数 系数标准误 T 值 P 值 显著性模型X1 X2 X3 X4 X5 X6 X7 X8 X9-1.153 1.157 7.423 9.070-1.263 5.990-2.363 3.687 0.493 48.810-0.577 0.578 3.712 4.535-0.632 2.995-1.182 1.843 0.247 0.409 0.409 0.409 0.409 0.409 0.409 0.409 0.409 0.409 0.409 119.47-1.41 1.42 9.09 11.10-1.55 7.33-2.89 4.51 0.60 0.000 0.294 0.293 0.012 0.008 0.262 0.018 0.102 0.046 0.607*****
由表6可知,预处理pH(X4)对酒糟还原糖得率影响极显著(P<0.01);预处理时间(X3)、纤维素酶添加量(X6)和酶解pH(X8)对酒糟还原糖得率影响显著(P<0.05)。因此,选择预处理时间、预处理pH、纤维素酶添加量和酶解pH这4个因素进行响应面优化。
2.3 酶解工艺优化响应面试验
2.3.1 响应面优化试验结果
在Plackett-Burman 试验数据结果分析基础上,选择预处理时间(A)、预处理pH(B)、纤维素酶添加量(C)以及酶解pH(D)自变量,还原糖得率(Y)作为响应值,进行Box-Behnken试验,结果见表7,方差分析结果见表8。
表7 Box-Behnken试验设计与结果
Table 7 Design and results of Box-Behnken experiments
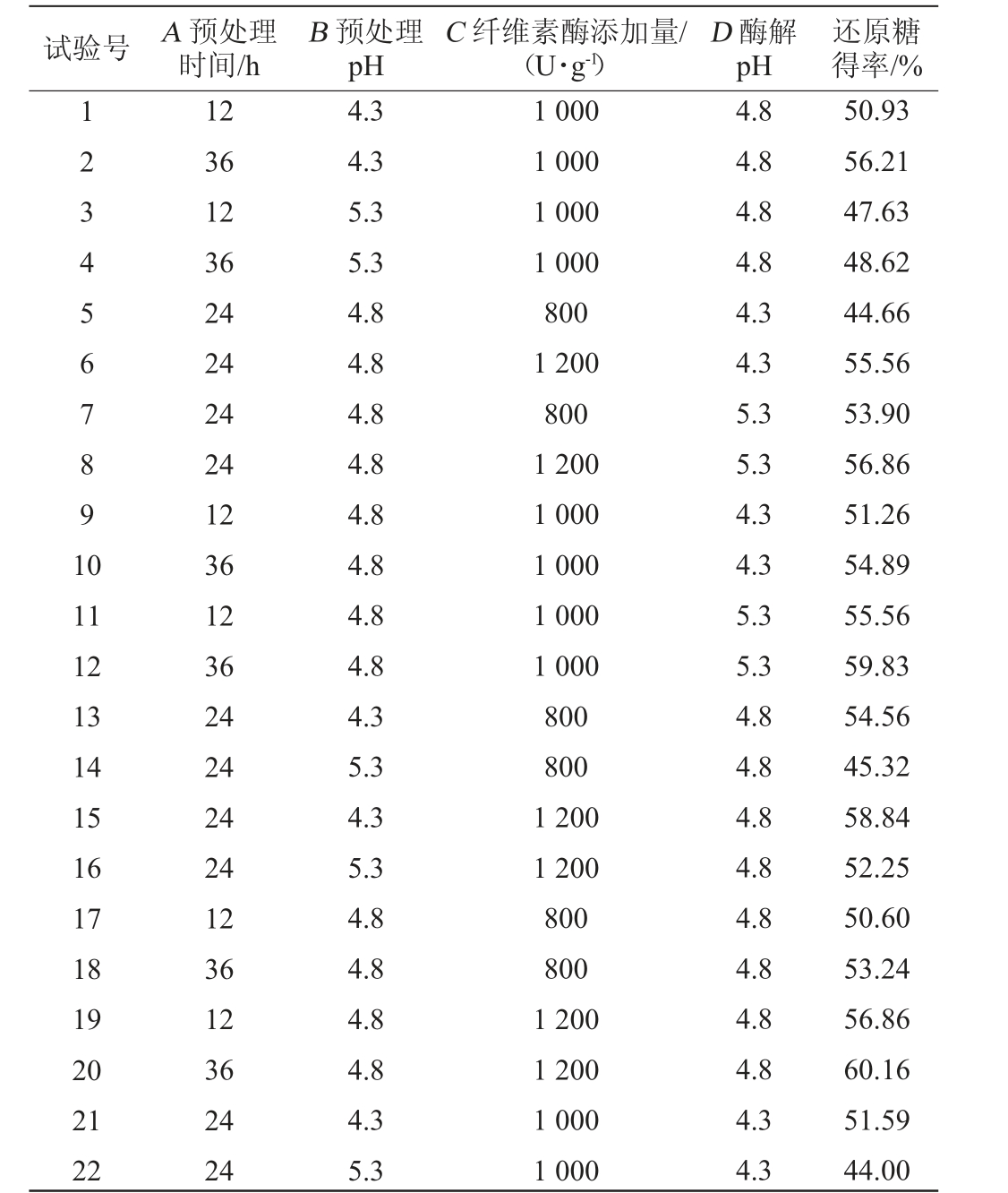
试验号 A 预处理时间/h B 预处理pH C 纤维素酶添加量/(U·g-1)D 酶解pH还原糖得率/%1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 12 36 12 36 24 24 24 24 12 36 12 36 24 24 24 24 12 36 12 36 24 24 4.3 4.3 5.3 5.3 4.8 4.8 4.8 4.8 4.8 4.8 4.8 4.8 4.3 5.3 4.3 5.3 4.8 4.8 4.8 4.8 4.3 5.3 1 000 1 000 1 000 1 000 800 1 200 800 1 200 1 000 1 000 1 000 1 000 800 800 1 200 1 200 800 800 1 200 1 200 1 000 1 000 4.8 4.8 4.8 4.8 4.3 4.3 5.3 5.3 4.3 4.3 5.3 5.3 4.8 4.8 4.8 4.8 4.8 4.8 4.8 4.8 4.3 4.3 50.93 56.21 47.63 48.62 44.66 55.56 53.90 56.86 51.26 54.89 55.56 59.83 54.56 45.32 58.84 52.25 50.60 53.24 56.86 60.16 51.59 44.00
续表
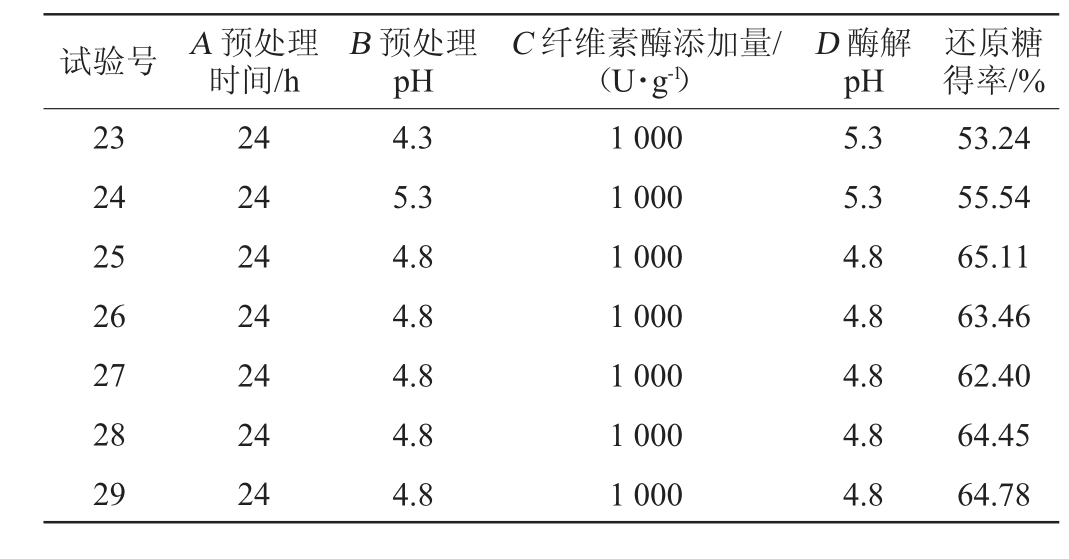
试验号 A 预处理时间/h B 预处理pH C 纤维素酶添加量/(U·g-1)D 酶解pH还原糖得率/%23 24 25 26 27 28 29 24 24 24 24 24 24 24 4.3 5.3 4.8 4.8 4.8 4.8 4.8 1 000 1 000 1 000 1 000 1 000 1 000 1 000 5.3 5.3 4.8 4.8 4.8 4.8 4.8 53.24 55.54 65.11 63.46 62.40 64.45 64.78
表8 回归模型方差分析
Table 8 Variance analysis of regression model

方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**********14 ABCDA B AC AD BC BD CD A2** **B2 C2 D2 21.726 21 10.934 67 27.704 67 39.558 92 29.391 35 1.492 854 0.035 334 0.033 225 0.569 632 7.934 059 5.113 801 38.929 39 124.242 9 45.964 85 61.673 97<0.000 1 0.005 2 0.000 1<0.000 1<0.000 1 0.241 9 0.853 6 0.858 0 0.462 9 0.013 7 0.040 2<0.000 1<0.000 1<0.000 1<0.000 1******残差失拟项误差项总和937.452 1 33.701 01 85.386 68 121.921 9 90.585 08 4.601 025 0.108 9 0.102 4 1.755 625 24.45 303 15.760 9 119.981 6 382.920 7 141.665 2 190.081 2 43.148 45 38.261 85 4.886 6 980.600 6 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 10 4 28 66.960 87 33.701 01 85.386 68 121.921 9 90.585 08 4.601 025 0.108 9 0.102 4 1.755 625 24.45 303 15.760 9 119.981 6 382.920 7 141.665 2 190.081 2 3.082 032 3.826 185 1.221 65 3.131 981 0.141 3不显著
利用Design-Expert 8.0.6软件对表7数据进行多元二次回归拟合后,得到回归方程为:Y=64.04+1.68A-2.67B+3.19C+2.75D-1.07AB+0.16AC+0.16AD+0.66BC+2.47BD-1.99CD-4.30A2-7.68B2-4.67C2-5.41D2。
由表8可知,模型P<0.01,该模型极显著。同时,该模型失拟项P=0.141 3,失拟项不显著,表明该模型方程与实际拟合度良好;模型决定系数R2=0.956 0,调整决定系数R2adj=0.912 0,说明该模型可以充分拟合预处理时间、预处理pH、纤维素酶添加量、酶解pH与还原糖得率之间的相互关系,因此可以用该回归方程确定酒糟最佳酶解工艺条件。
由P值可知,一次项A、B、C、D,二次项A2、B2、C2、D2对结果影响极显著(P<0.01),交互项BD、CD对结果影响显著(P<0.05)。由F值可知,各因素对结果影响顺序为纤维素酶添加量(C)>酶解pH(D)>预处理pH(B)>预处理时间(A)。
2.3.2 各因素交互作用分析
响应面模型能够直观、准确地描述两个因素之间的相互作用,预处理时间、预处理pH、纤维素酶添加量和酶解pH之间交互作用对酒糟还原糖得率影响的响应曲面及等高线见图9。
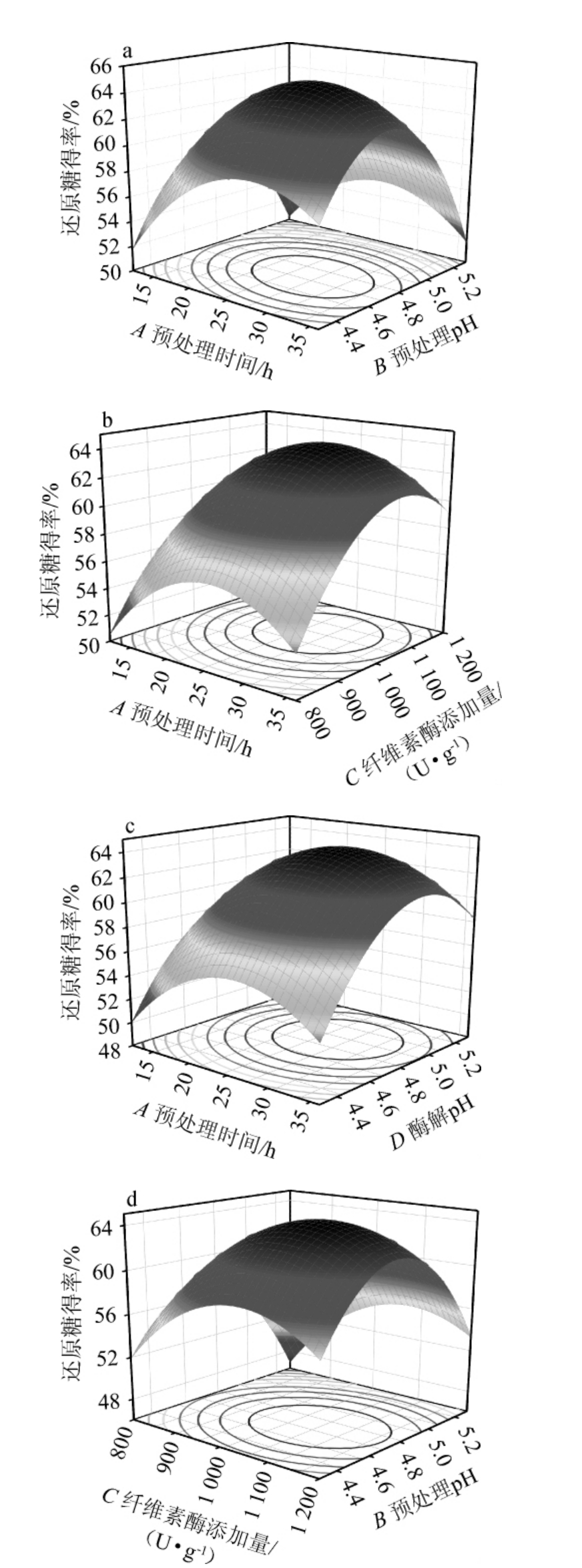

图9 各因素间交互作用对酒糟酶解还原糖得率的响应面和等高线
Fig.9 Response surface plots and contour lines of effects of interaction between various factors on reducing sugar yield of distiller's grains enzymatic hydrolysis
由图9c和9f可知,响应曲面的坡度较陡峭,等高线呈较均匀且紧密的微椭圆形分布,说明BD和CD交互作用显著。且由图9c亦可知,当设定预处理和纤维素酶添加量保持不变时,在酶解pH轴上,酒糟还原糖得率响应面更加陡峭,表明酶解pH比预处理时间对酒糟还原糖得率的影响程度大。由图9f可知,明显可见高线图接近椭圆形,曲面斜率陡峭,说明两因素的交互作用对酒糟还原糖得率的影响具有显著性,且酶解pH比纤维素酶添加量影响程度大,这与表8方差分析结果一致。
2.4 最佳酶解工艺的确定
使用Design Expert 8.0.6软件进行数据分析得出最优酶解工艺参数为预处理时间26.729 h,预处理pH 4.725,纤维素酶添加量1 059.638 U/g,酶解pH 4.886。在此条件下,酒糟还原糖得率理论值为65.09%。结合实际操作可行性,修正最优酶解工艺参数为预处理时间27 h、预处理pH 4.7、纤维素酶添加量1 060 U/g、酶解pH 4.9。在此优化酶解工艺条件下进行3次平行验证试验,酒糟还原糖得率实际值为64.44%,与预测值65.09%相比,误差仅为0.99%,表明该模型可靠,具有较好的预测作用;相同条件下无芬顿试剂预处理的对照组试验酒糟还原糖得率平均值为25.66%。该工艺条件下还原糖得率与邢军梅[31]采用微波结合P.chrysosporium预处理相比提高了1.5倍。
2.5 酒糟原料、芬顿试剂预处理酒糟和酶解酒糟的形态观察
在芬顿试剂预处理和纤维素酶酶解的过程中,化学组分发生变化的同时表面微观结构也发现了不同程度的改变。为了评估芬顿试剂和纤维素酶对原料外观形貌的影响,对酒糟原料残渣、芬顿试剂预处理酒糟及酶解酒糟进行了扫描电镜分析,结果见图10。由10a可知,酒糟原料的纤维表面呈现光滑且粗大的致密的形态结构,该结构阻碍了纤维素酶的对纤维素的可及性。由图10b可知,芬顿试剂预处理之后的酒糟表面结构呈现不同程度的变化,原先规则的形态被破坏形成单个的纤维束状,还发现表面出现层次各异的蓬松状态,裂痕明显,且伴随小颗粒碎片。其原因主要是芬顿试剂处理导致部分木质素和半纤维素被去除,而有利于增加纤维素酶对纤维素的可及性,进而提高纤维素酶解糖化效率。由图10c可知,酒糟进一步纤维素酶酶解之后,块状物质明显减少,基本上见不到明显的纤维素结构,且表面显露出许多小孔,除了酒糟原来残渣原有的气孔之外,其余气孔或许是纤维素酶和纤维素结果降解所致。结果表明,酒糟还原糖得率与表面微观形貌变化直接相关。

图10 酒糟原料、芬顿试剂处理酒糟及酶解酒糟的扫描电镜结果
Fig.10 Scanning electron microscopy results of distiller's grains raw material, distiller's grains with Fenton reagent and distiller's grains with enzymatic hydrolysis
(a)酒糟原料;(b)芬顿试剂预处理酒糟;(c)纤维素酶解酒糟。放大倍数为2 000倍。
3 结论
该研究以酒糟为原料,采用芬顿试剂预处理辅助酶法降解纤维素获取还原糖,利用还原糖得率为评价指标,在单因素试验的基础上,通过Plackett-Burman试验及Box-Behnken试验对酒糟纤维素酶解工艺优化,得到最优酶解工艺参数为预处理时间27 h、预处理pH4.7、纤维素酶添加量1 060 U/g、酶解pH4.9。此优化条件下,酒糟还原糖的率为64.44%,比相同条件下无芬顿试剂处理的对照组相比提高了148.37%,初步验证了芬顿试剂对酒糟纤维的预处理效果。SEM观察结果表明,酒糟的表面的形貌结构不一样,经过处理后的残表面出现不同程度的裂痕,说明在芬顿试剂预处理过程中,部分半纤维素和木质素被脱除。该研究结果显示,芬顿试剂对酒糟纤维素酶解具有显著促进作用,能为酒糟资源的开发利用提供借鉴。
[1]胡志强,李存福,张国顺,等.白酒酒糟综合利用技术研究进展[J].山东化工,2022,42(15):76-78.
[2]中华人民共和国国家统计局[DB/OL].http://data.stats.gov.cn/easyquery.htm?cn=A01&zb=A020909&sj=201712,2021-10-5.
[3]李茂雅,陈玉连,成启明,等.酒糟饲料化利用的研究进展[J].中国饲料,2022(15):133-138.
[4]李顺滢,陈昊翔,周远浩,等.黄酒糟资源化利用技术研究进展[J].中国酿造,2023,42(8):1-6.
[5]蔡凤娇,蔡林洋,孔博,等.白酒糟的多元化利用研究进展[J].酿酒,2020,47(2):11-15.
[6]曲亮璠,肖海燕,薛薇,等.醇-碱法提取啤酒糟中蛋白质的研究[J].食品工程,2020,32(1):24-27,33.
[7]王霞,敖玲,曾珊,等.白酒酒糟营养解析及其动物饲料化应用研究进展[J].中国饲料,2023,46(22):281-288.
[8]张伟,林燕,刘妍,等.利用秸秆制备燃料乙醇的关键技术研究进展[J].化工进展,2011,30(11):2417-2423.
[9]WANG W,LIANG T,BAI H Y,et al.All cellulose composites based on cellulose diacetate and nanofibrillated cellulose prepared by alkali treatment[J].Carbohydr Polym,2018,179(28):297-304.
[10]赵博,胡尚连,龚道勇,等.固体酸催化纤维素水解转化葡萄糖的研究进展[J].化工进展,2017,36(2):555-567.
[11]马文鹏,裴芳霞,任海伟,等.双酶复合水解酒糟制备可发酵糖的工艺研究[J].酿酒科技,2016(4):89-92.
[12]QU W J,MA H L,LIU B,et al.Enzymolysis reaction kinetics and thermodynamics of defatted wheat germ protein with ultrasonic pretreatment[J].Ultrason Sonochem,2013,20(6):1408-1413.
[13]HAN Y J,CHEN H Z.Improvement of corn stover bioconversion efficiency by using plant glycoside hydrolase[J].Bioresource Technol,2011,102(7):4787-4792.
[14]ZHOU Z Y,OUYANG D G,LIU D H,et al.Oxidative pretreatment of lignocellulosic biomass for enzymatic hydrolysis: Progress and challenges[J].Bioresource Technol,2023,367(8):128-141.
[15]MORONE A, CHAKROBARTI T, PANDEY R A.Effect of chemical input during wet air oxidation pretreatment of rice straw in reducing biomass recalcitrance and enhancing cellulose accessibility[J].Kor J Chem Eng,2018,35(5):2403-2412.
[16]ANDERSEN S,CASTOLDI R,GARCIA J,et al.Improving enzymatic saccharification of Eucalyptus grandis branches by ozone pretreatment[J].Wood Sci Technol,2019,53(10):49-69.
[17]任海伟,陈晓前,邢超红,等.废弃白酒糟酸水解工艺的优化[J].食品工业科技,2013,34(3):240-242,246.
[18]吕晓静,吴跃华,蒋旭红,等.基于响应面法优化氢氧化钠预处理甘蔗渣的酶解条件[J].中国酿造,2022,41(1):161-166.
[19]刘俊红,王建成,王福梅,等.玉米秸秆纤维素降解工艺研究[J].河南城建学院学报,2022,31(5):80-86.
[20]刘梦佳.甘草渣的酶解产糖及发酵合成丁二酸的研究[D].郑州:河南农业大学,2022.
[21]WU D,WEI Z,ZHAO Y,et al.Improved lignocellulose degradation efficiency based on Fenton pretreatment during rice straw composting[J].Bioresource Technol,2019,294(9):122-132.
[22]XIONG Z Y,QIN Y H,MA J Y,et al.Pretreatment of rice straw by ultrasound-assisted Fenton process[J].Bioresource Technol,2017,227(12):408-411.
[23]曹焱鑫,邵丽杰,张欢,等.超低酸预处理结合酶解提高玉米秸秆糖化效率[J].农业工程学报,2014,30(6):179-184.
[24]刘俊红,洪军,赵彩霞,等.麸皮酶解制备还原糖的工艺研究[J].河南工业大学学报自然科学版,2014,35(2):73-76.
[25]孙乐乐.绿色介质耦合汽爆处理秸秆及其高固酶解发酵乙醇的研究[D].北京:中国科学院大学,2021.
[26]KATO D M,ELIA N,FLYTHE M,et al.Pretreatment of lignocellulosic biomass using Fenton chemistry[J].Bioresource Technol,2014,162(23):273-278.
[27]费庆志,姜慧,陈仕崎.基于响应面分析法优化芬顿处理废乳化液[J].大连交通大学学报,2023,44(1):112-119.
[28]JAIN P,VIGENSHWARAN N.Effect of Fenton's pretreatment on cotton cellulosic substrates to enhance its enzymatic hydrolysis response[J].Bioresource Technol,2012,103(1):219-226.
[29]WANG L,BU Y X,SUN L L,et al.A sequential combination of advanced oxidation and enzymatic hydrolysis reduces the enzymatic dosage for lignocellulose degradation[J].Renew Energy,2023,211(7):617-625.
[30]刘庆玉,杨明,张嫩,等.低过氧化氢浓度的芬顿试剂预处理玉米秸秤试验[J].沈阳农业大学学报,2019,50(5):628-633.
[31]邢军梅.微波结合P.chrysosporium预处理对酒糟酶解糖化效果的影响[D].兰州:兰州理工大学,2017.