桦褐孔菌(Inonotus obliquus)是一种含有多种生物活性成分的药食两用真菌,其主要以子实体形态生长于俄罗斯和我国东北地区的桦树上,当前研究主要集中于桦褐孔菌多糖[1-3]、三萜类和多酚类化合物[4]等活性成分的降血糖[5-8]、抗肿瘤[9]、抗氧化[10]以及提高免疫力等生物活性及其构效关系上[11-12]。天然且具有良好的药用价值的桦褐孔菌子实体需要在自然环境中生长10~15年[13],而液体深层发酵具有培养周期短且活性物质产量高、不受环境和季节限制等优势,因此当前对桦褐孔菌的研究主要集中于利用发酵培养技术进行纯培养产活性物质方面[14-15]。在发酵培养过程中,真菌自身遗传特性、培养基营养组成以及培养条件等因素都会对真菌自身生物量积累、代谢产物和生物活性形成影响[16-18]。碳源作为微生物生长所必需的营养物质,一方面为微生物的生长提供能量,另一方面通过一系列复杂的化学变化同化成为微生物自身的组分,如细胞壁、胞内多糖等物质[19]。因此适宜的碳源种类和浓度对于微生物的生长和代谢产物的积累均具有非常重要的作用。而在微生物发酵过程中,发酵周期是影响细胞生长、维持细胞代谢和产物形成的重要环境因素,过长或过短的培养周期均不利于细胞的生长和发酵产物的形成[20-21]。α-葡萄糖苷酶抑制剂能够减少进入肠胃食物中葡萄糖的释放量,从而以降低餐后血糖的方式缓解II型糖尿病症状。本课题组前期研究发现,桦褐孔菌在液体深层发酵培养的过程中对部分碳源、有机氮源和无机盐的利用较为广泛,其菌丝体可产降血糖活性物质[22-23]。XU X Q等[24]研究了在桦褐孔菌发酵培养基中添加花生壳、麦秆、稻秆、玉米秸秆等木质纤维素,发现桦褐孔菌可以利用其作为后续碳源,且均能不同程度促进桦褐孔菌液体发酵产降血糖活性物质积累。XIANG Y等[25]的研究表明,在桦褐孔菌发酵培养基中添加玉米秸秆能显著提高菌丝体胞内多糖和胞外多糖的产量,同时抗氧化活性也有显著提高。本实验系统研究不同初始碳源浓度对桦褐孔菌的生长以及代谢产物形成之间随发酵时间变化的规律,并建立发酵动力学模型,为桦褐孔菌液体发酵产降血糖活性物质的工艺控制以及从分批发酵向半连续发酵和连续发酵过渡提供理论基础,也为工业化液体深层发酵生产桦褐孔菌降血糖活性多糖提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
桦褐孔菌(Inonotus obliquus):四川省绵阳市食用菌研究所。
1.1.2 化学试剂
α-葡萄糖苷酶(40 U/mL)、对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG):美国Sigma公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、葡萄糖、麦芽糖、甘露糖、半乳糖、鼠李糖、木糖、乳糖、阿拉伯糖、羧甲基纤维素钠(均为分析纯)、可溶性淀粉、糖蜜(均为食品级):北京化工厂。
1.1.3 培养基
基础培养基:蔗糖20 g/L、牛肉膏3 g/L、K2HPO4 1 g/L、无水MgSO4 1 g/L、MnSO4·H2O 0.1 g/L,初始pH自然,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
M200 pro多功能酶标仪:Tecan集团奥地利有限公司;FLC-3超净工作台:哈尔滨市东联公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限公司。
1.3 方法
1.3.1 菌种的保存、活化和液体深层培养
采用胡涛等[15]的方法进行菌种保存与活化。以接种量10%接种于基础培养基,28 ℃、150 r/min条件下培养20 d。
1.3.2 分析检测
(1)菌丝体生物量的测定
到达发酵终点后对发酵液立即进行抽滤,将分离后的菌丝体用蒸馏水冲洗至无色,于60 ℃烘干至恒质量后称其质量。
(2)α-葡萄糖苷酶抑制率的测定
α-葡萄糖苷酶酶活力单位定义:在pH 6.8、37 ℃条件下、每1 min水解底物所产生1 μmol/L对硝基酚(p-nitrophenol,PNP)为1个活性单位(U)。采用王昭润等[2]的方法对α-葡萄糖苷酶抑制率进行测定,α-葡萄糖苷酶抑制率计算公式如下:
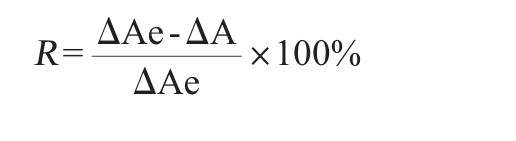
式中:R为α-葡萄糖苷酶抑制率,%;ΔAe为酶与底物反应后的吸光度值(扣除相应空白),ΔA为加入抑制剂后酶反应的吸光度值(扣除相应空白)。
(3)还原糖含量的测定
采用DNS法测定还原糖含量(以葡萄糖计),在波长540 nm处测定吸光度值,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制标准曲线,得到标准回归方程为:y=0.140 1x-0.041 1,相关系数R2=0.999 5,将待测样品的吸光度值带入标准曲线方程得到待测样品的还原糖含量。
1.3.3 不同碳源对桦褐孔菌液体深层发酵的影响
去除基础培养基碳源后保持其他营养成分、基础发酵条件不变,探究分别以20 g/L的葡萄糖、麦芽糖、甘露糖、半乳糖、鼠李糖、木糖、乳糖、阿拉伯糖、羧甲基纤维素钠、可溶性淀粉、糖蜜为碳源,于28 ℃、150 r/min振荡培养12 d,达到发酵终点后立即测定菌丝体生物量以及发酵液(浓缩5倍)对α-葡萄糖苷酶的抑制率。每组实验重复3次,取平均值。
1.3.4 不同初始葡萄糖添加量分批发酵实验设计
葡萄糖的初始添加量分别为20 g/L、25 g/L、30 g/L和35 g/L,保持牛肉膏3 g/L、K2HPO4 1 g/L、无水MgSO4 1 g/L、MnSO4·H2O 0.1 g/L不变,在28 ℃、初始pH值自然条件下,分别在0~20 d培养周期中每2 d取样测定桦褐孔菌菌丝体生物量、发酵液(浓缩5倍)的α-葡萄糖苷酶抑制率和还原糖含量。
1.3.5 数据处理
采用Excel 2019软件进行数据整理,用Origin 9.0软件分别对菌体生长、代谢产物形成和基质消耗进行非线性拟合,并对拟合数据进行微分计算,获得菌体生长速率、代谢产物形成速率和基质消耗速率,再经平滑处理,分别获得菌体生长速率-时间关系曲线、代谢产物形成速率-时间关系曲线和基质消耗速率-时间关系曲线[26]。再根据定义对菌体生长速率、代谢产物形成速率和基质消耗速率进行计算即可得到菌体比生长速率、代谢产物比形成速率和基质比消耗速率。
2 结果与分析
2.1 不同碳源对桦褐孔菌液体深层发酵的影响
探究不同碳源对桦褐孔菌液体深层发酵菌丝体生物量及发酵液(浓缩5倍)对α-葡萄糖苷酶抑制率的影响,结果见图1。由图1A可知,分别以20 g/L糖蜜和葡萄糖为碳源时,生物量分别达到了85.0 mg/100 mL和78.7 mg/100 mL,均高于对照组的73.7 mg/100 mL,说明这两种碳源的添加对桦褐孔菌菌丝体的生长有促进作用。以20g/L甘露糖、阿拉伯糖、可溶性淀粉为碳源时的生物量分别为58.7mg/100 mL、62.0 mg/100 mL、52.0 mg/100 mL,略低于对照组水平。以20 g/L木糖和羧甲基纤维素钠为碳源时生物量均低于10.0 mg/100 mL,远低于对照组,说明这两种碳源对褐孔菌菌丝体生长有抑制作用。由图1B可知,不同碳源均会对发酵液的α-葡萄糖苷酶的抑制率产生影响,其中以20 g/L葡萄糖为碳源时的α-葡萄糖苷酶抑制率最高为31.38%,是对照组抑制率15.26%的两倍,且此时的菌丝体生物量较高为78.7 mg/100 mL,虽然以20 g/L木糖为碳源的实验组菌丝体生物量仅为10.0 mg/100 mL,处于较低水平,但α-葡萄糖苷酶抑制率却与其他组相差不大,说明木糖虽然不利于桦褐孔菌菌丝体的生长但是能够促进代谢产物的生成。虽然20 g/L糖蜜实验组的生物量较高,但其α-葡萄糖抑制率明显低于葡萄糖和麦芽糖。综上,选择以葡萄糖为最佳碳源。
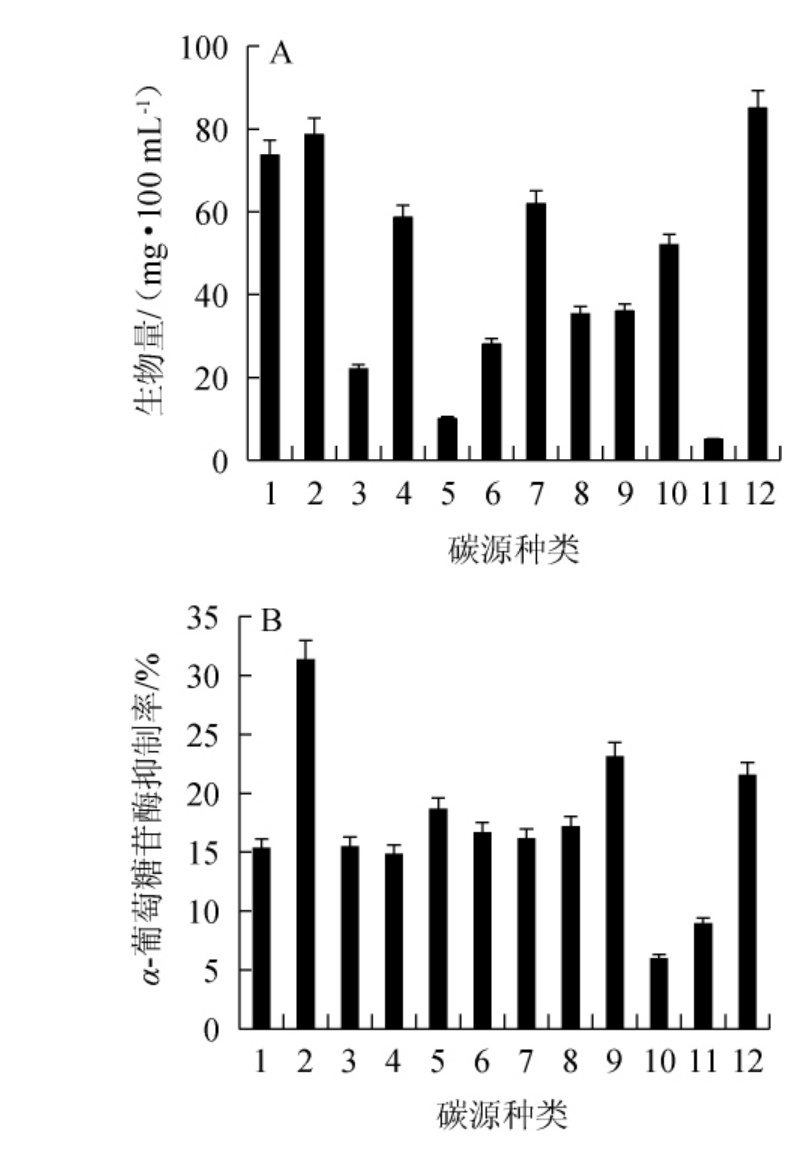
图1 不同碳源下桦褐孔菌液体深层发酵菌丝体生物量(A)及发酵产物对α-葡萄糖苷酶的抑制率(B)
Fig.1 Biomass of Inonotus obliquus mycelium with submerged fermentation (A) and inhibition rate of α-glucosidase by fermentation products (B) with different carbon sources
1-对照;2-葡萄糖;3-半乳糖;4-甘露糖;5-木糖;6-鼠李糖;7-阿拉伯糖;8-乳糖;9-麦芽糖;10-可溶性淀粉;11-羧甲基纤维素钠;12-糖蜜。
2.2 不同初始葡萄糖添加量对菌丝体生物量的影响
不同初始葡萄糖添加量下桦褐孔菌菌体生长动力学曲线见图2。
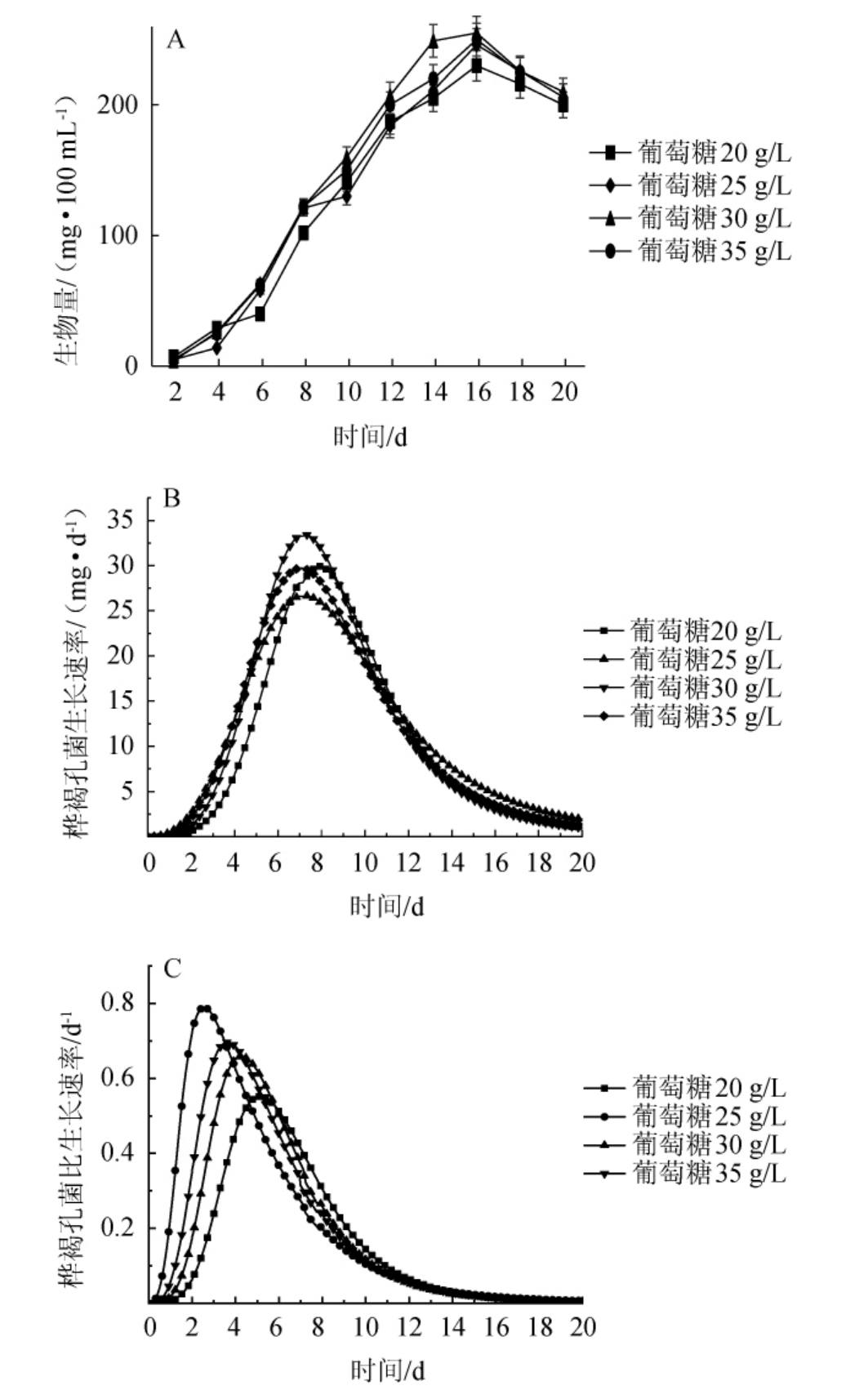
图2 不同初始葡萄糖添加量下桦褐孔菌菌体生长动力学曲线
Fig.2 Growth kinetic curves of Inonotus obliquus with different initial glucose addition
由图2A可知,在培养时间0~16 d范围内,随着培养时间的延长,菌丝体生物量呈现逐渐增长趋势,在培养时间6~14 d时,菌丝体生物量增长迅速,此时为微生物对数生长期。发酵初期,初始葡萄糖添加量为20~30 g/L时,随着碳源添加量的增长,菌丝体的生物量随之增加,但当初始葡萄糖的添加量为35 g/L时,菌体生物量并没有随之增长,说明高浓度的葡萄糖对菌体生长有抑制的作用,不利于桦褐孔菌菌丝体的生长。且菌丝体在4种不同初始浓度的葡萄糖中基本均在6~8 d生长速率达到最大。
由图2B可知,初始葡萄糖添加量为20 g/L、25 g/L、30 g/L和35 g/L时,菌体达到最大生长速率的时间分别是8 d、7 d、7 d和7 d,最大生长速率分别为:29.88 mg/d、26.60 mg/d、33.45 mg/d、29.67 mg/d。可见当初始葡萄糖的添加量为30 g/L时,桦褐孔菌菌丝体细胞生长速率最高,但是随着初始葡萄糖添加量的继续增加,细胞的最大生长速率降低,可能是培养基碳源浓度过高对菌体生长产生了抑制作用。
由图2C可知,初始葡萄糖添加量为20 g/L、25 g/L、30 g/L和35 g/L时,菌体达到最大比生长速率的时间分别是5.2 d、2.6 d、4.2 d和3.7 d,最大比生长速率分别为0.548 d-1、0.940 d-1、0.654 d-1、0.689 d-1。可见随着初始葡萄糖添加量的增加,菌体达到最大比生长速率的时间与初始葡萄糖添加量20 g/L相比均有所提前。但是随着初始葡萄糖添加量的增加,初始葡萄糖添加量30 g/L和35 g/L效果基本相同,与初始葡萄糖添加量为20 g/L相比,以30 g/L葡萄糖为碳源时的桦褐孔菌生物量提高了10.87%,最大生长速率提高了11.9%,最大比生长速率提升了19.3%。
2.3 不同初始葡萄糖添加量对基质消耗的影响
不同初始葡萄糖添加量下基质消耗动力学曲线见图3。
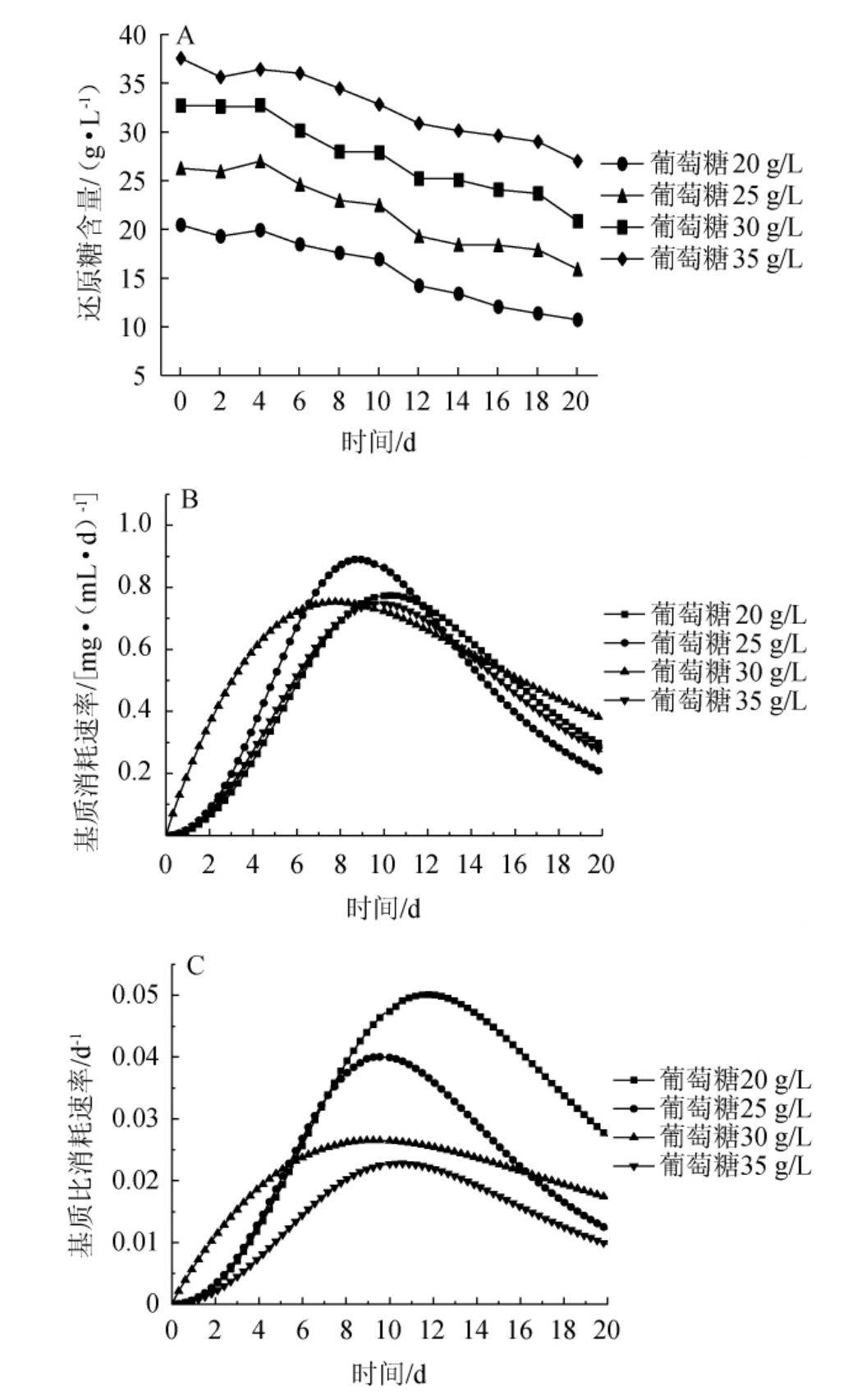
图3 不同初始葡萄糖添加量下基质消耗动力学曲线
Fig.3 Kinetic curves of substrate consumption with different initial glucose addition
由图3A可知,不同葡萄糖添加量均会影响桦褐孔菌菌丝体对基质的消耗,发酵液中还原糖的含量随着发酵时间延长均呈现下降趋势。由图3B可知,不同初始葡萄糖添加量基质消耗速率分别在10.3 d、9.5 d、7.9 d、8.9 d达到最大,分别为0.077 mg/(mL·d)、0.089 mg/(mL·d)、0.075 mg/(mL·d)、0.090 mg/(mL·d),可见随着初始葡萄糖添加量的增加,达到最大基质消耗速率所用的时间均有所提前,初始葡萄糖添加量为30 g/L时,基质消耗速率达到最大所用时间最短。由图3C可知,最大基质比消耗速率分别在10.3 d、9.5 d、8.8 d、11.5 d时达到最大,分别为0.023 d-1、0.040 d-1、0.027 d-1、0.05 d-1,不同初始葡萄糖添加量达到最大基质消耗速率和最大基质比消耗速率所用的时间基本一致。在初始葡萄糖添加量为30 g/L时,达到最大基质比消耗速率所用的时间最短。
2.4 不同初始葡萄糖添加量对产降血糖代谢产物的影响
不同初始葡萄糖添加量下降血糖活性物质形成动力学曲线见图4。
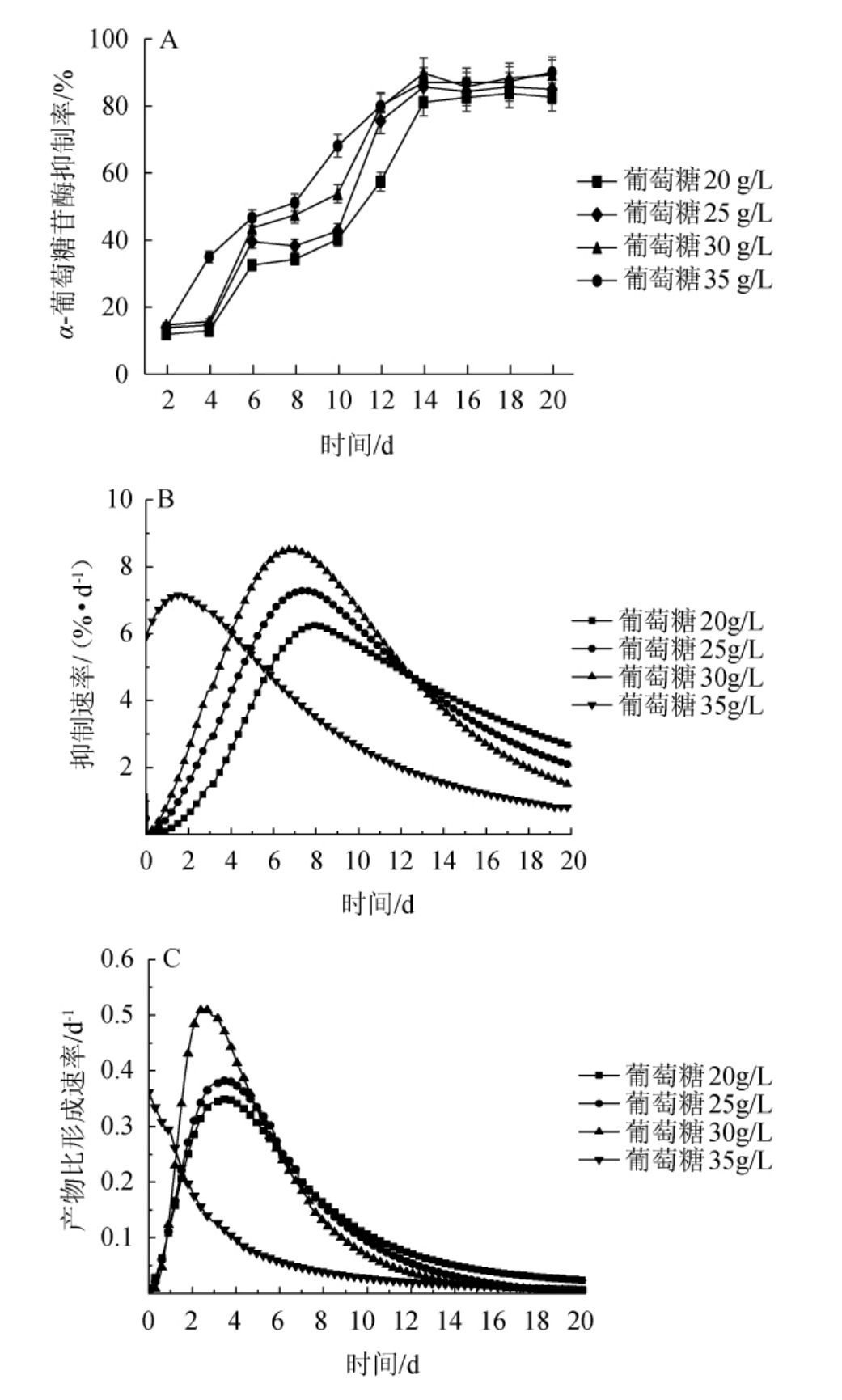
图4 不同初始葡萄糖添加量下降血糖活性物质形成动力学曲线
Fig.4 Kinetic curves of hypoglycemic active substances formation with different initial glucose addition
由图4A可知,添加不同初始葡萄糖时,发酵液对α-葡萄糖苷酶抑制率随发酵时间延长均呈现上升趋势,在发酵时间0~14 d,初始葡萄糖添加量越高,发酵液对α-葡萄糖苷酶抑制率越高,代谢产物的抑制率从发酵第6天开始有明显提高,且桦褐孔菌菌丝体对不同浓度的葡萄糖消耗均在发酵时间14 d左右时达到最大,此时期也为微生物对数生长期,这与王昭润[26]的研究结果相一致。由图4B可知,初始葡萄糖添加量为20 g/L、25 g/L、30 g/L和35 g/L时,α-葡萄糖苷酶抑制率达到最大抑制速率的时间分别是8 d、7 d、6 d、2 d,最大抑制速率分别为6.42%/d、7.21%/d、8.21%/d、7.25%/d。由图4C可知,初始葡萄糖添加量为20 g/L、25 g/L、30 g/L和35 g/L时,产物比形成速率达到最大的时间分别是3 d、2.9 d、2.2 d、0 d,产物最大比形成速率分别为是0.351 d-1、0.391 d-1、0.529 d-1、0.366 d-1。与初始葡萄糖添加量为20 g/L相比,以30 g/L葡萄糖为碳源时的桦褐孔菌代谢产物的形成速率和最大比形成速率分别提升了27.9%、50.57%。
2.5 桦褐孔菌发酵培养菌体生长模型建立
本研究选择Logistic方程构建桦褐孔菌菌体生长模型。

根据(2)式,以ln[Cx/(Cx,max-Cx)]对发酵时间(t)作图,直线斜率为最大比生长速率(μmax),截距为-ln(Cx,max/Cx,0-1),结果见图5。由图5可知,μmax=0.005,Cx,0=0.01。将Cx,0=μmax Cx,max代入(3)式整理得:
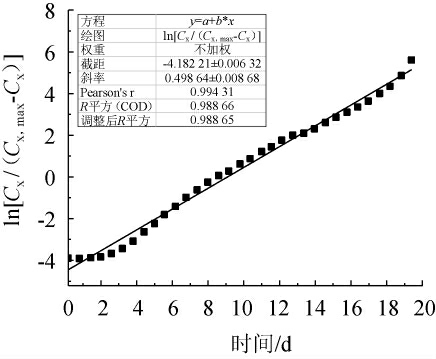
图5 桦褐孔菌生长的最大比生长速率评测结果
Fig.5 Evaluation results of maximum specific growth rate of Inonotus obliquus growth
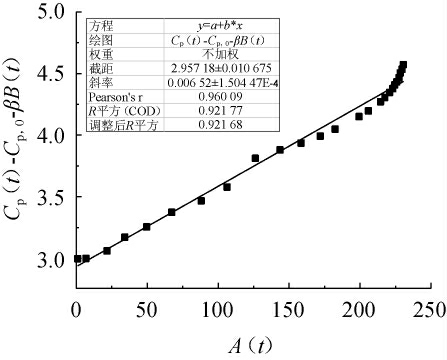
图6 桦褐孔菌代谢产物的α值评测结果
Fig.6 Evaluation results of α value of Inonotus obliquus metabolites
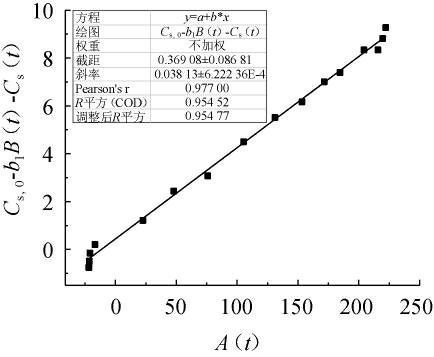
图7 桦褐孔菌基质消耗的b2值评测结果
Fig.7 Evaluation results of b2 value of Inonotus obliquus substrate consumption
2.6 桦褐孔菌发酵培养代谢产物形成模型建立
在大多数真菌合成代谢产物的动力学研究中,大多表现为部分生长耦联型,采用Luedeking-Piret方程描述代谢产物的比生长速率与生成速率之间的关系如下:


将模型参数值α,β,μmax,Cx,max和Cx,0值代入式(9)整理得桦褐孔菌代谢产物动力学模型为:
2.7 桦褐孔菌发酵培养基质消耗模型建立
基质消耗方程可用与Luedeking-Piret相似的方程式来表示。

当菌体生长处于稳态时,dCx/dt=0,可利用(13)可求得:

3 结论
本研究利用桦褐孔菌液体发酵法生产具有降血糖活性代谢产物,探讨发酵过程中不同初始葡萄糖添加量与桦褐孔菌菌丝体生长、液体基质消耗和发酵代谢产物形成之间的相互作用随时间变化的规律,结果表明,当初始葡萄糖添加量为30 g/L时,与初始葡萄糖添加量为20 g/L相比桦褐孔菌生物量提高10.87%,最大生长速率提高11.9%,最大比生长速率提升19.3%;最大基质消耗速率提升,均高于其他组;且此时得到的发酵液对α-葡萄糖苷酶抑制率最高,达到了89.82%,降血糖活性代谢产物形成与初始葡萄糖添加量为20 g/L时相比的最大形成速率和最大比形成速率分别提升了27.9%、50.57%。
[1]ZHANG C J,GUO J Y,CHENG H,et al.Spatial structure and antifatigue of polysaccharide from Inonotus obliquus[J].Int J Biol Macromol,2020,151:855-860.
[2]王昭润,刘萍,荣瑞芬,等.基于α-葡萄糖苷酶抑制率的桦褐孔菌多糖提取工艺优化[J].中国酿造,2018,37(4):150-154.
[3]XUE J,TONG S S,WANG Z R,et al.Chemical characterization and hypoglycaemic activities in vitro of two polysaccharides from Inonotus obliquus by submerged culture[J].Molecules,2018,23(12):3261.
[4]杨珺尧,孟利.桦褐孔菌及其药理作用研究进展[J].食药用菌,2021,29(3):202-207.
[5]陈盛宇,张淑梅,王玉霞,等.桦褐孔菌菌丝体多糖提取工艺优化及其降血糖能力测定[J].食品研究与开发,2023,44(19):110-117.
[6]赵佳茜,朱长俊,刘兰,等.桦褐孔菌多糖对小鼠的降血糖研究[J].生物化工,2021,7(4):99-102.
[7]夏晴,王箴言,王玉,等.桦褐孔菌多糖对糖尿病小鼠的干预作用及机制[J].中国食品学报,2021,21(3):71-78.
[8]张露,姜欣,金莉英,等.辐照处理对桦褐孔菌多糖降血糖作用的影响[J].食品与机械,2020,36(11):143-147.
[9]王梦雅,赵喆禛,薛娇,等.桦褐孔菌纯化多糖体外降血糖活性研究[J].食品工业科技,2020,41(10):316-320,326.
[10]LIU P,XUE J,TONG S S,et al.Structure characterization and hypoglycaemic activities of two polysaccharides from Inonotus obliquus[J].Molecules,2018,23(8):1948.
[11]段应策,隋丹,汪麟,等.桦褐孔菌小分子化合物化学成分及其药用价值的研究进展[J].菌物研究,2022,20(3):214-227.
[12]WANG L X,LU Z M,YAN Z,et al.Stimulated production of steroids in Inonotus obliquus by host factors from birch[J].J Biosci Bioeng,2014,118(6):728-731.
[13]NIU H,SONG D,MU H,et al.Investigation of three lignin complexes with antioxidant and immunological capacities from Inonotus obliquus[J].Int J Biol Macromol,2016,86:587-593.
[14]LU X, TONG S, LIU P.Enhanced α-glucosidase inhibition activity of exopolysaccharides fractions from mycelium of Inonotus obliquus under addition of birch sawdust lignocellulose component[J].Int J Biol Macromol,2023,242:124699.
[15]胡涛,刘萍,王亚亚,等.桦褐孔菌深层发酵培养条件的优化研究[J].中国酿造,2012,31(1):26-29.
[16]KIRAN G, NISHANTH L, PRIYADHARSHINI S, et al.Effect of Fe nanoparticle on growth and glycolipid biosurfactant production under solid state culture by marine Nocardiopsis sp.MSA13A[J].Bmc Biotechnol,2014,14(1):48.
[17]WANG C,LI W W,CHEN Z Q,et al.Effects of simulated gastrointestinal digestion in vitro on the chemical properties, antioxidant activity,α-amylase and α-glucosidase inhibitory activity of polysaccharides from Inonotus obliquus[J].Food Res Int,2018,103:280-288.
[18]WANG M,ZHAO Z,ZHOU X,et al.Simultaneous use of stimulatory agents to enhance the production and hypoglycaemic activity of polysaccharides from Inonotus obliquus by submerged fermentation[J].Molecules,2019,24(23):4400.
[19]刘雨婷.液体培养条件对桦褐孔菌产活性多糖的影响研究[D].长春:东北师范大学,2021.
[20]胡晓文.桦褐孔菌发酵条件的优化[D].济南:山东大学,2012.
[21]梁家旗.发酵时间对桦褐孔菌菌丝体活性成分的影响研究[D].吉林:吉林大学,2019.
[22]董文霞.桦褐孔菌多糖结构、硫酸化修饰及其降血糖活性研究[D].济宁:曲阜师范大学,2018.
[23]赵喆禛,王梦雅,薛娇,等.刺激因子对桦褐孔菌胞外多糖体外降血糖活性的影响[J].中国食品学报,2021,21(11):39-46.
[24]XU X Q,HU Y,ZHU L H.The capability of Inonotus obliquus for lignocellulosic biomass degradation in peanut shell and for simultaneous production of bioactive polysaccharides and polyphenols in submerged fermentation[J].J Taiwan Inst Chem Eng,2014,45(6):2851-2858.
[25]XIANG Y,XU X,LI J.Chemical properties and antioxidant activity of exopolysaccharides fractions from mycelial culture of Inonotus obliquus in a ground corn stover medium[J].Food Chem, 2012, 134(4): 1899-1905.
[26]王昭润.基于α-葡萄糖苷酶抑制率的桦褐孔菌胞外多糖培养基优化及结构鉴定[D].呼和浩特:内蒙古大学,2018.