中药渣是中草药通过熬煮后药效入汤剩下的残渣,含有蛋白质、氨基酸、脂肪和碳水化合物等多种营养成分和黄酮、生物碱、皂苷、多糖等生物活性物质[1],其作为中药提取生产企业末端的有机固体废弃物,具有含水量高、难降解、易腐败等特点[2-4]。据统计,全国中药渣年排放量已超过6 000~7 000万t[5]。研究表明,经提取后的中药渣中仍含有30%的活性成分和一定量的营养物质[6]。
中药渣发酵的菌种包括芽孢杆菌、乳酸菌、酵母菌、霉菌等[7-9]。研究表明,通过微生物代谢过程中产生的纤维素酶、淀粉酶、蛋白酶、果胶酶等可以破坏中草药细胞壁的完整性,充分释放药效成分,同时产生新的活性物质[10-11]。这种新型发酵饲料添加剂具有增强动物机体免疫力[12-13]、促进动物生长发育[14-15]、改善动物产品品质[16-17]、提高动物繁殖性能[18]等效果。刘倩等[19]研究结果表明,最优菌制剂为植物乳杆菌(Lactiplantibacillus plantarum)与枯草芽孢杆菌(Bacillus subtilis)等比例组合,其最佳发酵工艺条件为初始水分含量55%,发酵温度37 ℃,发酵时间72 h。陈鑫等[20]以白腐菌与产朊假丝酵母(Candida utilis)为菌种对红芪药渣进行固态发酵,并对其发酵条件进行优化,结果表明,在最佳发酵条件下,发酵产物中真蛋白含量达19.05%,粗纤维含量达19.94%。
夏桑菊由夏枯草、桑叶、菊花三味中药配伍而成[21],现代研究表明夏桑菊含有黄酮类、生物碱类、甾体类、氨基酸和有机酸等成分[22-23]。因此,夏桑菊中药渣具备开发新型发酵饲料添加剂的潜力。为实现夏桑菊中药渣资源化和高值化利用,本研究从长期堆积的夏桑菊中药渣中分离筛选提高夏桑菊中药渣生料中总生物碱含量的菌株,通过形态学特征、生理生化试验和16S rDNA序列分析对菌株进行鉴定,并通过单因素试验及响应面法对菌株发酵条件进行优化。研究夏桑菊中药渣生料发酵工艺条件,为研究开发中药渣新型发酵饲料添加剂提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌种分离样品
夏桑菊提取后的中药渣:广州白云山星珠药业有限公司,80 ℃烘干后粉碎至40~60目,备用。菌种分离样品:采集于广州白云山星珠药业有限公司周边长期堆积的夏桑菊中药渣。
1.1.2 试剂
玉米粉、豆饼粉:市售;葡萄糖、牛肉膏、蛋白胨:上海盛思生物科技有限公司;KNO3、KH2PO4、NaNO2、MgSO4·7H2O、α-萘胺、对氨基苯磺酸、冰乙酸、对二甲基氨基苯甲醛、浓盐酸、胰蛋白胨、丙酮、甲醇:国药集团化学试剂有限公司;酵母膏:上海天鹅啤酒有限公司;盐酸小檗碱标准品(纯度>98%):上海纯优生物科技有限公司;植物脱氧核糖核酸(deoxyribo nucleic acid,DNA)提取试剂盒:上海生工生物工程(上海)股份有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
分离培养基:葡萄糖2%,蛋白胨1%,酵母膏0.5%,NaCl 3%,KH2PO4 0.2%,MgSO4·7H2O 0.1%,琼脂2%,夏桑菊中药渣50%蒸煮液(以夏桑菊中药渣与水的料液比为1∶2加入蒸馏水,100 ℃条件下煮沸30 min,过滤,滤渣同样条件下煮沸一次,合并滤液,真空浓缩至含相当于50%中药渣的蒸煮液)1 000 mL,pH 7.2~7.5。
斜面培养基:牛肉膏0.3%,蛋白胨1%,NaCl 0.5%,琼脂2%,pH 7.2~7.5。
种子液培养基:葡萄糖3%,蛋白胨1%,牛肉膏0.5%,NaCl 0.3%,pH 7.2~7.5。
基础发酵培养基:夏桑菊中药渣80%,玉米粉10%,豆饼粉10%,葡萄糖2%,KH2PO4 0.15%,MgSO4·7H2O 0.1%,NaCl 3%,固水比1∶1(g∶mL),pH7.0,装料量为50 g/250 mL。
糖醇类发酵培养基、甲基红测定培养基、V-P测定培养基、淀粉水解培养基、纤维素分解培养基、硝酸盐还原培养基、亚硝酸盐还原培养基、反硝化培养基、吲哚培养基:参照文献[24]提供的方法配制。
上述培养基均在115 ℃条件下灭菌30 min。
1.2 仪器与设备
MIX-250BIII霉菌培养箱:天津市泰斯特仪器有限公司;ZQLY-180N振荡恒温培养箱:上海知楚仪器有限公司;752型紫外分光光度计:上海光谱仪器有限公司;YXQ-LS-50II高压蒸汽灭菌锅:上海博迅实业有限公司。
1.3 方法
1.3.1 夏桑菊中药渣发酵菌株的分离纯化、筛选
按照10倍稀释法将菌种分离样品适当稀释至10-6,分别取不同稀释度的稀释液0.1 mL均匀涂布于分离培养基平板表面,置于30 ℃恒温培养箱中培养36 h。选择不同形态的单菌落于分离培养基反复纯化后,接种至斜面培养基中,30 ℃恒温培养48 h,保存于4 ℃冰箱。
将分离到的菌种接种到种子液培养基中,37℃、170r/min培养24h。按5%(V/V)接种量接种到基础发酵培养基中,37 ℃培养箱中恒温培养5 d。80 ℃干燥后,测定总生物碱含量。
1.3.2 筛选菌种的鉴定
(1)形态学观察
将菌株L-1接种于牛肉膏蛋白胨固体培养基表面,37 ℃培养24 h后,观察菌落及细胞显微形态特征。
(2)生理生化试验
按照《常见细菌系统鉴定手册》[24]进行生理生化试验,对筛选菌种进行糖醇类发酵试验、接触酶试验、纤维素水解试验、淀粉水解试验、产吲哚试验、硝酸盐还原试验、亚硝酸还原试验、反硝化试验、甲基红试验、V-P试验等。
(3)分子生物学鉴定
使用植物DNA提取试剂盒提取菌种总基因组DNA,以通用引物722F(5'-AACACCAGTGGCGAAGGC-3')、907R(5'-CCGTCAATTCCTTTRAGTTT-3')PCR扩增16S rDNA。PCR扩增体系(50 μL):1×TSE101金牌mix 45 μL、27F(10 pmol/L)2 μL、1492R(10 pmol/L)2 μL、DNA模板1 μL;PCR扩增条件:98 ℃预变性2 min;98 ℃变性10 s,56 ℃复性10 s,72 ℃延伸5 min,共35循环;72 ℃再延伸10 min,4 ℃保存。用ContigExpress拼接测序结果,并去除两端不准的部分。将拼接好的序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)程序拼接,与NCBI数据库中的数据进行比对,利用软件Mega7.0构建系统发育树,其中Boot-strap分析重置设置为500。
1.3.3 总生物碱含量测定
总生物碱含量参照田凤等[25]提供的雷氏铵盐比色法进行测定,其计算公式为:
式中:A指根据吸光度在标准曲线上查到相应的总生物碱含量,mg/mL;M指被测物质的分子质量;V指溶解该生物碱雷氏盐沉淀所用的丙酮体积,mL;ε=106.5,指在丙酮中硫氰酸铬铵的摩尔吸收系数;W为样品质量,g。
1.3.4 夏桑菊中药渣的发酵条件优化
(1)单因素试验
发酵初始条件为固水比为1∶1(g∶mL),接种量5%(V/V),装料量为50 g/250 mL,pH 7.0,种龄为24 h,发酵温度30 ℃,发酵时间5 d。分别考察固水比(1.0∶0.8、1.0∶0.9、1.0∶1.0、1.0∶1.1、1.0∶1.2(g∶mL))、接种量(3%、4%、5%、6%、7%)、装料量(30 g/250 mL、40 g/250 mL、50 g/250 mL、60 g/250 mL、70 g/250 mL)、pH值(6.0、6.5、7.0、7.5、8.0)、发酵时间(3 d、4 d、5 d、6 d、7 d)、种龄(12 h、24 h、36 h、48 h)、温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)对夏桑菊中药渣总生物碱含量的影响。
(2)响应面优化
以单因素试验结果为依据,选择对菌株发酵有显著影响的装料量(A)、接种量(B)、发酵时间(C)、初始pH值(D)为4个因素,以总生物碱含量(Y)为响应值,根据Box-Behnken中心组合试验原理,进行4因素3水平响应面试验对夏桑菊中药渣发酵条件进行优化。响应面试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization
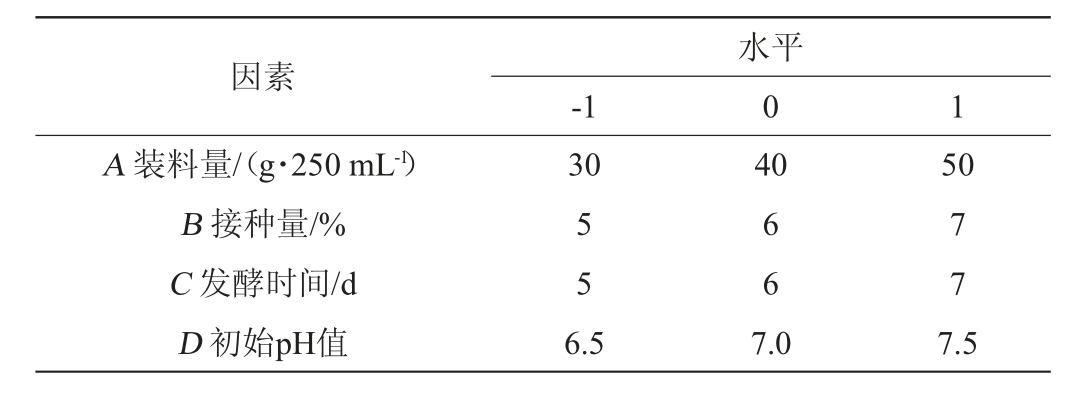
因素A 装料量/(g·250 mL-1)B 接种量/%C 发酵时间/d D 初始pH值-1水平0 1 30 40 50 5 5 6 6 7 7 6.5 7.0 7.5
1.3.5 数据处理
每次试验均进行3次重复,利用Excel 2019、Mega 7.0等软件进行数据处理及绘图,利用Design Expert12.0.3.0软件进行模型拟合和方差分析。
2 结果与分析
2.1 菌种筛选结果
通过分离纯化共获得6株产总生物碱的菌株,分别命名为菌株L-1、L-2、L-3、L-4、L-5、L-6。其产总生物碱含量分 别 为24.89 mg/g、17.90 mg/g、14.19 mg/g、17.46 mg/g、18.34 mg/g、16.07 mg/g。经菌株L-1发酵后,夏桑菊中药渣中的总生物碱含量最高(24.89 mg/g),较对照提高115.13%,故选择菌株L-1进行后续研究。
2.2 菌株L-1的鉴定结果
2.2.1 形态学观察
菌株L-1的菌落(a)及细胞(b)形态见图1。由图1可知,菌落形态为圆形,乳白色,不透明,边缘不规则,菌体为杆状,两端钝圆,革兰氏阳性。
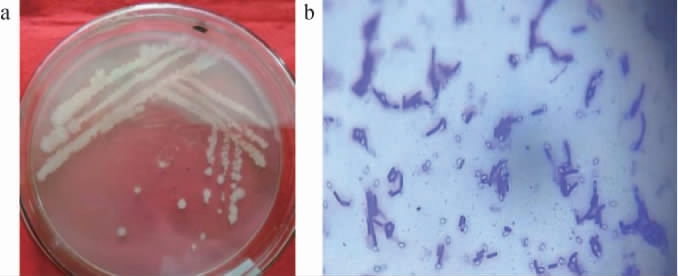
图1 菌株L-1的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain L-1
2.2.2 生理生化试验结果
菌株L-1的生理生化试验结果见表2。由表2可知,菌株L-1能利用葡萄糖、麦芽糖、蔗糖,不能利用木糖和甘露醇,甲基红试验、V-P试验阳性,能水解淀粉和纤维素,硝酸盐还原和亚硝酸盐还原阳性,反硝化试验阴性,能分解色氨酸形成吲哚。基于上述生理生化试验结果,将菌株L-1初步鉴定为芽孢杆菌属(Bacillus)。
表2 菌株L-1生理生化试验结果
Table 2 Results of physiological and biochemical tests of strain L-1
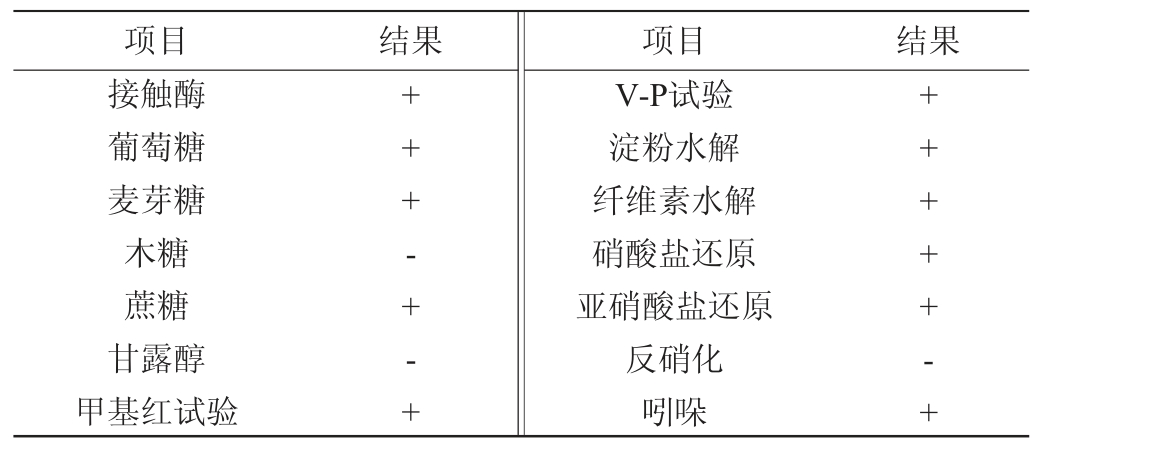
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 结果 项目 结果接触酶葡萄糖麦芽糖木糖蔗糖甘露醇甲基红试验+++-+-+V-P试验淀粉水解纤维素水解硝酸盐还原亚硝酸盐还原反硝化吲哚+++++-+
2.2.3 16S rDNA序列分析结果
将菌株16S rDNA扩增序列与Marker对比发现菌株L-1的16S rDNA片段大小为1 471 bp。将测序结果与NCBI中Genbank数据库经BLAST程序对比分析,利用软件Mega7构建系统发育树,结果见图2。由图2可知,菌株L-1与NR118383.1:8-1463枯草芽孢杆菌(Bacillus subtilis)strain SBMP4的同源性达100%。综合形态学、生理生化鉴定、分子生物学分析结果,鉴定菌株L-1为枯草芽孢杆菌(Bacillus subtilis)。
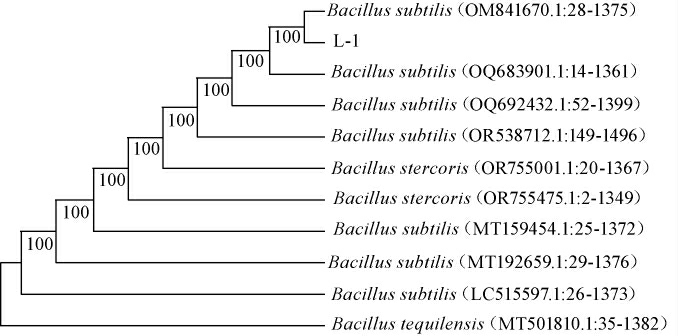
图2 基于16S rDNA序列菌株L-1的系统发育树
Fig.2 Phylogenetic tree of strain L-1 based on16S rDNA sequence
2.3 夏桑菊中药渣生料发酵条件优化
2.3.1 固水比对总生物碱含量的影响
固水比对总生物碱含量的影响见图3。由图3可知,当固水比为1.0∶0.8、1.0∶0.9、1.0∶1.0(g∶mL),总生物碱含量增加;当固水比为1.0∶1.0(g∶mL)时,总生物碱含量最高,为18.77 mg/g;固水比为1.0∶1.1、1.0∶1.2(g∶mL),总生物碱含量下降。主要原因为培养基中含水量太少,营养物质离子化程度低,影响微生物对营养物质的吸收利用,而水分含量太高,造成培养基中处于厌氧环境,从而影响微生物的生长和代谢[26]。因此,确定最佳固水比为1∶1(g∶mL)。
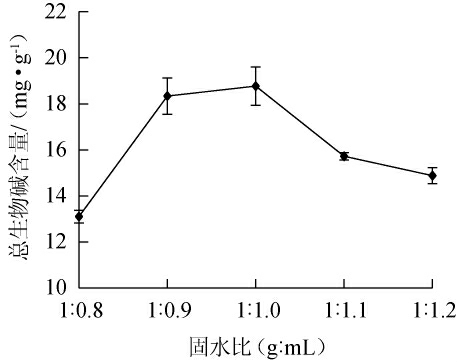
图3 固水比对总生物碱含量的影响
Fig.3 Effect of solid and water ratio on total alkaloid contents
2.3.2 接种量对总生物碱含量的影响
接种量对总生物碱含量的影响见图4。由图4可知,当接种量范围为3%~6%时,总生物碱含量逐渐增加;当接种量为6%时,总生物碱含量达20.74 mg/g;接种量>6%,总生物碱含量下降。因此,确定最佳接种量为6%。
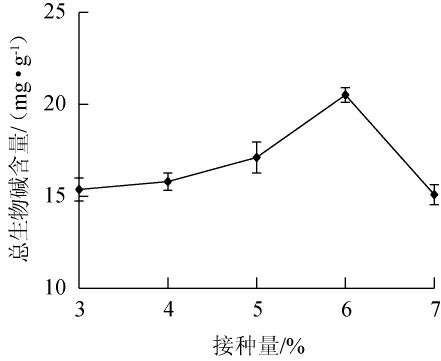
图4 接种量对总生物碱含量的影响
Fig.4 Effect of inoculum on total alkaloid contents
2.3.3 装料量对总生物碱含量的影响
装料量对总生物碱含量的影响见图5。由图5可知,当装料量为30~40 g/250 mL时,总生物碱含量逐渐增加;当装料量为40g/250mL时,总生物碱含量达到最大值,为20.96mg/g;当装料量>40 g/250 mL,总生物碱含量下降。因此,确定最佳装料量为40 g/250 mL。
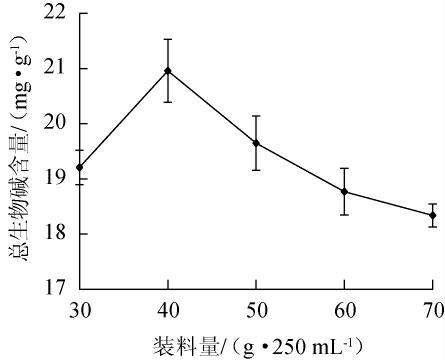
图5 装料量对总生物碱含量的影响
Fig.5 Effect of loading volume on total alkaloid contents
2.3.4 pH值对总生物碱含量的影响
初始pH值对总生物碱含量的影响见图6。由图6可知,当初始pH值为6.0~7.0时,总生物碱含量逐渐增加;当初始pH值为7.0时,总生物碱含量达21.39 mg/g;当初始pH值>7.0时,总生物碱含量下降。因此,确定最佳初始pH值为7.0。

图6 初始pH值对总生物碱含量的影响
Fig.6 Effect of initial pH on total alkaloid contents
2.3.5 种龄对总生物碱含量的影响
种龄对总生物碱含量的影响见图7。由图7可知,当种龄为12~36 h时,总生物碱含量逐渐增加;当种龄为36 h时,总生物碱含量最大,为25.54 mg/g;当种龄为36~48 h时,总生物碱含量下降。因此,确定最佳种龄为36 h。
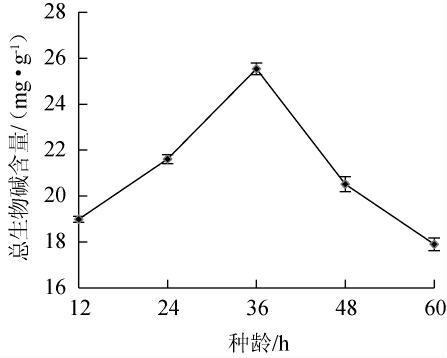
图7 种龄对总生物碱含量的影响
Fig.7 Effect of inoculum age on total alkaloid contents
2.3.6 发酵时间对总生物碱含量的影响
发酵时间对总生物碱含量的影响见图8。由图8可知,当发酵时间为3~6 d时,总生物碱含量逐渐增加;当发酵时间为6 d时,总生物碱含量达到26.41 mg/g;当发酵时间>6 d,总生物碱含量下降。因此,确定最佳发酵时间为6 d。
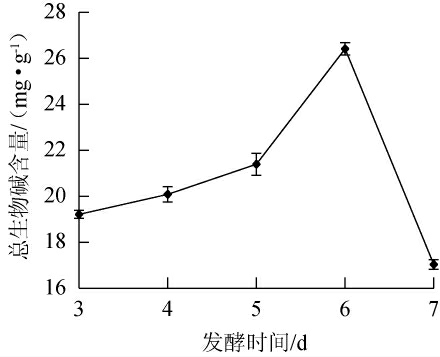
图8 发酵时间对总生物碱含量的影响
Fig.8 Effect of fermentation time on total alkaloid contents
2.3.7 发酵温度对总生物碱含量的影响
发酵温度对总生物碱含量的影响见图9。由图9可知,当发酵温度为26~28 ℃时,总生物碱含量逐渐增加;当发酵温度为28 ℃时,总生物碱含量达到最高值,为27.07 mg/g;当发酵温度>28 ℃,总生物碱含量明显下降。因此,确定最佳发酵温度为28 ℃。
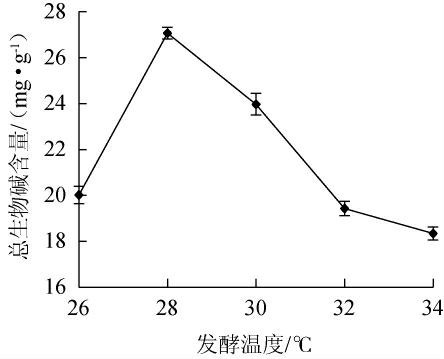
图9 发酵温度对总生物碱含量的影响
Fig.9 Effect of fermentation temperature on total alkaloid contents
2.4 响应面试验结果
在单因素试验结果的基础上,选择对菌株发酵有显著影响的装料量(A)、接种量(B)、发酵时间(C)、初始pH值(D)为考察因素,以总生物碱含量(Y)为响应值,根据Box-Behnken中心组合试验原理,进行4因素3水平响应面试验对发酵条件进行优化,试验设计及结果见表3,回归模型方差分析见表4。通过Design Expert12.0.3.0软件对表3结果进行方程拟合与显著性分析,得到总生物碱含量的二次多元回归方程:

表3 发酵条件优化响应面试验设计及结果
Table 3 Design and results of response surface tests for fermentation conditions optimization

试验号 A B C D Y 总生物碱含量/(mg·g-1)1234567891 0 100--1 0-1 10-1 00--1 10-00001-11-11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 11-100-0100000010010-1 1000100101000-1-1 0-1 101000000110-1-1 1101000-0011-1 110000--1 001 0101000-11-1 101-10 29.29 28.15 29.84 29.47 30.34 28.84 27.67 29.30 15.69 31.05 26.12 23.24 25.34 28.02 28.73 28.87 28.83 29.42 28.84 31.73 28.35 26.40 25.35 24.30 28.14 29.38 23.24
表4 回归模型方差分析
Table 4 Variance analysis of regression model
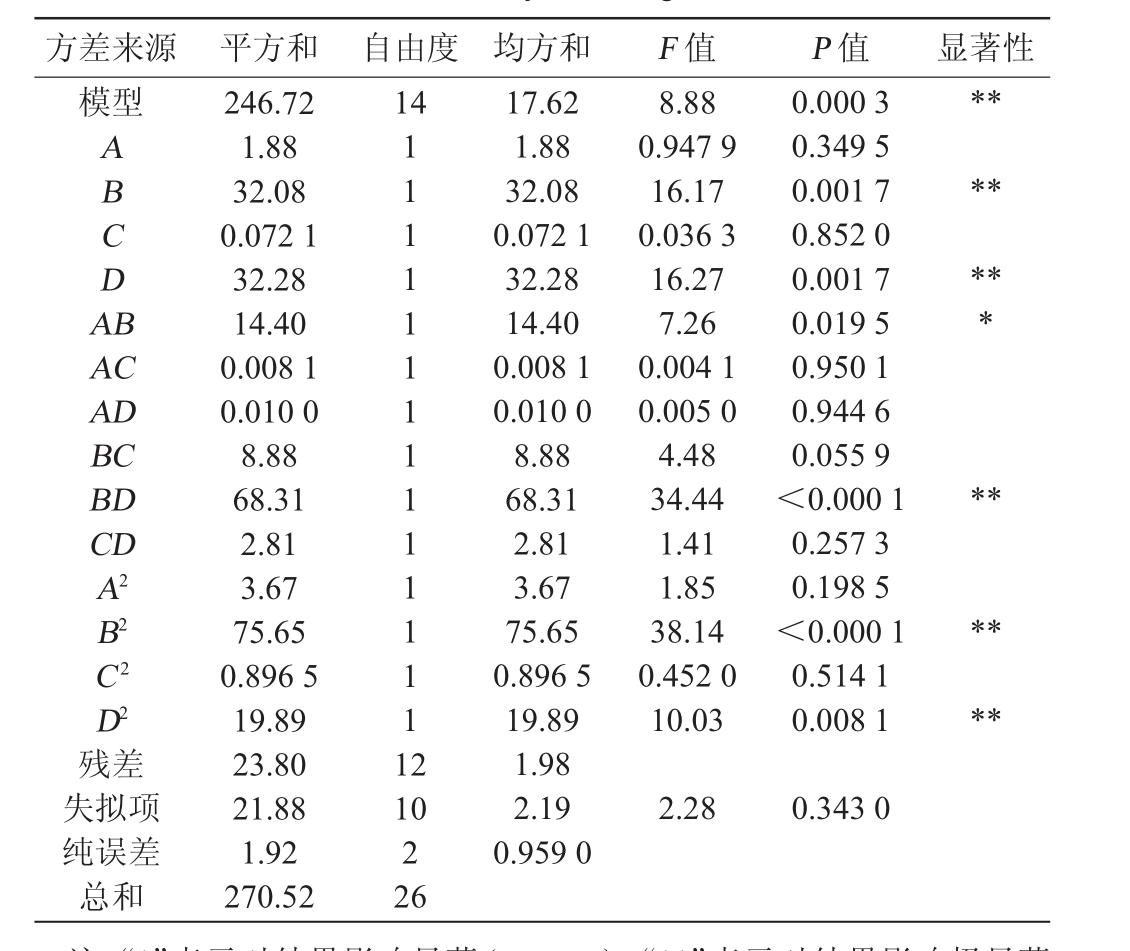
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
方差来源 平方和 自由度 均方和 F 值 P 值 显著性模型14 ABCDA B*******AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总和246.72 1.88 32.08 0.072 1 32.28 14.40 0.008 1 0.010 0 8.88 68.31 2.81 3.67 75.65 0.896 5 19.89 23.80 21.88 1.92 270.52 111111111111111 2******10 2 26 17.62 1.88 32.08 0.072 1 32.28 14.40 0.008 1 0.010 0 8.88 68.31 2.81 3.67 75.65 0.896 5 19.89 1.98 2.19 0.959 0 8.88 0.947 9 16.17 0.036 3 16.27 7.26 0.004 1 0.005 0 4.48 34.44 1.41 1.85 38.14 0.452 0 10.03 2.28 0.000 3 0.349 5 0.001 7 0.852 0 0.001 7 0.019 5 0.950 1 0.944 6 0.055 9<0.000 1 0.257 3 0.198 5<0.000 1 0.514 1 0.008 1 0.343 0
由表4可知,模型极显著(P值<0.01),失拟项不显著(P值>0.05),说明模型可行,决定系数R2为0.912 0,调整决定系数R2adj为0.809 4,表明本试验响应值总生物碱含量同各因素之间的相关性良好。变异系数(coefficientofvariation,CV)为5.11%,说明模型的重现性良好,变异程度低。由P值可知,一次项B、D,交互项BD,二次项B2、D2对结果影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),其他因素无显著影响(P>0.05)。由F值可知,影响总生物碱含量的主次顺序为初始pH值(D)>接种量(B)>装料量(A)>发酵时间(C)。
装料量、接种量、发酵时间、初始pH值各因素间交互作用对总生物碱含量影响的响应曲面及等高线见图10。由图10可知,装料量和接种量间交互作用对总生物碱含量影响较大,接种量和初始pH值间交互作用对总生物碱含量影响更大。这与方差分析结果一致。
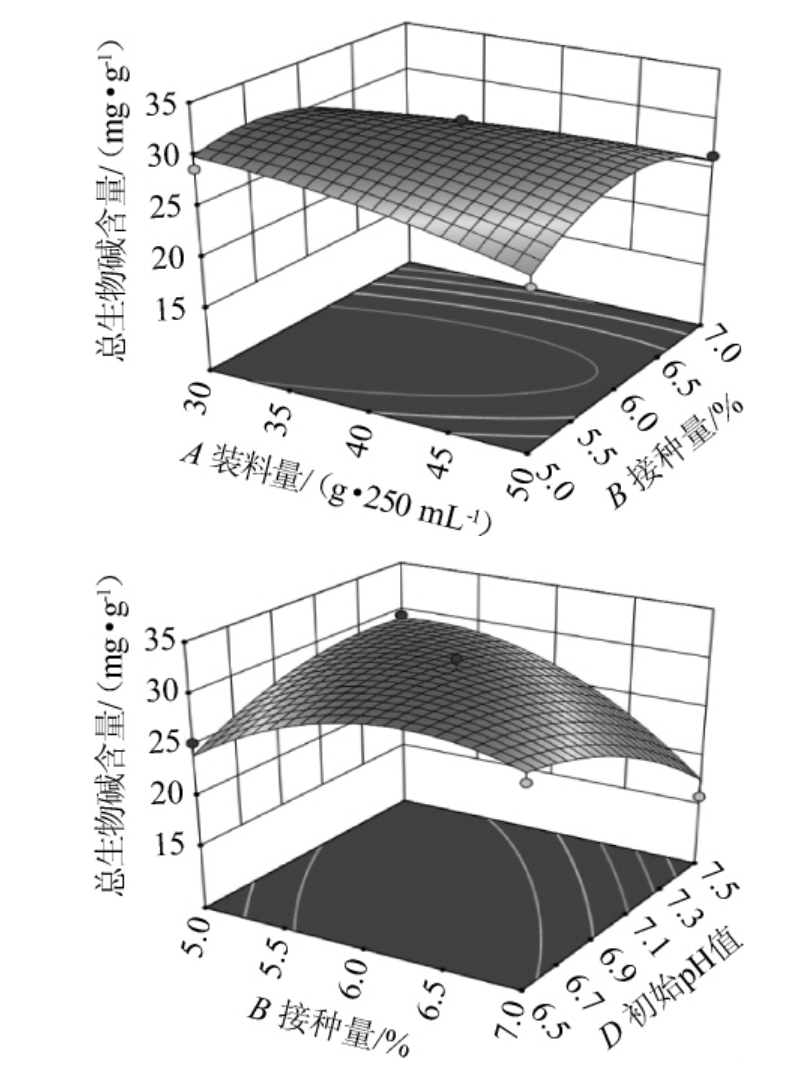
图10 各因素间交互作用对总生物碱含量影响的响应曲面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between various factors on total alkaloid content
经软件分析后可得夏桑菊中药渣的最佳发酵条件为:装料量48.669 g/250 mL,菌种接种量6.712%,发酵时间5.872 d,初始pH值6.5,在此优化条件下,总生物碱含量理论值为31.08 mg/g。考虑实际操作可行性,将夏桑菊中药渣的发酵条件修正为装料量50 g/250 mL、菌种接种量6.7%、发酵时间6 d、初始pH值6.5。进行3次平行验证试验,总生物碱含量实际值为31.15 mg/g,与理论值相差不大,为0.41%。说明该工艺可行。
3 结论
从长期堆积的夏桑菊中药渣中分离筛选一株提高夏桑菊中药渣生料中总生物碱含量的菌株L-1,其被鉴定为枯草芽孢杆菌(Bacillus subtilis),采用该菌株对夏桑菊中药渣生料进行固态发酵,以发酵产物中的总生物碱含量为评价指标,采用单因素试验和响应面试验确定其最佳发酵工艺条件为:固水比1∶1(g∶mL),装料量50 g/250 mL,接种量6.7%,发酵时间6 d,初始pH值6.5。在此优化条件下,发酵产物中总生物碱含量为31.15 mg/g。本研究结果对夏桑菊中药渣的深度开发和畜禽饲料添加剂的生产具有较好的生产指导意义。
[1]周达彪,唐懋华.中药渣农业循环利用模式产业化探讨[J].上海蔬菜,2007(6):112-114.
[2]LI H,WANG Y Y,ZHOU N,et al.Applications of calcium oxide-based catalysts in biomass pyrolysis/gasification-a review[J].J Clean Prod,2021,291:125826.
[3]CHEN L, YUAN J, LI T B, et al.A regenerable N-rich hierarchical porous carbon synthesized from waste biomass for H2S removal at room temperature[J].Sci Total Environ,2021,768:144452.
[4]KUMAR R, STREZOV V, WELDEKIDAN H, et al.Lignocellulose biomass pyrolysis for bio-oil production: a review of biomass pre-treatment methods for production of drop-in fuels[J].Renew Sust Energ Rev,2020,123:109763.
[5]张波,廖朝林,金茜,等.中药渣资源化利用研究[J].南方园艺,2016,27(2):36-38.
[6]LU Q, LI C L.Comprehensive utilization of Chinese medicine residues for industry and environment protection:Turning waste into treasure[J].J Clean Prod,2021,279:123856.
[7]安琦,曹亚彬,牛彦波,等.优化植物乳杆菌发酵黄芩药渣制备饲料添加剂的研究[J].饲料研究,2022,45(4):75-79.
[8]尹丽,梁海莲,陆万冰,等.Box-Behnken响应面法优化岗松药渣中葡萄糖的发酵工艺[J].亚太传统医药,2021,17(6):25-29.
[9]张庆明,徐云燕,陈美惠,等.灵芝菌固体发酵感冒清热颗粒药渣的主要活性物质变化研究[J].东南国防医药,2019,21(6):616-620.
[10]WEN Y L,YAN L P,CHEN C S.Effects of fermentation treatment on antioxidant and antimicrobial activities of four common Chinese herbal medicinal resi-dues by Aspergillus oryzae[J].J Food Drug Anal,2013,21(2):219-226.
[11]刘瑜彬,葛亚中,孙晓燕,等.发酵中药渣在生猪无抗养殖中的应用[J].中国食物与营养,2018,24(4):19-22.
[12]李芳蓉,李宏伟,田永峰,等.中药渣固态发酵生产蛋白饲料研究与应用[J].饲料研究,2019,42(4):94-99.
[13]侯海锋,李茜.发酵中药渣对断奶仔猪生长性能、血液生化指标、抗氧化能力及免疫功能的影响[J].中国畜牧兽医,2018,45(4):947-952.
[14]董彬厂,刘莎莎,畅文驰,等.发酵中药渣对犊牛生长发育和健康状况的影响[J].中国牛业科学,2022,48(6):14-17.
[15]王雪芳.发酵中药渣对仔猪生长性能的影响[J].中国猪业,2023,18(1):51-53.
[16]解超平.饲料中添加发酵中药渣对铁脚麻鸡肉质性状的改善[J].畜禽业,2019,30(4):9-10,12.
[17]LEI X J,YUN H M,KIM I H.Effects of dietary supplementation of natural and fermented herbs on growth performance, nutrient digestibility,blood parameters, meat quality and fatty acid composition in growingfinishing pigs[J].Ital J Anim Sci,2018,17(4):984-993.
[18]李华伟,黎智华,祝倩,等.饲粮添加中药渣和发酵中药渣对母猪繁殖性能与子代发育的影响[J].动物营养学报,2017,29(1):257-263.
[19]刘倩,罗国良,郭利,等.中药渣发酵菌剂筛选及发酵工艺优化效果研究[J].饲料工业,2024,45(4):85-94.
[20]陈鑫,李芳蓉,张建军,等.红芪药渣固态发酵生产蛋白饲料工艺条件优化[J].中国酿造,2019,38(6):176-180.
[21]夏伯候,曹艺,谢文剑,等.夏桑菊颗粒UPLC指纹图谱研究[J].中草药,2014,37(8):1463-1465.
[22]王巧琼,杨冬梅,陈临江,等.中药夏枯草化学成分及药理作用研究概述[J].广东化工,2021,48(24):6-7.
[23]王婷婷,马天宇,李琪,等.桑叶化学成分及生物活性研究进展[J].食品与药品,2018,20(5):390-393.
[24]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-370.
[25]田凤,李权,谢欣.中药百部总生物碱含量测定方法研究[J].黑龙江医药,2021,34(4):810-812.
[26]兰时乐,毛小伟,肖调义,等.菜籽粕混合菌固体发酵脱毒条件的响应面优化研究[J].动物营养学报,2013,25(3):617-627.