我国食醋多以谷物酿醋,酿造历史悠久,由于酿造工艺和原料不同造成食醋风味有所差异[1]。谷物醋经过发酵不但保留了谷物本身的营养价值,同时生成了大量生物活性成分,如有机酸、多酚、氨基酸、植物甾醇、矿物质、糖类和四甲基吡嗪等[2-3]。已知这些功能性化合物不仅可提升醋的风味,且现代科学研究已证明其在预防和治疗人类疾病中发挥重要作用[4],如抗氧化、抑菌、抗肿瘤、控制血压和抗炎等作用[5-8]。
山西老陈醋作为谷物醋的代表,凭借精湛的酿制过程及独特的熏醅和陈酿工艺位于四大名醋(山西老陈醋、镇江香醋、保宁醋、永春老醋)之首,独树一帜的酿造技艺酿制出的老陈醋不仅风味独特、品质优良,还具有良好的生物活性。山西老陈醋可调节血糖和血脂[9],其多酚提取物可以缓解氧化应激和炎症反应[10],熏醅工艺有利于提高老陈醋的抗氧化活性[11]。
多糖具有显著的免疫调节活性,在食品和医药领域有较好的开发价值[12]。张祥龙[13]研究表明,山西老陈醋中的含糖大分子单糖组成丰富,由10种单糖组成,主要成分为甘露糖、葡萄糖、木糖和阿拉伯糖,且具有免疫调节功能。本实验以山西老陈醋为原料,采用乙醇沉淀法提取多糖,采用单因素及响应面试验优化山西老陈醋多糖(Shanxi aged vinegar polysaccharide,SAVP)提取条件,对粗多糖进行脱蛋白、脱色、透析、层析柱分离纯化,并通过红外光谱对分离纯化后的多糖结构进行了初步鉴定、并进行了分子质量、单糖组成及热重分析。旨在为山西老陈醋多糖生物活性的进一步研究奠定基础,并有助于山西老陈醋保健机理的进一步阐明。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
山西老陈醋:山西紫林醋业股份有限公司。
1.1.2 化学试剂
葡萄糖、无水乙醇、苯酚、三氯乙酸(trichloroacetic acid,TCA)(均为分析纯):天津市风船化学试剂科技有限公司;牛血清蛋白(纯度≥98%):美国Roche公司;葡萄糖、甘露糖、岩藻糖、鼠李糖、木糖、阿拉伯糖、半乳糖、果糖、核糖、甘露糖醛酸、古罗糖醛酸、葡萄糖醛酸、半乳糖醛酸(均为色谱纯):美国Sigma公司;葡聚糖标准品(纯度>98%):北京Solarbio公司。其他试剂均为国产分析纯。
1.2 仪器与设备
HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;RV8旋转蒸发仪:艾卡仪器设备有限公司;Nicolet iS20傅里叶变换红外光谱仪、ICS-5000离子色谱、DionexTM CarboPacTM PA20(150 mm×3.0 mm,10 μm)色谱柱:美国赛默飞公司;TGA2热重分析仪:瑞士Mettler公司;Ifinite 200 Pro酶标仪:帝肯(上海)贸易有限公司;ALPHA 2-4 LD plus冻干机:德国Christ公司;DEAE-52纤维素层析柱(2.6 cm×30 cm)、葡聚糖凝胶G-100层析柱(1.6 cm×60 cm):北京Solarbio公司;TSK-GMPWXL色谱柱(7.8 mm×300 mm,10 μm):日本Tosoh公司。
1.3 方法
1.3.1 粗多糖提取
利用旋转蒸发仪将山西老陈醋在50 ℃条件下真空浓缩至原质量的1/2,向老陈醋浓缩物中加入一定体积无水乙醇于4 ℃下静置,并通过离心收集沉淀,经冷冻干燥(-70 ℃,12 h)后制得粗多糖。
1.3.2 多糖含量测定
多糖含量测定采用苯酚-硫酸法[14]。以葡萄糖质量浓度(x)和吸光度值(y)分别为横、纵坐标绘制标准曲线,得到葡萄糖标准曲线回归方程为:y=7.433 6x-0.002 4,相关系数R2=0.999 4。按照葡萄糖标准曲线回归方程计算样品中多糖含量,山西老陈醋多糖提取量计算公式如下:
式中:Y为多糖提取量,mg/g;m为1 mL山西老陈醋稀释液中多糖质量,mg;V为多糖提取液总体积,mL;n指稀释倍数;V1为吸取稀释液体积,mL;M为原料质量,g。
1.3.3 多糖提取条件优化
(1)单因素试验
选取醇沉时间(8 h、12 h、16 h、20 h、24 h)、乙醇溶液添加量为多糖溶液的倍数(1、2、3、4、5倍)和乙醇体积分数(75%、80%、85%、90%、95%)这3个单因素进行试验,分别考察其对山西老陈醋粗多糖提取量的影响。
(2)响应面试验
以单因素试验结果为依据,以乙醇体积分数(A)、醇沉时间(B)、乙醇倍数(C)作为自变量,以山西老陈醋多糖提取量(Y)作为响应值,采用Box-Behnken中心组合试验设计的原理,进行3因素3水平的响应面试验。响应面试验因素与水平见表1。
表1 提取条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for extraction conditions optimization

水平 A 乙醇体积分数/% B 醇沉时间/h C 乙醇倍数-1 01 85 90 95 12 16 20 345
1.3.4 粗多糖分离纯化
(1)脱蛋白
Sevag法:冻干后的粗多糖配制成8 mg/mL的溶液,取粗多糖溶液40 mL 加入1/4体积的Sevag试剂(氯仿∶正丁醇=4∶1,V/V),振荡30 min后离心(6 000 r/min,10 min)取上清液,重复多次至中间无明显乳状层。
TCA[16]法:冻干后的粗多糖配制成8 mg/mL的溶液,取40 mL粗多糖溶液加入8 mL TCA液(4 mol/L),4 ℃静置过夜后离心(8 000 r/min,10 min),收集上清液。
Sevag-TCA法:用TCA法得到的上清液继续用Sevag法处理。
比较上述粗多糖脱蛋白方法,计算蛋白去除率和多糖保留率。蛋白含量的测定采用考马斯亮蓝G-250法[15]。以牛血清蛋白质量浓度(x)和吸光度值(y)分别为横、纵坐标绘制标准曲线,得到牛血清蛋白标准曲线方程为y=0.004 2x+0.011 5,相关系数R2=0.995 2。蛋白质去除率及多糖保留率计算公式如下:
式中:A1、A2分别代表脱蛋白前后多糖溶液中的蛋白质含量,mg/g;B1、B2分别代表蛋白去除前后多糖溶液中的多糖含量,mg/g。
(2)脱色
活性炭法:将活性炭用蒸馏水清洗并过滤,烘干至恒质量。取经脱蛋白后多糖溶液添加2%的活性炭于55 ℃水浴搅拌2 h,收集上清液。
AB-8大孔树脂法:取200 mL经脱蛋白处理后的多糖溶液,向其中加入2%的AB-8大孔树脂,45 ℃恒温摇床中200 r/min匀速振荡1.5 h,收集上清液。
硅藻土法[17]:振荡条件为45 ℃恒温摇床中200 r/min匀速振荡1.5 h,收集上清液。
比较上述方法,计算脱色率和多糖保留率。脱色率及多糖保留率计算公式如下:
式中:C1、C2分别代表脱色前后多糖溶液吸光度值;D1、D2分别代表脱色前后多糖溶液中的多糖含量,单位mg/g。
(3)透析
经过脱蛋白、脱色处理的粗多糖溶液经浓缩后装入处理好的透析袋(截留分子质量3 500 Da)中,蒸馏水透析36 h,期间更换3次蒸馏水。透析后经浓缩、冷冻干燥得精多糖。
(4)柱层析
DEAE-52纤维素柱层析[18]:将10 mL精多糖溶液(精多糖加蒸馏水配制为10 mg/mL溶液)上样至处理好的DEAE-52纤维素层析柱(2.6 cm×30 cm)中,以蒸馏水和0.1 mol/L、0.3 mol/L、0.5 mol/L的NaCl溶液作为洗脱液依次洗脱,调节流速为2.5 mL/min,每管收集6 mL,并采用苯酚-硫酸法测定每管稀释后的吸光度值,绘制洗脱曲线。
Sephadex G-100柱层析:将SAVP-1(经DEAE-52柱层析分离收集得到的组分)配制成质量浓度为6mg/mL的溶液,经微孔滤膜(0.45μm)过滤,上样至处理好的SephadexG-100凝胶柱中,用超纯水洗脱,流速为0.4 mL/min,每管收集3 mL,利用苯酚-硫酸法测定每管多糖含量。根据洗脱峰收集纯化后多糖组分,冷冻干燥(-50 ℃,12 h)后备用。
1.3.5 SAVP-1结构鉴定
(1)分子质量测定
采用高效凝胶色谱法[19]测定SAVP-1分子质量。配制不同分子质量的葡聚糖标准品溶液经滤膜过滤后进样,以保留时间(retention time,RT)(x,min)为横坐标,分子质量的对数值(y,lg Mw)为纵坐标绘制葡聚糖标准曲线,根据标准曲线回归方程计算SAVP-1分子质量。色谱条件:TSKGMPWXL色谱柱;柱温为35 ℃;流动相为超纯水;流速1 mL/min;进样量20 μL。
(2)红外光谱分析
称取1 mg SAVP-1和100 mg KBr研细均匀后压片,将样片放入红外光谱仪中测试,波数范围4 000~400 cm-1。
(3)单糖组成分析
单糖组成测定参考方法[20]并稍作修改。称取5.06 mg SAVP-1,加入1mL2 mol/L三氟乙酸溶液,加热(121 ℃,2 h)。通氮气,吹干后,加入甲醇清洗,再吹干(重复2次);加入无菌水溶解,转入色谱瓶中待测。离子色谱条件:采用DionexTM CarboPacTM PA20色谱柱(150 mm×3.0 mm,10 μm);进样量5 μL;流速0.5 mL/min;柱温30 ℃;流动相A:水;流动相B:0.1mol/LNaOH,流动相C:0.1mol/LNaOH和0.2mol/LNaAc。
(4)热重分析
称取10 mg 纯化后多糖组分SAVP-1,载气为氮气(N2),升温范围设为30~800 ℃,升温速率设为10 ℃/min 进行热重分析。
1.3.6 数据处理
试验进行3次重复,采用Design-Expert 8.0.6进行响应面试验设计和数据分析、Origin 8.0软件作图。
2 结果与分析
2.1 多糖提取条件优化
2.1.1 单因素试验结果
由图1a可知,多糖提取量随乙醇体积分数逐渐增大,多糖提取量呈现先升高后降低的趋势。当乙醇体积分数为75%~90%时,多糖提取量随之增加;当乙醇体积分数为90%时,多糖提取量最大,为13.94 mg/g;当乙醇体积分数>90%之后,多糖提取量随之下降。由于乙醇可降低水的介电常数,在多糖溶液中加入乙醇后可产生沉淀,当乙醇体积分数过小时只能析出部分多糖,体积分数过大时会导致体系中多糖量减少,不利于多糖饱和析出[21]。因此,最适乙醇体积分数为90%。由图1b可知,当醇沉时间为8~16 h时,多糖提取量的增幅较大;当醇沉时间为16 h时,多糖提取量最大,为10.69 mg/g;当醇沉时间>16 h之后,多糖提取量趋于平缓。时间过短使多糖溶液和乙醇接触不充分,随时间延长可能会沉降出蛋白、淀粉等物质。因此,最适醇沉时间为16 h。由图1c可知,随着乙醇倍数在1~4倍的范围内增加,多糖提取量随之增加;当乙醇倍数为4倍时,多糖提取量最大,为9.22 mg/g;当乙醇倍数>4倍之后,多糖提取量变化不明显。因此,最适乙醇添加量为多糖溶液的4倍。
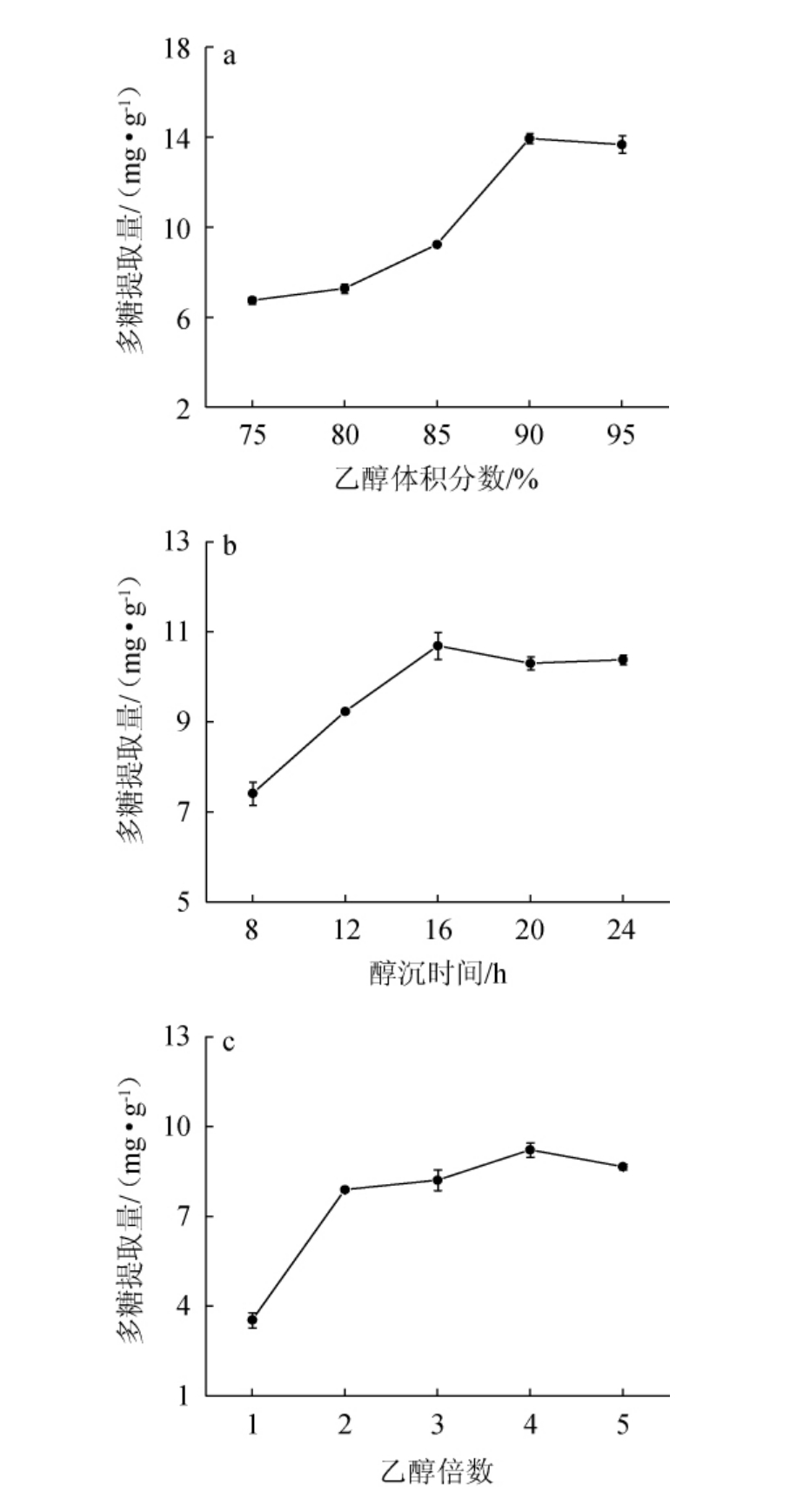
图1 提取条件优化单因素试验结果
Fig.1 Results of single factor experiments for extraction conditions optimization
2.1.2 响应面试验结果
在单因素试验基础上,以乙醇体积分数(A)、醇沉时间(B)、乙醇倍数(C)作为自变量,以山西老陈醋多糖提取量(Y)作为响应值,采用Box-Benhnken试验设计的原理,进行3因素3水平的响应面试验。响应面试验设计结果见表2,方差分析结果见表3。
表2 提取条件优化Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments design for extraction conditions optimization
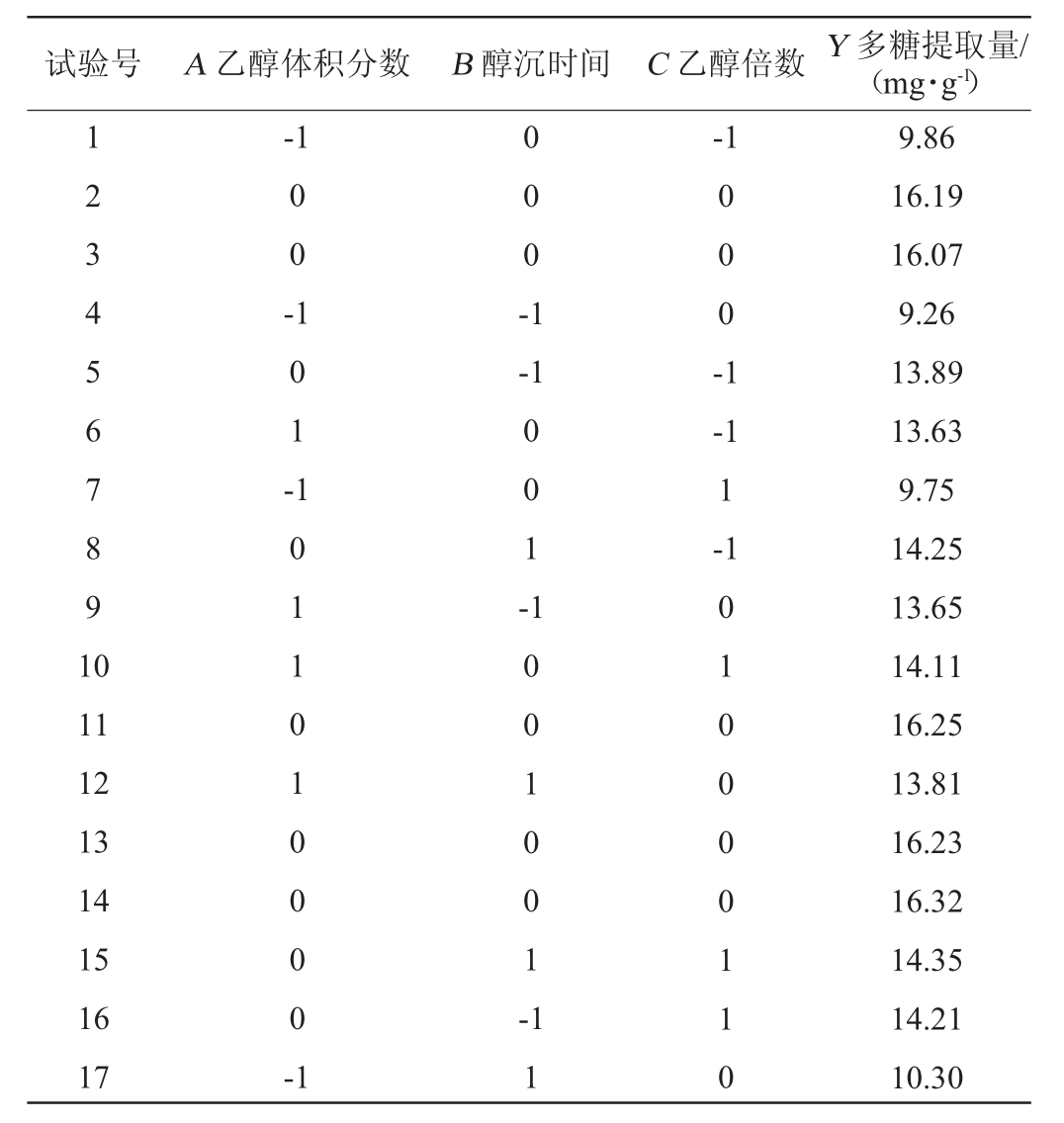
试验号 A 乙醇体积分数 B 醇沉时间 C 乙醇倍数Y 多糖提取量/(mg·g-1)1 2 3 4 5 6 7 8 9 1 0-1-1 0 0 -1 0 1 -0 0 0 -1-1 0 0 0 -1 1 0 1 1 0 1 0 0 0 0 -1 0 0 1 --1 1-1 11 12 13 14 15 16 17 1 0 0 1 0 0 1 -1 1 0 1 0 0 0 0 1 1 0 9.86 16.19 16.07 9.26 13.89 13.63 9.75 14.25 13.65 14.11 16.25 13.81 16.23 16.32 14.35 14.21 10.30
表3 回归模型方差分析
Table 3 Variance analysis of regression model
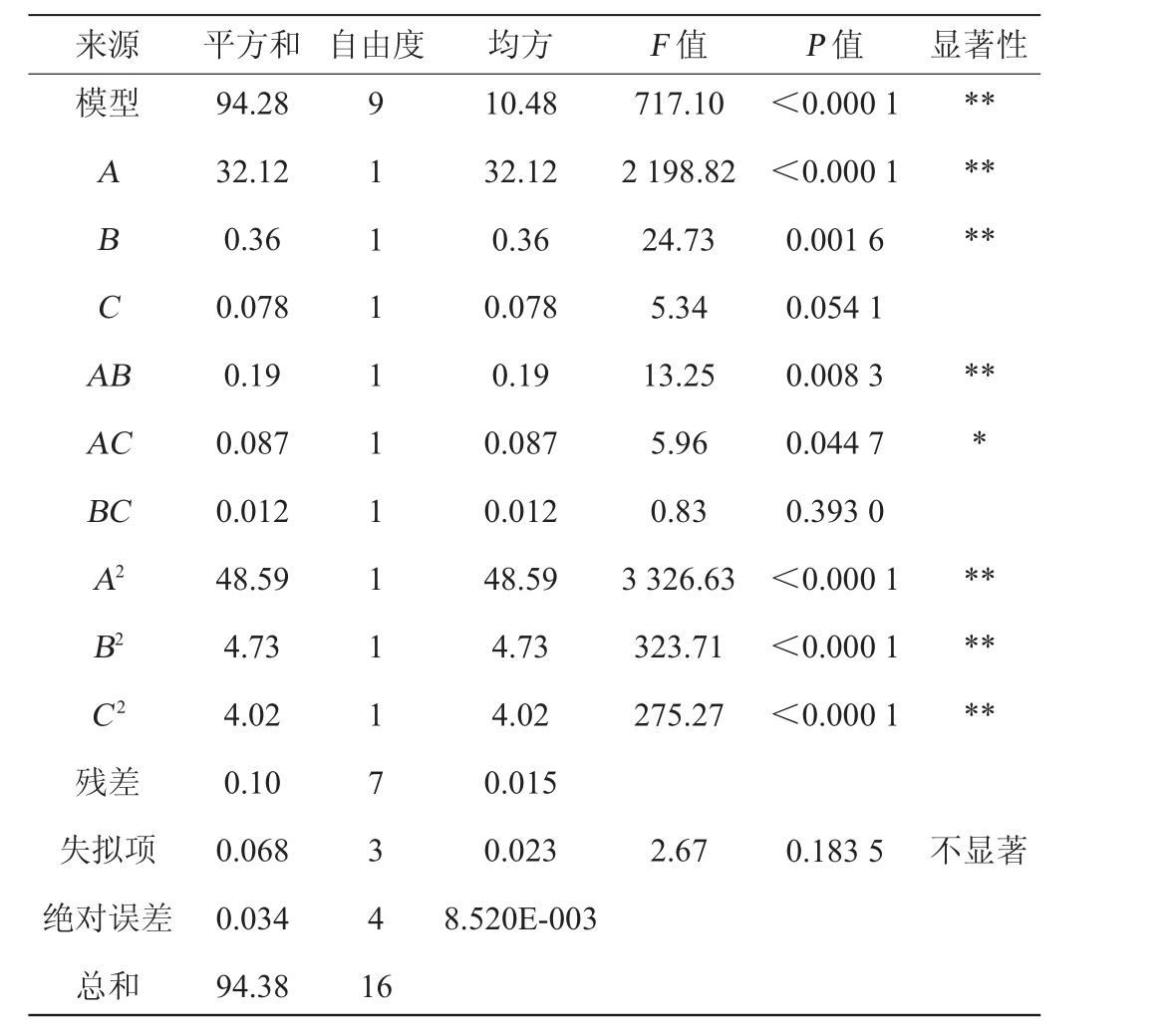
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型A BC A B******AC BC A2 B2 C2残差失拟项绝对误差总和94.28 32.12 0.36 0.078 0.19 0.087 0.012 48.59 4.73 4.02 0.10 0.068 0.034 94.38 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 10.48 32.12 0.36 0.078 0.19 0.087 0.012 48.59 4.73 4.02 0.015 0.023 8.520E-003 717.10 2 198.82 24.73 5.34 13.25 5.96 0.83 3 326.63 323.71 275.27<0.000 1<0.000 1 0.001 6 0.054 1 0.008 3 0.044 7 0.393 0<0.000 1<0.000 1<0.000 1*********2.67 0.183 5不显著
采用Design-Expert 8.0.6软件对表2试验数据进行拟合分析得到二次多项回归方程为:
由表3可知,该响应面模型的P值<0.01、失拟项P=0.183 5>0.05,说明该模型具有很强的显著性,失拟项不显著说明模型与实际情况能较好地拟合。模型的决定系数R2为0.998 9,调整决定系数R2adj为0.997 5,表明该模型拟合度高。根据P值大小可知,一次项A、B、交互项AB、二次项A2、B2、C2对多糖提取量影响极显著(P<0.01),交互项AC对结果影响显著(P<0.05),一次项C、交互项BC对结果影响不显著(P>0.05)。由F值可知,各因素对山西老陈醋多糖提取影响程度由大到小为:A(乙醇体积分数)>B(醇沉时间)>C(乙醇倍数)。
2.1.3 交互作用分析
响应曲面图中的曲面陡峭程度与因素对多糖提取量的影响大小有关[22]。各因素间交互作用对结果影响的响应面及等高线见图2。由图2可知,随着乙醇体积分数和醇沉时间的增加多糖提取量先升高后降低,随乙醇体积分数变化呈现的幅度较大,两因素对提取量的交互作用影响显著;当其他条件不变时,乙醇体积分数与乙醇倍数所得到的3D图曲面偏陡,在乙醇体积分数为89%~91%范围内和乙醇倍数为4倍附近时多糖提取量逐步增到最大值;在醇沉12~20 h、乙醇倍数3~5倍区间内,提取量变化量不大,曲面平缓。这与方差分析结果一致。
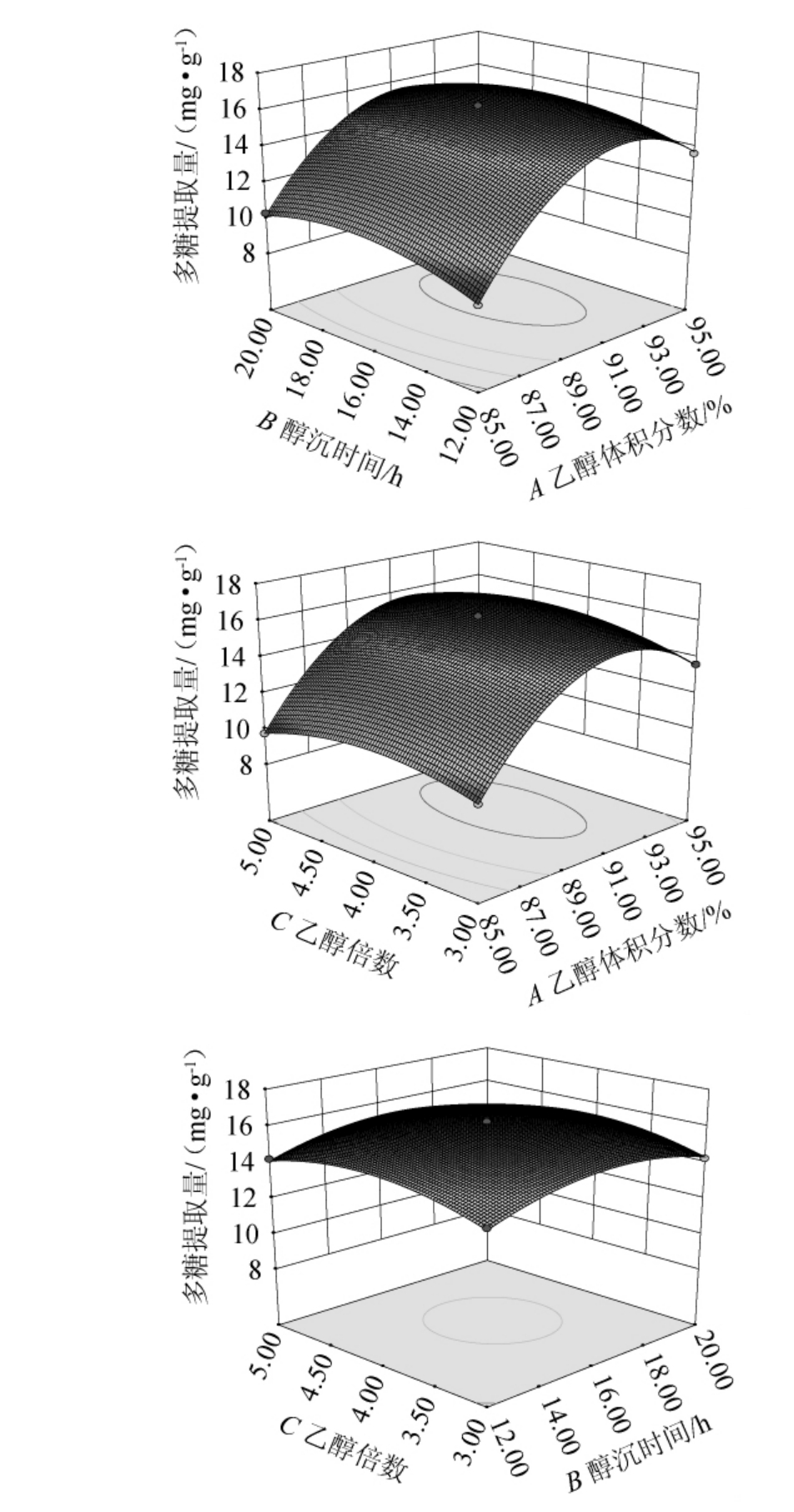
图2 各因素间交互作用对多糖提取量影响的响应面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between various factors on the extraction amount of polysaccharides
2.1.4 验证试验
经Design-Expert 8.0.6软件优化得到的最优多糖提取条件为乙醇体积分数91.47%、醇沉时间16.27 h、乙醇倍数4.07倍。在此条件下,多糖提取量理论值为16.52 mg/g。结合实际操作可行性,将多糖提取条件修正为:乙醇体积分数91%、醇沉时间16.3 h、乙醇倍数4倍。该条件下进行3次平行验证试验,多糖提取量实际值为16.48 mg/g,与理论值接近,表明该模型有效。
2.2 脱蛋白处理
以蛋白去除率和多糖保留率为评价指标筛选出最优脱蛋白方法,结果如图3所示,Sevag法虽脱除率较高,但需重复多次,费时且试剂损耗量较大;Sevag-TCA法同TCA法相比,多糖保留率无差异,但TCA法蛋白去除率仅为52.32%。故选用Sevag-TCA法进行脱蛋白处理,不仅可减少试验次数且脱除效果好,其蛋白去除率为74.65%,多糖保留率为77.87%。
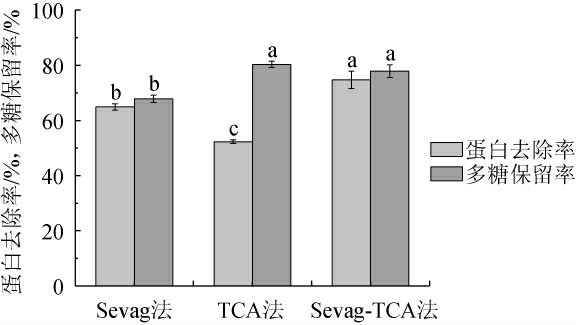
图3 粗多糖脱蛋白方法比较
Fig.3 Comparison of deproteinization methods of crude polysaccharide
字母不同表示差异显著(P<0.05)。下同。
2.3 脱色处理
由图4可知,多糖溶液使用活性炭法处理后其多糖损失率显著高于另外两种方法(P<0.05),是由于活性炭在吸附色素同时也会吸附多糖;硅藻土法脱色效果不佳,且本身不易处理;大孔树脂法对多糖溶液进行脱色处理,其脱色率为64.02%,多糖保留率为84.55%,故选择大孔树脂法进行脱色处理,其优点是吸附效果好,操作简便[23]。
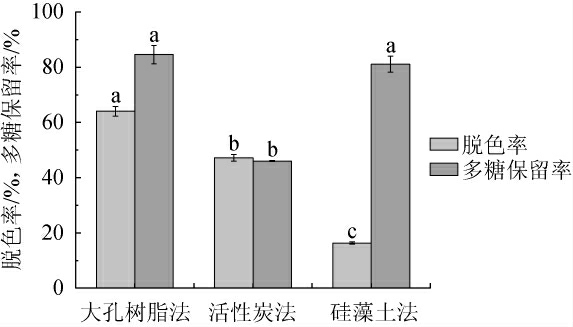
图4 粗多糖脱色方法比较
Fig.4 Comparison of decolorization methods of crude polysaccharide
2.4 柱层析
2.4.1 DEAE-52柱层析
将经过脱蛋白、脱色、透析后得到的山西老陈醋精多糖过DEAE-52纤维素柱,洗脱曲线如图5所示,得到三个对称的洗脱峰,即用蒸馏水、0.1 mol/LNaCl和0.3 mol/LNaCl洗脱得到的三种多糖组分A、B、C,分别命名为:多糖组分SAVP-1、多糖组分SAVP-2、多糖组分SAVP-3。后续实验针对含量最多的多糖组分SAVP-1继续研究。
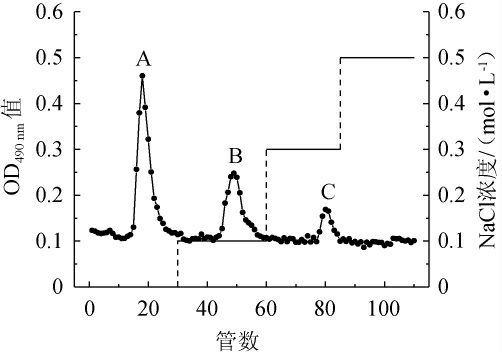
图5 山西老陈醋精多糖DEAE-52纤维素柱洗脱曲线
Fig.5 Elution curve of refined polysaccharide in Shanxi aged vinegar with DEAE-52 cellulose column
2.4.2 葡聚糖柱层析
多糖组分SAVP-1经Sephadex G-100凝胶柱层析洗脱,洗脱曲线如图6所示,得到的曲线单一并较为对称色谱峰,表明SAVP-1是纯的多糖组分。
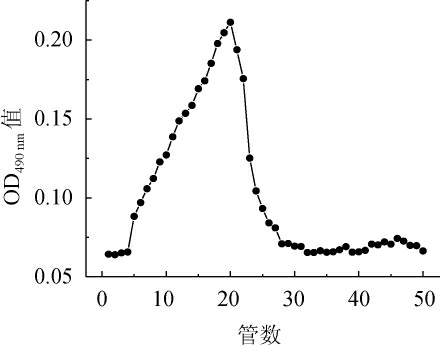
图6 山西老陈醋多糖组分AVP-1Sephadex G-100色谱柱洗脱曲线
Fig.6 Elution curve of polysaccharide fraction SAVP-1 in Shanxi aged vinegar with Sephadex G-100 chromatographic column
2.5 多糖组分SAVP-1结构鉴定
2.5.1 分子质量测定
经计算得到重均分子质量Mw对数值(lgMw)-保留时间(RT)的葡聚糖标准曲线回归方程为:y=-1.100 4x+14.181,相关系数R2=0.998 4。对山西老陈醋多糖组分SAVP-1进行分子质量检测,得到色谱图结果见图7。由图7可知,洗脱峰单一且对称,根据标准曲线回归方程计算得山西老陈醋多糖组分SAVP-1的分子质量为6.87 kDa。

图7 山西老陈醋多糖组分SAVP-1高效凝胶色谱图
Fig.7 High efficiency gel chromatogram of polysaccharide fraction SAVP-1 in Shanxi aged vinegar
2.5.2 红外光谱分析
由图8可知,多糖组分SAVP-1在波数3387.54cm-1处有宽而高的吸收峰,是由羟基伸缩振动引起,在波数2 930.35 cm-1处的吸收峰是烷烃C-H的伸缩振动所致,均为糖类物质的特征吸收峰。波数1 668.05 cm-1处的吸收峰由羧基官能团中的C═O的拉伸引起[24],在波数1 400.64 cm-1处的吸收峰是由于C-H弯曲振动引起;在波数1 152.35 cm-1、1 078.59 cm-1和1 026.84 cm-1存在三个吸收峰,是由于醚键(C-O-C)和羟基(-OH)的伸缩振动引起,说明SAVP-1具有吡喃环结构[25];在波数839.94 cm-1处的吸收峰说明糖苷键为α-D-吡喃糖苷键,同时在波数575.399 cm-1处存在α-糖苷键的特征吸收峰[26],表明多糖组分SAVP-1为α-型多糖。
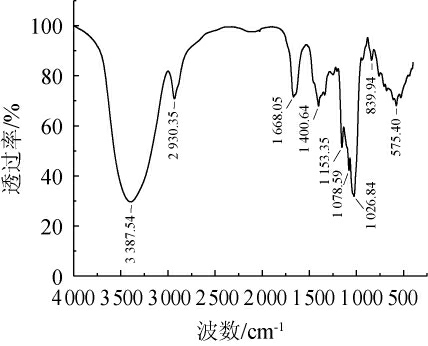
图8 山西老陈醋多糖组分SAVP-1红外光谱图
Fig.8 Infrared spectrogram of polysaccharide fraction SAVP-1 in Shanxi aged vinegar
2.5.3 单糖组成
混合单糖标准品和多糖组分SAVP-1离子色谱分析结果见图9。由图9可知,多糖组分SAVP-1中含有的单糖包括鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖,其主要成分为葡萄糖。并通过计算得其摩尔比分别为0.36∶6.53∶3.09∶71.86∶13.97∶4.2。
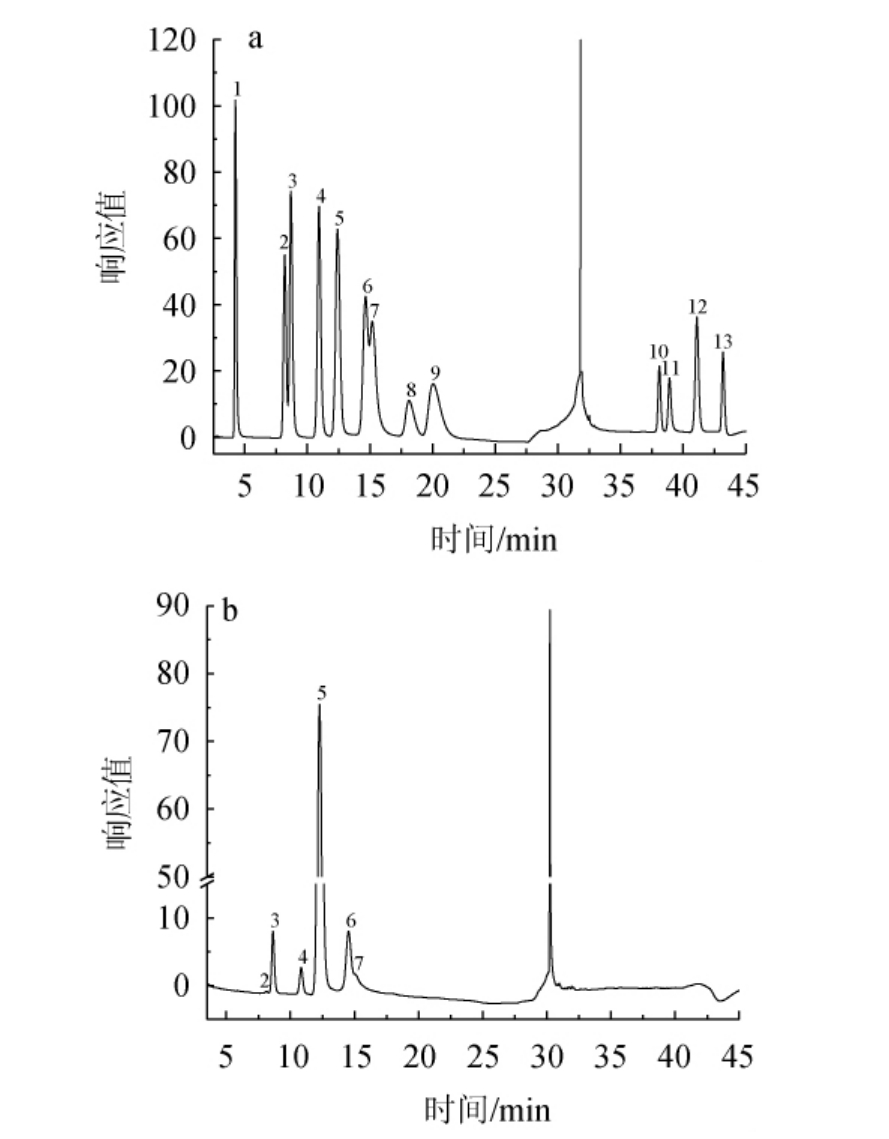
图9 单糖混标(a)和山西老陈醋多糖组分SAVP-1(b)离子色谱图
Fig.9 Ion chromatograms of monosaccharide mixture standards (a) and polysaccharide fraction SAVP-1 in Shanxi aged vinegar (b)
1.岩藻糖;2.鼠李糖;3.阿拉伯糖;4.半乳糖;5.葡萄糖;6.木糖;7.甘露糖;8.果糖;9.核糖;10.半乳糖醛酸;11.古罗糖醛酸;12.葡萄糖醛酸;13.甘露糖醛酸。
2.5.4 热重分析
山西老陈醋多糖组分SAVP-1热重分析结果见图10。由图10可知,第一阶段是室温至136 ℃,样品质量损失率为12%,主要是由多糖分子中水分丢失引起;第二阶段是136~579 ℃,质量损失率为61.21%,该阶段可能是由于多糖组分SAVP-1的结构和化学键遭到破坏导致质量损失率达到最大,在255.83℃热质量损失率达到最大;第三阶段579~800℃质量损失率下降程度平缓,最终质量损失率达到78.6%,第二、三阶段质量损失和多糖结构解聚和热分解相关[27]。综上所述,多糖组分SAVP-1在136 ℃下热稳定性较好。
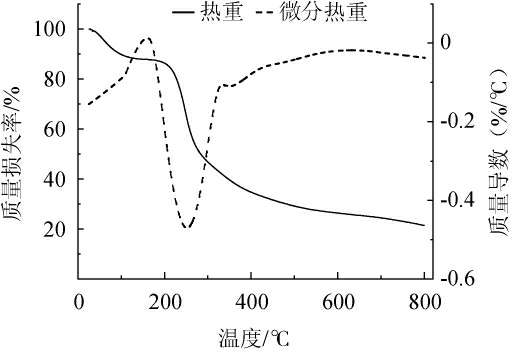
图10 山西老陈醋多糖组分SAVP-1热重分析
Fig.10 Thermogravimetric analysis of polysaccharide fraction SAVP-1 in Shanxi aged vinegar
3 结论
本研究通过单因素及响应面试验优化对山西老陈醋粗多糖提取条件,确定最适提取条件为乙醇体积分数91%,醇沉时间16.3 h,乙醇倍数4倍。在此优化条件下,粗多糖提取量为16.48 mg/g。使用Sevag-TCA法蛋白去除率为74.65%,使用大孔树脂法脱色操作简便且脱色率可达60.02%。初步纯化得到的精多糖通过DEAE-52纤维素柱洗脱后得到3个多糖组分SAVP-1、SAVP-2及SAVP-3,SAVP-1又经葡聚糖柱层析进一步纯化用于初步结构鉴定。SAVP-1具有多糖特征吸收峰,为α-型多糖,分子质量为6.87 kDa,其主要单糖组成为鼠李糖、阿拉伯糖、半乳糖、葡糖糖、木糖和甘露糖,摩尔比分别为0.36∶6.53∶3.09∶71.86∶13.97∶4.2,其中葡萄糖含量最高。热重分析表明其热稳定性较好。该研究为进一步研究山西老陈醋多糖体外功能活性奠定了基础,有助于揭示山西老陈醋保健功效。
[1]王宗敏,白桦,王辛禹,等.食醋中功能物质及其研究进展[J].食品科学,2023,44(11):196-204.
[2]KANDYLIS P, BEKATOROU A, DIMITRELLOU D, et al.Health promoting properties of cereal vinegars[J].Foods,2021,10(2):344.
[3]吴子航,张祥龙,刘丹彤,等.中国传统食醋营养健康物质组成研究进展[J].中国酿造,2022,41(12):9-14.
[4]HINDI N.In vitro antibacterial activity of aquatic garlic extract,apple vinegar and apple vinegar-garlic extract combination[J].Am J Phytomedicine Clin Therap,2013,1(1):42-51.
[5]XIA T, ZHANG B, DUAN W H, et al.Nutrients and bioactive components from vinegar:A fermented and functional food[J].J Funct Foods,2020,64:103681.
[6]XIE X L,ZHENG Y,LIU X,et al.Antioxidant activity of Chinese Shanxi aged vinegar and its correlation with polyphenols and flavonoids during the brewing process[J].J Food Sci,2017,82(10):2479-2486.
[7]SHEN F G,FENG J X,WANG X H,et al.Vinegar treatment prevents the development of murine experimental colitis via inhibition of inflammation and apoptosis[J].J Agr Food Chem,2016,64(5):1111-1121.
[8]YAO L L,CAO J R,LYU C J,et al.Food-grade γ-aminobutyric acid production by immobilized glutamate decarboxylase from Lactobacillus plantarum in rice vinegar and monosodium glutamate system[J].Biotechnol Lett,2021,43:2027-2034.
[9]丁月娣,闫裕峰,陈亨业,等.浓缩山西老陈醋对高脂血症小鼠血脂及血糖的调节作用[J].食品工业科技,2020,41(12):286-290.
[10]DU P,ZHOU J H,ZHANG L,et al.GC×GC-MS analysis and hypolipidemic effects of polyphenol extracts from Shanxi-aged vinegar in rats under a high fat diet[J].Food Funct,2020,11(9):7468-7480.
[11]郭李云,倪文杰,杨小兰.熏醅对山西老陈醋抗氧化活性的影响[J].中国酿造,2015,34(2):34-37.
[12]陈诺,席文杰,胡美芬,等.多糖免疫调节作用与结构关系研究进展[J].中国中药杂志,2023,48(10):2667-2678.
[13]张祥龙.山西老陈醋含糖大分子及其免疫活性研究[D].天津:天津科技大学,2022.
[14]程亚楠.多花黄精多糖提取纯化、结构表征及其体外益生活性研究[D].南昌:南昌大学,2023.
[15]胡庆娟,吴光杰,牛庆川,等.响应面试验优化木瓜蛋白酶法脱马齿苋多糖蛋白工艺[J].食品科学,2018,39(20):246-252.
[16]闻志莹,蔡为荣,许永,等.香椿子多糖脱蛋白脱色工艺及其体外抗凝血活性研究[J].安徽工程大学学报,2020,35(1):26-33.
[17]黎英,蔡淑鑫,陈雪梅,等.百香果皮果胶脱色工艺优化及体外抗氧化活性研究[J].食品科技,2022,47(8):214-220.
[18]陈越.龙葵果多糖的提取及其抗氧化活性的研究[D].长春:长春工业大学,2022.
[19]范信晖,李科,杨一丹,等.黄芪多糖中抗炎组分的结构及其活性的初步研究[J].山西医科大学学报,2021,52(10):1346-1356.
[20]ZHU M Q,HUANG R M,WEN P,et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano(Cucumis metuliferus)peels[J].Carbohydr Polym,2021,254:117371.
[21]曹甜,刘晓艳,刘露,等.客家黄酒多糖提取工艺的优化及其抗氧化活性研究[J].食品工业,2018,39(10):40-45.
[22]SHANG H M,ZHOU H Z,LI R,et al.Extraction optimization and influences of drying methods on antioxidant activities of polysaccharide from cup plant(Silphium perfoliatum L.)[J].PloS One,2017,12(8):e0183001.
[23]刘冲英,周宁,崔涛,等.响应面法优化大孔树脂纯化地黄多糖工艺[J].食品工业科技,2021,42(6):202-207,232.
[24]陈树俊,崔云.甘薯渣多糖提取、结构鉴定及体外功能研究[J].中国粮油学报,2021,36(9):67-73.
[25]陈树俊,李佳益,王翠连,等.黄梨渣多糖的提取、分离纯化和结构鉴定[J].食品科学,2018,39(20):278-286.
[26]WU J,CHEN R Z,TAN L,et al.Ultrasonic disruption effects on the extraction efficiency,characterization,and bioactivities of polysaccharides from Panax notoginseng flower[J].Carbohydr Polym,2022,291:119535.
[27]WANG B H, CAO J J, ZHANG B, et al.Structural characterization,physicochemical properties and α-glucosidase inhibitory activity of polysaccharide from the fruits of wax apple[J].Carbohydr Polym,2019,211:227-236.