中国白酒作为世界六大蒸馏酒之一,在一代代酿造者的精心调和下,形成了醇香浓郁、柔和均衡的独特风味[1]。清香型白酒作为我国四大香型(浓、清、酱、米)白酒之一,区别于其他香型,其风味清香醇甜,深受消费者喜爱[2-5]。清香型白酒以高粱为主要原料,选用酒曲为发酵剂,通过清蒸清烧工艺,经地缸式发酵、蒸馏、贮存和勾兑而成[6-7]。清香型白酒中最显著的香气特征为花果香气,这些香气主要由酯类物质贡献,包括乙酸乙酯、乙酸苯乙酯、丁酸乙酯、戊酸乙酯、己酸乙酯、乳酸乙酯和辛酸乙酯等,其中主体呈香物质为乙酸乙酯[8-9]。
白酒中的乙酸乙酯主要由产酯微生物代谢生成[10-11]。产酯微生物主要包括细菌、霉菌及酵母。其中,产酯酵母是一类具备强大酯化能力的酵母总称,生成的香气物质包括酯类、醇类、酸类、酮类、芳香族类等[12-13]。因此,产酯酵母是白酒产生香气的重要微生物之一。有研究表明,在白酒发酵过程中使用高效产酯酵母能够显著提高白酒中总酯的含量[14-17]。随着对微生物了解的不断深入,越来越多的酒厂开始培育高质量的产酯酵母,以显著提升成酒的品质。刘小改等[18]从清香型白酒酒曲中分离出一株高产乙酸乙酯酵母菌株J-4,并将其应用于麸曲白酒酿造,使原酒中乙酸乙酯的含量增加50.7%。目前在提高清香型白酒中乙酸乙酯含量方面已取得了一定研究成果,但仍无法达到企业生产目标[19]。
本研究以实验室保藏的分离自酒厂不同酒曲和窖泥中的6株产酯酵母菌株为研究对象,通过乙酸乙酯含量的测定从中筛选一株高产乙酸乙酯的酵母菌株。通过形态观察和分子生物学技术对筛选菌株进行鉴定,并以乙酸乙酯产量为响应值,通过单因素试验和响应面试验优化筛选菌株的最佳发酵条件,以期为深入了解产酯酵母的特性以及改善白酒的风味提供重要的基础和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株酵母菌株P-1~P-6:分离自酒厂不同酒曲和窖泥,保藏于本实验室。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose agar,YEPD)固体培养基[20]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸膏10 g/L,琼脂20 g/L,115 ℃高压蒸汽灭菌20 min。YEPD液体培养基:YEPD固体培养基中不添加琼脂。
产酯培养基[21]:葡萄糖80 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH 6.0,115 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
葡萄糖、蛋白胨、酵母浸粉、酵母浸膏、无水硫酸钠、正己烷、HCl、无水乙醇、无水乙酸、乙酸戊酯(均为生化试剂或分析纯):国药集团化学试剂有限公司。酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、琼脂糖凝胶DNA回收试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)Buffer、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTP)、Taq DNA聚合酶:天根生化科技(北京)有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
7890B-5977B气相色谱-质谱联用仪、DB-Wax石英毛细管色谱柱(30 m×0.25 mm×0.25 μm):安捷伦科技有限公司;PHS-25酸度计:上海仪电科学仪器有限公司;DM1000 LED生物显微镜:德国徕卡公司:LS-75LD立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;DNP-9022电热恒温培养箱:上海精宏实验设备有限公司;CTH1680R台式高速冷冻离心机:湖南湘立科学仪器有限公司;HNYC-203T恒温摇床:天津欧诺仪器股份有限公司;Vortex-BE1漩涡混合器:海门市其林贝尔仪器制造有限公司;XB3200C电子天平:普利赛斯称重设备有限公司;PowerPacTMBasic电泳仪、S1000TMThermal cycler梯度PCR仪、Gel DocTMXR+凝胶成像系统:美国伯乐公司。
1.3 方法
1.3.1 产乙酸乙酯酵母菌株的筛选
取一环酵母菌株接种于YEPD液体培养基中,在30 ℃条件下活化培养24 h后,取5 mL菌液接种于50 mL产酯培养基中,27 ℃恒温培养3 d。在发酵液中加入体积分数12%的无水乙醇和0.5 mL无水乙酸,置于27 ℃恒温培养24 h后,测定发酵液中的乙酸乙酯含量。
1.3.2 高产乙酸乙酯酵母菌株的鉴定
形态学观察:采用划线法将菌株P-3接种到YEPD培养基中,30 ℃条件下培养4 d,每天观察菌落形态。在载玻片上滴加一滴无菌水,挑取少量菌体与无菌水混合均匀,盖上盖玻片,置于显微镜下观察菌株。
分子生物学鉴定:采用酵母基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对菌株的ITS rDNA基因序列进行PCR扩增,PCR扩增体系:10×PCRbuffer2μL;引物各1μL;DNA模板1 μL;Taq DNA聚合酶0.5 μL;dNTPs 1 μL;双蒸水(ddH2O)13.5 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30s,56 ℃退火30 s,72 ℃延伸1 min,共33次循环;72 ℃再延伸5 min;16 ℃恒温5 min。将PCR扩增产物采用1%琼脂糖凝胶电泳检测合格后,委托武汉擎科生物科技有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性检索分析。选取同源性较高的模式菌株的ITS基因序列,采用MEGA 6.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.3 产酯条件优化单因素试验
在1.3.1的基础上,通过改变单一条件,考察发酵温度(24 ℃、27 ℃、30 ℃、33 ℃、36 ℃)、初始pH(3、4、5、6、7)、发酵时间(2 d、3 d、4 d、5 d、6 d)及乙醇体积分数(12%、14%、16%、18%、20%)对筛选菌株产乙酸乙酯的影响[22-23],以此确定最佳产酯条件。
1.3.4 产酯条件优化响应面试验
根据单因素试验结果,选择对结果影响较大的因素发酵温度(A)、发酵时间(B)、乙醇体积分数(C)为自变量,以乙酸乙酯产量(Y)为响应值,采用Design Expert v13.0.5.0软件设计3因素3水平的响应优化试验[24-26],Box-Behnken试验因素与水平见表1。
表1 产酯条件优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for ester production conditions optimization
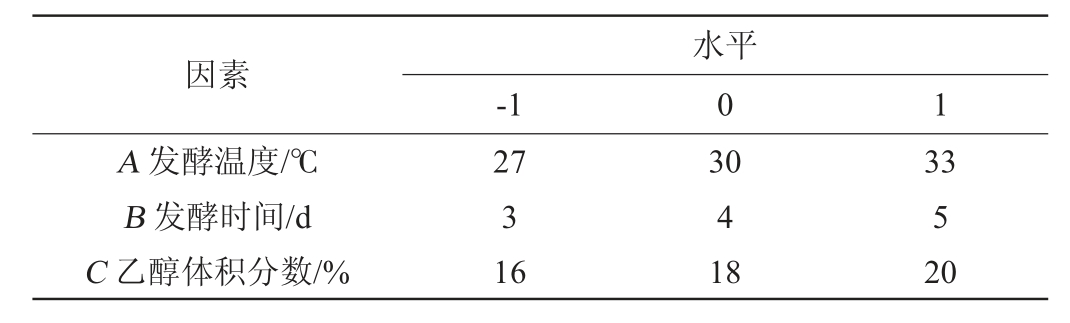
因素A 发酵温度/℃B 发酵时间/d C 乙醇体积分数/%-1水平0 1 27 3 16 30 4 18 33 5 20
1.3.5 乙酸乙酯含量的检测[27-29]
样品前处理:取发酵液,在8 000 r/min条件下离心5 min,取6 mL上清液于10 mL离心管中,再加入2 mL正己烷,充分振荡后静置30 min。取上层清液加入过量无水硫酸钠,-80 ℃保存1.5 h后,用0.22 μm有机滤膜过滤。在1 mL滤液中加入30 μL内标溶液(20 μL/mL乙酸正戊酯)。
GC条件:DB-Wax石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);升温程序为起始柱温45 ℃,恒温1.5 min,首先以6 ℃/min升温至85 ℃,然后以4 ℃/min升温至115 ℃,再以3 ℃/min升温至190 ℃,最终以5 ℃/min升温至225 ℃,保持3 min;进样口温度260 ℃;载气为氦气(He)(99.999%),流速为10.7 mL/min,分流进样,分流比为10∶1,溶剂设置不延迟。
MS条件:电子电离(electron ionization,EI)源,离子源温度为230 ℃,四极杆温度为150 ℃,电子能量为70 e V,发射电流为34.6 μA,倍增器电压为1 294 V;接口温度为280 ℃,质量扫描范围为50.00~600.00 m/z。
定性定量:通过GC-MS中的美国国家标准技术研究所(national institute of standards and technology,NIST)数据库检索定性,采用内标法进行定量。
1.3.6 数据处理
采用Origin 2021和Excel 2016分析数据和制图,采用SPSS 22.0软件进行单因素方差分析(one-way analysis of variance,ANOVA)。
2 结果与分析
2.1 高产乙酸乙酯酵母菌的筛选
6株酵母菌株的乙酸乙酯产量见图1。由图1可知,菌株P-3的乙酸乙酯产量最高,为134.32 mg/L,显著高于其他菌株(P<0.05),其次为菌株P-5,乙酸乙酯产量为55.83 mg/L。因此,选用高产乙酸乙酯菌株为菌株P-3。
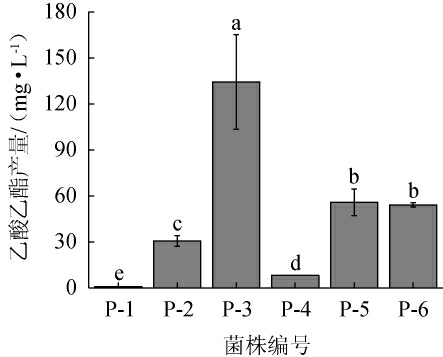
图1 6株筛选酵母菌株的乙酸乙酯产量
Fig.1 Ethyl acetate yield of 6 screened yeast strains
不同字母表示差异显著(P<0.05)。
2.2 菌株P-3的鉴定
2.2.1 形态学观察
将菌株P-3接种到YEPD培养基中,30 ℃条件下培养4 d,菌株P-3的菌落形态及细胞形态见图2。由图2可知,菌株P-3的菌落呈乳白色,湿润、粘稠且表面光滑,容易挑取;细胞呈椭圆形,无菌丝。根据《酵母菌的特征与鉴定手册》[30]初步判定菌株P-3为酵母菌。
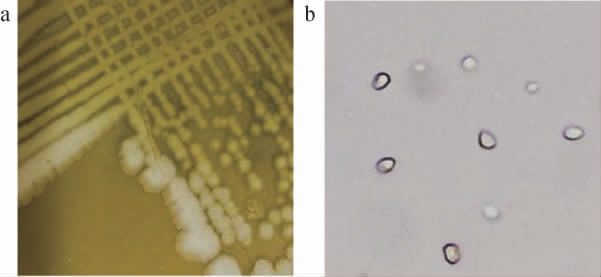
图2 酵母菌P-3的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of yeast P-3
2.2.2 菌株P-3的分子生物学鉴定
基于ITS基因序列构建菌株P-3的系统发育树,结果见图3。由图3可知,菌株P-3与库德里阿兹威毕赤酵母(Pichia kudriavzevii)bcpca-qj-7聚在同一个分支,相似度达到99%,亲缘关系最近。结合形态特征,最终鉴定菌株P-3为库德里阿兹威毕赤酵母(Pichia kudriavzevii)。
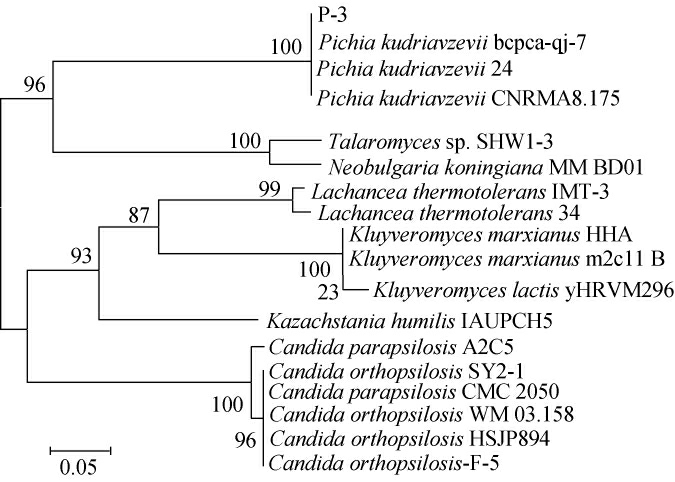
图3 基于ITS基因序列菌株P-3的系统发育树
Fig.3 Phylogenetic tree of strain P-3 based on ITS gene sequence
2.3 库德里阿兹威毕赤酵母P-3产乙酸乙酯条件优化单因素试验
2.3.1 温度对菌株P-3产乙酸乙酯的影响
温度能通过影响产酯酵母的生长繁殖和辅酶A活性而影响最终产酯量[31]。不同发酵温度对菌株P-3产乙酸乙酯的影响见图4。由图4可知,随着发酵温度的上升,菌株P-3的乙酸乙酯产量呈现先上升后下降的趋势,当发酵温度为30 ℃时,乙酸乙酯产量最高,为162.90 mg/L。推测原因可能是当发酵温度处于24~30 ℃时,适宜酵母菌生长繁殖,酶活性逐渐上升;当发酵温度>30 ℃之后,酵母出芽率受影响,生长受到抑制,酶活性也受到抑制[21]。因此,确定最优发酵温度为30 ℃。
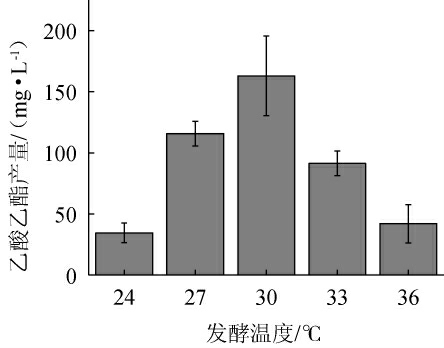
图4 发酵温度对菌株P-3产乙酸乙酯的影响
Fig.4 Effect of fermentation temperature on ethyl acetate production by strain P-3
2.3.2 初始pH对菌株P-3产乙酸乙酯的影响
pH不仅影响酵母菌的生长还会影响酵母代谢相关酶的活性[32]。不同pH对菌株P-3产乙酸乙酯的影响见图5。由图5可知,在初始pH为3~5时,随着初始pH的升高,乙酸乙酯产量呈现缓慢上升的趋势;当初始pH为5时,乙酸乙酯产量最高,为185.28 mg/L;当初始pH继续增大时,乙酸乙酯产量下降,这与酵母菌自身生长最适pH相符[33]。因此,确定最优初始pH为5。
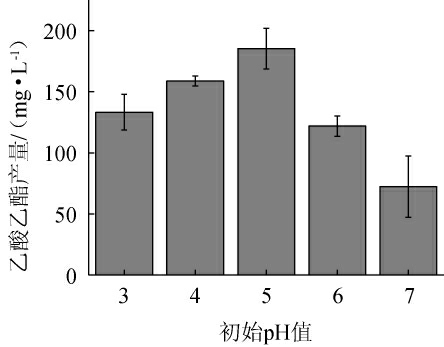
图5 初始pH对菌株P-3产乙酸乙酯的影响
Fig.5 Effect of initial pH on ethyl acetate production by strain P-3
2.3.3 乙醇体积分数对菌株P-3产乙酸乙酯的影响
乙醇作为产酯酵母合成风味物质的重要前体物质之一,其含量的多少直接影响着产酯酵母的代谢[34-35]。不同乙醇体积分数对菌株P-3产乙酸乙酯的影响见图6。由图6可知,随着乙醇体积分数的升高,菌株P-3的乙酸乙酯产量呈先升高后下降的趋势。当乙醇体积分数为18%时,乙酸乙酯产量最高,为203.58mg/L。因此,确定最优乙醇体积分数为18%。
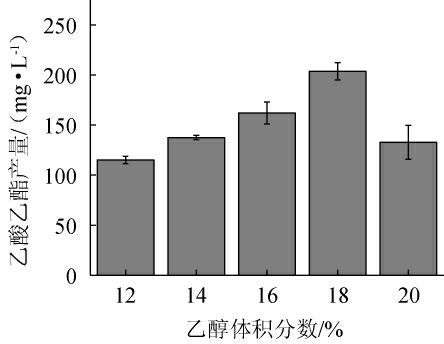
图6 乙醇体积分数对菌株P-3产乙酸乙酯的影响
Fig.6 Effect of ethanol volume fraction on ethyl acetate production by strain P-3
2.3.4 发酵时间对菌株P-3产乙酸乙酯的影响
不同发酵时间对菌株P-3产乙酸乙酯的影响见图7。由图7可知,随着发酵时间的延长,菌株P-3的乙酸乙酯产量呈先升高后下降的趋势。当发酵时间为2~4 d时,乙酸乙酯产量随之增加;当发酵时间为4 d时,乙酸乙酯产量最高,为166.33 mg/L;当发酵时间>4 d之后,乙酸乙酯产量有所下降。分析原因可能是,随着发酵时间的增加,酵母菌生长繁殖,发酵液中所积累的酵母菌数总体呈上升趋势,且代谢产酯能力强,但随着发酵时间的进一步增加,酵母菌发酵能力降低,且伴随乙酸乙酯的挥发,产酯量呈下降趋势[36]。因此,确定最优发酵时间为4 d。
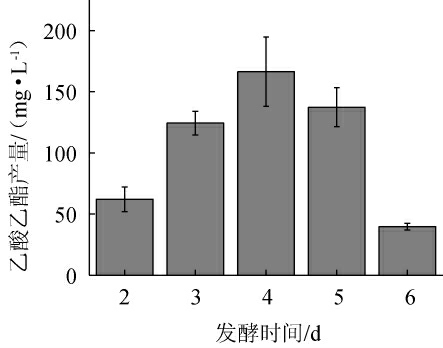
图7 发酵时间对菌株P-3产乙酸乙酯的影响
Fig.7 Effect of fermentation time on ethyl acetate production by strain P-3
2.4 库德里阿兹威毕赤酵母P-3产乙酸乙酯条件优化响应面试验
2.4.1 响应面试验结果
根据单因素试验结果,选择对结果影响较大的因素发酵温度(A)、发酵时间(B)、乙醇体积分数(C)为自变量,以乙酸乙酯产量(Y)为响应值,采用Design Expert v13.0.5.0软件设计3因素3水平的响应试验,Box-Behnken试验设计及结果见表2,方差分析见表3。
表2 产酯条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for ester production conditions optimization
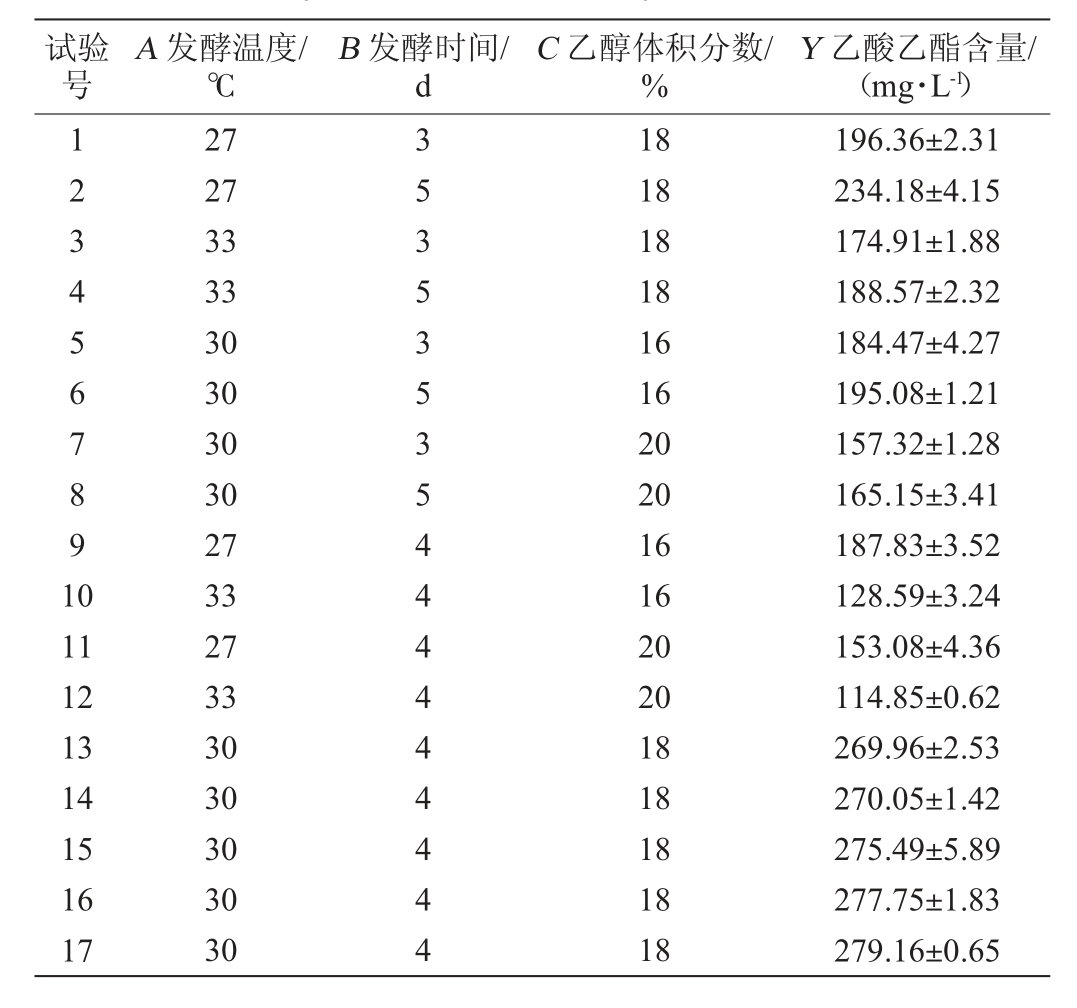
试验号A 发酵温度/℃B 发酵时间/d C 乙醇体积分数/%Y 乙酸乙酯含量/(mg·L-1)1234567891 0 11 12 13 14 15 16 17 27 27 33 33 30 30 30 30 27 33 27 33 30 30 30 30 30 35353535444444444 18 18 18 18 16 16 20 20 16 16 20 20 18 18 18 18 18 196.36±2.31 234.18±4.15 174.91±1.88 188.57±2.32 184.47±4.27 195.08±1.21 157.32±1.28 165.15±3.41 187.83±3.52 128.59±3.24 153.08±4.36 114.85±0.62 269.96±2.53 270.05±1.42 275.49±5.89 277.75±1.83 279.16±0.65
表3 回归模型方差分析
Table.3 Variance analysis of regression model
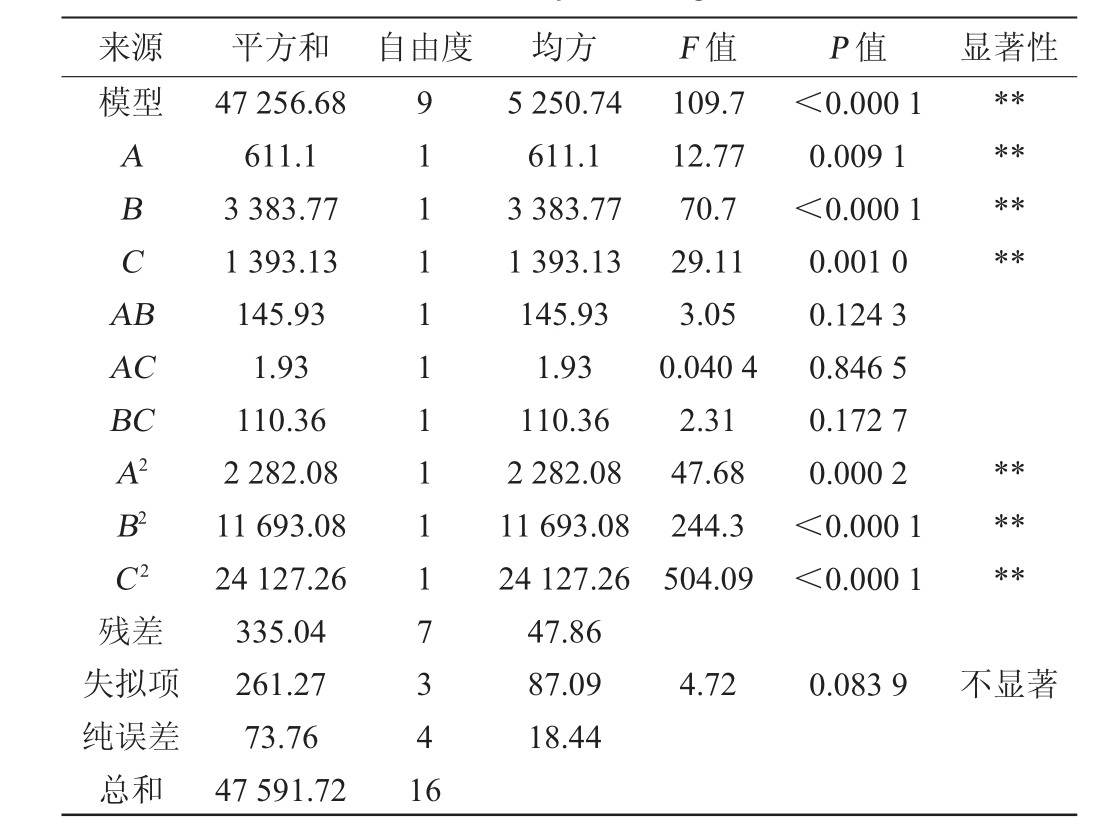
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著
(P<0.05)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总和47 256.68 611.1 3 383.77 1 393.13 145.93 1.93 110.36 2 282.08 11 693.08 24 127.26 335.04 261.27 73.76 47 591.72 91111111117341 6 5 250.74 611.1 3 383.77 1 393.13 145.93 1.93 110.36 2 282.08 11 693.08 24 127.26 47.86 87.09 18.44 109.7 12.77 70.7 29.11 3.05 0.040 4 2.31 47.68 244.3 504.09<0.000 1 0.009 1<0.000 1 0.001 0 0.124 3 0.846 5 0.172 7 0.000 2<0.000 1<0.000 1******4.72 0.083 9不显著
采用Design Expert v13.0.5.0对表2结果进行多元回归拟合,得到二次多项回归方程:
Y=274.48+8.74A-20.57B-13.20C-6.04AB-0.6950AC+5.25BC-23.28A2-52.70B2-75.70C2
由表3可知,回归模型极显著(P<0.01),失拟项不显著(P>0.05),说明试验误差较小,模型选择合理,预测结果可靠。回归模型的决定系数为0.993 0,调整决定系数R2Adj=0.983 9,说明用该模型实际拟合效果较好。由表3亦可知,一次项A、B、C及二次项A2、B2、C2均对乙酸乙酯产量有极显著影响(P<0.01),其他项对结果影响不显著(P>0.05)。各因素对结果的影响顺序为:B>C>A,即发酵时间>乙醇体积分数>发酵温度。通过Design-Expert v13.0.5.0软件对回归方程进行求解,得到菌株P-3产乙酸乙酯的最优发酵条件为:发酵温度29.36 ℃,乙醇体积分数17.81%,发酵时间4.22 d,在此条件下,乙酸乙酯含量预测值为278.24 mg/L。为便于实际操作,将最优发酵条件修正为发酵温度30 ℃,乙醇体积分数18%,发酵时间4 d,在此条件下进行三次重复试验,得到乙酸乙酯含量为(281.47±2.61)mg/L,与预测值接近,说明该模型有效。菌株P-3的乙酸乙酯产量与现有研究相比[27,37],属于中等水平。
2.4.2 响应面曲线分析
各因素间交互作用对乙酸乙酯含量影响的响应曲面及等高线见图8。响应面曲线坡度越陡,等高线越趋于椭圆,代表两因素间交互作用对响应值影响越大;反之,则代表两因素间交互作用对响应值影响越小[38-39]。由图8可知,各因素间交互作用的响应面均呈凸面,且等高线均呈椭圆形,说明各因素间交互作用对乙酸乙酯产量有一定影响,这与方差分析结果相符。
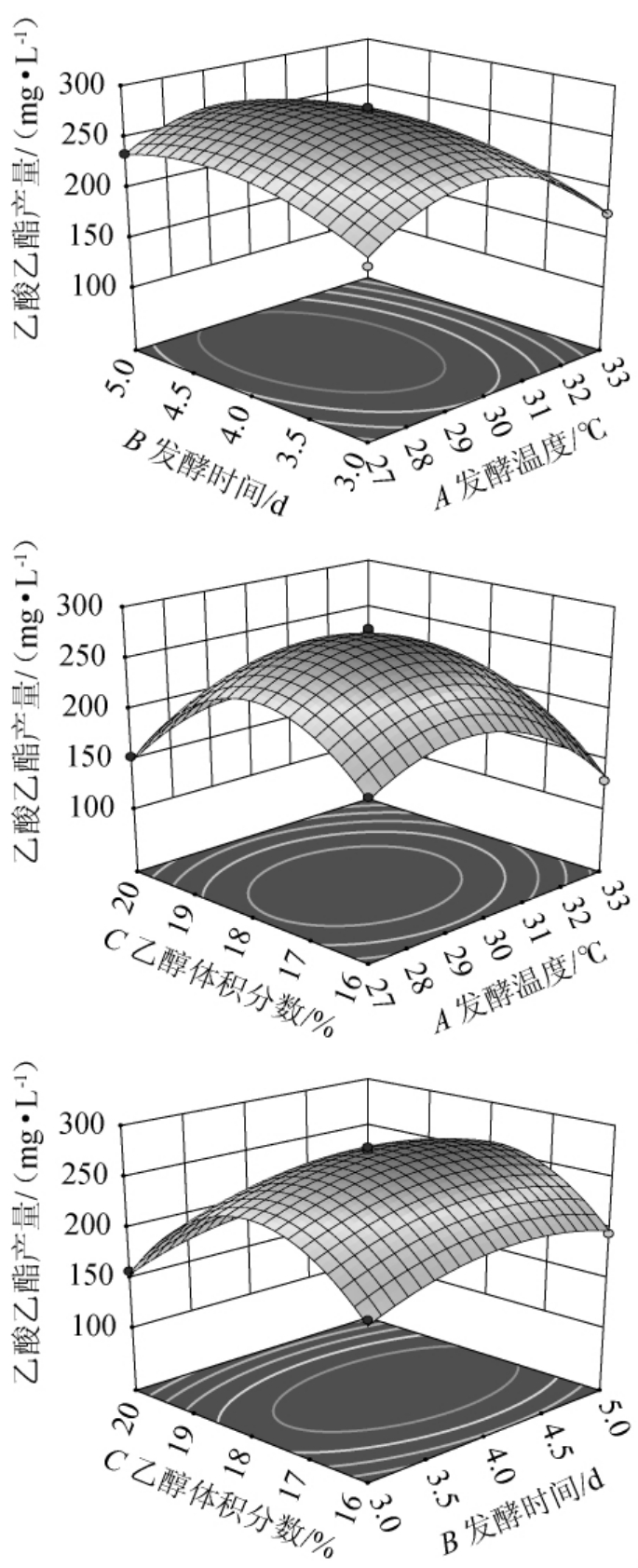
图8 各因素间交互作用对菌株P-3产乙酸乙酯影响的响应面及等高线
Fig.8 Response surface plots and contour lines of effects of interaction between various factors on the production of ethyl acetate by strain P-3
3 结论
本研究从实验室保藏的6株酵母菌株中筛选得到一株高产乙酸乙酯的酵母菌株,编号为P-3。经菌落形态观察、分子生物学分析,菌株P-3被鉴定为库德里阿兹威毕赤酵母(Pichia kudriavzevii)。通过单因素和响应面优化试验确定菌株P-3产乙酸乙酯的最佳发酵条件为:发酵温度30 ℃,乙醇体积分数18%,发酵时间4 d。在此条件下,乙酸乙酯产量为281.47 mg/L,比优化前提高了109.55%。
[1]张治刚,张彪,赵书民,等.中国白酒香型演变及发展趋势[J].中国酿造,2018,37(2):15-18.
[2]中华人民共和国国家市场监督管理总局,中国国家标准化管理委员会.GB/T 10781.2—2006 清香型白酒[S].北京:中国标准出版社,2006.
[3]相里加雄,曹苗文,杨凯环,等.清香型白酒不同酿造工艺下环境微生物群落结构差异[J].酿酒,2022,49(1):118-123.
[4]王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[5]SONG X B,WANG G N,ZHU L,et al.Comparison of two cooked vegetable aroma compounds, dimethyl disulfide and methional, in Chinese Baijiu by a sensory-guided approach and chemometrics[J].LWT-Food Sci Technol,2021,146:111427.
[6]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[7]XUE T D,ZHANG J H,WANG T R,et al.Reveal the microbial communities and functional prediction during the fermentation of Fen-flavor Baijiu via metagenome combining amplicon sequencing[J].Ann Microbiol,2023,73(1):16.
[8]张卜升,袁丛丛,李汶轩,等.浓香、酱香、清香型白酒挥发性风味的特征与差异研究[J].食品安全质量检测学报,2022,13(24):8058-8067.
[9]WANG J, MING Y Z, LI Y M, et al.Characterization and comparative study of the key odorants in Caoyuanwang mild-flavor style Baijiu using gas chromatography-olfactometry and sensory approaches[J].Food Chem,2021,347:129028.
[10]邢爽,王亚平,郭学武,等.发酵条件对5种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[11]李学章.乙酸乙酯合成条件的优化研究[J].当代化工研究,2021(20):26-27.
[12]徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.
[13]赵志军,王瑞卿,刘延波,等.酿酒糟醅中生香酵母的筛选及培养条件[J].食品与生物技术学报,2020,39(9):61-67.
[14]杜亚军,郭尚,李群,等.木枣产香酵母的分离筛选和应用[J].中国酿造,2021,40(10):123-128.
[15]HU Y N,HUANG X N,YANG B,et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Biosci,2021,44:101395.
[16]PIRES E J,TEIXEIRA J A,BRANYIK T,et al.Yeast:the soul of beer's aroma-a review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Appl Microbiol Biot,2014,98(5):1937-1949.
[17]李泽洋,伍时华,龙秀锋,等.米酒生香酵母的分离筛选鉴定及其性能研究[J].食品与发酵工业,2021,47(7):43-50.
[18]刘小改,马美荣,周林艳,等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造,2020,39(10):79-83.
[19]FAN G S,TENG C,XU D,et al.Enhanced production of ethyl acetate using co-culture of Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].J Biosci Bioeng,2019,128:564-570.
[20]胡沂淮,严启梅,蒲春,等.生香酵母Yeast-1液态发酵培养条件优化[J].酿酒科技,2013(6):46-50.
[21]王鹏昊,关统伟,张习超,等.小曲中优质产酯酵母分离鉴定及其产酯条件优化[J].食品与发酵工业,2018,44(2):62-67.
[22]陈维新,李静,王瑶,等.1株乙酸乙酯高产酵母的筛选及其特性研究[J].食品与发酵工业,2015,41(9):87-90.
[23]张会娟,张首玉,邱聪,等.一株产酯酵母的鉴定及发酵性能研究[J].河南工业大学学报(自然科学版),2015,36(2):23-27.
[24]刘梅,黄治国,卫春会,等.响应面法优化窖泥中一株产酯酵母的扩培条件[J].食品研究与开发,2019,40(6):186-193.
[25]高文静,甄攀,李惠源,等.基于响应面法优化高产乙酸乙酯清香型白酒大米查酒醅发酵工艺[J].中国酿造,2023,42(1):155-159.
[26]颜建虹,张祥瑞,卢红梅,等.响应面法优化刺梨白兰地原料酒发酵工艺[J].中国酿造,2023,42(6):186-191.
[27]李群,林斌,柯锋,等.高产乙酸乙酯毕赤酵母筛选及其耐受性能研究[J].酿酒科技,2022(12):39-45.
[28]李昊,曹雯雯,冯思雨,等.气相色谱法测定清香型白酒中乙酸乙酯的不确定度评定[J].中国酿造,2023,42(8):242-246.
[29]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[30]胡瑞青.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
[31]秦立芹,殷欢,成柳洁,等.一株高产己酸乙酯酵母菌株的筛选、鉴定及发酵条件优化[J].食品与发酵工业,2022,48(1):55-61.
[32]HASHEM M,ALAMRI S A,ASSERI T A Y,et al.On the optimization of fermentation conditions for enhanced bioethanol yields from starchy biowaste via yeast co-cultures[J].Sustainability,2021,13(4):1890.
[33]陶树兴,苏蕊,薛静,等.蜂蜜酒生香酵母产酯性能比较和产酯条件研究[J].食品工业科技,2011,32(10):234-238.
[34]FAN G S, SUN B G, XU D, et al.Isolation and identification of high yield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].J Am Soc Brew Chem,2018,76(2):117-124.
[35]刘薇,栾春光,王德良,等.高产酯酵母的筛选、鉴定及其发酵特性研究[J].食品与发酵工业,2021,47(23):311-318.
[36]刘源才,郭圣祥,李锐利,等.高产乙酸乙酯酵母的产酯条件研究[J].食品与发酵科技,2011,47(2):22-24.
[37]王旭亮,王异静,王德良,等.清香型白酒优质产酯酵母菌筛选[J].酿酒,2012,39(4):28-33.
[38]JIANG Y Q, WANG H, ZHAO C F, et al.Establishment of stable microalgal-bacterial consortium in liquid digestate for nutrient removal and biomass accumulation[J].Bioresource Technol,2018,268:300-307.
[39]张可欣,屠康,李心悦.响应面法优化荸荠山药猪肉丸配方[J].食品工业,2023,44(5):47-51.