佤族水酒是云南地区阿佤人自制的一种谷物发酵酒,俗称“布来侬”,是历史悠久的民族特色食品[1]。佤族水酒的主要原料为小红米,也可掺少量玉米、小麦、小米、高粱等共同酿制,是一种带有谷物及酒曲香气,味道醇美,未经蒸馏的淡黄色低度酒[2]。水酒富有氨基酸、维生素及糖类,营养价值丰富,具有生津止渴、健脾消肿、舒筋活络的保健功效。
高通量测序技术(high throughput sequencing,HTS)以其特有的测序量大,灵敏性高,速度快,成本低的优势被广泛应用于食品以及环境中的微生物测定[8-11]。酒的发酵离不开酒曲,酒曲由大量的微生物及酶组成,包括丝状真菌、酵母以及细菌[3-4]。孔祥聪等[5]研究发现,兰陵浓香大曲中,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为优势细菌门,芽孢杆菌属(Bacillus)为绝对优势细菌属;宁亚丽等[6]研究发现,发酵后的粗滤、精滤朝鲜族传统米酒的微生物群落相似,说明精滤工艺对米酒的微生物群落结构影响不大。谷晓东等[7]对6种黄酒酒曲中的微生物进行研究发现,不同酒曲中的微生物差异较大。目前尚未见到佤族水酒的微生物群落研究的报道。
本研究利用高通量测序探究酒曲和发酵过程中水酒样品的细菌、真菌群落组成,并基于属水平对细菌、真菌进行聚类分析(cluster analysis,CA),解析水酒在发酵过程中的微生物群落演变规律,以期保证不同批次之间的酒品质的稳定性,对实际生产中产品品质调控具有重要意义。
1 材料与方法
1.1 材料与试剂
云南小红米:云南普洱;酒曲:贵州安顺市酒厂;OMEGA-soil DNA Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega Bio-Tek公司;DNA胶回收试剂盒:美国Axygen公司;DNA聚合酶:日本Takara公司。
1.2 仪器与设备
SPX-250B-Z型生化培养箱:上海博讯实业有限公司;PE300型MiSeq测序仪:美国Illumina公司;GelDoc XR+型凝胶成像系统、C1000型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司。
1.3 方法
1.3.1 佤族水酒的加工工艺流程及操作要点
红米→清洗→浸泡→蒸煮→摊凉→接种酒曲→糖化→发酵→过滤离心→佤族水酒
操作要点:将500 g红米在18 ℃的水中浸泡20 h,将浸泡好的红米沥干并蒸煮30 min,煮熟后闷盖5 min,在室温下冷却。将0.8%酒曲和糊化红米混合,放入恒温培养箱中并于28 ℃的环境下恒温糖化发酵2 d[12],向糖化后的红米中倒入600 mL约30 ℃的水,拌匀并用保鲜膜封严,放入恒温培养箱中并于30 ℃的环境下发酵5 d。使用三层纱布过滤发酵好的酒醅,收集滤出的液体进行离心(8000r/min、10 min),取上层清液即为佤族水酒成品[13]。每24 h采集一次佤族水酒样品,并将样品分别编号为SJ0 d、SJ1 d、SJ2 d、SJ3 d、SJ4 d和SJ5 d。
1.3.2 DNA的提取及PCR扩增
DNA提取:利用DNA提取试剂盒提取酒曲和不同发酵时间酒醅的基因组DNA,方法参照说明书。
PCR扩增:对细菌16S rDNA的V3-V4可变区进行扩增,引物为338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。真菌的扩增引物为ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')。PCR扩增体系为(20 μL):5×FastPfu Buffer(4 μL)、2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2 μL)、上下游引物(5 μmol/L)各0.8 μL、FastPfu聚合酶(0.4 μL)、牛血清蛋白(bovine serum albumin,BSA)(0.2 μL)和DNA模板(10 ng),双蒸水(dd H2O)补足至20 μL。PCR扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,53 ℃(细菌)/55 ℃(真菌)退火30 s,72 ℃延伸45 s,共29个(细菌)/35个(真菌)循环;72 ℃延伸10 min。扩增完成后,使用2%的琼脂糖凝胶电泳检测PCR产物并切胶回收。
1.3.3 高通量测序数据处理与分析
将得到的扩增产物送往上海美吉生物公司,去掉引物、短片段及低质量的数据序列后,在Illumina Miseq平台上完成高通量测序。用FLASH软件进行双端序列拼接,使用QIIME(1.9.1)进行序列的去重过滤,并用UPARSE按照97%相似性阈值进行操作分类单元(operational taxonomic units,OTU)聚类分析,使用MOTHUR进行Alpha多样性的分析,并利用R语言分析作图,使用SILVA132数据(https://www.arb-silva.de)进行细菌16S rRNA分析,UNITE 8.0数据库(http://unite.ut.ee/index.php)进行真菌ITS分析。
2 结果与分析
2.1 酒曲及发酵过程中水酒样品细菌菌群Alpha多样性分析
由图1可知,随着抽样数的增加,稀释性曲线和香农曲线均逐渐趋向平坦,说明测序数量充足合理,已经检测到绝大部分微生物,即使增加数据量也只会产生少量新的OTU。

图1 样品细菌菌群稀释性曲线(a)及香农曲线(b)
Fig.1 Rarefaction curves (a) and Shannon curves (b) of bacterial community in samples
酒曲及发酵过程中水酒样品细菌的Alpha多样性指数见表1。由表1可知,酒曲的OTU数较高,而水酒的OTU数在发酵过程中呈来回波动的趋势。Shannon指数和Simpson指数可以用来描述物种多样性;Chao1指数和Ace指数可以用来描述物种丰富度;Coverage可以描述测序对物种的覆盖率[14-15]。由表1可知,在发酵0 d时,水酒样品中的Shannon指数最低,仅为0.58;而发酵结束后的水酒样品中,Shannon指数达到3.04,且OTU数有所增加,说明发酵完成的水酒样品微生物多样性有所提高。与未发酵样品相比,发酵结束样品的Ace指数和Chao1指数有所增加,分别为452.95和453.05,说明,发酵后样品的微生物多样性有所提高。Coverage均>99.00%,说明每个样品的测序量和覆盖率足够,能反映样品的真实情况。
表1 酒曲及发酵过程中水酒样品细菌菌群的Alpha多样性指数
Table 1 Alpha diversity indexes of bacterial community in Jiuqu and Shuijiu samples during fermentation
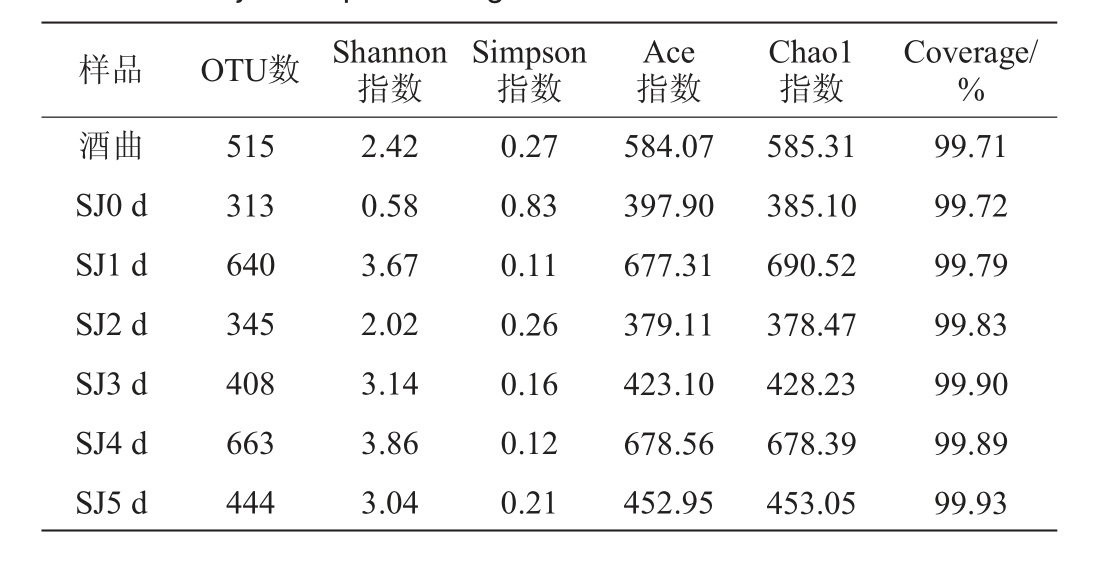
样品 OTU数 Shannon指数Simpson指数Ace指数Chao1指数Coverage/%酒曲SJ0 d SJ1 d SJ2 d SJ3 d SJ4 d SJ5 d 515 313 640 345 408 663 444 2.42 0.58 3.67 2.02 3.14 3.86 3.04 0.27 0.83 0.11 0.26 0.16 0.12 0.21 584.07 397.90 677.31 379.11 423.10 678.56 452.95 585.31 385.10 690.52 378.47 428.23 678.39 453.05 99.71 99.72 99.79 99.83 99.90 99.89 99.93
2.2 酒曲及发酵过程中水酒样品细菌菌群结构分析
2.2.1 基于门水平细菌菌群结构分析
由图2a可知,在酒曲和水酒样品中鉴定出的细菌共可归到6个细菌门,酒曲中的主要菌门包括厚壁菌门(Firmicutes)(50.34%)、变形菌门(Proteobacteria)(25.63%)和放线菌门(Actinobacteria)(19.76%),这与之前的报道结果相符[16-17]。拟杆菌门(Bacteroidetes)(1.55%)、异常球菌-栖热菌门(Deinococcus-Thermus)(1.09%)和蓝菌门(Cyanobacteria)(0.40%)和其他未鉴定门类的相对丰度<5%。

图2 基于门水平酒曲(a)及发酵过程中水酒样品(b)中细菌群落结构
Fig.2 Structure of bacterial community in Jiuqu (a) and Shuijiu samples (b) during fermentation based on phylum level
由图2b可知,发酵过程中水酒样品中厚壁菌门和变形菌门为优势菌门,其二者相对丰度之和始终>70%,其中厚壁菌门的相对丰度在发酵过程中呈先减小后增大的趋势,从93.65%(SJ0 d)降低至24.21%(SJ2 d),在发酵结束时又增加至71.28%。而变形菌门的变化趋势恰好与之相反,从4.79%(SJ0 d)增加至66.23%(SJ2 d),在发酵结束时又降低至15.61%。拟杆菌门(1.07%~5.21%)、放线菌门(0.27%~7.68%)和蓝菌门(0.92%~6.39%)也是水酒样品发酵过程中的主要菌门。在酒曲和水酒样品中,细菌在门水平下的种类大致相同,仅在组成比例上存在差异。
2.2.2 基于属水平细菌菌群结构分析
由图3a可知,在酒曲中基于属水平共鉴定出20个细菌属。在酒曲中,相对丰度>1%的有8种,分别为魏斯氏菌属(Weissella)(43.45%)、棒状杆菌属(Corynebacterium)(10.11%)、芽孢杆菌属(Bacillus)(2.89%)、库克菌属(Kocuria)(2.36%)、罗斯氏菌属(Rothia)(1.42%)和短状杆菌属(Brachybacterium)(1.35%)等。
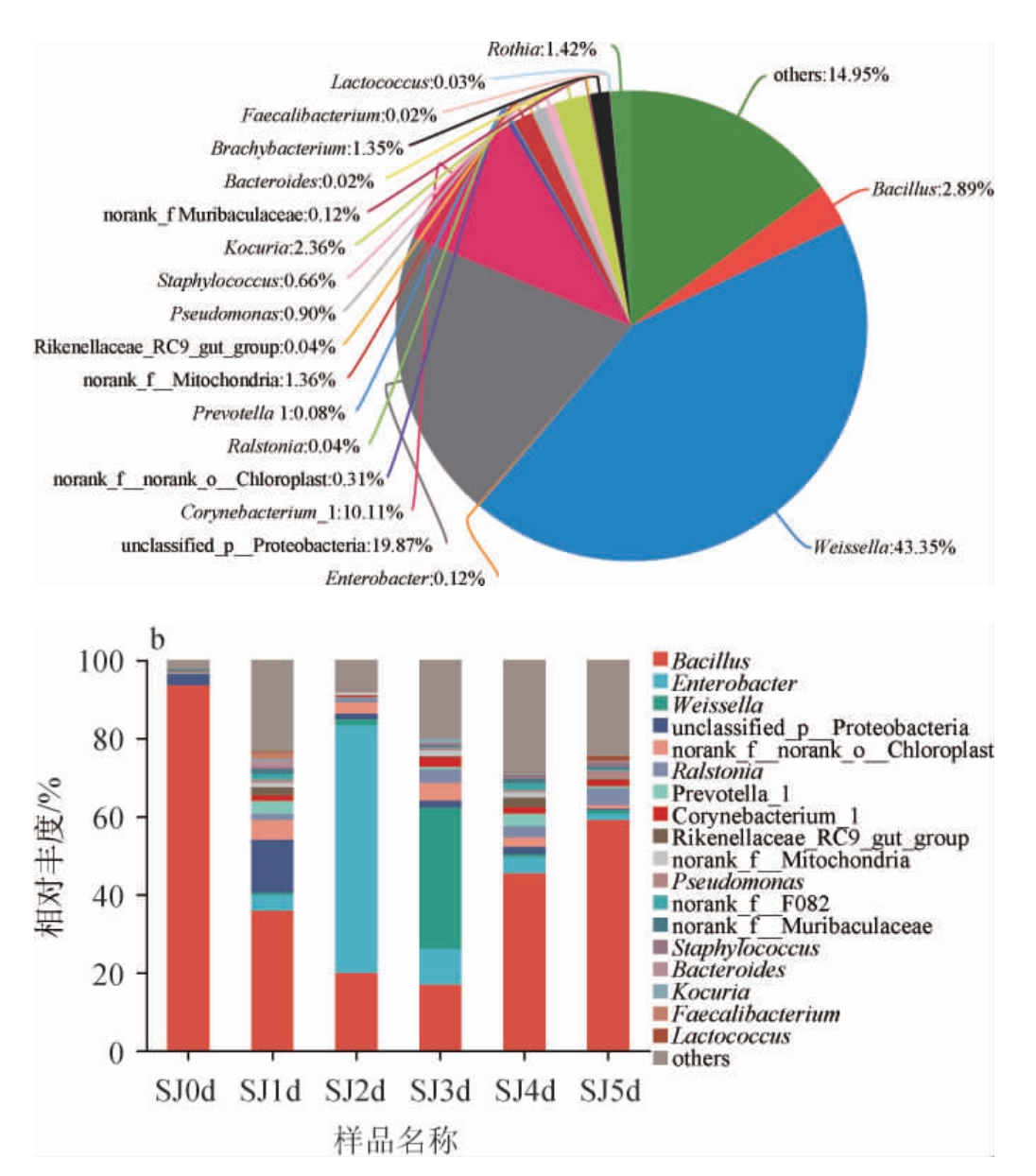
图3 基于属水平酒曲(a)及发酵过程中水酒样品(b)中细菌群落结构
Fig.3 Structure of bacterial community in Jiuqu (a) and Shuijiu samples (b) during fermentation based on genus level
由图3b可知,在水酒中共鉴定出18个细菌属,其中,芽孢杆菌属为水酒样品的优势细菌属(57.68%~93.60%),在发酵过程中呈先减小后增大的趋势。肠杆菌属(Enterobacter)是水酒样品中相对丰度较高的菌属(1.60%~68.37%),在水酒样品发酵过程中呈先增大后减小的趋势,但在酒曲中含量较低,仅占0.12%。魏斯氏菌属在发酵过程水酒样品中含量<1%,但在酒曲中是优势菌(43.35%),其可以产生乙酸、乙醇并推动纤维素降解[20]。芽孢杆菌属在水酒样品中相对丰度很高,在发酵0 d的样品中的相对丰度达93.60%,但在酒曲中相对丰度<3%,说明发酵醪液中的微生物不只由酒曲原料带入,其他原料与环境也影响着细菌群落的结构。芽孢杆菌为好氧菌,在搭窝糖化时,由于原料与空气接触面积较大,导致芽孢杆菌生长速度较快,在发酵初期含量较高[18]。随着发酵进行,发酵环境中含氧量降低,酒精含量升高,芽孢杆菌的生长逐渐受到抑制。芽孢杆菌可以分泌大量水解酶,促进风味物质的形成;还可以产生吡嗪类、醛类、酮类、醇类等挥发性风味物质[19]。其他相对丰度较低的菌属也在发酵过程中发挥着重要的作用。葡萄球菌属(Staphylococcus)具有酶解活性,有助于醛类与酯类的合成,促进风味物质的产生[21]。乳球菌属(Lactococcus)为产酸菌,是酒中乳酸、乙酸、柠檬酸的来源[22]。因此,各种菌属共同促进着水酒的发酵。
对酒曲及发酵过程中水酒样品总相对丰度排名前50的细菌菌属进行聚类分析,并绘制热图,结果见图4。
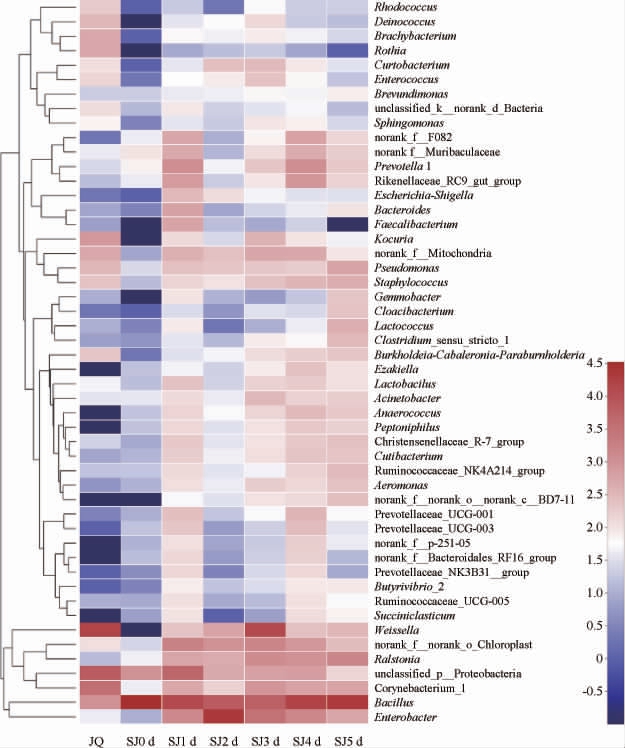
图4 基于属水平酒曲及发酵过程中水酒样品中细菌聚类分析热图
Fig.4 Heat map of cluster analysis for bacteria in Jiuqu and Shuijiu samples during fermentation based on genus level
由图4可知,与酒曲相比,发酵后的水酒样品在细菌种类上有所增多,大多数细菌菌属的相对丰度也有所提高。魏斯氏菌属、乳球菌属、肠杆菌属、罗尔斯通菌属(Ralstonia)、拟杆菌属(Bacteroides)、不动杆菌属(Acinetobacter)、厌氧球菌属(Anaerococcus)、嗜胨菌属(Peptoniphilus)、气单胞菌属(Aeromonas)等细菌菌属相对丰度在发酵完成后均有所上升。总体来说,基于属水平水酒样品细菌菌群的总相对丰度在发酵过程中不断增加。芽孢杆菌属在酒曲以及水酒样品中皆有优势,这与之前的一些研究结果相似。CAI H Y等[23]发现芽孢杆菌属是孝感米酒中三大优势菌之一。SONG S H等[24]研究表明,在韩国收集的42份酒曲的主要优势菌皆为芽孢杆菌属。因此,芽孢杆菌属是发酵水酒样品中的优势菌属。
2.3 酒曲及发酵过程中水酒样品真菌菌群Alpha多样性分析
由图5可知,稀释性曲线和香农曲线均逐渐趋于平坦,说明测序数量充足合理,测序结果能较为真实地反映样品中的真菌群落,可以进行后续生物学信息分析。
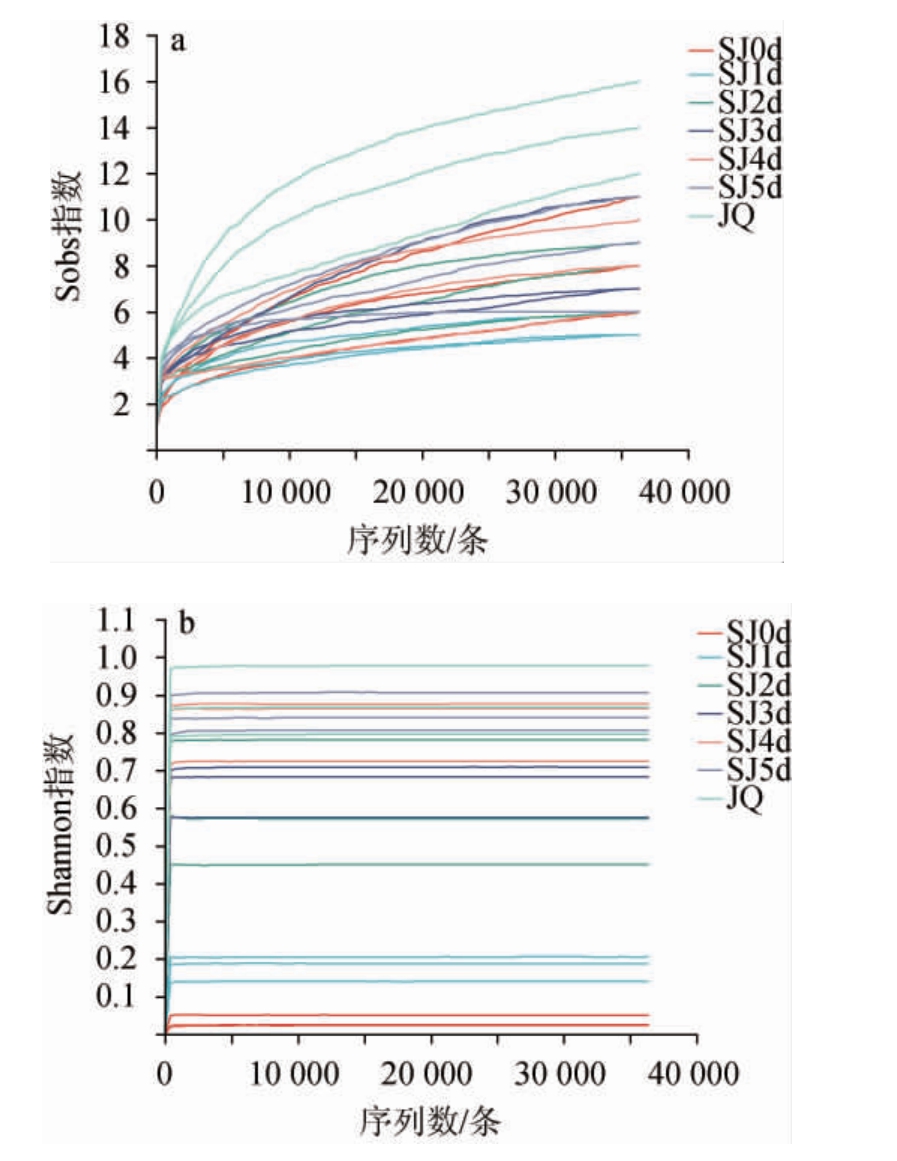
图5 样品真菌菌群稀释性曲线(a)及香农曲线(b)
Fig.5 Rarefaction curves (a) and Shannon curves (b) of fungal community in samples
由表2可知,酒曲的OTU数较高,水酒样品的OTU数在发酵过程中先减小后增大,与Ace指数和Chao1指数变化趋势相同。水酒样品的Shannon指数在发酵过程中逐步增大,从发酵0 d的0.03增至0.85,而Simpson指数则从0.99降至0.51,说明在发酵过程中水酒真菌的多样性逐渐提高。水酒样品的Ace指数和Chao1指数分别为6.54~17.89和5.33~10.17,而酒曲的两个指数分别为36.40和17.67,均高于水酒样品,说明酒曲中真菌多样性及丰度均比水酒样品稍高。与细菌相比,真菌的种类及丰度都大大减少,说明水酒发酵过程中以细菌为主。
表2 酒曲及发酵过程中水酒样品真菌的Alpha多样性指数
Table 2 Alpha diversity indexes of fungal community in Jiuqu and Shuijiu samples during fermentation
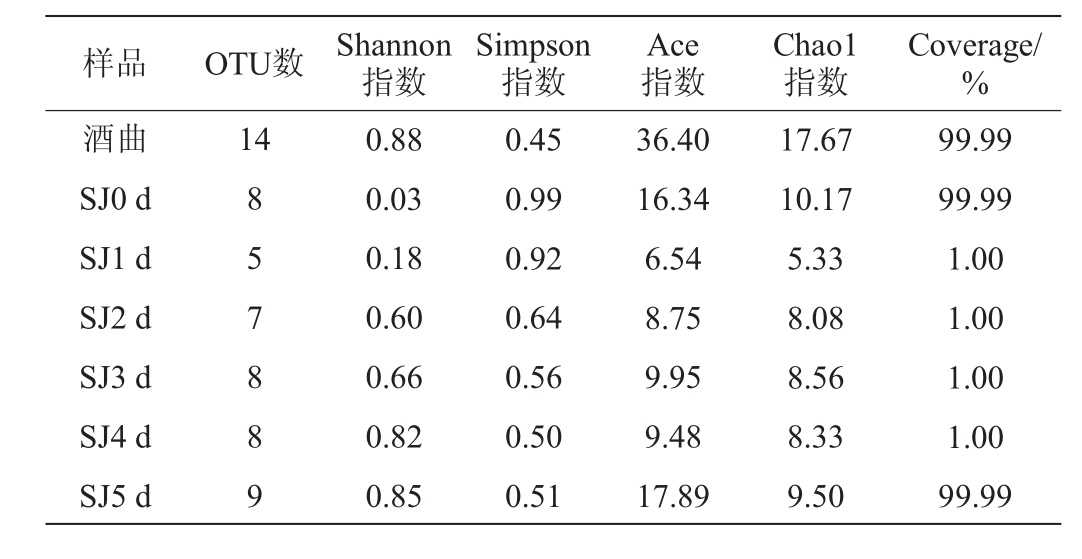
样品 OTU数 Shannon指数Simpson指数Ace指数Chao1指数Coverage/%酒曲SJ0 d SJ1 d SJ2 d SJ3 d SJ4 d SJ5 d 14 8 5 7 8 8 9 0.88 0.03 0.18 0.60 0.66 0.82 0.85 0.45 0.99 0.92 0.64 0.56 0.50 0.51 36.40 16.34 6.54 8.75 9.95 9.48 17.89 17.67 10.17 5.33 8.08 8.56 8.33 9.50 99.99 99.99 1.00 1.00 1.00 1.00 99.99
2.4 酒曲及发酵过程中水酒样品真菌菌群结构分析
2.4.1 基于门水平真菌菌群结构分析
由图6可知,子囊菌门(Ascomycota)和毛霉亚门(Mucoromycota)是酒曲中鉴定出的仅有的两个真菌门,其相对丰度分别为92.88%和7.10%。子囊菌门在发酵水酒样品中的相对丰度均>99.80%,占据绝对的主导地位。由此可见,毛霉亚门在发酵过程中逐渐消失,子囊菌门几乎占据样品的全部真菌门,这与一些研究结果相一致[6,25-26]。因此,子囊菌门是发酵水酒样品中的优势菌门。
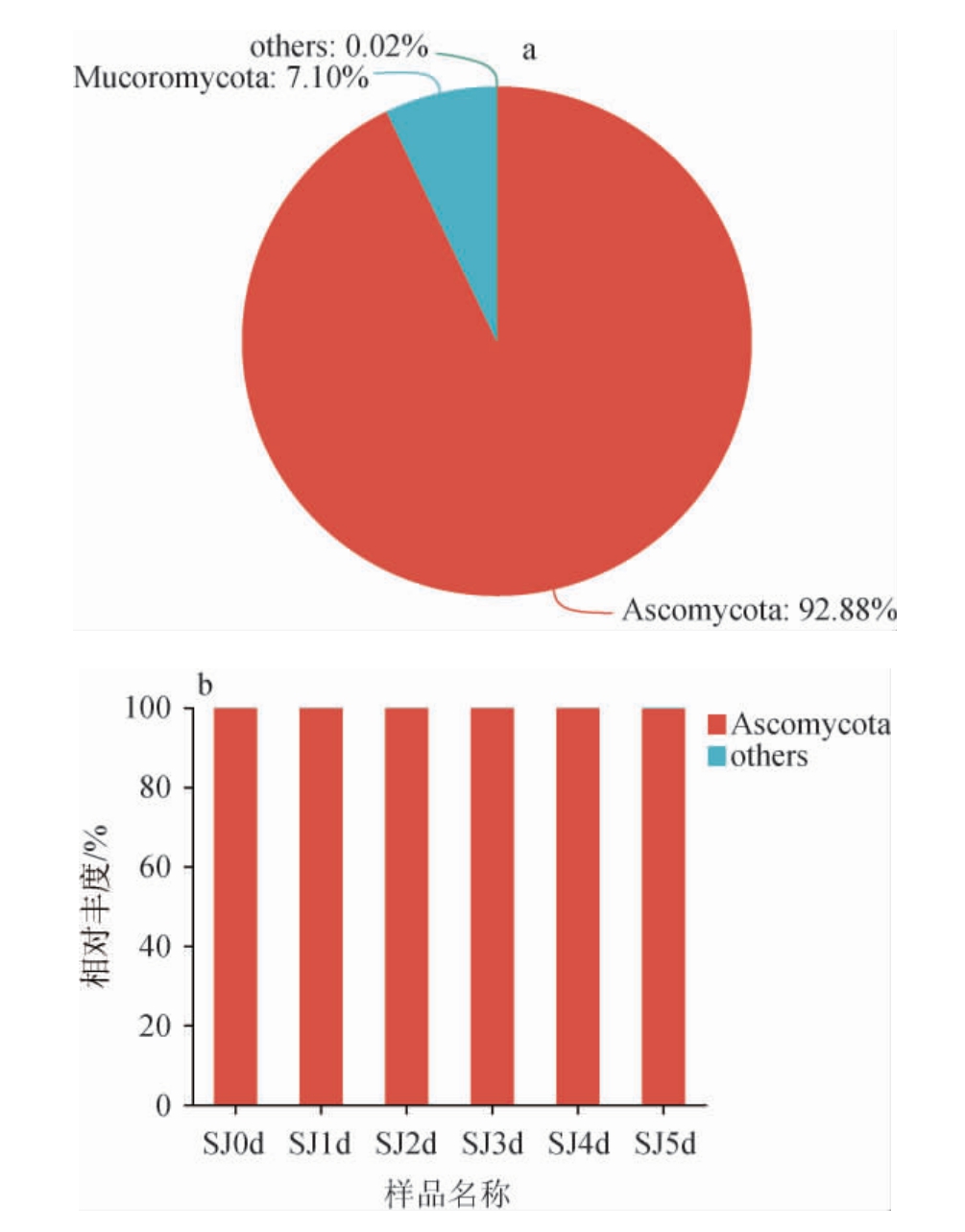
图6 基于门水平酒曲(a)及发酵过程中水酒样品(b)中真菌菌群结构
Fig.6 Structure of fungal community in Jiuqu (a) and Shuijiu samples(b) during fermentation based on phylum level
2.4.2 基于属水平真菌菌群结构分析
由图7a可知,在酒曲中共鉴定出3种真菌属,其中,曲霉属(Aspergillus)为优势真菌属,相对丰度达54.39%;其次为复膜孢酵母属(Saccharomycopsis),相对丰度达38.48%;根霉菌属(Rhizopus)相对丰度较低,仅为7.10%。由图7b可知,发酵0 d的水酒样品(SJ0 d)中复膜孢酵母属占>99%,为绝对优势菌群;除复膜孢酵母属外,样品SJ1 d的曲霉属相对丰度为5.07%;样品SJ2 d中,酵母属(Saccharomyces)相对丰度较高(22.63%),而曲霉属相对丰度有所降低(2.45%)。发酵3 d后的水酒样品中,酵母属含量逐渐增加,成为发酵中后期的真菌“主力军”,打破了复膜孢酵母属绝对优势的地位。在整个发酵过程中,复膜孢酵母属的相对丰度逐渐下降,到发酵结束时为23.18%。与酒曲相比,样品SJ5 d中的曲霉属相对丰度仅为10.08%,根霉菌属更是在发酵0~5 d的所有水酒样品中消失,说明在真菌的属水平上,酒曲与佤族水酒差异较大。曲霉属是酒曲中主要的丝状真菌,可以分泌大量的酶,有助于酒醪中淀粉的糖化[27]。酵母属是酒中酯香的主要来源,产酒精能力很强,广泛存在于各类酒中[28]。因此,水酒发酵过程中以复膜孢酵母属和酵母属为主。
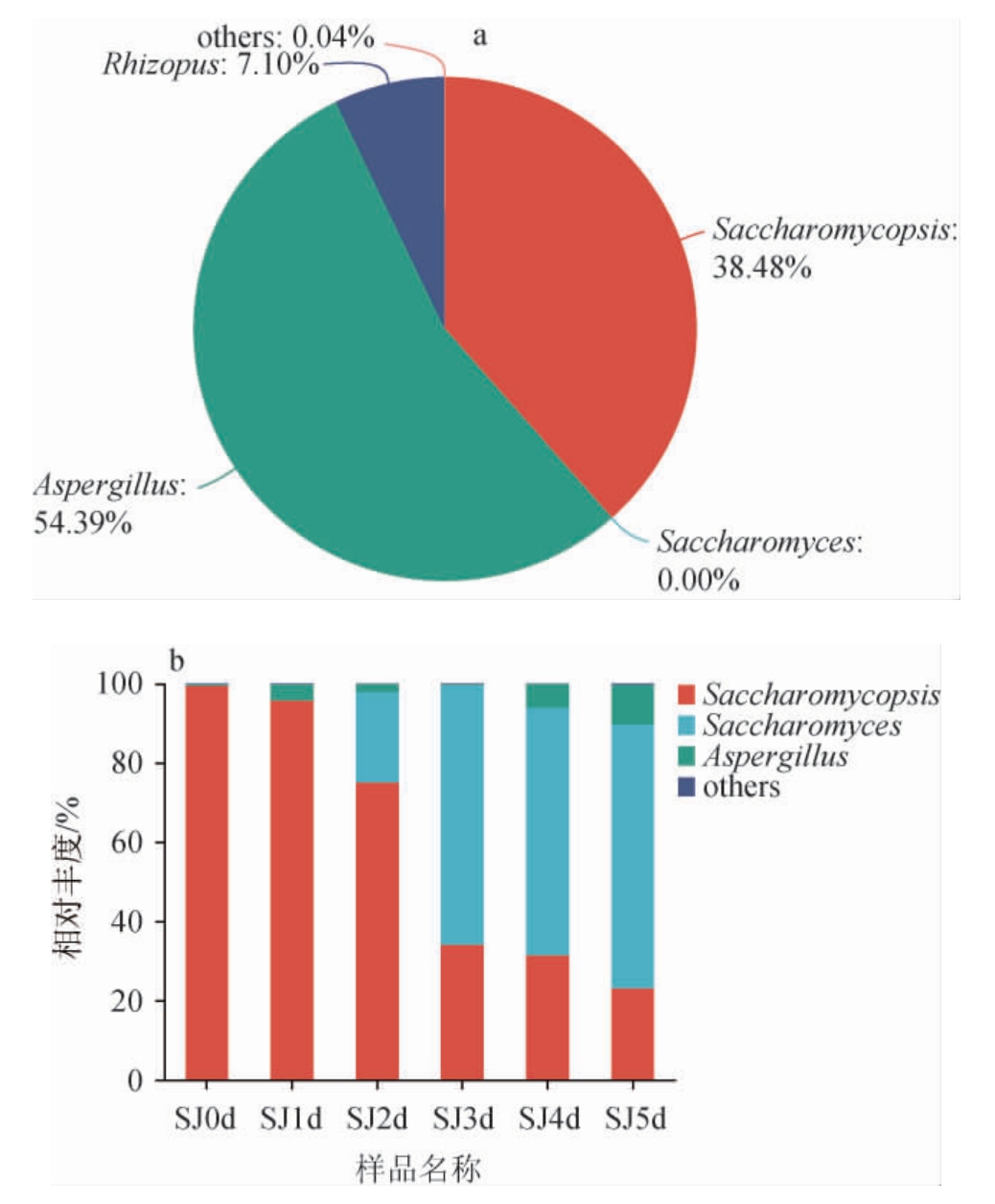
图7 基于属水平酒曲(a)及发酵过程中水酒样品(b)中真菌菌群结构
Fig.7 Structure of fungal community in Jiuqu (a) and Shuijiu samples(b) during fermentation based on genus level
对酒曲及发酵过程中水酒样品的真菌菌属进行聚类分析,并绘制热图见图8。由图8可知,在酒曲中没有酵母属,但酵母属在水酒样品中的相对丰度在发酵1 d后逐渐上升,并在发酵后期维持在较稳定的状态,成为了优势菌属;复膜孢酵母属的相对丰度在水酒样品发酵过程中逐渐降低;曲霉属在酒曲中占比最高,但在水酒样品中仅占有较低的相对丰度。因此,水酒中的微生物不只由酒曲带入,在发酵过程中,微生物会根据环境不断代谢和调整,最终形成能够适应环境并相对稳定的群落结构。
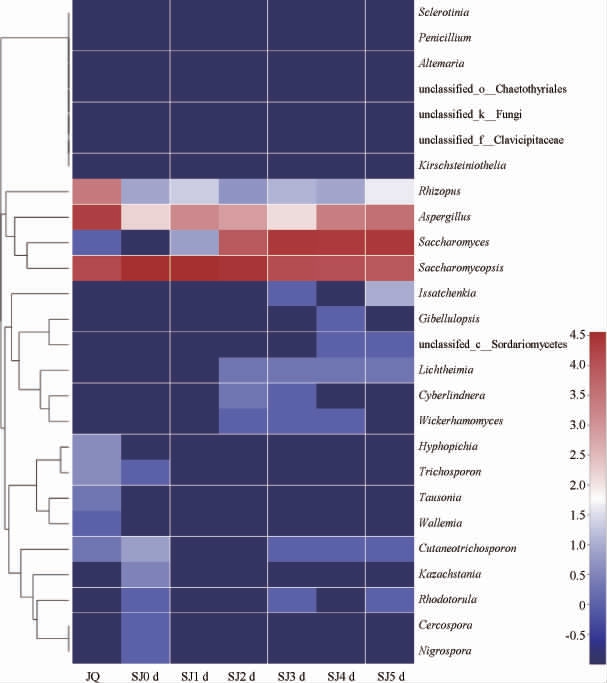
图8 基于属水平酒曲及发酵过程中水酒样品中真菌聚类分析热图
Fig.8 Heat map of cluster analysis for fungus in Jiuqu and Shuijiu samples during fermentation based on genus level
3 结论
本研究通过高通量测序对酒曲和佤族水酒发酵过程中的微生物群落进行研究发现,门水平上,厚壁菌门和变形菌门为酒曲和水酒样品的优势细菌门。属水平上,魏斯氏菌属为酒曲中的优势细菌属(43.45%),而芽孢杆菌属则为水酒样品中的优势细菌属(57.68%~93.60%)。酒曲的真菌多样性高于水酒样品。在门水平上,子囊菌门为酒曲及水酒样品中的优势真菌门;在属水平上,酒曲中的优势真菌属为曲霉属(54.39%);不同于酒曲,水酒样品发酵前期的优势真菌属为复膜孢酵母属,而酵母属为发酵后期的优势真菌属。微生物群落的变化情况纷繁复杂,受多种条件影响,解析微生物在发酵过程中的演替规律有助于筛选功能微生物,为实际生产中的定向调控提供帮助。
[1]李艳梅.雪林乡“小红米”生产现状及发展前景[J].农家参谋,2017(20):9-10.
[2]ZHANG H,WANG Y,FENG X,et al.The Analysis of changes in nutritional components and flavor characteristics of Wazu rice wine during fermentation process[J].Food Anal Met,2022,15(4):1132-1142.
[3]王柏文,吴群,徐岩,等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报,2021,48(5):1737-1746.
[4]郭学武,范恩帝,马冰涛,等.中国固态发酵白酒中功能细菌研究进展[J].食品与发酵工业,2020,46(1):280-286.
[5]孔祥聪,邢文慧,管桂坤,等.兰陵浓香大曲理化性质和细菌群落多样性研究[J].中国酿造,2023,42(7):126-131.
[6]宁亚丽,吴跃,何嫱,等.基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J].食品科学,2019,40(16):107-114.
[7]谷晓东,刘怡琳,席晓丽,等.基于高通量测序技术对6种黄酒酒曲中微生物多样性的研究[J].食品工业科技,2022,43(16):148-157.
[8]XIE M,LV F,MA G,et al.High throughput sequencing of the bacterial composition and dynamic succession in Daqu for Chinese sesame flavour liquor[J].J I Brewing,2020,126(1):98-104.
[9]范锦琳,易超,王诗宇,等.基于高通量测序技术解析菌草酒发酵过程中细菌菌群变化[J].中国酿造,2023,42(8):52-57.
[10]KIOROGLOU D,MAS A,PORTILLO M C.High-throughput sequencing approach to analyze the effect of aging time and barrel usage on the microbial community composition of red wines[J].Front Microbiol,2020,11:562560.
[11]左乾程,黄永光,郭敏,等.酱香型白酒机械化制曲发酵细菌群落的演替[J].食品科学,2021,42(18):150-156.
[12]赵亮亮,盛伟喜,时晓,等.浓香型白酒酿造生境中微生物群落多样性及群落间相互作用[J].中国酿造,2023,42(11):15-21.
[13]魏婧.糙米酒和发芽糙米酒发酵工艺及产品指标分析[D].哈尔滨:东北农业大学,2012.
[14]范晓攀,王娉,陈颖,等.肉类调理食品中细菌多样性的分析[J].现代食品科技,2017,33(1):237-242.
[15]张海燕,康三江,张霁红,等.苹果酵素发酵过程中微生物群落与风味物质的相关性分析[J].中国酿造,2022,41(12):110-119.
[16]梁晨,杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报,2017,44(2):384-393.
[17]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[18]WANG P,WU Q,JIANG X,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[19]于华,黄丹,陈卓,等.四川麸醋醋醅中产酸芽孢杆菌的分离及发酵特性研究[J].中国食品添加剂,2017(1):83-90.
[20]李巧玉,方芳,堵国成,等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业,2017,43(10):241-247.
[21]UDOMSIL N,RODTONG S,TANASUPAWAT S, et al.Improvement of fish sauce quality by strain CMC5-3-1: A novel species of Staphylococcus sp.[J].J Food Sci,2015,80(9):M2015-M2022.
[22]GARC A A, NAVARRO K, SANHUEZA E, et al.Characterization of Lactobacillus fermentum UCO-979C, a probiotic strain with a potent anti-Helicobacter pylori activity[J].Electron J Biotechnol, 2017, 25:75-83.
[23]CAI H Y,ZHANG T,ZHANG Q,et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiol,2018,73:319-326.
[24]SONG S H,LEE C,LEE S,et al.Analysis of microflora profile in Korean traditional nuruk[J].J Microbiol Biotechnol,2013,23(1):40-46.
[25]JIANG Q,WU X,XU Y,et al.Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J].3 Biotech,2021,11(5):224.
[26]付平.贵州香禾糯酒发酵微生物多样性及其酒体抗氧化活性研究[D].贵阳:贵州大学,2023.
[27]ZHENG X W,TABRIZI M R, NOUT M J R, et al.Daqu-A traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[28]李凯敏,付桂明,吴酬飞,等.特香型白酒酿造过程中真核微生物菌群演替[J].食品科学,2017,38(22):131-136.