芝麻香型白酒以芝麻香为主体香,兼具浓、清、酱三大香型白酒的风格特点,是我国鲁酒的代表香型[1]。芝麻香型白酒典型风格的形成与其特殊的生产工艺有关,其中最关键的工序是高温堆积发酵,堆积发酵的主体是微生物,微生物的生长代谢推动了堆积发酵,堆积发酵结束后以酒醅为载体,承载微生物、酶系、香气成分、营养物质等,入池后进行发酵,进而对白酒的生产产生影响[2]。温度是微生物代谢活动的外在表现,有研究表明,不同的堆积温度导致入窖发酵初始微生物菌群数量不同,尤其是酵母菌和芽孢杆菌(Bacillus)的数量,并最终对原酒的出酒率和质量有重要影响[3],由此可见,探究堆积酒醅中的酵母菌的种类和构成对芝麻香型白酒生产有重要的意义。
在白酒酿造过程中存在丰富的酵母菌资源[4-6],分离出可培养的酵母菌对解析酿造工艺有重要的作用。目前,已有学者对酿酒环境中的酵母菌进行分离,杨建刚等[7]从不同发酵时期的浓香型白酒酒醅中分离到发酵毕赤酵母(Pichia fermentans)、卡斯泰利诺莫夫氏酵母(Naumovozyma castellii)、戴尔有孢圆酵母(Torulaspora delbrueckii)等15个酵母菌种;李景辉[8]从酱香型白酒大曲及其制作过程、堆积酒醅、发酵酒醅和出窖酒醅中分离鉴定得到包括威克汉姆酵母属(Wickerhamomyces)、毕赤酵母属(Pichia)、裂殖酵母属(Schizosaccharomyces)等13个属的酵母菌;李群等[9]从清香型小曲白酒酒醅和酒曲中共分离出7个属13个种的酵母菌;王志山等[10]从芝麻香型白酒大曲中分离得到酿酒酵母(Saccharomyces cerevisiae)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)及热带假丝酵母(Candida tropicalis)。芝麻香型白酒酒醅通过堆积发酵融合了环境、高温大曲及芝麻香专用曲中的微生物,因此有必要对芝麻香酒醅中的酵母菌资源进行挖掘。
为挖掘芝麻香型白酒生产过程中的酵母菌种资源,本研究利用WL固体培养基对堆积酒醅中酵母菌进行计数,选择酵母菌活菌数较多的酒醅样品为分离源,采用稀释涂布平板法分离酵母菌,通过形态学观察及分子生物学技术进行菌种鉴定,并利用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气质联用(gas chromatography-mass spectrometry,GC-MS)法测定其发酵液中的挥发性风味物质,研究其产香性能,以期为芝麻香型白酒酵母菌种资源挖掘及其在生产中的应用提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
芝麻香型白酒堆积酒醅样品:采集自济南趵突泉酿酒有限责任公司芝麻香手工酿造班,根据堆积温度的变化特点,分别在堆积0 h、8 h、16 h、20 h、24 h、28 h、32 h、40 h取样。在堆积酒醅的上层、下层的中间层面上取4个固定点,每个点取样量相同,样品混合均匀后放到4 ℃冰箱保存,在取样48 h内完成试验。
1.1.2 试剂
酵母浸粉、蛋白胨(均为生化试剂):青岛海博生物技术有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、三羟甲基氨基甲烷-乙酸-乙二胺四乙酸(tris base-acetic acid-ethylene diamine tetraacetic acid,TAE)缓冲液:生工生物工程(上海)有限公司;Taq酶(5 U/μL)、琼脂糖(生化试剂)、DL 1 000 DNA Marker:北京全式金生物技术有限公司;叔戊醇、乙酸戊酯、2-乙基丁酸(均为色谱纯):北京百灵威科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
WL固体培养基:青岛海博生物技术有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[11]:酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,去离子水1 000 mL,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
YXQ-50Ⅱ高压蒸汽灭菌锅、SPX-150 B-Z生化培养箱:上海博讯实业有限公司;BBS-DDC超净工作台:济南鑫贝西生物技术有限公司;IY1200自动细胞计仪:上海睿钰生物科技有限公司;T100TM聚合酶链式反应(polymerase chain reaction,PCR)仪、PowerPacTM Basic电泳仪:美国伯乐公司;三相萃取头(50/30 DVB/CAR/PDMA μm):美国Supelco公司;7890A-5975C气相色谱-质谱联用仪:安捷伦科技有限公司。
1.3 方法
1.3.1 酵母菌计数
分别取25 g酒醅样品溶于225 mL无菌水中,用均质器120 r/min均质2 min;在超净工作台中进行10倍梯度稀释,分别取10-5、10-6、10-7稀释液0.1 mL涂布于WL固体培养基(含0.1 mg/L氯霉素)中,置入28 ℃培养箱中倒置培养2~3 d后,参照GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》进行酵母菌计数,每个样品作3次重复。根据菌落计数结果,挑取酵母菌活菌数最多的平皿进行酵母菌分离。
1.3.2 酵母菌的分离纯化
从上述培养皿中挑取不同形态的酵母菌划线于WL固体培养基中,28 ℃培养48~72 h。每株菌多次纯化至培养皿上为同一形态、镜检结果为同一类型细胞为止。从培养皿上挑取活化的酵母菌菌体溶于1 mL无菌甘油溶液(20%)中,混匀后放入-80 ℃冰箱中保存备用。
1.3.3 酵母菌菌株的鉴定
形态学观察:将酵母菌单菌落划线至WL固体培养基,28 ℃培养72 h后观察菌落形态,并采用显微镜观察细胞形态。
分子生物学鉴定:用无菌棉签刮取培养皿上的部分菌株于无菌离心管中,采用酵母基因组DNA快速抽提试剂盒提取基因组DNA。以其为模板,采用通用引物ITS1/ITS4 PCR扩增酵母菌的5.8S rDNA-ITS区序列[12]。PCR扩增产物经1.5%的琼脂糖凝胶电泳检测成功后委托生工生物工程有限公司进行测序。测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选取同源性较高的模式菌株序列,采用MEGA 4.0软件中的邻接法(neighbor-joining)构建菌株系统发育进化树。
1.3.4 酵母菌的发酵
将分离得到的酵母菌株接种于YPD液体培养基中,28℃活化培养24 h后,调至细胞浓度一致(108个/mL),以相同的接种量(5%)接种至YPD液体培养基中,28 ℃培养5 d,每个样品做3次重复。
1.3.5 挥发性风味成分的检测
取5 mL发酵液、2 g NaCl,100 μL内标(0.2%,叔戊醇、2-乙基丁酸、乙酸正戊酯)及转子装入顶空进样瓶中,在50 ℃的恒温磁力搅拌器上平衡10 min后,将老化好的萃取头插入到样品瓶顶空部分,萃取40 min。将萃取针插入GC-MS仪进样口热解吸5 min,采用GC-MS检测挥发性风味成分[13]。采用美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)8.0谱库及计算机检索进行定性分析,采用内标法进行定量。
1.3.6 数据分析
使用SPSS Statistics 17.0统计软件分析数据,采用Origin 8.5绘图。
2 结果与分析
2.1 酒醅堆积过程中温度及可培养酵母菌活菌数的变化
酒醅堆积过程中温度及可培养酵母菌活菌数的变化见图1。由图1可知,堆积过程中,酒醅的可培养酵母菌活菌数呈升高趋势,分析原因可能是芝麻香型白酒酒醅的堆积过程是在开放式的环境中进行的,是一次“二次制曲”的过程,环境中的微生物、大曲及芝麻香专用曲在酒醅中富集和发酵,导致可培养酵母菌数量升高,为入窖发酵准备条件[3]。温度是微生物繁殖代谢的外在表现,又是推动堆积进程的动力,随着堆积的进行,酒醅温度逐步升高,至40 h时堆积温度达到顶峰。温度的升高对酵母菌的结构起到一定的改变作用,生产中在堆积前期加入了大量的异常威克汉姆酵母(Wickerhamomyces anomalus),该菌的最适生长温度为28 ℃,随着温度的升高该菌逐渐减少,耐高温的酵母菌繁殖,WL固体培养基中也显示了堆积后期酵母菌的种类变多。因此,选择堆积结束时(40 h)的酒醅样品作为分离源,以期筛选到多种耐受性好的酵母菌。
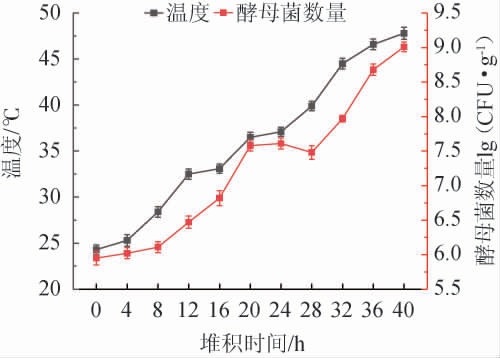
图1 酒醅堆积过程中温度及可培养酵母菌活菌数的变化
Fig.1 Changes of temperature and viable counts of culturable yeasts of fermented grains during the stacking process
2.2 酵母菌的分离及鉴定
2.2.1 酵母菌的分离与形态学观察
从堆积40 h的酒醅样品中共分离得到68株酵母菌菌株,划线接种于WL固体培养基培养后得到9种不同形态的酵母菌,其代表菌株的菌落及细胞形态见图2和表1。
表1 芝麻香型白酒堆积酒醅分离酵母菌的形态特征统计结果
Table 1 Statistical results of morphological characteristics of yeasts isolated from stacking fermented grains of sesame-flavor Baijiu

菌株编号 固体培养形态 细胞形态 液体静止培养形态 株数/株BY1 BY2 BY3 BY4 BY5 BY6 BY7 BY8 BY9菌落大,浅绿色,圆形,边缘整齐,中间微凸,表面有放射状绒毛,难挑起菌落大,乳白色,圆形,边缘不整齐,中间凸起,有褶皱,易挑起菌落大,中间浅绿色边缘乳白色,多边形,边缘不规则偶见白色蜡质,整个凸起,有褶皱,易挑起菌落大,中间浅黄色边缘乳白色,圆形,边缘整齐,中间凸起,表面有褶皱,不易挑起,挑破有液体菌落小,中间绿色边缘白色,圆形,边缘整齐,整个凸起,表面光滑,易挑起菌落大,白色,圆形,边缘整齐,整个凸起,表面光滑,易挑起菌落大,白色,圆形,边缘整齐,整个凸起,表面光滑,易挑起菌落小,绿色周围有不透明圈,圆形,边缘整齐,中间凸起,表面光滑,不易挑起菌落大,乳白色,圆形,边缘整齐,整个凸起中间有小凹陷,表面有褶皱,易挑起长杆型椭圆形椭圆形椭圆形椭圆形椭圆形圆形圆形卵圆形表面有大量菌膜,底部有白色沉淀表面有少量菌膜,底部有沉淀表面有少量菌膜,底部有沉淀菌液表面、中间、底部均有絮状沉淀表面有大量菌膜,底部有沉淀液体澄清,底部有沉淀液体澄清,底部有沉淀液体澄清,底部有沉淀有大量菌膜,底部有沉淀19 7 4 2 43222 3
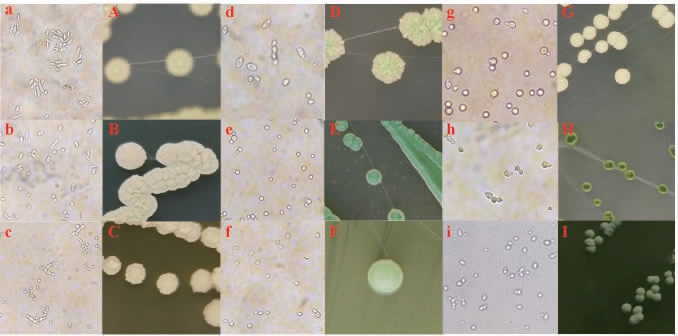
图2 芝麻香型白酒堆积酒醅分离酵母菌的形态特征
Fig.2 Morphological characteristics of yeasts isolated from stacking fermented grains of sesame-flavor Baijiu
A~I分别为菌株BY1、BY2、BY3、BY4、BY5、BY6、BY7、BY8、BY9的
菌落形态;a~i分别为BY1~BY9的细胞形态。
2.2.2 分离酵母菌的分子生物学鉴定
从9种形态类型中各选择1株综合特征能够代表本类酵母菌的模式菌株进行分子生物学鉴定,基于5.8S rDNAITS基因序列构建9种菌株的系统发育树,结果见图3。
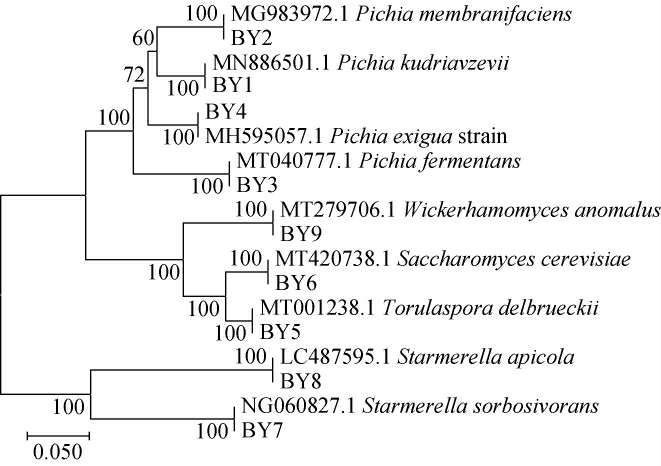
图3 基于5.8S rDNA-ITS基因序列分离酵母菌的系统发育树
Fig.3 Phylogenetic tree of isolated yeasts based on 5.8S rDNA-ITS gene sequences
由图3可知,菌株BY1与库德里阿兹威毕赤酵母(Pichia kudriavzevii)聚为一支,菌株BY2与膜醭毕赤酵母(Pichia membranifaciens)聚为一支,菌株BY3与发酵毕赤酵母(Pichia fermentans)聚为一支,菌株BY4与Pichia exigua聚为一支,菌株BY5与德尔布有孢酵母(Torulaspora delbrueckii)聚为一支,菌株BY6与酿酒酵母(Saccharomyces cerevisiae)聚为一支,菌株BY7与Starmerella sorbosivorans聚为一支,菌株BY8与Starmerella apicola聚为一支,菌株BY9与异常威克汉姆酵母(Wickerhamomyces anomalus)聚为一支,因此,将菌株BY1~BY9分别鉴定为库德里阿兹威毕赤酵母(Pichia kudriavzevii)、膜醭毕赤酵母(Pichia membranifaciens)、发酵毕赤酵母(Pichia fermentans)、Pichia exigua、德尔布有孢酵母(Torulaspora delbrueckii)、酿酒酵母(Saccharomyces cerevisiae)、Starmerella sorbosivorans、Starmerella apicola、异常威克汉姆酵母(Wickerhamomyces anomalus)。芝麻香型白酒兼具浓、酱、清香型白酒的工艺特点[14],在酵母菌种资源方面也体现了这种共性关系:Wickerhamomyces anomalus、Saccharomyces cerevisiae是芝麻香型白酒发酵过程中的主要功能酵母菌[15],同时也是酱香型、清香型白酒酿造环境中的核心酵母菌[16-18]。从不同香型白酒酿造环境中能分离到不同特性的Saccharomyces cerevisiae,杨宁等[19]从酱香型白酒酒醅中筛选到一株高产酒精且对高温具有较强耐受性的酵母菌株;向丽萍等[20]从中高温大曲中筛选到一株耐酸性的Saccharomyces cerevisiae;林斌等[21]从酒曲中分离筛选得到低产正丙醇的Saccharomyces cerevisiae,经生产应用发现该菌能够降低清香型白酒中正丙醇及提升乙酸乙酯的含量。Pichia kudriavzevii对胁迫环境的耐受性好,与酿酒酵母协同解除乳酸胁迫,提高酿酒酵母产乙醇的性能,是酱香型白酒入池发酵群落中核心功能微生物[22-23]。蜜生假丝酵母(Candida apicola)与槐糖酯的生成有关,在酱香型白酒酿造过程中随着轮次增加,逐步成为优势酵母菌[23],崔东琦等[24]从高温大曲中分离到该菌,并利用该菌强化大曲应用到酱香型白酒的发酵。Pichia fermentans、Pichia membranifaciens及Torulaspora delbrueckii是浓香型白酒的核心功能菌之一[25]。张霞等[26]从五粮液车间空气中分离到Pichia exigu,而在其他香型白酒中未见有此菌的报道,从芝麻香型白酒中分离到该菌,从某种层面上说,芝麻香型白酒和浓香型白酒在酵母方面存在一定的相关性。WANG J W等[27]从酱油渣中分离出Starmerella sorbosivorans,发现该菌是酱油中潜在的增香微生物,通过产生4-羟基-2,5-二甲基-3(2H)-呋喃酮(4-hydroxy-2,5-dimethyl-3(2H)-furanone,HDMF)和3-羟基-2-甲基-4h-吡喃-4-酮来增强酱油的甜味和焦糖样香气,目前首次在白酒酿造环境中分离到该菌株。
2.3 酵母菌发酵液挥发性代谢产物分析
使用HS-SPME-GC-MS测定9株代表酵母菌发酵液中的挥发性风味物质,将各类别所占的比例绘制成柱形图,结果见图4,将每种物质成分的含量绘制成热图,结果见图5。
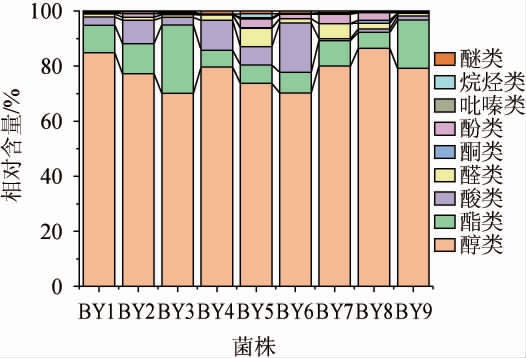
图4 分离酵母菌发酵液中各类别挥发性风味物质的占比
Fig.4 Proportion of various categories volatile flavor substances in fermentation liquid of isolated yeasts
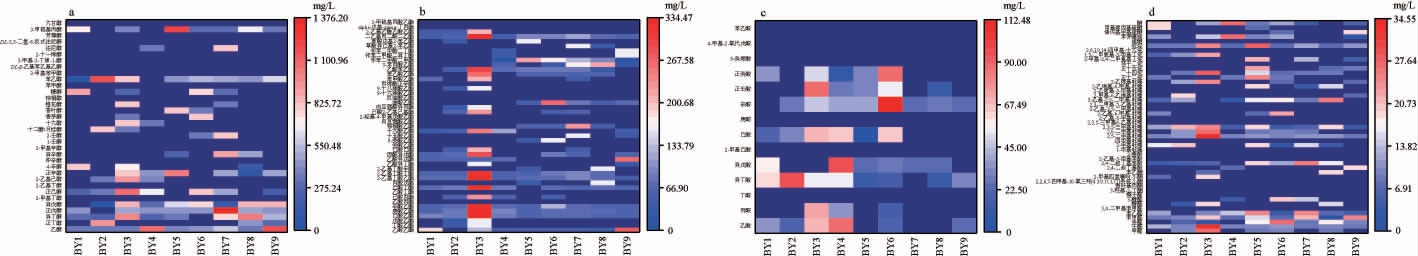
图5 分离酵母菌发酵液中各类别挥发性风味物质含量分析热图
Fig.5 Heat map for analysis of various categories volatile flavor substances contents in fermentation liquid of isolated yeasts
由图4及图5可知,从酵母菌发酵液中共检测到140种挥发性风味物质,均包括醇类、酯类、酸类、醛酮类、酚类、吡嗪类等其他物质,其中醇类、酯类和酸类是酵母菌发酵液的主要香气成分,占比高达90%~98%。
醇类物质是白酒的助香剂,沸点低,能拖带其他组分挥发,是白酒中不可或缺的味觉骨架成分之一[28]。由图4和5a可知,不同酵母菌发酵液中的醇类物质含量为394.44~1 734.97 mg/L,相对含量高达70%~85%。白酒的主要成分是水和乙醇,从这几种酵母菌发酵液中均或多或少的检测到乙醇,菌株BY4、BY7及BY9产生大量的乙醇,含量为196.85~656.38 mg/L;正戊醇具有杂醇味[29],菌株BY7发酵液中正戊醇含量最高,为105.21 mg/L,其他酵母菌发酵液中的正戊醇含量均<16.93 mg/L;异戊醇具有浓郁的花果香及略带辛辣的白兰地酒香味[29],菌株BY3、BY8及BY9发酵液中异戊醇的含量均>250 mg/L,而在菌株BY1发酵液中未检测到异戊醇;菌株BY1和BY3发酵液中4-辛醇含量较高,分别达1 376.27 mg/L和1 156.01 mg/L;苯乙醇是芝麻香型白酒关键风味物质之一,具有玫瑰香气[30],除菌株BY4不产苯乙醇外,其他酵母菌发酵液中的苯乙醇含量在101.31~305.39 mg/L之间;2-甲基苯乙醇仅在菌株BY4发酵液中检测到,含量为191.66 mg/L;3-甲硫基丙醇又叫菠萝醇,具有强烈的甜香、汤或肉样香气,是芝麻香香气特征成分之一[31],除菌株BY2和BY4外,其他酵母菌发酵液中均检测到该物质的存在。
酯类物质能够赋予白酒果香,是白酒香气的主体成分[32]。由图4和5b可知,不同酵母菌发酵液中的酯类物质含量为37.16~613.58 mg/L,相对含量为6%~25%,除菌株BY4和BY6外,其他菌株发酵液中的酯类物质总量仅次于醇类物质。乙酸乙酯具有香蕉或苹果的水果香气[29],菌株BY1、BY3及BY9发酵液中该物质含量较高,分别为125.22 mg/L、77.00 mg/L及194.84 mg/L,但在菌株BY2发酵液中未检测到该物质;己酸乙酯具有菠萝香[29],菌株BY3发酵液中该物质含量最高,为334.48 mg/L;苯乙酸乙酯、乙酸苯乙酯具有浓烈而甜的蜂蜜香气[29],这两种物质在菌株BY3发酵液中的含量分别为11.36 mg/L和27.77 mg/L。
酸类物质能够调节白酒的口感和后味,减少刺激、缓冲平衡及维持酯的香气的作用[33]。由图4和5c可知,不同酵母发酵液中酸类物质的含量为4.72~140.58 mg/L,相对含量为1%~18%,其中菌株BY4和BY6发酵液中总量较高,分别达到123.23 mg/L和140.58 mg/L。醋酸能够赋予酒体爽净感,菌株BY3和BY4发酵液中醋酸的含量分别为13.65 mg/L和19.24 mg/L,而在其他菌发酵液含量较少或未检测到;在菌株BY2发酵液中检测到13.5mg/L丁酸和13.1 mg/L异丁酸;辛酸带有脂肪味[29],在菌株BY6发酵液中检测112.48 mg/L辛酸,但菌株BY1发酵液中未检测到该物质。
醛酮类物质能够辅助白酒的香气,赋予白酒一种“香、爽”的口感[33]。由图4和5d可知,菌株BY5和BY7发酵液中的醛类物质含量较高,分别为42.92 mg/L、42.04 mg/L。苯甲醛具有杏仁和焦糖的气味[29],这9种酵母菌均能产生该物质;糠醛主要产生涩味和焦香[29],在菌株BY2、BY3及BY8发酵液中均能检测到该物质。酚类物质在白酒中含量很少,但呈香作用很大[34],在菌株BY5、BY7和BY8发酵液中分别检测到18.74 mg/L、25.24 mg/L和17.26 mg/L的2,4-二叔丁基苯酚。吡嗪类物质具有焦香或烤坚果香味,是芝麻香型白酒中重要的香气成分[35],在9种酵母菌发酵液中检测出多种吡嗪类物质,其中菌株BY3发酵液中吡嗪类物质总量最多,为7.04 mg/L。
由此可见,这9种酵母菌产生了大量与白酒香气息息相关的物质成分,在产香上既有共性又有特有的风味特性,其中菌株BY4、BY7和BY9能产生大量的乙醇等醇类物质和酯类物质,表明这3株菌在提高白酒产量上有较好的应用潜力,菌株BY3代谢产生的醇类、酯类及吡嗪类等物质的种类丰富、含量最高,表明该菌在产香方面有较好的应用潜力,可以根据应用的目的对这4株菌进行专项重点研究。
3 结论
通过可培养的方式检测到堆积40 h时芝麻香香型白酒酒醅中酵母菌的种类和数量最多,通过传统培养分离方法从此阶段共分离出9种类型酵母菌(BY1~BY9),通过形态观察及分子生物学技术鉴定,分别为库德里阿兹威毕赤酵母(Pichia kudriavzevii)、膜醭毕赤酵母(Pichia membranifaciens)、发酵毕赤酵母(Pichia fermentans)、Pichia exigua、戴尔有孢圆酵母(Torulaspora delbrueckii)、酿酒酵母(Saccharomyces cerevisiae)、Starmerella sorbosivorans、Starmerella apicola、异常威克汉姆酵母(Wickerhamomyces anomalus),其中Starmerella sorbosivorans首次在白酒酿造环境中分离。通过HS-SPME-GC-MS检测9种酵母菌发酵液中的挥发性物质成分,结果表明,这9种酵母菌产香既有共性又有特性,均能代谢产生醇类、酯类、酸类、醛酮类、酚类、吡嗪类等物质,其中醇类物种总量最多,其次是酯类或酸类,这三类物质占比高达90%~98%。其中,菌株BY4、BY7和BY9代谢产乙醇等醇类及酯类物质较多,菌株BY3代谢产生的醇类、酯类及吡嗪类等物质的种类丰富、含量最高。综上,芝麻香白酒堆积过程中有丰富的酵母菌种资源,酵母菌能够产生大量与白酒香气息息相关的物质成分,下一步探究酵母菌的生理特性,根据其产香特点有选择性的将酵母菌应用到白酒发酵环境中,以期为提升白酒品质提供菌株基础。
[1]高传强.芝麻香型白酒的典型工艺特征[J].酿酒,2022,49(2):3-15.
[2]李小龙.芝麻香型白酒发酵过程微生物群落演替及其驱动因素[D].无锡:江南大学,2019.
[3]李小东,高大禹,田庆贞,等.芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响[J].食品与发酵工业,2018,44(5):63-69.
[4]田瑞杰,张勇,冯大鸿,等.基于宏转录组学的浓香型白酒酒醅活性微生物群落空间异质性研究[J].轻工学报,2022,37(1):1-11.
[5]黎瑶依,胡小霞,黄永光.茅台镇酱香型白酒酿造环境中真菌菌群多样性分析[J].食品科学,2021,42(18):164-170.
[6]曹润洁,何宏魁,葛向阳,等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报,2019,46(6):1371-1380.
[7]杨建刚,苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
[8]李景辉.酱香型白酒生香酵母菌的筛选与应用[D].天津:天津科技大学,2021.
[9]李群,林斌,唐洁,等.清香型小曲白酒酿造中酵母资源解析及其耐受性能研究[J].食品与发酵工业,2022,48(9):41-47.
[10]王志山,刘晓昆,陈文浩,等.芝麻香型白酒大曲中酵母菌的分离与鉴定[J].生物资源,2019,41(6):550-556.
[11]罗玲,何静,徐丽萍,等.猕猴桃汁中酵母菌的分离鉴定及应用[J].中国酿造,2023,42(8):103-110.
[12]陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007(13):3785-3786,3792.
[13]崔新莹,吕志远,张梦梦,等.基于主成分分析法的中高温大曲香气物质评价模型的建立[J].食品安全质量检测学报,2023,14(7):279-287.
[14]任金玫,陈君平,李志健,等.十二种香型白酒相关研究概况[J].中国酿造,2022,41(4):13-19.
[15]李仍树,赵德义,王梦立,等.四种芝麻香型白酒酿造用曲理化性质和微生物群落的比较研究[J].中国酿造,2023,42(7):30-35.
[16]LI Y Y,CHENG Y X,WANG H,et al.Diverse structure and characteristics of the fungal community during the different rounds of Jiangflavoured Baijiu production in Moutai town[J].Food Sci Technol,2022,161(1):68-74.
[17]宋哲玮.酱香型白酒核心酿造菌群及群体代谢机制的研究[D].无锡:江南大学,2020.
[18]杜艾明,董孝元,李俊薇,等.清香型白酒酿造体系中酵母菌的分离鉴定及生产特性分析[J].食品科技,2021,46(7):29-36.
[19]杨宁,唐英,黄杰惠,等.酱香型白酒酒醅中高产酒精酵母的筛选及耐受性研究[J].中国酿造,2023,42(5):50-55.
[20]向丽萍,范斌强,杨志龙,等.一株耐酸性酿酒酵母的筛选鉴定及特性[J].食品与机械,2021,37(6):51-55.
[21]林斌,唐洁,江威,等.低产正丙醇酵母菌的筛选及其在清香型白酒中的应用[J].中国酿造,2023,42(4):131-136.
[22]DENG N, DU H, XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].J Agr Food Chem,2020,68(17):4903-4911.
[23]郝飞,吕锡斌,吴耀领,等.酱香型白酒酿造酒醅中酵母菌多样性研究[J].菌物学报,2019,38(5):620-630.
[24]崔东琦,罗小叶,班世栋,等.强化曲的制备及其在酱香型白酒中的应用[J].食品与发酵工业,2022,48(7):78-84.
[25]YOU L, WANG S, ZHOU R P, et al.Characteristics of yeast flora in Chinese strong-flavoured liquor fermentation in the Yibin region of China[J].J I Brewing,2016,122(3):517-523.
[26]张霞,雷学俊,刘芳,等.五粮液车间空气中的特征酵母菌及其挥发性风味物质分析[J].食品与发酵工业,2021,47(17):242-249.
[27]WANG J W,ZHAO M M,XIE N Y,et al.Community structure of yeast in fermented soy sauce and screening of functional yeast with potential to enhance the soy sauce flavor[J].Int J Food Microbiol,2022,370(1):625-631.
[28]侯雅馨,王俊山,武亚帅,等.浓香型白酒微量成分的研究进展[J].食品研究与开发,2022,43(20):194-205.
[29]章之柱,尹金彦,孟洋,等.桑葚果园中酿酒酵母的分离鉴定及特性研究[J].食品与发酵工业,2020,46(14):148-155.
[30]钱冲,廖永红,刘明艳,等.不同香型白酒的聚类分析和主成分分析[J].中国食品学报,2017,17(2):243-255.
[31]马景浩,王洋,张玉姣,等.微生物合成3-甲硫基丙醇的研究现状[J].中国酿造,2022,41(1):1-7.
[32]白乐宜,颜振敏,冯梦茹,等.四种芝麻香型白酒中香气活性成分分析[J].食品与发酵工业,2020,46(2):272-276.
[33]方超,刘治国,乔潞,等.基于感官定量描述分析法和GC-MS对山庄老酒3种香型白酒挥发性特征风味的分析[J].食品科学,2023,44(10):291-299.
[34]耿平兰,黄卫红,程化鹏.白酒中酚类物质及检测方法的研究进展[J].酿酒科技,2020(8):83-88.
[35]秦炳伟,吕志远,张梦梦,等.顶空固相微萃取-全二维气相色谱-飞行时间质谱解析泉香型白酒的风味物质[J].食品与发酵工业,2023,49(18):289-296.