红曲菌(Monascus spp.)是一类小型丝状腐生真菌[1],是我国重要的药食两用微生物[2],其在我国的应用可以追溯到汉朝。红曲菌可以产生多种有益的代谢产物(secondary metabolites,SM),如红曲色素(Monascus pigments,Mps),用于果酱、糖果、醋、调味品、发酵乳和腐乳等食品的着色[3],具有天然、绿色、营养等优点[4],此外,Mps在药品、化妆品、纺织、印染以及生物领域也占据重要地位[5]。因红曲菌的部分菌株会产生桔霉素(citrinin,CIT),使红曲制品的应用和出口受到限制[6],为了增加Mps而减少CIT,研究人员利用菌株筛选、改良、培养基优化及基因控制等方法对其进行了大量研究,已经取得了显著的成果[7-8]。
天鹅绒蛋白(velvet protein,VeA)最早于1965年在构巢曲霉(Aspergillus nidulans)中发现[9],2002年Hee-seo Kim首次发现构巢曲霉VeA由573个氨基酸组成,随后研究证实VeA存在于多数丝状真菌中,参与调控真菌的有性和无性繁殖[10-11]。随着研究的深入,Velvet家族VelB、VelC、VosA、VelD[12-13]蛋白相继鉴定,这些蛋白均具有Velvet结构域,且在丝状真菌中高度保守;研究还发现,VeA的N端存在一个高度保守的编码区域[14],连接VelB,在细胞质中形成VeA/VelB二聚体复合物并受光调控[15],影响丝状真菌生长发育及次级代谢产物的生成[16]。红曲菌的生长发育及代谢产物的生成也受光的调控[17],但红曲菌中VeA蛋白的功能及受光调控影响其生长发育及代谢产物的研究几乎未见报道。
1995年法国科学家Blanc等从紫红曲霉(Monascus purpureus)中分离出了CIT,它是一种具有肾脏毒素的真菌毒素[18],属聚酮类化合物,具有神经、肾脏、肝脏毒性,还可致畸、致癌和诱发基因突变等毒理特性[19],会造成线粒体膜渗透功能和细胞内氧化还原系统障碍[20],桔霉素与赭曲霉毒素A联合使用可造成肝细胞活性氧水平升高、脱氧核糖核酸(deoxyribonucleic acid,DNA)链断裂和线粒体介导的细胞凋亡,且毒性具有协同增强作用[21]。CIT不仅影响红曲菌的工业应用,也加深了红曲菌污染农产品的危害,对红曲的生产和应用产生了极大的负面作用,研究者对如何防治CIT污染,降低红曲菌中CIT合成,生产低产甚至不产CIT的红曲产品进行了大量的研究[22]。
前期大量实验发现,光能调控丝状真菌的生长发育、次级代谢和产毒能力[23]等,本课题组前期研究表明,300 lx红光可以促进红色红曲菌(Monascus ruber)M7生物量的积累和Mps生成,抑制CIT的合成[24]。因此,本研究选取黑暗、300 lx红光和300 lx白光进行光调控实验,以此探究不同光照对M.ruber M7野生菌株、MrVeA基因突变株ΔMrVeA和OEMrVeA生长发育和次级代谢的影响,旨在寻找高产Mps、低产或不产CIT的红曲菌株,并为其在产业化中的应用安全性提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
M.ruberM7野生菌株、MrVeA基因敲除和过表达技术分别构建基因缺失菌株(ΔMrVeA)和过表达菌株(OEMrVeA):本实验室保存。
1.1.2 化学试剂
体积分数为80%的甲醇、0.1%甲酸水、乙酸乙酯(均为色谱纯)、甲苯、异丙醇、甘油、氯仿(均为分析纯):天津市致远化学试剂有限公司;乙腈、甲醇(均为色谱纯):赛默飞世尔科技(中国)有限公司;甲酸(色谱纯):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取200 g土豆,去除表皮,切成1 cm3大小,加蒸馏水煮沸30 min,纱布过滤收集滤液,加入20 g葡萄糖,15 g琼脂粉,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min。
察氏酵母膏琼脂(Czapek yeast exatract agar,CYA)培养基:NaNO3 3.0 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,酵母浸膏5.0 g,蔗糖30 g,琼脂粉15 g,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min。
25%甘油硝酸盐琼脂基础(25% glycerol nitrate agar base,G25N)培养基:CYA培养基中加入25%(V/V)的甘油,121 ℃高压蒸汽灭菌20 min。
麦芽浸膏琼脂(malt extract agar,MEA)培养基:麦芽抽提物20 g,蛋白胨1 g,葡萄糖20 g,琼脂15 g,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min[26]。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:取200 g土豆,去除表皮,切成1 cm3大小,加蒸馏水煮沸30 min,纱布过滤收集滤液,加入20 g葡萄糖,加蒸馏水至1 000 mL,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
A580型双光束紫外可见分光光度计:翱艺仪器(上海)有限公司;ZQZY-88CJ型振荡培养箱:上海知楚仪器有限公司;HP250GS型智能人工气候箱:武汉瑞华仪器设备有限责任公司;Water e2695超高效液相色谱仪:美国Waters公司;5515R高速冷冻离心机、JA5003N电子天平:梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 M.ruber M7和MrVeA基因相关突变株的光培养
将M. ruber M7、MrVeA基因相关突变株ΔMrVeA和OEMrVeA菌株接种于PDA试管斜面,28 ℃避光培养14 d后,加5 mL灭菌蒸馏水刮洗斜面,经三层无菌擦镜纸过滤,收集孢子悬液,用血球计数板计数,并测量菌丝体干质量,用每克菌丝体能产生的孢子量来衡量其产孢能力。调整孢子液最终浓度为105个/mL。取100 μL孢子悬液接种于装液量为30 mL/100 mL PDB培养基中,在光照强度设置为300 lx的红光、白光下于培养箱28 ℃静置培养,以避光(黑暗)培养为对照。
1.3.2 不同光照对M.ruber M7及MrVeA基因相关突变株
菌落形态、显微特征分析
将M.ruber M7、ΔMrVeA和OEMrVeA的孢子悬液取0.5μL分别点接于PDA、CYA、G25N、MEA(各培养基体积为25mL)培养基中,28℃培养10d后,观察其菌落形态;将载玻片分别插在(PDA、CYA、G25N、MEA)平板中,28 ℃培养7 d后,取边缘菌丝在显微镜下观察闭囊壳和分生孢子的产生情况。
1.3.3 不同光照对M.ruber M7及MrVeA基因相关突变株
生长状况、生物量分析
取M.ruber M7、ΔMrVeA和OEMrVeA的孢子悬液0.5 μL点接于PDA培养基中,以避光(黑暗)培养为对照,在光照强度设置为300 lx的红光、白光条件下培养11 d,采用十字交叉法在第3、5、7、9、11天时测量单菌落菌株的菌落直径,对比其生长状况。
另取M.ruber M7、ΔMrVeA和OEMrVeA的孢子悬液各100 μL,按照1.3.1的方法培养15 d,并于第5、7、9、11、13、15天取样,每个样品取3个平行,将液态培养的菌丝体冻干后称量,测定生物量。
1.3.4 不同光照对M.ruber M7及MrVeA基因相关突变株
胞内、胞外Mps含量分析
用1.3.1的方式培养,于第5、7、9、11、13、15天取样,纱布过滤分离发酵液和菌丝体,将菌丝体冻干,加入1 mL体积分数为80%的甲醇,室温超声提取30 min;由于黄色素、橙色素、红色素分别在波长380 nm、470 nm、505 nm处有最大吸收,用紫外分光光度计在波长380 nm、470 nm、505 nm处测定吸光度值表示菌株的胞内黄色素、橙色素、红色素产量;发酵液采用紫外分光光度计分别在波长380 nm、470 nm、505 nm处测定吸光度值表示菌株胞外色素产量。色素产量(A)=吸光度值(OD值)×稀释倍数/菌丝干质量,单位是U/g[23]。
1.3.5 不同光照对M.ruber M7及MrVeA基因相关突变株
CIT含量分析
把过滤得到的发酵液用等体积的甲苯-乙酸乙酯-甲酸(体积比7∶3∶1)混合溶剂萃取,12 000 r/min离心10 min,取上层有机相于洁净的烧杯中,65 ℃水浴挥干,用体积分数80%甲醇萃取后经0.22 μm滤膜过滤。利用超高效液相色谱荧光检测器(ultra-high performance liquid chromatography-fluorescence detection,UPLC-FLD)检测CIT含量。UPLC色谱条件:Phenomenex C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相:A 0.1%甲酸水,B乙腈,洗脱程序为:0~3 min,90%A和10%B;3~10 min,30%A和70%B;10.01~12 min,10%A和90%B;12.01~15 min,90%A和10%B;柱温为40 ℃;激发波长330 nm,发射波长500 nm;流速0.3 mL/min,进样量为2 μL。所得样品CIT的峰面积与CIT标准品的峰面积对比计算发酵液中CIT的含量[25]。
1.3.6 数据处理
单因素试验重复3次,以“平均值±标准差”方式表示,采用Origin 2019软件处理及分析;釆用SPSS 19.0统计软件中Duncan法进行样本间差异显著性分析[24]。
2 结果与分析
2.1 光调控M.ruber M7及MrVeA基因相关突变株菌落形态、显微特征的变化
将M.ruber M7和MrVeA基因相关突变株在黑暗、红光、白光条件下,分别使用试管斜面28 ℃培养14 d后用无菌水洗下孢子,计算产孢量,结果见图1。由图1可知,黑暗条件下,ΔMrVeA突变株孢子产量降低65%,OEMrVeA突变株产孢量降低30%;有研究表明[27],VeA基因缺失后突变株不会产生子囊果,当VeA基因过表达时,分生孢子的数量减少,这与研究结果一致。红光条件下,M.ruber M7及MrVeA基因相关突变菌株的产孢量与黑暗条件相比均有增加,M.ruber M7产孢量增加16%;ΔMrVeA突变株孢子产量增加41.7%;OEMrVeA突变株产孢量增加30%,意味着红光刺激M.ruber M7及MrVeA基因相关突变菌株产孢;白光条件下,M.ruber M7和OEMrVeA突变株产孢量分别下降30%、17.12%,ΔMrVeA突变株产孢增加,说明白光抑制了M.ruber M7及OEMrVeA突变株产孢。
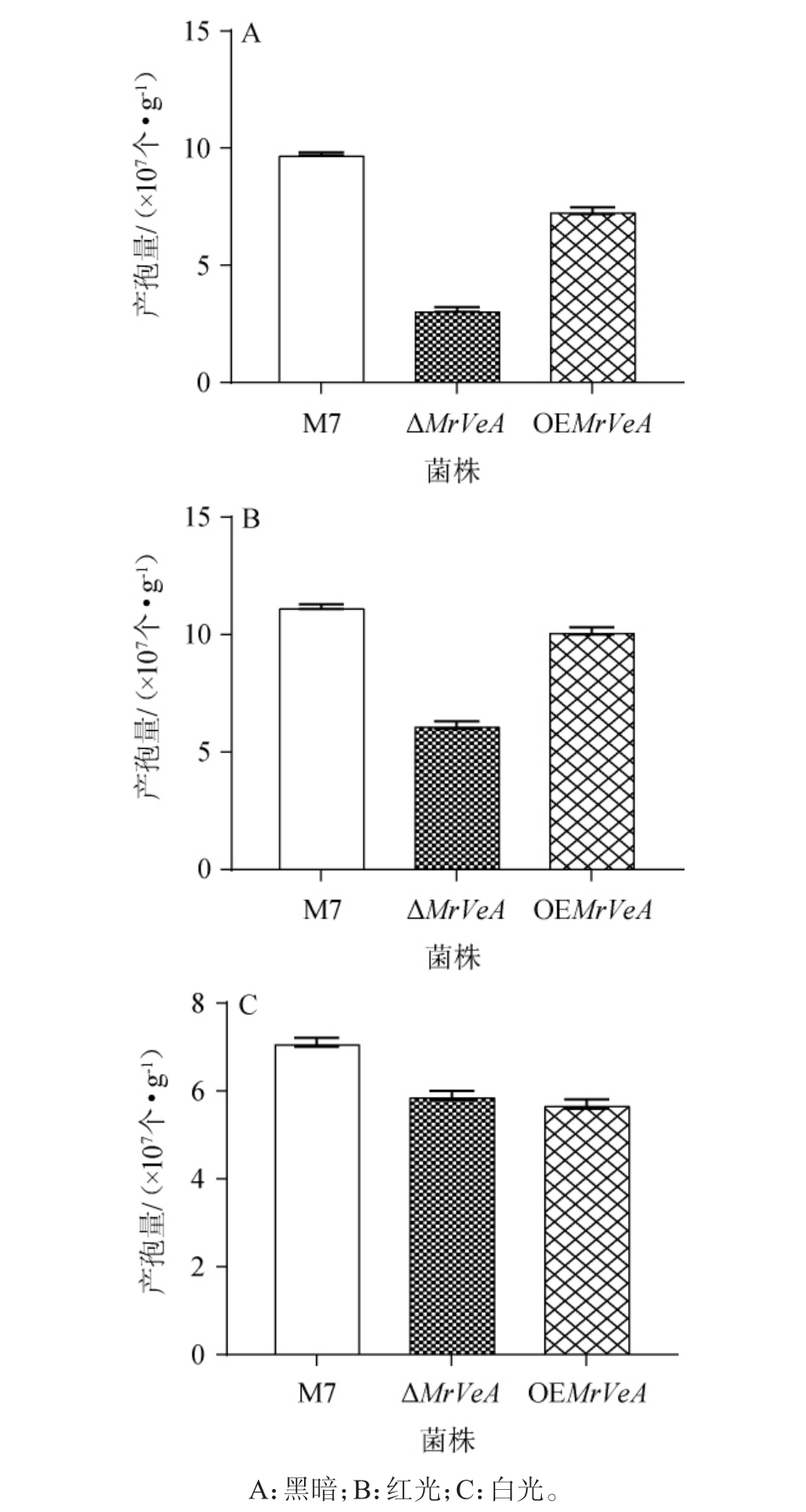
图1 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株的产孢量
Fig.1 Sporulation yield of Monascus ruber M7 and MrVeA gene related mutant strains under different light conditions
不同光照条件下M.ruber M7及MrVeA基因相关突变株的菌落形态见图2。由图2A可知,在黑暗条件下,M.ruber M7菌株的菌落边缘整齐,菌落中间有大量黄棕色孢子产生,菌落边缘气生菌丝呈乳白色;ΔMrVeA突变株气生菌丝发达细密,菌落呈绒地毯状,边缘整齐,菌落几乎呈白色;OEMrVeA突变株相较M.ruber M7菌株菌落颜色变浅,菌落较大且褶皱增多。由图2B可知,红光促进了M.ruber M7及MrVeA基因相关突变株气生菌丝发育,菌落直径变大,ΔMrVeA突变株的菌落形态无明显变化。由图2C可知,白光抑制了M.ruber M7及MrVeA基因相关突变株的菌丝发育,菌落直径均变小,M.ruber M7菌落发白,ΔMrVeA突变株菌落颜色变深,OEMrVeA突变株菌落颜色变浅。

图2 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株的菌落形态
Fig.2 Colony morphologies of Monascus ruber M7 and MrVeA gene related mutant strains under different light conditions
PDA、MEA培养基中的碳源是葡萄糖,有利于观察闭囊壳,CYA、G25N培养基中的碳源是蔗糖,有利于观察分生孢子。不同光照条件下M.ruber M7及MrVeA基因相关突变株的显微形态见图3。由图3A可知,在黑暗条件下,M.ruber M7的闭囊壳大而饱满,分生孢子多而圆润,菌丝粗壮,分枝多;但ΔMrVeA突变株的菌丝细密分枝少,分生孢子和闭囊壳均减少且直径变小,意味着敲除MrVeA基因抑制了红曲菌M7有性繁殖/无性繁殖;而OEMrVeA突变株的闭囊壳、分生孢子形态与M.ruber M7基本一致。由图3B可知,红光促进了M.ruber M7和OEMrVeA突变株的有性繁殖/无性繁殖,其分生孢子和闭囊壳均有增加,ΔMrVeA突变株的显微形态与黑暗条件下无明显差异。由图3C可知,白光抑制了M.ruber M7和OEMrVeA突变株产生闭囊壳和分生孢子,其菌丝变细,拥有更多分生孢子柄,表明白光抑制M.ruber M7和OEMrVeA突变株的有性繁殖/无性繁殖,而ΔMrVeA突变株的显微形态与黑暗和红光条件下无明显变化,亦说明红光和白光均不影响其显微形态。
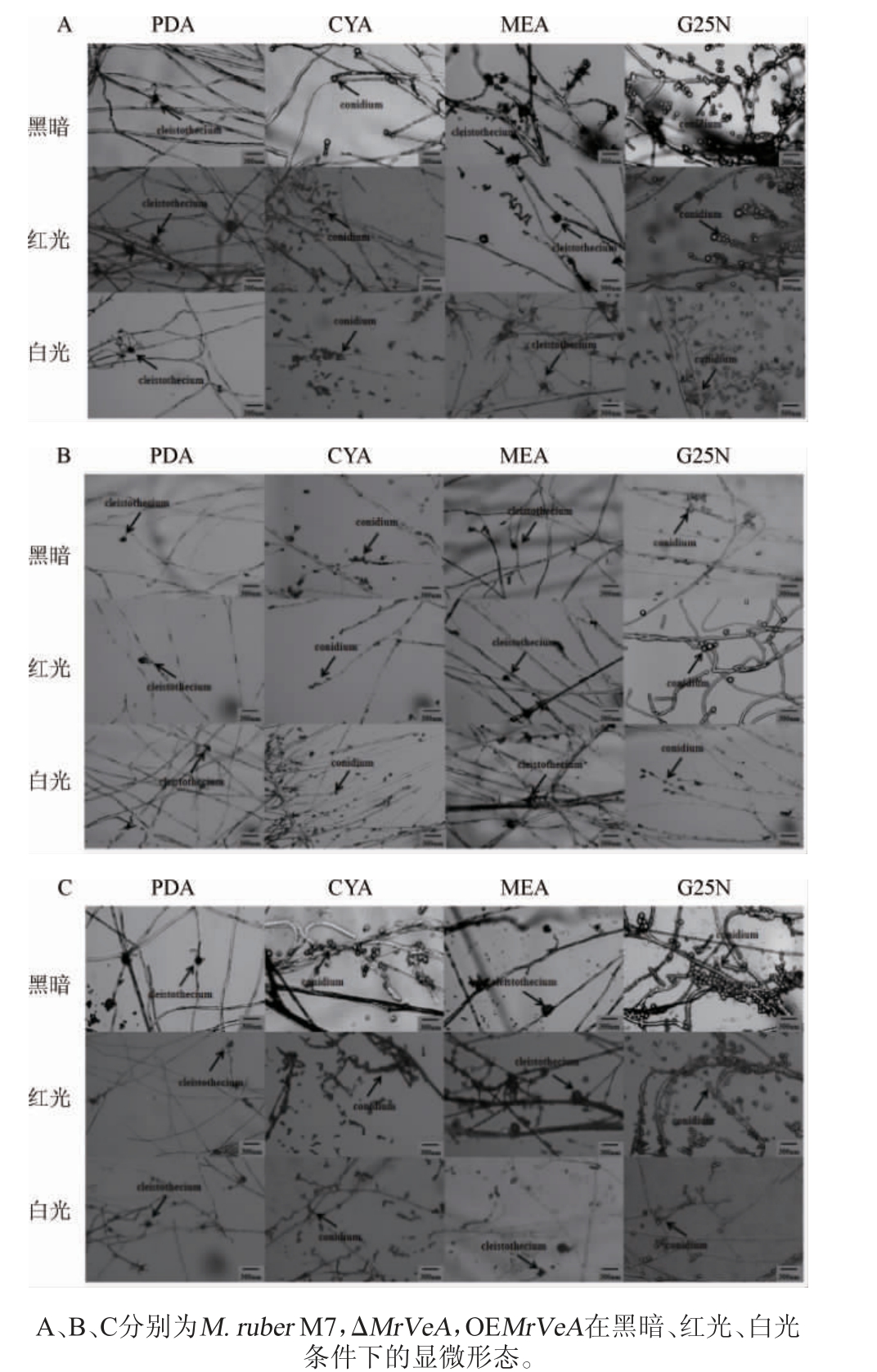
图3 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株的显微形态
Fig.3 Microscopic morphologies of Monascus ruber M7 and MrVeA gene related mutants under different light conditions
2.2 光调控M.ruber M7及MrVeA基因相关突变株生长状况、生物量的变化
2.2.1 光调控M.ruber M7及MrVeA基因相关突变株生长状况分析
对黑暗、红光、白光条件下M.ruber M7和MrVeA基因相关突变株生长3~11 d的菌落直径进行测定,结果见图4。由图4可知,在黑暗、红光和白光下,M.ruber M7和OEMrVeA突变株的菌落直径无明显差异,ΔMrVeA突变株的菌落直径始终比M.ruber M7和OEMrVeA大,在不同光照条件下OEMrVeA突变株的菌落直径与M.ruber M7基本一致,这说明VeA基因可调控菌株的生长。VeA基因的缺失和过表达对真菌的生长发育有重要影响[28]。
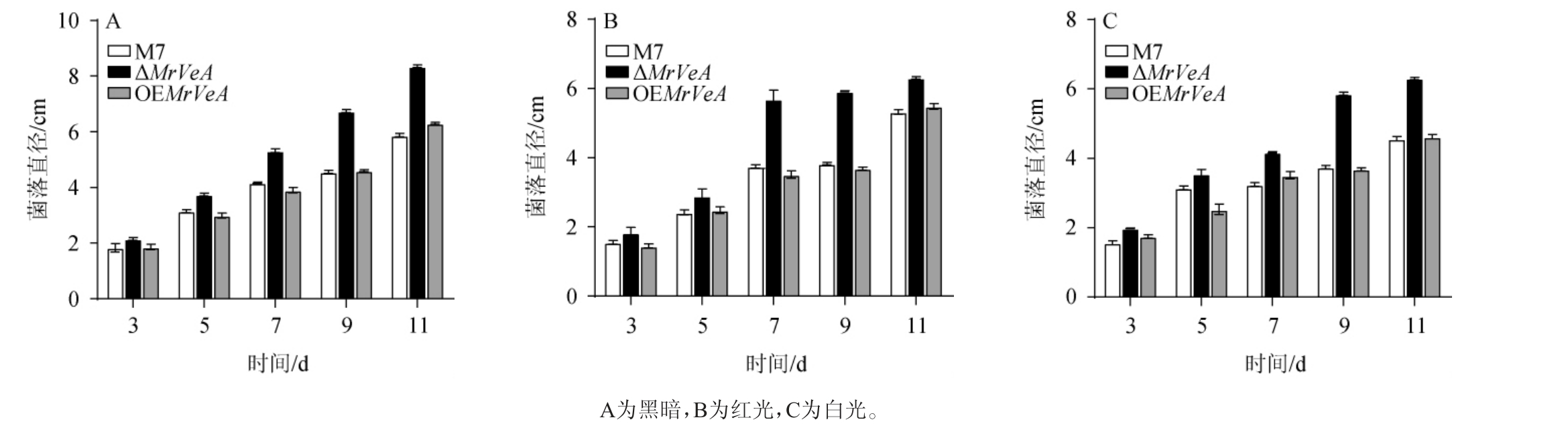
图4 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株的生长状况
Fig.4 Growth status of Monascus ruber M7 and MrVeA gene related mutants under different light conditions
2.2.2 光调控M.ruber M7及MrVeA基因相关突变株生物量分析
对M.ruber M7和MrVeA基因相关突变株生长3~15 d生物量进行测定,结果见图5。由图5可知,在黑暗、红光和白光下,M.ruber M7和OEMrVeA突变株的生物量无明显差异,突变株ΔMrVeA的生物量始终大于M. ruber M7和OEMrVeA。结果说明,敲除MrVeA基因影响了红曲菌的生长发育,而过表达MrVeA基因不影响其生长发育。红光促进M.ruber M7及MrVeA基因相关突变株的生长发育,白光反之。
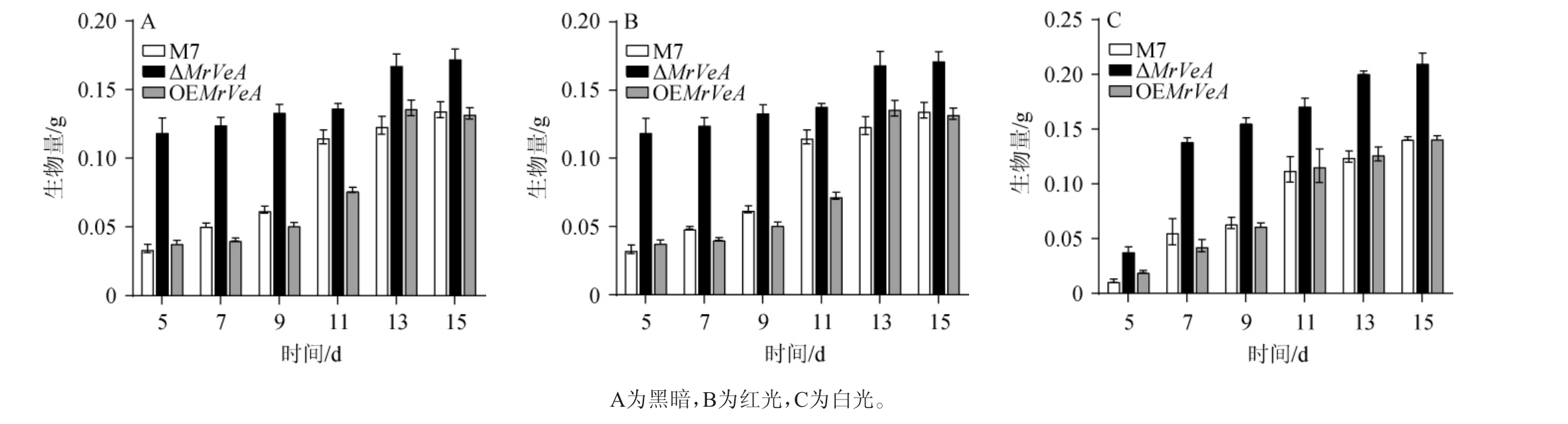
图5 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株的生物量变化
Fig.5 Changes of biomass of Monascus ruber M7 and MrVeA gene related mutants under different light conditions
2.3 光调控M.ruber M7及MrVeA基因相关突变株产胞内外Mps的变化
在28 ℃黑暗、红光、白光条件下,培养15 d,以M.ruber M7野生菌株为对照,分析了MrVeA基因相关突变株胞内外黄、橙、红色素的变化。
2.3.1 光调控M.ruber M7及MrVeA基因相关突变株产胞外Mps的变化
由图6~图8可知,在不同光照下,M.ruber M7和MrVeA相关突变株的胞外色素随着发酵时间的延长持续增加,M.ruber M7和OEMrVeA突变株的胞外色素无明显差异。黑暗条件下,ΔMrVeA突变菌株胞外黄、橙、红色素在15 d下降了59.24%,53.76%,29.67%(图6-A-1,7-A-1,8-A-1);红光条件下,ΔMrVeA突变菌株胞外黄、橙、红色素在15 d下降了70.26%,59.32%,60.61%(图6-B-2,7-B-2,8-B-2);白光条件下,ΔMrVeA突变菌株胞外黄、橙、红色素在15 d下降了16.17%,35.16%,52.00%(图8-C-1,8-C-2,8-C-3)。以上结果说明,缺失MrVeA基因的红曲菌大幅度丧失了产胞外色素能力。
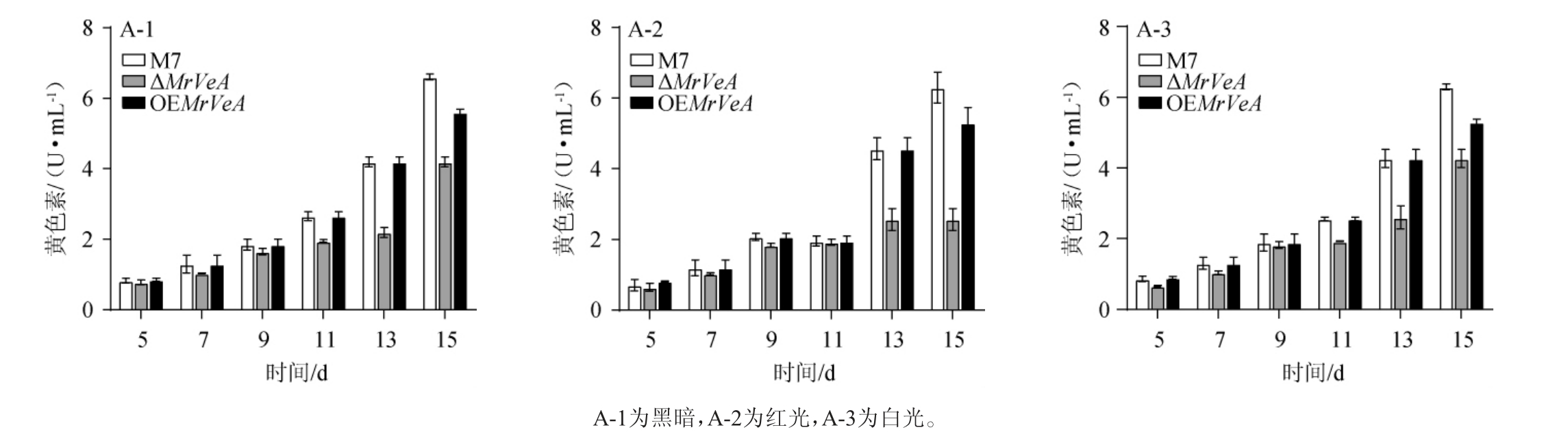
图6 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株胞外黄色素变化
Fig.6 Changes of extracellular yellow pigments in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
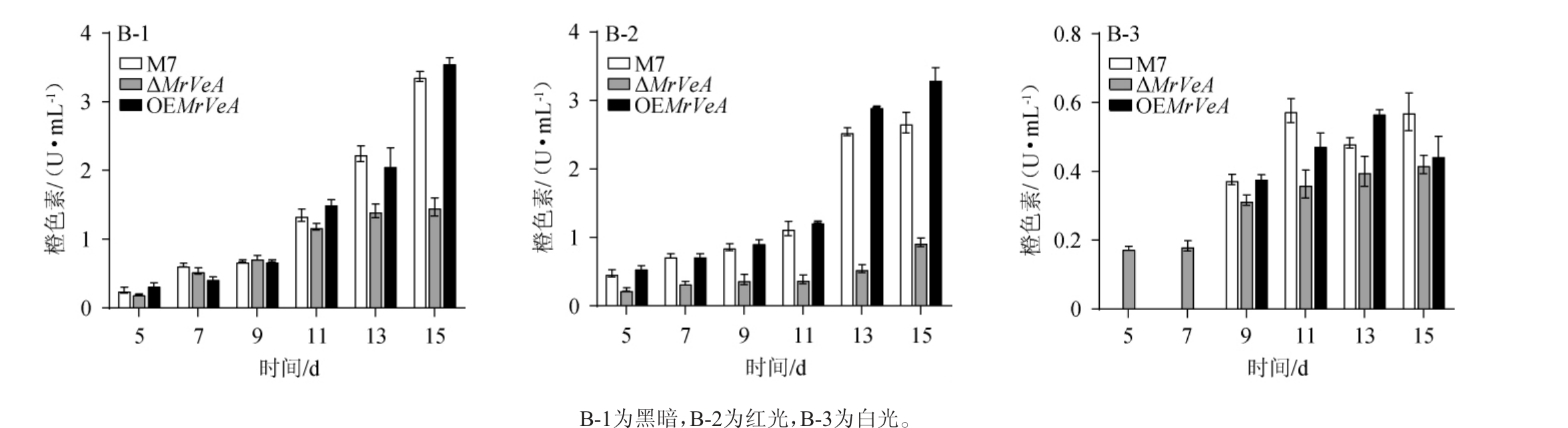
图7 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株胞外橙色素变化
Fig.7 Changes of extracellular orange pigments in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
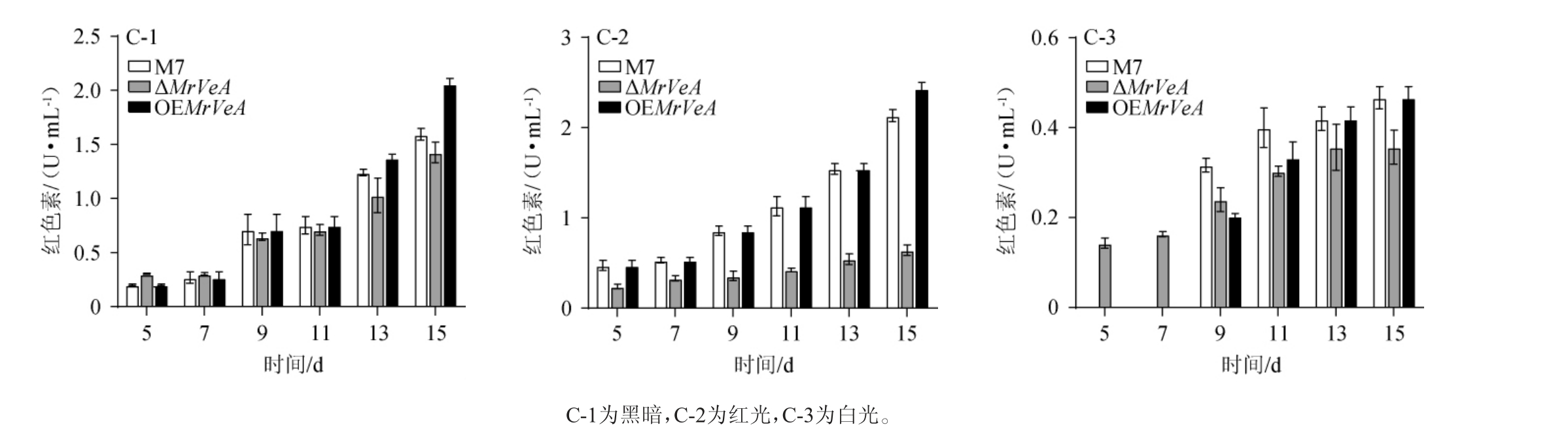
图8 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株胞外红色素变化
Fig.8 Changes of extracellular red pigments in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
2.3.2 光调控M.ruber M7及MrVeA基因相关突变株产胞内Mps的变化
由图9~图11可知,在黑暗条件下,ΔMrVeA突变株的Mps产量极低,对其胞内黄色素产量进行比较,M.ruber M7在13 d、15 d时分别降低了95.23%、96.09%;对其橙色素产量进行比较,M.ruber M7在13 d、15 d时分别降低了97.03%、97.92%;对其红色素产量进行比较,M. ruber M7在13 d、15 d时分别降低了98.26%、97.89%;在红光条件下,ΔMrVeA突变株胞内黄色素产量在13 d、15 d时相较M.ruber M7分别降低了72.33%、66.81%,橙色素产量在13 d、15 d时相较M. ruber M7分别降低了67.75%、64.44%,红色素产量在13 d、15 d时相较M.ruber M7分别降低了62.45%、62.50%;在白光条件下,ΔMrVeA突变株胞内黄色素产量在13 d、15 d时相较M.ruber M7分别降低了41.43%、27.16%,橙色素产量在13 d、15 d时相较M.ruber M7分别降低了48.97%、31.86%,红色素产量在13 d、15 d时相较M. ruber M7分别降低了46.19%、31.62%,意味着MrVeA正调控红曲菌生成Mps。
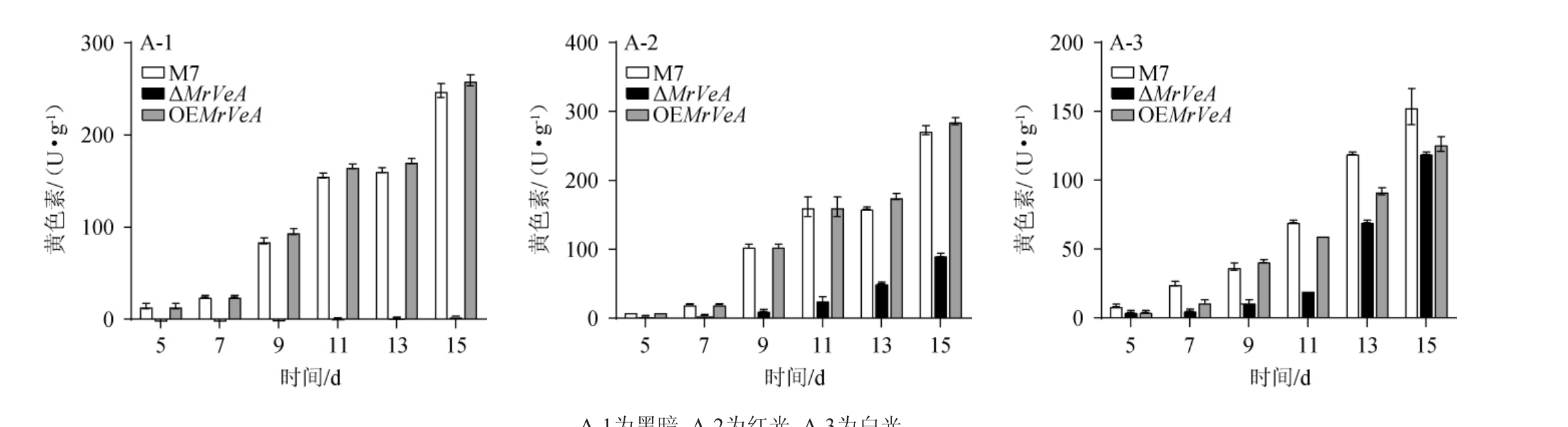
图9 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株胞内黄色素变化
Fig.9 Changes of intracellular yellow pigments in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
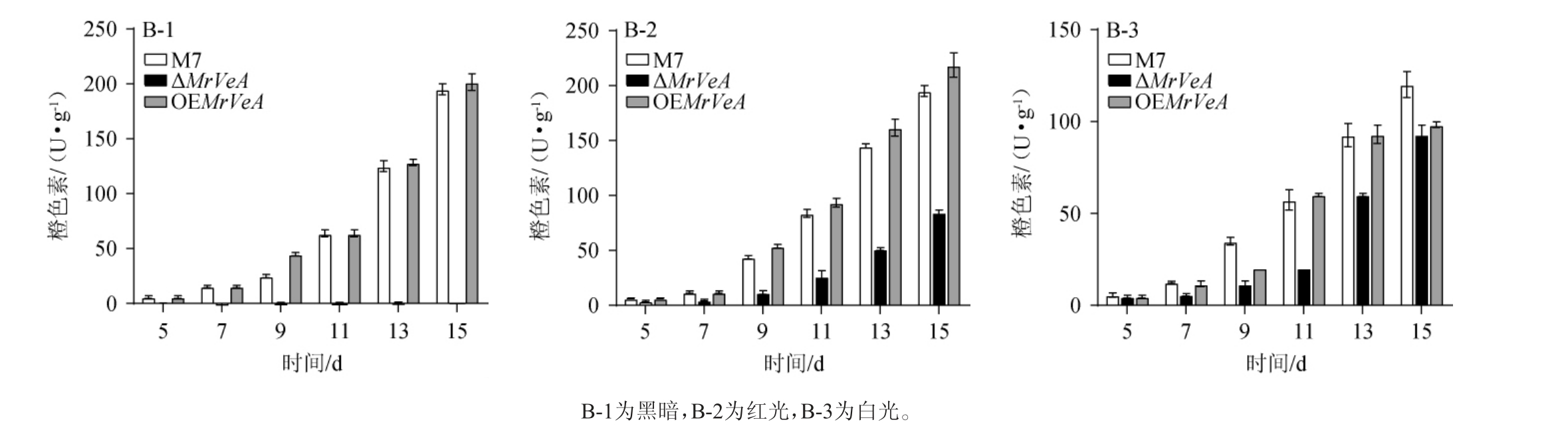
图10 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株胞内橙色素变化
Fig.10 Changes of intracellular orange pigments in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
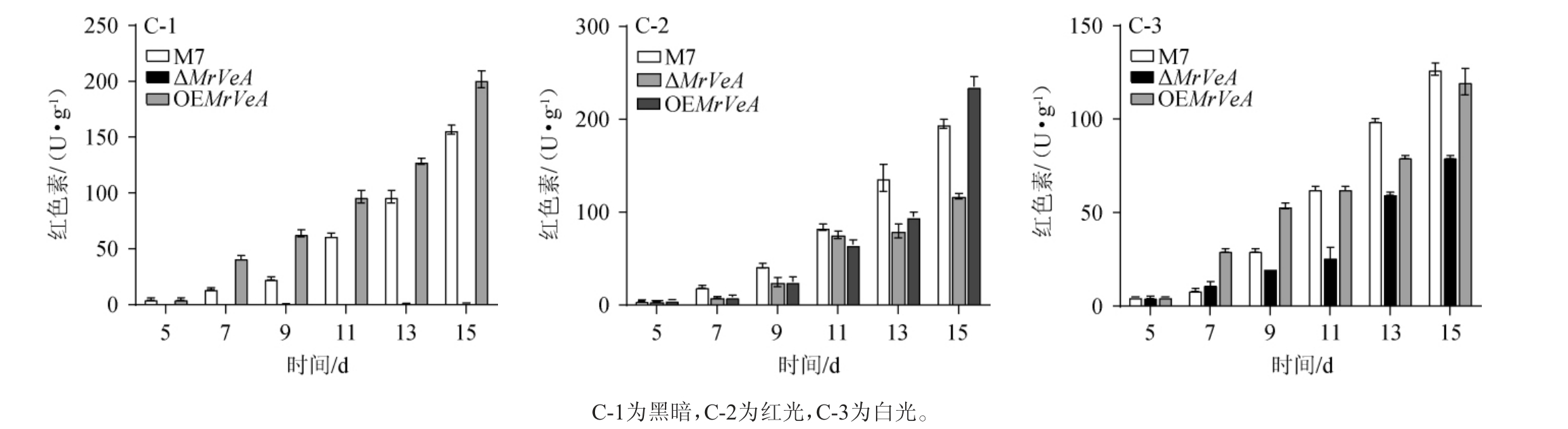
图11 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株胞内红色素变化
Fig.11 Changes of intracellular red pigments in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
在发酵末期(15 d)时,红光条件下M.ruber M7的胞内黄、橙、红色素比黑暗条件下增加了9.50%、18.84%、28.18%,白光条件下M.ruber M7的胞内黄、橙、红色素比黑暗条件下减少了43.22%、32.49%、27.27%;而ΔMrVeA突变株在红光和白光条件下的胞内黄、橙、红色素比黑暗条件下分别增加了89.33%、95.24%、95.97%和90.54%、95.47%、95.77%;OEMrVeA突变株在红光条件下比黑暗条件下胞内黄、橙、红色素增加了13.46%、7.01%、21.83%,在白光条件下比黑暗条件下胞内黄、橙、红色素减少了57.36%、58.36%、42.02%。
综上,M.ruber M7和突变株OEMrVeA的胞内外色素产量无显著差异,突变株OEMrVeA的产色素能力要略高于M.ruber M7,红光刺激M.ruber M7和突变株OEMrVeA生成色素,白光抑制M.ruber M7和突变株OEMrVeA生成色素。
2.4 光调控M.ruber M7及MrVeA基因相关突变株产CIT的变化
通过UPLC检测分析了在黑暗、红光、白光条件下28 ℃培养5~15 d后M.ruber M7和MrVeA基因相关突变株产CIT能力的变化,结果见图12。
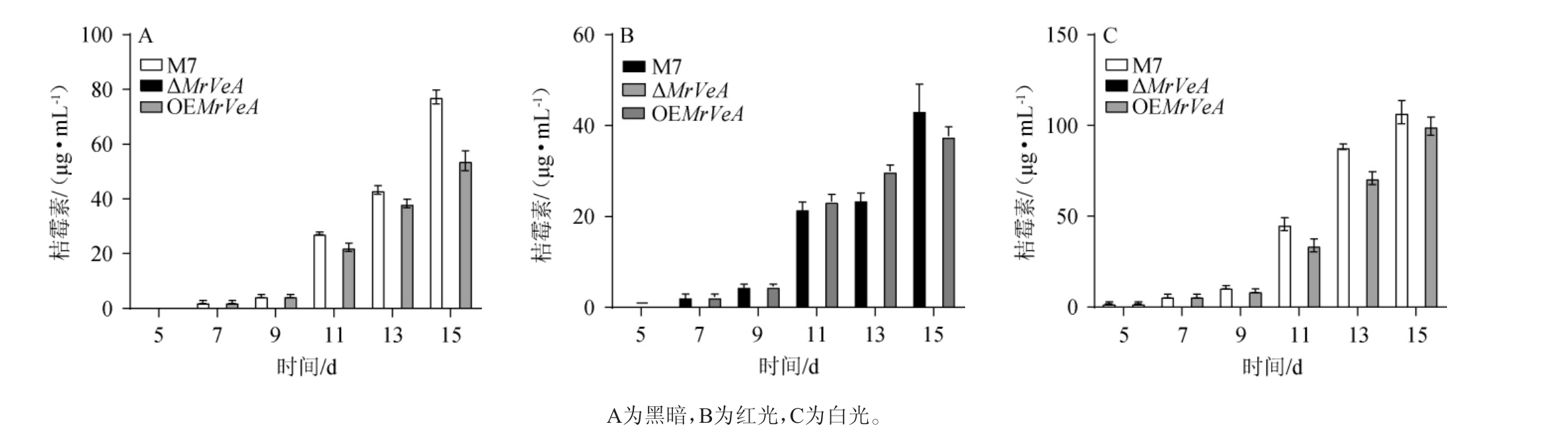
图12 不同光照条件下红色红曲菌M7及MrVeA基因相关突变株桔霉素含量变化
Fig.12 Changes of citrinin contents in Monascus ruber M7 and MrVeA gene related mutants under different light conditions
由图12可知,不论在黑暗、红光还是白光的条件下,ΔMrVeA突变株都不能产生CIT,说明MrVeA正调控红曲菌产CIT。在黑暗条件下,M.ruber M7与突变株OEMrVeA生成CIT含量无明显变化。有研究表明,构巢曲霉[29]、寄生曲霉、黄曲霉[30]中敲除VeA基因,可有效防止毒素的产生。红光条件下,突变株OEMrVeA比较M.ruber M7的CIT含量在13 d和15 d分别下降了35.31%、31.74%,且M.ruber M7产CIT含量比黑暗下降低32.01%、25.80%,突变株OEMrVeA CIT含量比黑暗下降低52.54%、45.52%,比黑暗下M.ruber M7降低56.02%、49.35%。白光条件下,突变株OEMrVeA对比M.ruber M7的CIT含量在13 d和15 d分别下降了18.37%、7.88%,差别不大;突变株OEMrVeA对比黑暗条件下CIT升高了24.29%、10.70%,比黑暗条件下M.ruber M7升高了18.30%、28.36%,意味着红光抑制CIT的生成,白光刺激CIT的生成。
3 结论
本研究主要对M.ruber M7、MrVeA基因相关突变株进行不同光调控发酵实验,对光调控红曲菌的生长发育和次级代谢产物进行分析总结。结果表明,在任何光照条件下,以M.ruber M7野生型菌株作对照可知,缺失MrVeA基因,ΔMrVeA突变株的有性繁殖、无性繁殖均减少,不产MPs、CIT,光照会弥补了因缺失MrVeA基因引起的色素产量下降的问题;在黑暗条件下,敲除MrVeA基因促进红曲菌的生长速度,但有性繁殖和无性繁殖均被抑制;ΔMrVeA突变株产色素能力降低约95%,不产CIT。而OEMrVeA突变株不影响红曲菌生长发育,CIT的产量降低,意味着MrVeA基因是红曲菌的全局调控因子。红光对ΔMrVeA突变株的表型特征影响较小,但红光对M.ruber M7和MrVeA基因相关突变株的生长发育有促进作用,而且红光促进OEMrVeA产Mps能力,抑制其产CIT的能力。在白光条件下,三种菌株的有性和无性繁殖均被抑制,白光抑制红曲菌产Mps的能力,刺激红曲菌产CIT的能力。该研究结果可为低产甚至不产CIT的红曲菌工业化应用提供参考。
[1]林风.福建古田为红曲发源地考证[J].中草药,2017,48(13):2793-2800.
[2]周康熙,陈颖,倪莉.红曲霉分离纯化、分类和鉴定研究进展[J].中国酿造,2021,40(1):7-13.
[3]ZHU B,QI F Y,WU J J,et al.Red yeast rice:A systematic review of the traditional uses, chemistry, pharmacology, and quality control of an important Chinese folk medicine[J].Front Pharmacol,2019,10:1449.
[4]尹鹤婷.关于天然色素稳定性的综述[J].食品工业,2024,45(1):178-183.
[5]SHI J,QIN X L,ZHAO Y R,et al.Strategies to enhance the production efficiency of Monascus pigments and control citrinin contamination[J].Process Biochem,2022,117:19-29.
[6]LIU Z B, WANG Z Y, LV X C, et al.Comparison study of the volatile profiles and microbial communities of Wu yi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[7]ROBERTS R G.The velvet underground emerges[J].PLoS Biol, 2013,11(12):e1001751.
[8]苏荣荣,杨武,王威,等.基于均匀设计法的枯草芽孢杆菌me-1的发酵培养基优化[J].安徽农业科学,2019,47(23):164-166,173.
[9]蒋沅岐,董玉洁,周福军,等.红曲的化学成分、药理作用及临床应用研究进展[J].中草药,2021,52(23):7379-7388.
[10]郝佳,范丽影,许朵霞,等.红曲色素生物合成、制粒及其理化性质研究进展[J].粮食与食品工业,2019,26(5):30-34.
[11]PARK H S,NAM T Y,HAN K H,et al.VelC positively controls sexual development in Aspergillus nidulans[J].PLoS One,2017,9(2):e89883.
[12]CHAUDHARY V, KATYAL P, POONIA A K, et al.Natural pigment from Monascus:The production and therapeutic significance[J].J Appl Microbiol,2022,133(1):18-38.
[13]何霞,黄汇惠,马鹏,等.VeA、VelB蛋白在真菌中的研究进展[J].食品研究与开发,2023,44(7):163-168.
[14]SCHUMACHER J, GORBUSHINA A A.Light sensing in plant-and rock-associated black fungi[J].Fungal Biol,2020,124(5):407-417.
[15]DE OLIVEIRA FILHO J W G,ISLAM M T,ALI E S,et al.A comprehensive review on biological properties of citrinin[J].Food Chem Toxicol,2017,110:130-141.
[16]刘宏,陈迪,杨华,等.红光对紫色红曲霉生长及色素和桔霉素产量的影响[J].现代食品科技,2017,33(7):180-185,140.
[17]刘宏,陈迪,陈勉华,等.不同单色光对紫色红曲霉生长、色素和桔霉素合成的影响[J].食品科学技术学报,2019,37(2):48-55.
[18]何毅.红色红曲菌M7高效基因敲除体系的构建及桔霉素生物合成途径的解析[D].武汉:华中农业大学,2015.
[19]林凤,李慧敏,王玉梅,等.红曲霉色素及代谢物研究进展[J].中国调味品,2019,44(12):188-191.
[20]OAKLEY C E,AHUJA M,SUN W W,et al.Discovery of McrA,a master regulator of Aspergillus secondary metabolism[J].Mol Microbiol,2017,103(2):347-365.
[21]MARICˇA,SKOCˇAJ M,LIKAR M,et al.Comparison of lovastatin,citrinin and pigment production of different Monascus purpureus strains grown on rice and millet[J].J Food Sci Technol,2019,56(7):3364-3373.
[22]BAYRAM Ö, FEUSSNER K, DUMKOW M, et al.Changes of global gene expression and secondary metabolite accumulation during lightdependent Aspergillus nidulans development[J].Fungal Genet Biol,2016,87:30-53.
[23]王丽玲.红色红曲菌M7中光受体基因的功能研究[D].武汉:华中农业大学,2017.
[24]徐素吟.红色红曲菌M7中桔霉素生物合成的调控机制解析[D].武汉:武汉轻工大学,2022.
[25]李傲然.红色红曲菌pksCT基因的RNA干扰菌株构建及影响桔霉素调控解析[D].武汉:武汉轻工大学,2020.
[26]KIM H,HAN K,KIM K,et al.The veA gene activates sexual development in Aspergillus nidulans[J].Fungal Genet Biol, 2002, 37(1): 72-80.
[27]马权,刘永翔,刘作易.丝状真菌veA基因的研究进展[J].贵州农业科学,2012,40(3):28-31.
[28]HÖFER A M,HARTING R,AßMANN N F,et al.The velvet protein Vel1 controls initial plant root colonization and conidia formation for xylem distribution in Verticillium wilt[J].PLoS Genet,2021,17(3):e1009434.
[29]DU W,OBRIAN G R,PAYNE G A.Function and regulation of aflJ in the accumulation of aflatoxin early pathway intermediate in Aspergillus flavus[J].Food Addit Contam,2007,24(10):1043-1050.
[30]CHANG P K.Lack of interaction between AFLR and AFLJ contributes to nonaflatoxigenicity of Aspergillus sojae[J].J Biotechnol,2004,107(3):245-253.