酱香型白酒是中国传统白酒的经典代表之一,具有酱香突出、口味细腻、酒体醇厚和回味悠长等独特的口感风味[1]。近年来,中国白酒呈现“酱酒热”,越来越多的酒厂涉足酱香型白酒酿造,因此,酱香型白酒需要不断提升自身品质与质量提升产品竞争力[2]。酱香型白酒的香味物质主要由功能菌群代谢而形成。与其他香型白酒相比,酱香型白酒中吡嗪类化合物的含量较高。吡嗪类化合物作为酱香型白酒的关键香味物质之一,也是白酒中的健康因子,为酒体提供了馥郁的烘焙和坚果香气。芽孢杆菌(Bacillus)为酱香大曲的优势微生物,能分泌蛋白酶、淀粉酶和纤维素酶等多种酶类,代谢生成吡嗪类化合物的前体物质,有利于提高酱香大曲的品质[3],进而影响酱香型白酒的品质与风格[4]。在相关研究中,罗建超等[5]研究发现,芽孢杆菌在高温、偏酸性的环境下能够产生大量的酶类及代谢物,进而通过美拉德反应生成如吡嗪等多种酱香味物质。梁慧珍等[6]通过在高温大曲中筛选高产吡嗪类物质的芽孢杆菌,提高了高温大曲吡嗪类物质的种类。王晓丹等[7]在高温大曲中筛选地衣芽孢杆菌并按5%的添加量添加到窖池中层酒醅中,发酵后的酒醅中四甲基吡嗪含量为对照组的3.03倍,有效提高了粹沙酒的酱香风格。张荣等[8]在高温大曲中分离得到三株地衣芽孢杆菌,发现其发酵液在6 d后呈现明显的酱香风味,检测到了乙偶姻、四甲基吡嗪以及呋喃扭尔等多种代谢物。目前,对于高温大曲的研究主要集中在筛选功能微生物及功能微生物的强化方面,但通过改变原料的添加来提升风味的研究仍相对较少。
本研究以麸皮为主要原料,辅以一定比例、不同处理方式的黄豆、豆粕和绿豆,接种地衣芽孢杆菌(Bacillus licheniformis)模拟酱香大曲发酵,采用顶空固相微萃取结合气相色谱-质谱联用技术(headspace solid-phase microextraction combined with gas chromatography-mass spectrometry,HS-SPME-GC-MS),研究不同添加量原料以及不同温度条件对曲药挥发性风味物质的影响,旨在提高曲药中吡嗪类化合物的含量,为曲药酱香风味的增强提供基础支撑。
1 材料与方法
1.1 材料与试剂
麸皮、黄豆、豆粕和绿豆:泸州市售;氯化钠(分析纯):国药集团化学试剂有限公司;甲醇(色谱纯):阿拉丁试剂(上海)有限公司;2-辛醇(纯度≥99.5%):上海麦克林生化科技股份有限公司;LB液体培养基:青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
GZX 9070 MBE电热鼓风干燥箱:上海博讯实业有限公司医疗设备厂;ZWYR-D240恒温培养箱振荡器:上海智城分析仪器制造有限公司;SX300全自动灭菌锅:日本日立公司;ME204E电子天平:梅特勒-托利多仪器(上海)有限公司;BF-300高速粉碎机:河北本辰科技有限公司;QP2020气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS):日本岛津公司;样品前处理和进样自动化平台:广州智达实验室科技有限公司;50/30 μm DVB/CAR/PDMS萃取头:美国Supelco公司;DB-FFAP色谱柱(60 m×0.25 mm×0.25 μm):美国Agilent公司。
1.3 实验方法
1.3.1 原料的预处理
向麸皮中加入常温水(保证含水量为0.6~0.7 mL/g),翻拌均匀,浸润10 min备用。将黄豆、豆粕和绿豆分别烘干后粉碎至过14目筛,分别加入一定量的水(保证含水量为0.37~0.42 mL/g),备用。分别向黄豆、豆粕和绿豆中加入2倍体积的常温水,浸泡12 h后粉碎至过14目筛,备用。
将麸皮分别与不同处理后的黄豆、豆粕和绿豆按不同比例进行复配,控制总的蛋白含量在10%~25%。分别将物料100 g置于三角瓶中,将三角瓶用封口膜封口后,于115 ℃高温灭菌处理15 min。各组配料编号如表1所示。
表1 添加不同原料曲药基质组成
Table 1 Components of matrix of koji by adding different raw materials
注:C和P分别表示烘焙和浸泡;H、D和L分别表示黄豆、豆粕和绿豆;1、2和3分别表示原料添加量为5%、10%和15%。
编号 编号对照组K 对照组K烘焙黄豆+麸皮浸泡黄豆+麸皮烘焙豆粕+麸皮浸泡豆粕+麸皮烘焙绿豆+麸皮CH1 CH2 CH3 CD1 CD2 CD3 CL1 CL2 CL3浸泡绿豆+麸皮PH1 PH2 PH3 PD1 PD2 PD3 PL1 PL2 PL3
1.3.2 不同原料和发酵温度曲药的制备
从保藏试管中挑取一环地衣芽孢杆菌菌落接种到LB培养基培养12 h,然后按照1%(V/V)接种量再次转接至LB培养基培养12 h,以此为种子液。将活化的菌液进行计数,调整接种菌液浓度为3×109 CFU/mL,按照3%比例接种到装有不同原料的三角瓶中,设置4个发酵温度(分别为37 ℃(细菌的最适生长温度)、50 ℃(蛋白酶的最适温度)、63 ℃(高温大曲顶温)和变温(模拟高温大曲升温曲线,设置为第1天37 ℃,第2天48 ℃,第3天52 ℃,第4~5天59 ℃,第6~7天63 ℃))发酵7 d,期间在培养箱提供两浅盘水,保证发酵湿度,发酵结束后取样检测。
1.3.3 测定方法
水分的测定:首先将称量瓶在105 ℃条件下进行烘干,至质量恒定时质量记为m0;将曲药放入称量瓶进行称质量,准确称取曲药和称量瓶的质量记为M,然后将称量瓶放入105 ℃干燥箱中烘干4 h,取出称量瓶冷却至室温称质量记为m1。曲药水分含量计算公式如下:
挥发性风味物质的检测:
预处理:将1.0 g曲药、5.0mL水、10 μL2-辛醇(41.1 mg/L)和2.0 g NaCl加入20 mL顶空瓶中,在60 ℃、450 r/min条件下,用50/30 μm DVB/CAR/PDMS三相萃取头萃取风味物质45 min。然后,立即将纤维插入GC-MS的进样口,在250 ℃条件下热解吸3 min。
气相色谱条件:DB-FFAP色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气(He);流速0.8 mL/min;不分流;温度程序:40 ℃保持1 min,以2.5 ℃/min的速度升温至75 ℃,以3 ℃/min的速度升温至162 ℃,以6 ℃/min的速度升温至230 ℃并保持5 min。
质谱条件:电子能量70 eV;离子源为电子电离(electron ionization,EI)源;离子源温度230 ℃;质量扫描范围35~500 amu;全扫描模式。
定性定量方法:未知化合物通过与美国国家标准与技术研究院(national institute of standards and technology,NIST)文库进行比对鉴定,选择匹配度>800的化合物,进行定性;以2-辛醇作为内标,检测体系中内标和化合物的峰面积之比等于浓度之比的原则,计算曲药挥发性风味物质的相对浓度(以曲药干质量计算)。
1.3.4 数据处理
采用SPSS 26.0进行单因素方差分析;ORIGIN 2022进行主成分分析(principal component analysis,PCA)和图形绘制;R语言绘制热图;SIMCA 14.1对数据进行正交偏最小二乘法判别分析。
2 结果与分析
2.1 不同原料、发酵温度制备曲药的水分含量
水分含量直接影响微生物的生长繁殖和多种酶系的形成,从而对风味产生影响,是曲药固态发酵过程中的一个关键指标[9]。不同原料和发酵温度条件下曲药的水分含量如图1所示。
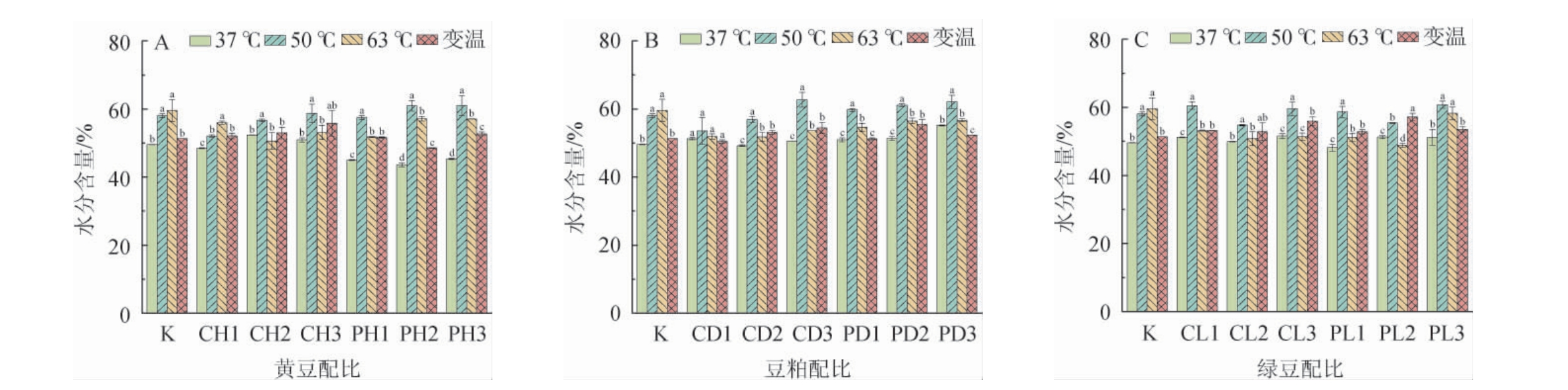
图1 不同添加量黄豆(A)、豆粕(B)、绿豆(C)在不同发酵温度下制备曲药的水分含量
Fig.1 Moisture content in Fuqu prepared by soybean (A), soybean meal (B) and mung bean (C) with different addition at different fermentation temperature
由图1可知,在50 ℃条件下制备的曲药水分含量最高,37 ℃条件下制备的曲药水分含量最低。可能是由于在37℃条件下,浅盘中的水分不容易挥发,难以补充发酵环境湿度;在50 ℃条件下,浅盘中的水分更容易挥发,保证了发酵环境湿度。而在变温和63 ℃条件下,曲药水分含量较低,可能是由于较高的温度导致浅盘和曲药中的水分同时大量挥发,加之培养箱具有一定的通风性,导致水分流失较大。黄豆曲药的水分含量范围为43.61%~61.03%,其中在50 ℃条件下PH3水分含量最高。豆粕曲药的水分含量范围为49.22%~62.71%,其中在50 ℃条件下CD3水分含量最高。绿豆曲药的水分含量范围为49.91%~60.76%,其中在50 ℃条件下PL3水分含量最高。在50 ℃和63 ℃条件下,添加浸泡原料的曲药水分含量高于添加烘焙原料的曲药,可能是因为浸泡原料本身的水分含量较高,从而确保整体曲药的水分较高。结果表明,在50 ℃条件下的曲药具有更高的水分含量,这对于微生物活动、酶系形成以及挥发性风味物质提高具有重要影响。
2.2 不同原料、发酵温度制备曲药的挥发性风味物质含量分析
对不同原料、发酵温度制备的曲药挥发性风味物质含量进行测定,结果见图2。由图2可知,所有样品中均检测到吡嗪类、酮类、酚类、酯类、醛类、酸类和醇类物质。在37 ℃条件下,所有曲药检测出的挥发性风味物质含量较低,随发酵温度升高,这些挥发性风味物质含量显著增加。虽然添加不同原料的曲药中总挥发性风味物质含量相近,但各类型挥发性风味物质的含量存在一定差异。
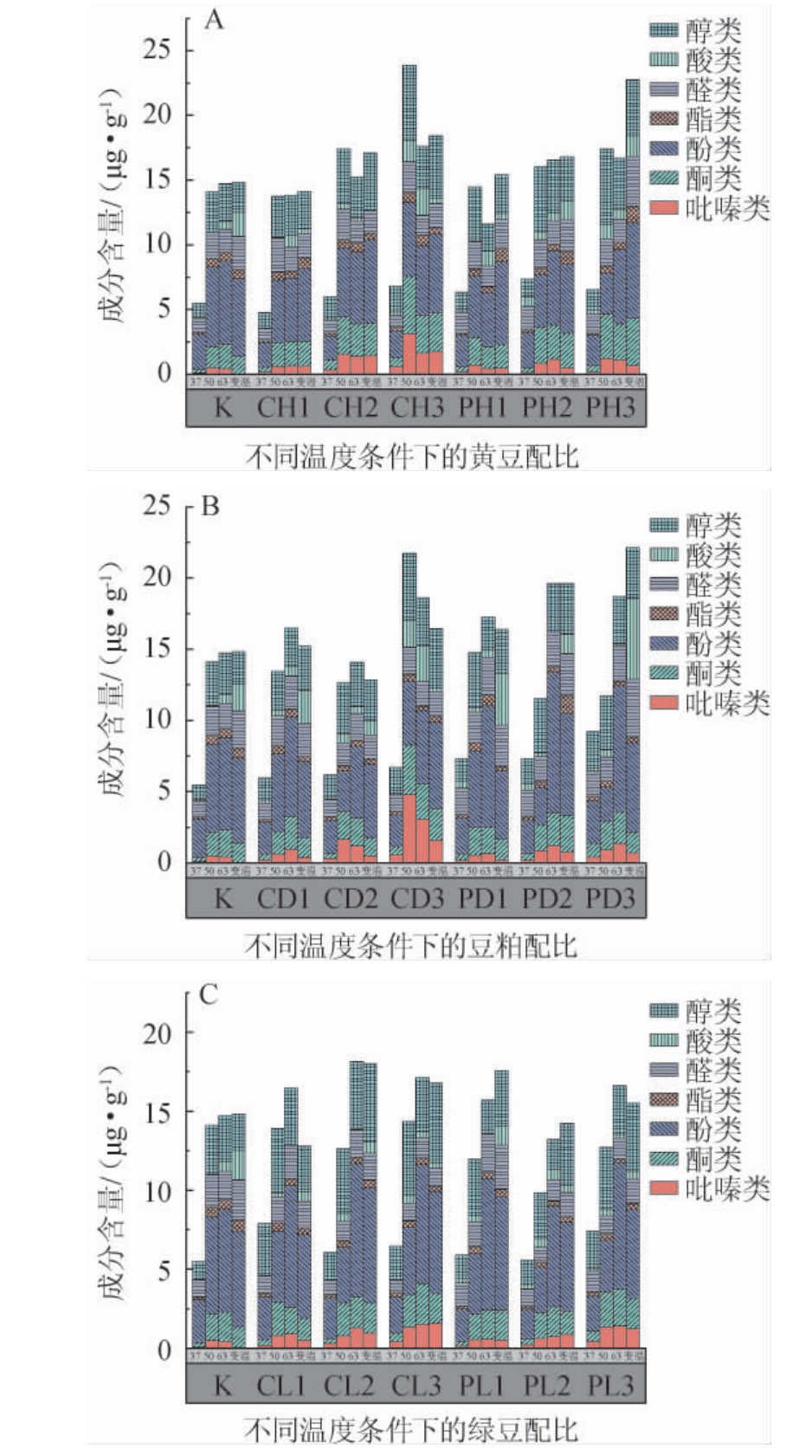
图2 不同添加量黄豆(A)、豆粕(B)、绿豆(C)在不同发酵温度下制备曲药的挥发性风味物质含量
Fig.2 Volatile flavor substances contents in Fuqu prepared by soybean (A), soybean meal(B), and mung bean (C) with different addition at different fermentation temperature
吡嗪类物质是酱香型白酒中的关键香味成分和健康因子,它赋予酒体浓郁的烘焙和坚果香气[10]。50 ℃条件下发酵CD3曲药的吡嗪类物质含量最高,为4.79 μg/g,主要包括2,5-二甲基吡嗪(2.18 μg/g)、2,3,5-三甲基吡嗪(1.16 μg/g)和2,3,5,6-四甲基吡嗪(0.93 μg/g)。酮类物质是白酒中香味物质,起着助香的作用,在白酒中的含量约占香味成分的2%[11]。50 ℃条件下发酵CH3曲药的酮类物质含量最高,为4.41 μg/g,主要包括2-庚酮(0.73 μg/g)、2-壬酮(0.70 μg/g)和苯基丙酮(0.61 μg/g)。酚类物质不仅在白酒口感和香气的形成上起着至关重要的作用,而且还具有抗氧化、抗炎等生理活性[12]。63 ℃条件下发酵PD2曲药的酚类物质含量最高,为9.85 μg/g,主要为愈创木酚(4.79 μg/g)、2,4-二叔丁基苯酚(3.01 μg/g)和苯酚(1.80 μg/g)。大多数挥发性酯类物质都具有芳香特征,在白酒中产生令人愉悦的果香,对白酒典型风格的形成起着关键作用[13]。变温条件下发酵PD2曲药的酯类物质含量最高,为1.31 μg/g,主要包括(E)-乙酸癸酯(0.82 μg/g)、γ-己内酯(0.16 μg/g)和丙位辛内酯(0.18 μg/g)。醛类物质的气味阈值较低,可为发酵食品提供特殊风味。变温条件下发酵PD3曲药的醛类物质含量最高,为4.07 μg/g,主要包括椰子醛(3.47 μg/g)、3-羟基-4-甲氧基苯甲醛(0.27 μg/g)和苯甲醛(0.17 μg/g)。酸类物质为产酯提香提供前驱物质,是调节白酒发酵过程和感官质量的重要物质,适量的酸性化合物可以增强白酒的甜味和消除苦味[14]。变温条件下发酵PL1曲药的酸类物质含量最高,为8.46 μg/g,主要包括己酸(0.46 μg/g)、辛酸(0.25 μg/g)和苯乙酸(0.19 μg/g)。醇类物质被用作辅助调味剂,主要协调白酒的香气和口感,辅助酯香气,这赋予了白酒浓郁醇厚的香气[13]。变温条件下发酵CL3曲药的醇类物质含量最高,为8.46 μg/g,主要包括苯乙醇(2.40 μg/g)、蘑菇醇(0.36 μg/g)和2-庚醇(0.27 μg/g)。在50 ℃发酵条件下添加烘焙豆粕和烘焙黄豆更有利于吡嗪类和酮类物质的生成;在63 ℃发酵条件下添加浸泡豆粕更有利于酚类物质的生成;在变温发酵条件下,添加浸泡豆粕有利于酯类、醛类物质的生成,添加浸泡绿豆有利于酸类和醇类物质的生成。
WU Q等[15]在麸皮培养基中使用分离出的地衣芽孢杆菌进行发酵,发现可以产生浓郁的酱香风味,尤其是在较高温度(55 ℃)下,酱香风味的影响更为显著。郭成栓等[16]通过模拟固体发酵试验研究了温度与功能菌株产生酱香味的关系,结果显示,随着温度升高,酱香风味增强。张荣[17]以麸皮浸出汁作为培养基,研究了温度与地衣芽孢杆菌酱香风味的关系,发现较高的温度有利于酱香风味的形成。结果表明,在50 ℃的发酵条件下,吡嗪的产量达到最高,从而更有利于酱香风味的形成,这一结果与已有研究结果一致。
2.3 不同原料、发酵温度制备曲药的挥发性风味物质主成分分析
主成分分析(PCA)通过确定几个主成分因子来简化原始样本中的复杂变量,然后,根据主成分因子在不同样本中的贡献率来评估样本之间的规律性和差异性[18]。运用PCA对不同原料、发酵温度制备曲药的挥发性风味物质进行分析,得到黄豆曲药、豆粕曲药和绿豆曲药的前3累计方差贡献率分别达72.18%、69.11%和66.44%,代表了原始数据的大部分信息[19]。PCA中累计贡献率越高,代表样本信息的反映越充分;样本间距离越大,表明它们之间的差异越明显[20]。由图3可知添加不同原料的曲药风味与发酵温度密切相关,不同原料的曲药在50 ℃、63 ℃和变温条件下的差异较小,成分相似;而37 ℃与其他三个温度下的曲药有较大差异,而在37 ℃条件下,添加不同配比原料差异最小。这可能是因为在变温的温度条件下,地衣芽孢杆菌能更好地进行发酵。
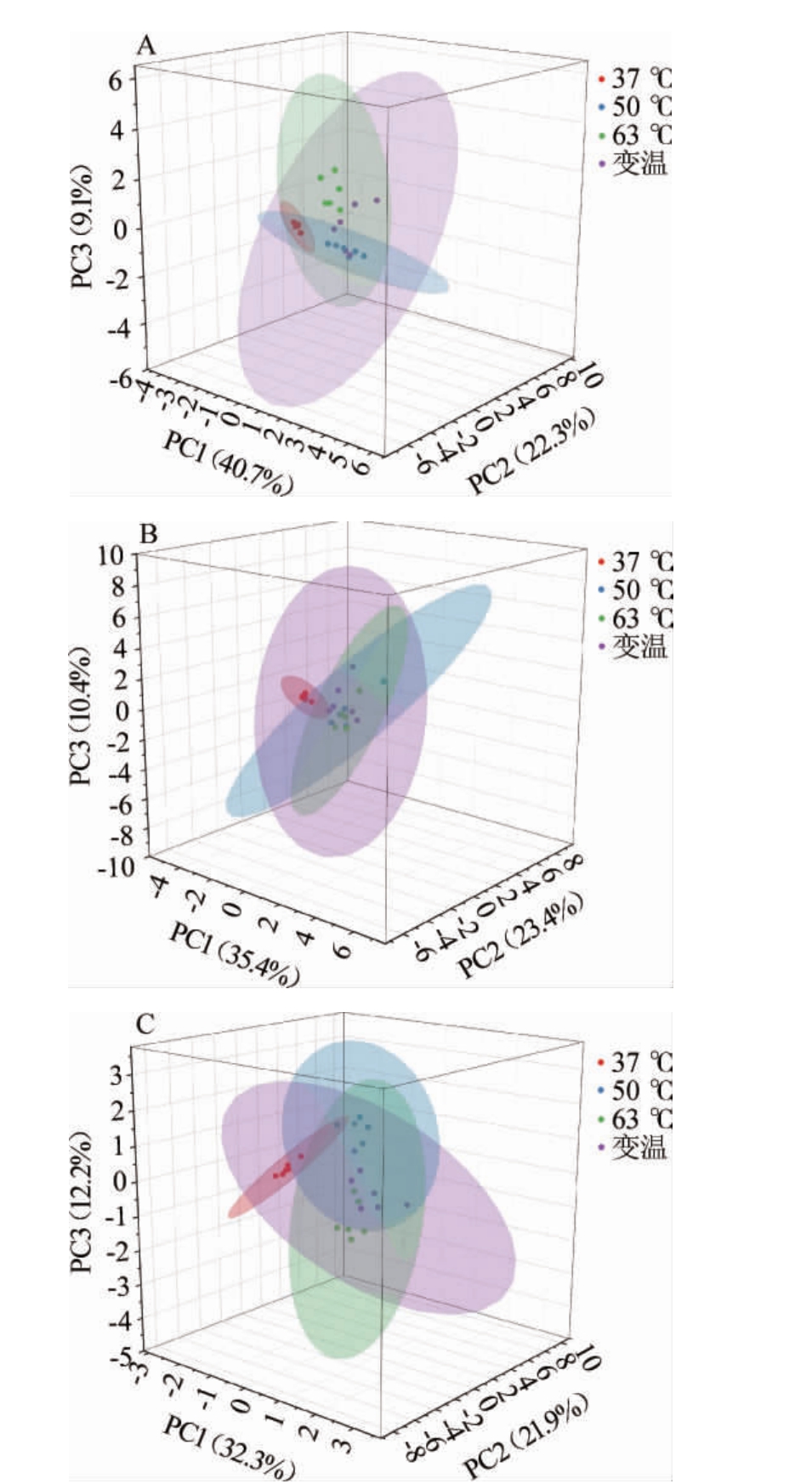
图3 不同添加量黄豆(A)、豆粕(B)、绿豆(C)在不同发酵温度下制备曲药的挥发性风味物质主成分分析
Fig.3 Principal component analysis of volatile flavor substances in Fuqu prepared by soybean (A), soybean meal(B), and mung bean (C) with different addition at different fermentation temperature
2.4 三种高产吡嗪曲药的差异分析
为研究不同原料添加对曲药风味的影响,选择三种高产吡嗪的曲药原料配比(CH3、CD3和CL3),并与纯麸皮组(K)一起进行了差异性分析,结果见图4和图5。由图4可知,4种曲药共同含有48种挥发性风味物质。此外,K组含有15种特有挥发性风味物质;CH3组含有11种特有挥发性风味物质;CD3组含有9种特有挥发性风味物质;CL3组含有18种特有挥发性风味物质。四种曲药所特有的物质种类差距较大,从某种程度上也反映了不同原料的添加对曲药风味的影响较大。
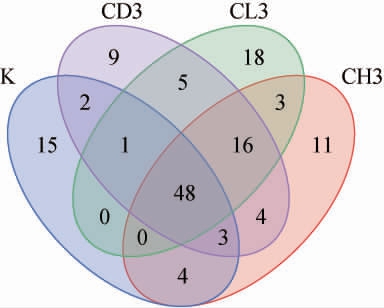
图4 三种高产吡嗪曲药与纯麸皮曲药的挥发性风味物质Venn图
Fig.4 Venn plot of volatile flavor substances of the three highyielding pyrazine Fuqu and controls
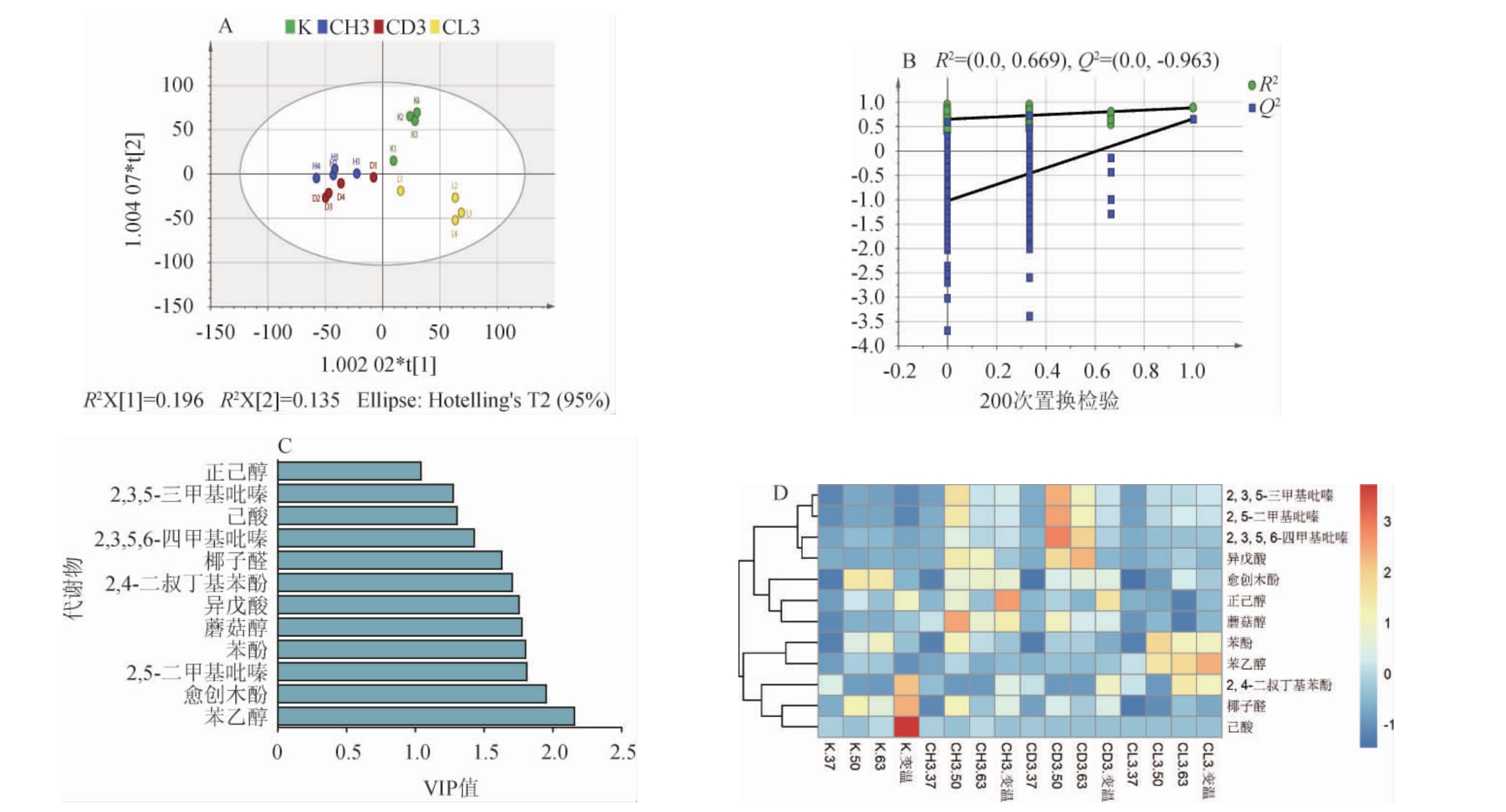
图5 三种高产吡嗪的曲药的挥发性风味物质正交偏最小二乘判别分析(A)、模型交叉验证结果(B)、VIP值得分图(C)和聚类分析热图(D)
Fig.5 Orthogonal partial least squares discriminant analysis (A), model cross-validation results (B), VIP value score plots (C), and heat maps (D) of volatile flavor substances in three high-yielding pyrazine Fuqu
正交偏最小二乘-判别分析(OPLS-DA)是一种有监督的判别分析统计方法。参数R2X和R2Y分别代表X矩阵和Y矩阵的解释率,Q2是模型的预测能力。理论上,R2和Q2值接近统一表示拟合精度高(达100%)。R2和Q2值达到0.5相当于50%的拟合精度,高于0.4也是可以接受的[21]。
由图5A可知,OPLS-DA模型具有较强的累积解释力和预测力,且稳定性良好(R2X=0.95,R2Y=0.807,Q2=0.409)。由图5B可知,利用200次交叉验证和置换检验对模型进行了可靠性分析(R2=0.669,Q2=-1.1),Q2的负值表明该模型是可靠的,没有过拟合现象,适用于对样本进行判别分析[22]。在37 ℃条件下,不同原料的曲药相互聚合,成分相似。温度升高,不同原料曲药渐远,均与K表现出差异,但黄豆曲药和豆粕曲药相互聚合,说明发酵风味相似。变量重要性投影值(variableimportantinprojection,VIP)是OPLS-DA 模型变量的权重值,用于衡量各成分累积差异对各组样本分类的影响强度和解释力[23]。VIP值越大,贡献率越大。通常,VIP>1是筛选差异代谢物的标准[23]。由图5C可知,筛选出12种VIP值大于1的对分类贡献度较大的代谢物,按VIP值由高到低排序,依次为苯乙醇、愈创木酚、2,5-二甲基吡嗪、苯酚、蘑菇醇、异戊酸、2,4-二叔丁基苯酚、椰子醛、2,3,5,6-四甲基吡嗪、己酸、2,3,5-三甲基吡嗪和正己醇。这些挥发性风味物质含量经过归一化处理,并进行了分层聚类热图分析,以实现样品中挥发性风味物质含量的可视化(图5D)。其中,K在50 ℃条件下产生了较高的愈创木酚(4.54 μg/g)和椰子醛(1.86 μg/g),这是因为麸皮中含有的阿魏酸是合成愈创木酚的前体物质,K中更高的麸皮含量更利于愈创木酚的合成[24]。CL3在50 ℃条件下产生了较高的苯酚(2.38 μg/g),并在变温条件下产生了较高的苯乙醇(2.40μg/g)。CD3在50℃条件下产生较高的2,5-二甲基吡嗪(2.18 μg/g)、2,3,5-三甲基吡嗪(1.13 μg/g)、2,3,5,6-四甲基吡嗪(0.93 μg/g)和异戊酸(1.63 μg/g)。其中,四甲基吡嗪不仅可以减轻炎症和抑制肿瘤等作用[25],还能赋予其烘烤香气,是形成酱香风味的重要成分[26]。
3 结论
本研究应用HS-SPME-GC-MS 对添加不同原料的曲药的挥发性风味物质进行检测,结果均检测出吡嗪类、酮类、酚类、酯类、醛类、酸类和醇类物质。添加烘焙的黄豆和豆粕的吡嗪类含量要分别高于添加浸泡的,且在50 ℃条件下吡嗪类物质的含量更高。通过对三种高产吡嗪类物质的曲药进行差异性分析,结果显示黄豆曲药和豆粕曲药成分相似,但与纯麸皮曲药和绿豆曲药表现出差异性。筛选出差异性的挥发性风味物质(VIP值>1)12种,其中,K在50 ℃条件下产生了更高的愈创木酚和椰子醛;CL3在50 ℃条件下产生了更高的苯酚,并在变温条件下产生了更高的苯乙醇;CD3在50 ℃条件下产生更高的2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪和异戊酸。本研究发现CD3产生的与酱香风味相关的关键挥发性风味物质含量更高且丰富,具有重要的研究价值,为后续研究不同原料对酱香白酒风味的影响提供了参考。
[1]章钰浛,班世栋,赵皓静,等.温度对产香酵母产挥发性风味物质的影响[J].食品与发酵工业,2022,48(5):58-67.
[2]何猛超,邬子璇,西玉玲,等.通过外源添加芽孢杆菌提升北方地区高温大曲的品质[J].食品工业科技,2024,45(1):145-154.
[3]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[4]FAN G S,SUN B G,FU Z L,et al.Analysis of physicochemical indices,volatile flavor components, and microbial community of a light-flavor Daqu[J].J Am Soc Brew Chem,2018,76(3):209-218.
[5]罗建超,谢和.大曲中产酱香芽孢杆菌的筛选及其代谢产香探析[J].酿酒科技,2012(5):35-40.
[6]梁慧珍,卢延想,刘正,等.高温大曲中高产吡嗪类物质芽孢杆菌的筛选与应用[J].中国酿造,2022,41(1):116-122.
[7]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[8]张荣,徐岩,范文来,等.酱香大曲中地衣芽孢杆菌及其特征风味代谢产物的分析研究[J].工业微生物,2010,40(3):7-12.
[9]王洪,罗惠波,周平,等.热风干燥技术对大曲质量的影响及相关性分析[J].食品研究与开发,2018,39(4):106-114.
[10]刘宇,王莉,管桂坤,等.基于强化大曲的北方酱香型白酒品质提升研究[J].酿酒科技,2021(11):80-84.
[11]泸州老窖集团有限责任公司.泸型酒技艺大全[M].北京:中国轻工业出版社,2011:42-45.
[12]黎露露,程平言,尤小龙,等.酱香型白酒功能活性成分研究进展[J].酿酒科技,2023(9):109-113.
[13]ZHANG M Z,WU X F,MU D D,et al.Profiling the influence of physicochemical parameters on the microbial community and flavor substances of zaopei[J].J Sci Food Agr,2021,101(15):6300-6310.
[14]ZHAO D R, SHI D M, SUN J Y, et al.Characterization of key aroma compounds in Gujinggong Chinese Baijiu by gas chromatography-olfactometry,quantitative measurements,and sensory evaluation[J].Food Res Int,2018,105:616-627.
[15]WU Q, XU Y.Transcriptome profiling of heat-resistant strain Bacillus licheniformis CGMCC3962 producing maotai flavor[J].J Agr Food Chem,2012,60(8):2033-2038.
[16]郭成栓,欧阳蒲月,谢和.枯草芽孢杆菌E20发酵产生挥发性风味成分的GC/MS分析[J].中国酿造,2010,29(9):153-155.
[17]张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2010.
[18]冯莹莹,董立强,马亮,等.基于主成分及聚类分析的东北南部地区优质粳稻品质的综合评价[J/OL].食品科学,1-12[2024-01-02].http://kns.cnki.net/kcms/detail/11.2206.TS.20231229.1441.016.html.
[19]王阳,佟伟,王文辉,等.辽宁鞍山不同产区南果梨果实香气成分分析[J].中国果树,2023(10):19-28,57,142.
[20]王铁儒,郭丽,马曼,等.SPME-GC-MS与电子鼻结合分析不同酵母混菌发酵猕猴桃酒的挥发性香气物质[J].食品工业科技,2021,42(16):119-128.
[21]邝格灵,李树,宁甜甜,等.基于GC-MS指纹图谱和多元统计学区分四川保宁醋和山西老陈醋的挥发性差异代谢产物[J].食品科学,2020,41(16):227-232.
[22]LIU Y J, QIAN Y Y, SHU B, et al.Effects of four drying methods on Ganoderma lucidum volatile organic compounds analyzed via headspace solid-phase microextraction and comprehensive two-dimensional chromatography-time-of-flight mass spectrometry[J].Microchem J, 2021,166:106258.
[23]范威威,林熙,龚霄,等.基于顶空气相-离子迁移谱技术对不同酵母发酵的百香果果啤香气比较[J].食品工业科技,2022,43(7):325-332.
[24]赵苏苏,高佳,吕冰,等.黑曲霉发酵麸皮产总阿魏酸工艺优化及其抑菌活性初探[J].中国粮油学报,2023,38(12):167-175.
[25]张潇月.清香白酒酿造中四甲基吡嗪功能菌的筛选及应用[D].太原:山西大学,2023.
[26]XU Y Q, JIANG Y F, LI X T, et al.Systematic characterization of the metabolism of acetoin and its derivative ligustrazine in Bacillus subtilis under micro-oxygen conditions[J].J Agr Food Chem, 2018, 66(12):3179-3187.