白酒是我国传统的民族特色饮料酒,酿造历史悠久,由于原料、酿造工艺和生态环境等诸多因素的不同,使得我国白酒呈现出十二大香型:酱香型、浓香型、清香型、米香型、兼香型、董香型、凤香型、特香型、芝麻香型、老白干型、馥郁香型和豉香型[1-2]。其中酱香型白酒由于其独特的“四高二长”酿造工艺,即高温制曲、高温堆积、高温发酵、高温馏酒,生产周期长、基酒贮存时间长等特点也被称为最古老、最传统的香型白酒之一[3-4]。其中传统酱香型白酒各轮次中,第三轮次酒对比其他轮次微生物相对丰度最高呈上升趋势最终形成独特的酱香型白酒成分构成和风味特征[5]。而洞酿白酒就是在天然溶洞里进行酿造的白酒,与传统酱香型白酒相比较,由于常年处于恒温恒湿的溶洞环境大大提高了白酒质量[6],对酒体的快速老熟和微生物群落差异有着重要的指导意义[7]。
近年来,对酱香型白酒风味特征风味的研究较多,如WANG X X等[8]利用固相微萃取-搅拌棒吸附萃取和气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术法定量分析了不同批次酱香型白酒中的挥发性风味物质,结果表明贮存时间越长的酒体酱香风味越突出。随着检测技术的快速发展,高通量测序技术[9]、顶空-固相微萃取(headspace solid phase microextraction,HS-SPME)联用[10]等技术被广泛运用于微生物多样性和白酒风味物质的相关性研究,运用这些技术对第三轮次酱香型白酒的酒醅风味和微生物进行了研究,其中研究结果显示第三轮次白酒相比前面两个轮次口感更加柔和细腻[11]。尚柯等[12]对酱香型白酒第三轮次酒堆积过程中挥发性风味物质进行了分析研究,分析结果表明,在堆积富集微生物的同时,酒体产生了大量风味物质,对酱香白酒的口感品质具有一定的影响。而洞酿酱香型白酒对于提高白酒的风味和质量有重要指导意义,但目前相关研究较少[13]。本研究以洞酿酱香型白酒第三轮次酒醅为研究对象,通过高通量测序技术(high throughput screening,HTS)和顶空固相微萃取结合气相色谱-质谱联用(GC-MS)技术,探究第三轮次洞酿酱香型白酒酒醅在酿造过程中微生物和挥发性风味物质的变化规律,结合偏最小二乘法-判别分析(partial least squarediscriminant analysis,PLS-DA)筛出关键差异风味物质,并揭示优势菌属与挥发性风味物质的相关性,为论证洞酿酱香型白酒的可行性、产品质量、安全性及生产可控性提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅样品:贵州某酒业有限公司。分别在第三轮酒醅堆积发酵0、24 h、48 h、72 h和窖池发酵44 d时进行取样(分别命名为:D0 h、D24 h、D48 h、D72 h和J44 d)。如图1所示,在上层A点进行取样,D、E、F、G点混匀后获得酒醅样品P1,在中层B进行取样,H、I、J、K点混匀后获得酒醅样品P2,在下层C点进行取样,L、M、N、O点混合后获得P3,分别将上层P1、中层P2、下层P3三个层面所取酒醅混合均匀后作为一个样消除取样误差,均匀混合,立即放入-80 ℃条件下保藏。
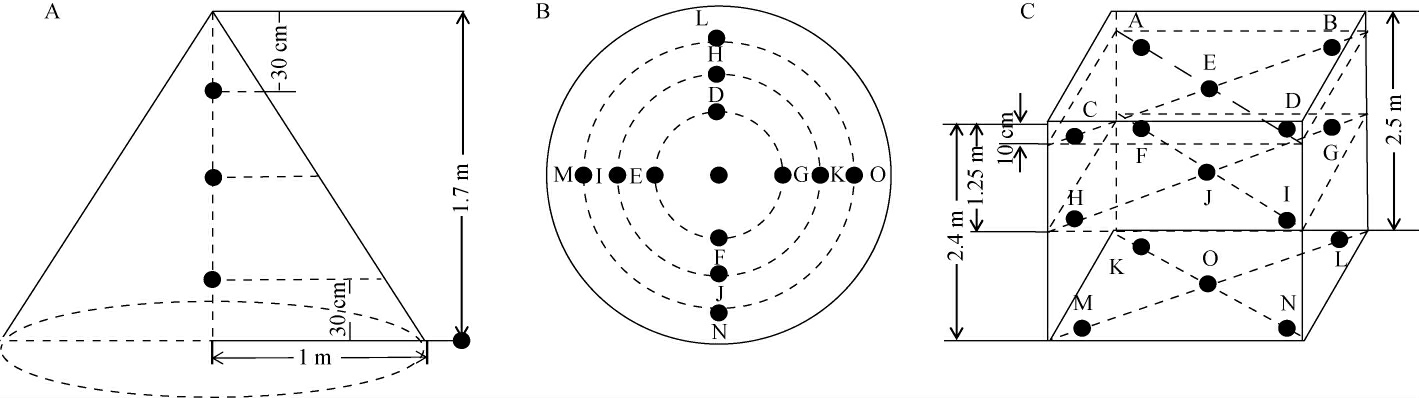
图1 取样示意图
Fig.1 Schematic diagram of sampling
1.1.2 化学试剂
Power SoilR脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国MP Biomedicals公司;MinEluteR 聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒:德国Qiagen公司;AxyPrep DNA凝胶回收试剂盒:美国Axygen公司;TruSeqTM DNA样品制备试剂盒;美国Illumina公司;琼脂糖(分析纯):西班Biowest公司;Fast Pfu缓冲液:中国TransGen公司;DNA聚合酶、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs):大连宝生物工程有限公司。
1.2 仪器与设备
GeneAmp 9700 PCR仪:美国ABI公司;Trace1300-TSQ8000气相色谱-质谱联用仪:美国ThermoFisherScientific公司;DYY-6C电泳仪:北京市六一仪器厂;Illumina Miseq MISEQ测序仪:美国Illumina公司;veriti FAST梯度PCR扩增仪:美国AB公司;Fluor Chem FC3型凝胶成像系统:美国Protein Simple公司;QL-901旋涡混合器:海门其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 DNA提取和PCR扩增
利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')引物对V3-V4可变区进行PCR扩增。PCR扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。PCR扩增体系为20 μL,包含4 μL 5×FastPfu 缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μLFastPfu聚合酶;10 ng DNA模板。
1.3.2 Illumina Miseq测序使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用Quanti FluorTM-ST(Promega,USA)进行检测定量。根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。将高通量测序获得的双端序列数据,经FLASH软件拼接,后用Trimmomatic软件进行质量过滤,再使用UCHIME软件去除嵌合体。通过USEARCH软件在97%的相似水平下将所有样本的有效序列聚类成操作分类单元(operational taxonomic units,OTU)。基于Silva数据库(Relwese128)和Unite数据库(Release 7.2),采用RDP Classifier(version 2.2)对OTU代表序列进行物种分类注释,并分别在各个分类水平统计样本的群落组成。
1.3.3 挥发性风味物质分析
将酒醅样品混合后,称取1 g样品放入顶空瓶中,加入2 g食盐和5 mL水,加入20 μg环己酮(20 μg/mL)作为内标,用聚四氟乙烯进行密封保藏,在60 ℃水中进行水浴10 min。50/30 μmol/L DVB/Carboxen/PDMS 萃取头在40 ℃下振摇并提取180 min,结束后,立即将样品的SPEM纤维插入进样端口在230 ℃温度下解吸5 min。参考邹恬杏等[13]的方法进行挥发性风味物质分析检测。
1.3.4 相关性分析
采用Spearson相关系数分析洞酿酱香型白酒第三轮次酒醅优势真菌属和细菌属(相对丰度>1%)与挥发性风味物质的相关性。根据方差分析的P<0.05和Spearson相关系数>0.9筛选出对挥发性风味物质影响较大的微生物属。
1.3.5 数据处理
采用IBM SPSS 26.0软件进行数据统计分析。利用R语言绘制群落组成堆叠图。计算酒醅微生物与差异挥发性风味物质间的Spearson相关系数,运用Cytoscape软件(版本3.9.1)进行相关性网络图可视化分析。柱状图利用Origin 9.0软件进行绘制。
2 结果与分析
2.1 微生物群落结构多样性分析
2.1.1 酒醅中微生物菌群的Alpha多样性分析
洞酿酱香型白酒第三轮次酒发酵过程中酒醅微生物菌群的稀释曲线和Shannon指数曲线见图2。由图2可知,基于酒醅微生物菌群的指稀释曲线和Shannon指数曲线先升高后趋于平缓,当序列数>20 000条时趋于稳定,OTU数量达到饱和,说明测序结果的数量和深度足够。本测序结果可信度较高,可进一步分析。
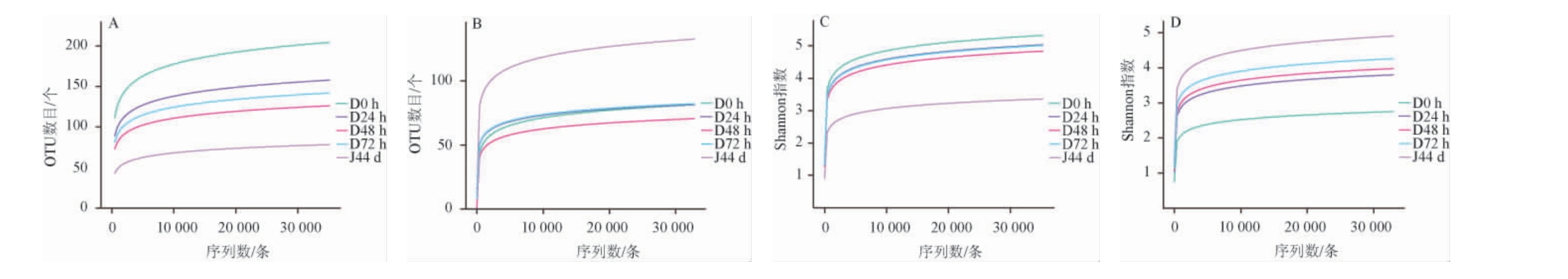
图2 酒醅中细菌和真菌的稀释曲线(A, B)和Shannon指数曲线(C, D)
Fig.2 Rarefaction curves (A, B) and Shannon index curves (C, D) of bacteria and fungi in fermented grains
在整个发酵过程中细菌的丰度较为稳定,真菌在发酵后期多样性和丰富度指数达到最高值,表明通过发酵真菌群落多样性和丰富度得到提升。此外,整个发酵过程中的真菌Chao1指数、Shannon指数和Simpson指数均大于细菌,说明浆水中真菌多样性与丰富度均大于细菌。Chao1指数体现物种的丰富度信息,数值越大,多样性越高;Shannon指数和Simpson指数综合体现物种的丰富度和均匀度,数值越大,多样性越高。由表1可知,在酒醅发酵过程中真菌的多样性变化,在堆积发酵48 h,真菌的Chaol指数最低(68.33±5.70);在堆积发酵72 h,Chaol指数上升为79.00±11.80,真菌菌群丰富度大幅度升高;在窖池发酵时期,Chaol指数达到最高(127.00±7.56),说明窖池发酵过程中真菌群落丰富度高于窖池发酵。在堆积发酵0 h时,Simpson指数(0.70±0.06)和Shannon指数(2.59±0.27)最低,在堆积发酵72 h时,Shannon指数(4.01±0.43)和Simpson指数(0.82±0.05)均升高;说明堆积发酵过程中,真菌群落多样性整体呈现增加的趋势。而针对细菌而言,堆积发酵过程中,细菌群落的丰富度随着发酵时间延长而降低,多样性无太大差别,在堆积发酵0 h时,Chaol指数(200.09±15.67)达到最高,细菌群落丰富度最高;而在窖池发酵阶段,酒醅Chaol指数(77.33±17.20)、Simpson指数(0.78±0.05)和Shannon指数(3.16±0.25)达到最低,表明在这个时期细菌群落丰富度和多样性最低,这可能是因为在窖池发酵环境中,好氧菌受到了抑制[14]。通过细菌Alpha多样性分析,在洞内发酵环境中,细菌的丰富度和多样性在堆积发酵时高于窖池发酵阶段,而真菌则相反,这可能是由于堆积发酵时氧气浓度高,而贠娟莉[15]研究表明,此阶段的主要微生物是Virgibacillus、Oceanobacillus和Pseudogracilibacillus等,皆是好氧微生物,所以此时的环境适宜细菌的生长,同时细菌的分泌的酸及抑菌素等也抑制了真菌的生长[15]。然而进入到窖池发酵阶段,氧气浓度降低,细菌的生长受到抑制,真菌的丰富度有所增加,与ZHENG J等[16]的研究结果一致。
表1 酒醅发酵过程中微生物菌群的Alpha多样性分析
Table 1 Alpha diversity analysis of microbial flora in fermented grains during fermentation
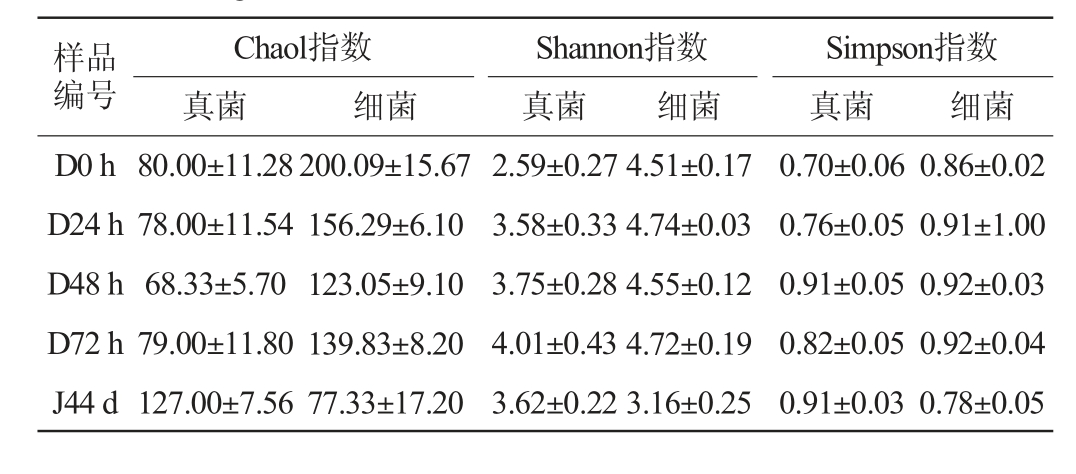
样品编号D0 h D24 h D48 h D72 h J44 d Chaol指数真菌细菌Shannon指数真菌细菌Simpson指数真菌 细菌80.00±11.28 78.00±11.54 68.33±5.70 79.00±11.80 127.00±7.56 200.09±15.67 156.29±6.10 123.05±9.10 139.83±8.20 77.33±17.20 2.59±0.27 3.58±0.33 3.75±0.28 4.01±0.43 3.62±0.22 4.51±0.17 4.74±0.03 4.55±0.12 4.72±0.19 3.16±0.25 0.70±0.06 0.76±0.05 0.91±0.05 0.82±0.05 0.91±0.03 0.86±0.02 0.91±1.00 0.92±0.03 0.92±0.04 0.78±0.05
2.2 酒醅样品中细菌和真菌的群落结构分析
采用高通量测序技术对洞酿酱香型白酒第三轮次发酵酒醅中的微生物群落结果进行分析,测序数据在门和属中进行分类,结果见图3。由图3可知,在门水平上,所有酒醅样品共检测出4个优势菌门(相对丰度>1%),为厚壁菌门(Firmicutes)、子囊菌门(Ascomycota)、放线菌门(Actinobacteria)、担子菌门(Basidiomycota),其中厚壁菌门(Firmicutes),子囊菌门(Ascomycota)占据主导地位,二者平均相对丰度总和>99%,是构成白酒酒醅中优势微生物的重要来源。子囊菌门(Ascomycota)不仅是酱香型白酒酿造酒醅的主要菌门,也是清香型、浓香型酿造酒醅的主要菌群,是中国白酒发酵过程中的关键微生物种群[17]。放线菌门(Actinobacteria)与酿造大曲、酒醅堆积发酵微生物菌群之间存在非常密切的联系,随着堆积发酵的进行相对丰度从4.68%急速下降到0.13%。
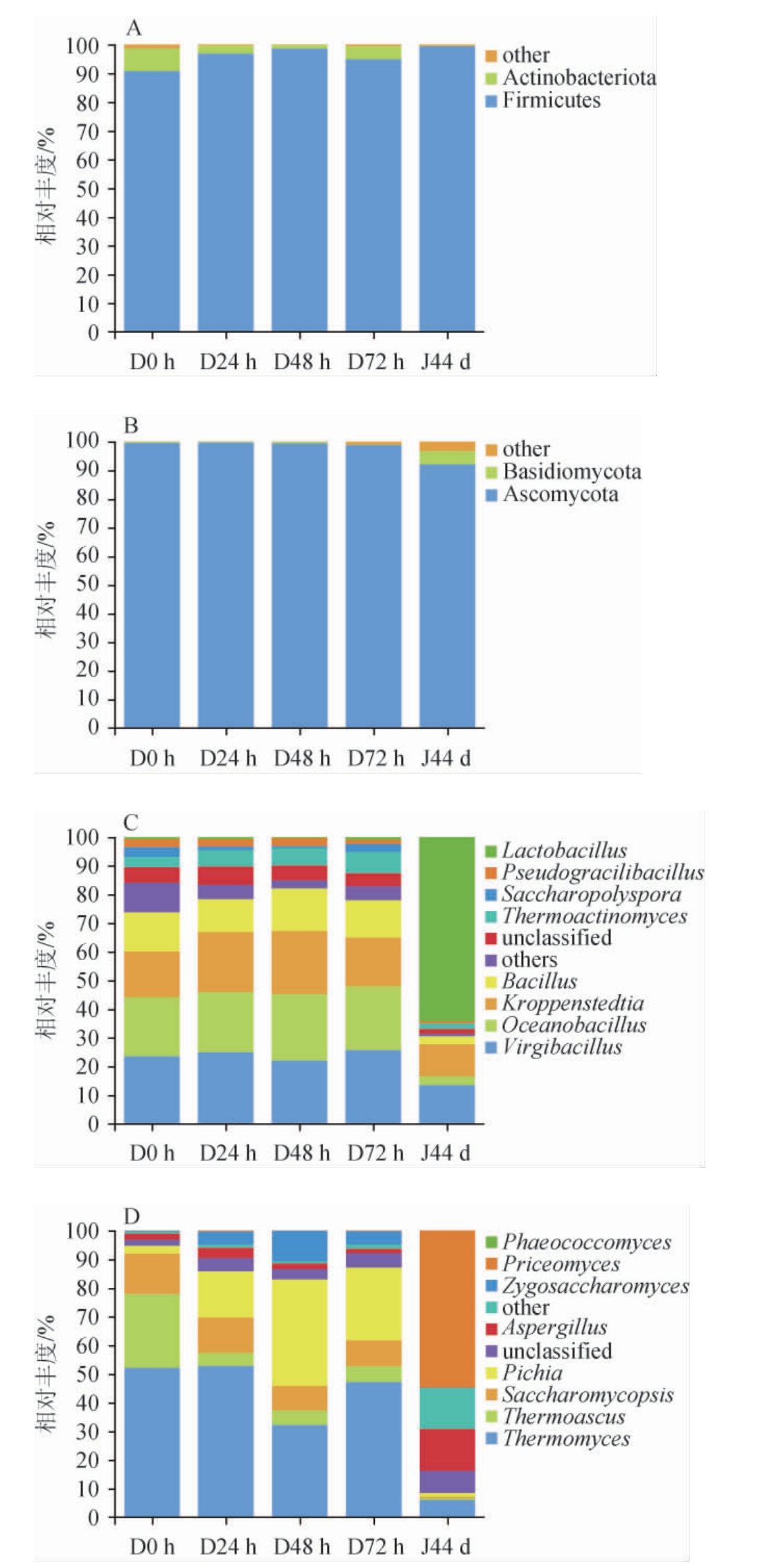
图3 酒醅发酵过程中在门和属水平上细菌(A, C)和真菌(B, D)的相对丰度
Fig.3 Relative abundance of bacteria (A, C) and fungi (B, D) in fermented grains during fermentation at phylum and genus levels
在属水平上,所有酒醅样品共检测出16个优势菌属(相对丰度>1%),包含8个细菌属,分别是枝芽孢杆菌属(Virgibacillus)、海洋芽胞杆菌属(Oceanobacillus)、假纤细芽胞杆菌属(Pseudogracilibacillus)、塔氏糖多孢菌属(Saccharopolyspora)、高温放线菌属(Thermoactinomyces)、芽孢杆菌属(Bacillus)、克罗彭斯特德菌属(Kroppenstedtia)和乳杆菌属(Lactobacillus);以及8个优势真菌属,分别是嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、复膜孢酵母属(Saccharomycopsis)、毕赤酵母属(Pichia)、曲霉属(Aspergillus)、接合酵母属(Zygosaccharomyces)、Priceomyces、暗色球菌属(Phaeococcomyces)。
在细菌属中,Virgibacillus、Oceanobacillus、Kroppenstedtia在整个堆积发酵阶段均为显著优势菌属(相对丰度都在10%以上),而在窖池发酵阶段急速降低。在窖池发酵过程中,Lactobacillus相对丰度从9.9%急剧上升至64.3%,这是因为在窖池发酵过程中,由于洞内环境氧气含量低,Virgibacillus、Oceanobacillus和Bacillus受到抑制,而Lactobacillus由于其兼性厌氧菌的特点的生长,在窖池发酵中占据主导优势[1]。在窖池发酵期间,Lactobacillus以乙醇、甘油、乙酸为碳源[18-19],以葡萄糖和其他碳水化合物代谢产酸为其他轮次酱香型白酒提供优势菌种,与非洞酿酱香型白酒第三轮次酒醅细菌群落[20]相比较,洞酿酱香型白酒酒醅中细菌多样性更高,优势细菌种类更丰富。
在真菌属中,Thermomyces、Thermoascus、Saccharomycopsis和Pichia为优势真菌属,而对于贵州传统的酱香型白酒其优势真菌属为Alternaria和Ciliophora[20],说明洞内环境对酱香型白酒中的微生物有较大影响,这可能与洞内恒温以及较高的水分湿度等有关。在堆积发酵初期,Thermomyes、Thermoascus和Saccharomycopsis含量最高,在堆积发酵过程中,Thermomyes、Thermoascus和Saccharomycopsis开始下降,而Pichia上升(从0 h的2.5%逐步增加至72 h的21.7%),是因为发酵过程中pH下降,其他优势菌属受到洞内环境影响而受到抑制,而Pichia由于其耐受低pH、低水活度、高渗透压和厌氧等的特点不会受到抑制[21],Pichia也是酒醅发酵过程中产乙醇和酯类物质的主要功能菌属。在洞内环境中Thermomyces持续升高,Thermomyces是堆积发酵时期的优势真菌,是白酒酿造过程中重要酶类的来源,可促进微生物的生长以及酒香的产生。在窖池发酵阶段Priceomyes和Aspergillus开始上升,在传统的洞酿酱香型白酒中Saccharomyces、Lactobacillus和Aspergillus为关键优势菌属[22],而Priceomyes在传统酱香型白酒制造工艺中并未出现,而其含量大幅度上升可能与和洞酿环境有关,此结果有待进一步研究。上述结论表明,由于洞内恒温恒湿的环境,洞酿酱香型白酒与与传统酱香型白酒[24]相比较,微生物群落结构更丰富。
2.3 洞酿酱香型白酒第三轮次酒醅中挥发性风味化合物分析
采用HS-SPME-GC-MS分析洞酿酱香型白酒第三轮次酒醅中的挥发性风味物质,结果见表2,第三轮次酒醅发酵过程各类挥发性风味化合物含量的变化见图4。
表2 酒醅发酵过程中挥发性风味物质含量测定结果
Table 2 Determination results of volatile flavor substances contents in fermented grains during fermentation

编号 保留时间/min 化合物C1 C2 C3 C4 C5 C6 C7 C8 C9 C10 C11 C12 C13 C14 C15 4.66 5.16 6.21 8.75 18.51 15.27 16.43 17.89 22.02 26.62 27.01 27.42 28.12 28.38 29.41 Z1 Z2 Z3 Z4 Z5 Z6 Z7 Z8 Z9 Z10 Z11 Z12 Z13 7.18 7.44 13.87 14.12 16.05 19.93 20.46 21.79 22.14 22.85 23.03 24.75 25.06醇类异戊醇2-戊醇2,3-丁二醇糠醇1-苯基-2-丙醇苯甲醇2-庚醇苯乙醇B-乙基苯乙醇2-[(Z)-9-十八烷氧基]乙醇1-七烷三醇1-十六烷醇十二醇叔十六硫醇3,7,11-三甲基十二烷醇酯类乳酸乙酯L(-)-乳酸乙酯乙酸糠酯己酸乙酯DL-2-羟基-4-甲基戊酸乙酯丁酸乙酯辛酸乙酯乙酸乙酯乙酸苯乙酯戊二酸二乙酯乙酸龙脑酯3-苯丙酸乙酯丙位壬内酯含量/(mg·L-1)D0 h D24 h D48 h D72 h J44 d(8种)0.09±0.03ab 0.04±0.03b 0.09±0.05ab 0.62±0.38a-0.50±0.16ab 0.10±0.04b-0.04±0.02b(11种)0.02±0.07bc-0.11±0.05ab 0.88±0.54a 0.05±0.02b 0.39±0.2ab 0.11±0.05b 0.01±0.00b 0.07±0.04b(10种)0.28±0.12cd 0.01±0.01a 0.04±0.04a 0.78±0.40a 0.04±0.01b 0.44±0.16ab--(8种)0.42±0.12d-0.19±0.16b 0.26±0.07a 0.10±0.03a 0.62±0.15b 0.13±0.04b(11种)0.11±0.01ab-0.12±0.01ab 0.51±0.18a 0.04±0.01b 0.29±0.06a 0.09±0.01b 0.01±0.00b 0.04±0.01b 0.01±0.00a-0.02±0.02ab 0.11±0.05ab 0.07±0.02b-- - - - ——--- -0.01±0.01b-0.15±0.03a——(23种)1.73±0.75a 0.11±0.06b 0.21±0.11a 0.21±0.09a 0.23±0.10b 0.08±0.04b 0.03±0.02b 1.46±0.75c 0.73±0.39b 0.02±0.01b 0.48±0.21a 0.16±0.07b 0.11±0.05b 0.05±0.04a 0.04±0.01c 0.01±0.01ab 0.02±0.01b(19种)1.82±0.88a-0.34±0.16a 0.31±0.14a 0.26±0.13b 0.10±0.04b 0.29±0.17a-1.19±0.57ab 0.02±0.01b-0.24±0.05b 0.14±0.07ab(15种)1.38±0.08a-0.14±0.04a 0.23±0.02a 0.18±0.03b 0.08±0.01b 0.09±0.12b-0.90±0.12b 0.02±0.00b-0.18±0.06b 0.11±0.01b 0.02±0.02ab 0.08±0.02bc 0.01±0.00a-(21种)1.74±0.38a 0.00±0.01a 0.29±0.09a 0.29±0.10a 0.29±0.11b 0.11±0.03b 0.04±0.02b-1.17±0.37ab 0.02±0.01b-0.25±0.07ab 0.14±0.04ab(22种)7.92±2.49b-0.34±0.07a 0.39±0.12a-0.21±0.07a 0.05±0.02b 3.64±1.11b 1.88±0.57a 0.07±0.03a 0.69±0.23a 0.40±0.14a 0.25±0.10a
续表
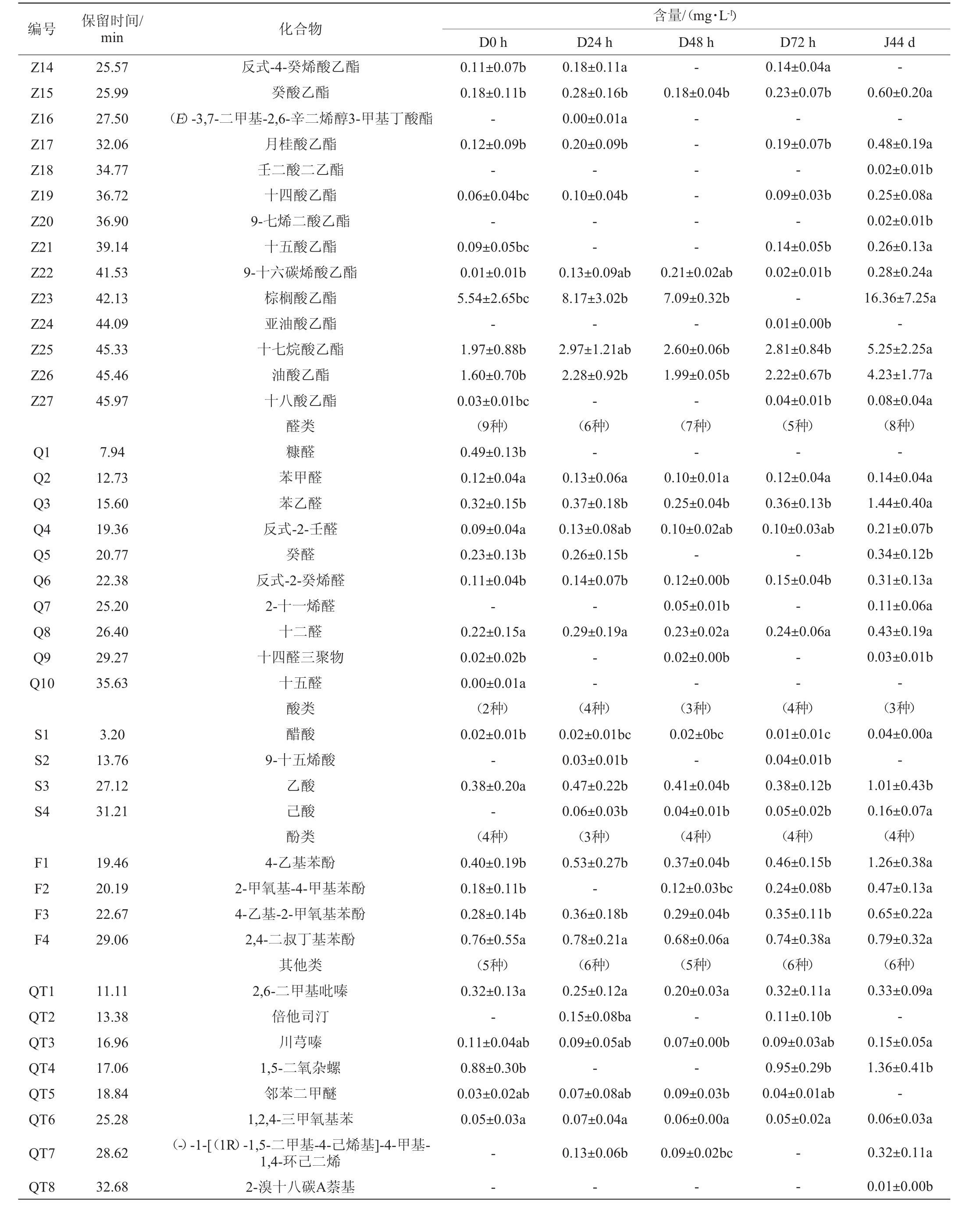
注:同一行的不同字母表示具有显著差异(P<0.05),“-”表示未检出该物质。
编号 保留时间/min 化合物Z14 Z15 Z16 Z17 Z18 Z19 Z20 Z21 Z22 Z23 Z24 Z25 Z26 Z27 25.57 25.99 27.50 32.06 34.77 36.72 36.90 39.14 41.53 42.13 44.09 45.33 45.46 45.97 Q1 Q2 Q3 Q4 Q5 Q6 Q7 Q8 Q9 Q10 7.94 12.73 15.60 19.36 20.77 22.38 25.20 26.40 29.27 35.63 S1 S2 S3 S4 3.20 13.76 27.12 31.21 F1 F2 F3 F4 19.46 20.19 22.67 29.06 QT1 QT2 QT3 QT4 QT5 QT6 QT7 QT8 11.11 13.38 16.96 17.06 18.84 25.28 28.62 32.68反式-4-癸烯酸乙酯癸酸乙酯(E)-3,7-二甲基-2,6-辛二烯醇3-甲基丁酸酯月桂酸乙酯壬二酸二乙酯十四酸乙酯9-七烯二酸乙酯十五酸乙酯9-十六碳烯酸乙酯棕榈酸乙酯亚油酸乙酯十七烷酸乙酯油酸乙酯十八酸乙酯醛类糠醛苯甲醛苯乙醛反式-2-壬醛癸醛反式-2-癸烯醛2-十一烯醛十二醛十四醛三聚物十五醛酸类醋酸9-十五烯酸乙酸己酸酚类4-乙基苯酚2-甲氧基-4-甲基苯酚4-乙基-2-甲氧基苯酚2,4-二叔丁基苯酚其他类2,6-二甲基吡嗪倍他司汀川芎嗪1,5-二氧杂螺邻苯二甲醚1,2,4-三甲氧基苯(-)-1-[(1R)-1,5-二甲基-4-己烯基]-4-甲基-1,4-环己二烯2-溴十八碳A萘基含量/(mg·L-1)D0 h D24 h D48 h D72 h J44 d 0.11±0.07b 0.18±0.11b-0.12±0.09b-0.06±0.04bc-0.09±0.05bc 0.01±0.01b 5.54±2.65bc-1.97±0.88b 1.60±0.70b 0.03±0.01bc(9种)0.49±0.13b 0.12±0.04a 0.32±0.15b 0.09±0.04a 0.23±0.13b 0.11±0.04b-0.22±0.15a 0.02±0.02b 0.00±0.01a(2种)0.02±0.01b-0.38±0.20a-(4种)0.40±0.19b 0.18±0.11b 0.28±0.14b 0.76±0.55a(5种)0.32±0.13a-0.11±0.04ab 0.88±0.30b 0.03±0.02ab 0.05±0.03a 0.18±0.11a 0.28±0.16b 0.00±0.01a 0.20±0.09b-0.10±0.04b--0.18±0.04b—— - - - -0.13±0.09ab 8.17±3.02b-2.97±1.21ab 2.28±0.92b-(6种)-0.13±0.06a 0.37±0.18b 0.13±0.08ab 0.26±0.15b 0.14±0.07b-0.29±0.19a 0.14±0.04a 0.23±0.07b-0.19±0.07b-0.09±0.03b-0.14±0.05b 0.02±0.01b-0.01±0.00b 2.81±0.84b 2.22±0.67b 0.04±0.01b(5种)-0.12±0.04a 0.36±0.13b 0.10±0.03ab-0.15±0.04b-0.24±0.06a——(4种)0.01±0.01c 0.04±0.01b 0.38±0.12b 0.05±0.02b(4种)0.46±0.15b 0.24±0.08b 0.35±0.11b 0.74±0.38a(6种)0.32±0.11a 0.11±0.10b 0.09±0.03ab 0.95±0.29b 0.04±0.01ab 0.05±0.02a--(4种)0.02±0.01bc 0.03±0.01b 0.47±0.22b 0.06±0.03b(3种)0.53±0.27b-0.36±0.18b 0.78±0.21a(6种)0.25±0.12a 0.15±0.08ba 0.09±0.05ab-0.07±0.08ab 0.07±0.04a 0.13±0.06b-0.21±0.02ab 7.09±0.32b-2.60±0.06b 1.99±0.05b-(7种)-0.10±0.01a 0.25±0.04b 0.10±0.02ab-0.12±0.00b 0.05±0.01b 0.23±0.02a 0.02±0.00b-(3种)0.02±0bc-0.41±0.04b 0.04±0.01b(4种)0.37±0.04b 0.12±0.03bc 0.29±0.04b 0.68±0.06a(5种)0.20±0.03a-0.07±0.00b-0.09±0.03b 0.06±0.00a 0.09±0.02bc---0.60±0.20a-0.48±0.19a 0.02±0.01b 0.25±0.08a 0.02±0.01b 0.26±0.13a 0.28±0.24a 16.36±7.25a-5.25±2.25a 4.23±1.77a 0.08±0.04a(8种)-0.14±0.04a 1.44±0.40a 0.21±0.07b 0.34±0.12b 0.31±0.13a 0.11±0.06a 0.43±0.19a 0.03±0.01b-(3种)0.04±0.00a-1.01±0.43b 0.16±0.07a(4种)1.26±0.38a 0.47±0.13a 0.65±0.22a 0.79±0.32a(6种)0.33±0.09a-0.15±0.05a 1.36±0.41b-0.06±0.03a 0.32±0.11a 0.01±0.00b
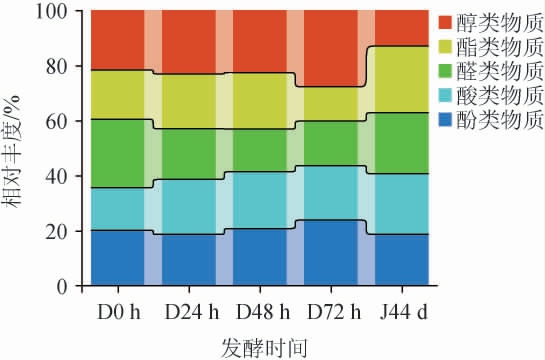
图4 酒醅发酵过程中各类挥发性风味物质含量的变化
Fig.4 Changes of various volatile flavor substances contents in fermented grains during fermentation
由表2可知,第三轮次洞酿酱香型白酒酒醅中共检出68种挥发性风味物质,其中醇类15种,酯类27种,醛类10种,酸类4种,酚类4种,其他类8种。5个时间点的酱香型白酒酒醅无论是风味物质种类数还是其含量都存在一定差异,其中,部分挥发性风味物质(2,3-丁二醇、糠醇、乙酸和己酸乙酯等)的变化趋势与韩兴林等[23]对酱香型白酒各轮次基酒变化趋势一致,都是先升高后降低。
由图4可知,在酒醅发酵过程中,含有大量酯类、醇类醛类、酸类和酚类物质,随着堆积发酵的进行保持着动态平衡,其中酯类物质在白酒中呈果香、花香,可在不同程度上增加白酒的风味[24]。
由表2可知,酒醅中共检出酯类27种,主要物质为棕榈酸乙酯、乳酸乙酯、亚油酸乙酯、油酸乙酯、苯乙酸乙酯、乙酸苯乙酯、DL-2-羟基-4-甲基戊酸乙酯、丁酸乙酯等,它们是导致酿造白酒酒醅中花香、果香差异比较大的主要原因[27]。而醇类和酸类与传统清酱香型白酒[25]对比研究发现,相对含量更高,而醇类和酸类物质是影响白酒的口感和后味的主要因素,它们是形成酒体醇厚风味的重要原因[26]。
在堆积发酵过程中苯甲醇、2,3-丁二醇、乙酸和己酸在不断增多,他们是影响酒体焦糖味和焦糊香的关键物质[27],乙酸的含量增多,这是因为在发酵过程中其他微生物大量繁殖所导致的[28]。而己酸在发酵初期未检出,而在后期不断增多,它不仅为酒体带来奶酪香、甜香风味,同时也消除水味、增加酒体回甜感[3]。窖池发酵结束后酯类物质含量显著增加,主要是由于乳酸乙酯、棕榈酸乙酯、油酸乙酯和乙酸乙酯的增加所致,而这些酯类物质中,乙酸乙酯具有菠萝果香味,乳酸乙酯的香气弱,呈脂肪气味[29],同时高级脂肪酸乙酯含量较高酱香风味越明显[25]。与传统工艺的酱香型白酒相比较,洞酿酱香型白酒酒醅中在窖池发酵阶段异戊醇的相对含量更低(0.42±0.12),而苯乙醇未检出。白酒中高级醇的含量过高会对人体造成危害[30]。因此,洞酿酱香型白酒更有利于人体身心健康。
2.4 挥发性风味物质的OPLS-DA及关键差异风味物质筛选
第三轮次酒醅样品发酵过程挥发性风味物质进行偏最小二乘法判别分析,结果见图5。由图5可知,各阶段发酵过程中样品完全分离,OPLS-DA在X轴方向模型累积解释能力(R2X)和Y轴方向模型累积解释能力(R2Y)分别为0.663、0.782,预测能力(Q2Y)0.725,各指标均>0.5。说明OPLS-DA模型构建成功。
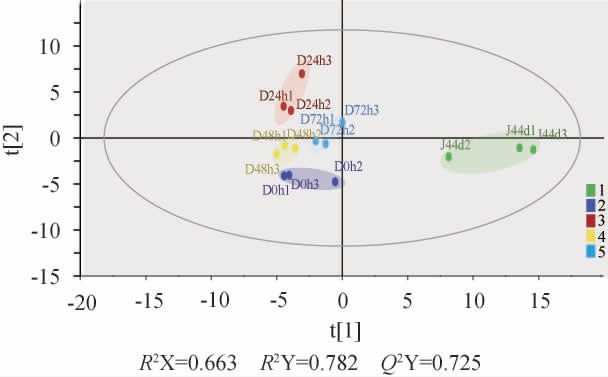
图5 酒醅发酵过程挥发性风味物质偏最小二乘法判别分析
Fig.5 Partial least square discriminant analysis of volatile flavor substances in fermented grains during fermentation
变量重要性投影(variable importance in the projection,VIP)是反映风味物质对模型分类的贡献程度,将VIP值>1作为筛选关键差异风味物质的标准,利用SIMCA软件在酱香型白酒第三轮次酒醅发酵过程中筛选关键差异风味物质,结果见图6。
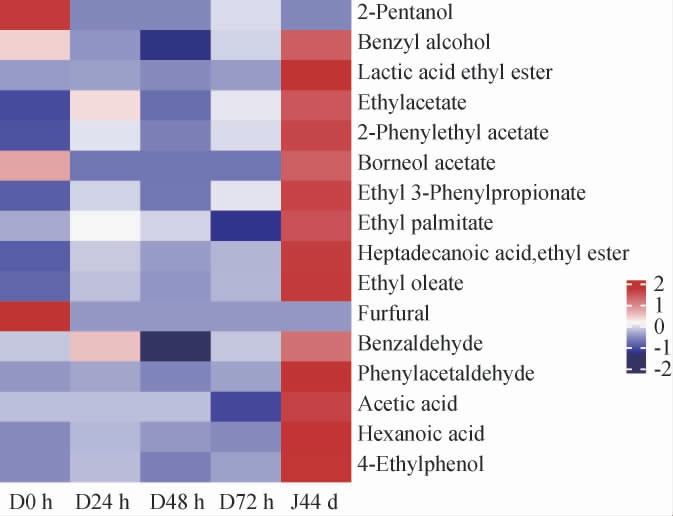
图6 酒醅发酵过程关键差异风味物质
Fig.6 Key differential flavor compounds in fermented grains during fermentation
由图6可知,通过OPLS-DA模型,共筛选出洞酿酱香型白酒第三轮酒醅发酵过程中关键差异风味物质16种,分别为醋酸、乙酸、苯乙醇、乙酸乙酯、2-戊醇、苯甲醇、乳酸乙酯、乙酸乙酯、2-苯基乙酸乙酯、乙酸酯、棕榈酸乙酯、十六烷酸乙酯、油酸乙酯、糠醛、苯甲醛和苯乙醛。窖池发酵阶段关键差异风味物质含量与其他阶段相差较大,而随着堆积发酵的进行,大多数关键差异风味物质含量不断增多。在XU Y Q等[31]研究表明,功能微生物(乳杆菌属、酵母菌属等)与主要风味化合物(己酸、乙酸和乳酸乙酯等)相互作用,促进白酒风味物质的稳定生产。而在窖池发酵阶段乳酸、乙酸和己酸含量的增加是因为受贮存温度和酒体酒精度的影响较大,贮存温度高、酒体酒精度降低,含量增长速度都会加快[32]。CHEN X等[33]研究发现,苯乙醇、乙醇和乙酸能够提高Aspergillus、Thermoascus和Thermomyces等相对丰度,并使他们成为优势菌属。
2.5 酒醅微生物与挥发性风味物质之间的相关性分析
为了解微生物对挥发性风味物质的影响,通过相关系数进行计算分析洞酿酱香型白酒第三轮次酒醅发酵过程中优势菌属(相对丰度>1%)和挥发性风味物质之间的相关性,利用Cytoscape软件对数据进行可视化分析,结果见图7。

图7 优势菌属与挥发性风味物质之间相关性分析结果
Fig.7 Correlation analysis results of dominant genus and volatile flavor substances
图中挥发性风味物质的序号同表2,正相关和负相关差异极显著(P<0.01)。
由图7可知,Aspergillus与大多数酯类物质呈极显著正相关(P<0.01)。Aspergillus是酒醅中重要的功能微生物,它可代谢产生对白酒酿造过程中至关重要的糖化酶和酯化酶等[34],而已有研究发现[35],酯类主要是酸和醇在酯化酶作用下合成的,表明曲霉菌为酒醅中的关键产酯功能菌属。关键差异风味物质十七烷酸乙酯与Priceomyces和Lactobacillus呈极显著正相关(P<0.01),是影响酱香型白酒酒醅中风味物质的关键。此外,Thermoascus与苯丙酸、乙酯、2-溴十八碳A萘等多种挥发性风味物质都具有一定相关性,也是白酒发酵环境中重要酶类的来源,产生的挥发性风味物质对促进微生物繁殖生长和产生酒香具有重要作用[36],表明在白酒发酵过程中该菌类对酒体风味具有重要作用。
3 结论
本研究对洞酿酱香型白酒第三轮次酒醅发酵过程中微生物和风味物质进行检测分析,结果表明,共检测出4个优势菌门,分别为Actinobacteria、Firmicutes、Basidiomycota和Ascomycota;共检测出16个优势菌属(包含8个细菌属和8个真菌属),分别为Virgibacillus、Oceanobacillus、Pseudogracilibacillus、Saccharopolyspora、Thermoactinomyces、Bacillus、Kroppenstedtia、Lactobacillus、Thermomyces、Thermoascus、Saccharomycopsis、Pichia、Aspergillus、Zygosaccharomyces、Priceomyces、Phaeococcomyces。在第三轮次酒醅发酵过程样品中共检出68种挥发性风味物质,其中醇类15种,酯类27种,醛类10种,酸类4种,酚类4种,其他类8种。利用多元统计分析酱香型白酒酒醅中的风味特征,基于VIP值>1筛选出16种关键差异风味物质,通过皮尔森相关系数进行计算分析洞酿酱香型白酒第三轮次酒醅发酵过程中优势菌属和挥发性风味物质之间的相关性,结果表明,Aspergillus与大多数酯类物质呈极显著正相关(P<0.01),关键差异风味物质十七烷酸乙酯与Priceomyces和Lactobacillus呈极显著正相关(P<0.01),是影响酱香型白酒酒醅风味的关键物质。除外在恒温恒湿的洞内环境中也产生了大量Thermoascus,与苯丙酸、乙酯、2-溴十八碳A萘等多种挥发性风味物质都具有一定相关性。该研究对科学认识洞酿酱香型白酒,利用溶洞恒温恒湿的环境控制白酒风味品质,提供了理论依据。
[1]戴奕杰,李宗军,田志强.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学,2019,40(4):152-159.
[2]任金玫,陈君平,李志健,等.十二种香型白酒相关研究概况[J].中国酿造,2022,41(4):13-19.
[3]李利利,马宇,黄永光,等.酱香白酒机械化酿造不同基酒风味化合物解析[J].食品科学,2021,42(18):199-206.
[4]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2018,84(1):1750-1768.
[5]韩兴林,潘学森,尚柯,等.酱香高温堆积酒醅中原核微生物构成的分析[J].酿酒,2017,44(1):22-27.
[6]张勇,樊林,向宗府.酒鬼酒洞藏工艺的初步研究[J].食品与生物技术学报,2009,28(3):418-423.
[7]李德林,张宿义,毛振宇,等.PCR-DGGE对浓香型白酒糟醅微生物群落结构解析[J].酿酒科技,2014(3):25-27.
[8] WANG X X, FAN W L, XU Y.Comparison on aroma compounds in Chinese soy sauce and strong aroma type liquors by gas chromatographyolfactometry, chemical quantitative and odor activity values analysis[J].Eur Food Res Technol,2014,239(5):813-825.
[9]SONG Z W,DU H,ZHANG Y,et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Front Microbiol, 2017, 10(8):1294-1308.
[10]JIA W, FAN Z B, DU A, et al.Recent advances in Baijiu analysis by chromatography based technology-A review[J].Food Chem,2020,324:126899.
[11]李芳香,张稳,时伟,等.酱香型酒糟萃取液的GC-MS分析及应用[J].中国酿造,2021,40(2):159-162.
[12]尚柯,韩兴林,王德良,等.酱香白酒高温堆积酒醅挥发性风味物质的检测分析[J].中国酿造,2016,35(2):139-143.
[13]邹恬杏,苏伟,母应春,等.洞酿酱香酒第四轮次酒醅发酵过程中微生物群落与挥发性代谢物分析[J].中国酿造,2023,42(6):64-71.
[14]孙利林,李立郎,胡萍,等.酱香型白酒第四轮次酒酿造过程中细菌多样性分析[J].中国酿造,2020,39(5):35-39.
[15]贠娟莉.太白酒生产过程中微生物区系的研究[D].杨凌:西北农林科技大学,2007.
[16]ZHENG J, ZHANG L, SHEN C H, et al.Characteristics of microbial community structure in Luzhou-flavor fermentation pits[J].J Appl Ecol,2011,22(4):1020-1026.
[17]郑同庆.山西堡子酒大曲菌群结构及多样性分析[J].晋中学院学报,2022,39(3):92-97.
[18]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[19]CHENG C Y,LIU X F,YUAN Y X,et al.Bacterial community structure in distiller's yeast and accumulated fermented grains of Maotai-flavor liquor[J].Chinese J Appl Environ Biol,2014,20(5):825-831.
[20]DAI Y J,TIAN Z Q,MENG W N,et al.Microbial diversity and physicochemical characteristics of the maotai-flavored liquor fermentation process[J].J Nanosci Nanotechno,2020,20(13):4097-4109.
[21]唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
[22]王琳.茅台产区酱香白酒窖池发酵酒醅微生物菌群结构特征分析[D].贵阳:贵州大学,2021.
[23]韩兴林,潘学森,刘民万,等.云门酱香型白酒各轮次基酒风味构成分析[J].酿酒科技,2015(8):46-49.
[24]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
[25]孙优兰,黄永光,朱晓春,等.清酱香型白酒特征风味化合物分析[J].食品科学,2020,41(24):199-208.
[26]廖永红,杨春霞,胡佳音,等.气相色谱-质谱法分析比较牛栏山牌清香型二锅头酒和浓香型白酒中的香味成分[J].食品科学,2012,33(6):181-185.
[27]王荣钰.酱香型不同轮次基酒理化特性及特征风味化合物研究[D].宜宾:四川轻化工大学,2021.
[28]王春晓,袁国亿,苏伟,等.白酒制曲环境和成品曲中产酸微生物分析[J].食品科学,2020,41(18):120-126.
[29]XU Y Q,ZHAO J R,LIU X,et al.Flavor mystery of Chinese traditional fermented Baijiu: the great contribution of ester compounds[J].Food Chem,2021,369(7):130920.
[30]黄志久,薛瑞琪,张雨,等.不同工艺参数对小曲清香型白酒的品质影响[J].食品与发酵科技,2022,58(4):32-38.
[31]XU Y Q, WU M Q, ZHAO D, et al.Simulated fermentation of strongflavor Baijiu through functional microbial combination to realize the stable synthesis of important flavor chemicals[J].Foods, 2023, 12(3):644.
[32]王乃军,马美荣.白酒贮存过程中酸酯含量、感官变化规律分析研究[J].酿酒科技,2023(7):75-81.
[33]CHEN X,WU Y X,ZHU H,et al.Turning over fermented grains elevating heap temperature and driving microbial community succession during the heap fermentation of sauce-flavor Baijiu[J].LWT-Food Sci Technol,2022,172:114173.
[34]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[35]PARK Y C,SHAFFER C E H,BENNETT G N.Microbial formation of esters[J].Appl Microbiol Biot,2009,85(1):13-25.
[36]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.