氧化还原电位(oxidation-reduction potential,ORP)是微生物发酵中的一个重要参数,该数值由氧化还原电极测定,表征发酵溶液中所有物质整体的电子接受/转移的强弱和氧化还原能力。ORP拥有类似于pH、温度等发酵参数在各种状态下的通用性和灵敏度,可以克服微氧、厌氧环境发酵中溶氧电极应用的限制,对微生物的生长状态进行实时监控[1]。发酵溶液中各种氧化还原电对所贡献的氧化还原电势共同造就整体的ORP,而氧化还原电对的多寡及其变动与细胞的基因表达、蛋白合成以及代谢网络密切相关;通过改变发酵溶液中的ORP,可以调控微生物生长、调节代谢流分配,进而提高发酵产量、优化发酵工艺[2]。目前,调控ORP的途径主要包括电化学调控、通气调控、氧化/还原性试剂调控。此外,ORP作为发酵参数可以呈现微生物的生长状态,对于生长曲线不同阶段的判断是一个有力的补充[3]。ORP相关发酵工艺研究大多停留在小试阶段且以代谢相关的基础研究居多,目前文献报道的符合中试放大规模验证的ORP调控产品仅有柠檬酸和葡萄酒发酵[4-6]。
1 ORP的概念
在发酵液中含有多种多样的氧化还原电对,每种电对具有不同的氧化还原能力,它们对溶液整体的氧化还原特性进行塑造,以ORP的形式进行数值上的表征。ORP被定义为在消除液接电位(液体接界的电势差)条件下,氧化还原电对组成的电极电位与标准氢电极之间的差值,单位为mV[7]。每个氧化还原电对都有其固有的ORP,即标准ORP,对电子的亲和力越大,标准ORP越高。烟酰胺腺嘌呤二核苷酸(氧化态)(oxidized nicotinamide adenine dinucleotide,NAD+)/烟酰胺腺嘌呤二核苷酸(还原态)(reduced nicotinamide adenine dinucleotide,NADH)、烟酰胺腺嘌呤二核苷酸磷酸(氧化态)(oxidized nicotinamide adenine dinucleotide phosphate,NADP+)/烟酰胺腺嘌呤二核苷酸磷酸(还原态)(oxidized nicotinamide adenine dinucleotide phosphate,NADPH)、氧化型谷胱甘肽(oxidized glutathione,GSSG)/还原型谷胱甘肽(reduced glutathione,GSH)、泛醌(氧化型/还原型)和氧气/水是细胞中最常见的氧化还原电对[2]。
通常规定,标准氢电极电位为0。考虑到氢电极使用过程中难操作难实现等实际问题,一般采用甘汞电极或银-氯化银电极作为参比电极。此外,温度、pH、转速、气体种类及流速等都会在发酵的实际过程中对ORP造成影响。ORP的定量公式可用能斯特方程[8]进行表示,计算公式如下:
式中:Eh表示发酵实际过程中的ORP,V;E⊖表示为体系在标准状态下得到的标准ORP,V;R为气体常数(8.314 J/K·mol);T为绝对温度,K;F为法拉第常数(96.485 C/mol),是每摩尔电子的库仑数;n是转移电子数。[Oxidation]是氧化剂的摩尔浓度,mol/L;[Reduction]是还原剂的摩尔浓度,mol/L。
该方程表明物种浓度和温度对ORP变化起关键作用。ORP为正值,表明系统总体偏氧化性,且数值越高氧化性越强;ORP为负值,表明系统总体偏还原性,且数值越低还原性越强。
2 ORP在微生物发酵中的应用
2.1 微生物发酵中ORP曲线波动的原理
发酵溶液中ORP的变化是胞内、胞外物质交换过程中电子的流动以及氧化还原反应持续发生所造成的,各种氧化还原电对的产生和消失与微生物的生长状态以及发酵液中营养物质的消耗密不可分。ORP的平衡依赖氧化能力和还原能力之间的竞争,当氧化力大于还原力时,电子被氧化剂吸收,两种力之间的平衡状态被打破,导致ORP升高;相反,当环境以还原能力为主时,ORP会降低[9]。ORP的曲线在微生物自然生长状态下一般可划分为迟滞期、对数期、平台期以及死亡期(如图1[2-3,8,10])。迟滞期阶段ORP缓慢下降,波动较小且持续时间较短;对数期时ORP呈对数趋势下降至平台期,持续时间由微生物生长状态以及发酵溶液剩余营养物质、通气比等因素决定[9,11];平台期内ORP维持在某一数值附近波动并持续至营养物质消耗殆尽;死亡期内ORP开始上扬并在相当长一段时间内维持此趋势,主要与微生物营养物质耗尽而发生死亡乃至胞体破裂,从而释放出大量氧化性物质有关[2-3]。
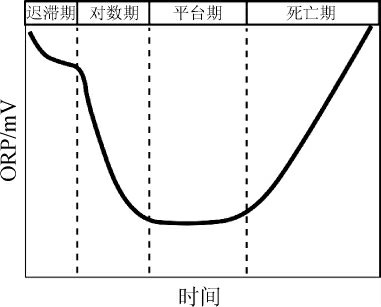
图1 微生物自然生长状态下氧化还原电位曲线
Fig.1 Oxidation-reduction potential curve under microbial natural growth state
2.2 ORP作为非调控参数指导发酵
因菌种及培养条件各异,发酵产生的ORP曲线随着微生物的生长状态展现出一定的特异性。综合ORP曲线、微生物生长曲线以及代谢产物产生、培养基消耗情况的曲线,可以找到发酵过程的一些特点并进行针对性研究,有利于发酵工艺的进一步优化。
2.2.1 ORP曲线指导工艺优化
由图1可知,在微生物最初生长阶段ORP往往保持下降趋势,这和微生物生长趋向旺盛并产生还原性物质有关。ORP曲线结合生长曲线可以大致确定微生物生长的对数期。蛋白诱导表达常常在对数期进行,针对ORP的分布变化,研究人员可直观地锁定对数生长期进行诱导剂的添加,省略较为频繁的取样验证及其可能造成的染菌现象。WANG Z H等[12]在光合细菌(photosynthetic bacteria,PSB)培养中发现ORP曲线出现的第一个较为明显的极小值(或波谷)为微生物生长的转折点,在此极小值(或波谷)附近往往对应菌体的对数生长期中末期,最低点与菌体生长开始停滞、碳源消耗殆尽的特征基本吻合,随后ORP开始回升。GUO J J等[13]研究了含有脯氨酸酶的重组大肠杆菌(Escherichia coli)诱导表达时的ORP曲线,发现在曲线上有两个较大的波谷:第一个ORP波谷代表对数生长阶段,此时选择添加诱导剂(对应OD600 nm值达到0.70);第二个ORP波谷期间蛋白质表达量最大,此时选择发酵终止和收集菌体。
2.2.2 基于ORP曲线的发酵检测技术开发
ORP曲线实时反映了微生物生长在ORP层面的变动情况,其变化率与微生物发酵时生长速率之间存在相关性,同时可以关联发酵过程中微生物的代谢活动。应用计算机技术及软件算法关联ORP与发酵过程其他参数,有望在一定程度上实现对发酵过程的具体状态及相关发酵参数的预测。ESCALANTE-MINAKATA P等[14]开发了一种基于非线性观测器的软件算法,关联ORP、乙醇、生物量浓度,利用人工神经网络计算出的生物量估计值来推断梅斯卡尔酒发酵过程的增长率。需要注意的是软件结合ORP所模拟的数据结果与真实值还存在一定差异,在趋势上较为吻合,但精确度需要进一步提高,距离广泛应用还存在较大的改善空间。
为了在电发酵时更为精确地判定微生物的生长状况,TENG P等[15]将ORP数值与微生物燃料电池(microbial fuel cell,MFC)的电压以能斯特方程的方式相结合并推导出公式(2),据此设计了一种新型的以MFC为基础的生物传感装置。通过将电位参数X与微生物生长动力学相结合,可以描述微生物菌株在发酵过程中的各个生长阶段。电位参数计算公式如下:
式中:X表示一种无量纲的电位参数,反映微生物之间的物质交换和整个发酵过程中生物量的积累;ΔORP表示在基于MFC的发酵反应过程中初始细胞电位的变化,mV;ΔV表示为MFC中所含的阳极和阴极隔室之间的电子运动所产生的电压,mV。
电位参数X的时间变化曲线提供了实时、高响应和高分辨率的数据,有效地识别了微生物生长的指数期的起始点、中点以及平台期的起始点[8]。电位参数X不仅评估了微生物生长引起的外部环境变化(ΔORP),还考虑了内部代谢活动和实际微生物性能(ΔV),有助于对微生物生长动力学的全面了解以及发酵的准确监测和控制[8]。
2.3 ORP作为调控参数指导发酵
ORP调控在微观上改变发酵体系中的电子流动水平并延展至胞内,对于代谢流[16-17]及基因表达[18]造成影响,从而为提高发酵产量提供多元化的解决方案。存在一个适宜的ORP调控数值或区域,在该数值或区域内维持ORP能够使得微生物的基因表达与代谢产物的变化达到较高水平,从而在已有的基础上为优化发酵工艺提供新的解决思路。值得注意的是,ORP的人为调控效果高度依赖实验验证,无法遍历所有数值,只能根据已有的实验和理论基础选取合适水平进行验证和推断,以期逼近合适的调控区域以及数值。
ORP调控往往根据自然状态下的ORP曲线进行单向调控,这是由于微生物生长往往使得ORP在一定时间内向下变动,直至死亡期时缓慢上升[2]。ORP调控稳定期,指在ORP调控下的微生物发酵过程中能够稳定维持ORP设定值的时间段,这一时期类似于自然发酵状态下ORP曲线的平台期。分批发酵下ORP调控稳定期的长短变化与发酵培养基中的碳源(如葡萄糖)、磷源、ORP数值以及通气比密切相关[9,11,19]。如在酿酒酵母(Saccharomyces cerevisiae)发酵过程中,相同的葡萄糖进料下ORP调控稳定期随ORP和通气比的增加而分别延长和缩短;而在相同的ORP水平下,高葡萄糖进料导致曲线中ORP调控稳定期延长[9];刘朋波等[19]分析了肺炎克雷伯氏菌(Klebsiella pneumoniae)发酵过程中NaH2PO4浓度变化对自然发酵状态下ORP的影响,结果发现初始培养基中较高的NaH2PO4浓度,可促进菌体的生长、延长非调控下ORP的平台期;而较低NaH2PO4浓度能够使对数生长期的ORP下降到较低的水平并缩短ORP的平台期,这对于ORP的调控亦具有借鉴意义。
ORP调控的常用方式有电化学调控、通气调控以及氧化/还原性试剂调控(见图2)。不同的调控方式以及相同方式下具体调控的差异都会对最终调控效果进行严格的评价限制,这是由于调控方法各异可能造成最终的调控效果的特异性。尤其对于氧化/还原性试剂的调控方式所造成的调控效果,最终所做出的结论只能限定在该种化学试剂调控方式下所塑造的ORP水平,必要时可用不同试剂调控的对照实验进行补充说明[20]。
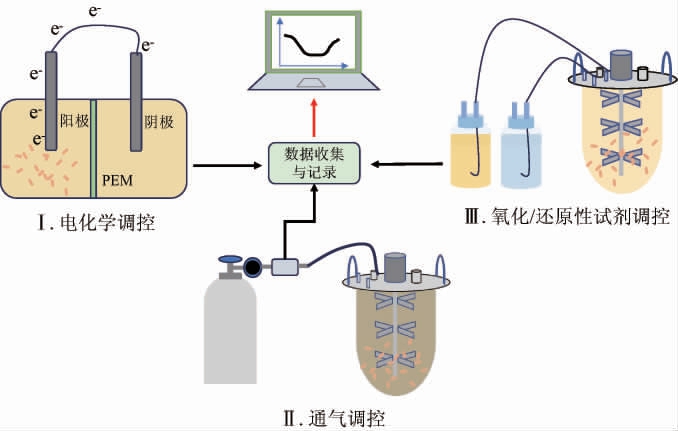
图2 氧化还原电位的主要调控方式
Fig.2 Primary regulation methods for oxidation-reduction potential
2.3.1 电化学调控ORP
电化学调控ORP指的是利用电极来调控发酵液中电子流动——阳极接受电子,阴极给出电子,从而较为直接地改变体系中的ORP水平。利用这种方式调控ORP不仅克服了传统调控时需要平衡反应物和产物之间的当量的缺点,还避免了外源性物质引入可能造成的发酵影响[21]。利用电化学方式调控ORP需要将微生物反应器改装成电化学电池:该装置由阳极和阴极两部分组成,它们由质子交换膜(proton exchange membrane,PEM)隔开;当阳极发挥作用并从微生物中夺取接受电子,则将装置称为微生物燃料电池[22];当阴极发挥作用并释放电子传导至微生物胞内,则将装置称为电发酵电池。电化学调控ORP要求微生物具有电化学活性,意即必须有代谢途径,通过细胞和导电阴极材料之间的直接或间接相互作用,允许电子胞内外转移;若无电化学活性则需加入导电介质以辅助ORP调控[23]。电化学调控的缺点在于它的装置较为复杂,有别于市面上常见的微生物反应器;对于微生物电化学活性方面的要求也限制其广泛应用;当阳极作为电子受体进行电发酵时,专性好氧菌的生长可能弱于同等条件下的分批发酵,这可能是由于阳极环境只提供部分氧需求和缺乏电子受体来完成微生物发育所需的代谢循环[8]。
2.3.2 通气调控ORP
利用氧化性或还原性的气体进行调控ORP,辅之以转速调控来改变气体在发酵液中的分布,可以使得发酵液中的ORP稳定在某一数值。使用气体的优点是它们通常具有低溶解度,对大多数细胞大多数没有毒性,并且不会在反应体系的液相中积累。通气调控ORP是目前应用最为广泛的调控ORP的方法,这与研究人员选择的发酵菌体高度相关。目前主要利用的气源为过滤空气,氢气、氧气依据其氧化还原性质具备理论上的可行性[24];氧化还原电位不受溶解氧浓度的影响,因为氧气本身不具有反应活性,而只有具有良好动力学的电子传递反应才参与溶液ORP的建立和变化;空气喷射引起的ORP的增加归因于过氧化氢的形成[4]。另有研究指出,发酵培养基中溶解氧的浓度是非酵母菌微生物生产乙醇的关键因素,此时氧气作为乙醇或生物质生产的主要调节剂[25]。此外,可以通入中性气体来去除溶液中的溶解氧以降低ORP,例如氮气。
通气调控一般选用无菌空气,故而最适用于兼性厌氧微生物(如酿酒酵母);但该种调控方式亦可尝试用于专性厌氧微生物,只需保持专性厌氧微生物的厌氧环境不被严重破坏即可[26],故而专性厌氧微生物主体厌氧环境的塑造可选用氮气等对微生物无害的气体;通气调控的效果与微生物的生长情况密切相关,如果代谢过于旺盛会影响调控的范围和效果。ORP调控效果较弱或者维持生长所需要的溶氧较高,其所造成的罐内转速和气压势必升高;这些情况进一步加剧微生物生长条件的剧烈程度,故而在选择通气调控时要对调控效果进行必要的验证,对调控方式进行充分的评估,避免损坏微生物反应器以及引入不必要因素阻碍微生物生长。
通气调控的策略可参考溶氧控制,与转速进行联动调节ORP。但气体喷射调控ORP也存在缺点:一是控制算法难以实现和维持期望的设定值,特别是当相关气体也被微生物消耗或产生且发酵液的理化性质在培养期间发生变化;二是向发酵液中喷射气体会干扰培养过程,导致CO2或其他挥发性成分的溶出[27]。
2.3.3 氧化/还原性试剂调控ORP
目前,常见的用来调控发酵中ORP的还原性试剂有硫化钠、二硫苏糖醇、硼氢化钠、L-胱氨酸(L-半胱氨酸)、NADH和亚硫酸钠,氧化剂有铁氰化钾、过氧化氢等[23,28-31]。加入氧化性试剂作为电子受体以提高发酵液的ORP,加入还原性试剂作为电子供体以降低ORP。氧化剂和还原剂的加入需要考察其对微生物的潜在毒害作用以及调控的效果,避免抑制微生物生长[32]。化学试剂进行调控的策略可参考pH调控逻辑,一般倾向于设计如比例积分微分(proportional integral derivative,PID)调控的程序以达到较为精准的控制水平;该种调控不可避免地改变发酵体积和培养基配置,故而试剂的选择和浓度的配置需要充分验证以匹配微生物生长的不同发酵时段。此外,必须考虑试剂调控对于分离纯化可能造成的困难,因而在试剂选择、产品安全性以及废水处理上面临着诸多限制。氧化/还原性试剂调控的研究结果可能被解读为细胞代谢对所添加化学物质的反应,并不主要反映细胞对ORP的代谢响应,从而给最终的结论判定造成困难[27]。
2.3.4 ORP调控在微生物发酵中的应用
ORP调控在微生物发酵中应用以提高发酵产率的示例见表1。
表1 氧化还原电位调控应用于微生物发酵的示例
Table 1 Examples of oxidation-reduction potential regulation applied to microbial fermentation
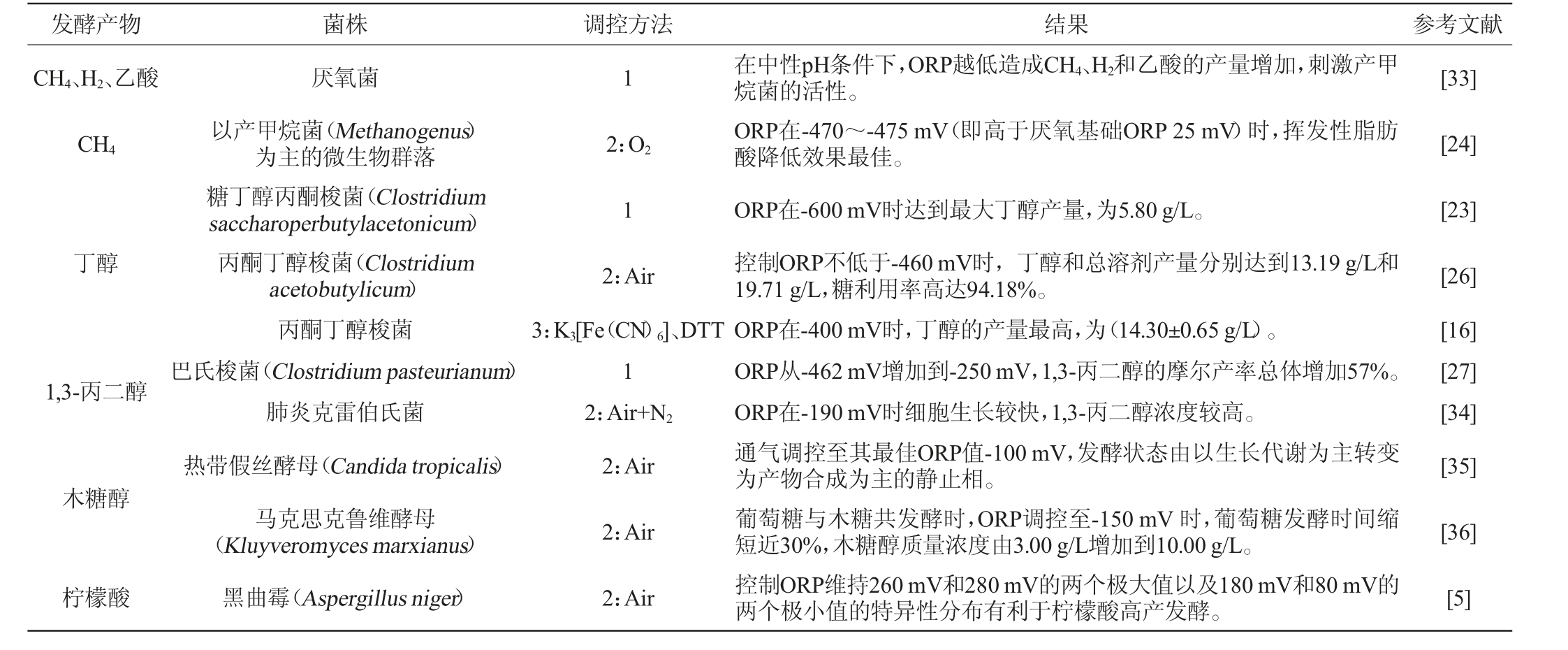
发酵产物 菌株 调控方法 结果 参考文献CH4、H2、乙酸1[33]CH4 2:O2[24]厌氧菌以产甲烷菌(Methanogenus)为主的微生物群落糖丁醇丙酮梭菌(Clostridium saccharoperbutylacetonicum)丙酮丁醇梭菌(Clostridium acetobutylicum)丙酮丁醇梭菌巴氏梭菌(Clostridium pasteurianum)肺炎克雷伯氏菌热带假丝酵母(Candida tropicalis)马克思克鲁维酵母(Kluyveromyces marxianus)黑曲霉(Aspergillus niger)1[23]丁醇1,3-丙二醇2:Air 3:K3[Fe(CN)6]、DTT 1 2:Air+N2 2:Air[26][16][27][34][35]木糖醇2:Air [36]柠檬酸2:Air在中性pH条件下,ORP越低造成CH4、H2和乙酸的产量增加,刺激产甲烷菌的活性。ORP在-470~-475 mV(即高于厌氧基础ORP 25 mV)时,挥发性脂肪酸降低效果最佳。ORP在-600 mV时达到最大丁醇产量,为5.80 g/L。控制ORP不低于-460 mV时,丁醇和总溶剂产量分别达到13.19 g/L和19.71 g/L,糖利用率高达94.18%。ORP在-400 mV时,丁醇的产量最高,为(14.30±0.65 g/L)。ORP从-462 mV增加到-250 mV,1,3-丙二醇的摩尔产率总体增加57%。ORP在-190 mV时细胞生长较快,1,3-丙二醇浓度较高。通气调控至其最佳ORP值-100 mV,发酵状态由以生长代谢为主转变为产物合成为主的静止相。葡萄糖与木糖共发酵时,ORP调控至-150 mV 时,葡萄糖发酵时间缩短近30%,木糖醇质量浓度由3.00 g/L增加到10.00 g/L。控制ORP维持260 mV和280 mV的两个极大值以及180 mV和80 mV的两个极小值的特异性分布有利于柠檬酸高产发酵。[5]
续表
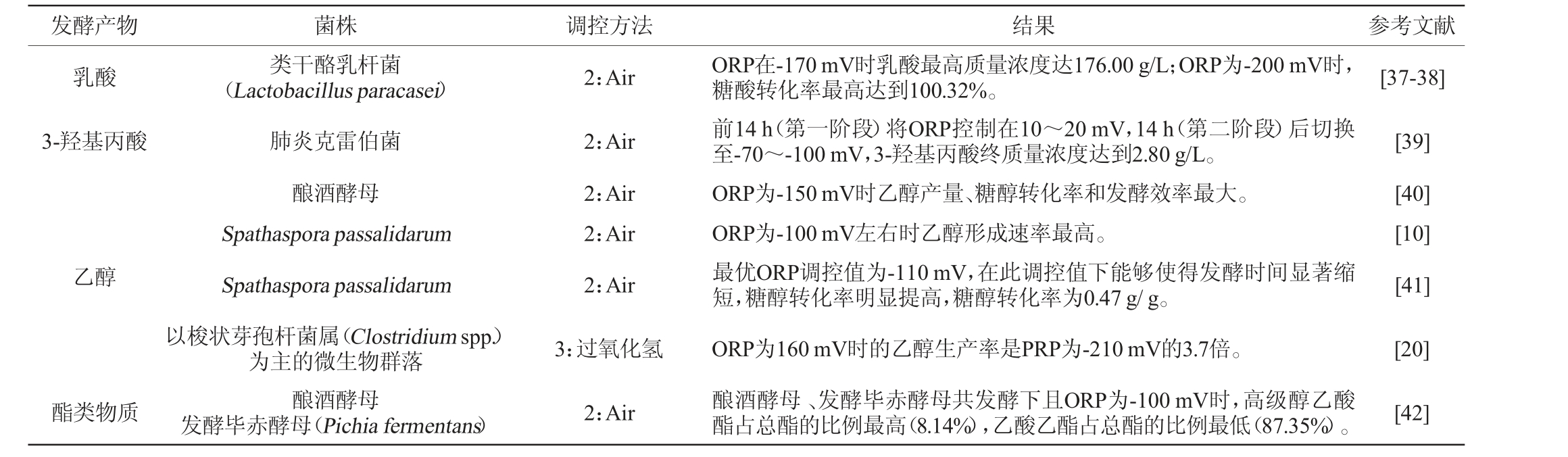
注:1表示电化学调控;2表示通气调控;3表示氧化/还原性试剂调控。
发酵产物 菌株 调控方法 结果 参考文献乳酸2:Air [37-38]3-羟基丙酸乙醇类干酪乳杆菌(Lactobacillus paracasei)肺炎克雷伯菌酿酒酵母Spathaspora passalidarum Spathaspora passalidarum 2:Air 2:Air 2:Air 2:Air ORP在-170 mV时乳酸最高质量浓度达176.00 g/L;ORP为-200 mV时,糖酸转化率最高达到100.32%。前14 h(第一阶段)将ORP控制在10~20 mV,14 h(第二阶段)后切换至-70~-100 mV,3-羟基丙酸终质量浓度达到2.80 g/L。ORP为-150 mV时乙醇产量、糖醇转化率和发酵效率最大。ORP为-100 mV左右时乙醇形成速率最高。最优ORP调控值为-110 mV,在此调控值下能够使得发酵时间显著缩短,糖醇转化率明显提高,糖醇转化率为0.47 g/g。[39][40][10][41]酯类物质以梭状芽孢杆菌属(Clostridium spp.)为主的微生物群落酿酒酵母发酵毕赤酵母(Pichia fermentans)3:过氧化氢2:Air ORP为160 mV时的乙醇生产率是PRP为-210 mV的3.7倍。酿酒酵母、发酵毕赤酵母共发酵下且ORP为-100 mV时,高级醇乙酸酯占总酯的比例最高(8.14%),乙酸乙酯占总酯的比例最低(87.35%)。[20][42]
2.4 ORP影响代谢流及基因、蛋白表达的常用分析方法
由ORP调控而产生的不同水平的氧化还原压力会影响微生物发酵代谢产物的最终产量,本质在于微生物的基因表达、酶蛋白合成、代谢等方面受到调节。ORP影响代谢流及基因、蛋白表达的常用分析方法见图3。针对代谢的变动研究,既可以监测影响密切的氧化还原电对(如NADH/NAD+和NADPH/NADP+)、主要代谢产物的水平[34,43],亦可建立代谢模型进行代谢流分析(metabolic flux analysis,MFA)、敏感性分析(sensitivity analysis)、调控分析(regulation analysis)和靶向代谢组学(targeted metabolomics)研究[17,20,27]。在基因表达、酶的合成方面可以采用实时荧光定量聚合酶链式反应(real time-fluorescence quantitative polymerase chain reaction,RT-fqPCR)[18,44]、核糖核酸测序(ribonucleic acid sequencing,RNA-Seq)、蛋白免疫印迹等分子生物学检测技术进行分析以探究ORP水平变化所造成的影响。例如ORP调控可以改变磷酸戊糖途径与糖酵解途径的代谢通量,从而影响胞内NADH/NAD+和NADPH/NADP+的绝对量以及比值[29,43]。为阐明代谢变化的具体原因,可以对关键酶蛋白做重点分析,主要包括酶活性、酶稳定性以及酶蛋白表达量相对变化[28];酶蛋白分析结果与其对应的基因表达量、酶促反应产物水平进行综合分析,进一步验证ORP对于代谢流的影响。
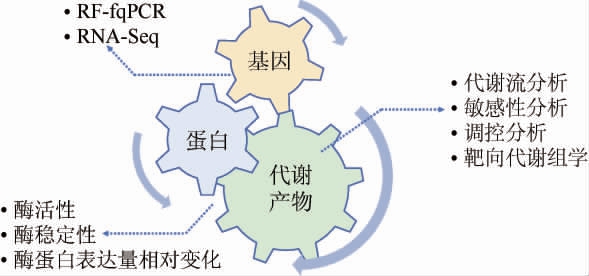
图3 氧化还原电位调控实验中的主要分析方法
Fig.3 Primary analytical methods in oxidation-reduction potential regulation experiments
2.5 ORP应用于微生物菌种选育
为提高微生物发酵的产量,从菌种性能方面进行改造是一个重要方向。由于ORP的波动及调控影响基因表达和代谢流,故而逐渐衍生出基于ORP的微生物菌种选育策略。
2.5.1 发酵过程中胞外ORP压力筛选育种
通过塑造不同的ORP水平,使得微生物在不同的ORP压力下抗逆生长以筛选生长性能较强或代谢产物水平较高的菌株。ORP水平的设置需要参考原始菌株生长的最适ORP范围,由于微生物在平台期前往往使得ORP向下波动,一般设置高还原压力、低于最适ORP范围的ORP水平进行筛选实验。DU C Y等[45]据此成功筛选出1,3-丙二醇生产能力增强的肺炎克雷伯氏菌(Klebsiella pneumoniae)突变株,1,3-丙二醇的含量相比原始菌株提高了63.1%;代谢通量分析表明,突变体胞内的还原分支得到了加强,从而改善了1,3-丙二醇的生物合成。压力筛选的ORP调控方式优选通气调控,电化学调控次之,氧化/还原性试剂调控较难界定结果是否归功于ORP筛选,因而必要时需要不同调控试剂的补充实验。
2.5.2 基于基因工程的胞内ORP扰动育种
微生物胞内各种氧化还原相关酶参与氧化还原电对的生产,尤以在分解代谢中发挥重要作用的辅因子NADH/NAD+相关酶最为关键,这是由于NADH/NAD+在胞内ORP调节中占据主导作用[3,46]。通过基因工程的各种手段改变胞内氧化还原酶的基因表达,影响氧化还原电对池的组成占比,最终改变胞内的正常ORP水平或范围。部分研究将此种菌株改造成的胞内ORP变动亦视为ORP调控的一种方法[3],但胞内ORP的状况难以进行精准的测量和控制,故而本文只将这种方式称之为胞内的ORP扰动,以区别于发酵过程中的菌液ORP调节。胞内ORP扰动可以造成代谢流、代谢产物类型及配比发生变化,进而改造出新的菌株应用于生产[47]。
3 总结与展望
利用ORP来指导微生物发酵是近年来发酵领域的热点,主要内容是通过不同的ORP水平作用于发酵液中的微生物,分析微生物相关的基因、蛋白、代谢变动以寻求提高发酵产量的方法。在调控ORP之外,结合ORP数据与微生物的生长状况并总结出规律,能够助力工艺优化以及基于ORP的新型微生物检测技术的开发。由于ORP是发酵溶液环境的所有物质整体的电子接受/转移的强弱和氧化还原能力的表征,其所蕴含的数据与微生物生长高度相关,遗憾的是目前缺乏相关手段对其进行高效的挖掘与利用。为了降低工业成本与绿色发展,利用ORP调控生产生物来源的大宗商品,并推进中试放大及商业化生产将具有可观的发展空间和经济效益。基于以上的现实基础,可通过如下的策略加速ORP在发酵中的应用:①发展微生物个性化的ORP调控方案。针对每种微生物的特点和生长条件,设计最为适合的调控方式;努力寻找最优的ORP调控区间及具体水平。②结合计算机技术的数据挖掘和精细控制。对于非调控下的ORP数据及曲线分布,要通过软件算法和其他代谢曲线结合起来并相互印证,总结出微生物生长的代谢规律并采取针对性的发酵操作,亦可以此为基础对代谢产量进行预测、开发新型检测技术。此外,开发更高效、精准的ORP控制软件匹配不同的调控方式,助力发酵过程的工艺控制。③微生物代谢网络和基因表达的进一步研究。无论是胞外整体环境的ORP水平调控,还是针对胞内氧化还原进行的扰动操作,都将影响微生物的基因表达、蛋白合成以及最终的代谢产物生成。只有推动微生物本身的基础研究,才能更好地解决ORP对于发酵过程工艺的难点和痛点;在现有基础研究的基础上,结合基因工程、合成生物学的技术手段进一步提高ORP调控下的发酵产量。
[1]温丹妮.氧化还原电位的研究进展及相关应用[J].轻工科技,2017,33(7):101-103.
[2]LIU C G,QIN J C,LIN Y H.Fermentation and redox potential[J].In Tech,2017:24-42.
[3]LIU C G,XUE C,LIN Y H,et al.Redox potential control and applications in microaerobic and anaerobic fermentations[J].Biotechnol Adv, 2013,31(2):257-265.
[4]NELSON J,COLEMAN R,CHACÓN-RODRÍGUEZ L,et al.Advanced monitoring and control of redox potential in wine fermentation across scales[J].Fermentation,2022,9(1):7-21.
[5]BEROVICˇM.Scale-up of citric acid fermentation by redox potential control[J].Biotechnol Bioeng,1999,64(5):552-557.
[6]KILLEEN D J,BOULTON R,KNOESEN A.Advanced monitoring and control of redox potential in wine fermentation[J].Am J Enol Viticult,2018,69(4):394-399.
[7]马双忱,于燕飞,徐涛,等.ORP在水环境污染防控方面的应用[J].工业水处理,2020,40(2):14-27.
[8]SHEN S Y,LIN Y H,LIU C G.Real-time microbial growth monitoring by combining microbial fuel cell-based device with modified Nernst equation[J].Can J Chem Eng,2023,102(3):1020-1030.
[9]LIN Y H,CHIEN W S,DUAN K J.Correlations between reduction-oxidation potential profiles and growth patterns of Saccharomyces cerevisiae during very-high-gravity fermentation[J].Process Biochem,2010,45(5):765-770.
[10]BONAN C I D G,BIAZI L E,DIONÍSIO S R,et al.Redox potential as a key parameter for monitoring and optimization of xylose fermentation with yeast Spathaspora passalidarum under limited-oxygen conditions[J].Bioproc Biosyst Eng,2020,43(8):1509-1519.
[11]LIU C G, HAO X M, LIN Y H, et al.Redox potential driven aeration during very-high-gravity ethanol fermentation by using flocculating yeast[J].Sci Rep,2016,6(1):25763.
[12]WANG Z H, ZHU X W, HE G X, et al.Feeding culture process optimization of photosynthetic bacteria based on oxidation reduction potential[J].Sci Technol Food Ind,2019,40(12):141-144,148.
[13]GUO J J, WU Y X, TANAKA T, et al.Development of redox potential-driven fermentation process for recombinant protein expression[J].Biotechnol Lett,2021,43(1):99-103.
[14]ESCALANTE-MINAKATA P, IBARRA-JUNQUERA V, ROSU H C,et al.Online monitoring of Mezcal fermentation based on redox potential measurements[J].Bioproc Biosyst Eng,2009,32(1):47-52.
[15]TENG P,LIN Y H.Designing a novel portable oxidation-reduction potential and microbial fuel cell-based sensor to monitor microbial growth[J].Can J Chem Eng,2023,102(1):30-34.
[16]ZHOU Z Y,JING Y J,WEI S J,et al.Enhancement of butanol production in Clostridium acetobutylicum SE25 through oxidation-reduction potential regulation and analysis of its metabolic mechanisms[J].Fuel,2023,331:125708.
[17]ZHANG Y S,LIN Y H.Metabolic flux analysis of Saccharomyces cerevisiae during redox potential-controlled very high-gravity ethanol fermentation[J].Biotechnol Appl Biochem,2020,67(1):140-147.
[18]CHEN L, WU Y, XUE C, et al.Improving fructose utilization and butanol production by Clostridium acetobutylicum via extracellular redox potential regulation and intracellular metabolite analysis[J].Biotechnol J,2017,12(10):1700198.
[19]刘朋波,徐佳杰,付水林,等.1,3-丙二醇发酵中氧化还原电位的变化与控制[J].化学与生物工程,2008,25(3):45-48.
[20]GRIMALT-ALEMANY A,ETLER C,ASIMAKOPOULOS K,et al.ORP control for boosting ethanol productivity in gas fermentation systems and dynamics of redox cofactor NADH/NAD+under oxidative stress[J].J CO2 Util,2021,50:101589.
[21]YAMADA S,TAKAMATSU Y,IKEDA S,et al.Towards application of electro-fermentation for the production of value-added chemicals from biomass feedstocks[J].Front Chem,2022,9:805597.
[22]UCAR D,ZHANG Y F, ANGELIDAKI I.An overview of electron acceptors in microbial fuel cells[J].Front Microbiol,2017,8:643.
[23]ALBERTO GARCÍA MOGOLLÓN C, CARLOS QUINTERO DÍAZ J,OMAR GIL POSADA J.Production of acetone,butanol,and ethanol by electro-fermentation with Clostridium saccharoperbutylacetonicum N1-4[J].Bioelectrochemistry,2023,152:108414.
[24]NGUYEN D M.Oxidation-reduction potential-based micro-aeration control system for anaerobic digestion[D].Scotland:Heriot-Watt University,2018.
[25]BONAN C I D G,BIAZI L E,SANTOS S C,et al.Online monitoring of the redox potential in microaerobic and anaerobic Scheffersomyces stipitis fermentations[J].Biotechnol Lett,2019,41(6-7):753-761.
[26]张栩,吴又多,齐高相,等.氧化还原电位调控混合糖为底物的丁醇发酵[J].化工学报,2014,65(6):2225-2231.
[27]ARBTER P,WIDDERICH N,UTESCH T,et al.Control of redox potential in a novel continuous bioelectrochemical system led to remarkable metabolic and energetic responses of Clostridium pasteurianum grown on glycerol[J].Microbial Cell Factories,2022,21(1):178-196.
[28]RIONDET C,CACHON R,WACHÉ Y,et al.Extracellular oxidoreduction potential modifies carbon and electron flow in Escherichia coli[J].J Bacteriol,2000,182(3):620-626.
[29]姜岷,黄秀梅,李建,等.氧化还原电位调控对产琥珀酸放线杆菌代谢通量分布的影响[J].化工学报,2009,60(10):2555-2561.
[30]SRIDHAR J, EITEMAN M A.Influence of redox potential on product distribution in Clostridium thermosuccinogenes[J].Appl Biochem Biotech,1999,82(2):91-102.
[31]姜岷,李建,陈可泉,等.氧化还原电位调控对Actinobacillussuccinogenes厌氧发酵产丁二酸的影响[J].化工进展,2008,27(8):1250-1261.
[32]BAGRAMYAN K,GALSTYAN A,TRCHOUNIAN A.Redox potential is a determinant in the Escherichia coli anaerobic fermentative growth and survival: effects of impermeable oxidant[J].Bioelectrochemistry,2000,51(2):151-156.
[33]JIANG Y,LU L,WANG H,et al.Electrochemical control of redox potential arrests methanogenesis and regulates products in mixed culture electro-fermentation[J].ACS Sust Chem Eng,2018,6(7):8650-8658.
[34]DU C,YAN H,ZHANG Y,et al.Use of oxidoreduction potential as an indicator to regulate 1,3-propanediol fermentation by Klebsiella pneumoniae[J].Appl Microbiol Biot,2006,69(5):554-563.
[35]KASTNER J R,EITEMAN M A,LEE S A.Effect of redox potential on stationary-phase xylitol fermentations using Candida tropicalis[J].Appl Microbiol Biot,2003,63(1):96-100.
[36]冯华良,高教琪,侯胜博,等.ORP调控对马克斯克鲁维酵母发酵纤维素水解液的影响[J].化工学报,2017,68(11):4279-4287.
[37]郑继岱,徐国谦,储炬,等.利用氧化还原电位调控乳酸发酵[J].生物加工过程,2008(5):73-77.
[38]张泽,杭海峰,李晓雪,等.应用氧化还原电位调控拟干酪乳杆菌发酵产乳酸过程[J].食品与生物技术学报,2012,31(10):1025-1030.
[39]ZHU J G, JI X J, HUANG H, et al.Production of 3-hydroxypropionic acid by recombinant Klebsiella pneumoniae based on aeration and orp controlled strategy[J].Korean J Chem Eng,2009,26(6):1679-1685.
[40]方帷,李晓,李华志,等.利用氧化还原电位优化玉米酒精浓醪发酵过程研究[J].中国酿造,2019,38(3):59-64.
[41]宗晗,杜聪,李益民,等.氧化还原电位调控对Spathaspora passalidarum发酵纤维素水解液的影响[J].食品与发酵工业,2022,48(1):29-35.
[42]XUE S J,WANG L,CHEN S,et al.Controlled aeration driven by oxidation-reduction potential affects ester profile in wine alcohol fermentation with different starter cultures[J].Aust J Grape Wine R,2023,https://doi.org/10.1155/2023/5667458.
[43]XUE S J,ZHANG J R,ZHANG R X,et al.Oxidation-reduction potential affects medium-chain fatty acid ethyl ester production during wine alcohol fermentation[J].Food Res Int,2022,157:111369.
[44]HUANG T,TAN H L,LU F J,et al.Changing oxidoreduction potential to improve water-soluble yellow pigment production with Monascus ruber CGMCC 10910[J].Microbial Cell Factories,2017,16(1):208.
[45]DU C Y,ZHANG Y P,LI Y,et al.Novel redox potential-based screening strategy for rapid isolation of Klebsiella pneumoniae mutants with enhanced 1,3-propanediol-producing capability[J].Appl Environ Microbiol,2007,73(14):4515-4521.
[46]XIAO W S, WANG R S, HANDY D E, et al.NAD(H) and NADP(H)redox couples and cellular energy metabolism[J].Antioxid Redox Signal,2018,28(3):251-272.
[47]闻远.胞内氧化还原电位扰动提升运动发酵单胞菌对木质纤维素水解液抑制物的耐受性[D].上海:上海交通大学,2019.