1 黄酒概述
1.1 黄酒简介
黄酒是一种以糯米、粳米、籼米、小米等谷物为原料,经蒸煮、糖化、发酵、压榨、澄清、煎酒、陈酿、勾兑等工序酿造而成的中华传统饮品[1]。其酒精度偏低,一般为8%vol~16%vol。中国黄酒历史悠久,文化灿烂,是世界上三大古老的酿造酒之一,也是中国特有的粮食酿造酒,堪称“国粹”[2]。此外,黄酒富含多种营养物质和功能性成分,如氨基酸、谷胱甘肽等,因此还享有“液体蛋糕”的美誉[3]。我国黄酒的品种丰富,分布广泛,主要分布在沿海地区。不同地区的黄酒各有其特色,其中在国内和国际上,以绍兴黄酒最为知名[4]。
1.2 黄酒分类
根据不同的分类标准,黄酒的分类也有所不同。目前常见的分类方式如图1所示:
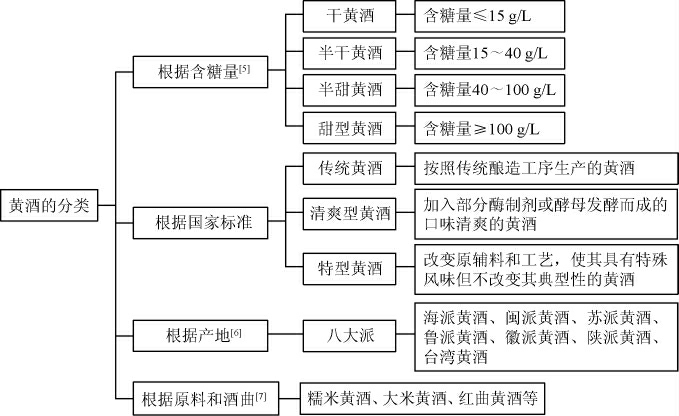
图1 黄酒分类示意图
Fig.1 Diagram of Huangjiu classification
2 黄酒微生物研究进展
2.1 黄酒酒曲的微生物多样性
2.1.1 酒曲的种类
黄酒发酵过程中微生物的主要来源于酒曲,这些微生物在发酵过程中会进行完全不同的代谢,生成多种不同的代谢产物,从而赋予黄酒独特的风味。目前报道的酒曲主要有三种:分别是麦曲、小曲(酒药)和红曲,黄酒三种主要酒曲制作工艺及代表产品见表1。早期黄酒及酒曲的微生物解析主要依赖传统培养方法[8]。随着科技发展,以脱氧核糖核酸(deoxyribonucleic acid,DNA)或核糖核酸(ribonucleic acid,RNA)为目标物的现代分子生物学技术逐渐兴起,如聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denatured gradient gel electrophoresis,PCR-DGGE)技术、温度梯度凝胶电泳、随机引物PCR-DNA多态性分析(random amplified polymorphic DNA,RAPD)和高通量测序(high-throughput sequencing,HTS)等,这些技术比较精确地揭示了微生物种类和遗传的多样性,极大地丰富了微生物资源[9-11]。
表1 黄酒三种主要酒曲制作工艺及代表产品
Table 1 Production process of 3 main Huangjiu Jiuqu and their representative products
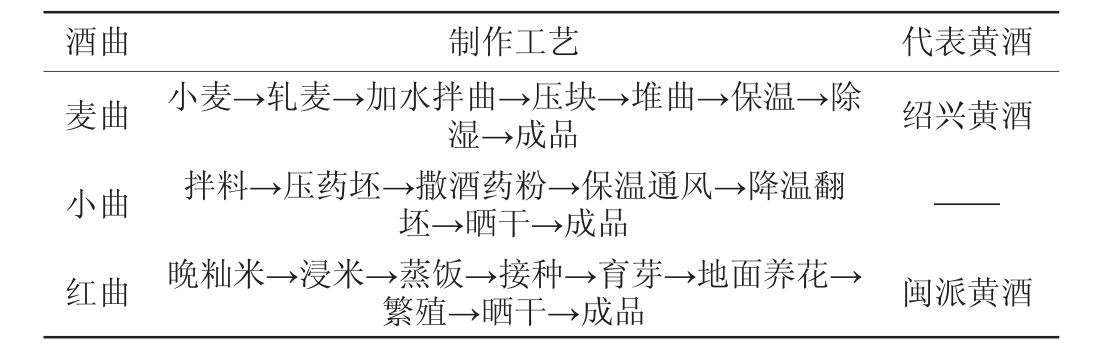
酒曲 制作工艺 代表黄酒麦曲 小麦→轧麦→加水拌曲→压块→堆曲→保温→除湿→成品 绍兴黄酒小曲红曲拌料→压药坯→撒酒药粉→保温通风→降温翻坯→晒干→成品晚籼米→浸米→蒸饭→接种→育芽→地面养花→繁殖→晒干→成品——闽派黄酒
2.1.2 麦曲的微生物多样性
麦曲顾名思义是“以麦制曲”,其含有丰富的微生物菌群,在酿酒过程中菌种的丰度和协调性直接影响了黄酒的品质。麦曲主要用于绍兴黄酒的生产,近几年已有不少研究者基于HTS解析了麦曲的菌群结构。如刘芸雅等[12]利用高通量测序平台(Illumina Miseq)对麦曲中细菌的16S rDNA的可变区序列进行分析,在属水平上检测到麦曲的优势细菌属有芽孢杆菌属、糖多孢菌属、肠杆菌属和葡萄球菌属,其中芽孢杆菌属是相对丰度最大的优势菌属,占58.65%。任清等[13]也从北宗黄酒麦曲中分离纯化得到了多株芽孢杆菌,有地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)、短小芽孢杆菌(Bacillus pumilus)、萎缩芽孢杆菌(Bacillus atrophaeus)等。说明芽孢杆菌是麦曲中常见的细菌属,但目前对于不同芽孢杆菌在发酵过程中对黄酒品质的影响鲜有报道,还需进一步探究。JI Z等[14]对比了上海金山(SJQ)、浙江绍兴(ZGQ)和江苏南通(JNQ)三个不同产地的生麦曲和另外两种熟麦曲的真菌群落多样性,结果表明自然培养的生麦曲比熟麦曲显示出更高的真菌多样性,并且在属的水平上,每个产地的黄酒麦曲微生物显著不同。在SJQ中,曲霉属(Aspergillus)和链格孢菌属(Alternaria)分别占72.5%和6%;在JNQ中,链格孢菌和镰刀菌(Fusarium)分别占85.0%和8.2%;在ZGQ中,嗜热真菌属(Thermomyces)、根毛霉属(Rhizomucor)和曲霉属分别占69.1%、13.2%和11.1%。由此可见,不同地理环境对自然培养的麦曲微生物多样性有着较大的影响。不仅如此,不同的制曲方式也会造成麦曲的微生物多样性差异。张中华[15]基于传统微生物分离培养方法和PCR-DGGE对手工麦曲、机制麦曲和熟麦曲中的细菌和真菌进行了全面地剖析,发现高温放线菌属和镰孢菌属是手工曲中特有的微生物;米黑根毛霉、蜡叶散囊菌和微小根毛霉等是机械曲中特有的真菌,这与谭婷婷等[16]研究的人工踏制麦曲有较大差异,其分离出的优势霉菌经鉴定为多枝横梗霉(Lichtheimia ramosa)、米曲霉(Aspergillus oryzae)、产紫青霉(Penicillium purpurogenum)、杂色曲霉(Aspergillus versicolor)和交链孢霉(Alternaria mali)。因此,研究多样的麦曲微生物是掌握发酵过程进行的第一步,通过了解其中的微生物并监测其在发酵过程中的变化,再进一步探究风味特性与参与发酵过程的主要微生物之间的相关性,就能在此基础上提高黄酒的质量。
2.1.3 红曲的微生物多样性
红曲又称丹曲,是以大米为原料经红曲霉等微生物发酵而成的一种米曲。福建省是我国红曲的主要产地,生产历史已传承延续了近千年,其中以古田红曲最为出名[17]。红曲又分为功能红曲和酿造红曲,红曲在固态发酵过程中红曲霉会产生多种活性代谢产物,如降血脂因子莫纳可林K等[18]。因此功能红曲主要是用于生产保健食品。而酿造红曲除了用于酿酒外,还可以用于多酱油、醋、腐乳等多种发酵食品[19]。李路等[20]在黄酒酿造红曲中发现其优势真菌属有黑曲霉(74.157%)、紫红曲霉(22.827%)、黄曲霉(2.716%)和酿酒酵母(0.198%);优势细菌属有芽孢杆菌属(62.791%)、魏斯氏菌属(6.944%)、片球菌属(17.290%)和葡糖醋杆菌属(2.931%)。该酒曲中最为主要的优势细菌也是芽孢杆菌,可见芽孢杆菌在黄酒发酵过程中发挥着重要的作用。据报道,芽孢杆菌属能分解大分子物质形成双乙酰、含氮化合物等芳香物质,这得益于其较强的产酶能力[21]。LIANG Z等[22]对武夷红曲的微生物多样性进行了分析,结果发现武夷红曲中的优势真菌群落为黑曲霉、红曲霉和根霉;优势细菌主要为芽孢杆菌。总体来看,红曲微生物多样性较为稳定,这可能与制曲的工艺有关。红曲主要通过接种红曲霉制得,加之其历史悠久,在发展过程中研究者不断从传统红曲中分离出优良菌株,结合传统工艺生产红曲,到如今红曲的品质已经得到了较大的改善,质量和菌群结构都较为稳定。
2.1.4 小曲的微生物多样性
小曲又称酒药、白药或白曲。主要用于生产白酒和黄酒的两大类,但两者的成品香型却不一样。小曲生产的白酒为小曲清香型白酒,是我国的四大香型白酒之一[23]。目前已有不少文献分析了小曲在清香型白酒中的应用,但其在黄酒中的报道却较少。通过以中国知网数据库(China national knowledge infrastructure,CNKI)为文献源,检索到以“黄酒白曲”和“黄酒小曲”、“黄酒酒药”为篇名的文献共195篇,可知有关小曲在黄酒发酵中的研究较少。这可能有两个原因:一是我国小曲的历史较为悠久,加之其工艺各有特色,形成多种类型,且分布较为广泛,研究具有一定的难度,毛青钟等[24]在文献中比较分析了三十多种小曲的特点,这也说明了这一点;二是小曲在白酒生产中已占据了较大的市场,使得研究者们忽略了其在黄酒中的应用研究,目前只有少数研究者研究了黄酒小曲的核心微生物组成及特性。早期,尹永祺[25]利用分离培养的方法,鉴定了黄酒酒药中的优势酵母菌是酿酒酵母(Saccharomyces cerevisiae)、密西西比毕赤酵母(Pichia mississippiensis)、费比恩毕赤酵母(Pichia fabianii)和葡萄牙棒孢酵母(Clavispora lusitaniae);霉菌则主要包括犁头霉、黄曲霉和米曲霉;优势细菌属仍是芽孢杆菌。毛青钟[26]也用同样的方法测定了成品酒药中的酵母、细菌和霉菌数量,发现酒药中最多的微生物是拟内孢霉酵母,其具有边生长边糖化的能力,是酒药香气的主要产生菌。酒药中的细菌数量仅次于酵母,主要包括乳酸球菌、乳酸杆菌、醋酸菌等;霉菌数量最少,但种类较多,有根霉、犁头霉、毛霉、青霉、念珠霉等,其中念珠霉是搭窝糖化期主要的糖化分解菌,能产生独特的清香。近年,杨晨等[27]利用单分子实时定量测序(single molecule real time sequencing,SMRT-seq)技术在种水平上分析了绍兴不同酒厂成品酒药(SYH、TP、JH、CYY)的微生物群落结构差异(表2)。从结果来看,不同环境下生产的酒药细菌群落结构差异较大,但真菌结构较为稳定,均以扣囊复膜酵母(Saccharomycopsis fibuligera)的相对丰度最高。可见环境条件对酒药中的真菌的影响较小,细菌影响较大。而黄酒的品质又受这些菌群共同作用的影响,因此在后续研究中可着手研究不同优势细菌的关键作用,保持菌群的稳定性。
表2 基于种水平不同酒厂成品酒药的微生物菌群结构
Table 2 Structure of microbial community in Jiuyao from different distilleries based on species level

酒药编号 真菌 细菌SYH TP JH CYY扣囊复膜酵母(Saccharomycopsis fibuligera)(73.53%),酿酒酵母(Saccharomyces cerevisiae)(7.08%)、异常威克汉姆酵母(Wickerhamomyces anomalus)(5.01%)扣囊复膜酵母(S.fibuligera)(64.74%),少根根霉(Rhizopus arrhizus)(15.58%),小孢根霉(Rhizopus microsporus)(9.55%)扣囊复膜酵母(S.fibuligera)(63.38%)、少根根霉(R.arrhizus)(9.83%)、东方伊萨酵母(Issatchenkia orientalis)(8.96%)扣囊复膜酵母(S.fibuligera)(76.67%)、光滑假丝酵母(Candida glabrata)(7.93%)、酿酒酵母(S.cerevisiae)(5.11%)戊糖片球菌(Pediococcus pentosaceus)(44.66%)、食窦魏斯氏菌(Weissella cibaria)(7.20%)、片球菌属其他(Pediococcus other)(5.20%)戊糖片球菌(P.pentosaceus)(36.27%)、肠杆菌属其他(Enterococcus other)(12.75%)、片球菌属其他(Pediococcus other)(4.35%)戊糖片球菌(P.pentosaceus)(36.27%)、肠杆菌属其他(Enterococcus other)(12.75%)、片球菌属其他(Pediococcus other)(4.35%)食窦魏斯氏菌(W.cibaria)(17.92%)、伴突属其他(Sodalis other)(6.50%),融合魏斯氏菌(W.confusa)(5.90%)
2.2 黄酒酿造过程中微生物的动态变化
2.2.1 细菌菌群的动态变化
LIU S P等[28]采用llumina MiSeq分析了绍兴黄酒发酵过程中的细菌动态变化,在投放初期发现了10个优势属。其中芽孢杆菌、葡萄球菌和热放线菌在初级发酵期间逐渐增加,然后在发酵后略有减少。这是随着发酵的进行,环境中氧气减少,酒精含量增加所致。乳酸菌最初急剧减少,然后增加,最终在发酵结束时占主导地位。乳酸菌属于兼性厌氧菌且耐酸性较强,因此在发酵后期可更好地生长。在红谷红曲黄酒中乳酸杆菌属(Lactobacillus)也呈现出相同的变化趋势,通过监测黄酒发酵过程中的理化指标,发现酒体的总酸含量先快速增加后下降,后期又增加[29]。部分乳酸杆菌在发酵后期参与淀粉、糊精的分解,是确保淋饭酒母后发酵期和摊饭酒发酵过程顺利完成的关键菌种[26]。此外,研究者还利用聚类分析探究了发酵过程中细菌菌群结构的相似性。结果发现发酵3 d、7 d的细菌群落较为相似,且这个阶段细菌菌群的结构发生了较大的变化。
2.2.2 真菌菌群的动态变化
牟穰等[30]检测了麦曲黄酒发酵液0 d、2 d和后发酵6 d(即后发酵开始阶段)的真菌群落变化。当发酵开始进行,由于加入其他原料带入了其他微生物,使得前阶段真菌种类相比于麦曲只增加了6种,因此黄酒发酵液中的微生物主要来源于麦曲。发酵刚开始时,发酵环境相对稳定,对真菌还没有明显的抑制作用。而随着发酵的进行,优势真菌呈现减少的趋势,这是由于有些微生物生长过程中的代谢产物对真菌有毒害作用。到了发酵后期,发酵温度下降,一些细菌的代谢活动变缓,真菌种类又开始增加,主要增加了根霉属、毛霉属这一类的糖化真菌。LV X C等[31]报道了有关武夷红曲黄酒发酵过程中真菌动态变化。研究显示,米根霉(R.oryzae)在酿造初期急剧增加并占主导地位,但从第10天到酿造结束持续下降。酿酒酵母在早期阶段急剧增加,并在传统酿造过程结束时成为了主要的优势菌种。在古田红曲黄酒发酵过程中,酿酒酵母在发酵后期也同样占据主导地位[32]。原因是酿酒酵母有极好的乙醇耐受性,即便发酵后期体系中酒精含量增加其也能存活。此外,红曲霉作为红曲黄酒中最具特征的微生物随着发酵的进行不断减少,其相对丰度从第一阶段的从24.72%下降至14.37%,最后下降至9.23%。综上所述,真菌和细菌在发酵过程中均有显著的变化,其变化趋势是由发酵环境的改变和自身特性所决定的。因此,通过探究两者之间的相关性可以设法控制微生物的生长,提高黄酒的品质和安全性。
3 黄酒微生物与风味物质的相关性研究
3.1 非挥发性风味物质
黄酒酿造工艺独特,其主要风味成分除了挥发性风味物质,还有氨基酸、有机酸、糖类等非挥发性风味物质。这些风味物质共同造就了黄酒独特、复杂的香气特征。
氨基酸自身会呈现不同的味道(酸、甜、鲜、涩、苦味),还会分解生成高级醇与黄酒中的有机酸酯化后生成多种酯类物质,是黄酒中重要的风味物质[33]。绍兴机械黄酒在发酵过程中平均含量较高的五种氨基酸分别是精氨酸(13.19%)、丙氨酸(12.27%)、色氨酸(11.23%)、脯氨酸(9.82%)和谷氨酸(9.43%)。这些氨基酸中,苦味氨基酸总体呈先增后降的趋势,而甜味氨基酸呈先急后缓的增长趋势[34],氨基酸的增长可能是由于微生物细胞自身所含的氨基酸溶出导致的。田翔等[35]建立了一种高效精确的超高效液相色谱法用于测定4种黄酒的17种氨基酸含量。结果表明游离氨基酸总量最高的是浙江糯米黄酒,总量最低的是山西麋子黄酒。前者含量较高的是丝氨酸和酪氨酸,后者则是丙氨酸含量较高。丙氨酸也是陕西麋子黄酒中含量较高的氨基酸,为165.88 mg/L,是山西麋子黄酒的2倍。可见,不同的原料和酿造过程对黄酒中氨基酸含量及分布有较大的影响。因此在黄酒酿造过程中可进一步研究原料蛋白与成品氨基酸的关联性,进而选择合适的原料,在提高黄酒营养的同时也能丰富口感。
有机酸在黄酒中起到呈香呈味的作用,同时还可以抑制发酵过程中杂菌的生长。含酸量少的酒酒味寡淡单调,而含酸量过高会导致味酸刺舌[36]。据此,张长勇等[37]建立了黄酒中有机酸指纹图谱,用于黄酒的鉴别和质量评价。根据高效液相色谱(high-performance liquid chromatography,HPLC)结果分析,大部分有机酸均存在于黄酒中[38]。其中乳酸、琥珀酸、柠檬酸、苹果酸等均属于不挥发酸[39]。LIU Q等[40]则采用毛细管电泳-间接紫外检测法来测定黄酒中的主要有机酸,结果显示黄酒中的有机酸平均质量浓度为5 455.50mg/L,其中最高的是乳酸(2 615.90~5 447.80 mg/L),其次是乙酸(337.60~684.90 mg/L)和柠檬酸(335.80~618.10 mg/L)。高云超等[41]采用HPLC的方法测定了广东客家黄酒中的有机酸,并将所测的有机酸分为了四类:其中50%左右的是以琥珀酸为代表的主要有机酸;10%~20%是次要有机酸,包括乳酸和乙酸;1%~20%的是良性口味氨基酸,主要有草酸和柠檬酸;微量有机酸为富马酸和丙酸,对风味没有贡献。有机酸检测需要找到更适合的方法,以克服现有方法成本高、基质效应严重以及在某些情况下需要衍生或样品净化的缺点。
3.2 挥发性风味物质
对于黄酒中的挥发性物质,目前已经有了大量的研究,多集中在不同种类黄酒的风味物质上。陈双[42]准确测定了古越龙山传统型黄酒的香气组分含量,并通过香气活力值(odor activity value,OAV)确定了香兰素、3-甲基丁醛、二甲基三硫、苯甲醛、γ-壬内酯等物质对黄酒香气特征有较大贡献。山西黄酒的主要香气成分则是β-苯乙醇、3-甲基丁酸、乳酸乙酯、索托龙、香草醛、肉桂酸乙酯、3-苯基丙酸乙酯、2-甲基丁醛和甲硫醇[43]。这是利用气相色谱-嗅觉测定法(gas chromatography-olfactometry,GC-O)结合芳香提取物稀释分析(aromatic hydrocarbon extraction,AEDA)和气味特定量估计(odor specific quantity estimates,OSME)确定的,这种方法还首次证实了肉桂酸乙酯和3-苯基丙酸乙酯在黄酒的整体香气中起关键作用。郭伟灵等[44]采用顶空固相微萃取结合气质联用(headspace solid phase microextractiongas chromatography-mass spectrometry,HS-SPME-GC-MS)法比较了不同地区红曲黄酒中的挥发性组分,结果从福建老酒、福州青红酒、乌衣红曲酒和龙岩沉缸酒中分别检出41种、36种和29种挥发性化合物,以酯类和醇类为主。据报道,苯乙醇、乙酸乙酯、乳酸乙酯、辛酸、丁二酸二乙酯等多种乙酯和3-甲基-1-丁醇是红曲黄酒和药白曲黄酒间的显著差异挥发性物质[45]。严沁等[46]也证明了这其中多种物质对麦曲黄酒的风味有较大的贡献作用。并通过多元性回归分析表明了正己酸乙酯和辛酸乙酯与黄酒的果香味呈显著正相关,而黄酒中的醇香多与异丁醇、异戊醇和蘑菇醇等醇类物质呈正相关。
此外,也有研究者对黄酒酿造过程的挥发性物质变化进行了研究。王春艳等[47]利用GC-MS监测了小米黄酒主发酵过程中的挥发性物质变化,发现0~2 d时各类挥发性物质开始迅速增加,增加最快的是高级醇类。18 d时,酯类超越醇类成为了发酵液中相对含量最高的物质。挥发性物质总量在发酵第24天达到了峰值,为44.36 mg/L。WANG J等[48]采用溶剂辅助蒸馏(solvent assisted flavor evaporation,SAFE)结合GC-MS和化学计量法对黍米黄酒黄酒酿造过程中几个不同阶段的挥发性成分进行了研究。结果表明,乙酸、3-甲基丁酸、1,1-二乙氧基乙烷和3-甲基丁醛在初级发酵阶段大量产生,乳酸乙酯、β-苯乙醇和2,3甲基-1-丁醇则主要在发酵阶段大量生成。发酵60 d之后,酯类是含量最高的物质,其次是酸类和醇类,此时黄酒中化合物的增速相较于主发酵阶段明显减缓。在过滤之后,酯类减少最多,醇类、酚类则保持稳定。而在陈酿阶段,随着时间的延长,醇类和酸类逐渐下降,此时主要的风味物质为酯类。赵培城等[49]研究发现,低年份黄酒更为醇香,这是由于苯乙醇、异戊醇和苯甲醛的作用。而高年份的黄酒则更为酯香和协调,这与乙酰基苯、糠醇和多种乙酯类风味物质有关。盛凤云等[50]首次探究了发酵温度对黄酒风味物质的影响,发现低温酿造的黄酒乙酸乙酯和总酯含量均要高于常温酿造的黄酒,且整体香气品质特别是水果香花香的香气特征显著优于常温酿制的黄酒。
综上,对黄酒风味贡献较大的挥发性物质主要以醇类和酯类为主。但黄酒风味受多种因素影响,不同产地、不同酒曲、不同发酵温度、不同陈酿时间等均会对黄酒的风味物质造成影响。因此需要逐渐统一黄酒的分类标准,按照不同分类系统地研究风味物质的多样性。
3.3 相关性研究
黄酒中的风味物质与微生物的生长代谢息息相关。红小米黄酒中丰度前20的细菌属与70种挥发性风味物质的相关性分析显示,乳酸杆菌属(Lactobacillus)与甲基环戊烷以及4种醇类、4种醛酮类有关联;正己醇与克鲁沃菌属(Kluyvera)、克罗彭斯特菌属(Kroppenstedtia)、肠球菌属(Enterococcus)、大洋芽孢杆菌属(Oceanobacillus)、魏斯氏菌属(Weissella)、慢生芽孢杆菌属(Lentibacillus)均具有相关性;乙酸乙酯只与芽孢杆菌属(Bacillus)相关;庚酸乙酯则只与慢生芽孢杆菌属相关[29]。LY S等[51]研究表明,魏氏菌属、足球菌属(Pediococcus)和乳酸杆菌属与风味化合物最为相关。洪家丽等[52]研究发现,葡糖酸醋酸杆菌属、柠檬明串珠菌、假单胞菌属和几种乳杆菌与酿造过程中的多种挥发性风味物质呈正相关;而多种芽孢杆菌,如人参土芽孢杆菌、单纯芽孢杆菌、枯草芽孢杆菌等在发酵过程中与大多数挥发性风味物质呈负相关,但其却与5,7-二氧辛酸、苯甲醛、己醛和丙酸等风味物质呈正相关。
对真菌而言,红曲霉属(Monascus)与苯乙醇、芳樟醇和己醛呈现较强的相关性。链格孢菌属(Alternaria)和根霉属(Rhizopus)分别与异丁醇和异丁酸乙酯具有极强的相关性。据报道,根霉属可以产生多种酶类推动各种代谢过程,并且生成多种有机酸,是酒中与香味物质有关的重要菌属[53];曲霉属(Aspergillus)则与苯乙醇的产生具有较强的相关性,其可以生成蛋白酶分解原料形成氨基酸,有效的丰富黄酒的口感[54]。酿酒酵母在低pH发酵条件下通过丙酮酸代谢途径会生成L-亮氨酸,L-亮酸通过降解III途径能生成具有麦芽香味的3-甲基丁烷-1-醇[55]。总体来看,与黄酒风味物质相关性较强的真菌主要是霉菌和酵母菌,霉菌主要是曲霉属和根霉属。而细菌受外界因素影响较大,菌群结构更为复杂多变,在发酵过程中难以控制。因此,通过探究不同黄酒的核心微生物与风味物质的相关性来寻找关键的产香微生物是十分重要的。
4 总结与展望
综上所述,目前黄酒麦曲和红曲的优势微生物已逐渐明朗,但小曲中的优势微生物研究还有待加强。酒曲为黄酒的发酵提供了丰富的微生物,常见的细菌菌群主要有芽孢杆菌属、多孢菌属、魏斯氏菌属和片球菌属,后三者均属于乳酸菌,这些菌属与多数关键风味物质具有相关性。常见的真菌有根霉属、曲霉属、扣囊复膜酵母和酿酒酵母。黄酒的挥发性风味物质主要是酯类和醇类,主要存在于主发酵和陈酿阶段。但通过对这些研究成果的总结分析,未来黄酒微生物与风味物质的研究还有一些问题亟待解决:①加大对一些地区特色黄酒的研究;②加强构建黄酒优势微生物与非挥发性物质的相关性网络;③重点关注完整酿造过程中菌群和风味的变化,以剖析整个酿造体系。同时还需深入研究微生物间的相互作用对黄酒风味物质的影响。
[1]方昊.基于黄酒非发酵配伍的复合配方筛选及抗疲劳效果研究[D].杭州:浙江工商大学,2020.
[2]傅祖康.中国黄酒产业分布现状及面临问题对策思考[J].中国酒,2022(4):42-51.
[3]孙清廉.中国传统的液体蛋糕——黄酒[J].家庭医学(下半月),2021(1):43.
[4]郑和龙.黄酒酵母菌株对黄酒发酵微生物群落结构与风味物质的影响[D].杭州:浙江工商大学,2020.
[5]CHEN S, WANG D, XU Y, et al.Characterization of odor-active compounds in sweet-type Chinese rice wine by aroma extract dilution analysis with special emphasis on sotolon[J].J Agr Food Chem, 2013, 61(40):9712-9718.
[6]章国强.发展中国黄酒的建议[J].酒·饮料技术装备,2022(2):27-29.
[7]黄酒的主要分类及酿制器具[J].科学之友(上半月),2014(7):26-27.
[8]余培斌.改善绍兴黄酒麦曲品质的初步研究[D].无锡:江南大学,2013.
[9]夏傲喃,李建华,林祥娜,等.发酵食品微生物多样性分析方法研究进展[J].食品研究与开发,2021,42(4):220-224.
[10]谭聃,欧铜.第三代测序技术的研究进展与临床应用[J].生物工程学报,2022,38(9):3121-3130.
[11]王玉静,陆梓涔,陈俊煜,等.高通量测序技术的发展及其在临床检测中的应用[J].厦门大学学报(自然科学版),2021,60(5):811-820.
[12]刘芸雅,毛健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1):201-208.
[13]任清,侯昌.北宗黄酒麦曲微生物的分离鉴定[J].食品科学,2017,38(4):77-82.
[14]JI Z, JIN J, YU G, et al.Characteristic of filamentous fungal diversity and dynamics associated with wheat Qu and the traditional fermentation of Chinese rice wine[J].Int J Food Sci Tech,2018,53(7):1611-1621.
[15]张中华.绍兴黄酒麦曲中微生物群落结构的研究[D].无锡:江南大学,2012.
[16]谭婷婷,王家林,桑戈,等.北方黄酒麦曲中真菌的筛选·鉴定及系统发育分析[J].安徽农业科学,2015,43(17):15-16,71.
[17]林风.福建古田为红曲发源地考证[J].中草药,2017,48(13):2793-2800.
[18]ENDO A, MONACOLIN K.Monacolin K, a new hypocholesterolemic agent produced by a Monascus species[J].J Antibiot,1979,32(8):852-854.
[19]陈慎,黄颖颖,杨成龙.酿造红曲研究现状与展望[J].中国酿造,2022,41(5):8-12.
[20]李路,吕燕霖,郭伟灵,等.红曲黄酒传统酿造用曲中的微生物菌群及挥发性风味组分分析[J].食品科学,2019,40(2):79-84.
[21]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[22]LIANG Z,LIN X,HE Z,et al.Dynamic changes of total acid and bacterial communities during the traditional fermentation of Hong Qu glutinous rice wine[J].Electron J Biotechnol,2020,43:23-31.
[23]王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J].食品科学,2022,43(14):264-271.
[24]毛青钟,林德君.各地小曲不同特点的探讨[J].酿酒,2013,40(1):28-34.
[25]尹永祺.黄酒酒药菌群分析、优良菌种筛选及混合菌株发酵研究[D].扬州:扬州大学,2011.
[26]毛青钟.酒药制作过程微生物的变化和作用[J].酿酒科技,2004(5):44-46.
[27]杨晨,刘双平,赵禹宗,等.基于实时定量测序和分离培养技术分析不同绍兴黄酒酒药中的功能微生物[J].食品与发酵工业,2022,48(11):232-238.
[28]LIU S P,MAO J,LIU Y Y,et al.Bacterial succession and the dynamics of volatile compounds during the fermentation of Chinese rice wine from Shaoxing region[J].World J Microbiol Biotechn,2015,31:1907-1921.
[29]谷晓东,李素萍,刘怡琳,等.红谷黄酒发酵过程中微生物多样性与理化指标、挥发性风味的相关性分析[J].食品工业科技,2022,43(23):133-143.
[30]牟穰,毛健,孟祥勇,等.黄酒酿造过程中真菌群落组成及挥发性风味分析[J].食品与生物技术学报,2016,35(3):303-309.
[31]LV X C,CAI Q Q,KE X X,et al.Characterization of fungal community and dynamics during the traditional brewing of Wuyi Hong Qu glutinous rice wine by means of multiple culture-independent methods[J].Food Control,2015,54:231-239.
[32]LIU Z, WANG Z, SUN J, et al.The dynamics of volatile compounds and their correlation with the microbial succession during the traditional solid-state fermentation of Gutian Hong Qu glutinous rice wine[J].Food Microbiol,2020,86:103347.
[33]周建弟.浅谈黄酒中的氨基酸及其含量的控制[J].酿酒科技,2002(4):73-74.
[34]陈青柳,刘双平,唐雅凤,等.绍兴机械黄酒发酵过程中风味物质变化[J].食品科学,2018,39(14):221-228.
[35]田翔,王君杰,秦慧彬,等.超高效液相色谱法测定不同黄酒中17种氨基酸的分析研究[J].酿酒科技,2019(11):74-78,82.
[36]晋湘宜,朱正军,万端极,等.房县传统型、洑汁型、清爽型黄酒中有机酸的分析研究[J].酿酒,2018,45(2):64-67.
[37]张长勇,张雪婧,纪丽君,等.有机酸指纹图谱结合化学计量学分析鉴定黄酒的方法研究[J].食品安全质量检测学报,2022,13(1):48-55.
[38]YU H Y,ZHAO J,LI F,et al.Characterization of Chinese rice wine taste attributes using liquid chromatographic analysis, sensory evaluation,and an electronic tongue[J].J Chromatogr B,2015,997:129-135.
[39]汪建国.嘉兴喂饭酒有机酸的种类、含量、来源及作用[J].江苏调味副食品,2010,27(4):28-31.
[40]LIU Q,WANG L,HU J,et al.Main organic acids in rice wine and beer determined by capillary electrophoresis with indirect UV detection using 2,4-dihydroxybenzoic acid as chromophore[J].Food Anal Meth,2017,10:111-117.
[41]高云超,宫晓波,杨春英,等.广东客家黄酒10种有机酸的HPLC分析[J].酿酒科技,2021(4):106-115.
[42]陈双.中国黄酒挥发性组分及香气特征研究[D].无锡:江南大学,2013.
[43]WANG J,YUAN C,GAO X,et al.Characterization of key aroma compounds in Huangjiu from northern China by sensory-directed flavor analysis[J].Food Res Int,2020,134:109238.
[44]郭伟灵,周文斌,蒋雅君,等.不同类型红曲黄酒中挥发性风味组分比较分析[J].福州大学学报(自然科学版),2018,46(4):586-592.
[45]李路,郭伟灵,周文斌,等.红曲和药白曲对红曲黄酒挥发性风味物质形成的影响[J].中国食品学报,2020,20(2):205-211.
[46]严沁,伍文驰,张楷正.米麦曲米酒挥发性风味物质、氨基酸与感官评价的相关性[J].中国酿造,2021,40(10):56-63.
[47]王春艳,于海彦,乔志航,等.红小米黄酒发酵过程中风味物质与细菌菌群分析[J].食品研究与开发,2022,43(11):102-108.
[48]WANG J, YU Y, GAO X, et al.Succession patterns of aroma components during brewing process of broomcorn millet(Panicum miliaceum L.)Huangjiu[J].Food Res Int,2022,154:110982.
[49]赵培城,蔡际豪,顾赛麒,等.不同酒龄传统绍兴黄酒的特征风味物质分析[J].食品科学,2020,41(22):231-237.
[50]盛凤云,徐俊敏,宋科峰,等.发酵温度对黄酒酿造及风味物质形成影响研究[J].酿酒科技,2021(5):56-61.
[51]LY S,MITH H,TARAYRE C,et al.Impact of microbial composition of Cambodian traditional dried starters(Dombea) on flavor compounds of rice wine: combining amplicon sequencing with HP-SPME-GCMS[J].Front Microbiol,2018,9:894.
[52]洪家丽,李秋艺,潘雨阳,等.红曲黄酒传统酿造过程挥发性风味组分及微生物菌群多样性分析[J].食品科学,2019,40(12):137-144.
[53]HUANG Z R,GUO W L,ZHOU W B,et al.Microbial communities and volatile metabolites in different traditional fermentation starters used for Hong Qu glutinous rice wine[J].Food Res Int,2019,121:593-603.
[54]马琳娜,邱树毅,王啸.不同黄酒酒曲的酿造微生物与风味物质之间的关系[J].食品与发酵科技,2021,57(3):81-89.
[55]SHA S P,JANI K,SHARMA A,et al.Analysis of bacterial and fungal communities in Marcha and Thiat, traditionally prepared amylolytic starters of India[J].Sci Rep,2017,7(1):10967.