泡菜是以乳酸菌为主发酵而成的一种“冷加工”蔬菜制品。在厌氧的环境条件中,乳酸菌作为优势菌群不断生长并生成有机酸等一系列代谢产物,赋予泡菜独特的口感[1];酵母菌在泡菜中含量较少,也不是优势菌群,研究过程其重要性常被忽略,但研究表明酵母在发酵过程产生的乙醇不但有效的抑制泡菜生花,还能与有机酸等物质反应生成酯类等芳香物质,丰富了泡菜的香气[2]。且过去研究发现乳杆菌属(Lactobacillus)和哈萨克斯坦酵母属(Kazachstania)是泡菜中的主要乳酸菌属和酵母属[3]。
乳酸菌和酵母菌处于同一发酵体系中,可以通过代谢产物交换或者细胞交流实现微生物种间的相互作用[4-5]。已有关于酸奶[6]、酸面团[7]、开菲尔乳[8]等的研究表明,酵母菌在富含氮源的生长环境中,其TORC1信号通路受到刺激,代谢产生的氨基酸可为乳酸菌提供生长所需的营养物质,促进乳酸菌的生长[9];而乳酸菌分解乳糖所产生的葡萄糖和半乳糖同时可被酵母菌利用[10]。乳酸菌和酵母菌的代谢互补机制使得微生物即使处于营养物质较匮乏的发酵环境中仍然能够生长,使得复杂体系发酵过程更加高效、稳定和可控[11]。泡菜作为典型的多菌种参与的复杂发酵体系,目前合成微生物群落的研究已经受到研究者的关注[12]。泡菜中关注点对于乳酸菌与乳酸菌或环境因素之间的影响或关系较多,然而关于泡菜中乳酸菌与酵母的互作对发酵进程和品质的影响研究还较少,仍需要深入探究。
因此,该研究通过采用无菌盐水发酵萝卜作为对照组,分别接种了植物乳杆菌(Lactiplantibacillus plantarum)、甘草乳杆菌(Liquorilactobacillus nagelii)和少孢哈萨克斯坦酵母(Kazachstania exigua)单菌和混菌于萝卜泡菜中,测定了发酵过程中萝卜泡菜卤水的微生物数量(乳酸菌数量、酵母菌数量和菌落总数)和理化参数(pH、总酸、还原糖、亚硝酸盐)。通过顶空固相微萃取-气质联用(headspace-solid phase microextraction and gas chromatography-mass spectrometry,HS-SPME-GC-MS)方法检测发酵终点泡萝卜的挥发性风味物质,使用正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)和层次聚类分析(hierarchical cluster analysis,HCA)方法分析了风味化合物差异,解析了乳酸菌和酵母菌混合发酵对萝卜泡菜风味的影响,以期为泡菜工业化生产过程中品质提升提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
新鲜红皮萝卜:成都市锦江区某果蔬市场。
植物乳杆菌(Lactiplantibacillus plantarum)(Lp)、甘草乳杆菌(Liquorilactobacillus nagelii)(Ln)与少孢哈萨克斯坦酵母(Kazachstania exigua)(Ke):筛分自泡菜卤水,并保存于四川省农业科学院农产品加工研究所微生物菌种保藏库。
1.1.2 试剂
氯化钠、盐酸:成都金山化学试剂有限公司;3,5-二硝基水杨酸:广州和为医药科技有限公司;四硼酸钠、α-萘乙二胺二盐酸盐、乙酸锌、无水对氨基苯磺酸和亚硝酸钠:成都市科隆化学品有限公司;亚铁氰化钾:成都市科龙化工试剂厂。试验所用试剂均为分析纯。
1.1.3 培养基
平板计数琼脂(plate count agar,PCA)培养基、乳酸菌(man rogosa sharpe,MRS)培养基和酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基:青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
SynergyTMHTX多功能酶标仪:美国博腾仪器有限公司;Centrifuge5810R冷冻离心机:艾本德(上海)国际贸易有限公司;LRH-150生化培养箱:上海一恒科学仪器有限公司;S210SevenCompact pH计:梅特勒-托利多仪器有限公司;Metrohm855全自动滴定仪:瑞士万通有限公司;Intuvo9000-5977b气相色谱-质谱联用仪:安捷伦科技有限公司。
1.3 方法
1.3.1 菌种活化
将乳酸菌Lp和Ln分别划线接种到MRS固体培养基中,于37 ℃恒温倒置培养24 h;酵母Ke划线接种到YPD固体培养基中,于30 ℃恒温倒置培养24 h。在恒温培养箱中培养24 h之后,分别挑取Ln和Lp的单菌落接入MRS液体培养基中,挑取Ke的单菌落接入YPD液体培养基中,进行24 h的富集培养,使所有菌体浓度达到7(lg CFU/mL)。
1.3.2 泡菜发酵模拟培养液的制备
无菌红皮萝卜汁的制备:挑选新鲜的红皮萝卜进行洗净、切分,与纯净水按1∶1的比例混合榨汁,然后过滤掉红皮萝卜残渣,将过滤红皮萝卜汁煮沸、撇去浮沫,最后使用纱布再次进行过滤、分装,高压蒸汽115 ℃、15 min灭菌后待用。用该萝卜汁模拟泡菜发酵营养液作为菌种培养液。
1.3.3 单菌组和混菌的发酵母液制备
将Lp、Ln和Ke按照1%的接种量分别接种于模拟营养液中;混菌发酵分别为Lp+Ke组、Ln+Ke组(1∶1)和Lp+Ln+Ke组(1∶1∶1),各组中微生物均按总接种量1%混合接种于模拟营养液中,所有培养液于30 ℃恒温培养24~48 h分别得到单菌和混菌发酵母液,各组处理菌体浓度均为7(lg CFU/mL)。
1.3.4 生长曲线测定
按照1%的总接种量分别接种1.3.3中的单菌组Lp、Ln、Ke以及混菌组Lp+Ke、Ln+Ke和Lp+Ln+Ke的菌体发酵母液于泡菜发酵模拟培养液中,25 ℃恒温培养菌液48 h,期间每隔2 h取样用酶标仪在波长600 nm条件下测定吸光度值,以时间为横坐标,吸光度值(OD600 nm)为纵坐标,绘制不同处理组的生长曲线。
1.3.5 萝卜泡菜制作
将新鲜的红皮萝卜洗净、晾干、切分后与4%的盐水以1∶2的比例装入500 mL的坛中,将1.3.3中的发酵母液各取50 mL菌液,在8 000 r/min条件下进行离心10 min,收集离心沉淀菌体,用生理盐水冲洗并接种于萝卜泡菜中;CK组为无菌4%的盐水发酵红皮萝卜。将制备好的萝卜泡菜放置于25 ℃,发酵0~7 d,并在0、1 d、3 d、5 d、7 d取样进行理化和微生物分析,取发酵终点7 d的萝卜样品进行挥发性风味物质的检测。
1.3.6 理化指标分析检测
取发酵过程中0、1 d、3 d、5 d、7 d的萝卜泡菜卤水进行理化指标分析:采用电位法测定pH值[13];采用酸、碱中和滴定法测定总酸[14];采用3,5-二硝基水杨酸法测定还原糖[15];采用GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》的分光光度法测定亚硝酸盐。
1.3.7 微生物分析检测
取0.5 mL萝卜泡菜卤水于4.5 mL无菌生理盐水中混合均匀,经梯度稀释后,分别涂布于MRS平板,厌氧条件下37 ℃经72 h培养后计数乳酸菌数量,采用孟加拉红平板,30 ℃条件下培养72 h后计数真菌数量,采用PCA平板,37 ℃经72 h培养后计数菌落总数。
1.3.8 挥发性风味物质检测[16]
(1)样品前处理
取5 g泡萝卜样品,并加入1.5 g的NaCl于20 mL的顶空进样瓶中。
(2)GC-MS测定条件
萃取条件:50 ℃振摇加热20 min,新萃取头需经270 ℃老化5 min,然后插入顶空瓶吸附30 min,随后在气相进样口250 ℃下解吸5 min。
气相色谱条件:DB-wax色谱柱(30m×250μm×0.25μm),柱温50 ℃,保持3 min,然后以5 ℃/min 的速度升至150 ℃保持3 min,以10 ℃/min升至220 ℃并保持2 min,载气(He),流速1 mL/min,不分流进样。
质谱条件:离子源温度230 ℃,四极杆温度150 ℃,接口温度250 ℃,电子能量70 eV,质量扫描范围:35~550 m/z。
(3)定性定量
由GC-MS得到的谱图,在美国国家标准与技术研究院(national institute of standards and technology,NIST)2001标准谱库的检索及标准品比对进行物质定性,使用面积归一化法进行物质的相对定量。
1.3.9 数据处理
采用SPSS20.0软件进行皮尔逊相关性分析,使用GraphPad Prism9.0.0软件绘制折线图,OPLS-DA分析使用SIMCA14.1。
2 结果与分析
2.1 单菌和混菌在萝卜泡菜模拟营养液中的生长曲线
生长曲线可以反映微生物的生长速度,为探究乳酸菌和酵母互作关系对其生长情况的影响,分别测定了Lp、Ln和Ke三种单菌的生长曲线以及Lp+Ke、Ln+Ke、Lp+Ln+Ke混菌的生长曲线,结果见图1。
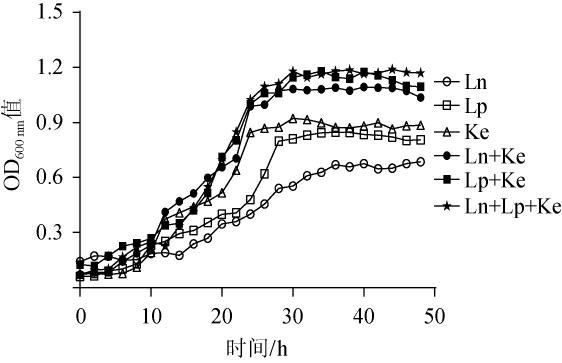
图1 单菌和混菌在培养液中的生长曲线
Fig. 1 Growth curves of single and mixed strains in culture solution
由图1可知,乳酸菌和酵母菌在共培养下,生长情况较单独培养时有明显差异,该研究结果同洪家丽等[17-18]的研究结果一致。在单乳酸菌体系的生长曲线结果中,Lp生长较Ln更快,26 h后逐渐进入平台期,OD600nm值不再有明显的变化。乳酸菌和酵母菌混合体系相较于单酵母菌Ke体系延迟了4~6 h进入平稳期。且乳酸菌和酵母的混合体系的生长速率最快,在8 h就进入对数期。其中,3种混菌体系的吸光度值普遍比单菌体系的吸光度值高,表明乳酸菌Lp、Ln和酵母Ke共培养时存在互作关系,对两类菌的生长均有促进作用。
2.2 单菌和混菌接种条件下萝卜泡菜发酵过程中微生物数量变化
单菌和混菌发酵制作萝卜泡菜过程中微生物数量变化情况结果见图2。
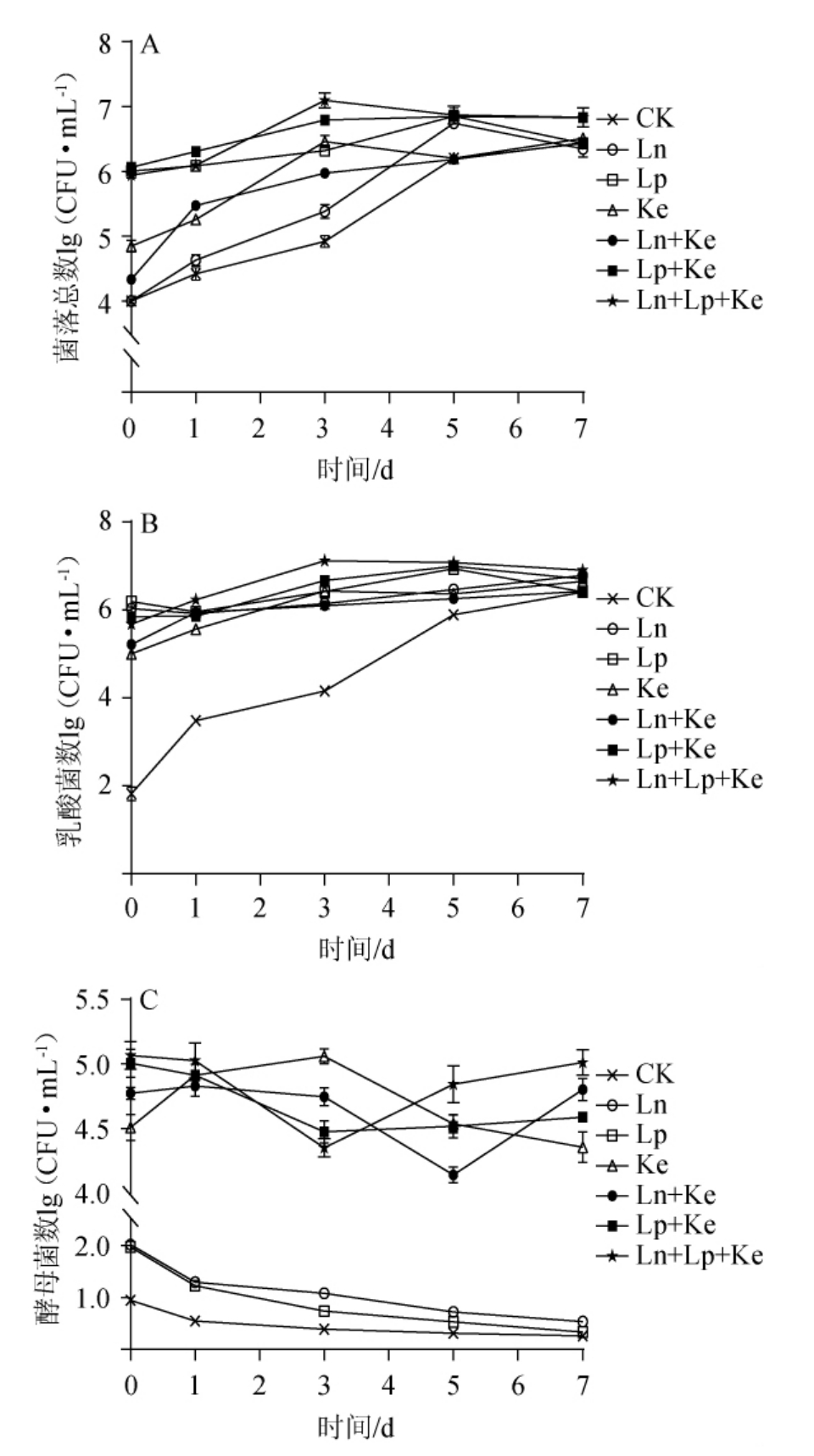
图2 单菌和混菌发酵萝卜泡菜过程中微生物变化情况
Fig. 2 Changes of microorganisms in radish Paocai fermented by single and mixed strains during fermentation process
由图2A和B可知,单菌组和混菌组在萝卜泡菜发酵过程中细菌和乳酸菌数量随着发酵时间的增加差异逐渐减小。发酵第7天时,Lp+Ln+Ke组的乳酸菌数量最高,其次是Ke单菌组,并且Lp+Ke组的乳酸菌数量比Lp单菌组的乳酸菌数量高,同时,Lp+Ln+Ke组和Lp+Ke组发酵过程中乳酸菌的数量均高于乳酸菌单菌发酵萝卜泡菜中的乳酸菌数量,可以得出乳酸菌Lp与Ln和酵母菌Ke的混合发酵有利于促进发酵体系中乳酸菌的生长。这可能是由于酵母菌代谢产生的CO2、氨基酸和维生素等物质能刺激乳酸菌的生长[19]。
由图2C可知,乳酸菌单菌组和CK组的酵母菌数量一直呈下降趋势,且在整个发酵过程中均与接种酵母组的萝卜泡菜中酵母菌数量存在显著性差异(P<0.05)。此外,混菌接种与酵母菌单菌接种发酵体系之间的酵母菌数量在发酵第3天也存在显著性差异(P<0.05),且发酵第7天时,混菌接种萝卜泡菜组中的酵母菌数量较酵母菌单菌接种组更高,表明乳酸菌Ln和Lp对酵母菌Ke的生长起到一定促进作用。研究表明,乳酸菌代谢产生的乳酸过多会抑制酵母生长,但适量的乳酸能螯合阳离子,减轻体系中阳离子对酵母菌细胞的影响[20-21]。
2.3 单菌和混菌接种条件下萝卜泡菜发酵过程中还原糖含量变化
还原糖是泡菜中的微生物的主要碳源物质,单菌和混菌发酵萝卜泡菜过程中的还原糖含量变化见图3。
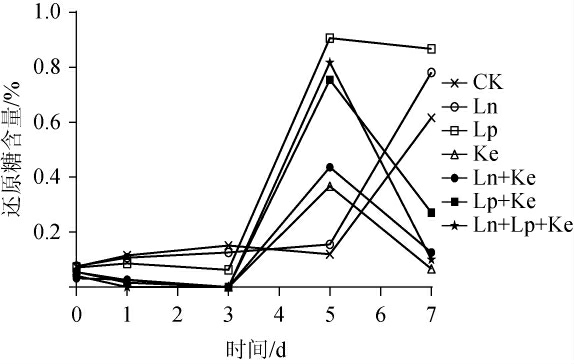
图3 单菌和混菌发酵萝卜泡菜过程中还原糖变化情况
Fig.3 Changes of reducing sugar contents in radish Paocai fermented by single and mixed strains during fermentation process
由图3可知,Lp、Ke组和其他混菌组发酵萝卜泡菜在发酵周期内还原糖含量都呈现先增加后减少的趋势。而Ln和CK组还原糖含量在发酵周期中的变化不同于其它组别,在0~5 d无明显变化,5~7 d呈增加趋势,表明CK组和Ln组中的微生物对还原糖的消耗速度小于红皮萝卜中还原糖的溶出速度,此现象和Ln的生长速率有关(见图1)。Lp组在3~5 d过程中还原糖的增加速度高于其他组,此现象结合Lp的生长曲线和产酸情况可以说明Lp在萝卜泡菜发酵体系中3~5 d时生长较快,期间代谢产物如乳酸、纤维素酶积累量增加,对植物细胞壁破坏更快,植物中的还原糖溶出速度也更快[22]。但乳酸菌相较于酵母菌对还原糖的利用更慢,5~7 d还原糖的降低速度明显含有酵母Ke组的要更快,且发酵第7天时Lp+Ln+Ke组、Ln+Ke组和Ke组的还原糖基本消耗殆,与CK组、Ln组和Lp组存在显著性差异(P<0.05)。相比于单菌发酵,混合菌发酵萝卜泡菜消耗还原糖速率更快,表明混菌发酵更能提高萝卜泡菜的发酵速率。
2.4 单菌和混菌接种条件下萝卜泡菜发酵过程中pH和总酸变化
pH和总酸反映的是泡菜发酵过程中的产酸情况和乳酸菌的产酸能力,单菌和混菌发酵萝卜泡菜过程中pH和总酸(以乳酸计)含量的变化情况见图4。

图4 单菌和混菌发酵萝卜泡菜过程中pH(A)和总酸(B)变化情况
Fig. 4 Changes of pH (A) and total acid (B) in radish Paocai fermented by single and mixed strains during fermentation process
由图4A可知,各处理组下萝卜泡菜的pH值均随着发酵的进行而逐渐降低。其中Lp+Ln+Ke组在7个处理组中表现出了最快的产酸进程,发酵3 d后pH降至4.50以下,发酵第7天时萝卜泡菜产品的pH为3.53,表现出了较好的发酵产酸效果。由图4B可知,7个组的萝卜泡菜在整个发酵周期中的总酸含量都呈逐渐上升的趋势,与pH的变化趋势相符。在发酵3 d后,总酸的增加趋势表现出了差异,其中含有Lp的发酵组总酸含量普遍较高,说明植物乳杆菌为发酵萝卜泡菜中主要的产酸菌之一。同时,三个混菌组在发酵第7天时的总酸含量普遍高于单菌组及CK组,其中产酸效果最好的体系是Lp+Ln+Ke混菌体系,在第7天时总酸含量达0.31 mL/100 mL,达到较佳的即食效果[23]。结果说明,两菌、三菌混合发酵可以协同产酸,提高了萝卜泡菜的发酵进程。
2.5 单菌和混菌接种条件下萝卜泡菜发酵过程中亚硝酸盐含量变化
亚硝酸盐是泡菜中的安全指标之一,单菌和混菌发酵萝卜泡菜过程中亚硝酸盐含量的变化情况见图5。由图5可知,CK组在发酵第3天出现亚硝峰含量高达12.34 mg/kg,虽低于国家对酱腌菜中亚硝酸盐的限量要求(不超过20 mg/kg),但显著高于其他组(P<0.05)。Ln+Ke组和Lp+Ke组在发酵第1天出现亚硝峰,含量略高于其余单菌组和三菌混合组,随后与其余接菌组的亚硝酸盐含量接近,且在发酵第5天之后所有接菌组的亚硝酸盐含量基本都接近于0。乳酸菌具有降解亚硝酸盐的基因[24],因此接种发酵可在5 d后可获得几乎不含亚硝酸盐的萝卜泡菜。

图5 单菌和混菌发酵萝卜泡菜过程中亚硝酸盐含量变化情况
Fig. 5 Changes of nitrite contents in radish Paocai fermented by single and mixed strains during fermentation process
2.6 单菌和混菌接种条件下萝卜泡菜发酵终点挥发性风味物质组成
挥发性风味物质是泡菜风味的重要组成部分,为了探究乳酸菌与酵母互作发酵对萝卜泡菜挥发性风味物质的影响,利用HS-SPME-GC-MS对7组处理发酵第7天的萝卜泡菜挥发性风味物质进行检测,共检测到包括酯类、醇类、醚类、酸类、醛酮类等109种风味物质。以化合物含量指标为变量X,不同发酵组样本作为分类变量Y,对发酵第7天的7组样品进行OPLS-DA。结合化合物在图中的分布差异以及HCA能够获得不同组中的差异代谢物[25],结果见图6。
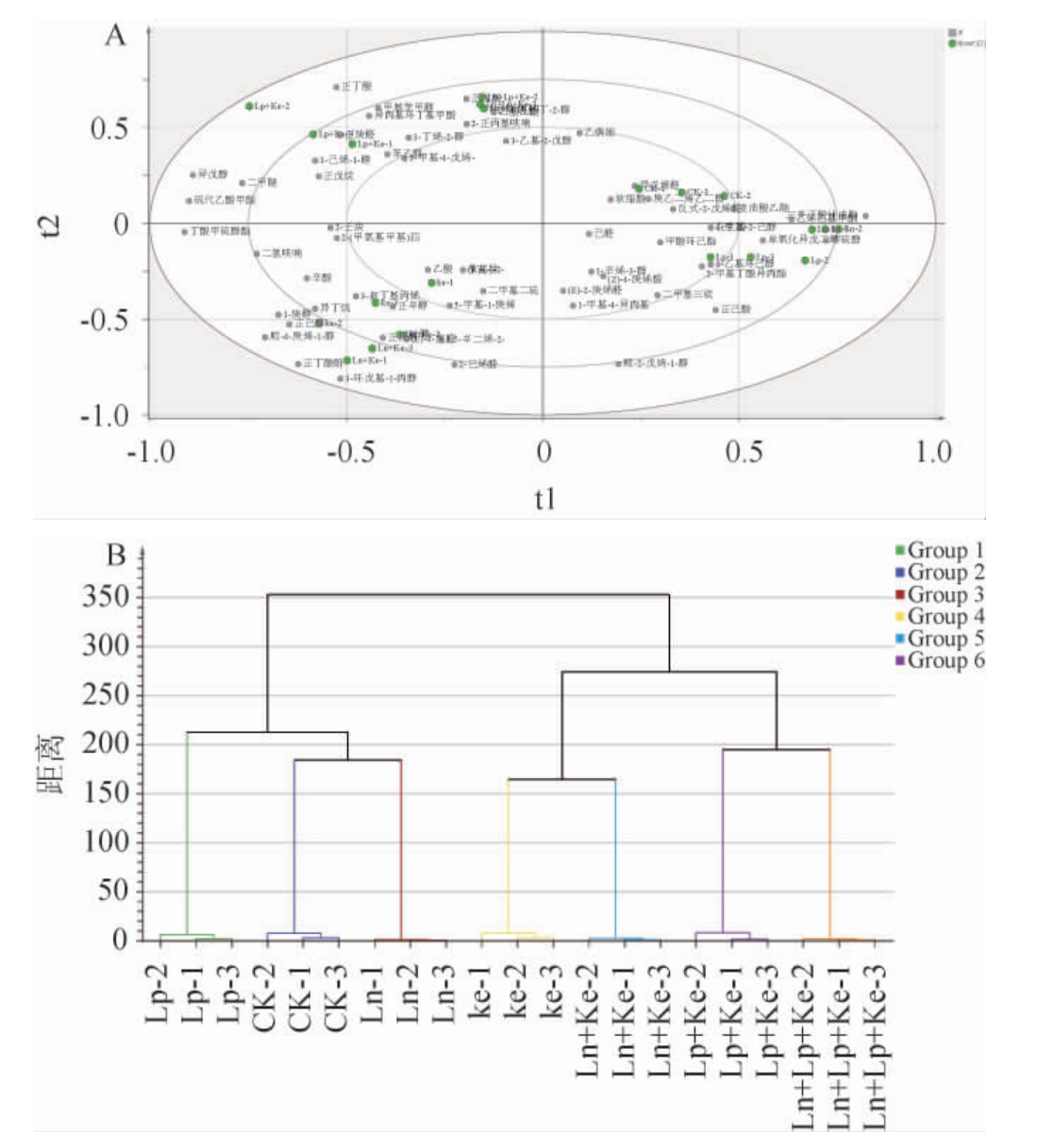
图6 单菌和混菌发酵萝卜泡菜第7天的挥发性风味物质正交偏最小二乘法判别分析(A)和层次聚类分析(B)
Fig. 6 Orthogonal partial least squares-discriminant analysis (A) and hierarchical clustering (B) of volatile flavor compounds of radish Paocai fermented by single and mixed strains on the 7th day
模型中R2和Q2分别代表模型可解释的变量和可预测度,可对模型的优劣进行判别,理论上拟合优度(R2)、预测优度(Q2)数值越接近1,说明模型越好,越低说明模型的拟合准确性越差。通常情况下,R2、Q2高于0.5较好,高于0.4可接受,Q2在Y轴的截距小于0.05,可认为模型没有出现过拟合。
由图6A可知,模型对X轴的解释度(R2X)为0.734、模型对Y轴的解释度(R2Y)为0.97、Q2(cum)为0.804,置换检验结果显示R2=0.508,Q2=-0.764,表明该模型稳定可靠[25]。图6A中的CK组和单乳酸菌组的风味物质主要集中在醛酮类物质和烃类物质周围,其中三芥子酸甘油酯和二甲基三硫为十字花科蔬菜(如红皮萝卜)的特征挥发性风味物质,表明发酵进程缓慢,发酵不完全[26]。单乳酸菌组与含有酵母菌的发酵组的风味轮廓则表现出明显差异,含有酵母菌的发酵组风味物质种类更加丰富。且图6A和图6B中的Ke组和Ln+Ke组均与第三主成分呈正相关且聚类在第二分支,风味成分结构更相似,周围含有具有强烈芳香气味的正辛醇和具有水果香味的庚醛,这可能与酵母菌发酵代谢、蛋白质分解及氨基酸的代谢有关[27],但依旧含有红皮萝卜本身的辛辣刺激风味物质,如二甲基二硫等[26]。Lp+Ke组和Lp+Ln+Ke组的挥发性风味物质在HCA中分离于其他组,物质主要集合在第二象限,有3-己烯-1-醇、异戊醇、苯乙醇、正丁酸、硫代乙酸甲酯、丁酸甲硫醇酯等,这可能由于Lp代谢更快,与Ke互作会促进酸和醇类物质生成酯类物质,从而提升萝卜泡菜的复合香气。值得注意的是乙酸乙酯仅在Lp+Ln+Ke组中检测到,表明多乳酸菌与酵母菌互作更有利于酯类挥发性风味物质的产生。由图6B可知,CK组、Ln组和Lp组在HCA中都在第一分支,挥发性成分特征趋于一致。研究表明相较于单菌种,多菌种微生物群落具有更广泛的代谢灵活性,菌种间的沟通和交流增强能更有效地催化许多复杂代谢过程,对待外界环境的扰动具有更高的抵抗性[28-29]。
3 结论
本实验采用盐水发酵萝卜作为对照组,分别接种Lp、Ln和Ke单菌,Lp+Ke、Ln+Ke、Lp+Ln+Ke混菌作为菌种发酵萝卜泡菜,并在发酵过程中测定不同接种发酵方式下萝卜泡菜的微生物数量、理化指标以及发酵终点的挥发性风味物质。单菌和混菌接种发酵萝卜泡菜在发酵过程中,经不同微生物群落的代谢作用,理化指标的变化存在显著差异,主要体现在混菌发酵的糖代谢速率和产酸速率更快。在挥发性风味物质方面,混菌发酵可以丰富萝卜泡菜的风味化合物组成,其中乙酸乙酯仅在Lp+Ln+Ke组中检测到。多乳酸菌与酵母菌互作发酵,增加了挥发性风味物质的种类,可以提高萝卜泡菜的复合香。酵母和不同的乳酸菌混合发酵表现出的理化性质以及风味代谢上均有差异。OPLS-DA和HCA结果表明,可以将不同菌种发酵的泡菜进行有效区分。因此,酵母菌和多乳酸菌互作体系具有发酵产酸速度快、风味成分更丰富的优势,为提升泡菜品质提供一定的理论依据。
[1]曾维友,周於强,池浩.泡菜中乳酸菌的分离鉴定及抗性筛选[J].中国酿造,2021,40(10):163-167.
[2] YANG Q L, YAO H L, LIU S P, et al. Interaction and application of molds and yeasts in Chinese fermented foods[J].Front Microbiol,2022,12:doi.org/10.3389/fmicb.2021.664850.
[3] HUANG Y L, GE L H, LAI H M, et al. Seasonal alteration of environmental condition-driven shift in microbiota composition,physicochemical attributes and organic compound profiles in aged Paocai brine during intermittent back-slopping fermentation[J].Food Biosci,2022,50:102111.
[4]BALDINI F,HEINKEN A,HEIRENDT L,et al.The Microbiome Modeling Toolbox:from microbial interactions to personalized microbial communities[J].Bioinformatics,2019,35(13):2332-2334.
[5]BREXÓ R P,SANT'ANA A D S,et al.Microbial interactions during sugar cane must fermentation for bioethanol production: does quorum sensing play a role?[J].Crit Rev Biotechnol,2018,38(2):231-244.
[6] MALIGOY M, MERCADE M, COCAIGN-BOUSQUET M, et al. Transcriptome analysis of Lactococcus lactis in coculture with Saccharomyces cerevisiae[J].Appl Environ Microbiol,2008,74(2):485-494.
[7]张国华,王伟,涂建,等.基于宏转录组学技术解析传统酸面团中微生物代谢机理[J].中国粮油学报,2019,34(11):10-16.
[8] MENDES F, SIEUWERTS S, DE HULSTER E, et al. Transcriptomebased characterization of interactions between Saccharomyces cerevisiae and Lactobacillus delbrueckii subsp.bulgaricus in lactose-grown chemostat cocultures[J].Appl Environ Microbiol,2013,79(19):5949-5961.
[9]廖一漠,敖晓琳,康海燕,等.传统发酵食品中乳酸菌与酵母菌互作机制研究进展[J].食品与发酵工业,2023,49(3):340-346.
[10]PONOMAROVA O,GABRIELLI N,SÉVIN D C,et al.Yeast creates a niche for symbiotic lactic acid bacteria through nitrogen overflow[J].Cell Syst,2017,5(4):345-357.
[11]WIDDER S,ALLEN R J,PFEIFFER T,et al.Challenges in microbial ecology: building predictive understanding of community function and dynamics[J].ISME J,2016,10(11):2557-2568.
[12]张小龙,王嘉瑞,李青卓,等.合成微生物群落及在发酵食品中应用研究进展[J].中国酿造,2021,40(3):17-21.
[13]GE L H,LAI H M,HUANG Y L,et al.Comparative evaluation of package types in alleviating textural softening and package-swelling of Paocai during storage:Insight into microbial invasion,cell wall pectinolysis and alteration in sugar and organic acid profiles[J]. Food Chem,2021,365:130489.
[14]YANG X Z,HU W Z,JIANG A L,et al.Effect of salt concentration on quality of Chinese northeast sauerkraut fermented by Leuconostoc mesenteroides and Lactobacillus plantarum[J].Food Bioscience,2019,30:100421.
[15] SHAO Y J, LIN A H. Improvement in the quantification of reducing sugars by miniaturizing the Somogyi-Nelson assay using a microtiter plate[J].Food Chem,2018,240:898-903.
[16]侯新磊,赵楠,葛黎红,等.低温等离子体对低盐泡菜生花腐败的抑制及贮藏期品质的影响[J].食品科学,2022,43(21):282-290.
[17]洪家丽,陈敏,周文斌,等.乳酸菌对红曲黄酒酿造过程酵母菌生长及风味物质形成的影响[J].中国食品学报,2020,20(1):91-100.
[18]张文娟,陈安特,韩宇琴,等.酿酒酵母对萝卜泡菜发酵的影响[J].食品与发酵工业,2017,43(8):134-137.
[19]顾悦.环境胁迫及酵母菌对乳酸菌LuxS/AI-2群体感应系统的影响[D].呼和浩特:内蒙古农业大学,2017.
[20]李院,魏新元,王静,等.抑制青霉菌乳酸菌的分离、鉴定及抑菌物质分析[J].食品科学,2015,36(21):150-155.
[21]王小标,武运,王璐,等.酸马乳发酵过程中乳酸菌与酵母菌生长的相互影响[J].食品科学,2015,36(11):125-129.
[22]赵楠,葛黎红,郭壮,等.泡辣椒发酵过程中质构劣化规律及其影响因素研究[J].中国酿造,2020,39(1):119-123.
[23]陈功,唐垚,张其圣,等.泡菜浅发酵与冷加工的研究及应用[J].食品与发酵科技,2022,58(2):1-8.
[24]黄燕燕,刘冬梅,邝嘉华,等.植物乳杆菌DMDL 9010降解亚硝酸盐特性及其相关基因挖掘[J].现代食品科技,2021,37(11):14-24.
[25]黄玉立,赵楠,葛黎红,等.不同发酵温度下低盐泡萝卜中氨基甲酸乙酯含量差异成因分析[J].食品与发酵工业,2023,49(11):111-118.
[26] MEI Y, GE L H, LAI H M, et al. Decoding the evolution of aromatic volatile compounds and Key odorants in Suancai (a Chinese traditional fermented vegetable)during fermentation using stir bar sorptive extraction-gas chromatography-olfactometry-mass spectrometry[J].LWT-Food Sci Technol,2023,178:114611.
[27]SINGRACHA P,NIAMSIRI N,VISESSANGUAN W,et al.Application of lactic acid bacteria and yeasts as starter cultures for reduced-salt soy sauce (moromi) fermentation[J]. LWT-Food Sci Technol, 2017, 78:181-188.
[28] HONJO H, IWASAKI K, SOMA Y, et al. Synthetic microbial consortium with specific roles designated by genetic circuits for cooperative chemical production[J].Metab Eng,2019,55:268-275.
[29] STENUIT B, AGATHO S N, et al. Deciphering microbial community robustness through synthetic ecology and molecular systems synecology[J].Curr Opin Biotechnol,2015,33:305-317.