内生酵母是定植于健康植物中且与宿主植物形成互惠互利关系的一种独特内生微生物类群[1],宿主植物为内生酵母提供营养和稳定的环境条件,而内生酵母通过分泌植物激素,如吲哚-3-乙酸(indole-3-acetic acid,IAA)、吲哚-3-丙酮酸(indole-3-pyruvic acid,IPYA)等次生代谢产物,提高植物抵抗不利条件的能力,促进植物生长,维持植株健康状态[2],内生酵母也能通过乙烯调控机制抑制植物对金属的吸收,保护植物免受金属毒性[3]。相对于同一植物的内生细菌,内生酵母菌数量和多样性均较少,但因具有独特的分泌抑制物如木糖和乙醇等功能[4],且对植物化学物质的耐受性更强[5],内生酵母菌具有特殊研究价值。目前,已有关于陈皮[6]、松萝[7]、水稻和玉米[8]等植物内生酵母的研究,其多样性分析通常采用传统平板培养法和高通量测序技术检测,高通量测序技术因可直接从植物基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)层面快速分析内生酵母多样性和群落结构,被广泛应用于微生物多个领域。
高粱(Sorghum bicolor(L.)Moench)是中国主要杂粮作物之一,产量仅次于玉米、小麦、水稻和大麦。因其独有的抗旱、耐涝、耐盐碱和耐贫瘠等特性,在恶劣环境下也能正常生长,是食品配料、饲料和酿酒业原料的重要来源[9]。中国高梁主要分布于东北(辽宁、吉林和黑龙江)、华北(山西、内蒙古和河南)和西南(四川、贵州和重庆)等3个主产区,其中西南地区以糯性高粱为主[10]。糯红高梁属国家地理标志的保护农产品,作为酿酒原料在酿酒逆反应过程中表现出易糊化、易发酵的优势,这一酿造原料品质的形成可能与内生酵母组成有密不可分的关系[11]。宜宾酿酒专用糯红高粱包括杂交种金糯粱1号和地方种青壳洋等。有研究显示,金糯粱1号具有植株矮、产量高、抗病力强的特点,主要经济现状优于青壳洋[12]。现仅有通过可培养法从2个品种中分离纯化内生酵母,并筛选具有产蛋白酶功能菌株的报道[13],而关于采用高通量技术分析花期糯红高粱内生酵母的研究鲜见报道。
本研究采用Illumina MiSeq高通量测序技术对不同品种糯红高粱(杂交种金糯粱1号和地方种青壳洋)花期不同器官(根、茎、叶、花)内生酵母菌群落多样性进行分析,为探究高粱与内生酵母共生关系奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
杂交种金糯粱1号(FA)和地方种青壳洋(FB):宜宾市翠屏区农牧局农技推广中心。
1.1.2 试剂
E.Z.N.A.@Soil DNA Kit试剂盒:美国OMEGA公司;引物NL1F(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL2R(5'-CTTGTTCGCTATCGGTCTC-3'):上海美吉生物医药科技有限公司;体积分数75%乙醇:海氏海诺乳胶(青岛)有限公司;次氯酸钠(99%):广东博锐化工有限公司;琼脂糖(生化试剂):法国Biowest公司。其他试剂均为国产分析纯。
1.2 仪器与设备
DPH-9052微生物培养箱:上海一恒科学仪器有限公司;RS489恒温摇床:北京东联哈尔仪器有限公司;BSA2202S电子天平:北京赛多利斯科学仪器有限公司;GeneAmp 9700聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;NanoDrop 2000超微量分光光度计:美国赛默飞公司;Illumina MiSeq高通量测序平台:美国Illumina公司。
1.3 方法
1.3.1 糯红高粱组织无菌处理
待高粱进入花期时,采集并标记2个品种健康的根(FR)、茎(FS)、叶(FL)与花(FF),各样本3个重复。将样本装入无菌袋内,冷链带回实验室用于后续试验。根表面依次用流水冲洗60 min,无菌水冲洗2次,体积分数75%乙醇处理1 min,无菌水冲洗1次,5%NaClO处理3 min,体积分数75%乙醇处理1 min,晾干。茎表面依次用流水冲洗60 min,无菌水冲洗2次,体积分数75%乙醇处理0.5 min,无菌水冲洗1次,4%NaClO处理4 min,体积分数75%乙醇处理20 s,晾干。叶和花表面依次用流水冲洗60 min,无菌水冲洗2次,体积分数75%乙醇处理20 s,无菌水处理1次,3%NaClO处理3 min,体积分数75%乙醇处理20 s,晾干。
1.3.2 样本DNA提取、PCR扩增与Illumina MiSeq高通量测序
采用E.Z.N.A.@Soil DNA Kit试剂盒提取不同品种糯红高粱各器官基因组DNA,利用Nanodrop 2000检测DNA浓度和纯度;使用1%琼脂糖凝胶电泳测定DNA质量,合格的DNA用于PCR扩增。以提取的基因组DNA为模板,使用引物NL1F和NL2R对内生酵母菌的26S rDNA D1/D2区基因进行PCR扩增,PCR扩增程序:95 ℃预变性3 min,30次循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min。PCR扩增体系(20 μL):5×FastPfu Buffer 4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)2 μL,5 μmol/L正反引物各0.8 μL,FastPfu Polymerase 0.4 μL,牛血清白蛋白(bovine serum albumin,BSA)0.2 μL,模板DNA 10 ng,双蒸水(ddH2O)补至20 μL。2%琼脂糖凝胶电泳检测PCR扩增产物,利用Illumina MiSeq PE300平台对扩增产物进行双端测序。
1.3.3 数据处理与统计分析
从Illumina MiseqTM测序平台抽取得到各样本的有效数据,使用Usearch去除预处理后的非放大区域序列,修正序列错误。同时,利用Blastn比较去除嵌合体序列和数据库中代表序列,将低于阈值的比较结果作为目标区域外序列。根据序列间距离,借助Uparse将所有样本序列进行聚类,按照序列间97%相似性将序列分割成各个操作分类单元(operational taxonomic unit,OTU),展开OTU分析。用Qiime软件对OTU中出现频数最高的序列进行物种注释分析[14],并分别在门、纲、目、科、属分类水平统计各样本群落组成,基于物种注释结果绘制群落柱形图和韦恩图。Alpha多样性分析包括香农(Shannon)指数、辛普森(Simpson)指数、超1(Chao1)指数、ACE指数、Sob分析指数,其中Shannon指数、Simpson指数反映样本中内生酵母群落多样性,Shannon值越大表明群落多样性越高,而Simpson指数值越大表明群落多样性越低;ACE、Chao1和Sob指数反映样本内生酵母群落丰富度[15]。基于物种注释结果,使用非度量多维尺度(non-metric multidimensional scaling,NMDS)进行Beta多样性分析,主要评估糯红高粱不同样本在物种组成上的相似性和差异性[16]。采用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)寻找糯红高梁内生酵母菌中的差异菌。利用FUNGuild(http://funguild.org)数据库对内生酵母菌群功能进行注释,置信度选择很可能(probable)和极可能(highly probable)。利用Microsoft Excel 2016进行数据整理和分析,运用Origin 2018软件作图。
2 结果与分析
2.1 序列深度分析与数据质控
通过高通量测序分析,从不同样本中共获得407 060条高质量序列,各样本序列数范围为10 806~25 218条,平均碱基长度为269 bp。
2.2 糯红高粱内生酵母菌群OTU分析
按照97%相似水平对序列进行OTU划分和注释,结果见表1。由表1可知,糯红高粱样本中共注释到内生酵母菌8门182属337 OTUs,其中金糯粱1号共鉴定到7门104属173 OTUs;青壳洋共鉴定到8门176属315 OTUs。按照不同器官分类,根部共鉴定获得内生酵母7门105属200 OTUs;茎部鉴定获得内生酵母5门96属130 OTUs;叶部鉴定获得内生酵母4门107属163 OTUs;花部鉴定获得内生酵母5门50属64 OTUs。因此,地方种青壳洋和糯红高粱根部中内生酵母群落组成更为丰富。
表1 糯红高粱花期不同品种及器官样本内生酵母菌群分类结果
Table 1 Taxonomic results of endophytic yeast in different varieties and organs of waxy sorghum at flowering period
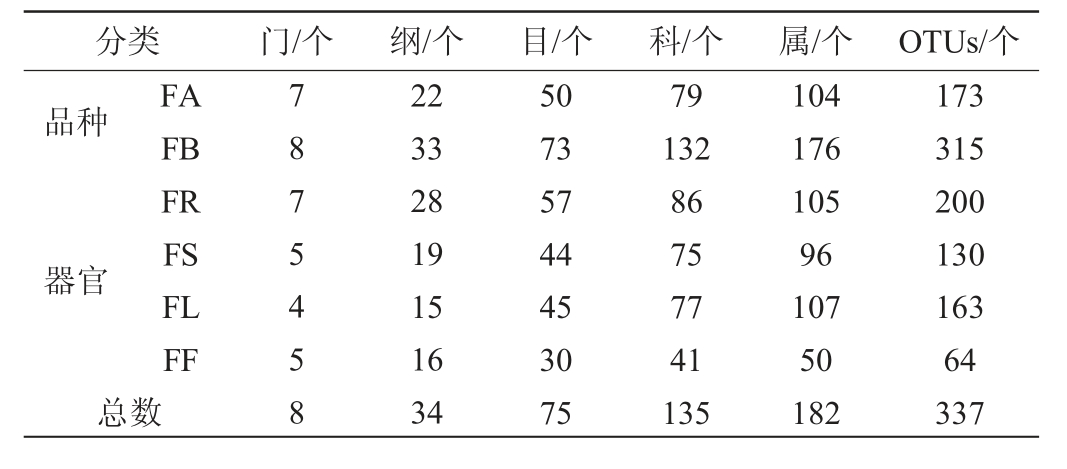
分类 门/个 纲/个 目/个 科/个 属/个 OTUs/个品种器官总FA FB FR FS FL FF数7875458 22 33 28 19 15 16 34 50 73 57 44 45 30 75 79 132 86 75 77 41 135 104 176 105 96 107 50 182 173 315 200 130 163 64 337
为分析样本共有和特有OTU数目,绘制OTU Venn图,结果见图1。
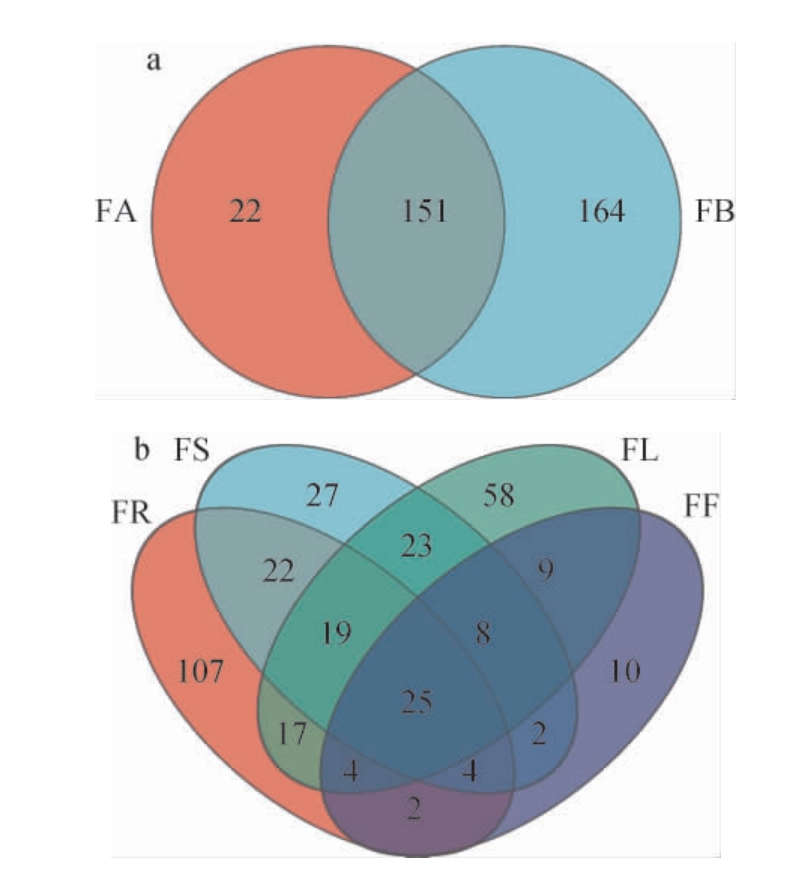
图1 糯红高粱花期不同品种(a)及器官(b)样本内生酵母菌OTU分布韦恩图
Fig. 1 Venn diagram of endophytic yeast OTU distribution in different varieties (a) and organs (b) of waxy sorghum at flowering period
由图1可知,按照不同品种分类,金糯粱1号和青壳洋共有OTUs数为151个,特有OTUs数分别为22个和164个。按照不同器官分类,根、茎、叶和花共有OTUs数为25个,特有OTUs数分别为107、27、58和10个。结果表明,糯红高粱花期不同品种及不同器官内生酵母群落结果均具有一定相似性,且也表现出特异性,特异性以青壳洋高于金糯粱1号,以地下器官(根)高于地上器官(茎、叶、花)。
2.3 糯红高粱内生酵母菌群多样性分析
2.3.1 Alpha多样性分析
糯红高粱花期不同品种及不同器官样本内生酵母菌群的Alpha多样性分析结果见表2。由表2可知,按照不同品种分类,不同品种糯红高粱内生酵母菌群的Shannon指数、Simpson指数、Chao1指数和Sob指数均存在显著性差异(P<0.05),且青壳洋内生酵母菌群的Shannon指数、Chao1指数和Sob指数显著更高(P<0.05),Simpson指数显著更低(P<0.05),说明青壳洋内生酵母菌群落多样性和丰富度均显著性高于金糯粱1号。根据不同器官分类,糯红高粱不同器官内生酵母菌群的Shannon指数、Simpson指数和ACE指数均无显著性差异(P>0.05),仅有Chao1和Sob指数存在显著性差异(P<0.05),且叶部内生酵母菌群落显著高于茎和花(P<0.05),与根部无显著差异(P>0.05),说明叶部内生酵母菌群的丰富度显著性高于茎和花。结果表明,不同品种糯红高粱的内生酵母群落多样性和丰富度存在差异,且青壳洋内生酵母菌群的多样性和丰富度均最高;糯红高粱花期不同器官内生酵母菌群丰富度存在差异,且叶部内生酵母菌群的丰富度最高,其次为根部和茎部,花部最低。
表2 糯红高粱花期不同品种及器官样本内生酵母菌群的Alpha多样性分析结果
Table 2 Alpha diversity analysis results of endophytic yeast in different varieties and organs of waxy sorghum at flowering period
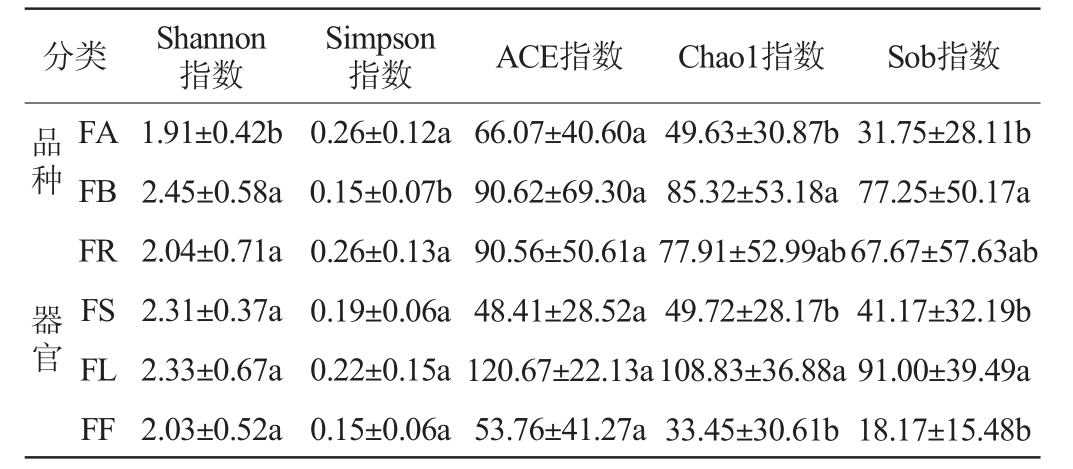
注:同列数据肩标不同小写字母表示不同品种或不同器官样本内生酵母菌群多样性指数差异显著(P<0.05)。
分类Shannon指数Simpson指数 ACE指数 Chao1指数 Sob指数品种 器官FA FB FR FS FL FF 1.91±0.42b 2.45±0.58a 2.04±0.71a 2.31±0.37a 2.33±0.67a 2.03±0.52a 0.26±0.12a 0.15±0.07b 0.26±0.13a 0.19±0.06a 0.22±0.15a 0.15±0.06a 66.07±40.60a 90.62±69.30a 90.56±50.61a 48.41±28.52a 120.67±22.13a 53.76±41.27a 49.63±30.87b 85.32±53.18a 77.91±52.99ab 49.72±28.17b 108.83±36.88a 33.45±30.61b 31.75±28.11b 77.25±50.17a 67.67±57.63ab 41.17±32.19b 91.00±39.49a 18.17±15.48b
2.3.2 Beta多样性分析
糯红高粱花期不同品种及不同器官样本内生酵母菌群的Beta多样性分析结果见图2。由图2可知,糯红高粱花期不同品种间内生酵母菌OTU(R=0.135 6,P=0.044)及不同器官间内生酵母菌OTU(R=0.723 9,P=0.001)均存在显著性差异(P<0.05)。通常认为Stress<0.1时,不同样本具有一个好的排序,糯红高粱不同分组Stress均为0.09,说明品种和器官分组是一个好的排序。
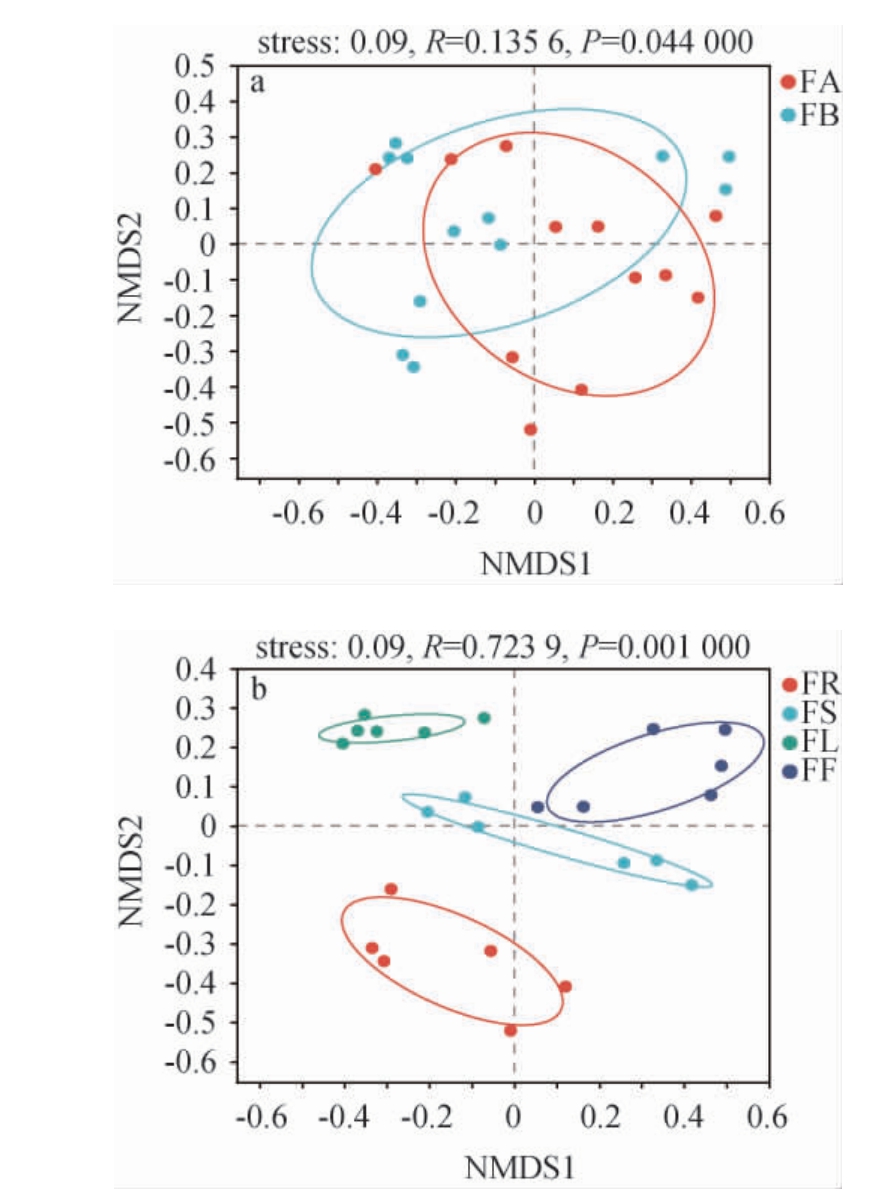
图2 糯红高粱花期不同品种(a)及器官(b)样本内生酵母菌群Beta多样性分析结果
Fig. 2 Beta diversity analysis results of endophytic yeast in different varieties (a) and organs (b) of waxy sorghum at flowering period
2.4 糯红高粱内生酵母群落结构分析
基于门水平糯红高粱内生酵母菌群结构见图3,将相对丰度最大的门类和属类定义为优势菌门和优势菌属。由图3可知,在门分类水平上,按照不同品种分类,金糯粱1号中内生酵母菌群主要分布在子囊菌门(Ascomycota)(90.99%)、未知真菌门(Unclassified Fungi)(5.42%)、担子菌门(Basidiomycota)(2.47%)、Evosea(1.10%);青壳洋中内生酵母菌群主要分布在子囊菌门(55.03%)、担子菌门(21.79%)、未知真菌门(1.01%)。按照不同器官分类,糯红高粱根部相对丰度最高的门类为未知真菌门(49.63%);茎部和叶部相对丰度最高的门类均为子囊菌门,相对丰度分别为66.38%和80.13%;花部担子菌门(30.47%)的相对丰度最高,且Evosea的相对丰度高于其他器官。
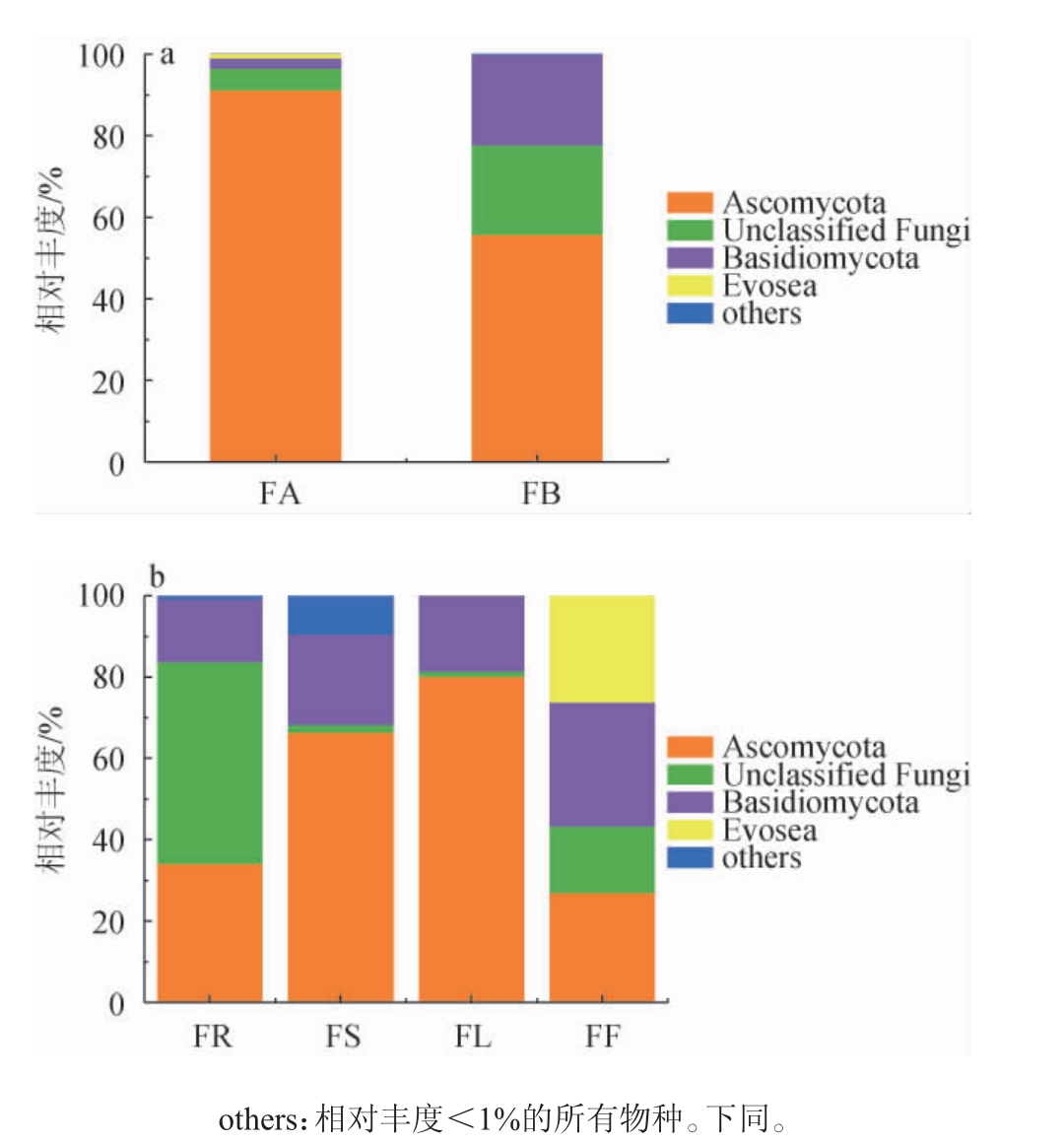
图3 基于门水平糯红高粱花期不同品种(a)和器官(b)样本内生酵母菌群落结构分析结果
Fig. 3 Community structure analysis results of endophytic yeasts in different varieties (a) and organs (b) of waxy sorghum based on phylum level at flowering period
基于属水平糯红高粱内生酵母菌群结构见图4。由图4可知,在属分类水平上,按照不同品种分类,金糯粱1号中相对丰度>5%的酵母属为刺盾炱目未分类菌属(Unclassified Chaetothyriales)(41.50%)、Alatosessilispora(15.12%)、新茎点霉属(Neosetophoma)(6.37%)和未知真菌属(Unclassified Fungi)(5.42%);青壳洋中相对丰度>5%的酵母属为未知真菌属(21.84%)、刺盾炱目未分类菌属(9.58%)、镰刀菌属(Fusarium)(6.74%)、新茎点霉属(5.72%)和Alatosessilispora(5.24%)。2个品种共有内生酵母属为98个。按照不同器官分类,根部中相对丰度>5%的酵母属为未知真菌属(49.63%)、镰刀菌属(14.19%)和伞菌纲未分类菌属(Unclassified Agaricomycetes)(6.55%);茎部中相对丰度>5%的酵母属为枝氯霉属(Ramichloridium)(36.34%)、Papiliotrema(8.18%)、镰刀菌属(7.44%)和Phyllozyma(5.30%);叶部中相对丰度>5%的酵母属为刺盾炱目未分类菌属(27.67%)、Alatosessilispora(12.66%)、新茎点霉属(10.02%)、亚隔孢壳属(Didymella)(7.70%)、汉纳酵母属(Hannaella)(5.98%);花部中相对丰度>5%的酵母属为Didymium(19.40%)、未知真菌属(16.42%)、Pseudozyma(13.06%)、镰刀菌属(8.46%)、Microbotryozyma(7.84%)和煤绒菌属(Fuligo)(6.22%)。根、茎、叶、花共有内生酵母属24个,包括Pseudozyma、Golubevia、Phaeodothis、Kondoa、新茎点霉属、Symmetrospora、Papiliotrema、汉纳酵母属、Tilletiopsis等。结果表明,糯红高粱花期内生酵母的群落组成和相对丰度在品种和器官之间存在较大差异。

图4 基于属水平糯红高粱花期不同品种(a)和器官(b)样本内生酵母菌群落结构分析结果
Fig. 4 Community structure analysis results of endophytic yeasts in different varieties (a) and organs (b) of waxy sorghum based on genus level at flowering period
在门水平上,除未知真菌门外,金糯粱1号、青壳洋以及根、茎、叶和花器官样本中内生酵母主要归类于子囊菌门和担子菌门,这与现有部分关于内生酵母菌的研究类似[8,17],子囊菌门是最有可能与植物互惠共生的门类,可分解难降解性有机质,并参与养分循环[16]。隶属于子囊菌门和担子菌门的酵母菌可栖居在如冰川、森林、沼泽等极端环境以及维管束植物、果实和腐烂木材表面等自然环境中,具有耐寒、耐盐碱、耐高酸等特征[18],因此,对后期可培养法分离纯化并鉴定内生酵母菌株试验具有参考意义。在属水平上,不同品种和器官样本的优势菌属存在共性与差异,其中共有属类包括Neoosetophoma、枝氯霉属和汉纳酵母属等,研究表明Neoosetophoma产生的3种类萜代谢产物对乳腺癌、卵巢癌及间皮瘤有一定作用[19];本研究中枝氯霉属属于内生菌,有研究显示此属类也发现于外生真菌中,利于降解角质层并增加宿主的斜坡耐受性[20];汉纳酵母属具有清除活性氧、降解病原菌细胞壁、提高植物抗性和抗性物质的合成等作用,对苹果青霉病具有一定生物防治作用[21-22];本研究中Pseudozyma在糯红高粱花部中的相对丰度(13.06%)显著高于其他器官,该属类现已成为一种商业酵母,能分泌糖脂生物表面活性剂、角鲨烯、衣康酸等物质,其代谢物中分离纯化的α-D-甘露聚糖具有镇痛和抗炎活性,作为内生菌群参与促进植物健康生长过程[23]。不同品种和器官样本中内生酵母菌群表现出差异性,可能是因菌株在不同生境条件下具有不同的传播机制所致。如Papiliotrema仅出现在青壳洋中,研究表明,其可用于植物病原真菌的生物防治,有助于果实采前和采后的品质维护,且能改善菌根定殖、氮营养和植物生长[24],说明通过对青壳洋内生酵母的分离纯化获得该属,有利于功能优势菌的开发。本研究中仍有一些OTU序列在不同的分类水平上未被注释分类,表明糯红高粱中还蕴含有部分未知的内生酵母需深入研究。有研究表明,不同地理区域、不同栽培方式和不同生长年限等因素对内生菌的组成有显著影响[25],本研究2个品种均种植于同一区域且统一时间采收,后续将严格控制栽培措施和施肥方式,探讨糯红高梁中内生菌群的组成。
2.5 糯红高粱内生酵母菌群落差异性
通过LEfSe多级物种层级分析糯红高梁花期不同品种及器官样本中内生酵母菌中的差异菌,结果见图5。由图5可知,按照不同品种分类,在LDA阈值为2时,仅有青壳洋中具有起重要作用的内生酵母类群,包括担子菌门、酵母菌纲(Saccharomycetes)、酵母菌目(Saccharomycetales)、线黑粉酵母属(Filobasidium)等2门5纲9目12科12属。按照不同器官分类,未知真菌门、粪壳菌纲(Sordariomycetes)、肉座菌目(Hypocreales)等1门2纲3目3科4属是根中起重要作用的内生酵母菌类群;座囊菌纲(Dothideomycetes)、球腔菌目(Mycosphaerellales)、锥梗菌科(Dissoconiaceae)等1纲1目2科2属是茎中起重要作用的内生酵母菌类群;子囊菌门、刺盾炱目(Chaetothyriales)、汉纳酵母属等1门3纲8目15科20属是叶中起重要作用的内生酵母菌类群;花中起重要作用的内生酵母类群是担子菌门、黑粉菌纲(Ustilaginomycetes)和Pseudozyma等1门2纲4目3科4属。

图5 糯红高粱花期不同品种(a)及器官(b)样本内生酵母菌群差异LEfSe分析结果
Fig. 5 LEfSe analysis results of endophytic yeast microbial community difference in different varieties (a) and organs (b) of waxy sorghum at flowering period
2.6 糯红高粱内生酵母菌群功能差异分析
基于FUNGuild数据库解析糯红高粱2个品种和4个器官内生酵母菌的营养型和生态功能类别,选择“很可能”和“极可能”置信度作为分析对象,结果见表3。
表3 糯红高粱花期不同品种和器官样本内生酵母菌群功能结构分析结果
Table 3 Functional structure analysis results of endophytic yeast in different varieties and organs of waxy sorghum at flowering period
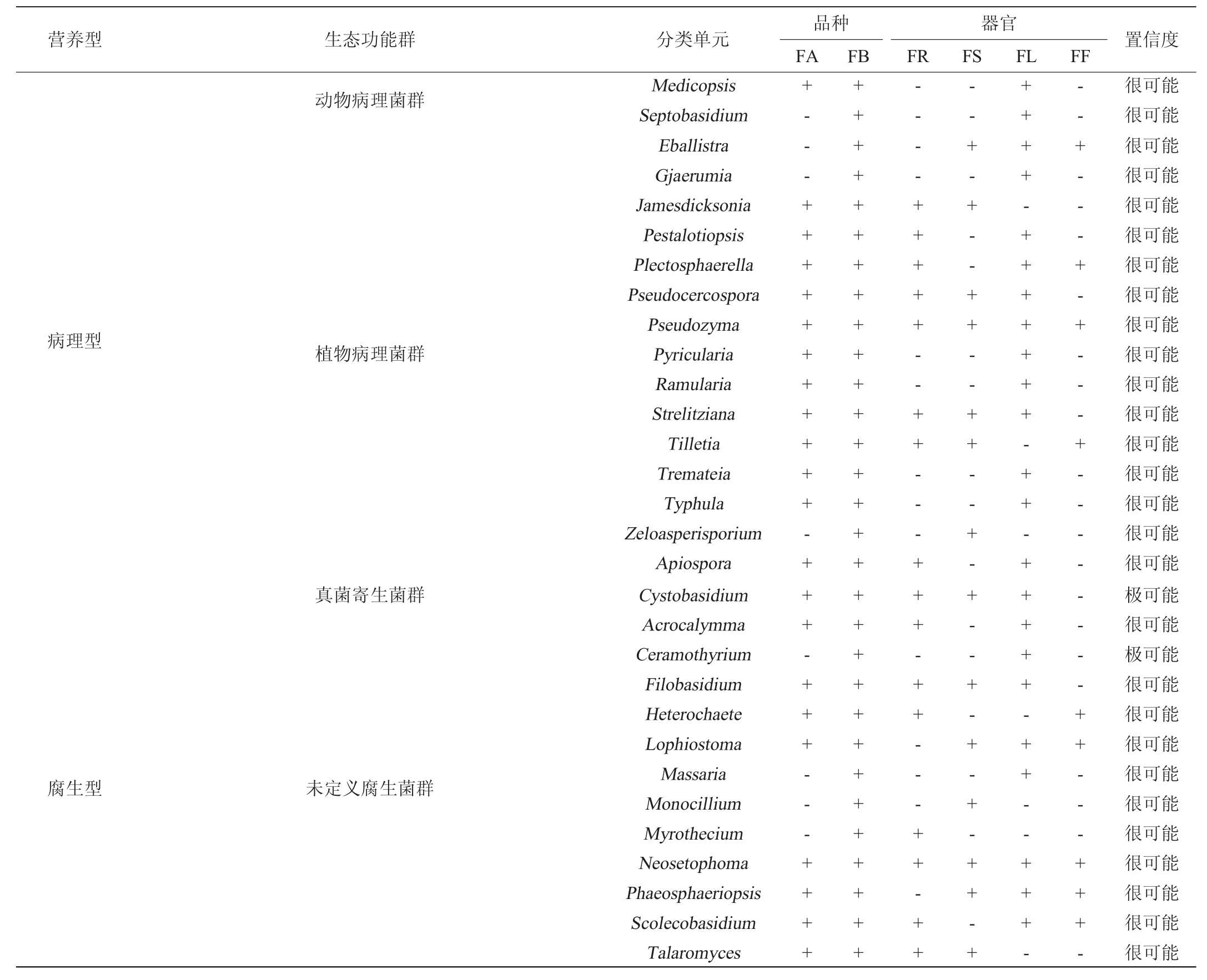
营养型 生态功能群 分类单元 置信度品种FA器官FR FS FL FF动物病理菌群病理型植物病理菌群真菌寄生菌群腐生型未定义腐生菌群Medicopsis Septobasidium Eballistra Gjaerumia Jamesdicksonia Pestalotiopsis Plectosphaerella Pseudocercospora Pseudozyma Pyricularia Ramularia Strelitziana Tilletia Tremateia Typhula Zeloasperisporium Apiospora Cystobasidium Acrocalymma Ceramothyrium Filobasidium Heterochaete Lophiostoma Massaria Monocillium Myrothecium Neosetophoma Phaeosphaeriopsis Scolecobasidium Talaromyces+---+++++++++++-+++-+++---++++FB++++++++++++++++++++++++++++++----+++++--++---+ ++-++---++-++--+-+--++--++--+- +--+-+-+-++-+++++-+++++++-++-+++++-++--+++--- + - - - + - + - - - + - - - - - - - - + + - - - + + + -很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能极可能很可能极可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能
续表
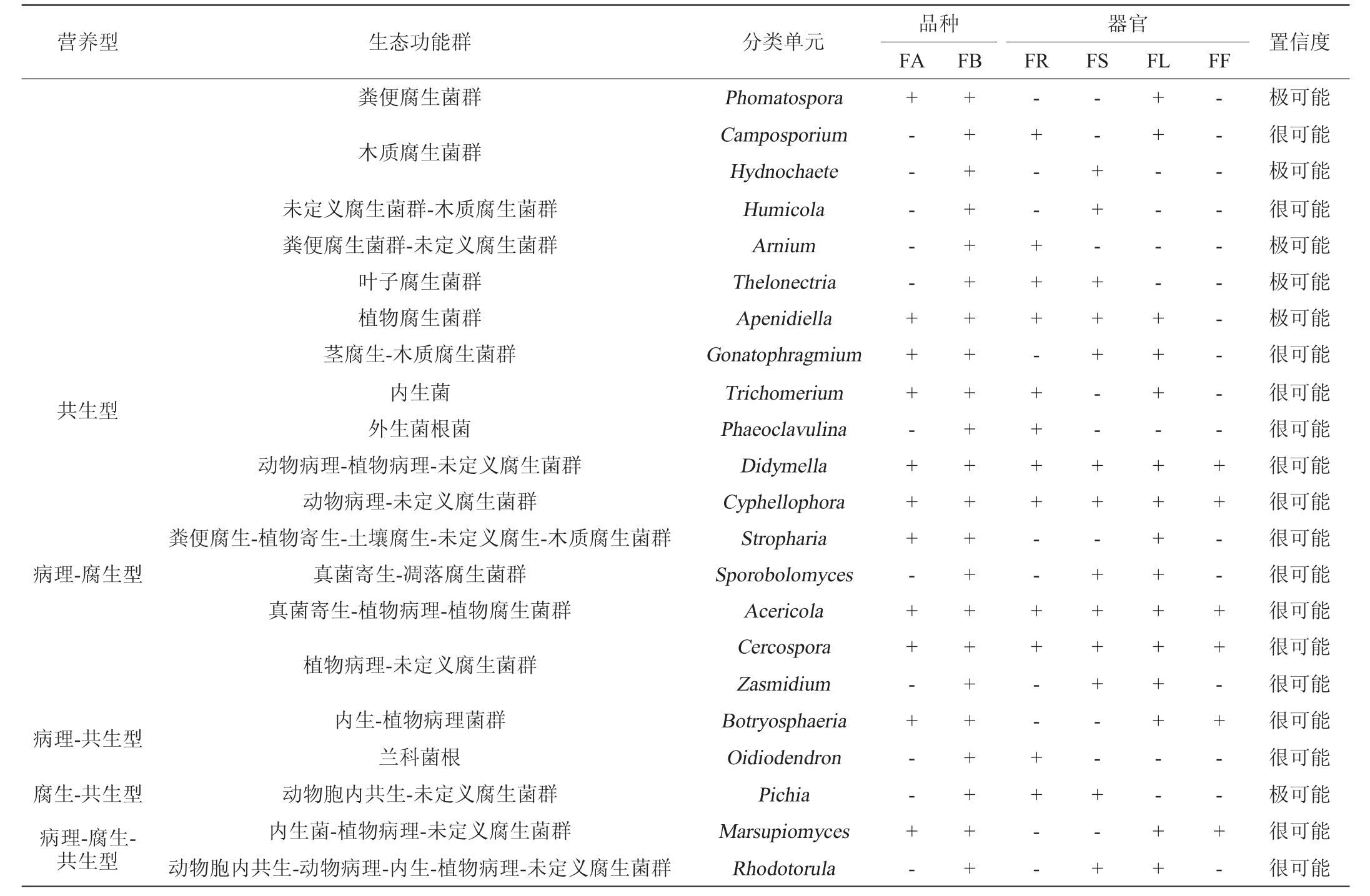
注:“+”代表含有分类单元;“-”代表不含分类单元。
品种FA营养型 生态功能群 分类单元 置信度FB器官FR FS FL FF共生型病理-腐生型病理-共生型腐生-共生型病理-腐生-共生型粪便腐生菌群木质腐生菌群未定义腐生菌群-木质腐生菌群粪便腐生菌群-未定义腐生菌群叶子腐生菌群植物腐生菌群茎腐生-木质腐生菌群内生菌外生菌根菌动物病理-植物病理-未定义腐生菌群动物病理-未定义腐生菌群粪便腐生-植物寄生-土壤腐生-未定义腐生-木质腐生菌群真菌寄生-凋落腐生菌群真菌寄生-植物病理-植物腐生菌群植物病理-未定义腐生菌群内生-植物病理菌群兰科菌根动物胞内共生-未定义腐生菌群内生菌-植物病理-未定义腐生菌群动物胞内共生-动物病理-内生-植物病理-未定义腐生菌群Phomatospora Camposporium Hydnochaete Humicola Arnium Thelonectria Apenidiella Gonatophragmium Trichomerium Phaeoclavulina Didymella Cyphellophora Stropharia Sporobolomyces Acericola Cercospora Zasmidium Botryosphaeria Oidiodendron Pichia Marsupiomyces Rhodotorula+- - - - - + + + - + + + - ++- + - - + -++++++++++++++++++++++-+ - - + + + - + + + + - - ++- - + + - --- + + - + + + - - + + - + +++ - - + - +++ - - - - ++ + - + + + + ++++ - -+ +-- - - - - - - - - + + - - ++- + - - + -极可能很可能极可能很可能极可能极可能极可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能很可能极可能很可能很可能
由表3可知,内生酵母菌营养模式可分为7种,分别为病理型、腐生型、共生型、病理-腐生型、病理-共生型、腐生-共生型和病理-腐生-共生型。同时可分为动物病理菌群、植物病理菌群、真菌寄生菌群等24个生态功能群。按照不同品种分类,金糯粱1号和青壳洋共有营养型6种,共有生态功能群15个,其中青壳洋独有功能菌株数量较多。按照不同器官分类,根、茎、叶和花共有营养型3种,共有生态功能群6个。不同器官独有功能群存在差异,其中叶部独有功能菌株数最多,花部最少。
在植物演化选择过程中,内生菌为应对植物各阶段生理状态,具备了共生、腐生和寄生等生存策略,不同品种和器官营养模式和功能群数差异较大。在功能结构中Medicopsis和隔担耳属(Septobasidium)被定义为动物病原菌,说明某些动物病原菌可跨界侵染不同生物宿主[26]。掷孢酵母属(Sporobolomyces)被定义为病理-腐生型菌,显示主要存在于叶、茎器官及青壳洋中,也被发现于自苹果、葡萄等植株的叶、花和果实中,能引发植物病变,但又是促进生物体抗性增加的调控因子[27],与罗方雯等[28]从茅台酱香白酒酿造大曲中分离的酵母菌株相似。病理型在叶器官中占比最高,说明该功能群可能易集中于生长旺盛且丰富的营养物质部位[29]。由于内生酵母菌在不同品种和器官中发挥不同功能,赋予不同器官和品种的产物和功能差异。
前期本课题组已从糯红高粱不同器官中分离筛选得到33株产明胶、干酪素等蛋白酶的内生酵母[13],后续随着可培养功能菌株的深入发掘,糯红高粱内生酵母菌的功能将会进一步明确,因此分析内生酵母菌的多样性和组成,对功能性菌株开展应用研究奠定基础。
3 结论
采用Illumina MiSeq高通量测序技术对花期糯红高粱不同品种及不同器官的内生酵母菌群多样性进行分析,结果表明,共注释到8门182属。地方种青壳洋内生酵母菌的群落多样性和丰富度均高于杂交种金糯粱1号,叶部丰富度最高。不同品种及茎叶的优势菌门均为子囊菌门(Ascomycota),花和根部的优势菌门分别为担子菌门(Basidiomycota)、未知真菌门(Unclassified Fungi);在属水平上,金糯粱1号和青壳洋优势菌属分别为刺盾炱目未分类菌属(Unclassified Chaetothyriales)和未知真菌属,根、茎、叶和花部的优势菌属分别为未知真菌属、枝氯霉属(Ramichloridium)、刺盾炱目未分类菌属和Didymium。采用LEfSe对不同样品间的差异指示菌进行分析,结果显示,青壳洋中最重要的差异指示属为Papiliotrema;根、茎、叶和花部最重要的差异指示属分别为镰刀菌属(Fusarium)、枝氯霉属、Alatosessilispora和Pseudozyma。通过FUNGuild对菌群功能预测,结果显示,糯红高粱内生酵母菌群功能丰富,可分为7种营养模式和24个生态功能群,且青壳洋和叶部独有功能菌数最多。本研究结果为后期深入探究内生酵母与宿主糯红高粱的互作机制及功能菌的开发提供参考。
[1] ISAEVA O V, GLUSHAKOVA A M, GARBUZ S A, et al. Endophytic yeast fungi in plant storage tissues[J].Biol Bull,2010,37:26-34.
[2] NUTARATAT P, SRISUK N, ARUNRATTIYAKORN P, et al. Plant growth-promoting traits of epiphytic and endophytic yeasts isolated from rice and sugar cane leaves in Thailand[J]. Fungal Biology, 2014, 118:683-694.
[3]DOMKA A,JEDRZEJCZYK R,WAZNY R,et al.Endophytic yeast protect plants against metal toxicity by inhibiting plant metal uptake through an ethylene-dependent mechanism[J].Plant Cell Environ,2023,46(1):268-287.
[4]LING L J,TU Y X,MA W X,et al.A potentially important resource:endophytic yeasts[J].World J Microb Biot,2020,36(8):110.
[5]慕丽琴,冯汉青.植物内生酵母研究简况[J].生物学通报,2021,56(2):1-4.
[6] LING L J, LI Z B, JIAO Z L, et al. Identification of novel endophytic yeast strains from tangerine peel[J].Curr Microbiol,2019,76(9):1066-1072.
[7]王慕瑶,曾杜文,王淇,等.松萝内生酿酒酵母菌株耐酸生理特性与分子机制探究[J].微生物学报,2022,62(11):4155-4164.
[8] KHUNNAMWONG P,JINDAMORAKOT S,LIMTONG S.Endophytic yeast diversity in leaf tissue of rice, corn and sugarcane cultivated in Thailand assessed by a culture-dependent approach[J].Fungal Biol,2018,122(8):785-799.
[9]邹剑秋,王艳秋,柯福来.高粱产业发展现状及前景展望[J].山西农业大学学报(自然科学版),2020,40(3):2-8.
[10]蒋力力,尹艳艳,杨军林,等.酿酒原料高粱对白酒品质影响的研究进展[J].中国酿造,2022,41(8):6-11.
[11]殷勇,张林,毛思根,等.宜宾糯红高粱绿色生产技术规程[J].大麦与谷类科学,2021,38(4):43-46.
[12]李建.金糯粱1号的品比与种植密度试验[J].四川农业与农机,2022(5):46-47.
[13]胡连清,刘雯雯,刘婉茹,等.糯红高粱中产蛋白酶内生酵母筛选鉴定及发酵特性研究[J].食品与发酵工业,2023,49(5):74-80.
[14]KÕLJALG U,NILSSON R H,ABARENKOV K,et al.Towards aunified paradigm for sequence-based identification of fungi[J].Mol Ecol,2013,22(21):5271-5277.
[15]程齐,宁鑫,乔旻航,等.不同生长期核桃根际微生物群落特征[J].生态学杂志,2023,42(9):2061-2071.
[16]张桂华,李旦,何承忠.基于高通量测序分析喙核桃内生真菌多样性[J].山东农业科学,2022,54(11):62-69.
[17] INTO P, PONETS A, SAMPAIO J P, et al. Yeast diversity associated with the phylloplane of corn plants cultivated in Thailand[J]. Microorganisms,2020,8(1):80.
[18] ZHANG X, HUA M X, SONG C L, et al. Occurrence and diversity of marine yeasts in Antarctica environments[J].J Ocean Univ China,2012,11:70-74.
[19] EL-ELIMAT T, RAJA H A, AYERS S, et al. Meroterpenoids from Neosetophoma sp.:a dioxa[4.3.3]propellane ring system,potent cytotoxicity,and prolific expression[J].Org Lett,2019,21(2):529-534.
[20]WANG B,LIANG X F,GLEASON M L,et al.Genome sequence of the ectophytic fungus Ramichloridium luteum reveals unique evolutionary adaptations to plant surface niche[J].BMC Genomics,2017,18(1):729.
[21]AIRES A,GONCALVES C,SAMPAIO J P.Hannaella floricola sp.nov.,a novel basidiomycetous yeast species isolated from a flower of Lantana camara in Portugal[J].Int J Syst Evol Micr,2023,73(2):005740.
[22] LIN R L, YANG Q, XIAO J, et al. Study on the biocontrol effect and physiological mechanism of Hannaella sinensis on the blue mold decay of apples[J].Int J Food Microbiol,2022,382:109931.
[23]VALASQUES J G L, DOS-SANTOS J D G, CHAVES P F P, et al.Antinociceptive and anti-inflammatory activity of α-d-mannan from Pseudozyma sp.[J].3 Biotech,2021,11(2):73.
[24]DE-ALMEIDA E L M, VENTORIM R Z, DE-MOURA F M A, et al.Papiliotrema laurentii: general features and biotechnological applications[J].Appl Microbiol Biot,2022,106(21):6963-6976.
[25]凡贞洁,徐静雅,侯典云,等.人参内生菌的研究进展[J].世界科学技术-中医药现代化,2022,24(8):2938-2946.
[26]白彦丽.植物病原细菌Xanthomonas感染秀丽隐杆线虫引发的天然免疫应答研究[D].兰州:兰州大学,2015.
[27]刘开平,韦玉梅,熊杰,等.东亚飞蝗和刺腿食蚜蝇内生酵母菌多样性分析[J].广东农业科学,2018,45(9):90-95.
[28]罗方雯,黄永光,涂华彬.茅台镇酱香白酒不同酿造区域可培养酵母种群结构多样性分析[J].食品科学,2020,41(12):143-149.
[29]刘涛,马楠,金吉芬,等.黑老虎内生真菌及根际土壤真菌的群落结构与生态功能分析[J].广西植物,2023,43(5):869-879.