葡萄酒是新鲜葡萄或葡萄汁经发酵而成的酒精饮料,具有多酚、单宁、花色苷等活性物质[1],可以美容、减肥、抗癌、延寿,预防心血管疾病,保护视力、预防感冒[2]。目前,国内葡萄酒企业主要使用商业酿酒酵母(Saccharomyces cerevisiae,SC)酿造葡萄酒,尽管使用SC纯种发酵具有易于控制和发酵均匀的优点,但会导致葡萄酒缺乏独特的风味差异,使葡萄酒出现同质化现象[3]。非酿酒酵母(non-Saccharomyces cerevisiae)在发酵过程产生多种胞外酶,与香气前体物质相互作用产生酯类、酸类、醇类、萜类化合物等代谢产物,对酒体增香、丰富口感具有举足轻重的作用[4]。
非酿酒酵母与酿酒酵母混合发酵更能加强葡萄酒的香气及功能成分。尹雪林等[5]以戴尔有孢圆酵母(Torulaspora delbrueckii)SY-2-2和酿酒酵母(Saccharomyces cerevisiae)RV002为菌种,分别以单菌和混菌发酵猕猴桃酒,结果表明,混菌发酵的猕猴桃酒挥发性香气成分种类和质量均最高;袁晓龙等[6]采用产香酵母B(异常毕赤酵母(Pichia anomala))与安琪果酒酵母(SY)共发酵鸭梨酒结果表明,总酯产量是单菌发酵结果的2.6倍;金海炎等[7]采用有孢汉逊酵母(Hanseniaspora vineae)与安琪果酒酵母(SY)混合发酵猕猴桃果酒发现,其抗氧化能力整体优于单菌发酵果酒。目前,非酿酒酵母多由酿酒原料或酿造环境中分离筛选[8],鲜有从发酵食品源中分离筛选非酿酒酵母的研究报道。
本研究以醋醅中分离的产酯能力较强的非酿酒酵母JM为对象,对其进行形态学观察、分子生物学鉴定和耐受性分析;再以赤霞珠葡萄为原料,以商业酿酒酵母SC、安琪活性生香干酵母ADY与非酿酒酵母JM为发酵菌种,进行单菌及混菌发酵酿造葡萄酒,并对葡萄酒品质进行分析,以期为提高葡萄酒品质及其他发酵环境中的非酿酒酵母的利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
赤霞珠葡萄:河北张家口怀来县;菌株JM:分离自山西老陈醋熏醅中的产香酵母,现保存于信阳农林学院食品学院实验室;商业酿酒酵母SC、安琪活性生香干酵母ADY:安琪酵母股份有限公司。
1.1.2 试剂
蛋白胨、酵母膏、琼脂粉:北京鸿润宝顺科技有限公司;果胶酶(40 U/mg)、偏重亚硫酸钾、柠檬酸:江苏博立生物制品有限公司;葡萄糖、氢氧化钠、无水乙醇、硫酸铜:天津市恒兴试剂有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,琼脂20 g/L,121 ℃灭菌20 min。
马铃薯葡萄糖液体培养基:200 g马铃薯切块蒸馏水煮沸,保留滤液,添加20 g葡萄糖,115 ℃灭菌20 min。
WL鉴别培养基:葡萄糖50 g/L,蛋白胨5 g/L,酵母浸粉5 g/L,氯化钾0.425 g/L,磷酸二氢钾0.55 g/L,氯化钙0.125 g/L,氯化铁0.002 5 g/L,硫酸锰0.002 5 g/L,硫酸镁0.125 g/L,溴甲酚绿0.022 g/L,琼脂粉20 g/L,pH 5.5,121 ℃灭菌20 min[9]。
1.2 仪器与设备
XMTD-7000电热恒温水浴锅:北京市永光明医疗仪器有限公司;G-040S/G-080S歌能超声波清洗机:深圳市歌能清洗设备有限公司;SW-CJ-1D单人单面垂直净化工作台:上海尚道仪器制造有限公司;BM-220电子天平:启东友铭衡器有限公司;MQL-621R振荡培养箱:上海旻泉仪器有限公司;LDZM-8OL-III立式高压蒸汽灭菌器:上海申安医疗器械厂;TG16离心机:上海卢湘仪离心机仪器有限公司;CHA-S生化培养箱:常州荣华仪器制造有限公司;EX2000生物显微镜:重庆中显光电有限公司;GC9800气相色谱(gas chromatography,GC)仪:上海科创色谱仪器有限公司。
1.3 方法
1.3.1 葡萄酒的加工工艺流程及操作要点[10-11]
酿酒葡萄→除梗破碎→冷浸渍→成分调整→酶解→接种活化酵母→发酵→皮渣分离、倒罐→成品
操作要点:
预处理:除梗破碎前,通过人工穗选去除着色较浅的果穗和枝条、叶片及其他杂物,采用除梗破碎机脱去果梗并轻度破碎。
冷浸渍:将破碎后入罐的葡萄原料置于冷库中降温至12 ℃,带皮带渣浸渍48 h,以提取葡萄皮中的色素和风味物质。
成分调整:葡萄汁含糖量(以还原糖计)180 g/L,通过添加白砂糖调整糖度至220 g/L,添加0.10 g/L偏重亚硫酸钾。
酶解:添加40 mg/L葡萄汁的果胶酶,于40 ℃条件下酶解8 h。
酵母活化、接种:将商业化酵母SC、生香干酵母ADY置于无菌水中,30 ℃活化15 min,接种于酶解后样品中。
发酵:28 ℃恒温发酵,在发酵过程中定期测定理化指标,至糖度趋于稳定为发酵结束。
皮渣分离、倒罐:发酵至葡萄皮下沉后将葡萄皮和酒分离,保留分离后的酒液,静置澄清,即得葡萄酒成品。
1.3.2 非酿酒酵母JM种子液的制备
将菌株JM划线接种于YPD培养基,28 ℃培养2 d,挑选菌落特征明显的单菌落接种于10 mL YPD液体培养基制备种子液,于28 ℃、170 r/min的条件下培养24 h,血球计数板计数,获得1.3×106 CFU/mL的种子液。
1.3.3 非酿酒酵母JM的鉴定
(1)形态学观察
将菌株JM划线接种于YPD培养基,观察单菌落颜色、透明度、光滑、湿润以及边缘整齐等特征情况,挑选单菌落,于显微镜下观察形态特征,参考《酵母菌的特征与鉴定手册》[12]进行初步的形态学鉴定。挑选YPD培养基上单菌落,接种于WL鉴别培养基28 ℃培养2 d后,对WL培养基上菌落形态进行观察[13]。
(2)分子生物学鉴定
参考何宏魁等[14]的鉴定方法,取种子液1 mL,5 000 r/min离心2 min后去上清收集菌体,采用试剂盒提取酵母菌基因组的脱氧核糖核酸(deoxyribonucleic acid,DNA)。以其为模板,采用引物NL-1(5'-GCATATCAATAGCGGAGGAAAAG-3')和NL-4(5'-GGTCCGTGTTTCAAGACGG-3')聚合酶链反应(polymerase chain reaction,PCR)扩增26S rDNA目标基因,PCR扩增体系(50 μL):2×PCR buffer 25 μL,引物NL-1和NL-4各1.0 μL,DNA模板5.0 μL,双蒸水(ddH2O)18 μL。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃修复延伸5 min。PCR产物经1%琼脂糖凝胶电泳后,送至郑州生工生物公司测序,结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对分析,用Clustalx l.83和MEGA 7.0构建系统进化树。
1.3.4 菌株JM耐受性测定
取YPD液体培养基9mL,接种菌株JM种子液1 mL,28 ℃培养24 h,分别考察柠檬酸添加量(1%、1.5%、2.0%、2.5%、3.0%)、温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、乙醇体积分数(4%、6%、8%、10%、12%)、氯化钠添加量(1%、2%、3%、4%、5%)对菌株JM OD600nm值的影响。
1.3.5 不同酵母添加方式对葡萄酒品质的影响
在葡萄酒酿造工艺流程基础上,参照原苗苗[15]的试验方法设计如下酵母添加方式制备葡萄酒:①接种JM 1×107 CFU/mL;②接种ADY 1×107 CFU/mL;③接种SC 1×107 CFU/mL;④先接种JM 1×106 CFU/mL,于48 h后接种SC 1×106 CFU/mL;⑤先接种ADY 1×106 CFU/mL,于48 h后接种SC 1×106 CFU/mL;28 ℃恒温箱中发酵6 d,在酒精发酵过程中每隔1 d测定一次理化指标。
1.3.6 理化指标的检测
糖度的测定:采用手持糖度仪;pH值的测定:采用pH计;还原糖、总酸、酒精度的测定:参照GB/T15038—2006《葡萄酒、果酒通用分析方法》;总酯、花色苷的测定:分别参考廖永红等[16-17]的方法;颜色参数的测定:采用色度仪。
1.3.7 抗氧化活性的检测
(1)DPPH自由基清除率的测定
参考林恋竹等[18]的方法,并稍作修改。取2 mL样品与2 mL的0.1 mmol/L DPPH溶液放入试管,振荡30 s,室温避光反应30 min,测定波长517 nm处吸光度值,记为A样品。将2 mL样品溶液与2 mL无水乙醇溶液混合后,测定波长517 nm处的吸光度值,记为A对照,将2 mL无水乙醇与2 mL DPPH溶液混合后,测定波长517 nm处的吸光度值,为空白组记A空白。其计算公式如下:
(2)ABTS自由基清除率的测定
参考李勇[19]的方法并稍加修改。取0.4 mL稀释10倍的葡萄酒样品加到3.6 mL ABTS+溶液中避光反应5 min,测定波长734 nm处的吸光度值,记为A样品,同体积的无水乙醇替代样品测定吸光度值,记为A空白。其计算公式如下:
1.3.8 葡萄酒的感官评价
挑选10名经过感官培训的人员组成感官评定小组,从色泽、澄清度、香气、滋味、整体评价5个方面对葡萄酒进行感官评价,满分100分,参照叶林林[20]的方法制定感官评价标准,见表1。
表1 葡萄酒的感官评价标准
Table 1 Sensory evaluation standards of wine
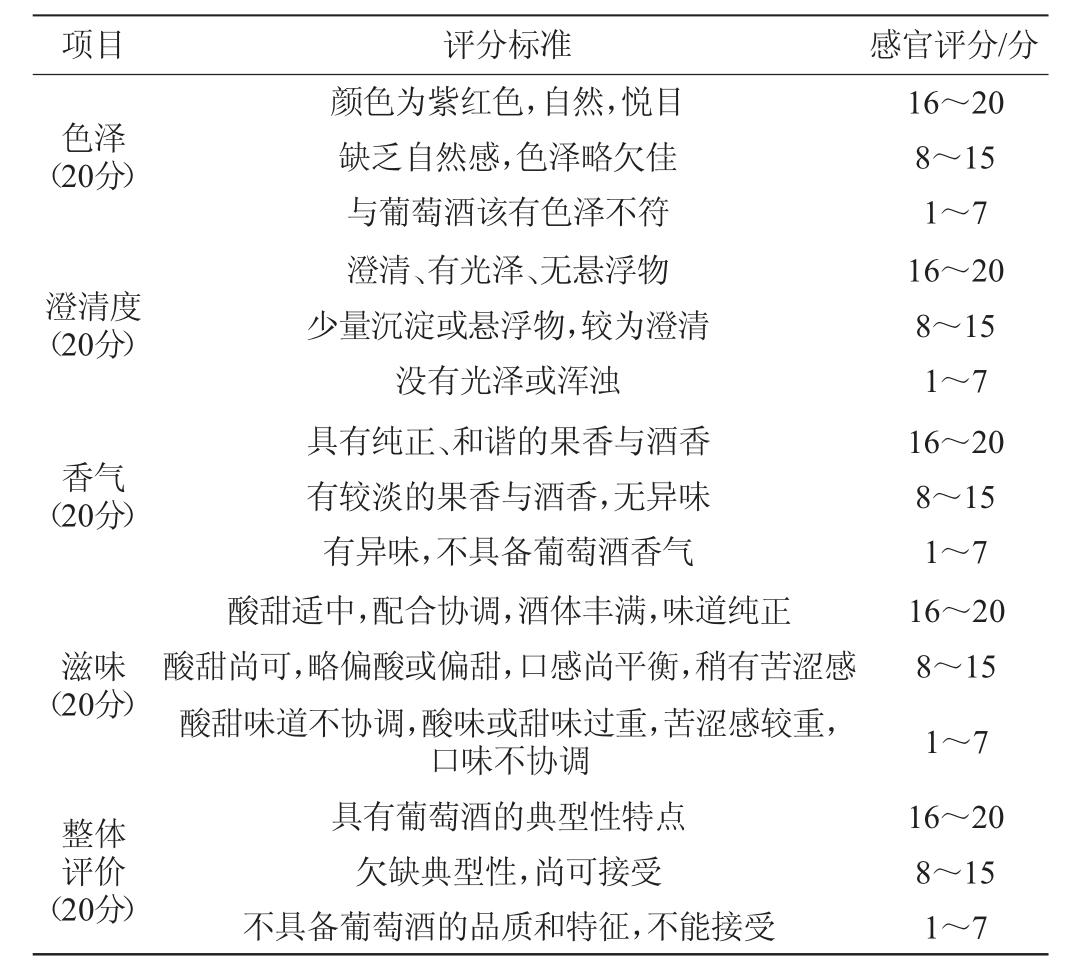
项目 评分标准 感官评分/分色泽(20分)澄清度(20分)香气(20分)颜色为紫红色,自然,悦目缺乏自然感,色泽略欠佳与葡萄酒该有色泽不符澄清、有光泽、无悬浮物少量沉淀或悬浮物,较为澄清没有光泽或浑浊具有纯正、和谐的果香与酒香有较淡的果香与酒香,无异味有异味,不具备葡萄酒香气16~20 8~15 1~7 16~20 8~15 1~7 16~20 8~15 1~7滋味(20分)酸甜适中,配合协调,酒体丰满,味道纯正酸甜尚可,略偏酸或偏甜,口感尚平衡,稍有苦涩感酸甜味道不协调,酸味或甜味过重,苦涩感较重,口味不协调16~20 8~15 1~7整体评价(20分)具有葡萄酒的典型性特点欠缺典型性,尚可接受不具备葡萄酒的品质和特征,不能接受16~20 8~15 1~7
1.3.9 挥发性风味成分的测定
采用气相色谱法(GC)测定葡萄酒样品中的挥发性风味成分。取5 mL酒样,加入2 g氯化钠、20 μL内标(4-甲基-2-戊醇为50 g/L的丙酮溶液,终浓度为9.8 mmol/L)于棕色透明顶空瓶中,在70 ℃下水浴30 min,用500 μL微量进样器吸取300 μL顶空瓶上层气体,并立即插入气相色谱仪进样口中测定。
色谱条件:色谱柱为弹性石英毛细管柱DB-WAX-10(30 m×0.53 mm×1 μm),载气为氮气(N2),设初始温度为55 ℃,在55 ℃下保持3 min;随后以15 ℃/min升至200 ℃并保持3 min。
定性、定量分析:采用保留时间定性,内标法定量[21]。
1.3.10 数据处理
试验数据采用SPSS 20.0进行统计学分析,利用单因素方差分析Duncan检验进行差异显著性检验,P<0.05表示差异显著,采用Origin 2018绘图。
2 结果与分析
2.1 菌株JM的鉴定
2.1.1 形态学鉴定
菌株JM的菌落形态及细胞形态见图1。由图1a、图1b可知,菌株JM菌落大而厚,隆起,边缘整齐,外观较稠,不透明,呈乳白色,柔顺、光滑、湿润,有浓厚的酵母气息和酯香味。酵母菌细胞呈长条形;由图1c可知,菌株JM在WL培养基上菌落中央奶油色,边缘绿色,与文献报道的假丝酵母在WL培养基上的形态一致[13],不符合酿酒酵母菌的菌落特征,初步判定菌株JM为非酿酒酵母。
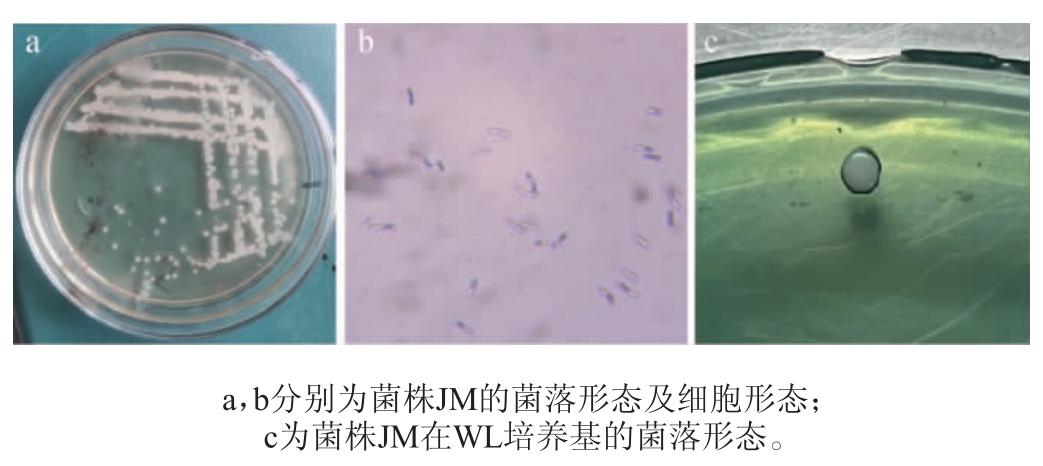
图1 菌株JM的菌落形态及细胞形态Fig. 1 Colony morphology and cell morphology of strain JM
2.1.2 分子生物学鉴定
菌株JM的26S rDNA基因序列PCR扩增产物凝胶电泳结果见图2。由图2可知,菌株JM基因序列在550 bp左右出现目的条带,符合酵母菌片段,说明PCR成功扩增出目标序列。将基因测序结果与NCBI中序列进行BLAST同源性分析,构建系统发育树,结果见图3。由图3可知,菌株JM与扁平云假丝酵母(Candida humilis)(AF399778.1)在同一分支上,同源性达100%,因此,将菌株JM鉴定为扁平云假丝酵母(Candida humilis)。
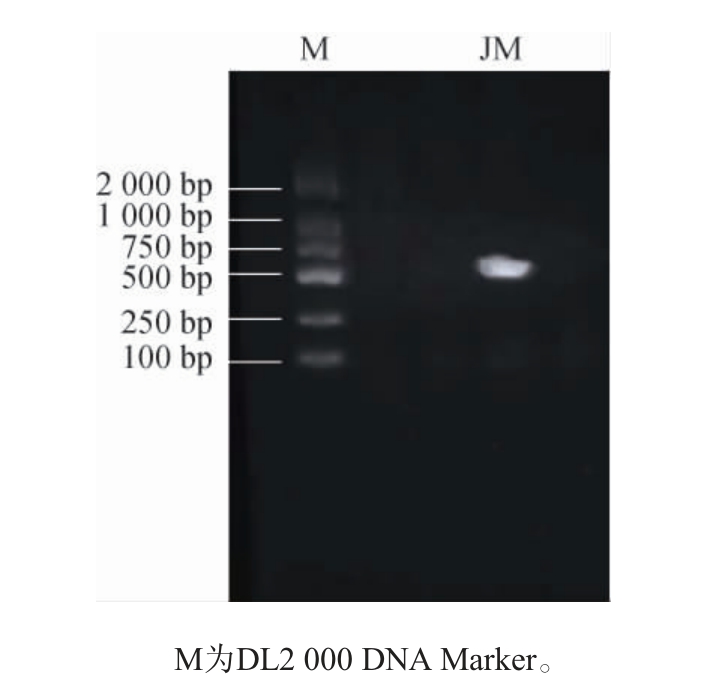
图2 菌株JM的26S rDNA基因序列PCR扩增产物电泳结果
Fig. 2 Electrophoretic results of 26S rDNA gene sequence amplified by PCR of strain JM

图3 基于26S rDNA基因序列菌株JM的系统发育树
Fig. 3 Phylogenetic tree of strain JM based on 26S rDNA gene sequence
2.2 菌株JM的产酯能力和耐受性分析
2.2.1 产酯能力分析
将菌株JM培养3 d后,测得菌株JM的产酯含量为2.64 g/L,高于李晨[22]筛选后并优化的产香酵母Y-213的产酯量(2.32g/L),经对比分析可得,该株酵母菌产酯能力较高。
2.2.2 耐受性测定结果
由图4a可知,随着柠檬酸添加量在1.0%~3.0%范围内的增加,菌株JM均可生长。该结果与刘晓柱等[23]结果相似,菌株F119在柠檬酸含量1.0%~3.0%均可生长,可能是由于菌株具有较强控制氢离子进出细胞的能力,维持细胞内中性环境。根据国家标准GB 15037—2006《葡萄酒》中理化指标要求,菌株JM可应用于葡萄酒发酵。因此,该菌株可耐受3.0%柠檬酸。

图4 菌株JM的耐受性试验结果
Fig. 4 Results of strain JM tolerance test
由图4b可知,随着温度在20~25 ℃范围内升高,菌株JM生物量逐渐增加;当温度为25~35 ℃时,菌株生物量变化平缓;当温度高于35℃时,菌株生物量显著下降(P<0.05)。发酵过程中温度过高或过低都会影响酵母体内酶活性,导致菌体趋向死亡[24]。低温时,酵母的发酵性能过于平稳,让整体发酵工艺持续时间较长;高温时,可能是由于酵母生长旺盛,产生一定量的酒精,导致菌体的生长受到了一定抑制作用。因此,该菌株可耐受温度为35 ℃。
酵母的酒精耐受性越好,最后所得到的葡萄酒酒精度越高[25]。由图4c可知,随着乙醇体积分数在4%~6%范围内的升高,菌株JM的OD600 nm值快速下降,当乙醇体积分数>6%时,酵母生长受到抑制,当乙醇体积分数>8%时,菌株JM几乎停止生长,逐渐走向衰亡期,这与刘晓柱等[23,25]的研究结果一致。其原因可能是当乙醇的体积分数到达6%,乙醇增加了细胞膜的运动性和疏水区的极性,破坏了酵母菌的正常生理功能,菌株的生长受到严重抑制。因此,该菌株可耐受体积分数6%的乙醇。
由图4d可知,当NaCl添加量为1~4%,随着NaCl含量的增加,OD600nm值显著下降(P<0.05);当NaCl添加量>4%,酵母菌的生长受到了严重抑制。由韦元琪等[26]的研究结果可知,菌株JM在NaCl含量>4%时,菌株细胞水分含量降低、细胞质的组分发生变化并伴随细胞膜损伤等,从而降低了细胞活性。因此,菌株JM可耐受NaCl含量为4%。
2.3 不同葡萄酒发酵过程中基本理化指标分析
发酵过程中葡萄酒理化指标检测结果见图5。
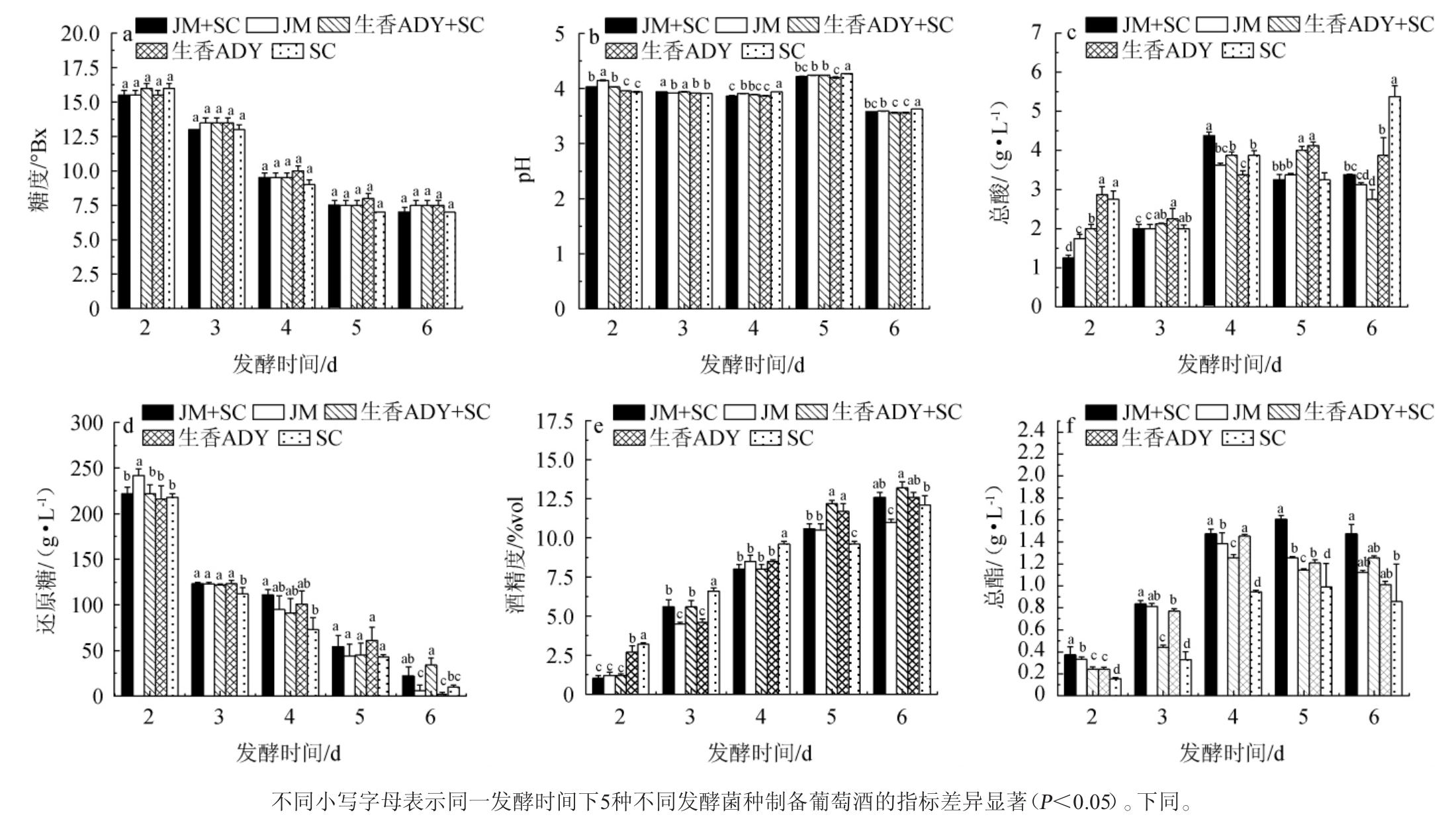
图5 葡萄酒发酵过程中理化指标的变化
Fig. 5 Changes of physicochemical indexes during wine fermentation process
由图5a可知,随发酵时间在0~6 d范围内的延长,5种酵母制备葡萄酒发酵过程中糖度均呈下降趋势,与叶林林[20]所得结果一致。发酵前期(2~4 d)酵母菌处于对数生长,糖分消耗加快,发酵后期,糖分变化幅度降低,发酵基本完成。在同一发酵时间点下,不同葡萄酒样品的糖度无显著差异(P>0.05)。因此,不同处理组均在第5天后完成葡萄酒的初步发酵。
由图5b可知,当发酵时间为2~4 d时,不同葡萄酒样品的pH值变化不明显;当发酵时间为4~5 d时,pH值逐渐增加;当发酵时间>5 d时,pH值下降,当发酵时间为6 d时,JM+SC、JM、生香ADY+SC、生香ADY和SC组pH值分别为3.58、3.59、3.56、3.56、3.63,杨辉等[25]研究结果表明,第4天后pH有一定升高趋势的原因可能是由于酒精发酵速率加快导致酒精度升高,有机酸相对降低,第6天后发酵基本结束,pH回落并趋于稳定。pH在4.5以下可有效抑制葡萄酒发酵过程中杂菌的生长,且葡萄酒的pH在2.9~3.9之间,因此,5种菌组合发酵的葡萄酒均能有效防止杂菌污染,具有一定稳定性,且符合葡萄酒的pH范围。
酸是果酒的骨架,酸度的缺失使果酒酒体贫乏,立体感差,而酸度过于高则让口感不柔和[26]。由图5c可知,当发酵时间在2~4 d范围内增加,不同组别总酸含量均呈上升趋势,发酵4 d后JM+SC、JM和生香ADY+SC组总酸呈下降趋势,生香ADY组总酸先上升后下降,而SC组总酸呈先下降后整体上升趋势。由于酵母菌在发酵过程中会产生较多柠檬酸、苹果酸等,使有机酸积累,总酸含量升高,后期体系中酸含量较高,有一些有机酸被酵母菌利用,总酸含量呈略微下降趋势[26]。发酵结束时,JM+SC、JM、生香ADY+SC、生香ADY和SC组的总酸含量分别为3.38 g/L、3.13 g/L、2.75 g/L、3.88 g/L、5.38 g/L,葡萄酒的总酸质量浓度通常≤2.0 g/L。发酵第6天后葡萄酒初期发酵基本完成。因此,SC组酿造的葡萄酒总酸最高,生香ADY+SC组总酸最低,JM+SC组酿造的葡萄酒酸度适中,综合分析,5组不同发酵菌种酿造的葡萄酒均符合NY/T274—2023《绿色食品葡萄酒》要求较适合酿造葡萄酒。
从图5d可知,酒精发酵过程中还原糖含量持续下降,尤其发酵2~3 d时,还原糖下降明显,此时酵母菌活性旺盛,发酵3~6 d后,还原糖含量逐渐降低,与雷蕾等[27]研究结果相似。发酵结束时JM+SC组的还原糖含量为22.00 g/L,低于生香ADY+SC 组(34.00 g/L),说明前者对于还原糖的利用高于后者,JM+SC组的还原糖与SC组相比无显著差异。综合分析,JM+SC混菌发酵与商业酿酒酵母SC在发酵过程中显示的发酵能力相一致,可有效保证其在葡萄酒酿造过程中的充分发酵。
由图5e可知,随着发酵的进行,发酵过程中酒精度不断增加,发酵结束时,生香ADY+SC组酒精度最高,为13.20%vol,菌株JM单独发酵酒精度最低,为11.00%vol。非酿酒酵母可分为发酵型酵母和半发酵型酵母,其中发酵型酵母有较好的产酒精和耐受能力,且具备混合发酵过程中的提升酒体风味的作用[28],非酿酒酵母S. cerevisiae能实现利用糖转化为乙醇的效果[29]。尤雅等[30]研究表明,扁平云假丝酵母(C. humilis)CVE20单菌发酵产酒精能达到9.77%vol,与本研究中非酿酒酵母单菌发酵产酒精度相近。JM+SC组酒精度为12.60%vol,显著高于JM单菌发酵组(P<0.05),略高于SC组(12.10%vol),略低于生香ADY+SC组(13.20%vol)。因此,JM+SC混菌发酵的葡萄酒符合商业葡萄酒酒精度要求符合NY/T274—2023《绿色食品葡萄酒》中≥8.5%vol的要求。
总酯是酒中所有酯类芳香物的总和,其含量的多少与酒的品质及香型有关,总酯含量太低则酒味淡薄[28]。由图5f可知,当发酵时间为2~6 d时,所有处理组的总酯含量大致呈先上升后稍下降的趋势,JM+SC组在发酵过程中的产酯能力高于其他组,在第5天时,含量达到了最高值(1.61 g/L),显著高于SC组的总酯。因此,JM+SC组可以为酒体风味物质提供有力支持。
2.4 葡萄酒发酵过程中功能成分及抗氧化活性分析
花色苷是葡萄酒的重要显色物质,也是一种很好的体内自由基清除剂和抗氧化剂,是稳定葡萄酒色泽的重要指标,有助于预防冠心病和动脉粥样化等疾病[27]。
由图6a可知,当发酵时间为2~4 d时,花色苷含量下降速率较快;当发酵时间>4 d后,花色苷下降速率趋于平稳;发酵结束时,JM+SC组、生香ADY+SC组、SC组的花色苷含量分别为205.52 mg/L、209.53 mg/L、203.86 mg/L,但差异不显著(P>0.05),与叶林林[20]研究变化趋势相同,发酵前期花色苷容易和SO2形成亚硫酸氢盐加成物,致使花色苷前期降低速率较快,此外发酵过程中微生物产生一些酶也会导致花色苷酶解,而后期降速逐渐变慢。
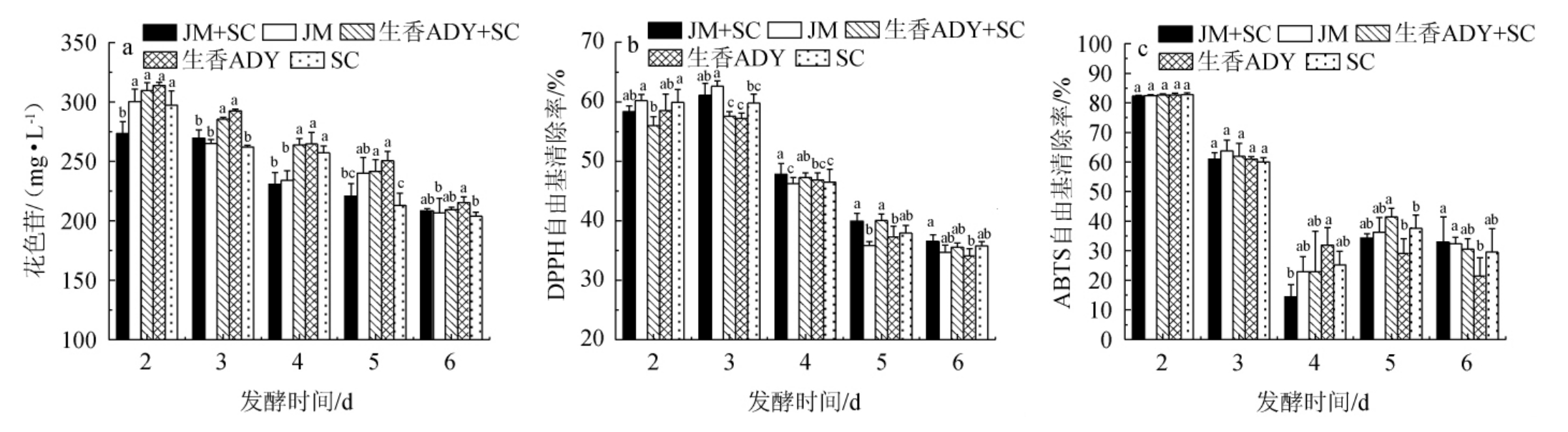
图6 葡萄酒发酵过程中花色苷、DPPH、ABTS自由基清除率的变化
Fig. 6 Changes of anthocyanins, DPPH and ABTS radical scavenging rates during wine fermentation process
由图6b可知,在整个发酵过程中JM+SC的DPPH自由基清除率整体较高,当发酵时间为2~3 d时,DPPH自由基清除率呈上升趋势;当发酵时间为3 d时,DPPH自由基清除率达到最高值(62.60%),第3天后,DPPH自由基清除率逐渐下降,到酒精发酵后期趋于平稳。根据叶林林[20]的研究分析,在前期DPPH自由基清除率上升是由于酚类物质溶出,而随着发酵体系中酚类物质降解导致DPPH自由基清除率逐渐下降,最后趋于平稳。综合分析,在发酵过程中JM+SC组的DPPH自由基清除率持续在较高水平,有利于葡萄酒酒体的稳定。
由图6c可知,当发酵时间为2~6 d时,JM+SC组的ABTS自由基清除率呈先下降后上升再下降的趋势。发酵结束时,ABTS自由基清除率最高(达到32.86%)。段丽丽等[32]研究结果表明,ABTS自由基清除率随着时间逐渐降低,自由基的产生和消除的平衡受制于抗氧化物,推测JM+SC发酵的葡萄酒中抗氧化物增多,导致葡萄酒自由基清除能力增强。因此,发酵结束后JM+SC发酵的葡萄酒具有较好的ABTS自由基清除率,有利于葡萄酒的存储。
综上可知,葡萄酒中花色苷含量越高,对DPPH、ABTS自由基清除作用越大。
2.5 不同葡萄酒样品的感官评价
2.5.1 颜色参数
由表2可知,JM+SC组L*值显著高于其他组(P<0.05);b*值显著高于JM组(P<0.05);a*值显著低于生香ADY组(P<0.05),与SC组无显著差异(P>0.05),显著高于其他三组(P<0.05)。研究表明色度高,酚类物质含量就越高,酒的颜色越深,该项指标的酒相较优良[33]。有研究表明红酒在酿造过程中较大L*值,a*值,b*值更符合消费者偏好。综合分析,JM+SC组有较好的红酒色泽。
表2 添加不同酵母葡萄酒色度值
Table 2 Chroma values of wine with different yeasts addition
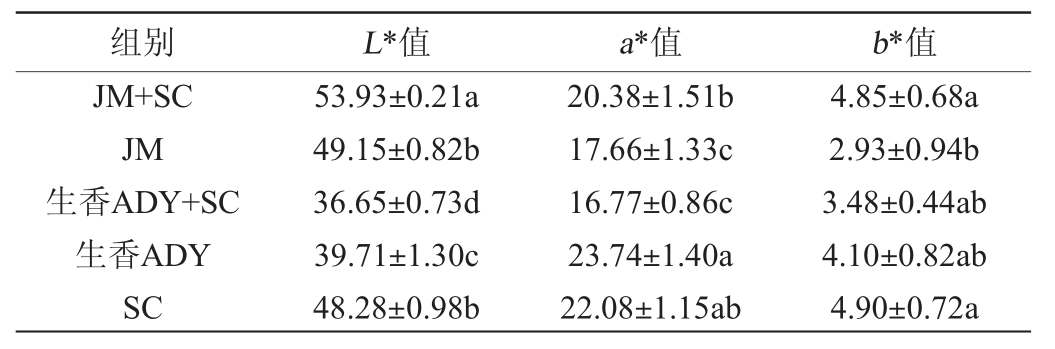
组别 L*值 a*值 b*值JM+SC JM生香ADY+SC生香ADY SC 53.93±0.21a 49.15±0.82b 36.65±0.73d 39.71±1.30c 48.28±0.98b 20.38±1.51b 17.66±1.33c 16.77±0.86c 23.74±1.40a 22.08±1.15ab 4.85±0.68a 2.93±0.94b 3.48±0.44ab 4.10±0.82ab 4.90±0.72a
2.5.2 感官评分
由图7可知,JM+SC混菌发酵组在酒体色泽、透明度、香气、滋味和整体评价5个方面均明显高于其他四组。JM+SC组综合五项指标其感官评价得分78分,其香气相较其他四组更加浓郁,整体甜度较低,符合葡萄酒品质特征,能赋予葡萄酒良好风味。
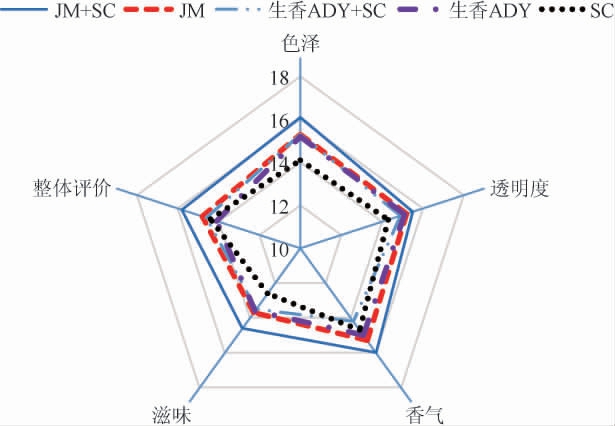
图7 葡萄酒的感官评分雷达图
Fig. 7 Radar chart of sensory score of wine
综合以上试验分析,JM+SC混菌发酵的葡萄酒在感官评价,发酵、产酯、降酸能力和抗氧化效果方面有明显的优势,因此,选择JM+SC混菌发酵的葡萄酒进行进一步的挥发性成分分析。
2.6 JM+SC混菌发酵葡萄酒的挥发性风味成分分析
挥发性香气物质是影响葡萄酒品质的主要因素之一,在葡萄酒风格和质量方面起着重要的作用[34]。根据李曼祎等[35]的实验结果可知,在葡萄酒中含量较高的酯类为乙酯类,有丙酸乙酯、乳酸乙酯等,赋予了果酒清新的花香及果香味;醇类化合物是果酒中重要的助香化合物,也是酯类合成的前体物质,由原料中蛋白质、氨基酸和糖类在发酵过程中生成。研究表明,非酿酒酵母与酿酒酵母混合发酵可提高酯类物质的含量,增加酒体的芳香复杂度[36]。邢家爱等[37]的研究表明,乙酸苯乙酯、己酸乙酯、乙酸乙酯、乙酸异戊酯、丁酸乙酯、正己醇等为葡萄酒花香味和果香味贡献较大。因此,本研究中对JM+SC组葡萄酒中部分挥发性物质进行检测,结果见表3。由表3可知,共检出8种酯类,1种醇类,1种有机酸类。其中,丙酸乙酯(7.97 g/L)和乙酸戊酯(1.99 g/L)含量最高,可能对香气贡献较大。
表3 JM+SC发酵葡萄酒样品中挥发性风味成分检测结果
Table 3 Determination of volatile flavor components in wine sample fermented by JM+SC
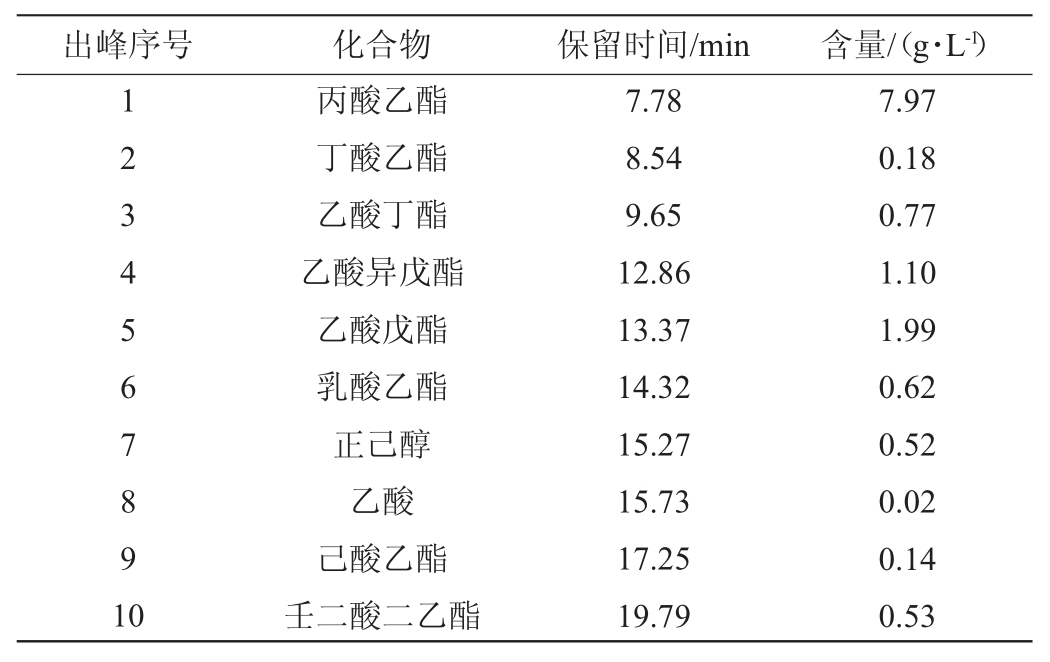
出峰序号 化合物 保留时间/min 含量/(g·L-1)123 4567891 0丙酸乙酯丁酸乙酯乙酸丁酯乙酸异戊酯乙酸戊酯乳酸乙酯正己醇乙酸己酸乙酯壬二酸二乙酯7.78 8.54 9.65 12.86 13.37 14.32 15.27 15.73 17.25 19.79 7.97 0.18 0.77 1.10 1.99 0.62 0.52 0.02 0.14 0.53
3 结论
本研究中菌株JM被鉴定为扁平云假丝酵母(Candida humilis),在发酵液中总酯产量为2.64 g/L,其可耐受3.0%柠檬酸、35 ℃温度、体积分数6%的乙醇及4%NaCl。在不同组别葡萄酒样品中,JM+SC混菌制备的葡萄酒品质最佳,其酒体颜色为紫红色,L*值、a*值、b*值分别为53.93、20.38、4.85;糖度为7 °Bx,总酸含量为3.38 g/L,还原糖含量为22.00 g/L,pH为3.58,花色苷含量为205.52 mg/L,酒精度为12.60%vol,总酯含量为1.47 g/L;DPPH、ABTS自由基清除率分别为42.21%、32.86%;酒样富含丙酸乙酯和乙酸戊酯,果香浓郁,清爽可口,具备酿造高品质葡萄酒的潜力。该研究为非酿酒酵母的开发及葡萄酒的品质改良提供菌种参考。
[1] WHELAN A P, SUTHERLAND W H F, MCCORMICK M P, et al. Effects of white and red wine on endothelial function in subjects with coronary artery disease[J]. Int Med J,2004,34(5):224-228.
[2] LIU P T, LU L, DUAN C Q, et al. The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Sci Technol,2016,71:356-363.
[3]刘沛通,许丹丹,许引虎,等.4株本土非酿酒酵母的发酵特性[J].食品科学,2021,42(14):86-93.
[4]VAN WYK N,GROSSMANN M,WENDLAND J,et al.The whiff of wine yeast innovation:Strategies for enhancing aroma production by yeast during wine fermentation[J].J Agr Food Chem,2019,67(49):13496-13505.
[5]尹雪林,龚丽娟,钟武,等.戴尔有孢圆酵母与酿酒酵母混合发酵对猕猴桃酒香气的影响[J].食品科学,2021,42(22):216-223.
[6]袁晓龙,边名鸿,刘茗铭,等.酿酒酵母与产香酵母混合发酵鸭梨酒工艺条件优化[J].食品与发酵工业,2020,46(6):184-190.
[7]金海炎,王丰园,鲁云风,等.混菌发酵猕猴桃果酒工艺条件优化及抗氧化性研究[J].食品与发酵工业,2022,48(3):177-185.
[8]LIU J,LIU M,YE P,et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast (S. cerevisiae,S. bayanus, S. uvarum) and T. delbrueckii[J]. Eur Food Res Technol,2020,246(4):807-820.
[9]冯炘,何凯翔,解玉红.葡萄中酵母菌的筛选及菌株鉴定[J].价值工程,2020,39(13):270-273.
[10]何晓丽,马成武,许引虎,等.非酿酒酵母对河西走廊黑比诺葡萄酒发酵品质的影响[J].酿酒科技,2021(5):112-116.
[11]李斌斌,杜展成,吴敏,等.冷浸渍处理对干红葡萄酒颜色品质及风味特征的影响[J].食品与机械,2019,35(12):179-184.
[12]BARNET J A,PENN R W,YARROW D.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:4-15.
[13]王晓昌.宁夏贺兰山东麓非酿酒酵母的分离鉴定与发酵特性研究[D].银川:宁夏大学,2017.
[14]何宏魁,李冬冬,刘国英,等.一种酿酒酵母菌在白酒生产中的强化应用[J].酿酒科技,2019(12):93-97.
[15]原苗苗.非酿酒酵母及其发酵温度对葡萄酒香气的影响[D].济南:齐鲁工业大学,2018.
[16]廖永红,沈晗,石文娟,等.产香酵母碳源利用及发酵产香特性初步研究[J].食品与发酵工业,2010,36(2):1-7.
[17]岳泰新.不同生态区酿酒葡萄与葡萄酒品质的研究[D].杨凌:西北农林科技大学,2015.
[18]林恋竹,赵谋明.反应时间对DPPH法、ABTS+法评价抗氧化性结果的影响[J].食品科学,2010,31(5):63-67.
[19]李勇.葡萄酒抗氧化活性测定方法研究[D].杨凌:西北农林科技大学,2009.
[20]叶林林.复合发酵红提葡萄酒工艺优化及其香气的研究[D].杭州:浙江农林大学,2019.
[21]袁丽.气相色谱法测定葡萄酒中多种香气成分及其含量分析[D].泸州:四川医科大学,2015.
[22]李晨.一株产香酵母的筛选、鉴定及其产香条件的优化研究[D].武汉:武汉轻工大学,2019.
[23]刘晓柱,赵湖冰,李银凤,等.一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J].食品与发酵工业,2020,46(8):97-104.
[24]韩志双,刘军,黄思敏,等.传统麸醋醋醅中一株产香酵母的筛选鉴定及生长特性研究[J].中国调味品,2013,38(10):41-45.
[25]杨辉,王婷婷,赵敏,等.非酿酒酵母发酵海红果酒的特性研究[J].陕西科技大学学报,2021,39(1):52-57.
[26]韦元琪,钱旭,雍晓雨,等.一株耐盐酵母的分离、鉴定及其生物学特性[J].生物加工过程,2018(6):1-7.
[27]雷蕾,郑海武,李正英,等.不同酿酒酵母发酵对干红葡萄酒品质的影响[J].中国酿造,2021,40(6):41-45.
[28]王春晓,俞俊竹,周文亚,等.非酿酒酵母属酵母的葡萄酒发酵应用研究进展[J].中国农业科学,2023,56(3):529-548.
[29] TAILLANDIER P, LAI Q P, JULIEN-ORTIZ A, et al. Interactions between Torulaspora delbrueckii and Saccharomyces cerevisiae in wine fermentation:Influence of inoculation and nitrogen content[J].World J Microb Biot,2014,30(7):1959-1967.
[30]尤雅,段长青,燕国梁.扁平云假丝酵母与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J].食品科学,2018,39(20):146-154.
[31] PARKER M,CAPONE D L,FRANCIS I L,et al.Aroma precursors in grapes and wine:Flavor release during wine production and consumption[J].J Agr Food Chem,2017,66(10):2281-2286.
[32]段丽丽,杨晓仪,唐菊莲,等.萨兹酒花对葡萄酒抗氧化活性的影响[J].食品科技,2019,44(4):89-94.
[33]南立军,杨荣,张瑛莉,等.石河子产区‘赤霞珠’‘美乐’葡萄酒品质差异研究[J].中外葡萄与葡萄酒,2018(4):65-69.
[34]姚瑶,张亚飞,刘晓燕,等.不同产区赤霞珠干红葡萄酒香气成分分析[J].中国酿造,2019,38(7):178-183.
[35]李曼祎,张亚萌,刘春凤,等.枸杞果酒发酵工艺优化及香气成分分析[J].安徽农业大学学报,2021,48(5):865-872.
[36]王静尧.高产酯非酿酒酵母筛选及在混菌发酵中的发酵特性研究[D].阿拉尔:塔里木大学,2023.
[37]邢家爱,于庆泉,李福东,等.混菌发酵对西拉葡萄酒香气品质的影响[J].食品研究与开发,2023,44(20):76-82.