大曲中微生物种类繁多,其中霉菌是浓香型白酒酿造中重要的产酯微生物之一[1-3]。微生物在浓香型白酒中通过生产酯化酶,将己酸(窖泥功能菌代谢)与乙醇(糟醅体系代谢)缩合生成呈主体香味的己酸乙酯[4-5]。通过筛选和利用代谢活力高的产酯化酶菌株进行发酵,可以提高酒糟己酸乙酯的生成率,进而达到增添白酒风味、优化白酒酒质、缩短发酵周期的目的[6]。目前,国内外的研究主要集中在对红曲霉(Monascus)[7-10]、根霉(Rhizopus)[11-12]和生香酵母[13-15]的分离筛选,产酶(生酯)条件的优化,酯化酶性质的研究及白酒应用上。众多研究表明,能产生酯化酶的微生物包括霉菌、酵母、细菌[2],来源不同的酯化酶其性质也有很大差别,且催化反应受反应介质和底物、产物的浓度等因素影响较大[16-19]。因此,探索高产酯化酶菌株的分离筛选及酯化酶活力的优化,可以极大地提高酯化酶产量,有针对性的让酯化酶技术更好的为浓香型白酒工业生产服务。
本研究从五粮液浓香型白酒大曲中分离、筛选产酯化酶活力较高的霉菌菌株,经形态学观察和18S rDNA序列分析对筛选菌株进行鉴定,并以酯化酶活力为响应值,通过单因素试验及Box-Behnken响应面试验优化该菌株的发酵条件,为其在提高大曲中酯化酶含量及提高浓香型白酒的优质率奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
五粮液浓香型白酒大曲样品:市售。
1.1.2 试剂
无水乙醇、MgSO4、FeSO4、NaCl(均为分析纯):成都市科隆化学品有限公司;环己烷、己酸、无水硫酸钠、氢氧化钠、K2HPO4、MnSO4(均为分析纯):上海麦克林生化有限公司;KCl(分析纯):成都金山化学试剂有限公司;可溶性淀粉(分析纯):天津科密欧化学试剂有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速提取试剂盒:北京酷来搏科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:葡萄糖2 g/L,琼脂2 g/L,淀粉20 g/L。
分离培养基[20]:蛋白胨10 g/L,琼脂25 g/L,氯化钠5 g/L,牛肉膏3 g/L、25%(V/V)乳化液(按体积比1∶9将三丁酸甘油酯和聚乙烯醇混合),自然pH。
液体发酵培养基[11]:MgSO40.5 g/L,K2HPO41 g/L,FeSO4 0.01 g/L,KCl 0.5 g/L,MnSO4 0.3 g/L,可溶性淀粉10 g/L,蛋白胨50 g/L,pH 5.5~6.5。
固体发酵培养基[21]:麸皮10 g,玉米粉1 g,豆粕2 g,(NH4)2SO4 0.5 g,蒸馏水10 mL,自然pH。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
YJ-840型超净工作台:苏信环境科技有限公司;LRH-150CL恒温培养箱:金城致杰实验仪器厂;Applied Biosystems测序仪、Applied Biosystems聚合酶链式反应(polymerase chain reaction,PCR)仪、LG4C6734电泳仪、HE-120电泳槽:北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 产酯化酶活力菌株的分离、纯化及筛选
将10 g研磨成细粉的大曲添加至100 mL无菌生理盐水中,加入玻璃珠打散,静置30 min。取1 mL上清液加入9 mL无菌生理盐水中,配制成10-2菌悬液。依次类推,采用生理盐水按10倍系列梯度稀释至10-7。依次吸取0.2 mL 10-3~10-7的梯度稀释液,涂布于分离培养基平板,36 ℃恒温培养72 h。观察菌落周围的透明圈大小,测量透明圈直径(D)与菌落直径(d),计算D/d值。选择D/d值较大且菌落直径较大的菌株进行纯化。将筛选菌株保藏于20%的甘油管中,置于-20 ℃冰箱中冷藏备用。
将分离菌株接种于液体发酵培养基,36 ℃、150 r/min培养5 d,发酵液经4 000 r/min离心20 min,去沉淀,上清液即为粗酶液,测定酯化酶活力,筛选高产酯化酶的菌株。
1.3.2 酯化酶活力的测定
参考黄丹等[22]的方法测定酯酶活力:分别称取环己烷10 mL、己酸6.25 mL、乙醇3.65 mL及0.2 mL粗酶液(所有试剂每500 mL加入30 g无水硫酸钠)于100 mL锥形瓶中,36 ℃密封进行酯化反应24 h,取0.5 mL上清液加入5 mL水,两滴酚酞,用0.05 mol/L NaOH滴定至终点。酶活力单位定义:在测定条件下每分钟消耗1 μmol己酸所需要的酶量为1个酶活力单位,U/mL。
1.3.3 菌种的鉴定
形态观察:将筛选菌株接种于PDA培养基,36 ℃条件下培养72 h,观察菌落的生长、颜色、表面形态、质地、边缘形状和高度等,并采用显微镜观察菌丝、孢子和子实体结构的形态。
分子生物学鉴定:选择菌落生长状况良好且纯种的平板,当菌丝长满培养基表面但并未产生孢子时,直接从平板上刮取菌丝,加入适量石英砂研磨,取研磨液分别稀释1倍、5倍和10倍。采用真菌基因组DNA快速提取试剂盒提取DNA。以其为模板,采用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对筛选菌株的ITS基因序列进行PCR扩增[22]。PCR扩增条件:98 ℃预变性3 min;98 ℃变性10 s,53 ℃退火10 s,72 ℃延伸10 s,共进行35个循环;72 ℃再延伸5 min。PCR扩增体系:T5 Mix 25 μL、上下游引物各1 μL、基因组DNA 1 μL、双蒸水(ddH2O)22 μL。将PCR扩增产物进行1%琼脂糖凝胶电泳检测及胶回收,委托成都肇科生物科技有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取同源关系较大的模式菌株的ITS基因序列,采用MEGA 7软件中的邻接(neighbor-joining,NJ)法构建系统发育树[23]。
1.3.4 筛选菌株产酯化酶发酵条件优化单因素试验
在1.3.1的基础上,采用单因素轮换法依次考察碳源(蔗糖、葡萄糖、玉米粉、可溶性淀粉)及其添加量(10 g/L、15 g/L、20 g/L、25 g/L)、氮源(黄豆粉、蛋白胨、酵母膏、尿素)及其添加量(40 g/L、50 g/L、60 g/L、70 g/L)对筛选菌株产酯化酶活力的影响。
确定最优碳源、氮源及其添加量后,分别考察发酵时间(3 d、5 d、7 d、9 d)、发酵温度(30 ℃、31 ℃、32 ℃、33 ℃、34 ℃、35 ℃、36 ℃、37 ℃)对筛选菌株产酯化酶活力的影响。
1.3.5 筛选菌株产酯化酶发酵条件优化Box-Behnken响应面试验
根据单因素试验结果,以蔗糖添加量(A)、尿素添加量(B)、发酵时间(C)、发酵温度(D)为自变量,以酯化酶活力(Y)作为响应值,采用Design-Expert 8.0软件设计4因素3水平的Box-Behnken响应面试验,试验因素与水平见表1。
表1 发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for fermentation conditions optimization
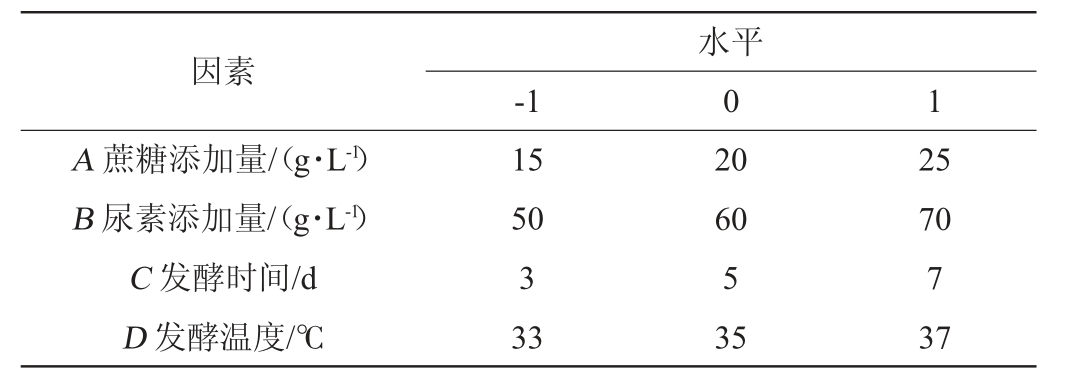
因素A 蔗糖添加量/(g·L-1)B 尿素添加量/(g·L-1)C 发酵时间/d D 发酵温度/℃-1水平0 1 15 50 3 33 20 60 5 35 25 70 7 37
1.3.6 数据处理
每个试验重复3次,结果用“平均值±标准差”表示。采用SPSS 26.0软件对结果进行单因素方差分析(one-way analysis of variance,ANOVA),采用Design-Expert 13.0进行响应面设计及分析,采用Origin 2018作图。
2 结果与分析
2.1 高产酯化酶活力菌种的分离及筛选
通过透明圈法初筛,共筛选得到6株透明圈较大的菌株,编号为B1~B6,计算其D/d值,并测定酯化酶活力,结果见表2。
表2 6株菌株的D/d值及酯化酶活力测定结果
Table 2 Determination results of D/d value and esterase activity of 6 strains
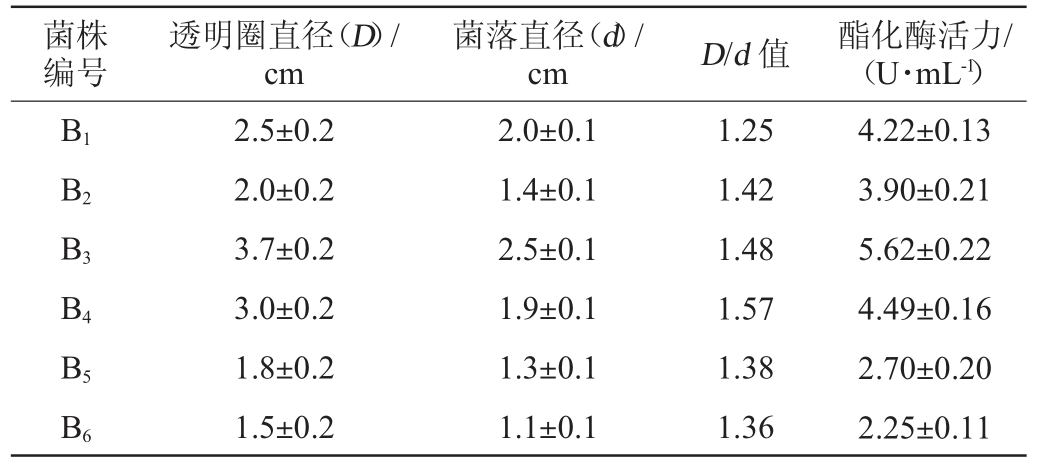
菌株编号透明圈直径(D)/cm菌落直径(d)/cm D/d 值 酯化酶活力/(U·mL-1)B1B2B3B4B5B6 2.5±0.2 2.0±0.2 3.7±0.2 3.0±0.2 1.8±0.2 1.5±0.2 2.0±0.1 1.4±0.1 2.5±0.1 1.9±0.1 1.3±0.1 1.1±0.1 1.25 1.42 1.48 1.57 1.38 1.36 4.22±0.13 3.90±0.21 5.62±0.22 4.49±0.16 2.70±0.20 2.25±0.11
由表2可知,6株菌株均具有产酯化酶的能力,其中菌株B3的D/d值较高,酯化酶活力最高,分别为1.48、5.62 U/mL,因此将其视为高产酯化酶活力的菌株。
2.2 菌株B3的鉴定
2.2.1 形态学观察
菌株B3在PDA培养基上培养3 d后的菌落及细胞形态见图1。由图1可知,菌株B3的菌落较大、质地疏松,呈灰白色;菌株具有足细胞,分生孢子梗极粗糙、较长,可达到1.5 mm。
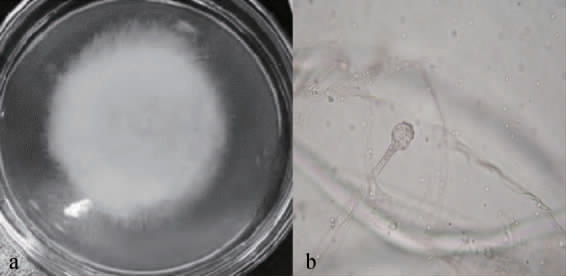
图1 菌株B3的菌落(a)及菌丝(b)形态
Fig. 1 Colony (a) and mycelial (b) morphology of strain B3
2.2.2 分子生物学鉴定
基于ITS基因序列构建菌株B3的系统进化树,结果见图2。由图2可知,菌株B3与总状横梗霉(Lichtheimia ramosa)(GQ342847)聚于一支,亲缘关系最近,结合菌株B3的形态特征,最终鉴定菌株B3为总状横梗霉(Lichtheimia ramosa)。
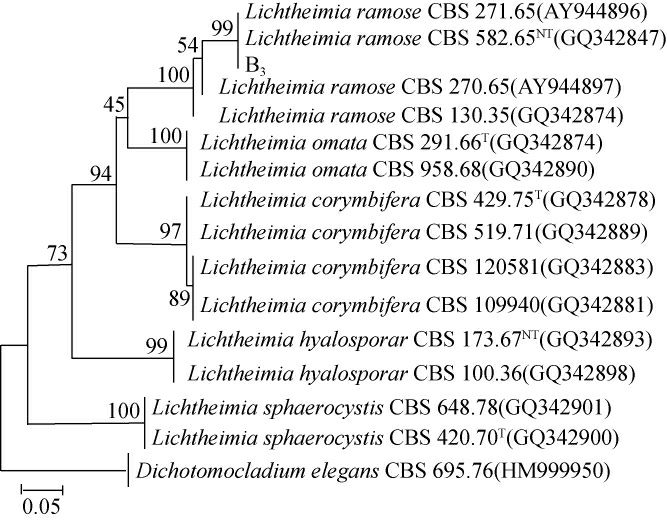
图2 基于ITS基因序列菌株B3的系统进化树
Fig. 2 Phylogenetic tree of strain B3 based on ITS gene sequence
2.3 总状横梗霉B3的产酯化酶发酵条件优化
2.3.1 不同碳源及其添加量对酶化酶活力的影响
碳是构成生物体细胞结构和代谢产物中碳架的重要营养物质,也为生物体提供重要的能源物质[23]。有研究表明,微生物对碳源的利用具有选择性[23],因此,考察不同碳源及其添加量对菌株B3产酯化酶的影响,结果见图3。
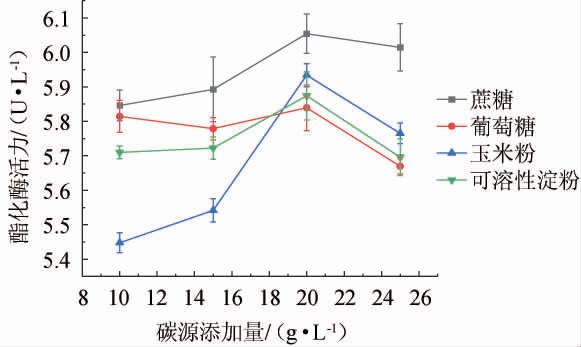
图3 不同碳源及其添加量对总状横梗霉B3产酯化酶的影响
Fig. 3 Effect of different carbon sources and their addition on the production of esterase by Lichtheimia ramose B3
由图3可知,4种碳源中蔗糖作为碳源时,酯化酶活力最高,且随着蔗糖添加量的升高,酯化酶活力呈先升高后下降的趋势,分析原因可能是碳源浓度过低抑制微生物生长,碳源浓度过高,导致碳氮比失衡,同样抑制了菌株的生长代谢和产酶[24]。许春艳等[4]研究多种碳源对红曲霉产酯化酶活力的影响,发现蔗糖作为碳源时酶活最高,且酯化酶酶活随着蔗糖添加量的升高呈现先升高后下降趋势,这与本研究结果一致。当蔗糖添加量为20 g/L时,酯化酶活力最高,达到6.05 U/mL。因此,确定最佳碳源为蔗糖,最佳添加量为20 g/L。
2.3.2 不同氮源及其添加量对酶化酶活力的影响
氮源为微生物提供用于合成细胞所需的含氮物质:如核酸、蛋白质等,足够的氮源有利于菌体的生长以及产酶[25]。因此,考察不同氮源及其添加量对菌株B3产酯化酶的影响,结果见图4。
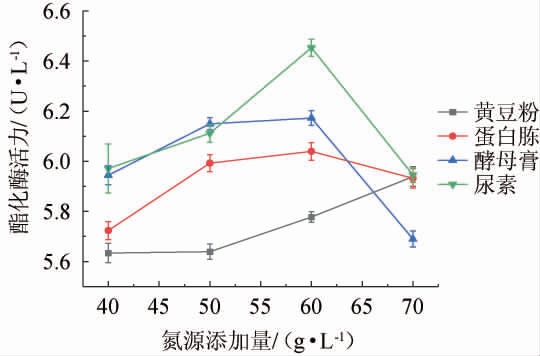
图4 不同氮源及其添加量对总状横梗霉B3产酯化酶的影响
Fig. 4 Effect of different nitrogen sources and their additions on the production of esterase by Lichtheimia ramose B3
由图4可知,4种氮源中尿素作为氮源时,酯化酶活力最高,且随着尿素添加量的增加呈先升高后下降的趋势,分析原因可能是低于或高于最适碳氮比,均会抑制总状横梗霉产酯化酶活力[26]。王晓丹等[21]研究发现,紫色红曲霉(Monascuspurpureus)在以蛋白胨为氮源的培养基中产酯化酶活力比尿素高,这可能是因为总状横梗霉比紫色红曲霉分解利用尿素的能力更强。当尿素添加量为60 g/L时,酯化酶活力达到最高,为6.45 U/mL。因此,确定最佳尿素添加量为60 g/L。
2.3.3 不同发酵时间对酶化酶活力的影响
液体发酵过程中,发酵时间对菌体的生成与产酶有着显著的影响[27]。因此,考察不同发酵时间对菌株B3产酯化酶的影响,结果见图5。
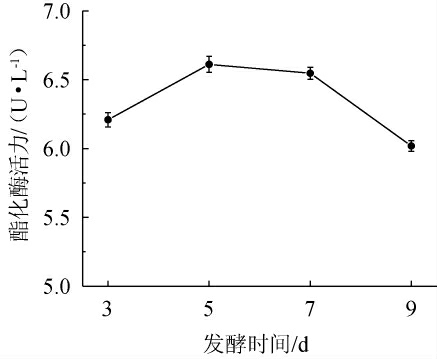
图5 不同发酵时间对总状横梗霉B3产酯化酶的影响
Fig. 5 Effect of different fermentation time on the production of esterase by Lichtheimia ramose B3
由图5可知,随着发酵时间的延长,酯化酶活力呈先升高后下降的趋势。分析原因可能是,发酵时间过短,横梗霉生长速度慢,产酯化酶少;发酵时间过长,发酵培养基中营养物质减少,霉菌衰老、自溶及自噬,进而影响产酯酶。当发酵时间为5 d时,酯化酶活力最高,为6.61 U/mL,因此确定5 d为最佳发酵时间。该结果与颜丽[27]研究发酵时间对华根酶产酯化酶活力的影响结果一致。
2.3.4 不同发酵温度对酶化酶活力的影响
温度是影响产酶的重要因素之一,细胞代谢与产物的合成都需要酶的催化来完成,只有当温度适于菌体生长时,催化反应才能正常进行[28]。因此,考察不同发酵温度对菌株B3产酯化酶的影响,结果见图6。
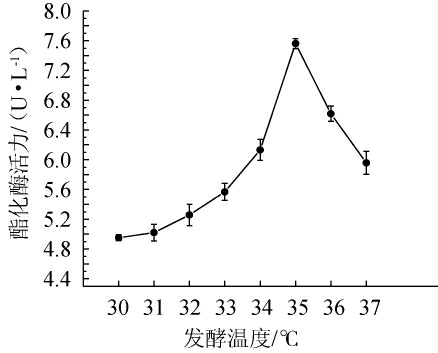
图6 不同发酵温度对总状横梗霉B3产酯化酶的影响
Fig. 6 Effect of different fermentation temperatures on esterase production by Lichtheimia ramose B3
由图6可知,随着发酵温度的升高,酯化酶活力呈先升高后下降的趋势,当发酵温度为35 ℃时,酯化酶活力最高,为7.46 U/mL,因此,确定最佳发酵温度为35 ℃。宫若楠[29]研究发现,衡水老白干大曲产酯化酶霉菌在发酵温度为36 ℃时酯化酶活力最高;滕巍等[30]通过优化汾酒大曲产酯酶霉菌固体发酵培养基得到最佳发酵温度为36 ℃,与本研究结果相近,说明不同菌体产酯化酶的最适温度略有差异。
2.4 Box-Behnken响应面试验
2.4.1 Box-Behnken试验设计与分析
在单因素试验基础上,以蔗糖添加量(A)、尿素添加量(B)、发酵时间(C)、发酵温度(D)为考察因素,以酯化酶活力(Y)作为响应值,采用Design-Expert 8.0软件设计Box-Behnken响应面试验,试验设计及结果见表3,方差分析见表4。
表3 Box-Benhnken试验设计及结果
Table 3 Design and results of Box-Benhnken tests
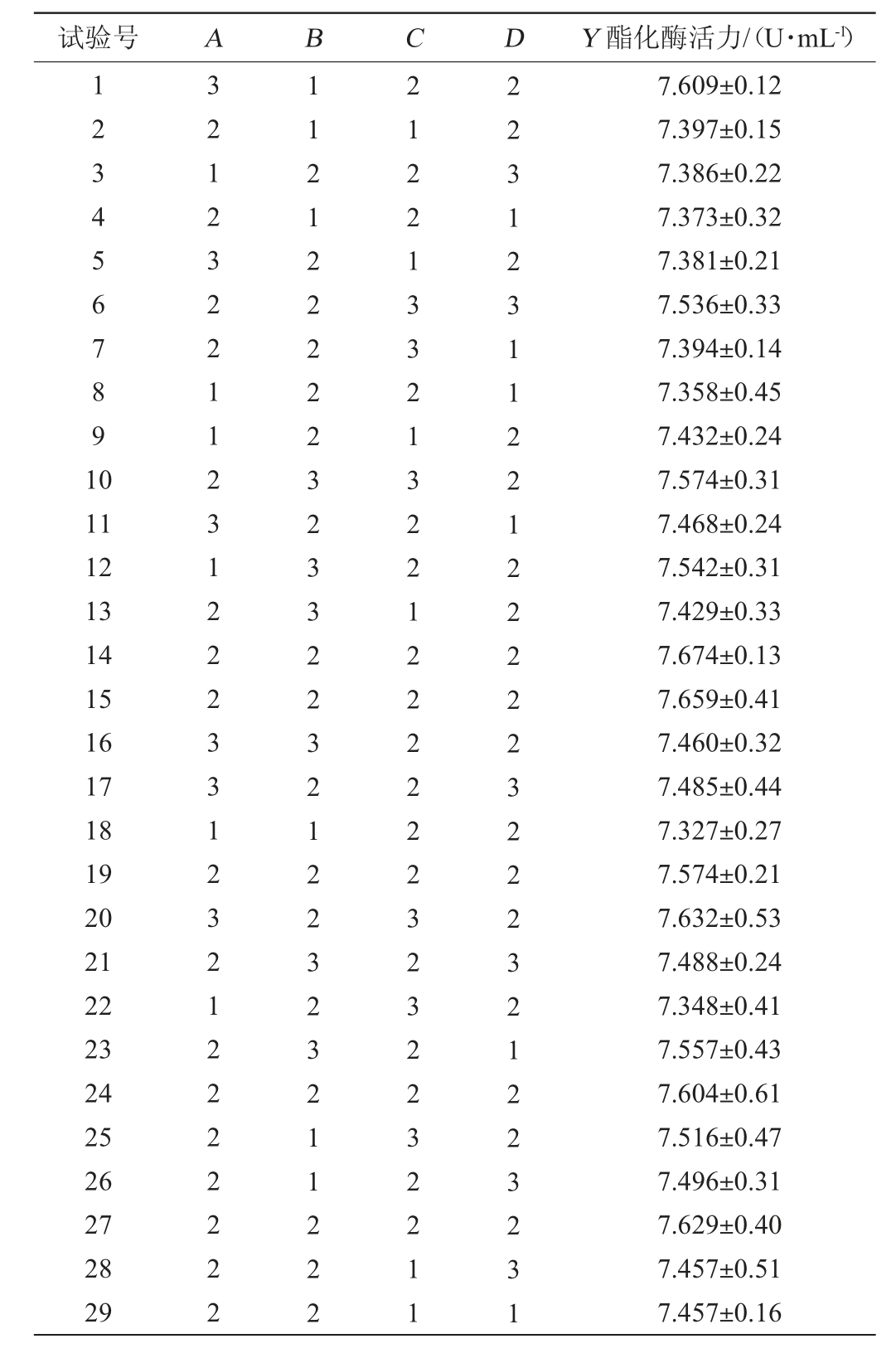
试验号 A B C D Y 酯化酶活力/(U·mL-1)1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 32123221123122233123212222222 11212222232332232122323211222 21221332132212222223232232211 22312311221222223222321223231 7.609±0.12 7.397±0.15 7.386±0.22 7.373±0.32 7.381±0.21 7.536±0.33 7.394±0.14 7.358±0.45 7.432±0.24 7.574±0.31 7.468±0.24 7.542±0.31 7.429±0.33 7.674±0.13 7.659±0.41 7.460±0.32 7.485±0.44 7.327±0.27 7.574±0.21 7.632±0.53 7.488±0.24 7.348±0.41 7.557±0.43 7.604±0.61 7.516±0.47 7.496±0.31 7.629±0.40 7.457±0.51 7.457±0.16
表4 回归模型方差分析
Table 4 Variance analysis of regression model
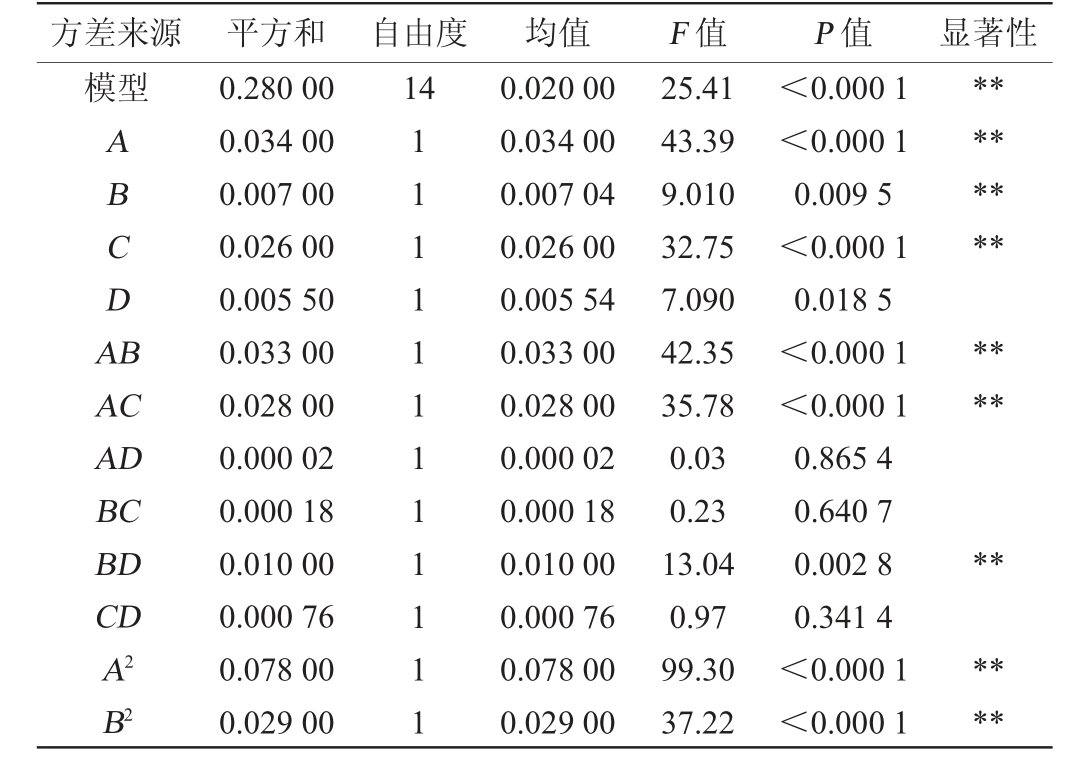
方差来源 平方和 自由度 均值 F 值 P 值 显著性模型14 ABCDA B********AC AD BC BD CD A2 B2 0.280 00 0.034 00 0.007 00 0.026 00 0.005 50 0.033 00 0.028 00 0.000 02 0.000 18 0.010 00 0.000 76 0.078 00 0.029 00 111111111111 0.020 00 0.034 00 0.007 04 0.026 00 0.005 54 0.033 00 0.028 00 0.000 02 0.000 18 0.010 00 0.000 76 0.078 00 0.029 00 25.41 43.39 9.010 32.75 7.090 42.35 35.78 0.03 0.23 13.04 0.97 99.30 37.22<0.000 1<0.000 1 0.009 5<0.000 1 0.018 5<0.000 1<0.000 1 0.865 4 0.640 7 0.002 8 0.341 4<0.000 1<0.000 1**********
续表
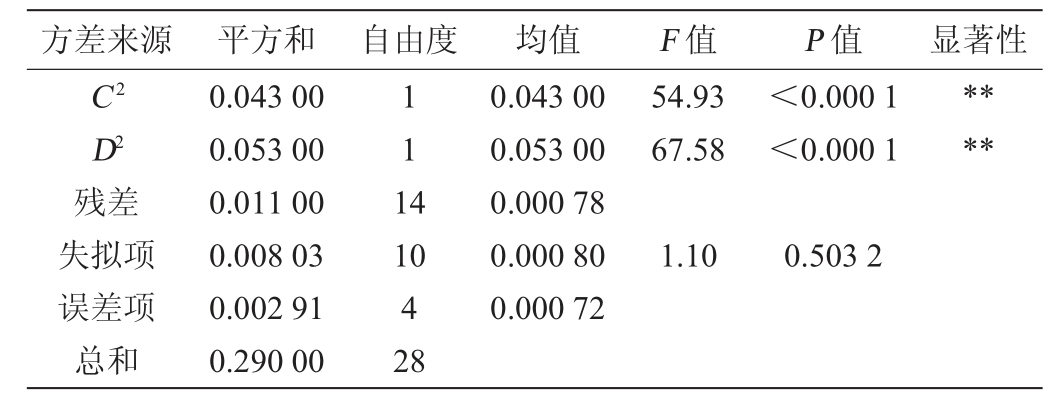
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均值 F 值 P 值 显著性C2 D2残差失拟项误差项总和0.043 00 0.053 00 0.011 00 0.008 03 0.002 91 0.290 00 111 4 54.93 67.58<0.000 1<0.000 1****10 4 28 0.043 00 0.053 00 0.000 78 0.000 80 0.000 72 1.10 0.503 2
采用Design-Expert13.0软件对表3数据进行多元二次回归拟合,得到酯化酶活力(Y)对蔗糖添加量(A)、尿素添加量(B)、发酵时间(C)、发酵温度(D)的多元二次回归方程为:Y=7.64-0.054A+0.024B+0.046C-0.021D-0.091AB+0.084AC-0.001 906AD+0.006 667BC-0.04BD+0.011CD-0.11A2-0.067B2-0.081C2-0.061D2。
由表4可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明模型可靠。决定系数R2=0.957 5,调整决定系数R2adj=0.915 0,表明模型与试验具有较好的拟合性,试验误差较小,该模型对酯化酶活力的预测准确性较高。由表4亦可知,一次项A、B、C、交互项AB、AC、BD及二次项A2、B2、C2、D2对结果影响极显著(P<0.05),其他项对结果影响不显著(P>0.05)。
2.4.2 各因素间交互作用的等高线和响应面图
采用Design-Expert 13.0软件绘制蔗糖添加量与尿素添加量、蔗糖添加量与发酵时间、尿素添加量与发酵温度间交互作用对酯化酶活力影响的响应曲面及等高线,结果见图7。由图7可知,响应面呈凸形,存在最高点,等高线为椭圆,说明AC、AB、BD间交互作用均比较显著,这与方差分析的结果一致。
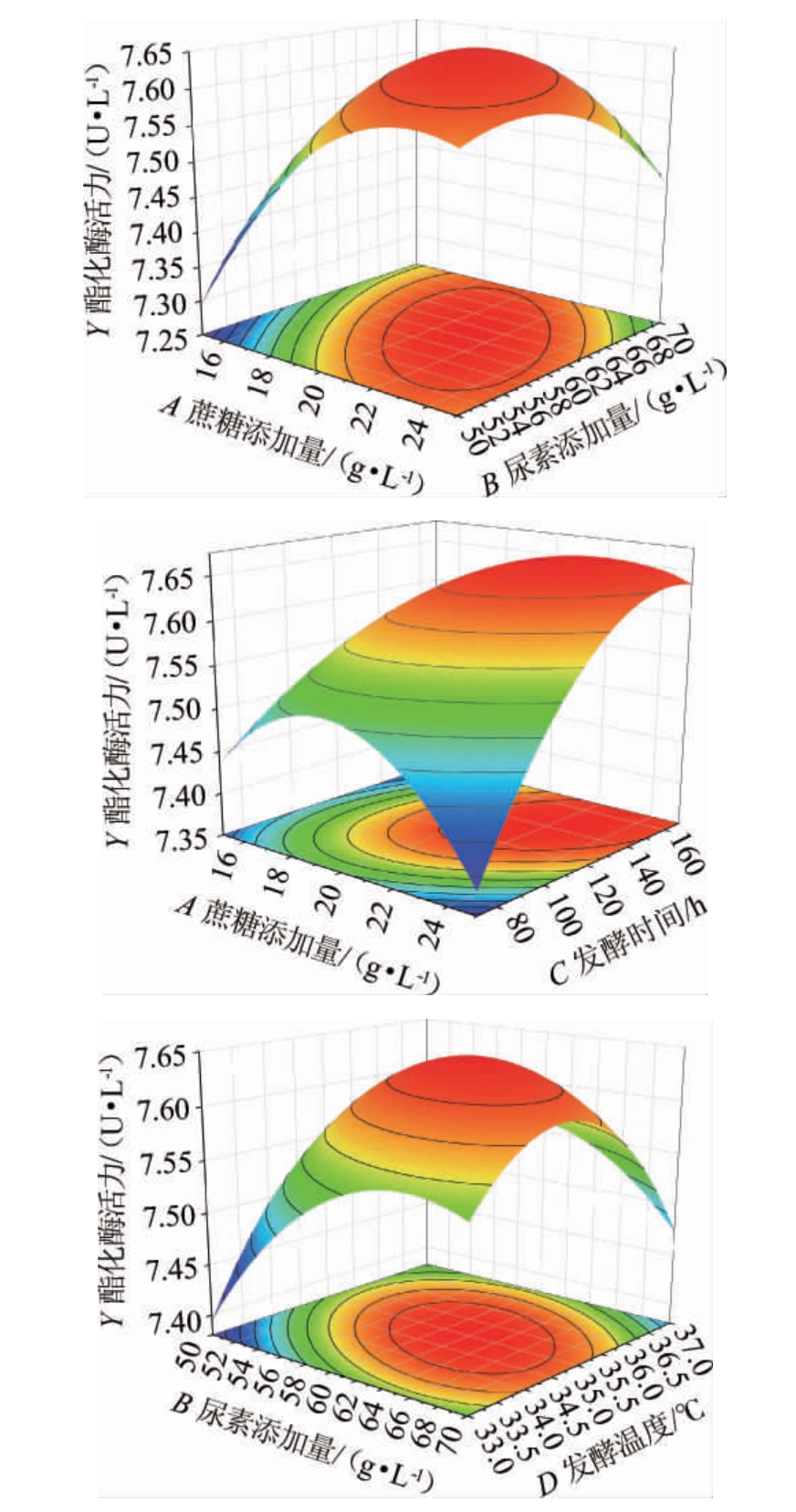
图7 不同因素间交互作用对酯化酶活力影响的响应面及等高线
Fig. 7 Response surface plots and contour lines of effect of interaction between each factors on esterase activity
2.4.3 优化结果及验证试验
采用Design-Expert 13.0软件对模型进行求解,得到最优发酵条件为:蔗糖添加量22.00 g/L、尿素添加量58.00 g/L、发酵时间6.08 d、发酵温度35.20 ℃。在此条件下,酯化酶活力预测值为7.667 U/mL。为便于实际操作,将最优条件修订为蔗糖添加量22.0 g/L、尿素添加量58.00 g/L、时间6 d、发酵温度为35 ℃,在此条件下进行3次验证试验,得到酯化酶活力实际值为7.673 U/mL,试验值与模型预测值接近,相对误差较小,表明该模型能较好地预测试验结果,模型可靠。
有研究表明,刘新宇等[31]从汾酒分离到2株红曲霉,在固态发酵条件下测得酯化酶酶活为2.46 U/mL;黄丹等[11]从浓香型大曲中分离得到的少根根霉(Rhizopus arrhizus)产酯化酶酶活最高,达7.91 U/mL;侯小歌等[32]从宋河大曲复筛出地衣芽孢杆菌(Bacillus licheniformis),通过正交试验优化发酵条件后,该菌株的酯化酶活力达到22.83 U/mL;刘延波等[33]在张弓老酒大曲中筛选得到一株表皮葡萄球菌(Staphylococcus epidermidis),通过单因素及响应面试验对其产酶条件优化后,酯化酶活力达到最高,为83.33 U/mL。本研究从五粮液浓香型白酒大曲中分离鉴定的总状横梗霉B3产酶能力处于中等水平,可进一步研究以提高其产酯化酶活力。
3 结论
从五粮液浓香型白酒大曲中筛选得到一株高产酯化酶的菌株B3,通过形态观察及分子生物学技术鉴定该菌株为总状横梗霉(Lichtheimia ramosa)。通过单因素试验及响应面试验优化得到总状横梗霉B3的最优发酵培养基及条件为蔗糖添加量22 g/L、尿素添加量58 g/L、时间6 d、发酵温度为35 ℃,在此条件下,酯化酶活力可达7.67 U/mL,是优化前(5.62 U/mL)的1.3倍,有利于进一步提高浓香型白酒的品质。
[1]罗小叶,邱树毅,王晓丹.微生物发酵产酯化酶在浓香型白酒品质提升中研究进展[J].中国酿造,2019,38(8):6-8.
[2]梁栩煜,钱敏,白卫东,等.白酒酿造过程中的微生物研究进展[J].中国酿造,2020,39(7):11-15.
[3]刘绪兴,程鹏,陈才,等.真菌在大曲酒生产中的应用研究[J].酿酒科技,2020(7):50-57.
[4]许春艳,孙宝国,徐友强,等.合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化[J].中国食品学报,2020,20(5):138-147.
[5]FAN G S,LIU P X,CHANG X,et al.Isolation and identification of a highyield ethyl caproate-producing yeast from daqu and optimization of its fermentation[J].Front Microbiol,2021,12:663744.
[6]黄丹,方春玉,尚志超,等.一株酯化酶霉菌的分离、鉴定及代谢产物特征[J].中国酿造,2010,29(6):62-64.
[7]刘欢欢,杨帆,李贞景,等.高产酯化酶红曲菌的筛选、鉴定及酶学性质研究[J].中国酿造,2019,38(5):49-53.
[8]郭晋田,荆旭,张丽,等.响应面法优化红曲霉高产酯化酶发酵工艺[J].中国酿造,2020,39(2):73-77.
[9]赵志军,赵婷,刘延波,等.酯化型红曲菌复合诱变选育及其固态发酵条件优化[J].食品工业科技,2021,42(2):76-82.
[10]CAO Z,SHAOLIANG L I,XUESI L I,et al.Effect of Different Exogenous Factors on the Quality of Daqu in Songhe Daqu[J].Liquor Making,2018(8):80-84.
[11]黄丹,储玉龙,尚志超,等.大曲酯化酶根霉菌的分离及产酶条件研究[J].食品与发酵科技,2010,46(3):30-32.
[12]刘雪,杨爱华,张学梅,等.华根霉生物酶法合成己酸乙酯条件的研究[J].酿酒科技,2017(2):57-60.
[13]秦立芹,殷欢,成柳洁,等.一株高产己酸乙酯酵母菌株的筛选、鉴定及发酵条件优化[J].食品与发酵工业,2022,48(1):55-61.
[14]赵志军,王瑞卿,刘延波,等.酿酒糟醅中生香酵母的筛选及培养条件[J].食品与生物技术学报,2020,39(9):61-67.
[15]周森,赵卫鹏,胡佳音,等.生香酵母在二锅头酒酿造过程中的应用[J].酿酒科技,2019(11):91-96,101.
[16]曹新志,任林生,肖梦月,等.一种从浓香型大曲中分离纯化酯化酶的方法:CN110628744A[P].2019-12-31.
[17]ZHANG W X,WU Z Y,ZHANG Q S.Combination of newly developed high quality Fuqu with traditional Daqu for Luzhou-flavor liquor brewing[J].World J Microb Biot,2009,25(10):1721-1726.
[18]任林生,曹新志,熊俐,等.浓香型大曲中酯化酶提取工艺的研究[J].酿酒科技,2015(5):15-20.
[19]HUANG Y G,WU Q,XU Y.Isolation and identification of a black Aspergillus strain and the effect of its novel protease on the aroma of Moutaiflavoured liquor[J].J I Brewing,2014,120(3):268-276.
[20]龚虎程,王宇,罗静,等.窖泥中酯化菌的筛选鉴定及协同发酵条件优化[J].中国酿造,2023,42(12):81-86.
[21]王晓丹,李付丽,胥思霞,等.一株产酯化酶菌株的分离鉴定及产酶[J].酿酒,2014,41(5):42-47.
[22]黄丹,方春玉,储玉龙,等.一株酯化酶细菌的分离、鉴定及代谢产物特征[J].四川理工学院学报(自然科学版),2010,23(3):321-323,327.
[23]MANTER D K,VIVANCO J M.Use of the ITS primers,ITS1F and ITS4,to characterize fungal abundance and diversity in mixed-template samples by QPCR and length heterogeneity analysis[J].J Microbiol Methods,2007,71(1):7-14.
[24]雷学俊,张霞,刘多涛,等.包包曲及制曲环境中可培养霉菌的分离与鉴定[J].酿酒科技,2019(12):17-22.
[25]张聪芝,葛向阳,张伟国.添加外源物质对红曲霉固态发酵产酯化酶的影响[J].食品与生物技术学报,2012,31(11):1221-1225.
[26]徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.
[27]颜丽.高活力酯化菌株的筛选与优化研究[D].济南:齐鲁工业大学,2020.
[28]徐惠东,尤扬,游颖欣,等.一种高耐热乳糖酶的异源表达、固定化及酶学性质研究[J/OL].食品与发酵工业,1-11[2024-01-29].https://doi.org/10.13995/j.cnki.11-1802/ts.037932.
[29]宫若楠.衡水老白干大曲中产酯化酶霉菌的筛选及其特性研究[D].石家庄:河北科技大学,2018.
[30]滕巍,李国莹,刘小波,等.大曲中产酯化酶菌株的分离鉴定及固体发酵工艺优化[J].食品与生物技术学报,2016,35(9):971-977.
[31]刘新宇,赵景龙,任美斌,等.红曲霉的分离纯化及酯化酶活性研究[J].酿酒科技,2014(6):42-46.
[32]侯小歌,张杰,孙忠科,等.大曲产酯化酶芽孢菌的分离鉴定及其发酵条件优化研究[J].轻工学报,2018,33(4):13-20.
[33]刘延波,唐艳彦,赵志军,等.张弓老酒大曲中高产酯化酶细菌的分离筛选及产酶条件优化[J].甘肃农业大学学报,2021,56(2):150-159.