微生物多糖是细菌[1]、真菌[2]、酵母菌等微生物在生长和代谢过程中产生的多糖聚合物,也称内生菌多糖,对自身具有保护作用。内生菌多糖根据在细胞内的位置,可分为胞内多糖、胞壁多糖[3]和胞外多糖(extracellular polysaccharide,EPS)。其中,内生菌胞外多糖[4]是在生长代谢过程中分泌到细胞壁[5]外常渗于培养基的一类糖类化合物。与胞内多糖相比,胞外多糖在组成和结构上有很大差异,并且具有不同的功能特性。因此内生菌胞外多糖产量的提高和功能的探索让其具有较高的研究价值和工业应用前景。
近年来,花椒被公认为是研究生物活性化合物的很有吸引力的材料,包括酰胺、挥发油、生物碱和多糖类化合物[6]。尤其多糖类化合物显示出显著的药理活性。多糖具有提高免疫力、抗病毒及抗癌、降血糖[7]等重要作用。因此它引起了营养学、医学、食品科学等领域研究人员的关注。基于某些内生菌能产生和其共生植物相同或相似生理活性物质的特点,近年来对药用植物内生菌的研究十分活跃。利用内生菌,实现花椒多糖的微生物发酵体外培养,则可使花椒多糖的工业化生产不受植物资源的限制,并可防止花椒资源的日益短缺[8]。
生物体在新陈代谢过程中会产生自由基[9]。国内外关于微生物胞外多糖的抗氧化性能的报道较多。HU X等[10]研究发现,内生真菌Talaromyces purpureogenus的胞外多糖具有良好抗氧化性;蒋光阳等[11]研究发现,乳酸菌胞外多糖对1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS)自由基和羟自由基均具有一定的清除能力;王艳等[12]从发酵乳杆菌(Lactobacillus fermentium)TG4-1-1分离的EPS具有作为天然抗氧化剂或功能性食品添加剂的巨大潜力。目前,胞外多糖的研究大多集中在乳酸菌[13]上,但其产糖量相对较低,极大地限制了其应用和发展[14]。假单胞菌是自然界广泛存在的微生物菌群,黄褐假单胞菌(Pseudomonas fulva)是第四类病原微生物[15],通常不会引起人类或动物疾病的微生物。此外研究表明,大多数假单胞菌都能够产生胞外多糖,但目前有关于黄褐假单胞菌产EPS的研究较少。
前期试验基于对从花椒叶中自主分离、筛选和鉴定的一株菌株黄褐假单胞菌(Pseudomonas fulva)Y11的研究发现,该菌株能够产生胞外多糖,本研究探究了该菌的最佳产胞外多糖条件以及胞外多糖的抗氧化性能,旨在为胞外多糖的工业化生产、以及花椒内生菌代谢物的进一步开发及利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
黄褐假单胞菌(Pseudomonas fulva)Y11:由大连工业大学东山采摘的花椒叶中经自主筛选得到的内生菌株。
1.1.2 试剂
果糖、乳糖、葡萄糖、麦芽糖、蔗糖、尿素、硫酸铵、磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钙、氯化镁、氯化钾、(均为分析纯):天津市科密欧化学试剂有限公司;木糖(分析纯):上海伊卡生物技术有限公司;蛋白胨、胰蛋白胨、大豆蛋白胨、牛肉膏、酵母浸粉(均为生化试剂):北京奥博星生物技术有限公司。
1.1.3 培养基
发酵液体培养基:葡萄糖20 g/L,牛肉膏5 g/L,NaCl 5 g/L,蛋白胨10 g/L,K2HPO4 1 g/L,KH2PO4 0.5 g/L,MgSO4 1 g/L,MnSO4 0.5 g/L,pH 7.2~7.4。121 ℃高压蒸汽灭菌30 min。固体培养基加入琼脂20 g。
1.2 仪器与设备
SW-CJ-2FD型超净工作台:苏州安泰空气技术有限公司;TGL-16M高速冷冻离心机:湖南湘仪离心机仪器有限公司;SHP-150型生化培养箱:上海森信实验仪器有限公司;岛津UV-2600紫外可见分光光度计:岛津仪器(苏州)有限公司;ZHWY-211B型恒温冷冻摇床:上海智诚分析仪器制造有限公司。
1.3 方法
1.3.1 发酵液的制备
从固体培养基中挑取菌株Y11,接种至发酵液体培养基中,28 ℃、160 r/min培养48 h,作为种子液。并将种子液OD600nm值调至1.00±0.05后以4%(V/V)的接种量接种到装液量100 mL/250 mL的发酵液体培养基中,在28 ℃、160 r/min条件下发酵72 h。
1.3.2 多糖含量的测定
多糖含量在李慧颖[16]报道的苯酚硫酸法基础上进行一定修改后测定。称取无水葡萄糖粉末10 mg,去离子水稀释定容至10 mL,即为1 mg/mL。使用去离子水将葡萄糖标准溶液稀释为0、0.02 mg/mL、0.04 mg/mL、0.06 mg/mL、0.08 mg/mL、0.10 mg/mL。取上述不同质量浓度的葡萄糖标准溶液各1 mL,分别加入0.5 mL 6%的苯酚溶液和2.5 mL浓硫酸,摇匀静置30 min,于波长490 nm处测定吸光度值,以葡萄糖标准溶液质量浓度为x轴,吸光度值为y轴,绘制标准曲线,得到标准曲线回归方程为y=2.11x+0.002 3,R2=0.999 5。根据标准曲线方程计算样品中的多糖含量。
1.3.3 黄褐假单胞菌Y11生长曲线及其产胞外多糖曲线绘制
按照1.3.1的方法制备黄褐假单胞菌Y11种子液,向发酵液培养基中注入4%接种量的种子液,28 ℃、160 r/min条件下培养,每隔4 h测定OD600nm值,以去离子水为空白对照。以发酵时间为横坐标,以OD600nm值为纵坐标绘制菌株生长曲线。黄褐假单胞菌Y11胞外多糖产量按照1.3.2每隔24 h进行测定。以发酵时间为横坐标,胞外多糖产量为纵坐标,绘制该菌株的胞外多糖产量曲线。
1.3.4 单因素试验
根据1.1.3发酵液体培养基及1.3.1发酵液制备为基础条件,改变单一变量,分别考察碳源(葡萄糖、果糖、木糖、乳糖、麦芽糖、蔗糖)和碳源添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)、氮源(大豆蛋白胨、蛋白胨、胰蛋白胨、尿素、硫酸铵、酵母抽提物)及氮源添加量(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L)、无机盐(磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钙、氯化镁、氯化钾)及无机盐添加量(2 g/L、4 g/L、6 g/L、8 g/L、10 g/L)、pH(5.0、6.0、7.0、8.0、9.0)、发酵时间(1 d、2 d、3 d、4 d、5 d)、转速(120 r/min、140 r/min、160 r/min、180 r/min、200 r/min)、发酵温度(20 ℃、24 ℃、28 ℃、32 ℃、36 ℃)、接种量(2%、4%、6%、8%、10%)对黄褐假单胞菌Y11胞外多糖产量的影响。
1.3.5 Plackett-Burman设计
采用Placket-Burman(PB)试验设计检验筛选显著影响因素。在单因素试验基础上,利用Design-Expert 13软件,考察不同碳源添加量、氮源添加量、无机盐添加量、pH、发酵时间、发酵速度、发酵温度、接种量8个因素对胞外多糖产量的影响,PB试验因素及水平见表1。
表1 黄褐假单胞菌产胞外多糖发酵条件优化Placket-Burman试验设计因素与水平
Table 1 Factors and levels of Placket-Burman experiments for fermentation conditions optimization of extracellular polysaccharide production by Pseudomonas syringae
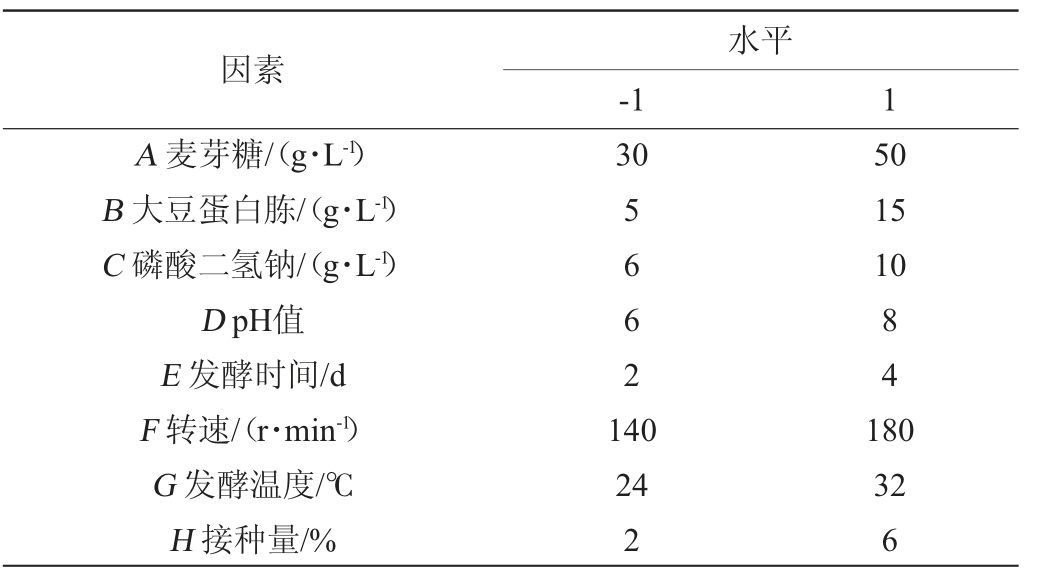
因素A 麦芽糖/(g·L-1)B 大豆蛋白胨/(g·L-1)C 磷酸二氢钠/(g·L-1)D pH值E 发酵时间/d F 转速/(r·min-1)G 发酵温度/℃H 接种量/%水平-1 1 30 5662 50 15 10 84 140 24 2 180 32 6
1.3.6 最陡爬坡试验
根据Placket-Burman试验结果,选择对胞外多糖产量具有显著性影响的因素,利用最陡爬坡试验确定响应面试验中心点。
1.3.7 胞外多糖发酵条件优化响应面试验设计
在Plackett-Burman设计的基础上,采用Design-Expert 13软件进行响应面设计,根据3个显著因素:麦芽糖添加量(A)、大豆蛋白胨添加量(B)、磷酸二氢钠添加量(C)设计3因素3水平的测试组合,以研究因素变化对胞外多糖产量的影响,Box-Behnken试验因素及水平见表2。
表2 Box-Behnken试验设计因素及水平
Table 2 Factors and levels of Box-Behnken experiments design

水平 A 麦芽糖添加量/(g·L-1)C 磷酸二氢钠添加量/(g·L-1)-1 B 大豆蛋白胨添加量/(g·L-1)0 1 30 40 50 5 10 15 6 8 1 0
1.3.8 胞外多糖抗氧化性评价
(1)DPPH自由基清除率测定
参照WANG Q F等[17]的试验方法稍作修改。将2 mL DPPH-乙醇溶液(4×10-3mol/L)与2 mL测试的胞外多糖或不同质量浓度(0、0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL)的抗坏血酸在试管中混合。将混合物避光反应30 min,在波长517 nm处测量混合物的吸光度值。按公式(1)中计算DPPH自由基清除率。
(2)ABTS自由基清除率测定
参照WANG W N等[18]的试验方法稍作修改。将等体积的7.4 mmol/L ABTS溶液和2.6 mmol/L K2S2O8混合并在黑暗中放置12 h。将混合物用pH 7.4的磷酸盐缓冲液稀释,使其在波长734 nm处的吸光度值为0.70±0.02。将不同质量浓度(0、0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL)的样品(0.2 mL)加入0.8 mL ABTS溶液中,37 ℃避光振荡15 min,在波长734 nm处测量吸光度值。按式(2)计算ABTS自由基清除率。
(3)羟自由基自由基清除率测定
参照HAO L M等[19]的试验方法稍作修改。首先将1 mL不同质量浓度(0、0.5mg/mL、1.0mg/mL、1.5mg/mL、2.0mg/mL、2.5 mg/mL)的胞外多糖或抗坏血酸加入10 mL试管中,然后加入1 mL FeSO4(9×10-3 mol/L)转移至溶液中混匀;之后加入1 mL H2O2(8.8×10-3 mol/L)、1 mL水杨酸-乙醇溶液(9×10-3 mol/L)并充分混合。然后将混合物置于37 ℃水浴1 h。以蒸馏水为空白,在波长510 nm处测量混合物的吸光度值。按式(3)计算羟自由基清除率。
(4)超氧阴离子自由基清除率测定
参照文献[20]的方法取0.05 mol/L Tris-HCl缓冲液(pH 8.2)5 mL,置于25 ℃水浴中预热20 min,加入4 mL不同质量浓度(0、0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL)的胞外多糖,于25 ℃水浴中预热20 min,然后在25 ℃水浴中加入3 mmol/L预热20 min的邻苯三酚溶液1 mL,混匀,在25 ℃水浴中准确反应5 min,加10 mol/L HCl 1 mL终止反应,测定波长320 nm处的吸光度值,空白对照组用等体积蒸馏水代替样品。每个样品做3个平行样品,取平均值。按式(4)计算超氧阴离子自由基清除率。
1.3.9 数据统计分析
所有试验设置3个平行,根据试验数据得到结果以“平均值±标准差”来表示。采用SPSS26.0软件进行差异显著性分析,采用Origin 2021软件进行绘图,Plackett-Burman设计与响应面试验采用Design Expert 13软件进行设计和分析[21]。
2 结果与分析
2.1 黄褐假单胞菌Y11生长曲线及其产胞外多糖曲线
黄褐假单胞菌Y11生长曲线及产胞外多糖曲线见图1。
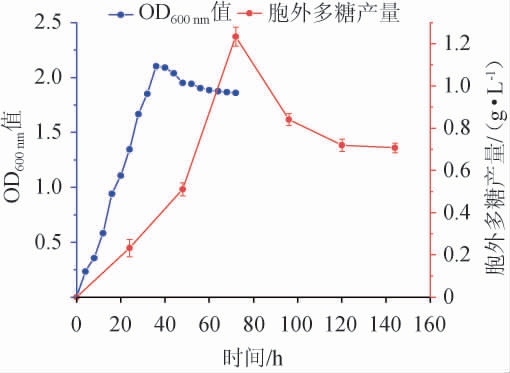
图1 黄褐假单胞菌Y11生长曲线及产胞外多糖曲线
Fig. 1 Growth curve and extracellular polysaccharide production curve of Pseudomonas flavus Y11
由图1可知,黄褐假单胞菌Y11的生长和产EPS是同步的,属于同步合成型,也叫生长偶联型。在前36 h菌株繁殖迅速,曲线呈快速增长,为对数生长期;在36 h时OD600 nm值基本达到最高点,36 h时后菌株稳定繁殖,进入稳定期。所以在活化菌株时,摇床培养36 h为最佳时间。EPS产量在发酵72 h时达到最大值(1.23 g/L),之后由于菌株进入衰亡期,EPS产量下降。因此应通过优化发酵条件,补充营养底物,促进细菌生长,以产生更多的胞外多糖[22]。
2.2 单因素试验结果分析
2.2.1 碳源对黄褐假单胞菌Y11产EPS的影响
考察不同碳源种类及最佳碳源添加量对黄褐假单胞菌Y11产EPS的影响,结果见图2。
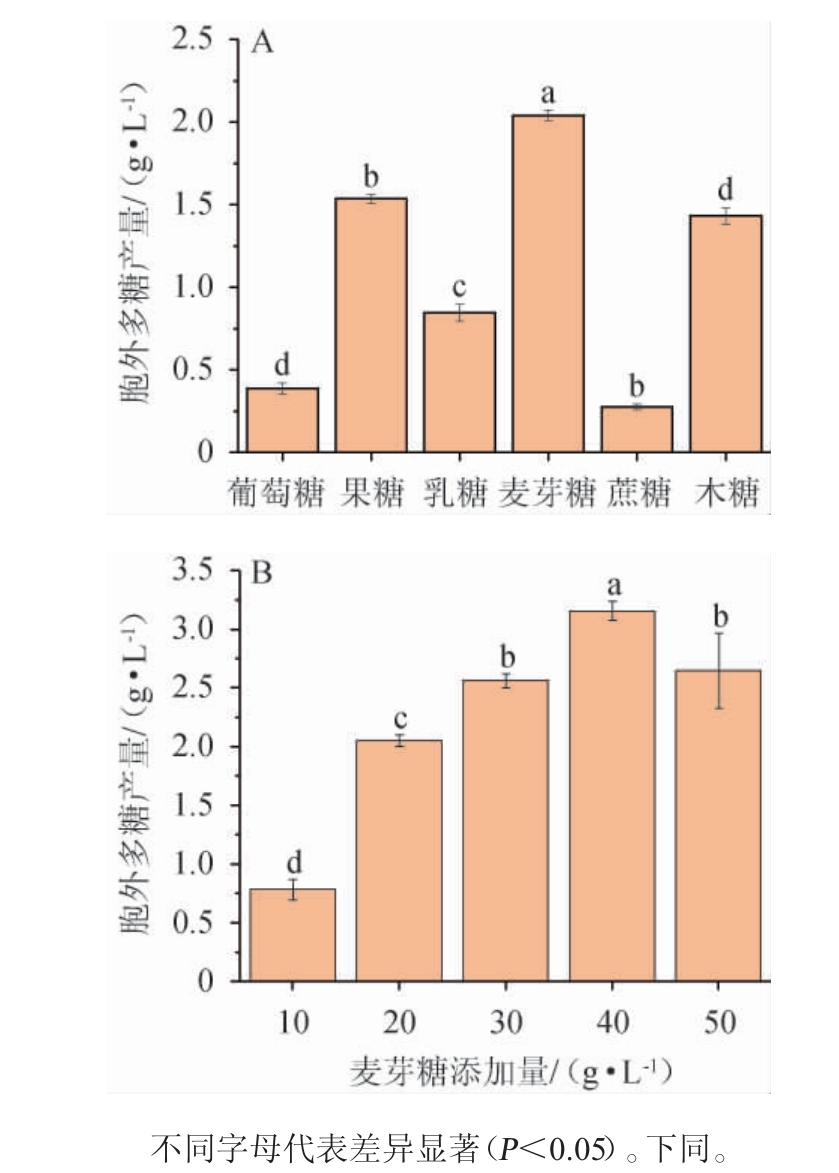
图2 碳源种类(A)及麦芽糖添加量(B)对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 2 Effect of carbon source types (A) and maltose addition (B)on extracellular polysaccharide production by Pseudomonas flavus Y11
由图2A可知,根据所选取的六种碳源对黄褐假单胞菌Y11产糖能力的影响来看,当麦芽糖作为碳源时,黄褐假单胞菌Y11产胞外多糖能力最强,为2.05 g/L,产胞外多糖能力显著高于其他碳源(P<0.05),因此最佳碳源为麦芽糖。由图2B可知,胞外多糖产量随麦芽糖添加量的增加呈现先升高后降低的趋势,当麦芽糖添加量为40 g/L时,EPS产量最高,为3.16 g/L;这可能是因为当培养基中麦芽糖添加量低于40g/L时,培养基中的碳源含量不足以满足黄褐假单胞菌Y11的生长代谢需要[23],导致产生的EPS被新陈代谢消耗掉;在添加量>40 g/L时,胞外多糖含量降低,这可能是由于培养基中麦芽糖含量过多,导致菌体内外渗透压失衡,其生长受到抑制,从而影响细胞外多糖的合成,故麦芽糖最佳添加量为40g/L。
2.2.2 氮源对黄褐假单胞菌Y11产EPS的影响
氮同样是生物和EPS生产的主要营养素[24],不同氮源种类及最佳氮源添加量对黄褐假单胞菌Y11产EPS的影响见图3。
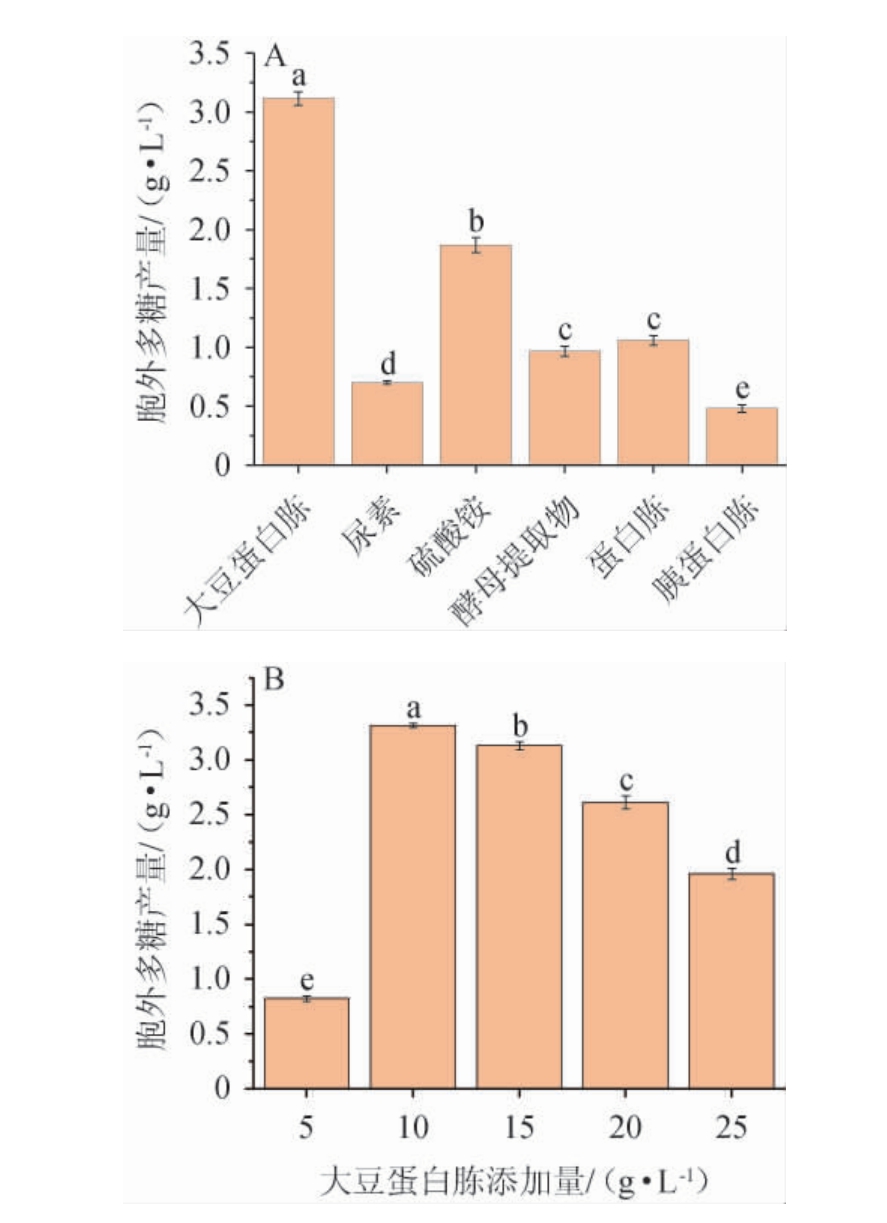
图3 氮源种类(A)及大豆蛋白胨添加量(B)对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 3 Effect of nitrogen source types (A) and soy peptone addition(B) on extracellular polysaccharide production by Pseudomonas flavus Y11
由图3A可知,不同氮源对黄褐假单胞菌Y11产EPS含量的影响存在显着差异(P<0.05)。与无机氮源相比,有机氮源明显优于无机氮源。当大豆蛋白胨作为氮源时,更显著有利于黄褐假单胞菌Y11产生胞外多糖(P<0.05),EPS产量最高为3.11 g/L。由图3B可知,胞外多糖产量随着大豆蛋白胨质量浓度的增加先显著升高后降低(P<0.05),这是因为当氮源含量过多,细菌没有充足能量合成代谢产物。当大豆蛋白胨质量浓度为10 g/L时,EPS产量最高,为3.31 g/L,故最佳大豆蛋白胨添加量为10 g/L。
2.2.3 无机盐对黄褐假单胞菌Y11产EPS的影响
不同无机盐及最佳无机盐添加量对黄褐假单胞菌Y11产EPS的影响见图4。

图4 无机盐离子种类(A)及磷酸二氢钠添加量(B)对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 4 Effect of inorganic salt ion species (A) and sodium dihydrogen phosphate addition (B) on extracellular polysaccharide production by Pseudomonas flavus Y11
由图4A可知,这几种无机盐离子的添加对黄褐假单胞菌Y11产EPS含量均具有一定的促进作用。当无机盐离子为磷酸二氢钠时,黄褐假单胞菌Y11的EPS产量最高,为4.19 g/L。因此,选用磷酸二氢钠作为培养基中无机盐类。由图4B可知,胞外多糖产量随着磷酸二氢钠质量浓度的增加先显著升高后降低的趋势(P<0.05),当磷酸二氢钠的添加量为8 g/L时,黄褐假单胞菌Y11EPS产量最高,为4.16g/L。这表明EPS的产生可能与磷酸盐的添加有关,磷酸盐是EPS分泌的重要刺激物[25],有利于EPS的产生。因此最佳无机盐及添加量为8 g/L磷酸二氢钠。
2.2.4 初始pH对黄褐假单胞菌Y11产EPS的影响
不同初始pH对黄褐假单胞菌Y11产EPS的影响见图5。由图5可知,胞外多糖产量随着初始pH的增加先升高后降低,由此说明菌株只有在适宜pH条件下才能正常生长代谢,酶活性良好,对多糖产物的合成才能发挥最大作用。因此,EPS生产的最佳培养初始pH为7.0,此时获得了最高的EPS产量,为4.19 g/L。
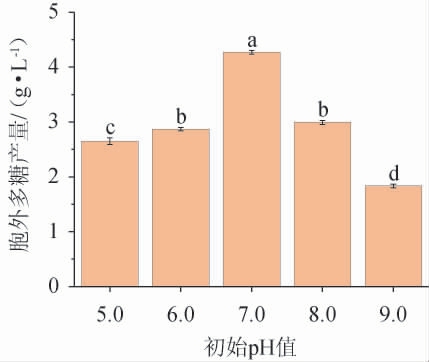
图5 初始pH对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 5 Effect of initial pH on extracellular polysaccharide production by Pseudomonas flavus Y11
2.2.5 发酵时间对黄褐假单胞菌Y11产EPS的影响
不同发酵时间对黄褐假单胞菌Y11产EPS的影响见图6。由图6可知,EPS产量从发酵1~3 d呈快速生长趋势,从3~5 d略有下降。发酵3 d时,EPS产量达到最高水平,为4.21g/L。3 d后,细菌菌株进入衰亡阶段,因此生物量下降[26]。故最佳发酵时间为3 d。
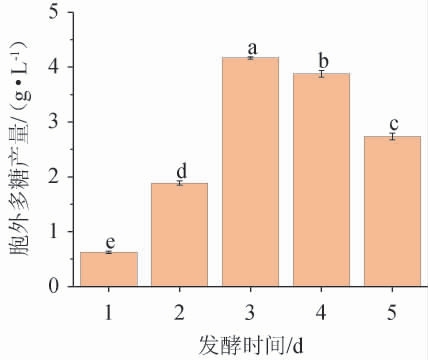
图6 发酵时间对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 6 Effect of fermentation time on extracellular polysaccharide production by Pseudomonas flavus Y11
2.2.6 转速对黄褐假单胞菌Y11产EPS的影响
转速对黄褐假单胞菌Y11产胞外多糖的影响见图7。
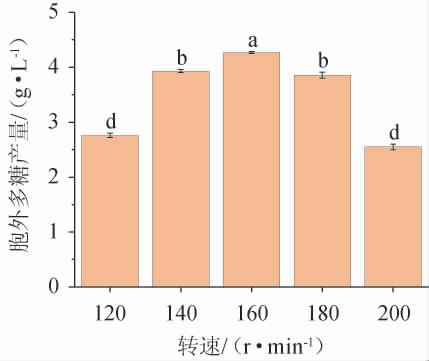
图7 转速对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 7 Effect of rotational speed on extracellular polysaccharide production by Pseudomonas flavus Y11
一般来说,摇瓶发酵时,转速越高,溶氧越多,越适合菌种培养和发酵。但研究表明,速度高时溶解氧不一定高。由图7可知,在转速120~160 r/min范围内,转速越高,EPS产量越大;转速为160 r/min时,黄褐假单胞菌Y11的EPS产量最高,为4.23 g/L;转速为160~200 r/min时开始下降,这与文献[27]的研究结果一致,故最佳摇床转速为160 r/min。
2.2.7 发酵温度对黄褐假单胞菌Y11产EPS的影响
不同发酵温度对黄褐假单胞菌Y11 EPS产量的影响见图8。由图8可知,在20~36 ℃的发酵温度范围内菌株EPS产量先升高后降低,在28 ℃时,EPS产量最高为4.26 g/L。温度过高或过低影响菌株内酶促反应速率的变化,都不利于EPS的生产,故最佳发酵温度为28 ℃。
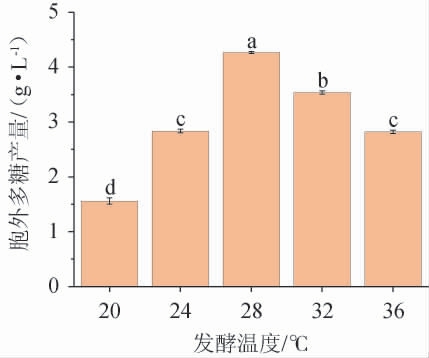
图8 发酵温度对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 8 Effect of fermentation temperature on extracellular polysaccharide production by Pseudomonas syringae Y11
2.2.8 接种量对黄褐假单胞菌Y11产EPS的影响
接种量的多少会影响微生物发酵产物的合成,不同接种量对黄褐假单胞菌Y11产胞外多糖的影响结果见图9。由图9可知,相同发酵时间下,随着接种量的增加,黄褐假单胞菌Y11的EPS产量先升高后降低,且接种量为4%时EPS产量最高,为4.27 g/L,接种量超过4%后开始下降,可能是因为接种量过多引起细菌之间的竞争,影响了EPS的合成和积累[28]。故最佳接种量为4%。
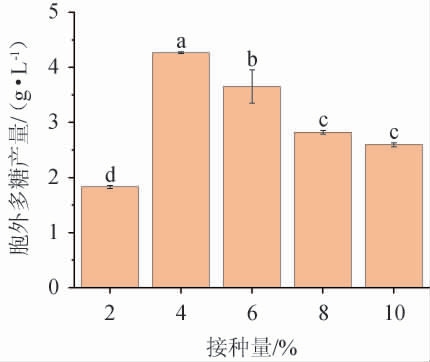
图9 接种量对黄褐假单胞菌Y11产胞外多糖的影响
Fig. 9 Effect of inoculum on extracellular polysaccharide production by Pseudomonas syringae Y11
2.3 Plackett-Burman设计试验结果及分析
在单因素试验的基础上,设计Plackett-Burman试验,结果见表3,方差分析见表4。
表3 Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman experiments
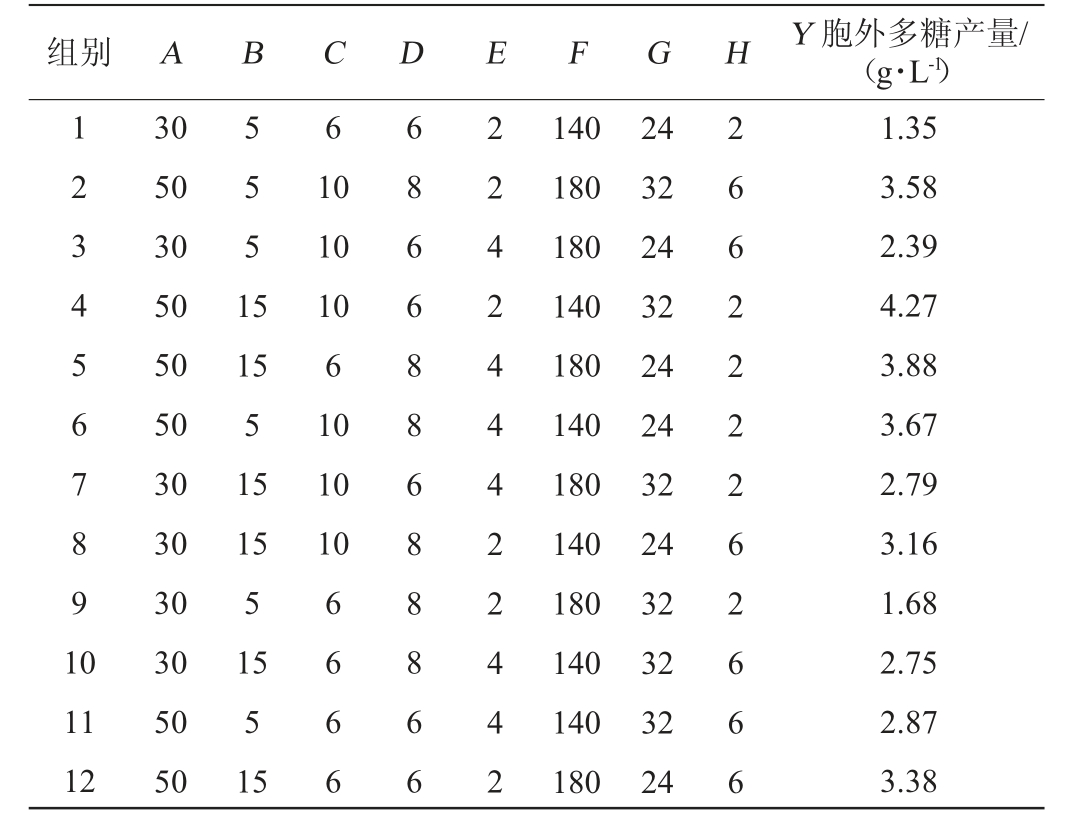
组别 A B C D E F G H Y 胞外多糖产量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 5 5 5 1 5 6 10 10 10 6 10 10 10 11 12 30 50 30 50 50 50 30 30 30 30 50 50 15 5 15 15 5 15 5 15 6 6 6 6 6 8 6 6 8 8 6 8 8 8 6 6 2 2 4 2 4 4 4 2 2 4 4 2 140 180 180 140 180 140 180 140 180 140 140 180 24 32 24 32 24 24 32 24 32 32 32 24 2 6 6 2 2 2 2 6 2 6 6 6 1.35 3.58 2.39 4.27 3.88 3.67 2.79 3.16 1.68 2.75 2.87 3.38
表4 Plackett-Burman试验结果方差分析
Table 4 Variance analysis of Plackett-Burman experiments results
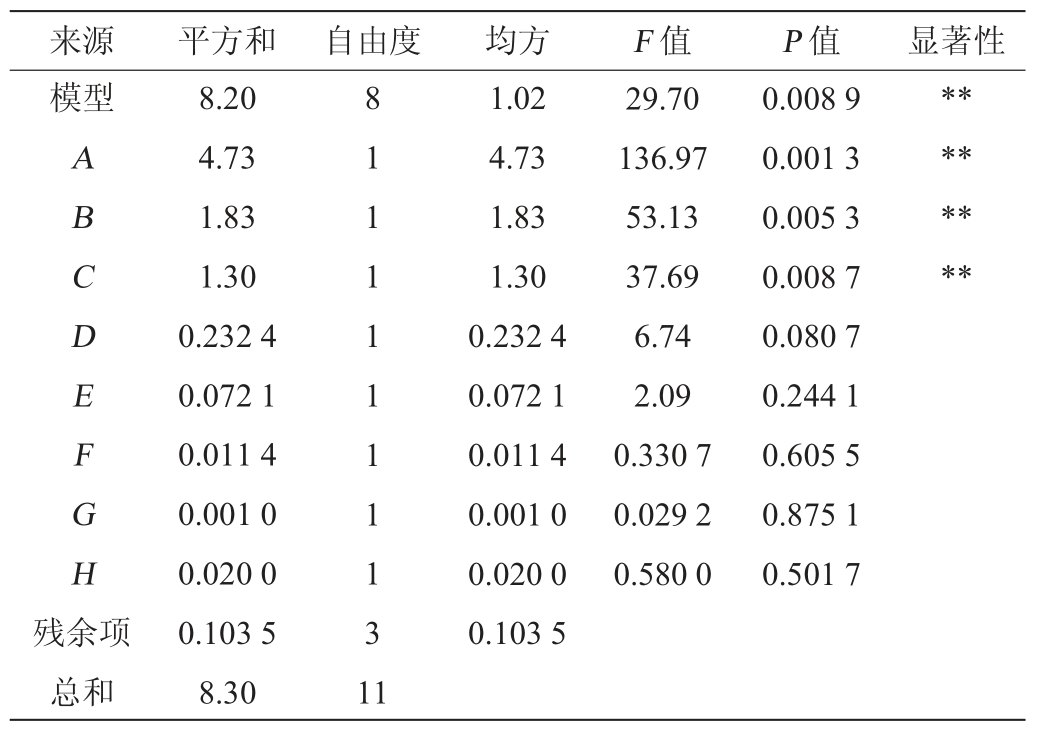
注:“**”表示对结果影响极显著(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCDEFGH 29.70 136.97 53.13 37.69 6.74 2.09 0.330 7 0.029 2 0.580 0 0.008 9 0.001 3 0.005 3 0.008 7 0.080 7 0.244 1 0.605 5 0.875 1 0.501 7********残余项总和8.20 4.73 1.83 1.30 0.232 4 0.072 1 0.011 4 0.001 0 0.020 0 0.103 5 8.30 8 1 1 1 1 1 1 1 1 3 1 1 1.02 4.73 1.83 1.30 0.232 4 0.072 1 0.011 4 0.001 0 0.020 0 0.103 5
由表3和表4可知,模型变异系数(coefficient of variation,CV)=6.23%<10%,R2(0.987 5)与调整后的R2adj(0.954 3)之差<0.1,表明该模型具有较强的优化信号和适用性较好[29]。模型P=0.008 9<0.05,说明回归模型具有统计学意义,模型拟合良好。经方差分析得出的多元回归方程为:Y=2.98+0.6275A+0.390 8B+0.329 2C+0.139 2D+0.077 5E-0.030 8F+0.009 2G+0.040 8H
由表3可知,第4组可获得最高的胞外多糖产量,为4.27 g/L。其中,麦芽糖添加量(A)、大豆蛋白胨添加量(B)、磷酸二氢钠添加量(C),这三种因素对EPS产量有显著影响(P<0.05),因此选择这三个因素进行最陡爬坡试验,其他因素保持在单因素法测定的最佳水平进行后续试验。
2.4 最陡爬坡试验
为了逼近麦芽糖添加量(A)、大豆蛋白胨添加量(B)、磷酸二氢钠添加量(C)的响应中心点,根据Plackett-Burman试验结果,采用Design-Expert 13设计最陡爬坡试验,试验设计及结果见表5。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the streepest climbing tests

试验号A 麦芽糖添加量/(g·L-1)B 大豆蛋白胨添加量/(g·L-1)C 磷酸二氢钠添加量/(g·L-1)胞外多糖产量/(g·L-1)1 2 3 30 40 50 5 10 15 6 8 1 0 1.47 4.25 3.65
由表5可知,在试验号2的培养条件下,胞外多糖产量最高,可达4.25 g/L。因此选择麦芽糖40 g/L、大豆蛋白胨10 g/L、磷酸二氢钠8 g/L作为响应面试验的中心点。
2.5 Box-Behnken设计试验结果及分析
在单因素法和Plackett-Burman设计的基础上,以麦芽糖(A)、大豆蛋白胨(B)和磷酸二氢钠(C)添加量为考察因素,以胞外多糖产量(Y)为评价指标进行Box-Behnken试验,优化3个变量的最佳添加量及其交互作用,结果见表6,方差分析结果见表7。
表6 黄褐假单胞菌产胞外多糖培养条件优化响应面试验设计及结果
Table 6 Design and results of response surface experiments for culture conditions optimization of extracellular polysaccharide production by Pseudomonas syringae
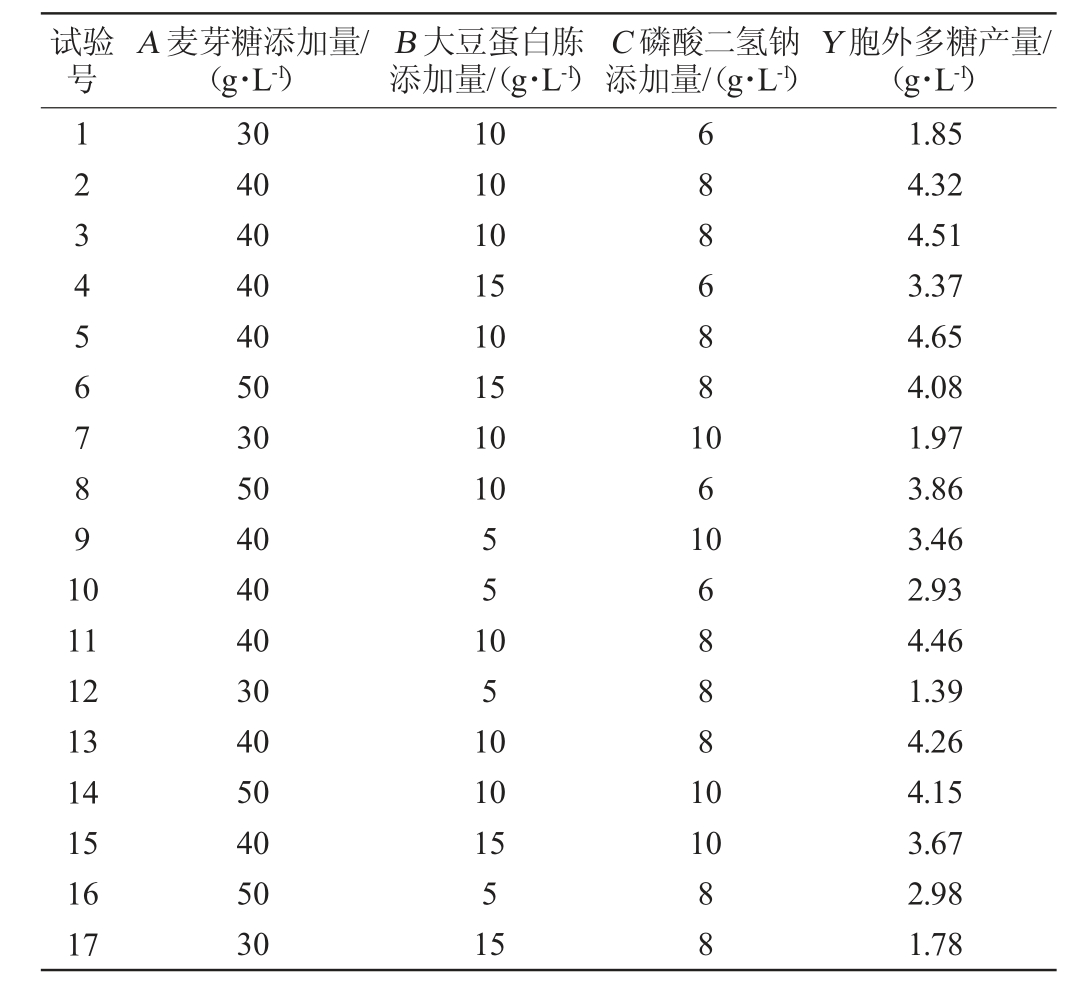
试验号A 麦芽糖添加量/(g·L-1)B 大豆蛋白胨添加量/(g·L-1)C 磷酸二氢钠添加量/(g·L-1)Y 胞外多糖产量/(g·L-1)1234567891 0 10 10 10 15 10 15 10 10 6886881 061 11 12 13 14 15 16 17 30 40 40 40 40 50 30 50 40 40 40 30 40 50 40 50 30 551 051 0 10 15 5 15 068881 0 10 88 1.85 4.32 4.51 3.37 4.65 4.08 1.97 3.86 3.46 2.93 4.46 1.39 4.26 4.15 3.67 2.98 1.78
表7 响应面试验结果方差分析
Table 7 Variance analysis of response surface test results
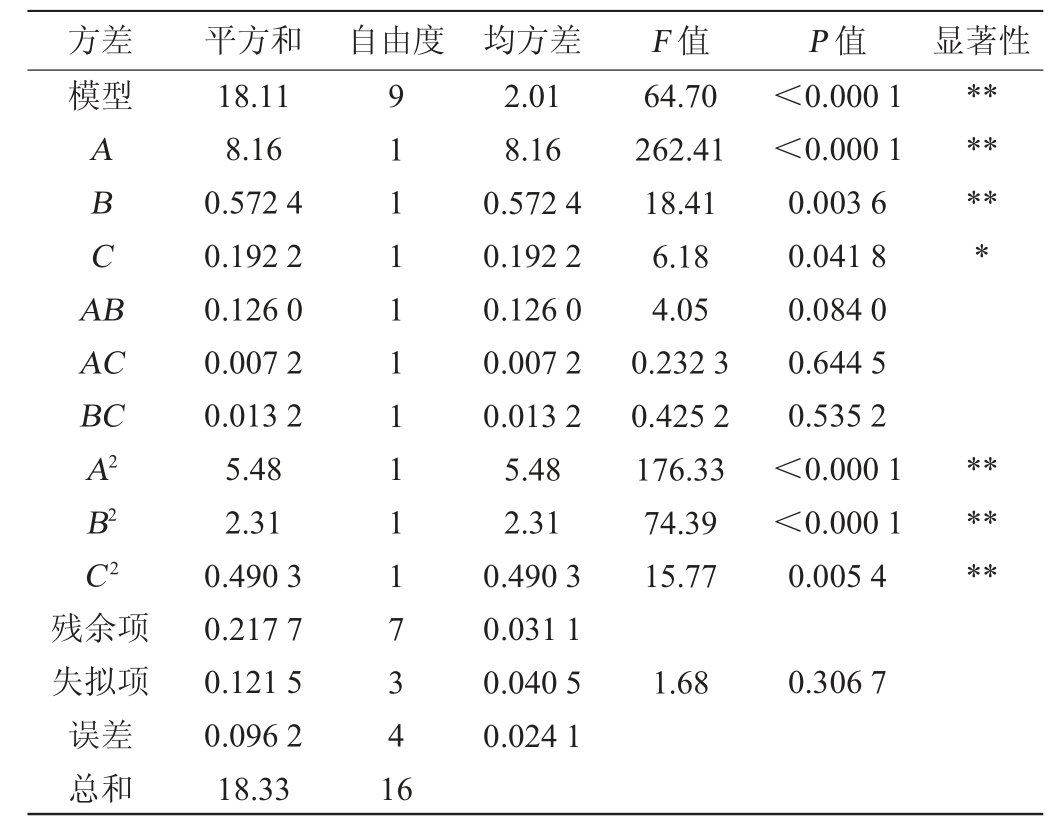
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差 平方和 自由度 均方差 F 值模型ABCA B*******AC BC A2 B2 C2残余项失拟项误差总和18.11 8.16 0.572 4 0.192 2 0.126 0 0.007 2 0.013 2 5.48 2.31 0.490 3 0.217 7 0.121 5 0.096 2 18.33 91111111117341 6 2.01 8.16 0.572 4 0.192 2 0.126 0 0.007 2 0.013 2 5.48 2.31 0.490 3 0.031 1 0.040 5 0.024 1 64.70 262.41 18.41 6.18 4.05 0.232 3 0.425 2 176.33 74.39 15.77 P 值 显著性<0.000 1<0.000 1 0.003 6 0.041 8 0.084 0 0.644 5 0.535 2<0.000 1<0.000 1 0.005 4******1.68 0.306 7
采用Design-Expert 13软件对表6试验结果进行多元回归拟合分析,结果表明,EPS产量的预测产量Y可由以下二阶多项式方程求得:Y=4.44+1.01A+0.267 5B+0.155 0C+0.177 5AB+0.042 5AC-0.057 5BC-1.14A2-0.741 3B2-0.341 2C2
由表6可知,模型极显著(P<0.01),失拟项不显著(P>0.05),这表明模型方程足以预测任意变量组合的EPS产量。模型的决定系数R2为0.988 1,表明98.81%的响应变异性可以被模型解释。此外,预测值与实际值之间的高度相似性也反映了响应面试验的准确性和适用性,可用于获得优化的最大EPS产量。由表6可知,一次项A、B、二次项A2、B2、C2对结果影响极显著(P<0.01),一次项C对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
2.6 最佳工艺验证
通过对响应面试验结果进行分析,得到最佳发酵工艺为麦芽糖添加量44.15 g/L、大豆蛋白胨浓度11.32 g/L、磷酸二氢钠7.80 g/L。结合Plackett-Burman联合BBD-RSM进行的优化试验,并根据实际操作可行性,得到最佳条件为麦芽糖44 g/L、大豆蛋白胨11g/L、磷酸二氢钠8 g/L、接种量4%、转速160 r/min、发酵温度28 ℃、发酵时间72 h、初始pH 7,此时胞外多糖的产量最高为4.68 g/L,以上述条件进行了3次验证试验。结果发现该条件下胞外多糖的实际值为(4.56±0.13)g/L,接近于预测值4.68 g/L。因此,通过Plackett-Burman设计与BBD响应面方法相结合优化黄褐假单胞菌合成胞外多糖的发酵条件是可靠且实用的。
2.7 黄褐假单胞菌Y11产胞外多糖抗氧化性评价
不同质量浓度的胞外多糖对4种自由基的清除活性见图10。由图10可知,在一定浓度范围内,EPS对DPPH、ABTS、OH、超氧阴离子自由基清除活性表现出浓度依赖性,但均低于维生素C(vitamin C,VC)。当质量浓度为2.5 mg/mL时,EPS的自由基清除率可达到最大值,EPS对DPPH自由基、ABTS自由基、羟自由基、超氧阴离子自由基的清除能力分别为(70.83±1.80)%、(45.00±1.73)%、(65.83±1.80)%和(44.6±2.11)%,这表明EPS具有较好的自由基清除活性。

图10 不同质量浓度EPS对DPPH(A)、ABTS(B)、OH(C)及超氧阴离子(D)自由基清除率的影响
Fig. 10 Effect of different mass concentrations of EPS on free radical scavenging rate of DPPH (A), ABTS (B), OH (C) and superoxide anion (D)
3 结论
本研究通过单因素试验、Plackett-Burman设计联合Box-Behnken响应面设计,优化了黄褐假单胞菌Y11产胞外多糖条件,并研究了其胞外多糖的抗氧化性。结果表明,黄褐假单胞菌Y11产胞外多糖最佳发酵工艺为麦芽糖添加量44 g/L、大豆蛋白胨添加量11 g/L、磷酸二氢钠添加量8 g/L、接种量4%、转速160 r/min、发酵温度28 ℃、发酵时间72 h、初始pH 7.0,此时胞外多糖的产量最高为4.56 g/L,是优化前的3.7倍。抗氧化性研究结果表明,EPS具有一定的DPPH自由基、ABTS自由基、羟自由基和超氧阴离子自由基清除活性,对于测定的体外活性强弱表现为VC>EPS。本研究为黄褐假单胞菌EPS的工业化生产提供了一定的参考,对胞外多糖的体外抗氧化活性提供了理论依据。
[1]李春雨,杨棒棒,周佳,等.红杆菌NBS58-1产胞外多糖发酵条件优化及其保湿性研究[J].中国酿造,2022,41(11):155-160.
[2]范熠,刘丽莎,韩玉竹,等.解淀粉芽孢杆菌胞外多糖的理化性质及免疫调节作用[J].中国农业大学学报,2014,19(1):131-136.
[3]李彬.产胞外多糖菌株的筛选及胞外多糖性质和结构分析[D].南京:南京理工大学,2016.
[4]陈东.产胞外多糖乳杆菌筛选/鉴定、多糖应用和发酵工艺初步研究[D].无锡:江南大学,2021.
[5]张瑞琪.植物糖原的提取及其在化妆品中的应用探究[D].无锡:江南大学,2019.
[6]吴寒月,王慧美,岳庆磊,等.植物乳杆菌PA01胞外多糖合成条件的优化[J].家畜生态学报,2023(4):22-30.
[7]吴梦园,徐慧敏,张鑫,等.黄绿卷毛菇胞外多糖发酵条件的优化及其生物活性研究[J].核农学报,2023,37(8):1598-1608.
[8]石金铭,陈秋羽,刘昭曦,等.乳杆菌胞外多糖合成基因簇及构效关系[J].微生物学报,2023,63(9):3482-3499.
[9]范秋苹.一株依氏交替假单胞菌HZ胞外多糖的研究[D].济南:齐鲁工业大学,2016.
[10]HU X,SARAVANAKUMAR K,PARK S,et al.Isolation,characterization,antioxidant,and wound healing activities of extracellular polysaccharide from endophytic fungus Talaromyces purpureogenus[J]. Appl Biochem Biotechnol,2023,195(6):3822-3839.
[11]蒋光阳,田永强.乳酸菌产胞外多糖的发酵条件优化及其抗氧化活性研究[J].中国酿造,2023,42(4):187-195.
[12]王艳,郑砚学,张悦,等.西藏牦牛乳制品中高产胞外多糖乳酸菌的筛选及多糖抗氧化特性研究[J].食品科技,2022,47(1):1-7.
[13]宋倩倩,李苏冉,胡宇辰,等.一株解淀粉芽孢杆菌胞外多糖的分离纯化及其抗氧化性研究[J].天津理工大学学报,2022,38(5):27-36.
[14]茹素龙,赵永龙,王紫薇,等.产胞外多糖菌株的分离鉴定及其功能研究[J].微生物学报,2023,63(11):4315-4329.
[15]王宠,郑琳琳,王在峰.生态环境监测实验室生物安全风险因子分析及防控措施[J].环境与发展,2021,33(2):157-164.
[16]李慧颖.出芽短梗霉发酵产普鲁兰多糖的初步研究[D].保定:河北农业大学,2012.
[17]WANG Q F,HUANG Q H,LIANG L,et al.Research on sugarcane juice fermentation by Ganoderma lucidum and assay of antioxidant activity of exopolysaccharide[J]. J Food Process Preserv, 2018, 42(1): DOI:10.1111/jfpp.13761.
[18] WANG W N, LI Y, ZHANG Y, et al. Comparison on characterization and antioxidant activity of exopolysaccharides from two Porphyridium strains[J].J Appl Phycol,2021,33(5):1-12.
[19] LI P, MOU Z G, ZHENG G X, et al. Characterization and antioxidant activities of polysaccharides from Fructus corni[J].Adv Mat Res,2012,560-561:231-236.
[20]胡月芳.淮山多糖超声辅助提取及清除超氧阴离子自由基的作用[J].江苏农业科学,2017,45(4):144-146.
[21]吕青遥,雷霜江,包善思,等.基于基因分析的产胞外多糖乳酸菌的筛选及其体外抗氧化研究[J].中国乳品工业,2022,50(3):8-13.
[22]王琪.罗汉果内生菌产胞外多糖菌株的筛选及其抗氧化与降糖活性研究[D].桂林:广西师范大学,2021.
[23]蹇华丽,田文祥,杨幼慧,等.多黏类芽孢杆菌PS04产胞外多糖发酵条件优化[J].食品科技,2013,38(1):26-30.
[24] MAHAPATRA S, BANERJEE D. Optimization of a bioactive exopolysaccharide production from endophytic Fusarium solani SD5[J].Carbohydr Polym,2013,97(2):627-634.
[25]LIU J,WANG X,PU H,et al.Recent advances in endophytic exopolysaccharides: Production, structural characterization, physiological role and biological activity[J].Carbohydr Polym,2017,157:1113-1124.
[26]LEE W Y,PARK Y,AHN J K,et al.Factors influencing the production of endopolysaccharide and exopolysaccharide from Ganoderma applanatum[J].Enzyme Microbial Technol,2007,40(2):249-254.
[27] LIU C, FENG J, WANG S, et al. Enhancement of hyphae growth and medium optimization for Pleurotus eryngii-3 under submerged fermentation[J].Agronomy,2022,12(10):2413.
[28]ZHANG D,BAO Y,MA Z,et al.Optimization of fermentation medium and conditions for enhancing valinomycin production by Streptomyces sp.ZJUT-IFE-354[J].Preparative Biochem Biotechnol,2023,53(2):157-166.