食醋是我国传统的调味品,具有悠久的历史[1]。大红浙醋是传统食醋中的典型代表,其玫瑰红色来源于氨基和羰基化合物之间的美拉德反应,发酵过程中不同于其他食醋的微生物群落丰度与组成也使得大红浙醋具有独特的风味[2,3]。大红浙醋的主要酿造阶段包括糖化阶段、酒精发酵阶段以及醋酸发酵阶段[4],其中酒精发酵阶段的主要微生物为酿酒酵母(Saccharomyces cerevisiae),它能够将糖类转化为乙醇,为后续的醋酸发酵提供底物,而产香非酿酒酵母(non-Saccharomyces cerevisiae)的存在能够提升食醋风味的丰富性和芳香性[5-7]。目前对大红浙醋的研究主要集中于酿造工艺的改进以及微生物群落的组成,而对产香非酿酒酵母在其风味组成上的贡献鲜有报道[8-10]。
产香非酿酒酵母是酿造工业广泛应用的微生物菌株,这些酵母虽不像酿酒酵母那样可以产生高浓度的乙醇,但可以产生具有不同香气的风味物质[11-12]。袁英豪等[6]从20份醋源样品中分离得到了一株产酯能力强,产香浓郁、柔和的异常威克汉姆酵母(Wickerhamomyces anomalus),其可产59种挥发性风味物质。韩志双等[13]从醋醅中筛选得到的粟酒裂殖酵母(Scizosaccharomyces pombe)产酯量达到3.66g/L。这些非酿酒酵母的存在使得食醋的风味更加浓郁。
本实验以大红浙醋酒精发酵阶段为研究对象,为了探讨非酿酒酵母弗比恩毕赤酵母(Pichia fabianii)、耐热克鲁维酵母(Kluyveromyces thermotolerans)、库德里阿兹威毕赤酵母(Pichia kudriavzeii)、扣囊复膜酵母(Saccharomycopsis fibuligera)在大红浙醋酒精发酵阶段的产香机制,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定其还原糖代谢能力,失重法测定CO2生成能力,通过顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术测定其挥发性风味物质组成,研究非酿酒酵母对酒精的耐受性,以及在以大米为发酵底物的条件下对糖分的利用情况和挥发性风味物质的生成情况,旨在探究不同非酿酒酵母对大红浙醋酒精发酵阶段风味形成的贡献。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
大米(依娇儿南陵大米):市售;产香非酿酒酵母(弗比恩毕赤酵母(Pichia fabianii,Pf)、耐热克鲁维酵母(Kluyveromyces thermotolerans,Kt)、库德里阿兹威毕赤酵母(Pichia kudriavzeii,Pk)、扣囊复膜酵母(Saccharomycopsis fibuligera,Sf)),商业酿酒酵母(Saccharomyces cerevisiae,Sc),酒曲(Jiuqu,JQ):安琪酵母股份有限公司;酿酒酵母(Saccharomyces cerevisiae)SHQ630:本实验室从大红浙醋中筛选保藏。
1.1.2 化学试剂
2-辛醇(色谱纯):美国Sigma-Aldrich公司;3,5-二硝基水杨酸(DNS)(分析纯):天津市富宇精细化工有限公司;乳酸(分析纯):天津市津东天正精细化学试剂厂;丙三醇(分析纯):天津市风船化学试剂科技有限公司;α-淀粉酶(10 000 U/g):福建福大百特生物科技有限公司;糖化酶(100 000 U/g):内蒙古霸润酶制剂制作有限公司;酸性蛋白酶(150 000 U/g):浙江一诺生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:2%葡萄糖、2%蛋白胨、1%酵母粉。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
ZHJH-C1115C超净工作台、ZWY-100H温振荡培养箱:上海智诚仪器有限公司;TQS-Ⅱ厌氧培养箱:上海龙跃仪器设备有限公司;GZX-9070MBE恒温干燥箱:上海博讯实业有限公司;DY04-13-44-00 立式压力蒸汽灭菌锅:上海东亚压力容器有限公司;CX23LEDRFS1C 生物显微镜:奥林巴斯(广州)工业有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad Laboratories公司;DVB/CAR/PDMS 50/30 μm萃取头:日本岛津公司;UV-1800 紫外可见分光光度计:上海美谱达仪器有限公司;QP2010Ultral气相色谱-质谱联用仪:上海安谱实验科技有限公司。
1.3 方法
1.3.1 实验模拟食醋酒精发酵
在浸泡过夜的大米中加入2倍体积的水,经121 ℃高压蒸汽灭菌20 min后按照料液比1∶6(g∶mL)加灭菌蒸馏水,加入酶制剂(糖化酶0.2%、淀粉酶0.1%和蛋白酶0.05%)和0.1%的干酵母(4株非酿酒酵母、2株酿酒酵母以及酒曲),共七组试验,模拟食醋酒精发酵。
1.3.2 分析检测
(1)还原糖和CO2的测定
还原糖采用3,5-二硝基水杨酸(DNS)法测定[14];CO2采用失重法[15]。
(2)菌株耐乙醇和耐酸的测定
将实验所用的四株非酿酒酵母、两株酿酒酵母以及酒曲活化后,按2%的接种量分别接种至乙醇体积分数分别为0、6%、9%、12%、15%、18%的YPD培养基中;再按2%的接种量分别接种至pH值为3.6、3.4、3.2、3.0、2.8、2.6和自然pH(5.8)的YPD培养基中,28 ℃、120 r/min培养24 h,在波长600 nm处测定吸光度值(OD600nm值)。
(3)挥发性风味物质的测定
挥发性风味物质采用顶空固相微萃取-气相色谱-质谱联用法[16]。
顶空固相微萃取(HS-SPME):将模拟食醋酒精发酵的粮食发酵液8 000 r/min条件下离心5 min,取上清液2 mL于顶空瓶中,加入质量浓度为20mg/L的2-辛醇标准品30μL,并加入转子。将顶空瓶密封后置于加热磁力搅拌器上,60 ℃平衡20 min;然后插入经过老化的萃取头,保持温度不变,萃取30 min,250 ℃解吸15 min。
气相色谱条件:使用Rtx-5 ms色谱柱(30 m×0.25 mm×0.25 μm)。升温程序为初始温度40 ℃保持3 min,以4 ℃/min上升到150 ℃,保持1 min;再以8 ℃/min上升到250 ℃保持6 min;载气为高纯氦气(He),恒定流速为1.0 mL/min,分流比为10∶1,进样口温度250 ℃,进样时间1 min。
质谱条件:离子源温度200 ℃,接口温度220 ℃,溶剂延迟时间1.3 min,电离方式为电子电离(electronic ionization,EI)源,电子能量70 eV,扫描质量范围为33~500 m/z,扫描速率3.00次/s。
定性定量方法:根据美国国家标准技术研究所(national institute of standards and technology,NIST)17数据库检索选取相似度>80%的化合物,并结合离子碎片及保留指数(retention index,RI)进行定性。以2-辛醇(20 mg/L)作为内标,通过内标法进行半定量。
1.3.3 香气活性值的计算
香气活性值(ordor activity value,OAV)是表征某一香气成分对食物整体香气特征贡献度的指标,OAV=香气成分质量浓度/感觉阈值[17]。某种香气成分的OAV越大,其对食物的香气体系的贡献度越大,对食物香气体系特征的形成作用也越大。当OAV>1时,说明该挥发性香气成分对主体香气有显著贡献,是关键挥发性香气成分。
1.3.4 数据处理
数据分析采用3次平行实验,结果以“平均值±标准差”表示。采用单因素方差分析(analysis of variance,ANOVA),Duncan 多重范围检验显著性水平设为P<0.05。采用SPSS软件27.0 进行统计分析,Origin 2023软件绘图。
2 结果与分析
2.1 酒精发酵阶段还原糖及CO2变化
酵母菌消耗葡萄糖生成乙醇的同时释放出CO2,在还原糖减少的同时测量CO2的生成量可大致估算酵母菌的乙醇生成能力和发酵动力[18]。酒精发酵过程中还原糖含量和CO2生成量变化结果见图1。
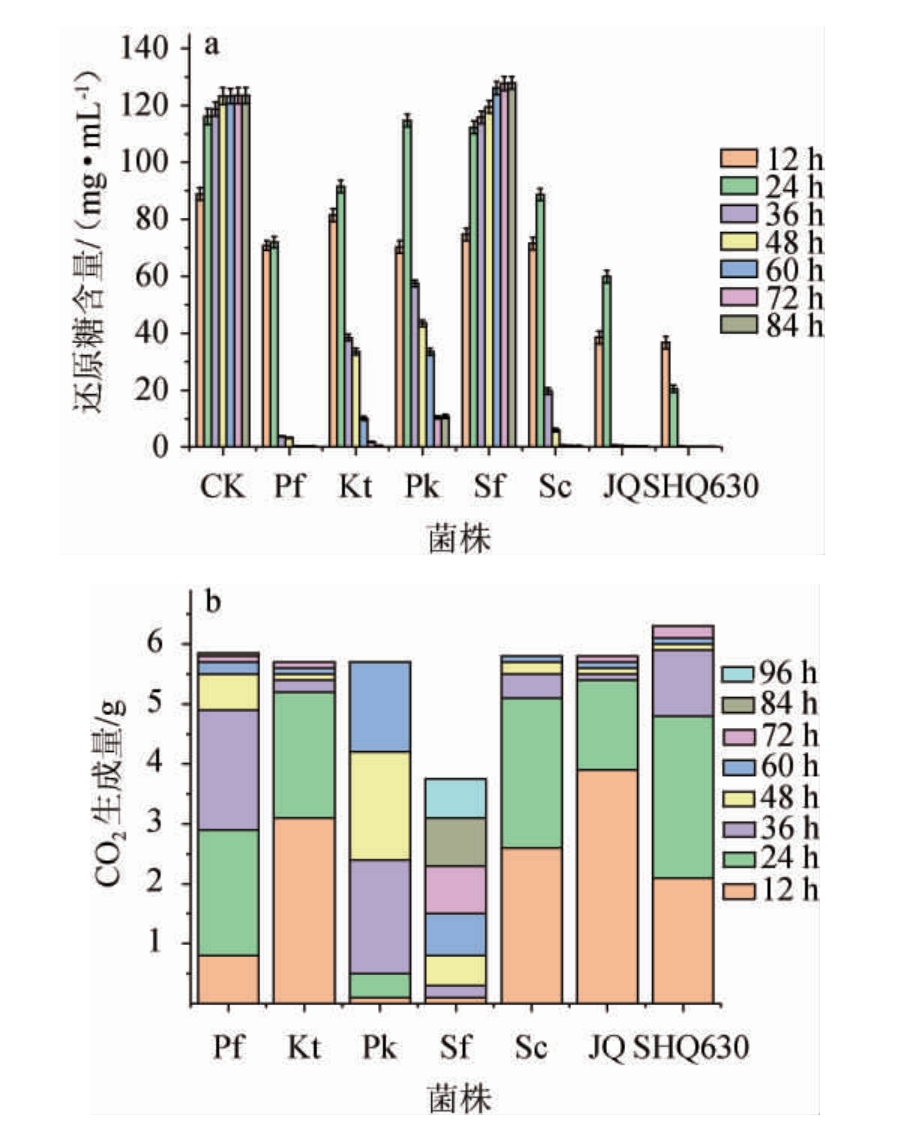
图1 不同非酿酒酵母酒精发酵过程中还原糖含量(a)和CO2生成量(b)的变化
Fig. 1 Changes of reducing sugar contents (a) and CO2 production(b) during alcoholic fermentation with different non-Saccharomyces cerevisiae
由图1可知,不加菌只加酶制剂的空白组(CK)中,在发酵前4 d,还原糖含量由88.71 mg/L显著增加到124.68 mg/L,第4天后增加趋势变缓慢。在发酵前期,糖化酶和淀粉酶作用于淀粉分子的α-1,4糖苷键和α-1,6糖苷键,将淀粉大分子分解为小分子葡萄糖[19],还原糖含量不断升高。在发酵第5天,淀粉分子基本被分解完全,还原糖含量不再增加。在加菌的实验组中,第2天的还原糖含量基本高于第1天,说明菌种用于生长繁殖消耗还原糖的速率低于淀粉分子分解产生还原糖的速率。菌株Sf酒精发酵过程中还原糖含量呈上升趋势,这表明菌株Sf可在发酵过程中生成还原糖或者生成了能够促进大分子淀粉水解成还原糖的酶,且在发酵过程中,这株酵母产生的CO2量相较于其他酵母少得多,这表明其利用还原糖生成乙醇的能力也较差,从而导致还原糖的生成速率高于其消耗速率,使得最终还原糖含量高于空白组。除这株酵母外,其他酵母在发酵两天后还原糖含量均呈现下降的趋势,且在第7天时,还原糖基本被利用完全,CO2也不再继续生成。其中酿酒酵母SHQ630在发酵过程中还原糖被利用的最快,发酵结束后,其CO2生成量也最多,这表明SHQ630产乙醇能力最强。JQ和产香非酿酒酵母Pf、Kt、Pk与商业酿酒酵母Sc的CO2生成量基本相同,其中菌株Pk在24~60 h生成的CO2量较多,JQ、Pf、Kt、Sc的CO2主要在36 h内合成,这表明他们产乙醇能力也基本相同,但是乙醇生成速率不同。
2.2 酒曲和酵母的耐酸性和耐乙醇性
酵母菌适合在酸性环境下生存,一般最适生长pH为4.5~5.0,偏酸或偏碱环境都会影响酵母菌的正常生长繁殖和代谢。然而酵母自身在代谢过程中也会生成一些呈酸性的物质使pH降低[20],在醋酸发酵过程中有时也需要酵母菌发挥作用,这就要求酵母菌必须具有一定的耐酸能力。耐乙醇是作为发酵用酵母必须具备的能力,在酒化阶段酵母菌自身利用底物生成乙醇并积累增多,当达到一定量的时候这些乙醇会反过来抑制菌株本身的生长和代谢水平[21],因此,能耐高浓度乙醇的菌株会在这种环境下获得优势,并且能够生成更多的乙醇。
酒曲和6株酵母在不同乙醇体积分数和pH环境中的生长情况见图2。
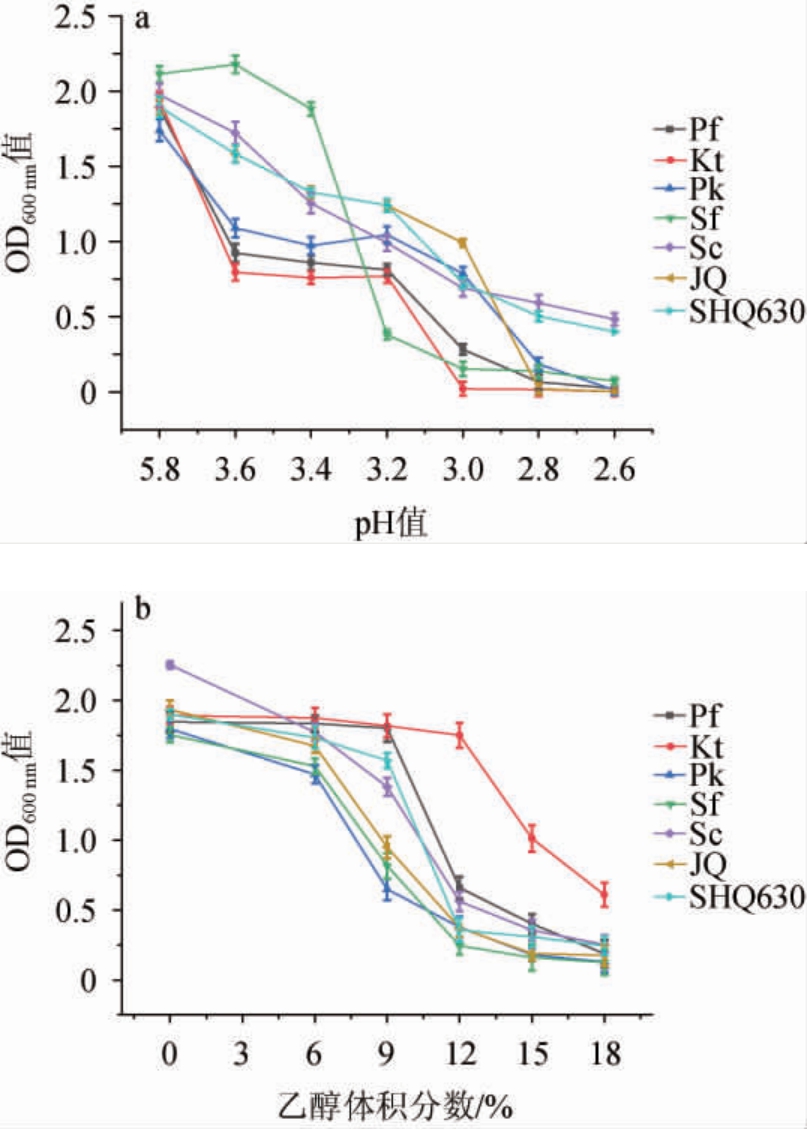
图2 酒曲和不同酵母的酸(a)及乙醇(b)耐受性
Fig. 2 Acid (a) and ethanol (b) tolerance of Jiuqu and different yeasts
由图2a可知,菌株Sc和SHQ630具有最强的耐酸能力,在pH 2.6的强酸环境下,菌株Sc的OD600nm值为0.517,SHQ630的OD600nm值为0.501仍具有生长能力,而其他菌株在此酸度环境中基本已无法生长(OD600 nm值几乎为零);酒曲(JQ)和菌株Sc有相似的耐酸性,但其在pH 3.0时活力急剧下降,pH 2.8时几乎丧失了活力;在四株产香非酿酒酵母中,菌株Sf和Pk的耐酸性相对较好。这说明在与醋酸菌发酵的末期这四株产香非酿酒酵母和酒曲已经不能发挥作用了,而酿酒酵母还能生长。
由图2b可知,菌株Pf和Kt的乙醇耐受性明显高于菌株Sc、SHQ630和酒曲(JQ);菌株Pf和Kt与商业酿酒酵母Sc的乙醇耐受性基本相同。因此,在还原糖充足的条件下,菌株Pf和Kt在酒精发酵末期高浓度乙醇的胁迫下在产乙醇方面更具优势。
2.3 酒曲和酵母酒精发酵产物中挥发性风味物质的测定
酒曲和不同酵母发酵液中挥发性风味物质的GC-MS测定总离子流色谱图见图3,各挥发性风味物质检测结果见表1,酒曲和不同酵母发酵液中挥发性风味物质种类及含量见图4,产香非酿酒酵母挥发性风味物质韦恩图见图5。由图3和表1可知,挥发性风味物质检出最多的是产香非酿酒酵母Sf,共24种,其中OAV>1的有13种,其次是商业酿酒酵母Sc,共检出23种,其中OAV>1的只有9种,虽然产香非酿酒酵母Pk只共检出18种挥发性风味物质,但其OAV>1的有12种。
表1 酒曲和不同菌株发酵液中挥发性风味物质测定结果
Table 1 Determination results of volatile flavor substances in fermentation broth by Jiuqu and different strains
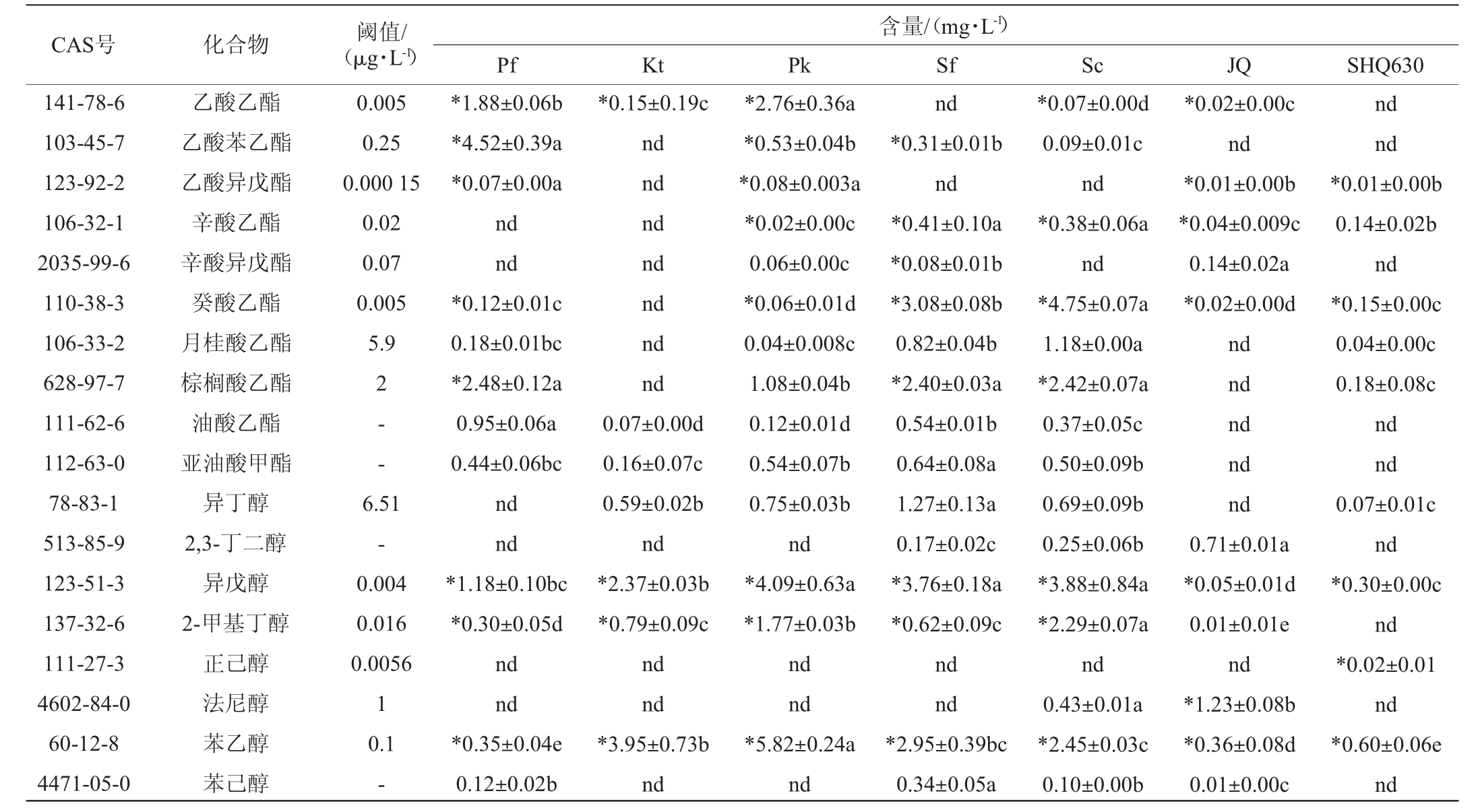
CAS号 化合物 阈值/(μg·L-1)141-78-6 103-45-7 123-92-2 106-32-1 2035-99-6 110-38-3 106-33-2 628-97-7 111-62-6 112-63-0 78-83-1 513-85-9 123-51-3 137-32-6 111-27-3 4602-84-0 60-12-8 4471-05-0乙酸乙酯乙酸苯乙酯乙酸异戊酯辛酸乙酯辛酸异戊酯癸酸乙酯月桂酸乙酯棕榈酸乙酯油酸乙酯亚油酸甲酯异丁醇2,3-丁二醇异戊醇2-甲基丁醇正己醇法尼醇苯乙醇苯己醇0.005 0.25 0.000 15 0.02 0.07 0.005 5.9 2- -6.51-0.004 0.016 0.0056 1 0.1-含量/(mg·L-1)Pf Kt Pk Sf Sc JQ SHQ630*1.88±0.06b*4.52±0.39a*0.07±0.00a nd nd*0.12±0.01c 0.18±0.01bc*2.48±0.12a 0.95±0.06a 0.44±0.06bc nd nd*1.18±0.10bc*0.30±0.05d nd nd*0.35±0.04e 0.12±0.02b*0.15±0.19c nd nd nd nd nd nd nd 0.07±0.00d 0.16±0.07c 0.59±0.02b nd*2.37±0.03b*0.79±0.09c nd nd*3.95±0.73b nd*2.76±0.36a*0.53±0.04b*0.08±0.003a*0.02±0.00c 0.06±0.00c*0.06±0.01d 0.04±0.008c 1.08±0.04b 0.12±0.01d 0.54±0.07b 0.75±0.03b nd*4.09±0.63a*1.77±0.03b nd nd*5.82±0.24a nd nd*0.31±0.01b nd*0.41±0.10a*0.08±0.01b*3.08±0.08b 0.82±0.04b*2.40±0.03a 0.54±0.01b 0.64±0.08a 1.27±0.13a 0.17±0.02c*3.76±0.18a*0.62±0.09c nd nd*2.95±0.39bc 0.34±0.05a*0.07±0.00d 0.09±0.01c nd*0.38±0.06a nd*4.75±0.07a 1.18±0.00a*2.42±0.07a 0.37±0.05c 0.50±0.09b 0.69±0.09b 0.25±0.06b*3.88±0.84a*2.29±0.07a nd 0.43±0.01a*2.45±0.03c 0.10±0.00b*0.02±0.00c nd*0.01±0.00b*0.04±0.009c 0.14±0.02a*0.02±0.00d nd nd nd nd nd 0.71±0.01a*0.05±0.01d 0.01±0.01e nd*1.23±0.08b*0.36±0.08d 0.01±0.00c nd nd*0.01±0.00b 0.14±0.02b nd*0.15±0.00c 0.04±0.00c 0.18±0.08c nd nd 0.07±0.01c nd*0.30±0.00c nd*0.02±0.01 nd*0.60±0.06e nd
续表
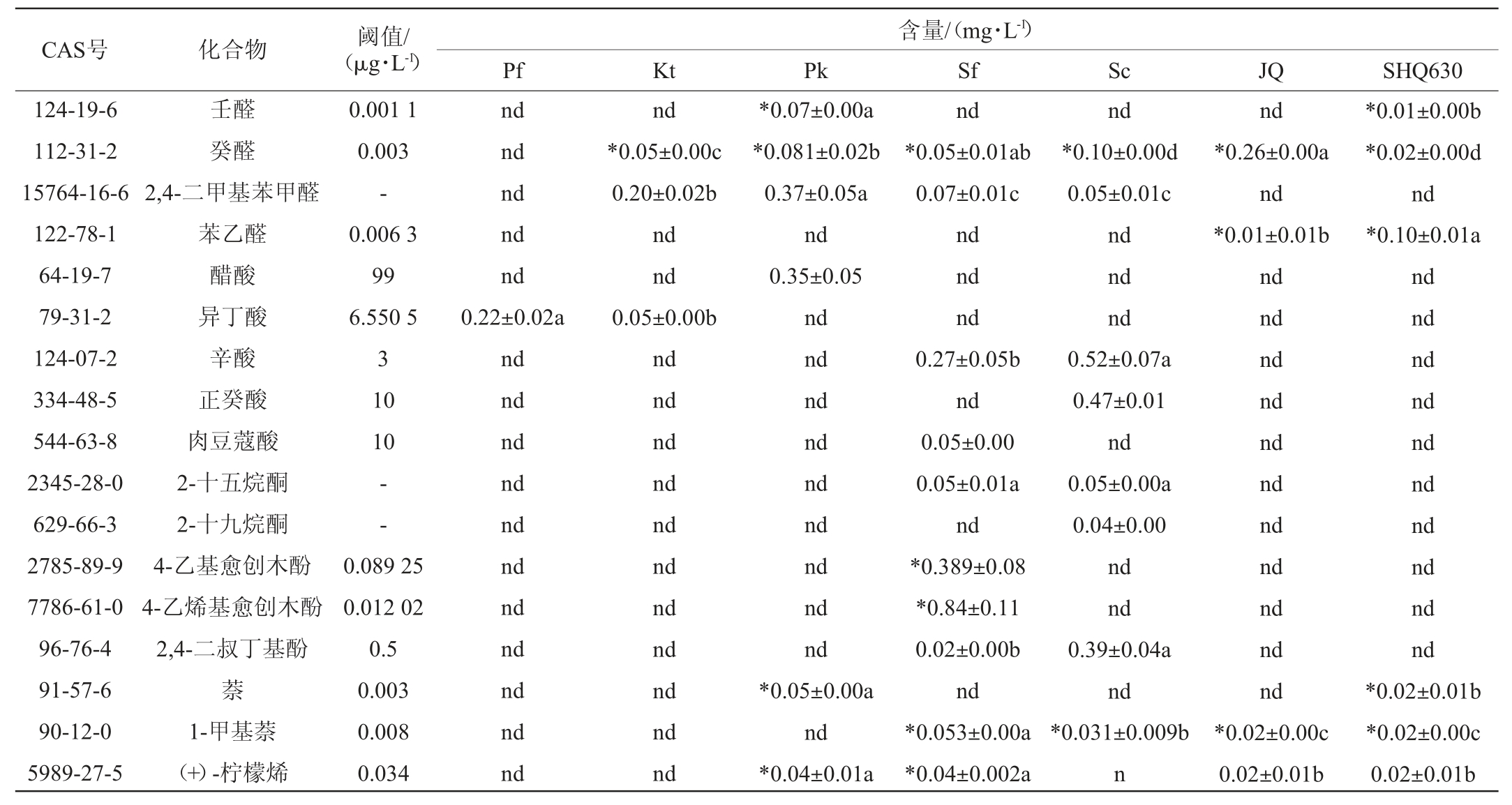
注:同行不同小写字母表示差异显著(P<0.05),“nd”表示未检出,“-”表示这种物质的阈值未在文献中查出。“*”表示OAV>1。
CAS号 化合物 阈值/(μg·L-1)124-19-6 112-31-2 15764-16-6 122-78-1 64-19-7 79-31-2 124-07-2 334-48-5 544-63-8 2345-28-0 629-66-3 2785-89-9 7786-61-0 96-76-4 91-57-6 90-12-0 5989-27-5壬醛癸醛2,4-二甲基苯甲醛苯乙醛醋酸异丁酸辛酸正癸酸肉豆蔻酸2-十五烷酮2-十九烷酮4-乙基愈创木酚4-乙烯基愈创木酚2,4-二叔丁基酚萘1-甲基萘(+)-柠檬烯0.001 1 0.003-0.006 3 99 6.550 5 3 10 10--0.089 25 0.012 02 0.5 0.003 0.008 0.034含量/(mg·L-1)Pf Kt Pk Sf Sc JQ SHQ630 nd nd nd nd nd 0.22±0.02a nd nd nd nd nd nd nd nd nd nd nd nd*0.05±0.00c 0.20±0.02b nd nd 0.05±0.00b nd nd nd nd nd nd nd nd nd nd nd*0.07±0.00a*0.081±0.02b 0.37±0.05a nd 0.35±0.05 nd nd nd nd nd nd nd nd nd*0.05±0.00a nd*0.04±0.01a nd*0.05±0.01ab 0.07±0.01c nd nd nd 0.27±0.05b nd 0.05±0.00 0.05±0.01a nd*0.389±0.08*0.84±0.11 0.02±0.00b nd*0.053±0.00a*0.04±0.002a nd*0.10±0.00d 0.05±0.01c nd nd nd 0.52±0.07a 0.47±0.01 nd 0.05±0.00a 0.04±0.00 nd nd 0.39±0.04a nd*0.031±0.009b n nd*0.26±0.00a nd*0.01±0.01b nd nd nd nd nd nd nd nd nd nd nd*0.02±0.00c 0.02±0.01b*0.01±0.00b*0.02±0.00d nd*0.10±0.01a nd nd nd nd nd nd nd nd nd nd*0.02±0.01b*0.02±0.00c 0.02±0.01b
图3 酒曲和不同菌株发酵液中挥发性风味物质GC-MS分析总离子流色谱图
Fig. 3 Total ion chromatogram of volatile flavor substances in fermentation broth by Jiuqu and different strains analyzed by GC-MS
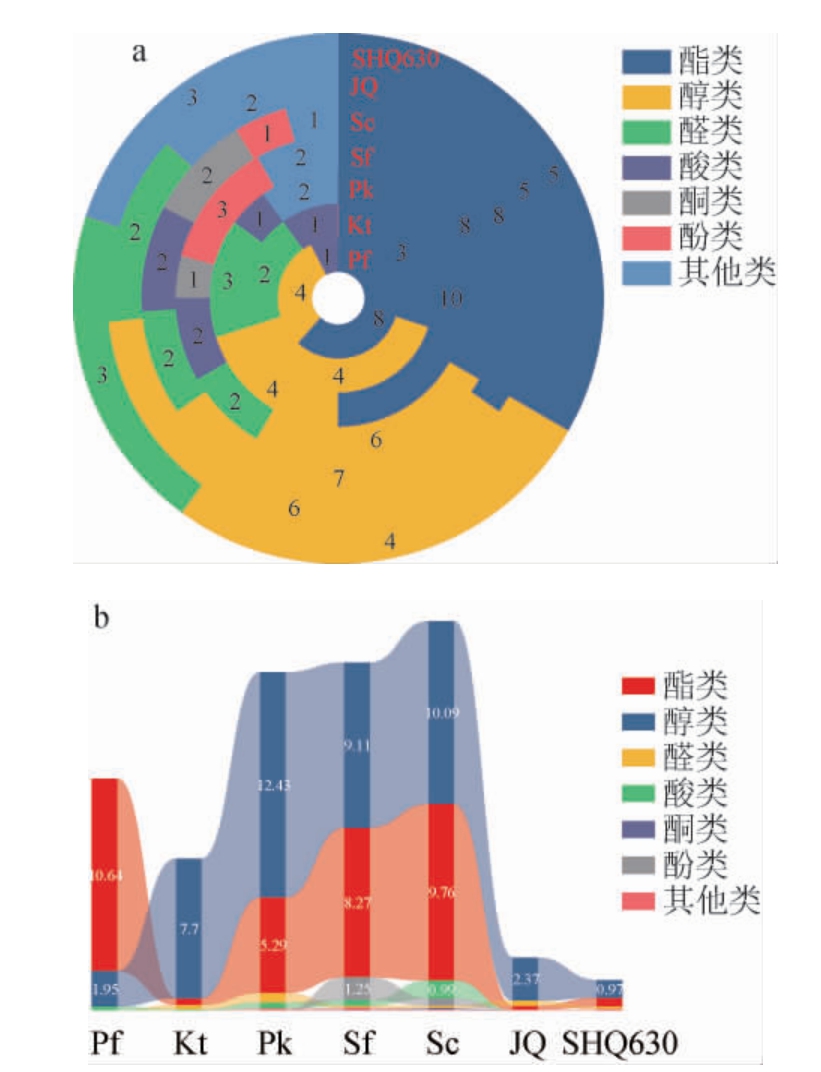
图4 酒曲和不同酵母发酵液挥发性风味物质种类(a)及含量(b)
Fig. 4 Types (a) and contents (b) of volatile flavor compounds in fermentation broth by Jiuqu and different yeasts
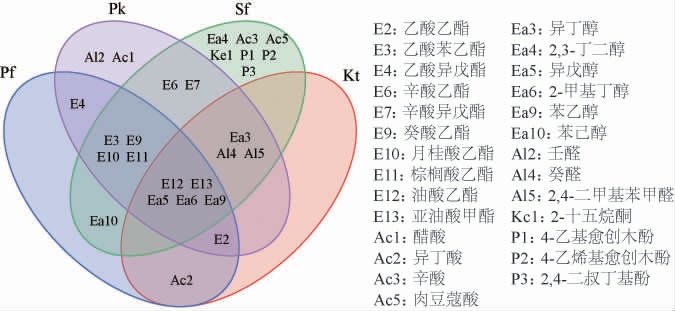
图5 不同非酿酒酵母发酵液挥发性风味物质韦恩图
Fig. 5 Venn diagram of volatile flavor substances in fermentation broth by different non-Saccharomyces cerevisiae
由图4a和图4b可知,产酯种类最多的为产香非酿酒酵母Pk,共10种,酯类物质含量最多的为产香非酿酒酵母Pf,为10.64 mg/L;产醇种类最多的为商业酿酒酵母Sc,共7种,醇类物质含量最多的为产香非酿酒酵母Pk,为12.43 mg/L。
由图5可知,油酸乙酯、亚油酸乙酯、异戊醇、2-甲基丁醇和苯乙醇是产香非酿酒酵母酒精发酵产物中所共有的挥发性风味物质。所检测到的酯类物质呈现不同的水果香味和花香[22];醇类物质是酵母代谢的次级产物之一,是酒中主要香气物质,醇类物质呈现出的香味较为复杂[23],如产香非酿酒酵母酒精发酵产物中所共有的挥发性风味物质异戊醇具有浓郁的威士忌香味,2-甲基丁醇具有酒香,而苯乙醇是果香和花香;几组发酵液中醛、酸、酮、苯以及酚的种类和含量都较少,然而却可以为风味做出独特的贡献。
酒曲和不同酵母发酵液中挥发性风味物质测定结果表明,酒曲和酵母的存在能够丰富食醋的风味,产香非酿酒酵母能够产生酿酒酵母所没有的独特风味,其中产香非酿酒酵母Sf产生风味最为丰富并且能生成具有丁香香料风味的4-乙基愈创木酚和4-乙烯基愈创木酚两种独特物质,能够增添食醋的柔和感,起到呈香、助香的作用[24-26]。
3 结论
本实验研究了酒曲和6株酵母在模拟食醋酒精发酵阶段消耗还原糖产乙醇的能力以及在不同酸度和乙醇胁迫下菌株的生长情况,并以大米为底物,利用气相色谱-质谱联用(GC-MS)技术检测酒精发酵初期各菌株产生的挥发性风味物质特征。结果表明,在酒精发酵过程中,菌株SHQ630产乙醇能力最强,菌株Pf、Kt及Pk的产乙醇能力与菌株Sc和酒曲(JQ)相当,菌株Sf产乙醇能力最弱。耐受性试验结果表明,菌株Sf和Pk耐酸性较好,菌株Pf和Kt乙醇耐受性较好。GC-MS结果表明,菌株Sf、Pk、Pf及Kt发酵液分别共检出挥发性风味成分24种、18种、13种、10种,菌株Pk产酯种类最多(10种)、产醇最高(12.43 mg/L),菌株Pf产酯最高(10.64 mg/L)。结果显示,非酿酒酵母能够提升大红浙醋酒精发酵阶段风味的丰富性和芳香性。在大红浙醋酒精发酵阶段,不同产香非酿酒酵母的存在,能够使大红浙醋酒精发酵阶段的风味更加丰富、芳香,并能提升乙醇产量,使接下来的醋酸发酵阶段,醋酸菌有更多的底物。
[1]吴子航,张祥龙,刘丹彤,等.中国传统食醋营养健康物质组成研究进展[J].中国酿造,2022,41(12):9-14.
[2]陈建红,沈海锋,杨明,等.陈酿时间对玫瑰醋挥发性风味物质的影响[J].食品工业科技,2024,45(3):270-276.
[3] FANG G Y, CHAI L J, ZHONG X Z, et al. Deciphering the succession patterns of bacterial community and their correlations with environmental factors and flavor compounds during the fermentation of Zhejiang rosy vinegar[J].Int J Food Microbiol,2021,341:109070.
[4]石晖琴,张工,张彦民,等.大红浙醋醋酸菌分离及其产酸关键氨基酸分析[J].中国酿造,2022,41(2):34-39.
[5] LI T, WANG X W, LI C Y, et al. Investigation of microbial succession and volatile compounds dynamics during the fermentation of traditional cereal vinegar in Xinjiang[J].LWT-Food Sci Technol,2023,186:115258.
[6]袁英豪,何梦娇,唐春麟,等.醋源生香酵母的筛选及其特性研究[J/OL].食品与发酵工业:1-12[2024-03-06].https://doi.org/10.13995/j.cnki.11-1802/ts.037324.
[7]曹施静,胡海霞,楠极.四大名醋发酵微生物研究现状[J].农产品加工,2023,12(22):98-102.
[8]蒋予箭,黄炳文,李婷.补料发酵法生产玫瑰醋工艺优化及风味分析[J].农业工程学报,2019,35(15):304-311.
[9]方冠宇,穆晓静,蒋予箭.发酵罐结构对浙江玫瑰醋品质的影响[J].食品科学,2020,41(6):184-192.
[10]方冠宇,黄炳文,蒋予箭.基于高通量测序的浙江玫瑰醋发酵过程中细菌菌群结构及其动态演替[J].食品科学,2020,41(4):125-133.
[11] SADOUDI M, TOURDOT-MARÉCHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J].Food Microbiol,2012,32(2):243-253.
[12]方冠宇,姜佳丽,蒋予箭.多菌混合发酵对酱油的风味物质形成及感官指标的影响[J].中国食品学报,2019,19(9):154-163.
[13]韩志双,刘军,黄思敏,等.传统麸醋醋醅中一株产香酵母的筛选鉴定及生长特性研究[J].中国调味品,2013,38(10):41-45.
[14]王明瑞,侯彦喜,张亚丹.3,5-二硝基水杨酸法测定发酵液中多糖含量[J].现代食品,2020,68(4):216-222.
[15] BINATI R L, JUNIOR W J F L, LUZZINI G, et al. Contribution of non-Saccharomyces yeasts to wine volatile and sensory diversity:A study on Lachancea thermotolerans, Metschnikowia spp. and Starmerella bacillaris strains isolated in Italy[J].Int J Food Microbiol,2020,318:108470.
[16]SHI H Q,LI J J,ZHANG Y J,et al.Effect of wheat germination on nutritional properties and the flavor of soy sauce[J]. Food Biosci, 2022,48:101738.
[17]赵丽丽,史冠莹,蒋鹏飞,等.基于OAV和GC-O-MS法鉴定香椿中的关键香气成分[J].现代食品科技,2022,38(11):264-275.
[18]冯文倩,王倩,刘延琳,等.低产乙醇本土有孢汉逊酵母的筛选及酿造特性[J].食品与发酵工业,2021,47(21):9-17.
[19]徐清萍,金鑫,郭苗苗,等.红茶菌在谷物原料发酵制醋中的应用[J].中国酿造,2019,38(6):90-95.
[20]王春晓,袁国亿,苏伟,等.白酒制曲环境和成品曲中产酸微生物分析[J].食品科学,2020,41(18):120-126.
[21]范光森,许岱,富志磊,等.古井贡酒曲中酵母的分离及其产香挥发性风味物质分析[J].中国食品学报,2018,18(7):220-229.
[22]付安珍,祁乙雯,李双,等.不同品种杏酿造白兰地香气成分分析[J].中国酿造,2021,40(1):169-175.
[23]张秀玲,汲润,李凤凤,等.发酵工艺对蓝靛果酒功能性及香气成分的影响[J].食品科学,2022,43(10):189-198.
[24]邹谋勇,何理琴,孙启星,等.产4-乙基愈创木酚酵母的鉴定及其在酱油中的应用[J].食品科学,2021,42(12):138-144.
[25]赵庭,姜琳,贾晶,等.小麦啤酒上面啤酒酵母生成4-乙烯基愈创木酚的条件优化及其发酵动力学模型构建[J].轻工学报,2022,37(2):15-22.
[26]叶博文,闵恺,包晓丽.中国传统食醋香气物质分析研究进展[J].应用技术学报,2023,23(4):341-348.