红曲霉(Monascus sp.)是一类嗜醇喜酸真菌,幼龄时其菌丝为白色,因菌丝成熟过程中产色素,逐渐由白色变为红色。红曲霉的最适生长pH和温度分别是3.5~5.0和25~30 ℃[1-2],可产糖化酶、酯化酶、蛋白酶等多种酶系,是传统发酵食品(白酒、黄酒和食醋等)生产中常见的功能菌之一[3]。
随着白酒生产过程中功能菌株的不断挖掘,红曲霉在白酒酿造中的贡献亦引起了广泛的重视[4-5]。已有的研究结果表明,Monascus在多种大曲中都是优势真菌[6-7]。目前,接种Monascus强化浓、清香型大曲的技术已被证明是改善大曲品质及提高基酒品质与产率的有效措施之一。如罗小叶等[8]利用高产酯化酶的紫色红曲霉(Monascus purpureus)生产的高酯化大曲,显著提高了浓香型基酒的酸类和酯类挥发组分的含量及产率;刘新宇[9]利用烟色红曲霉(Monascus rubber)和橙色红曲霉(Monascus aurantiacus)强化清香型大曲,结果发现酒体特征和香气组分均得到了改善。此外,黄酒生产中应用红曲霉菌,不仅赋予了红艳、香甜、味醇等感官特色,且提高了酯类组分的含量[10-11],但其在酱香型白酒及其大曲生产方面的应用研究则鲜见报道。
本研究采用可培养技术从呈粉红色的高温大曲中分离红曲霉(Monascus)菌株,结合多元统计分析方法研究其在纯培养麦曲、模拟白酒固态发酵及强化大曲中的代谢特征,进而筛选优良的功能红曲霉菌株,并通过形态观察和分子生物学技术对筛选菌株进行鉴定,旨在解析红曲霉功能菌株在高温及高酸、醇环境中的代谢多样性特征,为开发高温强化大曲生产技术提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
小麦、高粱和工厂生产用高温大曲粉:四川泸州老窖股份有限公司;呈粉红色的高温大曲:贵州省茅台镇某知名酒企。
1.1.2 试剂
草酸、柠檬酸、苹果酸、乳酸、乙酸和辛酸甲酯等标准品(均为色谱级):美国Sigma-Aldrich公司;氢氧化钠、浓硫酸、浓盐酸、己酸、无水乙醇、葡萄糖和淀粉(均为分析纯):成都金山化学试剂有限公司;植物脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(通用型):北京擎科生物科技有限公司;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
麦芽汁琼脂培养基[12]:麦芽糖度10°Bx,加琼脂2%,121 ℃高压蒸汽灭菌20 min。
麦曲培养基:在63 g的小麦粉中加入37 g水,搅拌均匀,润料30 min,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
CX31显微镜:日本奥林巴斯有限公司;Trace 1300-TSQ 9000气相色谱-质谱联用(gas chromatography-mass spec trometry,GC-MS)仪:美国赛默飞世尔科技公司;50/30 μm DVB/CAR/PDMS固相微萃取头:美国Supelco公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;Alltech OA-1000有机酸色谱柱(300×6.5 mm):美国格雷斯公司;C18固相萃取小柱(solid phase extraction column,SPEC):成都思为科学仪器有限公司。
1.3 试验方法
1.3.1 功能红曲霉菌株的分离及筛选
称取呈粉红色的高温大曲粉2.00 g,加入无菌生理盐水制备成均匀的菌团悬浮液,10倍梯度稀释并血球计数后,取活菌数为1×102~1×104 CFU/mL的稀释液涂布于麦芽汁琼脂培养基平板上,于30 ℃条件下培养2~3 d。挑取呈白色菌丝的菌落接种于相同培养基斜面,同样温度条件下培养2~3 d,将菌丝呈红色的菌株作为分离菌株,经多次纯化后得到纯菌株。按1%的接种量将分离菌株接种于麦曲培养基中,30 ℃条件下培养3~5 d,长满呈红色的菌丝(麦曲)后,45 ℃烘干,粉碎(麦曲粉),参照轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》和岳建明等[13]的方法测定其糖化力、液化力、酯化力和色价。
1.3.2 筛选菌株代谢特性分析
测定麦曲粉中的有机酸和挥发性代谢组分,并将麦曲粉按2%的接种量接种于常压蒸煮的高粱中进行模拟固态酿酒发酵。高粱固态发酵模拟酿酒试验参照文献[14]并略作修改:将粉碎的高粱(粉碎度<20目筛的高粱质量占比约为85%)以80 ℃热水(水与高粱的质量比为2∶1)浸泡1 h后,加入20%(以干高粱计)提前蒸至无异味的稻壳,蒸煮约30 min(高粱透明无白心),出甑后适量打量水(撒90 ℃热水),摊晾鼓风冷却至温度低于40 ℃,实验组加入生产用高温大曲粉15%和麦曲粉2%,对照组(KB)只加入15%生产用高温大曲粉(以干高粱计)。室温堆积糖化1 d后,将其分装至灭菌的塑料盒(28 cm×19 cm×14 cm),封口膜覆盖后,置于真空袋中抽真空,30 ℃恒温厌氧发酵28 d。每隔7 d取样一次,检测糟醅的理化指标,并检测发酵结束后糟醅的代谢组分。
1.3.3 筛选菌株强化高温大曲
将筛选菌株制备的麦曲粉按3%接种于碎小麦(过20目筛,50%半细粉和50%粗粉及麦皮)中,加水拌料、混匀,人工踩曲为曲坯(曲培的含水量为37%左右),摊晾30 min,置于曲房盖满稻草后自然发酵,待曲心温度高于65 ℃时,进行第一次翻曲后再发酵,当曲心温度再次高于65 ℃时,第二次翻曲,继续发酵28 d,转房贮存。随机挑选不同菌株强化的高温大曲,粉碎后取样,于-20 ℃下保存,测定其理化指标和挥发性风味组分。
1.3.4 筛选菌株的鉴定
形态学观察[15]:将复筛菌株接种于麦芽汁琼脂培养基,30 ℃恒温培养5 d,通过光学显微镜观察其菌体及菌落的形态特征。
分子生物学鉴定:使用植物DNA提取试剂盒(通用型)提取复筛菌株的基因组DNA,以其为模板,采用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和IST4(5'-TCCTCCGCTTATTGATATGC-3')聚合酶链式反应(polymerase chain reaction,PCR)扩增ITS区基因序列,PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托北京擎科生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性检索,选取同源性较高的模式菌株的ITS基因序列,采用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 分析检测方法
有机酸测定:参考ZHANG L Q等[16]的HPLC法。
挥发性代谢组分测定:参考ZHENG J等[17]的顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-GC-MS法。
理化指标(水分、还原糖、总糖、总酸和酒精度)的测定:按照《白酒分析与检测技术》[18]和QB/T 4257—2011《酿酒大曲通用分析方法》规定的方法,并计算总糖利用率,其计算公式如下:
1.3.6 数据处理与统计分析
所有实验均重复进行3次,结果以“平均值±标准差”表示,采用SPSS 25.0软件和Duncan方法,对数据进行方差分析和多重测试分析。采用Simca 14.1软件对挥发性风味物质进行偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA);采用Origin 2021软件绘图。
2 结果与分析
2.1 红曲霉菌株的分离及筛选
从麦芽汁琼脂培养基中共挑取出40株(H1~H40)菌丝呈白色的菌株,经麦芽汁琼脂斜面培养基培养后,仅获得12株菌丝呈红色的分离菌株。将12株分离菌株纯培养麦曲后,测定麦曲的酯化力、糖化力、液化力和色价,结果见表1。
表1 不同菌株纯培养麦曲酯化力、糖化力、液化力及色价的检测结果
Table 1 Determination results of esterifying power, saccharifying power, liquefying power and color value of pure culture wheat Qu with different strains
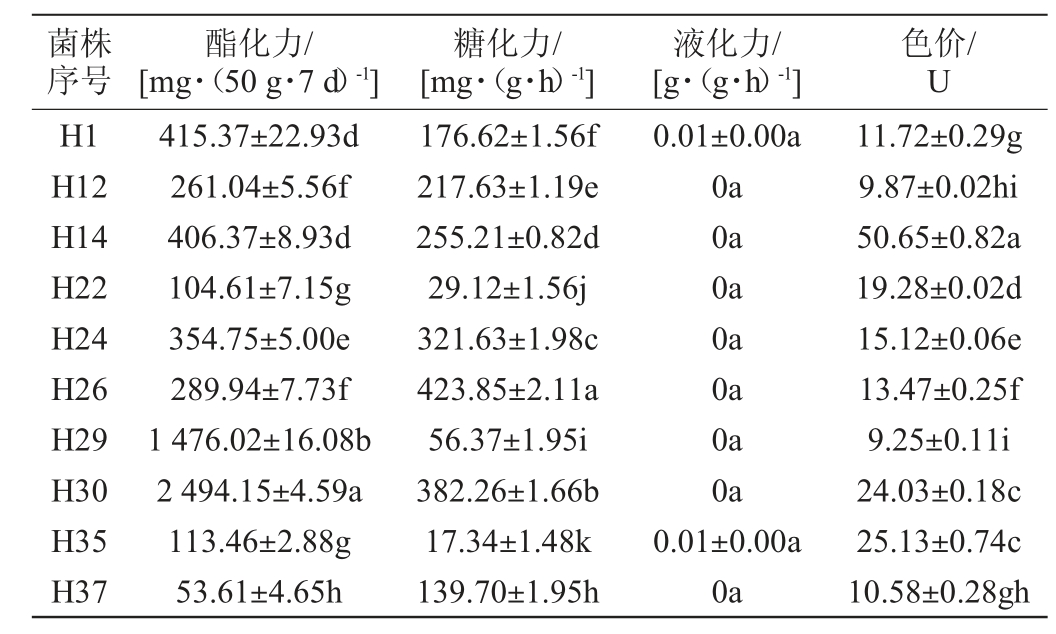
菌株序号酯化力/[mg·(50 g·7 d)-1]糖化力/[mg·(g·h)-1]液化力/[g·(g·h)-1]色价/U H1 H12 H14 H22 H24 H26 H29 H30 H35 H37 415.37±22.93d 261.04±5.56f 406.37±8.93d 104.61±7.15g 354.75±5.00e 289.94±7.73f 1 476.02±16.08b 2 494.15±4.59a 113.46±2.88g 53.61±4.65h 176.62±1.56f 217.63±1.19e 255.21±0.82d 29.12±1.56j 321.63±1.98c 423.85±2.11a 56.37±1.95i 382.26±1.66b 17.34±1.48k 139.70±1.95h 0.01±0.00a 0a 0a 0a 0a 0a 0a 0a 0.01±0.00a 0a 11.72±0.29g 9.87±0.02hi 50.65±0.82a 19.28±0.02d 15.12±0.06e 13.47±0.25f 9.25±0.11i 24.03±0.18c 25.13±0.74c 10.58±0.28gh
续表

注:同列不同字母表示差异显著(P<0.05)。
菌株序号色价/U H38 H39酯化力/[mg·(50 g·7 d)-1]糖化力/[mg·(g·h)-1]液化力/[g·(g·h)-1]403.65±3.85d 479.51±20.46c 153.86±0.86g 8.61±2.30l 0a 0a 28.08±1.44b 13.18±0.30f
由表1可知,分离菌株H30的酯化力最高,为2 494.15 mg/(50 g·7 d);分离菌株H26的糖化力最高,为423.85 mg/(g·h);分离菌株H14的色价最高,为50.65 U;分离菌株H39的糖化力[8.16 mg/(g·h)]显著低于其他分离菌株(P<0.05),且酯化力[479.51 mg/(50 g·7 d)]和色价(13.18 U)也较低,此外,所有菌株的液化力都较低。综上,选取H14、H26、H30和H39(对比)4株分离菌株进一步探究。
2.2 筛选菌株代谢特性的研究
2.2.1 不同筛选菌株纯培养麦曲代谢组分间的差异
不同筛选菌株纯培养麦曲的有机酸种类及含量见图1。由图1可知,从4种麦曲中均检测出3种有机酸,分别为乙酸、苹果酸和柠檬酸,且均以乙酸和苹果酸为主。其中菌株H14产有机酸的能力最强,有机酸含量达22.36 mg/kg。不同菌株产有机酸能力具有差异,如菌株H14和H26分别产乙酸和苹果酸的能力最强。
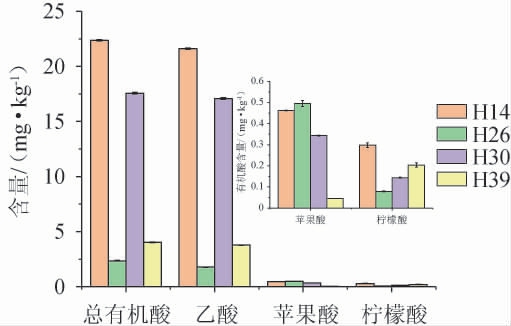
图1 不同菌株纯培养麦曲有机酸种类及含量的检测结果
Fig. 1 Determination results of organic acids species and contents of pure culture wheat Qu with different strains
采用HS-SPME-GC-MS法检测不同初筛菌株纯培养麦曲的挥发性风味成分,结果见表2。
表2 不同菌株纯培养麦曲挥发性代谢组分GC-MS分析结果
Table 2 GC-MS analysis results of volatile metabolites of pure culture wheat Qu with different strains μg/kg
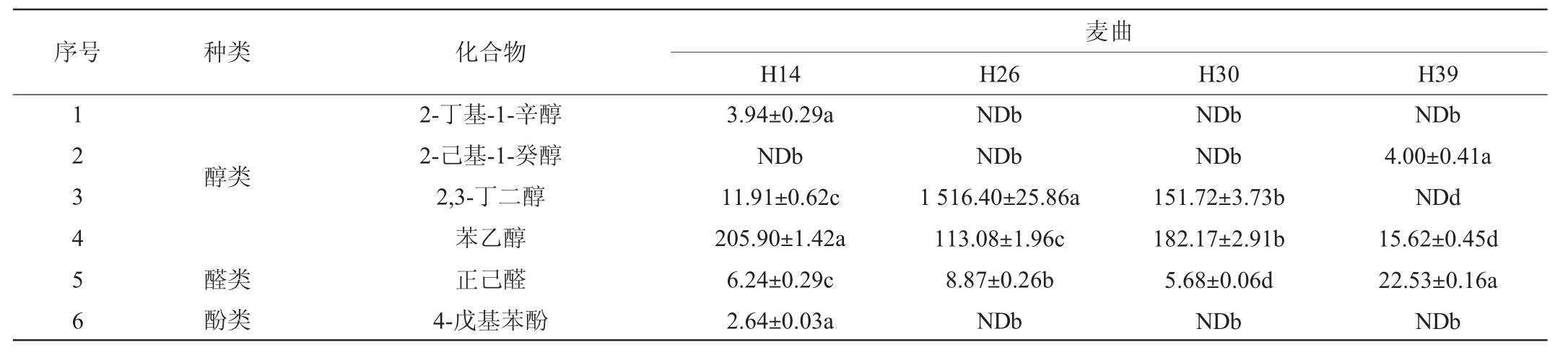
序号 种类 化合物麦曲H14 H26 H30 H39 123456醇类醛类酚类2-丁基-1-辛醇2-己基-1-癸醇2,3-丁二醇苯乙醇正己醛4-戊基苯酚3.94±0.29a NDb 11.91±0.62c 205.90±1.42a 6.24±0.29c 2.64±0.03a NDb NDb 1 516.40±25.86a 113.08±1.96c 8.87±0.26b NDb NDb NDb 151.72±3.73b 182.17±2.91b 5.68±0.06d NDb NDb 4.00±0.41a NDd 15.62±0.45d 22.53±0.16a NDb
续表
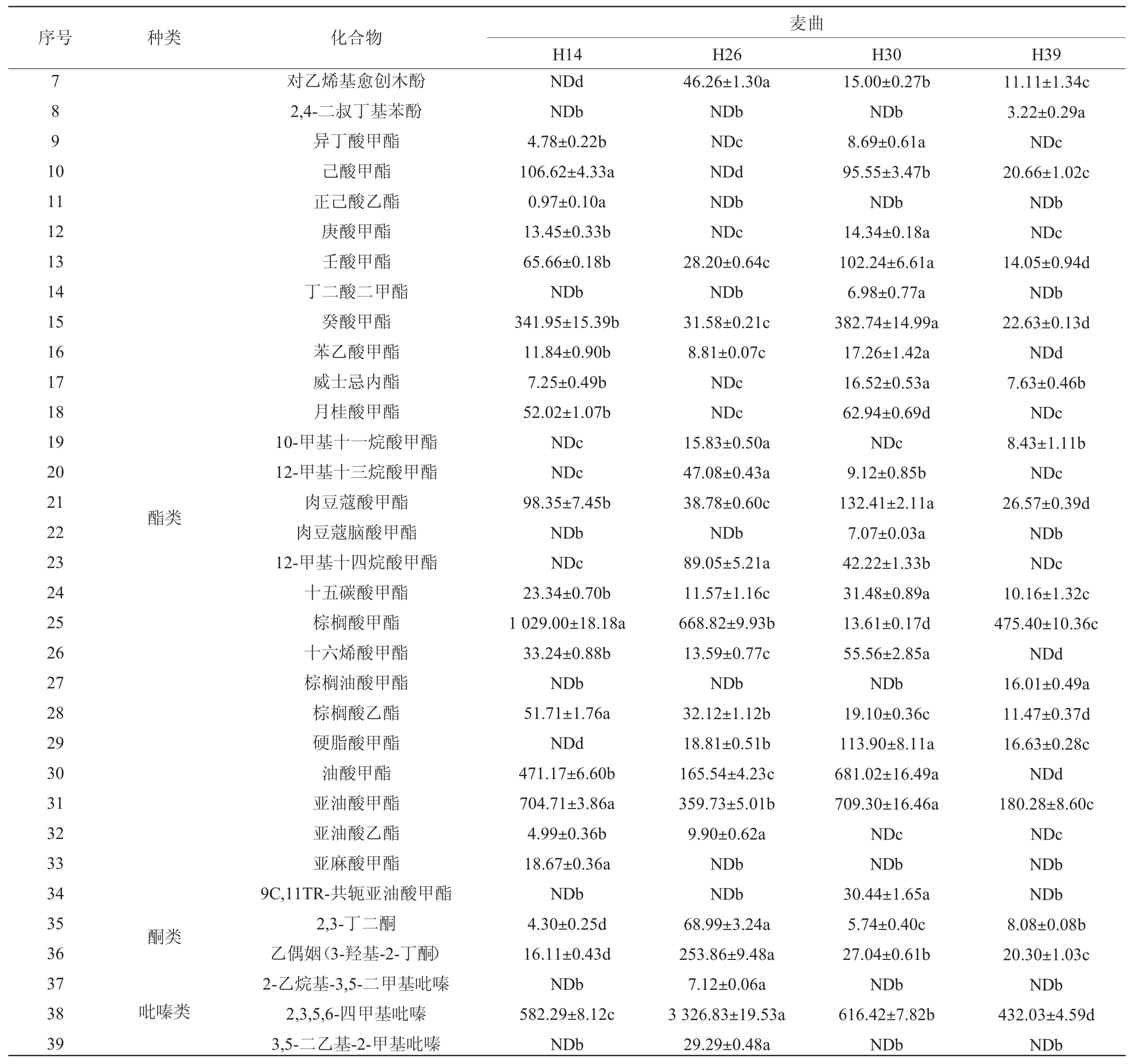
注:同行不同字母表示差异显著(P<0.05),“ND”表示未检测出。
序号 种类 化合物7891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39酯类酮类吡嗪类对乙烯基愈创木酚2,4-二叔丁基苯酚异丁酸甲酯己酸甲酯正己酸乙酯庚酸甲酯壬酸甲酯丁二酸二甲酯癸酸甲酯苯乙酸甲酯威士忌内酯月桂酸甲酯10-甲基十一烷酸甲酯12-甲基十三烷酸甲酯肉豆蔻酸甲酯肉豆蔻脑酸甲酯12-甲基十四烷酸甲酯十五碳酸甲酯棕榈酸甲酯十六烯酸甲酯棕榈油酸甲酯棕榈酸乙酯硬脂酸甲酯油酸甲酯亚油酸甲酯亚油酸乙酯亚麻酸甲酯9C,11TR-共轭亚油酸甲酯2,3-丁二酮乙偶姻(3-羟基-2-丁酮)2-乙烷基-3,5-二甲基吡嗪2,3,5,6-四甲基吡嗪3,5-二乙基-2-甲基吡嗪麦曲H14 H26 H30 H39 NDd NDb 4.78±0.22b 106.62±4.33a 0.97±0.10a 13.45±0.33b 65.66±0.18b NDb 341.95±15.39b 11.84±0.90b 7.25±0.49b 52.02±1.07b NDc NDc 98.35±7.45b NDb NDc 23.34±0.70b 1 029.00±18.18a 33.24±0.88b NDb 51.71±1.76a NDd 471.17±6.60b 704.71±3.86a 4.99±0.36b 18.67±0.36a NDb 4.30±0.25d 16.11±0.43d NDb 582.29±8.12c NDb 46.26±1.30a NDb NDc NDd NDb NDc 28.20±0.64c NDb 31.58±0.21c 8.81±0.07c NDc NDc 15.83±0.50a 47.08±0.43a 38.78±0.60c NDb 89.05±5.21a 11.57±1.16c 668.82±9.93b 13.59±0.77c NDb 32.12±1.12b 18.81±0.51b 165.54±4.23c 359.73±5.01b 9.90±0.62a NDb NDb 68.99±3.24a 253.86±9.48a 7.12±0.06a 3 326.83±19.53a 29.29±0.48a 15.00±0.27b NDb 8.69±0.61a 95.55±3.47b NDb 14.34±0.18a 102.24±6.61a 6.98±0.77a 382.74±14.99a 17.26±1.42a 16.52±0.53a 62.94±0.69d NDc 9.12±0.85b 132.41±2.11a 7.07±0.03a 42.22±1.33b 31.48±0.89a 13.61±0.17d 55.56±2.85a NDb 19.10±0.36c 113.90±8.11a 681.02±16.49a 709.30±16.46a NDc NDb 30.44±1.65a 5.74±0.40c 27.04±0.61b NDb 616.42±7.82b NDb 11.11±1.34c 3.22±0.29a NDc 20.66±1.02c NDb NDc 14.05±0.94d NDb 22.63±0.13d NDd 7.63±0.46b NDc 8.43±1.11b NDc 26.57±0.39d NDb NDc 10.16±1.32c 475.40±10.36c NDd 16.01±0.49a 11.47±0.37d 16.63±0.28c NDd 180.28±8.60c NDc NDb NDb 8.08±0.08b 20.30±1.03c NDb 432.03±4.59d NDb
由表2可知,从纯培养麦曲中共检出39种挥发性风味成分,包括醇类(4种)、醛类(1种)、酚类(3种)、酯类(26种)、酮类(2种)和吡嗪(3种)6类。不同菌株间的挥发性风味成分组成的轮廓不同。除菌株H26外,其余3株菌株纯培养麦曲中的酯类物质相对含量>60%,且主要为棕榈酸甲酯等长链脂肪酸甲酯。菌株H26纯培养麦曲中的吡嗪类物质含量最高,相对含量达到48.67%,其次为醇类物质,相对含量为23.58%。这些菌株纯培养麦曲中含有12种共有的挥发性风味成分,主要包括2,3-丁二酮、乙偶姻、2,3,5,6-四甲基吡嗪、苯乙醇、己醛、癸酸甲酯和棕榈酸甲酯等。此外,菌株H14、H26、H30和H39分别有4种、2种、3种和3种独有的成分。
基于PLS-DA模型解析菌株对麦曲挥发性风味成分的影响,结果见图2。由图2可知,自变量拟合指数(R2X)、因变量拟合指数(R2Y)和模型预测指数(Q2)分别为0.994、0.995和0.989,R2和Q2均接近1,表明模型可靠。菌株H26纯培养麦曲位于PLS1轴的负半轴,菌株H14、H30和H39纯培养麦曲均位于PLS1轴的正半轴,说明菌株H26和其他3种菌株代谢的挥发性成分轮廓不同,且主要由2,3,5,6-四甲基吡嗪、2,3-丁二醇和一些酯类物质的含量所致。由此可见,菌株H14、H30和H39主要代谢组分为酯类,而菌株H26主要代谢组分则是吡嗪类。
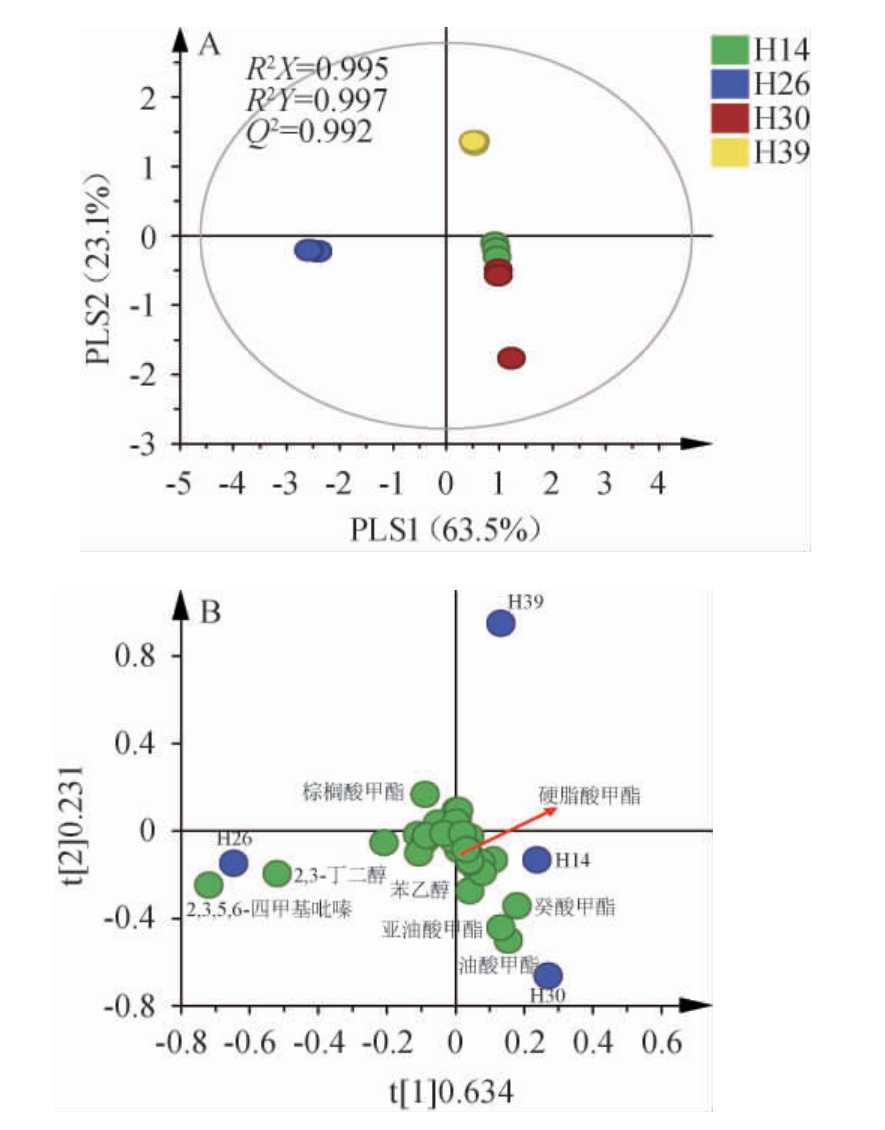
图2 不同菌株纯培养麦曲挥发性代谢组分的偏最小二乘判别分析得分图(A)与载荷图(B)
Fig. 2 Partial least squares discriminant analysis score chart (A) and load chart (B) of pure culture wheat Qu with different strains
基于变量投影重要性(variable importance in projection,VIP)>1得到8种显著影响其风味特征的挥发性代谢组分,分别为2,3,5,6-四甲基吡嗪、2,3-丁二醇、苯乙醇、亚油酸甲酯、油酸甲酯、棕榈酸甲酯、硬脂酸甲酯和癸酸甲酯。同属的种/株间对特征风味的贡献差异显著,菌株H26合成2,3,5,6-四甲基吡嗪和2,3-丁二醇的能力最强,后者是合成前者的前体物质[19],其中2,3,5,6-四甲基吡嗪具有烘焙香和甜香味,是酱香型白酒重要呈香组分[20-21]。菌株H14则是合成赋予玫瑰花香的苯乙醇的能力显著高于其余菌株[22]。菌株H30则是合成赋予水果香和花香的油酸甲酯和癸酸甲酯的能力较强[23-24]。而菌株H39对差异代谢物的贡献都较低。
2.2.2 模拟固态酿酒发酵糟醅主要代谢组分的差异
将不同菌株纯培养麦曲应用于模拟固态酿酒发酵中,测定糟醅的理化性质,并计算总糖利用率,结果见表3。
表3 不同菌株模拟固态酿酒发酵过程糟醅理化指标的测定结果及总糖利用率
Table 3 Determination results of physicochemical indexes and total sugar utilization in fermented grains of different strains during simulated solid-state brewing
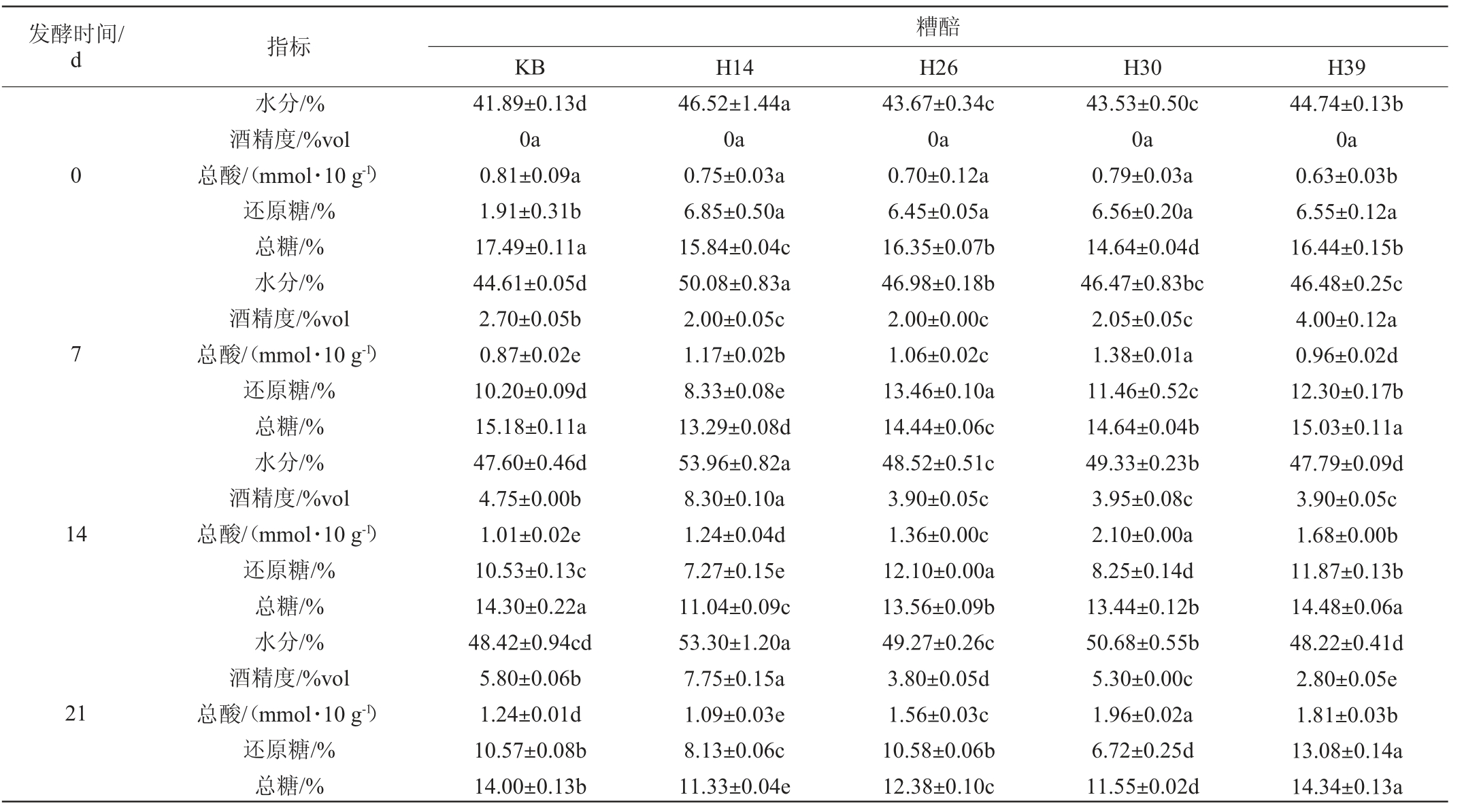
发酵时间/d 指标糟醅KB H14 H26 H30 H39 0 7 14 21水分/%酒精度/%vol总酸/(mmol·10 g-1)还原糖/%总糖/%水分/%酒精度/%vol总酸/(mmol·10 g-1)还原糖/%总糖/%水分/%酒精度/%vol总酸/(mmol·10 g-1)还原糖/%总糖/%水分/%酒精度/%vol总酸/(mmol·10 g-1)还原糖/%总糖/%41.89±0.13d 0a 0.81±0.09a 1.91±0.31b 17.49±0.11a 44.61±0.05d 2.70±0.05b 0.87±0.02e 10.20±0.09d 15.18±0.11a 47.60±0.46d 4.75±0.00b 1.01±0.02e 10.53±0.13c 14.30±0.22a 48.42±0.94cd 5.80±0.06b 1.24±0.01d 10.57±0.08b 14.00±0.13b 46.52±1.44a 0a 0.75±0.03a 6.85±0.50a 15.84±0.04c 50.08±0.83a 2.00±0.05c 1.17±0.02b 8.33±0.08e 13.29±0.08d 53.96±0.82a 8.30±0.10a 1.24±0.04d 7.27±0.15e 11.04±0.09c 53.30±1.20a 7.75±0.15a 1.09±0.03e 8.13±0.06c 11.33±0.04e 43.67±0.34c 0a 0.70±0.12a 6.45±0.05a 16.35±0.07b 46.98±0.18b 2.00±0.00c 1.06±0.02c 13.46±0.10a 14.44±0.06c 48.52±0.51c 3.90±0.05c 1.36±0.00c 12.10±0.00a 13.56±0.09b 49.27±0.26c 3.80±0.05d 1.56±0.03c 10.58±0.06b 12.38±0.10c 43.53±0.50c 0a 0.79±0.03a 6.56±0.20a 14.64±0.04d 46.47±0.83bc 2.05±0.05c 1.38±0.01a 11.46±0.52c 14.64±0.04b 49.33±0.23b 3.95±0.08c 2.10±0.00a 8.25±0.14d 13.44±0.12b 50.68±0.55b 5.30±0.00c 1.96±0.02a 6.72±0.25d 11.55±0.02d 44.74±0.13b 0a 0.63±0.03b 6.55±0.12a 16.44±0.15b 46.48±0.25c 4.00±0.12a 0.96±0.02d 12.30±0.17b 15.03±0.11a 47.79±0.09d 3.90±0.05c 1.68±0.00b 11.87±0.13b 14.48±0.06a 48.22±0.41d 2.80±0.05e 1.81±0.03b 13.08±0.14a 14.34±0.13a
续表
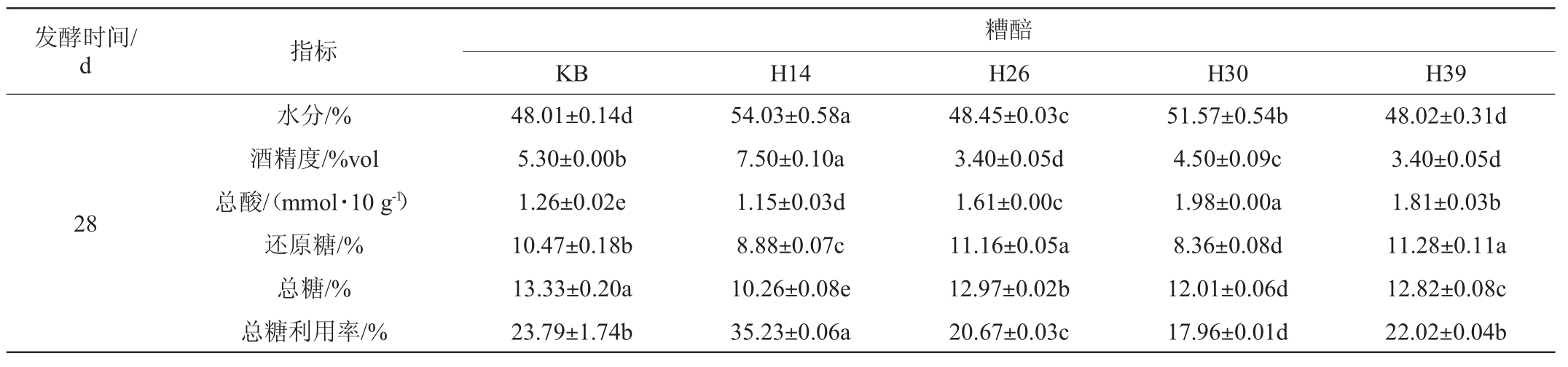
注:同行不同字母表示差异显著(P<0.05)。
发酵时间/d 指标糟醅KB H14 H26 H30 H39 28水分/%酒精度/%vol总酸/(mmol·10 g-1)还原糖/%总糖/%总糖利用率/%48.01±0.14d 5.30±0.00b 1.26±0.02e 10.47±0.18b 13.33±0.20a 23.79±1.74b 54.03±0.58a 7.50±0.10a 1.15±0.03d 8.88±0.07c 10.26±0.08e 35.23±0.06a 48.45±0.03c 3.40±0.05d 1.61±0.00c 11.16±0.05a 12.97±0.02b 20.67±0.03c 51.57±0.54b 4.50±0.09c 1.98±0.00a 8.36±0.08d 12.01±0.06d 17.96±0.01d 48.02±0.31d 3.40±0.05d 1.81±0.03b 11.28±0.11a 12.82±0.08c 22.02±0.04b
由表3可知,发酵过程中,不同糟醅间的主要理化性质变化趋势不同。其中,菌株H14的总糖利用率最高(35.23%),且入池坯的水分含量较高(46.52%),发酵0~14 d总糖含量急剧降低,发酵7~14 d酒精度急剧升高,发酵14 d时,酒精度最高达到8.3%vol,总酸和还原糖含量变化趋势平缓。发酵结束时(28 d),糟醅的水分含量为54.03%,酒精度为7.5%vol,酒精度显著高于其他组和KB组(P<0.05),说明菌株H14显著提高了出酒率。此外,菌株H30和H39发酵过程中糟醅的水分呈现单调递增的趋势,菌株H39和H26发酵过程中糟醅的总酸含量也呈现单调递增的趋势。值得注意的是,发酵结束时,菌株H26、H30和H39的总糖利用率和酒精度都低于KB。
发酵结束时,采用HPLC测定糟醅的有机酸种类及含量,结果见图3。
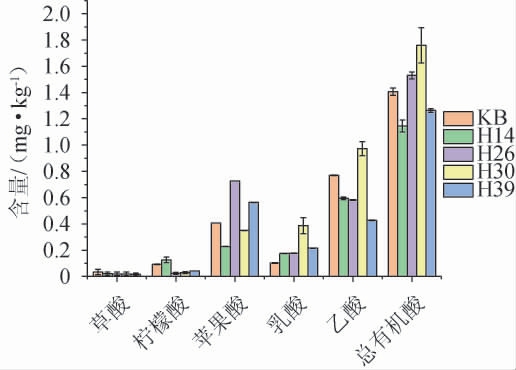
图3 不同菌株模拟固态酿酒发酵糟醅有机酸含量的测定结果
Fig.3 Determination results of organic acid content in fermented grains of different strains during simulated solid-state brewing
由图3可知,在所有糟醅中均检测出5种有机酸,其中菌株H14发酵糟醅中虽然总有机酸酸含量(1.13 mg/kg)最低,但柠檬酸含量(0.13 mg/kg)最高,菌株H26发酵糟醅中苹果酸(0.73 mg/kg)含量最高,而菌株H30发酵糟醅中则是乙酸含量最高(0.97 mg/kg)。
采用HS-SPME-GC-MS法从发酵结束的糟醅中共检出34种挥发性风味成分,结果见图4。
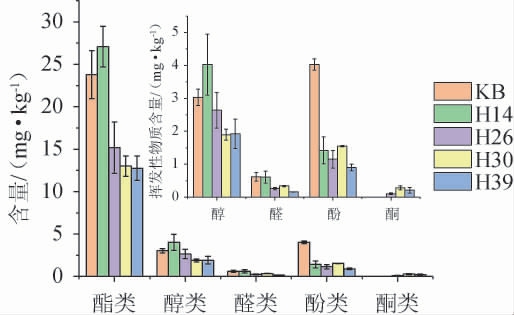
图4 不同菌株模拟固态酿酒发酵糟醅挥发性风味物质含量测定结果
Fig. 4 Determination results of volatile flavor substance contents of different strains during simulated solid-state brewing
由图4可知,不同筛选菌株发酵对糟醅挥发性成分含量及轮廓的影响具有一定差异。菌株H14发酵糟醅的总挥发性风味成分含量最高(33.12 mg/kg),其酯类和醇类的含量分别为27.07 mg/kg和4.02 mg/kg,较KB分别高13.84%和33.00%。此外,其较高的酯类含量和较低的有机酸含量可能是醇酸间缩合反应消耗了有机酸所致,其中酯类物质含量的增加与郑翠银等[10-11]将红曲霉应用于黄酒的研究结果类似。
基于PLS-DA模型解析不同筛选菌株对糟醅挥发性风味成分的影响,结果见图5。
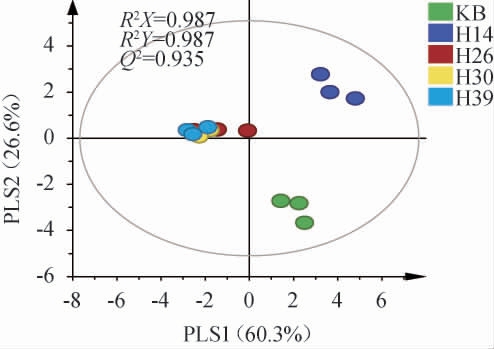
图5 不同菌株模拟固态酿酒发酵糟醅挥发性代谢组分的偏最小二乘判别分析结果
Fig. 5 Partial least squares discriminant analysis results of volatile metabolites of different strains during simulated solid-state brewing
由图5可知,R2和Q2均接近1,表明模型可靠,菌株H14发酵糟醅和KB分别位于第I和第IV象限,菌株H26、H30和H39发酵糟醅则均位于第II象限,且距离非常接近,表明其挥发性成分的组成类似。
基于VIP值>1筛选得到12种显著影响其风味特征的差异挥发性代谢组分,结果见表4。由表4可知,12种差异挥发性代谢组分分别为棕榈酸乙酯、反油酸乙酯、2,3-丁二醇、丁酸乙酯、苯酚、苯乙醇、3-糠醛、乙酸乙酯、异戊醇、琥珀酸二乙酯、棕榈酸甲酯和4-乙基愈创木酚。菌株H14发酵糟醅中棕榈酸乙酯、反油酸乙酯和2,3-丁二醇3种成分含量显著高于其他样品(P<0.05),其中棕榈酸乙酯和2,3-丁二醇是优势组分,前者呈微弱蜡香、奶油香和坚果香,是酒中常见酯类物质[25-26],该结果亦揭示红曲霉菌具有提高合成棕榈酸乙酯的结果[11-12]。而在菌株H39发酵糟醅中丁酸乙酯含量更高,在菌株H30发酵糟醅中苯酚和3-糠醛含量更高。但是,致使其麦曲挥发性成分轮廓差异的2,3,5,6-四甲基吡嗪在糟醅中都未检出,其原因待进一步探讨。综上表明,这些筛选菌株显著提高了糟醅中酒精和酸的积累以及淀粉的利用,此外,这些分离菌株亦改善了糟醅的风味轮廓。
表4 不同菌株模拟固态酿酒发酵糟醅中的主要差异代谢挥发性组分
Table 4 Main differential volatile metabolites of volatile metabolites of different strains during simulated solid-state brewing mg/kg
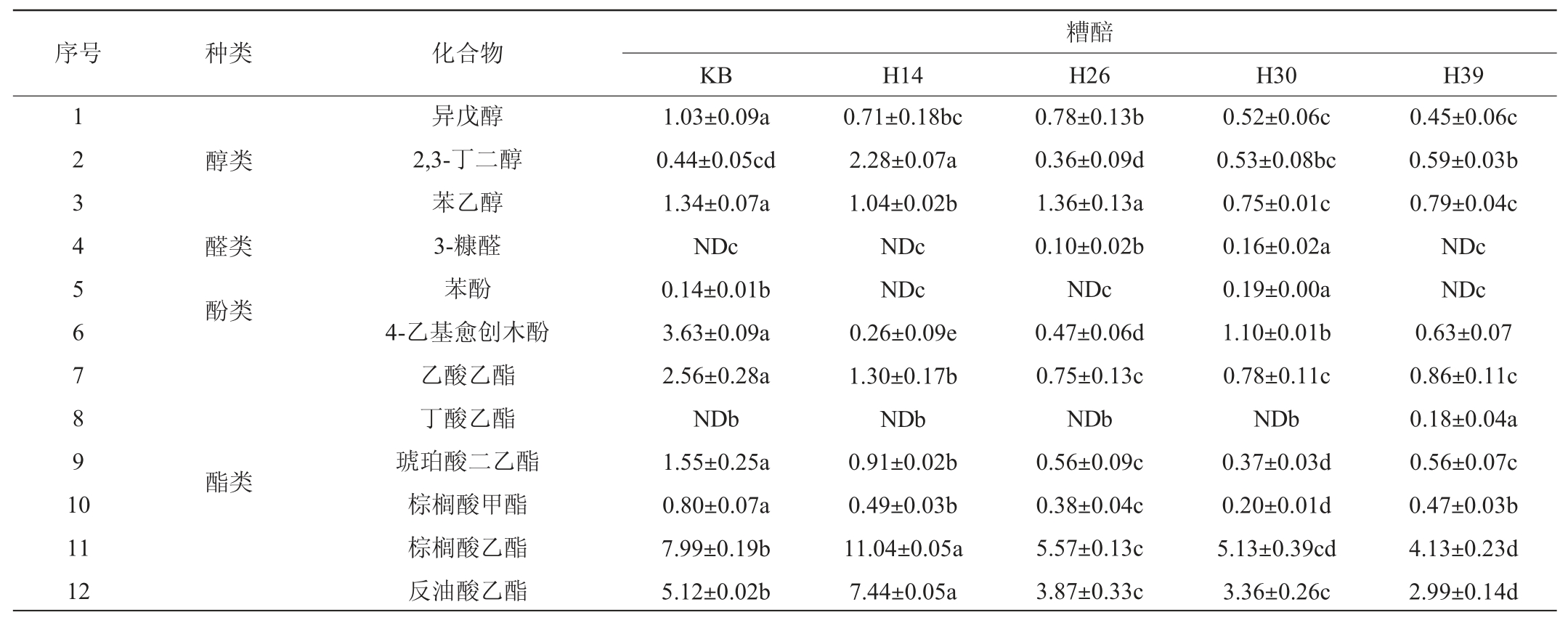
注:同行不同字母表示差异显著(P<0.05),“ND”表示未检测出该物质。
序号 种类 化合物1 2 3 4 5 6 7 8 9 1 0醇类醛类酚类酯类11 12异戊醇2,3-丁二醇苯乙醇3-糠醛苯酚4-乙基愈创木酚乙酸乙酯丁酸乙酯琥珀酸二乙酯棕榈酸甲酯棕榈酸乙酯反油酸乙酯KB H14 1.03±0.09a 0.44±0.05cd 1.34±0.07a NDc 0.14±0.01b 3.63±0.09a 2.56±0.28a NDb 1.55±0.25a 0.80±0.07a 7.99±0.19b 5.12±0.02b 0.71±0.18bc 2.28±0.07a 1.04±0.02b NDc NDc 0.26±0.09e 1.30±0.17b NDb 0.91±0.02b 0.49±0.03b 11.04±0.05a 7.44±0.05a糟醅H26 H30 H39 0.78±0.13b 0.36±0.09d 1.36±0.13a 0.10±0.02b NDc 0.47±0.06d 0.75±0.13c NDb 0.56±0.09c 0.38±0.04c 5.57±0.13c 3.87±0.33c 0.52±0.06c 0.53±0.08bc 0.75±0.01c 0.16±0.02a 0.19±0.00a 1.10±0.01b 0.78±0.11c NDb 0.37±0.03d 0.20±0.01d 5.13±0.39cd 3.36±0.26c 0.45±0.06c 0.59±0.03b 0.79±0.04c NDc NDc 0.63±0.07 0.86±0.11c 0.18±0.04a 0.56±0.07c 0.47±0.03b 4.13±0.23d 2.99±0.14d
2.3 不同筛选菌株对高温大曲贡献的差异
2.3.1 高温大曲的理化性质
将4株筛选菌株纯培养麦曲粉接种到曲坯中生产高温大曲,测定其主要理化指标,结果见表5。
表5 4株筛选菌株对高温大曲理化指标的影响
Table 5 Effects of 4 screened strains on physicochemical indexes of high temperature Daqu
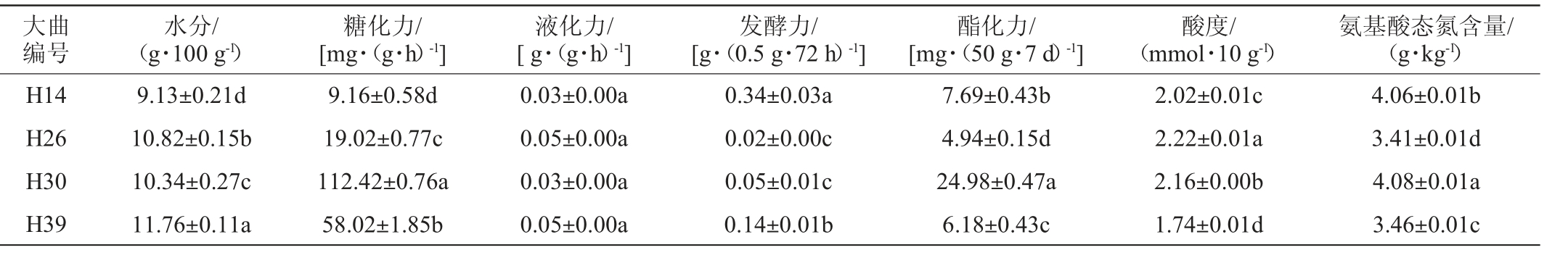
注:同列不同字母表示显著性差异(P<0.05)。
大曲编号水分/(g·100 g-1)糖化力/[mg·(g·h)-1]液化力/[g·(g·h)-1]发酵力/[g·(0.5 g·72 h)-1]酯化力/[mg·(50 g·7 d)-1]酸度/(mmol·10 g-1)H14 H26 H30 H39 9.13±0.21d 10.82±0.15b 10.34±0.27c 11.76±0.11a 9.16±0.58d 19.02±0.77c 112.42±0.76a 58.02±1.85b 0.03±0.00a 0.05±0.00a 0.03±0.00a 0.05±0.00a 0.34±0.03a 0.02±0.00c 0.05±0.01c 0.14±0.01b 7.69±0.43b 4.94±0.15d 24.98±0.47a 6.18±0.43c 2.02±0.01c 2.22±0.01a 2.16±0.00b 1.74±0.01d氨基酸态氮含量/(g·kg-1)4.06±0.01b 3.41±0.01d 4.08±0.01a 3.46±0.01c
由表5可知,不同菌株对大曲理化性质贡献不同,菌株H30对糖化力[112.42 mg/(g·h)]、酯化力[24.98 mg/(50 g·7 d)]及氨基酸态氮含量(4.08 g/kg)的贡献程度显著高于其余菌株(P<0.05);菌株H14的发酵力[0.34 g/(0.5 g·72 h)]显著高于其他菌株(P<0.05),有提高出酒率的潜力。由此可见,实际体系因涉及与多种种属微生物的互作关系,改变了菌株的贡献,其机制待进一步深入探讨。
2.3.2 高温大曲的挥发性代谢组分
采用HS-SPME-GC-MS对4株菌株强化的高温大曲中的挥发性风味成分进行检测,结果见图6。
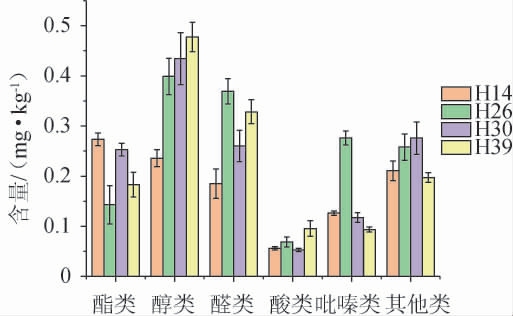
图6 不同菌株强化高温大曲挥发性风味物质含量测定结果
Fig. 6 Determination results of volatile flavor substance in high temperature Daqu fortified by different strains
由图6可知,从4株菌株强化的高温大曲中共检出29种挥发性代谢成分,包括酯类(5种)、醇类(3种)、醛类(9种)、吡嗪类(4种)、酸类(1种)和其他(7种)6类。结合表2可知,相对纯培养的麦曲,4种强化大曲的酯类物质的种类从26降至5种,醛类物质的种类增加了8种。而且菌株H26强化大曲亦是吡嗪类含量最高,菌株H14和H39强化大曲则是酯类和醇类物质含量最高。表明菌株H26在麦曲和强化大曲中对吡嗪类物质的合成都具有较大的贡献。
基于挥发性代谢组分对不同菌株强化高温大曲进行PLS-DA,并基于VIP值>1筛选贡献度较大的差异代谢成分,结果见图7。
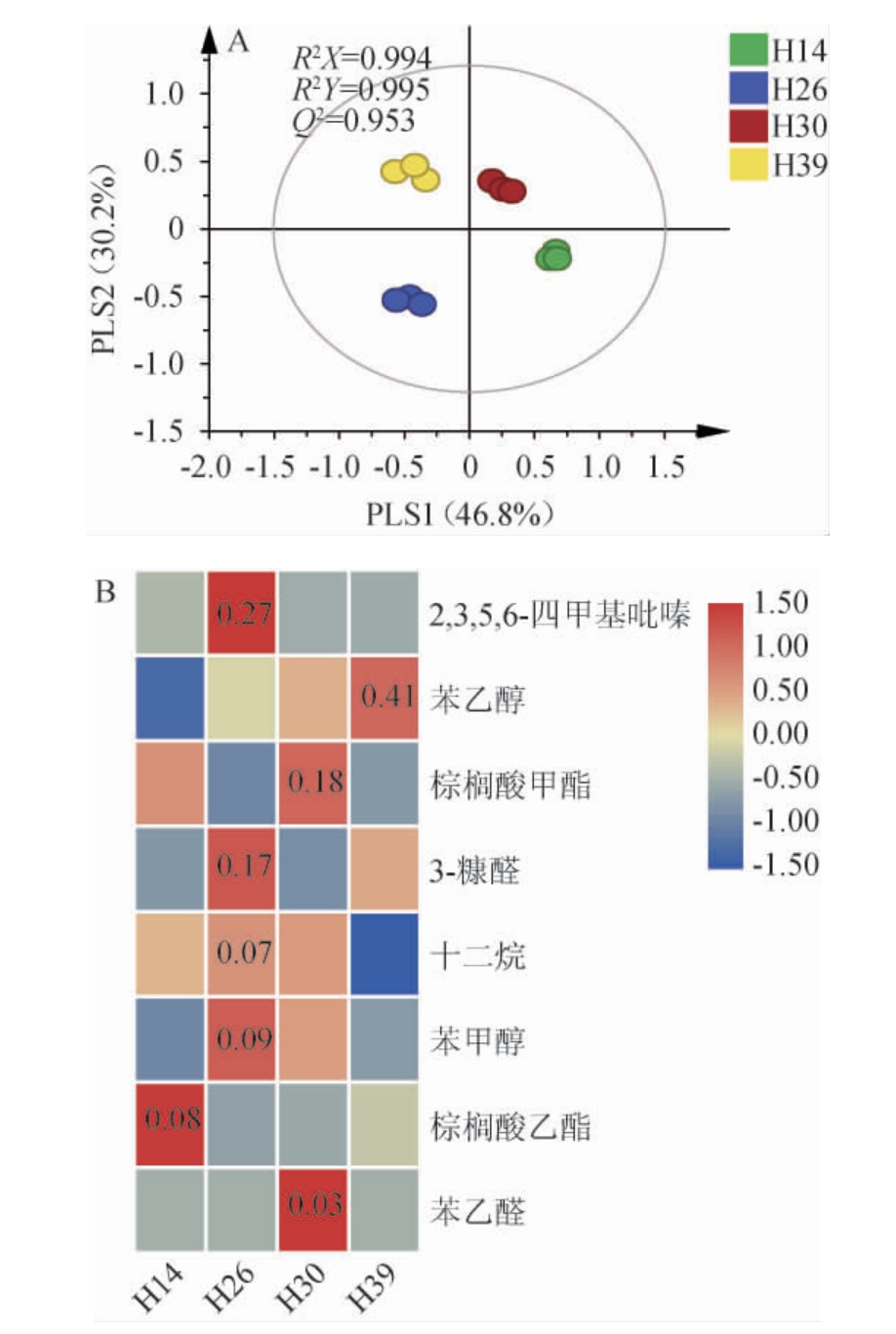
图7 不同菌株强化高温大曲中挥发性代谢组分的偏最小二乘-判别分析结果(A)及主要差异代谢物质(B)
Fig. 7 Partial least squares-discriminant analysis results (A) and main differential metabolites (B) of volatile metabolites in high-temperature Daqu fortified by different strains
由图7A可知,R2和Q2均接近1,表明模型可靠。4种高温大曲分别位于4个象限,说明挥发性代谢成分具有较大差异。由图7B可知,基于VIP值>1共筛选出了8种贡献度较大的差异代谢成分,分别为2,3,5,6-四甲基吡嗪、苯乙醇、棕榈酸甲酯、3-糠醛、十二烷、苯甲醇、棕榈酸乙酯和苯乙醛,其中2,3,5,6-四甲基吡嗪、苯乙醇和棕榈酸甲酯和棕榈酸乙酯是导致强化大曲挥发性成分轮廓差异的主要成分之一,其分别在菌株H26、H39、H30和H14强化大曲中含量最高,含量分别是0.27 mg/kg、0.41 mg/kg、0.18 mg/kg和0.08 mg/kg。综上,红曲霉具有改善高温大曲理化性质和代谢组分轮廓的潜在功能,但需解决与大曲内生群落的种属间的互作关系、营养网络及代谢调控的影响规律。
2.4 筛选菌株的鉴定
2.4.1 形态学鉴定
4株筛选菌株的菌落及细胞形态见图8。由图8可知,所有菌株的菌落均呈圆形、中间呈红色,四周呈白色,菌丝较粗壮,孢子丝上有连串的孢子。结合《红曲菌的形态与分类学》[27]初步鉴定这4株菌株均为红曲霉属(Monascus sp.)。
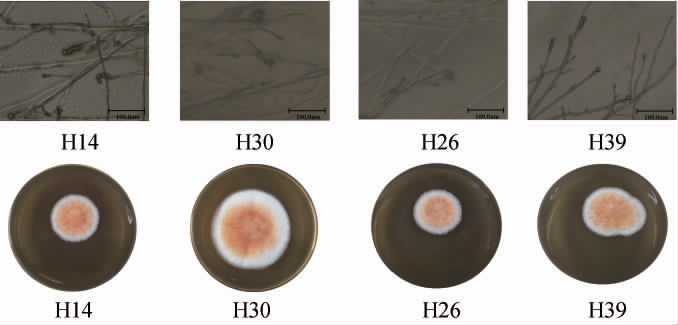
图8 筛选菌株的细胞和菌落形态学特征
Fig. 8 Morphological characteristics of cell and colonies of screened strains
2.4.2 分子生物学鉴定
菌株H14、H26、H30和H39的系统发育树见图9。
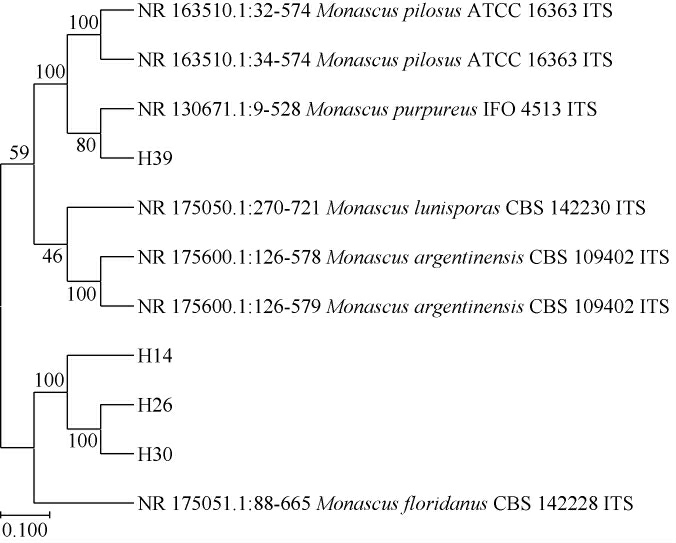
图9 基于ITS基因序列4株筛选菌株的系统发育树
Fig. 9 Phylogenetic tree of 4 screened strains based on ITS gene sequence
由图9可知,菌株H14、H26和H30与佛罗里达红曲霉(Monascus floridanus)聚于一簇,亲缘关系最近;菌株H39与紫色红曲霉(Monascus purpureus)聚于一簇,亲缘关系最近。结合形态学特征,将菌株H14、H26和H30均鉴定为佛罗里达红曲霉(Monascus floridanus),将菌株H39鉴定为紫色红曲霉(Monascus purpureus)。
3 结论
采用可培养技术从呈粉红色的高温大曲中共分离得到12株红曲霉菌株,这些菌株虽然同属,但种/株的理化性质差异显著。通过多元统计分析方法研究其在纯培养麦曲、模拟白酒固态发酵及强化大曲中的代谢特征,进而筛选得到3株优良的功能红曲霉菌株,编号分别为H14、H26和H30。在纯培养麦曲和强化的大曲中,菌株H26产吡嗪类物质的能力显著高于其余菌株,菌株H30的酯化力和菌株H14的发酵力分别显著高于其他菌株。此外,模拟白酒固态发酵试验结果表明,菌株H14不仅有提高基酒产率(7.5%vol)的潜力,其对糟醅挥发性组分轮廓也具有改善作用,总挥发性物质含量为33.12 mg/kg。通过形态观察和分子生物学技术鉴定菌株H14、H26和H30均为佛罗里达红曲霉(Monascus floridanus)。本研究结果可为基于应用对象的目标产物的功能菌株筛选提供了可借鉴的策略,也为基于红曲霉菌扰动改善高温大曲的性能提供了理论支撑。
[1] PATAKOVA P. Monascus secondary metabolites: production and biological activity[J].J Ind Microbiol Biot,2013,40(2):169-181.
[2]史成.固态发酵基质影响红曲他汀与色素产量的研究[D].天津:天津科技大学,2019.
[3]LI M,ZHANG J L,LI L,et al.Effect of enzymatic hydrolysis on volatile flavor compounds of Monascus-fermented tartary buckwheat based on headspace gas chromatography-ion mobility spectrometry[J]. Food Res Int,2023,163:112180.
[4]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学,2022,43(14):193-198.
[5]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156:111298.
[6] CAI W C, WANG Y R, NI H, et al. Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150:110734.
[7]LIU W H,CHAI L J,WANG H M,et al.Bacteria and filamentous fungi running a relay race in Daqu fermentation enable macromolecular degradation and flavor substance formation[J]. Int J Food Microbiol, 2023,390:110118.
[8]罗小叶,胥思霞,邱树毅,等.高酯化大曲催化增香技术在浓香型白酒生产上的应用[J].中国酿造,2018,37(10):141-144.
[9]刘新宇.红曲霉的分离纯化及在清香型白酒中的应用[D].临汾:山西师范大学,2014.
[10]郑翠银.红曲黄酒特征风味的分析与表征[D].福州:福州大学,2013.
[11]ZHAO W H,QIAN M,DONG H,et al.Effect of Hong Qu on the flavor and quality of Hakka yellow rice wine(Huangjiu)produced in Southern China[J].LWT-Food Sci Technol,2022,160:113264.
[12]陈帅,赵金松,郑佳,等.红曲与产酯酵母酯化黄水代谢物的特征[J].食品科学,2013,34(7):1-5.
[13]岳建明,杨强,肖潇,等.铵盐对紫色红曲霉合成代谢红曲色素及桔霉素的影响[J].食品科学,2016,37(5):102-107.
[14]MAO F J,HUANG J,ZHOU R Q,et al.Effects of different daqu on microbial community domestication and metabolites in Nongxiang Baijiu brewing microecosystem[J].Front Microbiol,2022,13:939904.
[15]沈萍.微生物学实验[M].北京:高等教育出版社,2007:69-76.
[16]ZHANG L Q,HUANG J,ZHOU R Q,et al.Evaluating the feasibility of fermentation starter inoculated with Bacillus amyloliquefaciens for improving acetoin and tetramethylpyrazine in Baoning bran vinegar[J].Int J Food Microbiol,2017,255:42-50.
[17]ZHENG J,LIANG R,WU C D,et al.Discrimination of different kinds of Luzhou-flavor raw liquors based on their volatile features[J].Food Res Int,2014,56:77-84.
[18]先元华.白酒分析与检测技术[M].北京:中国轻工业出版社,2015:145-151.
[19]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[20]黄魏,程平言,张健,等.酱香型白酒风味形成的影响因素及主体风味成分研究进展[J].酿酒科技,2020(4):85-93.
[21]FAN W L,XU Y,ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agric Food Chem,2007,55(24):9956-9962.
[22]郭孝敬.产2-苯乙醇酵母菌的筛选及其固定化技术研究[D].石河子:石河子大学,2019.
[23]梁敏华,赵文红,白卫东,等.白酒酒曲微生物菌群对其风味形成影响研究进展[J].中国酿造,2023,42(5):22-27.
[24]马统魏,张波,王红娟,等.红树莓酒发酵过程中游离态和结合态香气成分分析[J/OL]. 食品与发酵工业,2023:1-11. https://doi.org/10.13995/j.cnki.11-1802/ts.036801.
[25]刘延波,刘润雨,赵志军,等.赊店老酒大曲质量差异研究[J].食品工业科技,2019,40(23):77-80,87.
[26]邓星星,江英,马越,等.无花果及其果酒挥发性成分的研究[J].中国酿造,2016,35(3):98-103.
[27]李钟庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003:13-45.