粉状米勒氏酵母(Millerozyma farinose)属于毕赤酵母属(Pichia)[1],广泛分布于白酒酒醅[2]、包包曲[3]、酱油[4]、泡菜[5]、大豆酱[6]中。蓝翔等[7]从发酵酱油中筛选到一株可将组胺高效降解为氨类物质的Millerozyma farinose,此菌株在发酵鱼露中也表现出良好的降胺能力,发酵60 d时生物胺降解效率最高可达57.13%,具有广泛的应用前景。李莹等[8]从特香型白酒酒醅中筛选出一株Millerozyma farinose,并对其进行乙醇耐受适应性进化研究,最终获得1株最高可耐受体积分数13%乙醇的Millerozyma farinosa NCUF 304.1-1。王靖雯等[9]从高盐稀态酱醪中筛选出一株Millerozyma farinose,因其繁殖代谢会大幅提高酱油中2-辛酮、2-壬酮和1,2,3-三甲氧基苯的含量,所以对酱油风味具有负面影响。张霞等[10]从浓香型白酒酿造环境中分离出一株Millerozyma farinose,保藏编号为CGMCC No.22621,通过五粮粉液态静置发酵和五粮粉固态模拟窖池发酵发现,该菌株的发酵产物中均有浓郁的蜡香和柑橘香的复合气味。
目前,在浓香型白酒酿造的多个环节中均已发现粉状米勒氏酵母(Millerozyma farinose)[2,3,10],但其能否利用糟醅进行发酵以及其在白酒酿造中的作用还鲜见报道。浓香型白酒发酵后期窖池内部呈现出对微生物生长发酵不利的环境,酵母作为白酒发酵中常用的菌株之一,在发酵过程中,自身代谢易受环境的影响,对胁迫环境的耐受性直接影响到发酵程度、发酵结果、代谢产物,最终影响白酒的品质[11]。对胁迫环境耐受性能强的酵母菌在发酵过程中具有更强的竞争力,因此了解菌株的耐受性能更好地掌握其能否适应浓香型白酒窖池环境。为了探究粉状米勒氏酵母(Millerozyma farinose)在浓香型白酒糟醅环境中的适应性,本研究以分离自浓香型白酒酿造环境中的一株Millerozyma farinose为研究对象,对其耐受性及风味物质代谢情况进行分析,旨在考察该菌能否适应浓香型白酒窖池环境并利用糟醅进行发酵,为研究粉状米勒氏酵母在浓香型白酒酿造窖池中的发酵提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
五粮粉(高粱、大米、糯米、玉米和小麦)、粮食糟和丢糟:五粮液股份有限公司酿酒车间;粉状米勒氏酵母(Millerozyma farinose)WLY-Y-91:分离自浓香型白酒酿造环境中,保藏于本实验室。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[12]:蛋白胨20 g/L,酵母膏10 g/L,葡萄糖20 g/L,pH自然。115 ℃高压蒸汽灭菌20 min。YPD固体培养基:YPD液体中添加琼脂20 g/L。
五粮粉液态发酵培养基[13]:水煮沸,按照五粮粉与水质量体积比为1∶10加入五粮粉,煮至稀粥状,冷却;五粮粉糖化液中加入1.80%液化酶,65 ℃保温3 h;再加入1.80%糖化酶,62 ℃保温3 h;过滤,将糖度调至12~13°Bx;121 ℃高压蒸汽灭菌15 min。
1.1.3 试剂
葡萄糖、氯化钠、氢氧化钠、乙醇(均为分析纯):国药集团化学试剂有限公司;4-辛醇(色谱纯):德国Sigma-Aldrich公司。其他试剂均为国产分析纯。
1.2 仪器与设备
TG-WAX毛细管色谱柱(30.00 m×0.25 mm×0.25 μm):美国Thermo公司;57330-U固相微萃取手柄、50 μm CAR/DVB/PDMS纤维萃取头:美国Supelco公司;7890B-5977B气相色谱-质谱联用(gas chromatography-mass spectrography,GC-MS)仪:安捷伦科技(中国)有限公司;5810R离心机、22331 Hamburg分光光度计:德国Eppendorf公司;FE28 pH计:德国WTW公司;BPC-250F生化培养箱:上海一恒科技仪器有限公司。
1.3 方法
1.3.1 粉状米勒氏酵母WLY-Y-91生长曲线的测定
参照马勇等[14]的方法采用分光光度计比浊法测定粉状米勒氏酵母WLY-Y-91的生长曲线,确定菌体生长规律。将粉状米勒氏酵母WLY-Y-91接种于YPD培养基中,28 ℃、120 r/min条件下培养16 h作为种子液。将种子液以1%(V/V)的接种量接种于YPD液体培养基中,28 ℃、120 r/min培养,分别在0、4 h、8 h、12 h、24 h、28 h、32 h、36 h、48 h、54 h、59 h取菌液测定其OD600nm值,以未接种的YPD液体培养基作为空白对照,重复3次,结果取其平均值,以培养时间为横坐标,OD600nm值为纵坐标,绘制菌株WLY-Y-91生长曲线。
1.3.2 耐受性研究[15-18]
将粉状米勒氏酵母WLY-Y-91接种于YPD液体培养基中,在28 ℃、120 r/min条件下活化培养到对数生长期(OD600 nm值=1.8),将种子液按5%(V/V)的接种量接种到含有不同体积分数乙醇(14%、15%、16%、17%)、不同质量浓度NaCl(150 g/L、160 g/L、170 g/L、180 g/L、190 g/L、200 g/L)、不同pH值(2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0)及不同葡萄糖质量浓度(400 g/L、500 g/L、600 g/L、700 g/L、800 g/L、900 g/L、1 000 g/L)的YPD液体培养基中,于28 ℃、120 r/min条件下培养48 h,采用分光光度计测定OD600 nm值,考察粉状米勒氏酵母WLY-Y-91的乙醇、NaCl、pH及葡萄糖耐受性。以5%(V/V)的接种量接种到YPD液体培养基中,在不同培养温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)下培养48 h,采用分光光度计测定OD600nm值,考察粉状米勒氏酵母WLY-Y-91的高温耐受性。
1.3.3 粉状米勒氏酵母WLY-Y-91的发酵
液态发酵:将种子液以5%(V/V)的接种量分别接入50 mL YPD液体培养基和50 mL五粮粉液态发酵培养基中,于28 ℃静置培养72 h。
模拟白酒固态发酵:将种子液以10%(V/V)的接种量分别接种至浓香型白酒粮食糟和丢糟中,混匀,密封,分别置于28 ℃静置培养70 d和30 d,同时以未接种的粮食糟和丢糟为空白对照。
1.3.4 模拟白酒固态发酵糟醅理化指标的检测
参照文献[19]对糟醅的水分、酸度、残留淀粉含量(残淀)和残留总糖含量(残糖)进行检测。其中酸度表示10 g糟醅消耗1 mmol NaOH标准液体的毫摩尔数,以“mmol/10 g”表示。
1.3.5 挥发性风味物质的测定
液态发酵结束后,12 000 r/min离心5 min,上清液过0.22 μm滤膜,备用。固态发酵结束后,取样品与体积分数10%乙醇按体积比1∶1混匀,振荡30 min,12 000 r/min离心5 min,上清液过0.22 μm滤膜,参照文献[20]采用顶空固相微萃取(head space solid phase microextraction,HS-SPME)结合GC-MS法测定挥发性风味物质成分。
1.3.6 数据分析
每个试验重复3次,利用Excel 2010软件处理数据,结果用“平均值±标准差”表示,采用Origin 2021软件进行方差分析和作图。
2 结果与分析
2.1 粉状米勒氏酵母WLY-Y-91的生长曲线
粉状米勒氏酵母WLY-Y-91在YPD液体培养基中的生长曲线见图1。由图1可知,粉状米勒氏酵母WLY-Y-91在发酵0~12 h时处于延滞期,发酵12~48 h时处于对数生长期,发酵48 h之后进入稳定期。
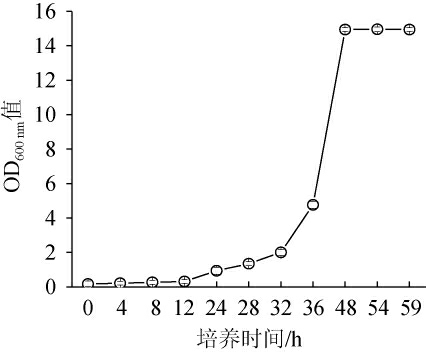
图1 粉状米勒氏酵母WLY-Y-91的生长曲线
Fig. 1 Growth curve of Millerozyma farinose WLY-Y-91
2.2 粉状米勒氏酵母WLY-Y-91的耐受性分析
粉状米勒氏酵母WLY-Y-91对不同环境的耐受性见图2。
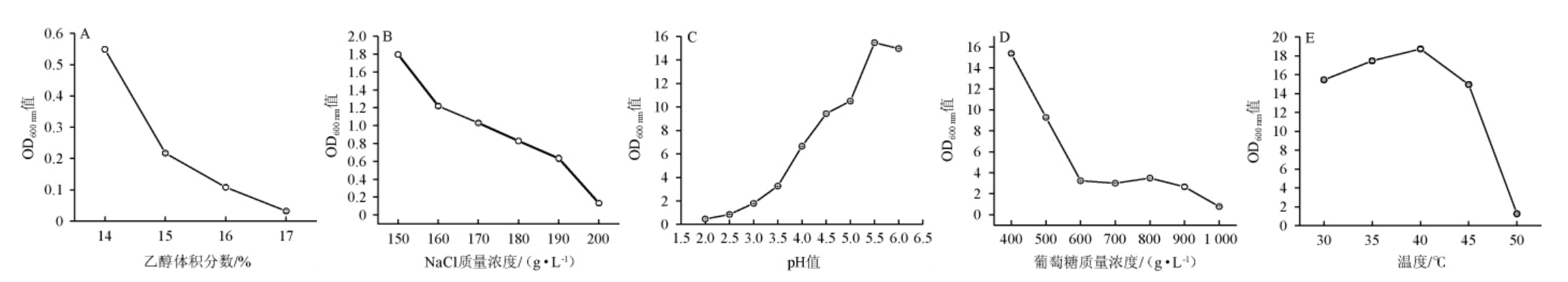
图2 粉状米勒氏酵母WLY-Y-91的耐受性测定结果
Fig. 2 Results of tolerance tests of Millerozyma farinose WLY-Y-91
高浓度的乙醇会结合到酵母细胞膜的疏水区,降低疏水性的相互作用,导致酵母蛋白变性,细胞膜破裂,降低酵母细胞的生存率终止发酵[21]。浓香型白酒发酵窖池在发酵后期主要进行无氧发酵,乙醇含量高达5%左右[22]。因此酵母菌对乙醇的耐受性格外重要,可耐受高浓度乙醇的酵母菌在白酒发酵中更占优势[23]。由图2A可知,当乙醇体积分数为16%时,粉状米勒氏酵母WLY-Y-91发酵液的OD600 nm值为0.13,而当乙醇体积分数为17%时,OD600nm值几乎为零,说明粉状米勒氏酵母WLY-Y-91最高可耐受乙醇体积分数16%。
酵母细胞在高盐环境下会积累过量有毒阳离子,造成细胞内外较大的渗透压,使细胞膜因细胞缺水而皱缩[24],从而影响酵母生长。由图2B可知,当NaCl质量浓度为190 g/L时,粉状米勒氏酵母WLY-Y-91发酵液的OD600 nm值为0.69,而当NaCl质量浓度为200 g/L时,OD600nm值为0.19,几乎不生长,说明粉状米勒氏酵母WLY-Y-91最高可耐受NaCl质量浓度190 g/L。
低pH值会改变细胞壁结构,使质膜丧失完整性,从而影响酵母菌的生长和发酵代谢功能[25]。浓香型白酒发酵中后期窖池内兼性厌氧或厌氧菌大量繁殖,尤其是乳酸菌,产生大量乳酸,使得窖池内酸度越来越高[26],酸度可高达5 mmol/10 g左右[27],因此,酵母菌耐受高酸能力尤显重要。由图2C可知,当pH为2.0时,粉状米勒氏酵母WLY-Y-91发酵液的OD600 nm值为0.48,生长状态较差,因此,粉状米勒氏酵母WLY-Y-91可耐受的最低pH为2.0。
酵母菌可以利用葡萄糖作为主要碳源,但葡萄糖质量浓度过高会引起高渗透压胁迫,使酵母细胞失水皱缩,影响细胞膜上的蛋白质活性和离子通道,进而抑制酵母菌的生长代谢[28-29]。由图2D可知,当葡萄糖质量浓度为900 g/L时,粉状米勒氏酵母WLY-Y-91发酵液的OD600 nm值为2.65,而当葡萄糖质量浓度为1 000 g/L时,OD600nm值为0.77,几乎不生长,说明粉状米勒氏酵母WLY-Y-91最高可耐受的葡萄糖质量浓度为1 000 g/L。
浓香型白酒发酵过程中,窖池内温度可高达35 ℃,一般适宜酵母菌生长的温度范围为25~30 ℃[30],高温会使蛋白或脱氧核糖核酸(deoxyribonucleic acid,DNA)变性,破坏酵母菌细胞膜的结构和功能,从而抑制酵母的生长[31]。因此,对高温环境有很好耐受性的酵母菌可以更好地适应发酵环境。由图2E可知,当培养温度为45 ℃时,粉状米勒氏酵母WLY-Y-91发酵液的OD600nm值为14.96,生长良好,而当培养温度升至50 ℃时,OD600 nm值为1.26,生长变缓,说明粉状米勒氏酵母WLY-Y-91最高可耐受的温度为50 ℃。
2.3 液体发酵挥发性风味物质分析
酵母在发酵过程中能产生一些代谢产物,如高级醇类、酸类、酯类、酚类、吡嗪类等,这些物质决定着白酒的风格[32]。因五粮液酿造原料是五种粮食混合物,先将菌株WLY-Y-91接种至五粮粉糖化液中研究其能否产生白酒有益风味物质。菌株WLY-Y-91在YPD和五粮粉液体培养基中静置培养3 d后,利用HS-SPME-GC-MS检测其发酵液中挥发性风味物质成分,结果见表1。
表1 粉状米勒氏酵母WLY-Y-91液体发酵挥发性风味物质GC-MS分析结果
Table 1 Volatile flavor substances in liquid-state fermentation of Millerozyma farinose WLY-Y-91 analyzed by GC-MS

相同风味物质2-庚醇2-壬酮乙酸2-壬烯-4-酮2-十一醇乙酸苯乙酯十二醇十四酸乙酯戊二酸异丁基酯壬酸癸二酸二(2-己)酯硬脂酸乙酯苯甲酸4-乙烯基愈疮木酚棕榈酸乙酯不同风味物质五粮粉发酵液 YPD发酵液乙醛乙酸乙酯2,3-丁二醇二硝酸酯月桂酸醋酸乙烯酯异丁醇乙偶姻4-辛醇癸酸2,3-丁二醇丙酸苯甲醛异丁酸己酸辛酸癸酸乙酯2-壬醇2-戊醇异戊醛甲醚2-戊酮3-甲基-2-丁醇丙酐吡嗪3-甲基-3-丁烯-1-醇2-甲基吡嗪2,5-二甲基吡嗪2,6-二甲基吡嗪2-乙基吡嗪十四烷2-乙基-6-甲基吡嗪壬醛2-乙基-(5或6)-甲基吡嗪2,3,5-三甲基吡嗪2-乙基-3,6-二甲基吡嗪3-甲硫基丙醛异辛醇2-壬基醇苯乙醛苯乙酮4-甲基苯酚
由表1可知,从两种发酵液中共检出56种挥发性风味成分,包括10种酯类、12种醇类、9种酸类和25种其他微量成分。其中15种在两种发酵液中均被检出,包括2-庚醇、2-十一醇、十二醇、乙酸、壬酸、苯甲酸和高级脂肪酸酯类等,4-乙烯基愈疮木酚呈发酵香气,略带甜味,微带酚的气息,是决定酒类、酱油、茶叶、咖啡、干酪等食品品位及质量的一个主要香味成分[33]。赵东等[34]首次在国内白酒中检测出4-乙烯基愈创木酚。
五粮粉发酵液中特有的挥发性风味成分有18种,包括丙酸、己酸、辛酸、癸酸、月桂酸等酸类,异丁醇、4-辛醇、2,3-丁二醇、2-壬醇、2-戊醇等醇类,乙酸乙酯、2,3-丁二醇二硝酸酯、癸酸乙酯等酯类,此外还检测到乙偶姻,乙偶姻具有特殊奶油香气,是白酒微量风味的重要组成成分,也是多种微生物糖代谢的中间产物[35-36]。YPD发酵液中特有的挥发性风味成分有23种,主要是吡嗪类物质,吡嗪类物质具有明显的焦香或烤坚果香味,是白酒中含氮微量成分,同时也是白酒香气成分的重要组成物质[37]。综上,粉状米勒氏酵母WLY-Y-91在YPD和五粮粉糖化液中均能产生白酒重要香味成分,在五粮粉糖化液中能够产生更多的酯类物质,更有益于浓香型白酒生产。
2.4 模拟白酒固态发酵
2.4.1 糟醅的理化指标分析
糟醅的理化指标测定结果见图3。由图3可知,糟醅的水分含量均>60%,且粉状米勒氏酵母WLY-Y-91发酵粮食糟和丢糟水分含量高于空白对照,分析原因可能是菌株代谢活动产生水分所致;粉状米勒氏酵母WLY-Y-91发酵粮食糟的残淀和残糖含量(10%和0.2%)分别低于空白对照(14%和1.2%),粉状米勒氏酵母WLY-Y-91发酵丢糟的残淀和残糖含量(6%和0.2%)也都低于空白对照(8.5%和0.9%),说明菌株利用粮食糟和丢糟继续发酵,利用了其中的淀粉和糖类进行代谢。粉状米勒氏酵母WLY-Y-91发酵粮食糟与空白对照组的酸度均在4.00 mmol/10 g糟醅左右;粉状米勒氏酵母WLY-Y-91发酵丢糟的酸度(5.60 mmol/10 g糟醅)高于空白对照组的酸度(4.70 mmol/10 g糟醅),分析原因可能是粉状米勒氏酵母WLY-Y-91在利用粮食糟进行发酵时产生的酸类物质较少,而利用丢糟进行发酵时更有利于酸类物质的合成和积累。
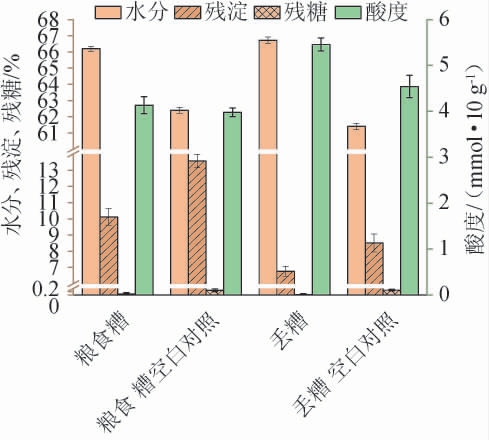
图3 粉状米勒氏酵母WLY-Y-91模拟白酒固态发酵糟醅理化指标的测定结果
Fig. 3 Determination results of physicochemical indexes of Millerozyma farinose WLY-Y-91 in simulated solidstate fermentation of Baijiu
2.4.2 糟醅的挥发性风味物质分析
微生物经发酵能产生风味化合物,将微生物接种于糟醅中可改变糟醅中风味化合物的组成。王松等[38]将人工强化后的长孢洛德酵母(Lodderomyces elongisporus)应用于复糟酒生产,发现发酵完成后处理组糟醅中乙酸乙酯、己酸乙酯、乙酸异戊酯、己酸异戊酯、β-苯乙醇等风味物质含量上升。简晓平等[39]将1株异常威克汉姆酵母(Wickerhamomyces anomalus)接种至糟醅中发酵,发现此酵母菌可减少糟醅中乙酸、乳酸、异戊醇、苯甲醇、丁酸乙酯和己酸乙酯的生成,可使糟醅中正丁醇、仲丁醇显著增高。酵母菌代谢产生的挥发性风味物质主要为醇类和酯类物质,正丙醇、异丁醇、正丁醇和异戊醇属于高级醇,乙酸乙酯和高级醇均为酵母菌在酒精发酵时的副产物,对白酒影响比较大,与白酒骨架成分相关[12]。因此,关注菌株WLY-Y-91固态模拟发酵糟醅中乙酸乙酯和高级醇含量的变化对进一步研究其能否在浓香型白酒窖池中利用糟醅发酵产生白酒挥发性风味物质具有一定的帮助。将菌株WLY-Y-91接种至浓香型白酒发酵糟醅中,采用GC-MS测定糟醅中的主要挥发性风味成分,结果见图4。由图4可知,菌株WLY-Y-91利用粮食糟和丢糟发酵均可产生少量的乙酸乙酯和高级醇类,利用粮食糟进行发酵时,乙酸乙酯、异戊醇及正丙醇含量(3.90 mg/kg、12.30 mg/kg、8.90 mg/kg)分别比粮食糟空白对照(1.60 mg/kg、5.30 mg/kg、7.40 mg/kg)增加143.8%、132.1%、20.3%,而异丁醇和正丁醇含量略微下降。利用丢糟进行发酵时,乙酸乙酯和高级醇含量均比丢糟空白对照有所增加,其中乙酸乙酯和正丁醇含量(13.70 mg/kg和14.30 mg/kg)增加比例最大,分别为44.2%和55.4%。综上,菌株WLY-Y-91可利用浓香型白酒粮食糟和丢糟进行发酵产生白酒重要挥发性风味成分。
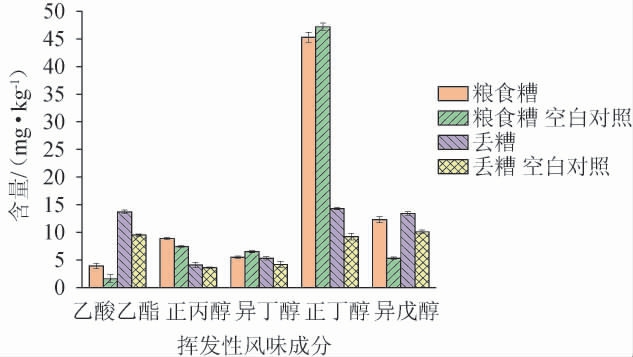
图4 粉状米勒氏酵母WLY-Y-91模拟白酒固态发酵糟醅挥发性风味成分GC-MS分析结果
Fig. 4 Volatile flavor substances in solid fermentation of Millerozyma farinose WLY-Y-91
3 结论
粉状米勒氏酵母WLY-Y-91具有良好耐受性能,可以耐受乙醇体积分数16%、NaCl 200 g/L和葡萄糖1 000 g/L,耐受最高温度和最低pH值分别为50 ℃、pH2.0,能适应浓香型白酒发酵环境。从菌株WLY-Y-91的YPD及五粮粉发酵液中共检测出56种挥发性风味物质,两种发酵液中的挥发性风味物质种类差异较大,共有的挥发性风味物质有15种;在五粮粉发酵液中特有的挥发性风味成分有18种,主要为醇、酯类以及乙偶姻;在YPD发酵液中特有的挥发性风味成分有23种,主要为吡嗪类物质,说明菌株WLY-Y-91可以利用五粮粉发酵产生白酒风味成分。进一步通过实验室水平模拟白酒固态发酵发现,接种菌株WLY-Y-91发酵使粮食糟和丢糟中的残淀和残糖含量分别降低25.50%、76.27%和20.52%、90%,乙酸乙酯、正丙醇及异戊醇含量分别升高143.8%、20.3%、132.1%和44.2%、13.89%、32.67%,说明该菌株可以利用粮食糟和丢糟合成挥发性风味物质乙酸乙酯、正丙醇和异戊醇。这对进一步研究此粉状米勒氏酵母WLY-Y-91能否在浓香型白酒酿造窖池中进行发酵提供理论支撑。
[1]MALLET S,WEISS S,JACQUES N,et al. Insights into the life cycle of yeasts from the CTG clade revealed by the analysis of the Millerozyma(Pichia)farinosa species complex[J].PLoS One,2012,7(5):e35842.
[2]杨建刚,苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
[3]向丽萍,范斌强,黄娇,等.包包曲中可培养酵母菌的分离纯化与鉴定[J].酿酒科技,2021(6):29-33.
[4]姜维.一株耐盐性高效生物胺降解新菌的筛选、分类鉴定及应用研究[D].青岛:中国海洋大学,2014.
[5]魏雯丽,宫尾茂雄,吴正云,等.基于宏转录组学技术解析工业豇豆泡菜发酵过程中活性微生物群落结构变化[J].食品与发酵工业,2020,46(10):65-70.
[6] XUE W J, DONG P, WEI Z, et al. Effect of aroma-producing yeasts in high-salt liquid-state fermentation soy sauce and the biosynthesis pathways of the dominant esters[J].Food Chem,2021(344):128681.
[7]蓝翔,程淑敏,徐莹,等.一株新筛选的高效降解组胺菌株的降解特性及降解条件优化话[C]//中国食品科学技术学会第十六届年会暨第十届中美食品业高层论坛论文摘要集.武汉:中国食品科学技术学会,2019:11-13.
[8]李莹,陈延儒,吴晓江,等.适应性进化技术选育优良乙醇耐受性能Millerozyma farinosa[J].食品与发酵工业,2021,47(19):1-6.
[9]王靖雯,赵谋明,陈涛,等.高盐稀态酱醪中功能性酵母菌的筛选、鉴定及发酵特性[J].食品科学,2021,42(22):91-97.
[10]张霞,郑佳,雷学俊,等. 一种产2-壬醇粉酵母菌株及其应用:ZL202110799390.3[P].2022-11-15.
[11]刘向勇,张小华,鲍晓明.酿酒酵母工业菌株胁迫条件耐受性分析[J].中国酿造,2006,25(1):8-11.
[12]张霞,雷学俊,王晓妹,等.不同接种顺序条件下3株酵母属菌株生长及酿造特性研究[J].中国酿造,2023,42(9):32-37.
[13]张霞,郑佳,赵东,等.多粮浓香型白酒中特征酵母菌与耐酸乳杆菌的关系[J].微生物学通报,2019,46(7):1571-1581.
[14]马勇,图雅,陈秀莉,等.分光光度法测定高浓度培养液下的产油酵母菌生长曲线[J].北方园艺,2013(8):116-118.
[15]吴健,何伟,王建成,等.酿酒酵母与产香酵母发酵特性及其相互作用[J].食品与发酵工业,2020,46(20):78-87.
[16]李进,李泽福,都振江,等.低醇半干白葡萄酒的酵母菌耐受性研究[J].中国酿造,2011,30(10):119-121.
[17]秦伟帅,海燕,李吕朋,等.不同葡萄酒酵母耐受性试验比较[J].中外葡萄与葡萄酒,2009(9):16-19.
[18]刘胜,刘品何,韩宁,等.云南德钦产区野生酵母菌株的耐受性分析[J].中外葡萄与葡萄酒,2013(6):10-13.
[19]乔宗伟,张霞,施思,等.不同感官质量曲药在培曲过程中理化指标变化规律研究[J].中国酿造,2016,35(10):116-119.
[20]赵东,郑佳,彭志云,等.利用顶空固相微萃取、液液萃取和香气分馏技术鉴定糠壳的挥发性成分[J].酿酒科技,2016(12):31-39.
[21]CHANDLER M,STANLEY G A,ROGERS P,et al.A genomic approach to defining the ethanol stress response in the yeast Saccharomyces cerevisiae[J].Ann Microbiol,2004,54(4):427-454.
[22]高玲,许冠生,张磊,等.浓香型白酒糟醅发酵过程中主要参数的跟踪研究[J].酿酒科技,2018(1):47-53.
[23]吴华昌,肖辰,邓静,等.一株耐高浓度乙醇酒精酵母的筛选及发酵特性的研究[J].中国酿造,2012,31(3):111-115.
[24]王聪.耐盐酵母基因组学的研究[D].天津:天津科技大学,2015.
[25] MARTANI F, FOSSATI T, POSTERI R, et al. Different response to acetic acid stress in Saccharomyces cerevisiae wild-type and L-ascorbic acid producing strains[J].Yeast,2013,30(9):365-378.
[26]胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[27]陈小文,张霞,乔宗伟.浓香型白酒糟醅生酸规律研究[J].食品与发酵科技,2019,55(3):20-22.
[28] HOHMANN S. Osmotic stress signaling and osmoadaptation in yeasts[J].Microbiol Mol Biol Rev,2002,66(2):300-372.
[29]时桂芹,任菲,谢冰宗,等.高糖胁迫对酿酒酵母抗氧化活性及代谢的影响[J].食品工业科技,2019,40(20):94-100.
[30]刘龙海,李新圃,杨峰,等.酿酒酵母菌生长特性的研究[J].中国草食动物科学,2016,36(3):38-41.
[31] WOO J M, YANG K M, KIM S U, et al. High temperature stimulates acetic acid accumulation and enhances the growth inhibition and ethanol production by Saccharomyces cerevisiae under fermenting conditions[J]. Appl Microbiol Biotechn,2014,98(13):6085-6094.
[32]张霞,雷学俊,刘芳,等.五粮液车间空气中的特征酵母菌及其挥发性风味物质分析[J].食品与发酵工业,2021,47(17):242-249.
[33]崔云前,曹小红,王春玲,等.发酵行业4-乙烯基愈创木酚和4-乙基愈创木酚研究进展[J].中国酿造,2009,28(4):14-17.
[34]赵东,李阳华,向双全.气相色谱-质谱法测定酒糟、白酒中的芳香族香味成分[J].酿酒科技,2006(10):92-94.
[35]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J]. J Ind Microbiol Biotechn,2010,37(8):815-821.
[36]陈诗佳,李玲玲,陈叶福,等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技,2018(10):114-119.
[37]黄家岭,廖妍俨,孙棣,等.顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物[J].中国酿造,2016,35(8):163-168.
[38]王松,陈雪玲,游玲,等.1株产香酵母在浓香型白酒复糟酒生产中的应用[J].中国酿造,2020,39(9):42-47.
[39]简晓平,简章容,余丽辰,等.1株Wickerhamomyces酵母菌对浓香型白酒发酵的影响[J].酿酒科技,2017(9):33-38.