猕猴桃,又称奇异果、藤梨、羊桃等[1],不仅富含维生素C(vitamin C,VC)[2],还含有黄酮、亚油酸、多酚类及黄酮类物质,可清除体内多余自由基,具有强的抗氧化性、防癌抗癌[5]等药理作用。苍溪县作为“红心猕猴桃”原产地和国内最早开展红心猕猴桃商业化种植的地区[6],产出的猕猴桃皮薄汁多可以提高人体免疫力,对心血管、消化道系统疾病也有较好功效[7],具有良好的开发前景。
果酒的酿造历史悠久,是以新鲜水果或果汁为原料,经发酵酿制而成的富含各种营养物质的低度饮料酒[8-9]。酵母菌是酒类酿造过程中重要的微生物,可以将果汁中的糖转化为乙醇、二氧化碳以及其他风味物质[10]。目前,混菌发酵是果酒酿造工业中常用的方法,其利用不同微生物代谢提供丰富的代谢产物,赋予发酵酒独特的风味。相比单菌发酵,混菌发酵可以提高挥发性香气物质总含量[11-13],改善了果酒感官品质[14],对果酒风味具有积极地贡献[15-16]。猕猴桃酿制的果酒风味独特,兼具鲜果香与酒香气[17-18],口感甘醇自然,酒精度低,符合酒类“四个转换”[19]。但不同酵母菌发酵得到的红心猕猴桃果酒在单一指标上表现优异,酵母菌AU、MA发酵的猕猴桃果酒具有良好的色泽,酵母菌BV发酵的猕猴桃果酒在气味和滋味上表现较为优异,酵母菌FR可以明显降低苦味和涩味。但鲜见混合酵母菌发酵猕猴桃果酒品质的研究报道。
在前期研究结果基础上,本研究将4种优质酵母菌AU、MA、BV、FR两两组合(BV-FR、BV-MA、BV-AU、FR-MA、FR-AU、MA-AU)发酵制备红心猕猴桃果酒,对果酒酒精度、颜色参数、滋味、气味指标及抗氧化性进行检测,以期为红心猕猴桃果酒混合酵母菌的选择提供理论依据,为猕猴桃果酒的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
红心猕猴桃鲜果:采自四川苍溪县;酵母菌L'AUTHENTIUQE(AU)、LA FRUITEE(FR)、LA MARQUISE(MA):俄罗斯SOFRALAB公司;葡萄酒活性干酵母BV818(BV):安琪酵母股份有限公司;果胶酶(酶活50 000 U/g):上海蓝季科技有限公司;偏重亚硫酸钾(分析纯):日照隆堡商贸有限公司;柠檬酸(分析纯):郑州商贸特征有限公司;白砂糖:市售。
1.2 仪器与设备
PAL-1手持糖度计:日本ATAGO公司;SA402B电子舌:日本INSENT公司;PEN3电子鼻:德国AIRSENSE公司;HUNTERLAB色度仪:美国HUNTERLAB公司;PHS-3E型实验室pH计:上海金迈仪器仪表公司;V-1800型可见光分光光度计:上海美谱达仪器有限公司。
1.3 实验方法
1.3.1 红心猕猴桃果酒加工工艺流程及操作要点
前处理→果胶酶酶解→调糖酸比→灭菌→混合酵母活化、接种→恒温发酵→过滤离心→成品
前处理:挑选无损伤、无发霉、无斑迹、无病虫害、成熟度好的红心猕猴桃鲜果,用纯水洗净自然风干,带皮放入洁净搅拌器破壁打浆,然后向猕猴桃果浆中加入0.1 g/L偏重亚硫酸钾溶液。
酶解:向果浆中加入果浆质量0.08%的果胶酶(用少量水溶解后加入),均匀搅拌后将其转移到45 ℃的水浴锅中,每隔30 min用玻璃棒搅拌1次,酶解3.5 h。
调糖酸比:采用碳酸钠溶液将猕猴桃果浆pH调节为3.7,白砂糖将果浆糖度调节至22°Bx。
灭菌处理:65 ℃的水浴锅中灭菌处理30 min。
酵母菌活化:分别将酵母菌BV、FR、MA、AU按质量比1∶1组合,得到混合酵母BV-FR、BV-MA、BV-AU、FR-MA、FR-AU、MA-AU。将0.20 g混合酵母菌加入5%葡萄糖溶液中,充分搅拌使其溶解,在37 ℃水浴锅中活化30 min。加入偏重亚硫酸钾溶液6 h后,向猕猴桃果浆中分别加入已活化混菌酵母。
恒温发酵:以发酵温度为20 ℃发酵11 d,观察到酒体中无气体产生,果酒发酵结束。
离心取酒:将完成发酵的猕猴桃果酒用纱布过滤多次,除去残渣,离心(4 ℃、8 000 r/min)10 min后取上清液得到红心猕猴桃果酒成品,放置冰箱-20 ℃备用。
1.3.2 分析检测
果酒酒精度:参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定[21]。
颜色参数:使用色度仪的透射模式进行测定[22]。L*值表示亮度、a*值代表红绿色、b*值代表黄蓝色[23]。
果酒滋味:取40 mL果酒样品和80 mL超纯水混合均匀,10 000 r/min离心10 min后取上清液抽滤,滤液备用[24]。用电子舌对果酒的酸味、苦味、涩味、咸味、鲜味五个基本味觉指标,苦的回味、涩的回味和丰度三个回味指标进行检测[25]。
果酒气味:准确量取果酒样品15 mL于50 mL的电子鼻样品瓶中,并封口,测样前需在室温放置10 min,用电子鼻探头顶空插入样品瓶中进行测样,取49 s、50 s、51 s 3个时间点处的平均响应值作为测定数据[26]。PEN3型电子鼻传感器由10种金属氧化物传器感构成[27],传感器的性能[28]见表1。
表1 金属传感器的性能
Table 1 Performance of metal sensors

金属传感器 性能W1C W5S W3C W6S W5C W1S W1W W2S W2W W3S对芳香类物质灵敏对氮氧化物灵敏对芳香类物质灵敏对氢气有选择性对芳香类物质灵敏对甲烷灵敏对有机硫化物、萜类物质灵敏对乙醇灵敏对有机硫化物灵敏对烷烃灵敏
1.3.3 猕猴桃果酒抗氧化能力
(1)羟自由基清除率测定
参照文献[29]依次将1 mL硫酸亚铁溶液(9 mmol/L),1 mL水杨酸(9 mmol/L)及1 mL的试样加入到5 mL的离心管中,混匀后加入1 mL的过氧化氢溶液(8.8 mmol/L)引发反应,摇匀后于37 ℃下放置30 min后用分光光度计测定波长510 nm处的吸光度值A1;取蒸馏水替代硫酸亚铁溶液测定吸光度值A2;取蒸馏水替代试样作空白对照测定吸光度值A3。计算公式如下:
(2)DPPH自由基清除率测定
参照文献[30]取0.15 mL果酒于试管中,补加纯水稀释至1.5 mL,加入0.2 mmol/L DPPH溶液1.5 mL,摇匀,室温避光反应30 min,测定波长517 nm处的吸光度值A1;取等体积乙醇溶液代替DPPH溶液测吸光度值A2;取乙醇代替果酒样品作空白对照测吸光度值A3。计算公式如下:
1.3.4 数据处理
采用SPSS16.0软件对果酒品质做显著性差异分析,运用SAS 8.1软件对果酒整体品质进行主成分分析(principal component analysis,PCA)和聚类分析(cluster analysis,CA),采用Origin2018作图。
2 结果与分析
2.1 混菌发酵对猕猴桃果酒酒精度的影响
不同酵母菌组合发酵对猕猴桃果酒酒精度的影响见图1。

图1 混菌发酵对红心猕猴桃果酒酒精度的影响
Fig.1 Effect of dual-yeast fermentation on alcohol content of red kiwifruit wine
不同字母表示差异显著(P<0.05)。下同。
由图1可知,不同组别猕猴桃果酒果酒酒精度为11.9%vol~13.9%vol,符合GB/T 15038—2006《葡萄酒、果酒通用分析方法》规定范围(8%vol~18%vol)内。其中BV-AU发酵的果酒酒精度最高,为13.9%vol。BV-FR发酵的果酒酒精度最低,为11.9%vol。表明BV-AU发酵利用糖转化酒精效能最优。
2.2 混菌发酵对猕猴桃果酒颜色参数的影响
不同酵母菌组合发酵对猕猴桃果酒颜色参数的影响见图2。
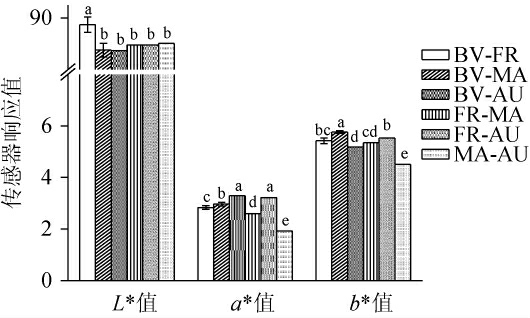
图2 混菌发酵对红心猕猴桃果酒颜色参数的影响
Fig.2 Effect of dual-yeast fermentation on chromaticity of red kiwifruit wine
由图2可知,BV-FR混菌发酵的红心猕猴桃果酒L*值与其他果酒存在显著性差异(P<0.05),表观上该果酒更明亮、清透。BV-AU、FR-AU发酵的果酒a*值显著高于其他果酒(P<0.05),果酒酒体颜色为浅红色,符合优质的红心猕猴桃果酒在表观上应呈现出的光泽度高、清亮、透明等特点[31]。BV-MA发酵的果酒的b*值最高,果酒酒体颜色为淡黄色。表明BV-AU发酵的果酒颜色参数表现最为优异。
2.3 混菌发酵对红心猕猴桃果酒滋味的影响
红心猕猴桃果酒滋味传感器响应雷达图见图3。
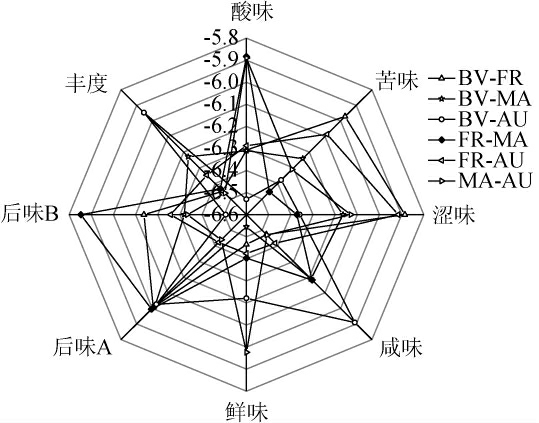
图3 红心猕猴桃果酒滋味传感器响应雷达图
Fig.3 Radar chart of dual-yeast fermentation on taste sensors of red kiwifruit wine
由图3可知,FR-MA发酵的猕猴桃果酒苦味、涩味最低,表明该组混菌发酵能够抑制发酵过程中产生的不良滋味。与之相反,BV-FR组苦味、涩味最浓。MA-AU组合发酵的猕猴桃果酒鲜味响应值最高,表明该组合有助于提升果酒鲜味。BV-AU组丰度(鲜味的回味)响应值最高,表明其可以提升鲜味的回味。因此,MA-AU与BV-AU发酵果酒的滋味品质较优。
2.4 混菌发酵对猕猴桃果酒气味的影响
混菌发酵对猕猴桃果酒气味的影响见表2。
表2 混菌发酵对红心猕猴桃果酒气味的影响
Table 2 Effect of dual-yeast fermentation on odor of red kiwifruit wine
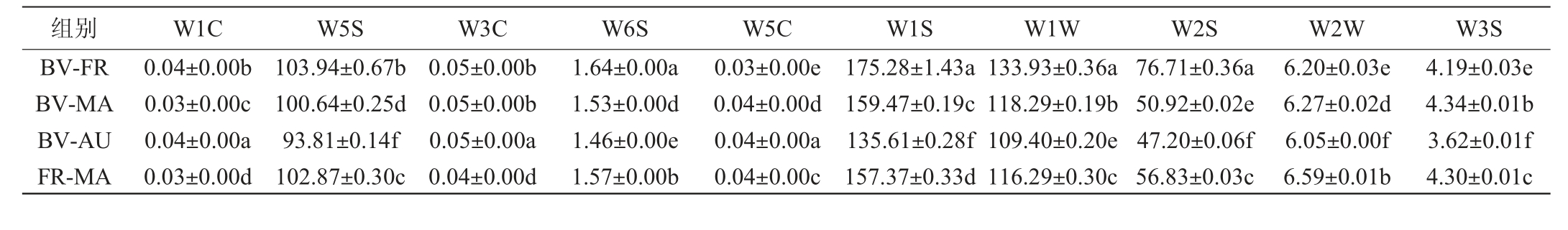
组别 W1C W5S W3C W6S W5C W1S W1W W2S W2W W3S BV-FR BV-MA BV-AU FR-MA 0.04±0.00b 0.03±0.00c 0.04±0.00a 0.03±0.00d 103.94±0.67b 100.64±0.25d 93.81±0.14f 102.87±0.30c 0.05±0.00b 0.05±0.00b 0.05±0.00a 0.04±0.00d 1.64±0.00a 1.53±0.00d 1.46±0.00e 1.57±0.00b 0.03±0.00e 0.04±0.00d 0.04±0.00a 0.04±0.00c 175.28±1.43a 159.47±0.19c 135.61±0.28f 157.37±0.33d 133.93±0.36a 118.29±0.19b 109.40±0.20e 116.29±0.30c 76.71±0.36a 50.92±0.02e 47.20±0.06f 56.83±0.03c 6.20±0.03e 6.27±0.02d 6.05±0.00f 6.59±0.01b 4.19±0.03e 4.34±0.01b 3.62±0.01f 4.30±0.01c
续表

注:同列小写字母不同表示差异显著(P<0.05)。
组别 W1C W5S W3C W6S W5C W1S W1W W2S W2W W3S FR-AU MA-AU 0.03±0.00c 0.03±0.00e 98.66±0.24e 107.40±0.20a 0.05±0.00c 0.04±0.00e 1.53±0.00d 1.56±0.01c 0.04±0.00b 0.04±0.00d 151.11±0.40e 164.86±0.32b 113.85±0.14d 118.00±0.28b 55.66±0.02d 60.80±0.18b 6.36±0.01c 6.85±0.03a 4.24±0.01d 4.92±0.01a
由表2可知,BV-AU发酵果酒对传感器W1C、W3C、W5C(对芳香类物质灵敏)响应值最高,表明BV-AU发酵过程中能促进芳香类化合物的生成[32-34],使得果酒香气浓郁[35],而对传感器W1W与W2W、W5S、W6S(对氢气有选择性)、W1S、W3S响应明显欠缺,表明BV-AU混合组能明显减少有机硫化物、氮氧化物、甲烷等缺陷性气味,使果酒的风味更好[36]。BV-FR发酵果酒虽然对传感器W1C、W3C响应值比较高,但其对传感器W6S、W1S、W1W的响应值最高,表明该组混菌发酵有较多缺陷性气味。MA-AU发酵果酒对传感器W1C、W3C响应值最低,同时对传感器W5S、W2W、W3S的响应值最高。综上所述,BV-AU发酵果酒的气味表现最为优异。
2.5 红心猕猴桃果酒品质指标的主成分分析
主成分分析是将多指标简化为少量变量的一种统计方法,用少数变量尽可能多的反映原来变量的信息[37-38]。酒精度、颜色参数、滋味、气味指标的主成分特征值及方差贡献率见表3,红心猕猴桃果酒品质指标主成分因子载荷图、各组别因子得分图及其主成分双标图见图4。
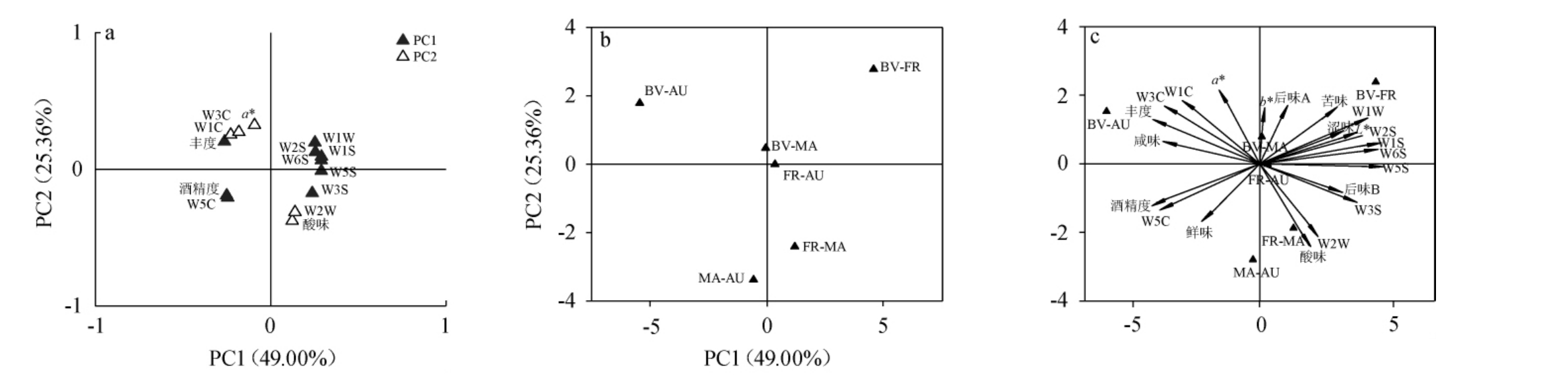
图4 红心猕猴桃果酒品质指标主成分因子载荷图(a)、因子得分图(b)及其主成分双标图(c)
Fig.4 Principal component factor loading diagram (a), factor score diagram (b) and its principal component biplot (c) of red kiwifruit wine based on quality indexes
表3 主成分特征值及方差贡献率
Table 3 Eigenvalue and variance contribution rate of principal components
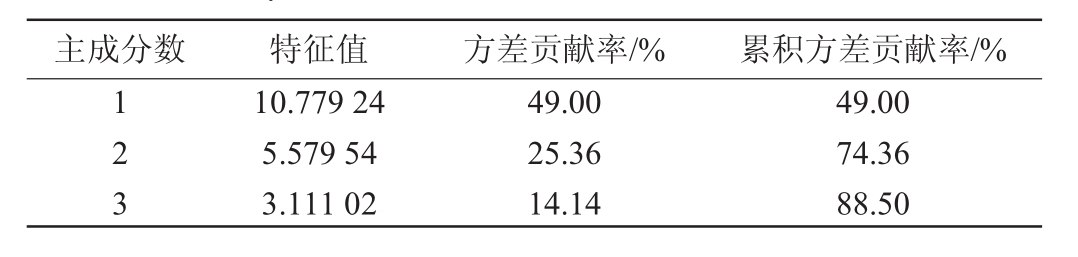
主成分数 特征值 方差贡献率/% 累积方差贡献率/%1 2 3 10.779 24 5.579 54 3.111 02 49.00 25.36 14.14 49.00 74.36 88.50
由表3可知,PC1、PC2、PC3方差贡献率分别为49.00%、25.36%、14.14%,累计方差贡献率达88.50%,可以很好地解释总变量。
由图4a可知,PC1由7种气味指标W5C、W1S、W2S、W3S、W5S、W6S、W1W、1种滋味指标丰度及酒精度构成,PC2由3种气味指标W1C、W3C、W2W和1种滋味指标酸味及颜色参数a*值构成。由图4b可知,酒样BV-FR、BV-MA分布在第一象限,酒样BV-AU分布在第二象限,酒样FR-AU几乎与X轴重合,酒样FR-MA、MA-AU分布在X轴下方。结合图4a和图4b可知,BV-AU果酒W1C、W3C、W5C、丰度、酒精度、a*值等指标对应的值较高,表明该果酒香气浓郁,鲜味的回味长,酒体呈现淡淡的红色。BV-FR果酒W6S、W1S、W1W等指标对应值较高,表明该果酒产生的缺陷性气味较多。与前述结果一致。主成分双标图综合主成分因子载荷和综合得分信息,能更全面、直观体现果酒品质的变化,由图4c可知,鲜味载荷因子位于双标图第三象限,与MA-AU组夹角最小且最为靠近,说明MA-AU组鲜味最丰富;同理,BV-AU组果酒香气最为浓郁;BV-FR组苦味、涩味最浓。与前述结果一致。因此,采用PCA可有效区分不同混合酵母菌发酵酒样。
2.6 红心猕猴桃果酒聚类分析
红心猕猴桃果酒聚类分析见图5。由图5可知,平均距离为15时,红心猕猴桃果酒可分为3个聚类,其中果酒样品BV-FR组形成聚类I,BV-MA、FR-MA、FR-AU与MA-AU果酒样品形成聚类Ⅱ,果酒样品BV-AU形成聚类Ⅲ,其中果酒样品BV-AU品质与其他果酒样品品质相差最大,而与MA-AU组品质最为相近。因此,采用聚类分析可有效区分不同混合酵母菌发酵酒样。
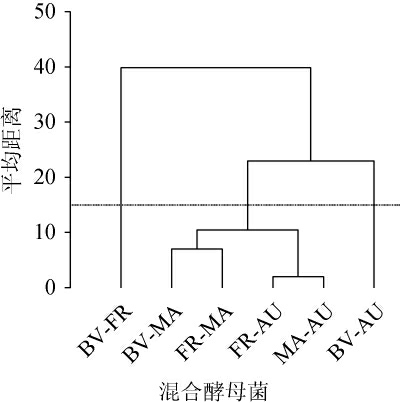
图5 红心猕猴桃果酒聚类分析
Fig.5 Cluster analysis of red kiwifruit wine
2.7 红心猕猴桃果酒抗氧化能力分析
由图6a可知,果酒对羟自由基清除率大小顺序为:BV-FR>FR-AU>BV-MA>BV-AU>MA-AU>FR-MA。果酒对羟自由基清除率均<50%,其中BV-FR发酵猕猴桃果酒羟自由基清除率最高(42.62%),FR-MA发酵果酒羟自由基清除率最低(30.37%),低于龚文玲等[39]的研究结果。由图6b可知,混菌发酵的果酒的DPPH自由基清除率整体较高,酵母组合对果酒DPPH自由基清除率大小顺序为:MA-AU>BV-FR>FR-AU>FR-MA、BV-MA、BV-AU,其中MA-AU发酵的猕猴桃果酒DPPH自由基清除率最高(98.96%),BV-AU发酵的猴桃果酒DPPH自由基清除率为94.18%,其他组别DPPH自由基清除率差异不显著(P>0.05),高于相关报道[39]。因此,MA-AU发酵果酒的抗氧化性较好。
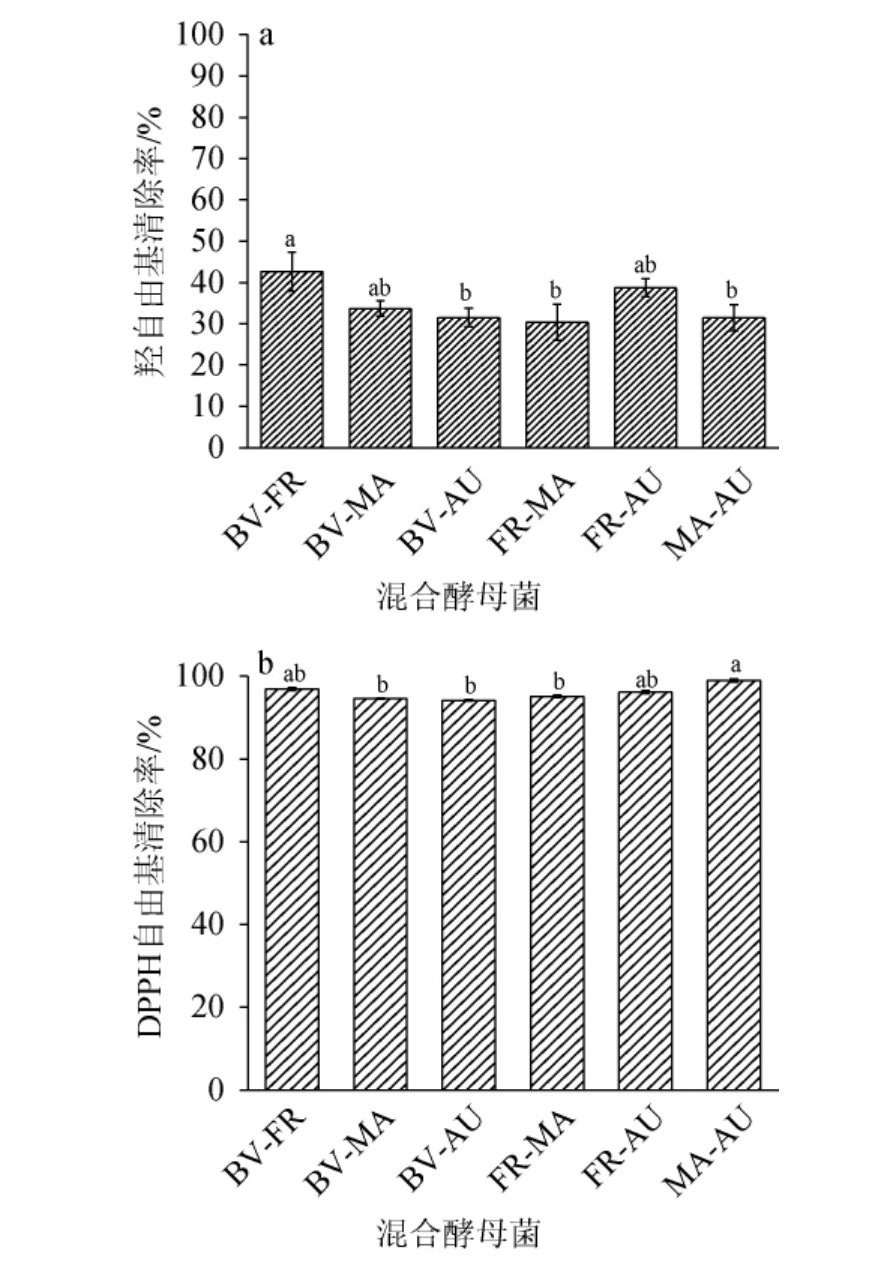
图6 红心猕猴桃果酒的羟自由基(a)及DPPH自由基(b)清除率
Fig.6 Hydroxyl radical and DPPH radical scavenging rate of red kiwifruit wine
3 结论
本研究对混菌发酵制得红心猕猴桃果酒的酒精度、颜色参数、滋味、气味其抗氧化活性进行检测,并基于品质指标进行主成分分析(PCA)及聚类分析(CA)。结果表明,BV-AU发酵的果酒酒精度、a*值、鲜味的回味响应值及芳香类物质含量最高,而缺陷性气味含量最低;其DPPH自由基清除率为94.18%,具有较好的抗氧化活性。PCA及CA结果表明,基于品质指标可有效区分不同混合酵母菌发酵酒样。
[1]李华丽,魏仲珊,邓萍,等.猕猴桃的营养价值及其加工应用[J].湖南农业科学,2019(1):119-122.
[2]DIMIDI E,STAUDACHER H M.Could a kiwifruit a day keep the doctor away[J].Lancet Gastroenterol Hepatol,2020,5(7):648.
[3]SUN X,ZHANG H,WANG J,et al.Sodium alginate-based nanocomposite films with strong antioxidant and antibacterial properties enhanced by polyphenol-rich kiwi peel extracts bio-reduced silver nanoparticles[J].Food Packaging and Shelf Life,2021,29:100741.
[4]ZHU M T,HUANG Y S,WANG Y L,et al.Comparison of(poly)phenolic compounds and antioxidant properties of pomace extracts from kiwi and grape juice[J].Food Chem,2019,271:425-432.
[5]秦晋颖,谢晓林,朱燕,等.红心猕猴桃果酒抗氧化及抑制人肝癌HepG2细胞增殖活性研究[J].酿酒科技,2020(11):36-39.
[6]王玉玺.苍溪县猕猴桃产业融合发展路径研究[J].安徽农业科学,2019,47(15):218-219.
[7]谯蓉.苍溪县种植红心猕猴桃的气候资源分析[J].种子科技,2017,35(11):52-53.
[8]梁艳玲,陈麒,伍彦华,等.果酒的研究与开发现状[J].中国酿造,2020,39(12):5-9.
[9]曹颖,耿瑶,韩乃瑄,等.果酒中的有机酸及降酸策略研究[J].食品工业科技,2023,44(14):1-8.
[10]刘晓柱,李银凤,张远林,等.鲜食葡萄来源酵母菌的鉴定及其酿造学特性分析[J].中国酿造,2021,40(3):48-53.
[11]王燕荣,胡海霞,史晓霞,等.混菌发酵对‘123’苹果酒香气成分的影响[J].中国酿造,2023,42(9):96-102.
[12]许强,杨素红,谭溪莉,等.混菌发酵桑葚酒工艺优化及挥发性成分分析[J].中国酿造,2022,41(5):60-66.
[13]王倩倩.嗜杀酿酒酵母与发酵毕赤酵母混菌发酵的增香酿造效果评价[D].杨凌:西北农林科技大学,2019.
[14]刘晓燕.混菌发酵、酒泥陈酿对赤霞珠干红葡萄酒品质的影响[D].乌鲁木齐:新疆农业大学,2022.
[15]尹晓洁.Williopsis saturnus和葡萄酒酵母共同发酵对枣酒风味物质的影响[D].南昌:南昌大学,2018.
[16]高甜甜.混菌发酵对柑橘果酒风味影响研究[D].长沙:湖南大学,2022.
[17] LAN T, GAO C X, YUAN Q Y, et al.Analysis of the aroma chemical composition of commonly planted kiwifruit cultivars in China[J].Foods,2021,10(7):1645.
[18]QI Y M,LIU M M,YANG K,et al.Effect of skin maceration treatment on aroma profiles of kiwi wines elaborated with actinidia deliciosa"Xuxiang"and a.chinensis"Hort16A"[J].J AOAC Int,2019,102(2):683-685.
[19] LI D X, ZHU F.Starch structure in developing kiwifruit[J].Int J Biol Macromol,2018,14(120):1306.
[20]李昕沂,刘丹丹,罗晶晶,等.不同酵母菌发酵对猕猴桃果酒品质的影响[J].中国酿造,2021,40(2):107-110.
[21]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[22]王玉荣,张俊英,潘婷,等.籼米米酒和糯米米酒品质的评价[J].食品与发酵工业,2017,43(1):186-191.
[23] WU Y Q, ZHANG C H, HUANG Z J, et al.The color difference of rubus fruits is closely related to the composition of flavonoids including anthocyanins[J].LWT-Food Sci Technol,2021,149:111825.
[24]马佳佳,李华佳,魏冰倩,等.徐香猕猴桃果酒发酵过程中品质动态变化的研究[J].中国酿造,2020,39(4):86-90.
[25]于博,郭壮,汤尚文,等.不同发酵时间米酒滋味品质变化的研究[J].食品研究与开发,2015,36(10):15-18.
[26]杨江,杨成聪,凌霞,等.基于电子鼻和气相色谱-质谱联用技术评价襄阳地区腊肠风味品质[J].肉类研究,2018,32(8):46-50.
[27]李娜,王玉荣,葛东颖,等.当阳地区鲊广椒中乳酸菌的分离鉴定及其应用[J].中国酿造,2019,38(2):37-41.
[28]杨淑花,李瑜.莲藕泡菜品质检测中电子鼻检测参数的优化[J].包装与食品机械,2018,36(4):20-24.
[29]兰永丽.石榴酒及石榴乳酸饮料发酵工艺优化及其风味和抗氧化性研究[D].杨凌:西北农林科技大学,2017.
[30]李诗颖,陈琳,糜心怡,等.提取方法对银杏蛋白功能特性及抗氧化活性的影响[J].食品科技,2021,42(20):37-43.
[31]HUANG J T,WANG Y Q,REN Y C,et al.Effect of inoculation method on the quality and nutritional characteristics of low-alcohol kiwi wine[J].LWT-Food Sci Technol,2022,156:113049.
[32]尹雪林,龚丽娟,钟武,等.戴尔有孢圆酵母与酿酒酵母混合发酵对猕猴桃酒香气的影响[J].食品科学,2021,42(22):216-223.
[33]王铁儒,郭丽,马曼,等.SPME-GC-MS与电子鼻结合分析不同酵母混菌发酵猕猴桃酒的挥发性香气物质[J].食品工业科技,2021,42(16):119-128.
[34]赵江林.红酵母和酿酒酵母混合发酵对猕猴桃酒风味物质的影响[D].成都:四川农业大学,2020.
[35]丁玉萍,王梦泽,刘宇欣,等.单菌与混菌发酵软枣猕猴桃果酒品质比较[J].中国酿造,2023,42(5):145-150.
[36]唐荣,陈绍军,钟焱,等.酵母及原料品种对猕猴桃酒挥发性成分的影响[J].食品工业科技,2019,40(3):216-223.
[37]MEIRA C L C,NOVAES C G,NOVAIS F C,et al.Application of principal component analysis for the evaluation of the chemical constituents of Mimosa tenuiflora methanolic extract by DLLME/GC-MS[J].Microchem J,2020,152:104284.
[38] HONG Y, LIAO X Y, CHEN Z L.Determination of bioactive components in the fruits of Cercis chinensis Bunge byHPLC-MS/MS and quality evaluation by principal components and hierarchical cluster analyses[J].J Pharm Anal,2021,11(4):465-471.
[39]龚文玲,传均强,徐洪磊,等.商业酿酒酵母发酵百香果果酒的品质及抗氧化性分析[J].中国酿造,2023,42(3):135-139.