银屑病是一种慢性炎症性皮肤病,其特征是带有白色鳞屑的界限清楚的红斑[1-2]。银屑病斑块的组织学显示棘皮症(表皮增生),其覆盖由真皮树突细胞、巨噬细胞、T细胞和中性粒细胞组成的炎症浸润[3],并导致不受控制的角质形成细胞增殖和功能失调的分化。该疾病的致病原因复杂,是一种由遗传、免疫和环境因素之间复杂的相互作用引起的多因素疾病[4],且压力、吸烟、皮肤感染、气候条件、某些药物等多种原因可能会引发皮肤细胞功能的改变[5]。因此,药物的抗炎、抗增殖和免疫抑制作用在银屑病治疗中发挥着重要作用。但目前的有效治疗药物皮质类固醇有萎缩、毛细血管扩张等副作用[6]。因此,一种能够在较长时间内提供疗效和安全性的药物尤为重要,因中药潜在的功效和安全性作为治疗银屑病的新候选药物而受到关注[7]。据报道,中药成分的新型药物递送系统具有多个作用位点,从而使患者康复并提高患者依从性[8]。中医理论认为,血燥是银屑病的主要证候之一,养血润肤、活血散风是中医治疗银屑病的治疗原则[9]。
汉代以前经典医药著作中记载的方剂通称为经方,经方黄精酒始载于《太平圣惠方》,具有延年补养,发白再黑,齿落更生之功效[10]。《本草纲目》中记载经方黄精酒“壮筋骨,益精髓,黑发,治百病”[11]。现代中医学认为,此五味中药合奏有乌须发、润血燥、延年益寿之功效。现代药理研究发现,其君药成分黄精(Polygonatum sibiricum)在抗氧化[12-13]、抗炎[14]、免疫调节[15]等方面发挥重要作用。臣药侧柏叶(Platycladi cacumen)提取物同样发挥着抗氧化、抗炎[16]等作用。另一味臣药地骨皮(Cortex lycii)主要活性成分具有抗氧化、抗炎、抗肿瘤[17]等多种药理活性。课题组前期以黄精(Polygonatum sibiricum)、苍术(Atractylodes lancea)、侧柏叶(Platycladi cacumen)、地骨皮(Cortex lycii)、天门冬(Asparagus cochinchinensis(Lour.))和黍米为原料,成功制备了半甜型经方黄精酒。基于中医理论上银屑病的成因以及中药的安全性、有效性。本研究建立了5%咪喹莫特(imiquimod,IMQ)乳膏诱导的银屑病样小鼠模型,研究黄精酒对模型小鼠银屑病样皮损、炎症反应和氧化应激水平的影响,以期为银屑病的中医药防治提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黄精(Polygonatumsibiricum):青岛天成中药饮片有限公司;苍术(Atractylodes lancea)、侧柏叶(Platycladi cacumen)、地骨皮(Cortex lycii)、天门冬(Asparagus cochinchinensis(Lour.)):青岛格恩制药有限公司;黍米:十月稻田;黄酒酵母:安琪酵母(睢县)有限公司;甲氨蝶呤:上海上药信谊药厂;咪喹莫特乳膏(明欣利迪):四川明欣药业有限责任公司。
1.1.2 试剂
甲醇、无水乙醇(均为分析纯):天津市富宇精细化工有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonic dialdehyde,MDA)、过氧化氢酶(catalase,CAT)生化试剂盒、小鼠白细胞介素-17A(interleu-kin-17A,IL-17A)试剂盒:上海江莱生物科技有限公司;4%组织细胞固定液:Biosharp公司。
1.1.3 实验动物
无特定病原体(specific pathogen free,SPF)级雄性SD小鼠,6周龄左右,体质量18~20 g,48只,购于济南朋悦实验动物繁育有限公司,动物生产许可证号:SCXK(鲁)20220006。饲养环境温度控制在(20~25)℃,相对湿度为45%~55%,每天12 h光暗循环。
1.2 仪器与设备
Specctra Max M5酶标仪:美国Molecular Devices公司;冷冻研磨仪:上海净信实业发展有限公司;CR21N高速冷冻离心机:德国Eppendorf公司;DK-S16电热恒温水浴锅:北京中仪国科科技有限公司;LA759超纯水机:英国ELGA公司。
1.3 实验方法
1.3.1 制备方法
水提液制备方法:取黄精、苍术、侧柏叶、地骨皮、天门冬药材,粉碎,全部通过二号筛(24目)且能通过四号筛(65目)的不超过40%。按照《本草纲目》中记载黄精∶苍术∶枸杞根∶侧柏叶∶天门冬∶黍米=4∶4∶5∶5∶3∶120质量比,加12倍量水浸泡10 min,煎煮0.5 h进行水提,离心抽滤后得到水提液。
经方黄精酒制备方法:按照《本草纲目》中所记载的黍米与药材的比例,黍米经过洗米、烫米后与按上述方法得到的水提液及药渣进行煮糜,在60 ℃时加入12%的麦曲糖化40 min,后加入0.15%酵母发酵7 d,发酵完成后经过离心、过滤、80 ℃杀菌40 min后得到经方黄精酒。
黄酒制备方法:黍米经过洗米、烫米后加入与提取水提液时相同体积的水进行煮糜,按照上述经方黄精酒的糖化、发酵方法进行制备。
经方黄精酒、黄酒的总糖、非糖固形物、酒精度、总酸、氨基酸态氮、氧化钙含量均满足GB/T 13662—2018《黄酒》中半甜型黄酒标准。
1.3.2 动物分组及造模
雄性SD小鼠48只适应性喂养1周后称体质量,随机分为8组,每组6只。2016版《中国居民膳食指南》中建议的成年人每日饮用酒精量和黄酒的酒精含量,成人以60 kg计,设定成人每日黄酒适宜摄入量为100 mL[19]。因此将组别设为空白对照组、模型组、甲氨蝶呤(methotrexate,MTX)组(1mg/(kg·d))(阳性组)、经方黄精酒低剂量组(5mL/(kg·d))、中剂量组(10 mL/(kg·d))、高剂量组(20 mL/(kg·d))、黄酒组(20 mL(kg·d))、水提液组(20 mL/(kg·d))。所有小鼠于造模前1 d剃毛,除空白对照组外,其余7组小鼠每天上午在剃毛区域涂抹62.5 mg含5%咪喹莫特(IMQ)的乳膏制剂,空白对照组涂抹等量的凡士林。6 h后各组对应灌胃给上述相应药液,空白对照组及模型组给予蒸馏水,MTX组给予1 mg/(kg·d)MTX,其余各组给予相应剂量药物。从造模之日起,所有灌胃给药均同步进行,每天一次,持续5 d。末次给药后小鼠禁食不禁水12 h,称体质量,解剖,同时采集脾、皮损和血清标本。
1.3.3 小鼠一般情况观察
造模的5 d中密切观测小鼠体质量、神态、活动度、体表毛发、存活率等一般情况,记录数据。
1.3.4 银屑病面积严重程度指数
每日利用数码相机拍照,观察小鼠背部皮损的变化情况,并对小鼠进行银屑病面积与严重性指数(psoriasis area and severity index,PASI)评分,评分指标包括皮损表面红斑、鳞屑和厚度等参数。研究中使用的评分量表基于医生全球评估严重程度量表[20],评分标准如表1所示,将肥厚、红斑、鳞屑指标三者得分相加得到总评分。
表1 银屑病面积与严重性指数评分标准
Table 1 Scoring criteria of psoriasis area and severity index
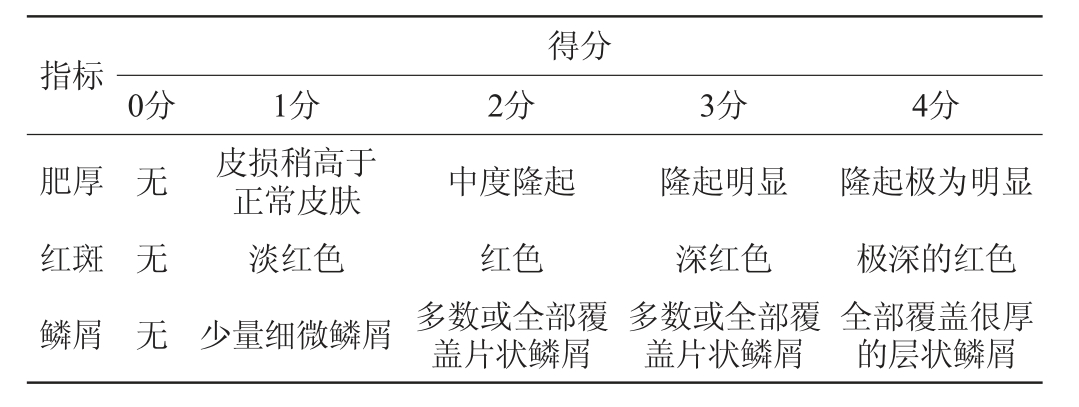
指标 得分0分 1分 2分 3分 4分肥厚红斑鳞屑无无无皮损稍高于正常皮肤淡红色少量细微鳞屑中度隆起红色多数或全部覆盖片状鳞屑隆起明显深红色多数或全部覆盖片状鳞屑隆起极为明显极深的红色全部覆盖很厚的层状鳞屑
1.3.5 脾脏指数
解剖当日称小鼠质量后,颈椎脱臼处死,立即取脾脏,去净筋膜,用滤纸吸干表面血污,称量脾脏质量,按照下式计算脾脏指数。
1.3.6 苏木精-伊红(HE)染色
小鼠皮肤组织用4%多聚甲醛溶液固定,石蜡包埋。将石蜡包埋的组织切片用HE染色以进行组织学评估。
1.3.7 IL-17A检测
第6天采用眼球取血法采集小鼠血样,4 ℃静置一夜后离心(3 000 r/min,4 ℃,20 min)。取血清于1.5 mL EP管中,采用IL-17A小鼠酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒检测血清中IL-17A的表达水平。
1.3.8 皮肤组织中丙二醛含量、过氧化氢酶和超氧化物歧化
酶活性测定
每只小鼠取0.1 g背部皮肤,用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗并切成小块,使用组织匀浆机将这些样品在提取液中进行匀浆。匀质化的组织在冷冻离心机中以4 ℃、12 000 r/min离心10 min。将获得的上清液用生化试剂盒进行MDA、CAT、SOD的测定。
1.3.9 数据处理
数据以“平均值±标准差”的形式表示,采用SPSS 22.0软件对数据进行分析,作图软件采用GraphPad Prism 9.0.0。
2 结果与分析
2.1 经方黄精酒对小鼠体质量变化的影响
各组小鼠5 d内的体质量变化测定结果见图1。由图1可知,正常组小鼠体质量稳定增加,精神状态较好,体表毛发鲜亮。模型组小鼠体质量逐渐减轻,精神萎靡不振,运动量减少,体表毛发明显减少且色泽暗淡。在经方黄精酒、黄酒、水提液给药期间,小鼠体质量有所回升,精神状态好转,体表毛发色泽有所恢复。其各项效果优于甲氨蝶呤组,且经方黄精酒中、高剂量组与黄酒组较其他组改善效果更优,考虑可能是中药及黄酒中有效成分对银屑病样小鼠模型存在着整体调节作用。
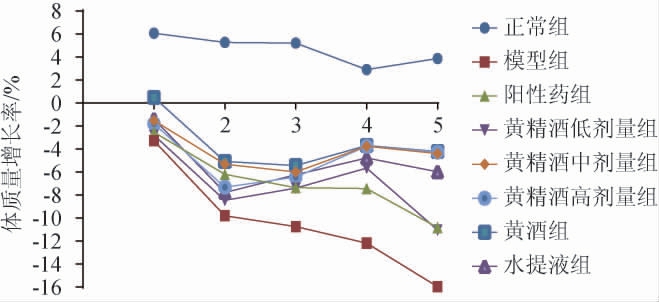
图1 各组小鼠5日内体质量变化
Fig.1 Changes of mice body weight in each group within 5 d
2.2 小鼠PASI评分变化
小鼠背部皮损的变化情况见图2。由图2可知,正常组小鼠背部皮肤光滑,模型组小鼠背部可见大面积红斑且鳞屑较厚,皮肤浸润增厚程度较重;与模型组相比,阳性组、经方黄精酒高剂量组、黄酒组、水提液组斑块成淡红色,鳞屑明显变少变薄,皮肤浸润情况减轻,说明阳性组、经方黄精酒高剂量组、黄酒组、水提液组均对IMQ诱导引起的背部皮损有一定的改善作用,且经方黄精酒高剂量组改善效果优于黄酒组、水提液组。
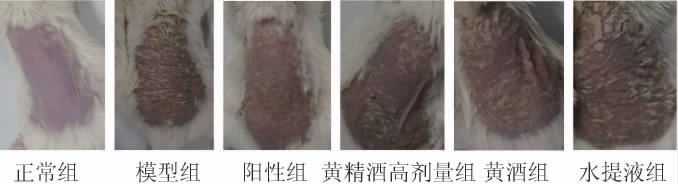
图2 小鼠背部皮损情况
Fig.2 Skin lesions on the back of mice
根据小鼠每日各项得分绘制PASI评分趋势线,结果见图3。由图3a可知,经方黄精酒组对于银屑病样小鼠的红斑改善效果优于黄酒组、水提液组,且经方黄精酒浓度越高改善效果越明显;由图3b可知,经方黄精酒组对于减少浸润增厚程度效果优于黄酒组、水提液组,且经方黄精酒浓度越高改善效果越明显;由图3c可知,经方黄精酒组对于减少鳞屑效果优于黄酒组、水提液组,且经方黄精酒浓度越高改善效果越明显;由图3d可知,将红斑、肥厚、鳞屑评分相加,得到最终的总评分,经方黄精酒组总评分均低于黄酒组、水提液组,且经方黄精酒浓度越高改善效果越明显。表明经方黄酒对银屑病样小鼠的红斑、肥厚度以及磷屑情况有改善效果。
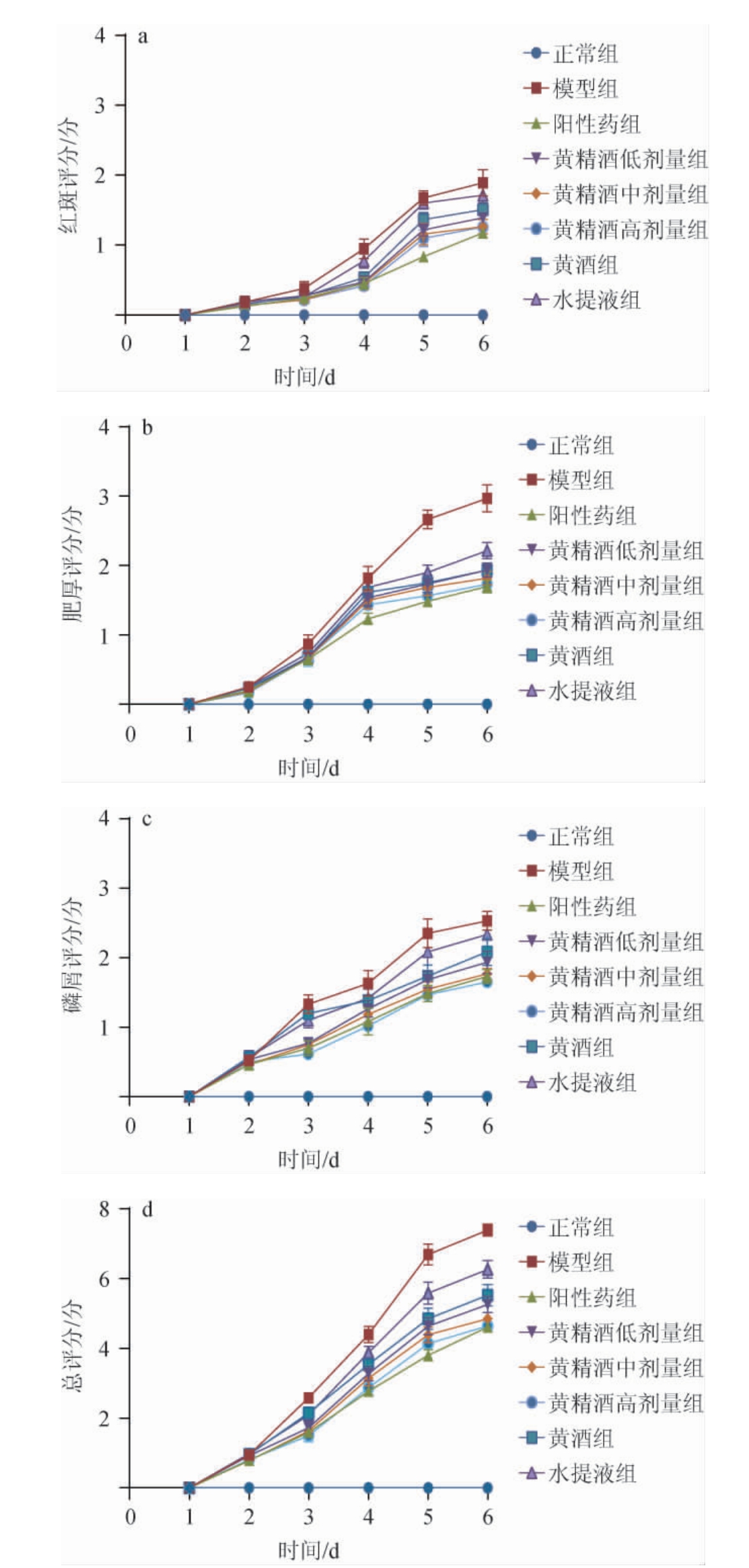
图3 各组小鼠5日后皮损形态学的变化
Fig.3 Morphological changes of skin lesions in each group after 5 d
2.3 脾脏指数
免疫细胞在银屑病发展过程中发挥着重要作用,IMQ是一种免疫激活剂,可通过激活免疫细胞来加重银屑病[21]。局部应用IMQ诱导银屑病导致脾肿大,IMQ诱导对脾脏指数的影响结果见图4。由图4可知,与正常对照组相比,模型组小鼠的脾脏指数极显著增加(P<0.01);与模型组相比,阳性组、经方黄精酒组、黄酒组、水提液组小鼠脾脏指数均极显著降低(P<0.01)。这说明MTX、经方黄精酒、黄酒、水提液对于IMQ诱导银屑病导致的脾肿大均具有很好的改善作用,且黄精酒低剂量组改善效果优于黄精酒中高剂量组、黄酒组、水提液组。
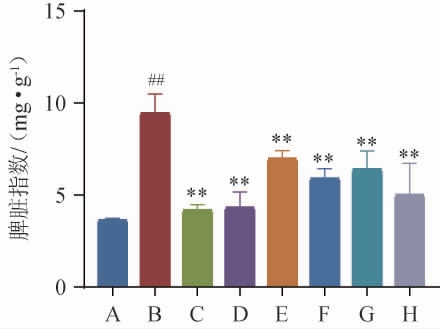
图4 咪喹莫特诱导对小鼠脾脏指数的影响
Fig.4 Effect of imiquimod induction on spleen index of mice
A-空白对照组;B-模型组;C-阳性对照组;D-经方黄精酒低剂量组;E-经方黄精酒中剂量组;F-经方黄精酒高剂量组;G-黄酒组;H-水提
液组;“##”表示与空白对照组比较差异显著(P<0.01);“**”表示与模型组比较差异极显著(P<0.01);“*”表示与模型组比较差异显著(P<0.05),下同。
2.4 各组小鼠背部皮肤病理学变化
为了进一步评价经方黄精酒对银屑病的治疗作用,通过HE染色分析了小鼠背部皮肤的病理变化,结果见图5。由图5可知,正常组小鼠皮肤组织结构正常,表皮层薄;模型组小鼠表皮层厚度增厚,过度角化,真皮层中炎症细胞大量浸润。与模型组相比,甲氨蝶呤组、经方黄精酒组、黄酒组、水提液组表皮层厚度明显变薄,真皮层中炎症细胞浸润程度较轻,皮损区域有所改善。经方黄精酒组对于皮损区域的改善效果优于黄酒组、水提液组,且随着经方黄精酒浓度的升高,表皮层厚度更薄,真皮层中炎症细胞浸润程度也更轻,表明经方黄精酒高剂量组可更加有效的改善银屑病样小鼠背部皮肤损伤。
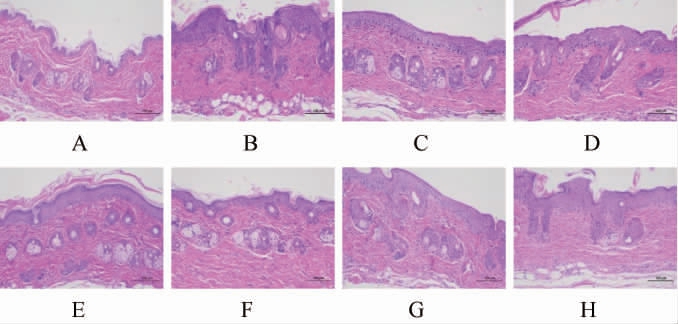
图5 各组小鼠5日后的皮损病理学表现(200×)
Fig.5 Pathological manifestations of skin lesions in mice of each group after 5 d (200×)
A-空白对照组;B-模型组;C-阳性对照组;D-经方黄精酒低剂量组;E-经
方黄精酒中剂量组;F-经方黄精酒高剂量组;G-黄酒组;H-水提液组。
2.5 IL-17A检测结果
IMQ局部应用于小鼠皮肤可能会引发炎症病变[22]。已有文献报道,角质形成细胞的过度增殖是银屑病的病理特征之一,IMQ可能通过角质形成细胞上的腺苷受体发挥其功能,从而导致促炎细胞因子的分泌[23]。此外,作为一种全身性疾病,IL-17A的过度表达在银屑病的发病机制中起着重要作用。炎症免疫细胞改变先天免疫细胞功能,从而使先天免疫细胞产生IL-17等细胞因子,这些细胞因子促进角质形成细胞过度增殖,诱发表皮增生,并导致银屑病皮肤炎症的慢性状态[24-25],小鼠血清中IL-17A表达水平测定结果见图6。由图6可知,与对照组相比,模型组小鼠IL-17A含量极显著升高(P<0.01);与模型组相比,经方黄精酒、黄酒中IL-17A含量极显著减少(P<0.01),且经方黄精酒中、高剂量组对IL-17A表达水平的抑制力优于黄精酒低剂量组、黄酒组、水提液组。表明经方黄精酒中、高剂量组可更有效的减少银屑病样小鼠炎症反应。
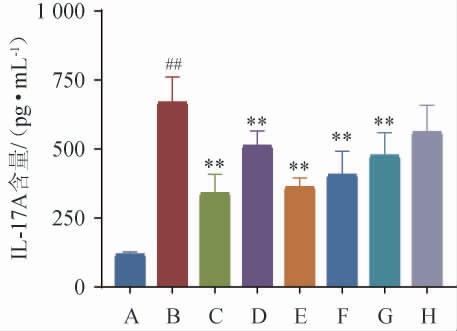
图6 小鼠血清中IL-17A表达水平
Fig.6 Expression level of IL-17A in serum of mice
2.6 背部皮肤组织抗氧化活性的生化评估
氧化应激也会引发刺激,这些刺激在免疫细胞的过度增殖和激活中起着重要作用。随着这些变化,氧化应激会导致活性氧失衡和抗氧化酶水平受损,从而导致分子异常和不规则的氧化还原信号传导。许多文献报道了氧化还原失衡与银屑病病变发生之间的关系。在这种情况下,氧化应激标志物显著增加,MDA、CAT、SOD等的活性及其酶水平受到影响。背部皮肤组织的抗氧化活性测定结果见图7。
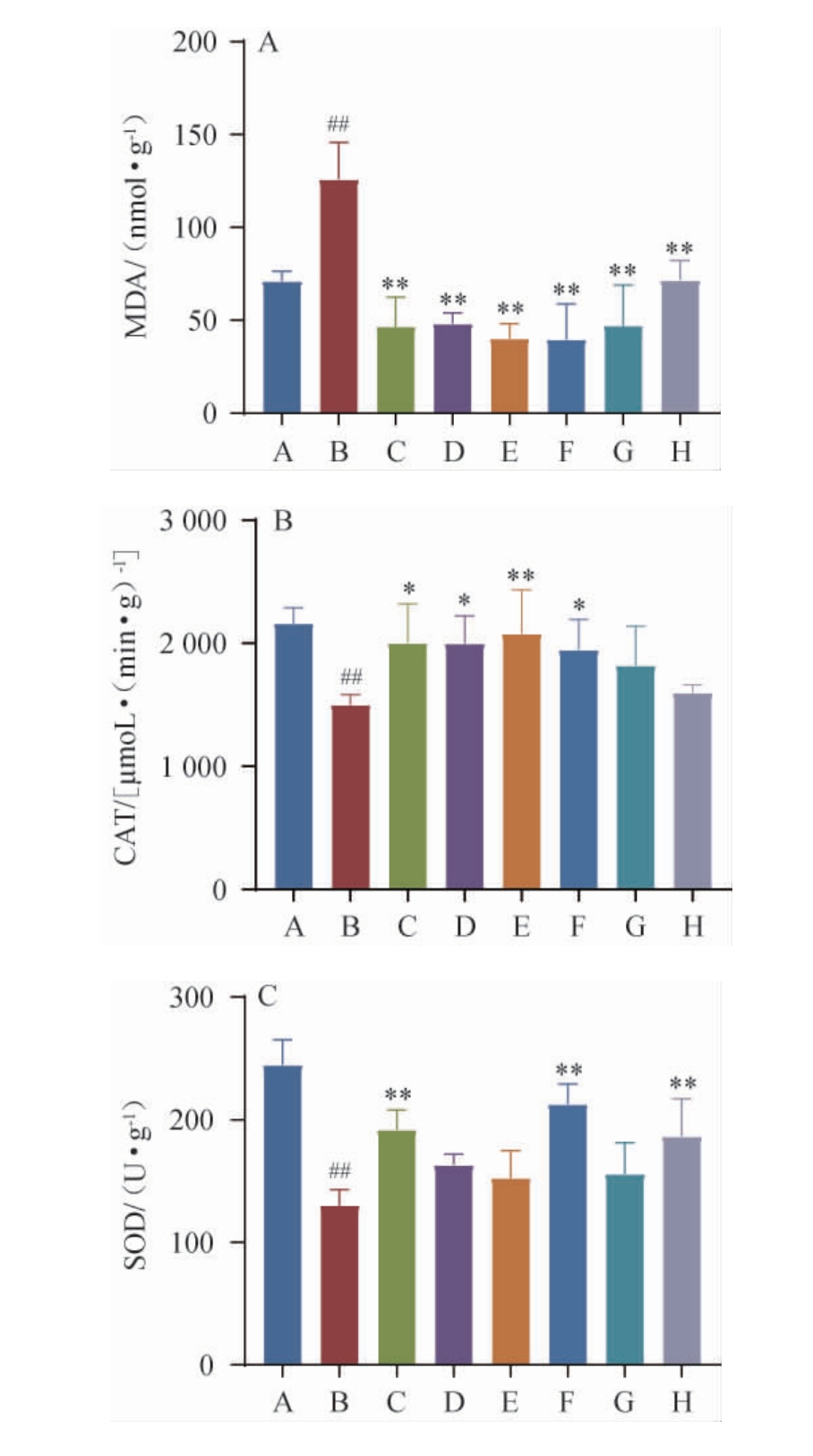
图7 背部皮肤组织抗氧化活性测定结果
Fig.7 Determination results of antioxidant activity of back skin tissue
MDA是由于生物体器官衰老或在逆境条件下受到伤害,其组织或器官脂质发生过氧化反应而产生的,银屑病皮肤中脂质过氧化的发生是通过硫代巴比妥酸(thiobarbituric acid,TBA)水平的增加来衡量的[26]。由图7A可知,与空白对照组相比,模型组小鼠MDA含量极显著升高(P<0.01);与模型组相比,经方黄精酒组、黄酒组、水提液组小鼠MDA含量极显著降低(P<0.01),且经方黄精酒中、高剂量组对MDA的抑制效果优于低剂量组、黄酒组、水提液组。
过氧化氢酶普遍存在于植物动物组织中,其活性与生物体的代谢强度及抗寒、抗病能力有一定关系,过氧化氢会加剧炎症状况,可通过测量过氧化氢酶的状态来分析它们对银屑病皮肤的影响。由图7B可知,与空白对照组相比,模型组小鼠CAT含量极显著降低(P<0.01);与模型组相比,经方黄精酒中剂量组小鼠中CAT含量极显著升高(P<0.01),低、高剂量组显著升高(P<0.05),而黄酒组及水提液组未见明显改善效果。
SOD是一种金属酶,在动植物、微生物和培养细胞体内广泛存在,可将超氧阴离子转化为过氧化氢,具有抗衰老、提高机体对多种疾病的抵抗力,在银屑病中,SOD水平降低与表皮过度增殖有关。由图7C可知,与正常对照组相比,模型组小鼠SOD水平极显著降低(P<0.01);与模型组相比,经方黄精酒高剂量组、水提液组SOD含量极显著升高(P<0.01),而低、中剂量组及黄酒组未见显著影响(P>0.05)。
综上,结果表明,经方黄精酒具有很好的抗氧化活性,可有效调节银屑病样小鼠氧化/抗氧化状态。经方黄精酒组对银屑病样小鼠的抗氧化活性优于黄酒组、水提液组,且高剂量组对其改善效果更佳。
3 结论
本实验室自制的经方黄精酒符合黄酒各项标准,含酒精量低,刺激性较弱。本研究对其减轻银屑病样小鼠症状能力进行评价,结果显示,经方黄精酒可以有效改善银屑病样小鼠体质量下降的现象,并可极显著缓解由IMQ引起的银屑病样小鼠的脾肿大(P<0.01);与模型组相比,经方黄精酒组小鼠表皮层厚度明显变薄,真皮层中炎症细胞浸润程度较轻,皮损区域有所改善;极显著抑制IL-17A的过度表达从而减轻银屑病炎症(P<0.01),并可通过减少MDA含量,提升CAT、SOD活性来有效调节IMQ诱导小鼠的氧化/抗氧化状态,使其达到更有利的生理平衡。黄酒及水提液对于银屑病样小鼠症状也有一定程度的改善作用,但总体效果来看弱于经方黄精酒。考虑是因经方黄精酒中共含五味中药,药物大部分具有活血祛瘀、抗炎、抗氧化的作用,将其与黍米炒制后发酵酿制而成经方黄精酒,药借酒力、酒助药势,可更好的将药效传至全身,提高了疗效。由以上研究结果可判定经方黄精酒可以很好的改善银屑病样小鼠相关症状,这为经方黄精酒的进一步开发提供了理论基础。
[1]BOEHNCKE W H,SCHON M P.Psoriasis[J].Lancet,2015,386(9997):983-994.
[2]GRIFFITHS C E M,ARMSTRONG A W,GUDJONSSON J E,et al.Psoriasis[J].Lancet,2021,397(10281):1301-1315.
[3]RENDON A,SCHAKEL K.Psoriasis pathogenesis and treatment[J].Int J Mol Sci,2019,20(6):1475.
[4]GUPTA R,DEBBANEH M G,LIAO W.Genetic epidemiology of psoriasis[J].Curr Dermatol Rep,2014,3(1):61-78.
[5] PANDEY K, NIMISHA.An overview on promising nanotechnological approaches for the treatment of psoriasis[J].Recent Pat Nanotechnol,2020,14(2):102-118.
[6]UVA L,MIGUEL D,PINHEIRO C,et al.Mechanisms of action of topical corticosteroids in psoriasis[J].Int J Endocrinol,2012,2012:561018.
[7]LUO Y,CHEN J,KUAI L.et al.Chinese herbal medicine for psoriasis:evidence from 11 high-quality randomized controlled trials[J].Front Pharmacol,2020,11:599433.
[8] DABHOLKAR N, RAPALLI V K, SINGHVI G.Potential herbal constituents for psoriasis treatment as protective and effective therapy[J].Phytother Res,2020,10.1002/ptr.6973.
[9]王晓瑾,张建英,张守亮,等.中医药防治银屑病的机制研究进展[J].中国实验方剂学杂志,2022,28(21):243-253.
[10](宋)王怀隐等.太平圣惠方[M].北京:人民卫生出版社,1968:200-203.
[11](明)李时珍.本草纲目:上[M].北京:华夏出版社,2011:105-108.
[12] LI J, WANG Z, FAN M, et al.Potential antioxidative and anti-hyperuricemic components targeting superoxide dismutase and xanthine oxidase explored from Polygonatum sibiricum red[J].Antioxidants (Basel),2022,11(9):1651.
[13] WANG S, LI G, ZHANG X, et al.Structural characterization and antioxidant activity of Polygonatum sibiricum polysaccharides[J].Carbohydr Polym,2022,291:119524.
[14]许慧,代磊,邓鹏飞,等.基于网络药理学黄精抗炎活性成分及作用机制研究[J].安徽农业大学学报,2022,49(1):144-149.
[15]叶绍凡.黄精多糖对力竭运动小鼠胸腺胸腺指数、脾脏指数、T淋巴细胞亚群、巨噬细胞吞噬功能的影响[J].基因组学与应用生物学,2015,34(1):60-65.
[16]李远辉,文全泰,张照平,等.侧柏叶多糖的提取及其抗氧化活性的研究[J].中国中医药科技,2016,23(1):40-42,47.
[17]臧慧静,刘学,孙亚娟,等.双水相萃取法提取地骨皮多酚及抗氧化活性研究[J].应用化工,2021,50(4):855-859,867.
[18]黎浩,柳航,王敏,等.地骨皮甲素的药理作用研究进展[J].药物评价研究,2022,45(6):1200-1205.
[19]秦文,王丽媛,杨倬,等.黄酒对高脂血症模型大鼠血脂及肠道菌群的影响[J].中国酿造,2019,38(4):65-69.
[20]PASCOE V L,KIMBALL A B.Seasonal variation of acne and psoriasis:A 3-year study using the Physician Global Assessment severity scale[J].J Am Acad Dermatol,2015,73(3):523-525.
[21]RAMANUNNY A K,WADHWA S,KUMAR SINGH S,et al.Topical non-aqueous nanoemulsion of Alpinia galanga extract for effective treatment in psoriasis: In vitro and in vivo evaluation[J].Int J Pharm,2022,624:121882.
[22]CHUANG S Y,LIN C H,SUNG C T,et al.Murine models of psoriasis and their usefulness for drug discovery[J].Expert Opin Drug Discov,2018,13(6):551-562.
[23] FLUTTER B, NESTLE F O.TLRs to cytokines: mechanistic insights from the imiquimod mouse model of psoriasis[J].Eur J Immunol,2013,43(12):3138-3146.
[24]ALBANESI C,MADONNA S,GISONDI P,et al.The interplay between keratinocytes and immune cells in the pathogenesis of psoriasis[J].Front Immunol,2018,9:1549.
[25]叶理,蘭茅强,吕成志,等.皮肤屏障功能异常与银屑病[J].皮肤科学通报,2017,34(4):426-433.
[26] TEKIN N S, TEKIN I O, BARUT F, et al.Accumulation of oxidized low-density lipoprotein in psoriatic skin and changes of plasma lipid levels in psoriatic patients[J].Mediators Inflamm,2007,2007:78454.