黄桃(Amygdalus persica)属于蔷薇科桃属,发源于我国的西北部高原地区[1],因其果肉呈金黄而得名。黄桃果肉含有丰富的维生素、矿物质、有机酸、膳食纤维等营养物质[2-4],具降脂降压[5]、缓解疲劳、生津止渴[6]等功效,堪称养生之桃。炎陵黄桃,又称高山黄桃,以香、脆、甜而闻名于世。炎陵黄桃生长于湖南省炎陵县平均海拔1 000 m以上的深山之中,由于种植面积越来越大,导致黄桃采后不耐贮藏、易腐烂的问题日渐凸显,造成资源浪费。因此,黄桃常被用来做食品加工原料,在市场上,黄桃罐头、黄桃干和黄桃果酱等都是经过简单加工处理后的产品,总体来说利用附加值并不高。将黄桃制成酵素,既能解决保藏和浪费问题,还能提升果品附加值,延伸黄桃产业链[7]。
果蔬酵素是指使用水果、蔬菜为原料,经过微生物如酵母菌、乳酸菌等益生菌发酵后得到,具有多种生物活性成分的一种产品[8]。酵素不仅保留了果蔬的营养成分,制备酵素过程中会产生新的代谢物如黄酮类、酚类、酶等活性成分[9],具有抗氧化[10]、抗菌消炎[11]、保护心血管、调节免疫[12]、改善肠道菌群等功能[13-14],通过发酵改变提升了产品的品质及经济价值[15-16]。酚类物质是酵素抗氧化活性的重要成分指标之一,其对O2-自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-二-3-乙基-苯并噻唑-6-磺酸二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基的清除率反映了非酶抗氧化活性。目前,国内主要对葡萄[17]、苹果[18]、石榴[19]、猕猴桃[20]、蓝莓[21]等水果酵素的工艺参数和抗氧化活性进行了深入的研究。然而,鲜有文献报道黄桃酵素的制备工艺。
本研究以炎陵黄桃为原料,酿酒酵母(Saccharomyces cerevisiae)作为发酵菌种制备黄桃酵素。在单因素试验的基础上,利用响应面法对黄桃酵素的发酵工艺进行优化,并对黄桃酵素的抗氧化活性及理化指标进行分析,以期提高其生物活性,为当地特色农产品深加工提供一定理论依据和实践指导。
1 材料与方法
1.1 材料与试剂
炎陵黄桃:采自湖南省炎陵县;酿酒酵母(Saccharomyces cerevisiae);安琪酵母股份有限公司;白糖:市售;没食子酸、乳酸、酒石酸、苹果酸、柠檬酸、丁二酸、富马酸、己二酸标准品、葡萄糖标准品(纯度均>98%)、抗坏血酸、2,4,6-三(2-吡啶基)三嗪(均为分析纯):上海源叶生物科技有限公司;ABTS:湖南汇百侍生物科技有限公司;无水乙醇、甲醇、酚酞、苯酚、葡萄糖(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
DP-YXQ-LS-50SⅡ全自动立式压力蒸汽灭菌器:北京亚欧德鹏科技有限公司;UV8000A紫外可见光分光光度计:上海精密仪器有限公司;FA2004电子天平:南京科航实验仪器有限公司;FS200-S均质器:力辰科技有限公司;WZ108手持糖度仪:济宁欧科机械设备股份有限公司;PH-100A笔试酸度计:浙江谱析仪器有限公司;10AT型高效液相色谱仪:日本Shimadzu公司;VM24固相萃取装置:天津博纳艾杰尔仪器有限公司;KQ250型超声波清洗机:上海科岛自动化系统有限公司;DHP-9032A电热恒温培养箱:上海飞越实验仪器有限公司;离心机TD5A-WS:湖南湘仪仪器有限公司。
1.3 方法
1.3.1 黄桃酵素的制备工艺流程及操作要点
黄桃→去核→打浆→灭菌→接种活化酵母→发酵、抽滤→黄桃酵素成品
操作要点:
选取无腐烂、无病虫害,充分成熟的新鲜黄桃,使用蒸馏水清洗干净后晾干,去除核后连皮打浆,充分混匀后分成5份,每份50 g。把黄桃果浆放入5个250 mL的具塞锥形瓶,加入20 g白糖。巴氏灭菌后在无菌操作台上接种已活化好的酵母(将5 g活性干酵母粉倒入50 mL已灭菌25 ℃的水活化30 min),在25 ℃条件下密封发酵3 d,当pH≤4.5时发酵结束,以未接种酵母作为对照组,真空抽滤即得黄桃酵素成品。
1.3.2 黄桃酵素发酵条件优化
单因素试验:设置基础发酵条件为发酵温度25 ℃,发酵时间3 d,酵母接种量1.0%,分别考察发酵温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃),发酵时间(1 d、2 d、3 d、4 d、5 d),酵母接种量(0.1%、0.5%、1.0%、1.5%、2.0%)对总酚含量的影响。
响应面试验:根据单因素试验结果,以酵母接种量(A)、发酵温度(B)、发酵时间(C)为自变量,以总酚含量(Y)为响应值,采用Design-Expert 10.0.4设计3因素3水平的响应面试验,响应面试验因素及水平见表1。
表1 发酵条件优化响应面试验设计因素和水平
Table 1 Factors and levels of response surface tests design for fermentation conditions optimization
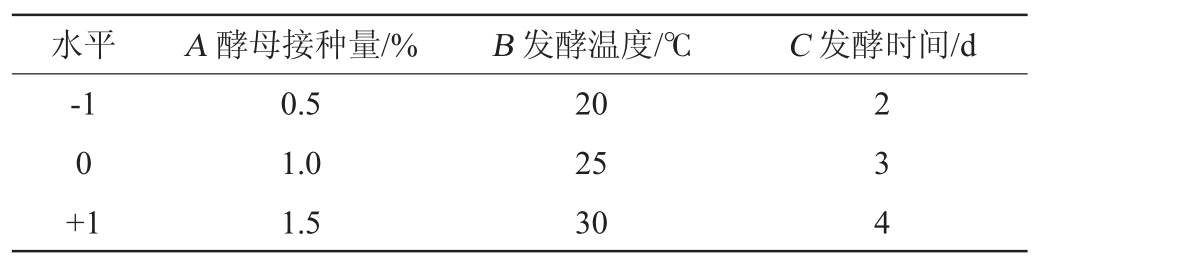
水平 A 酵母接种量/% B 发酵温度/℃ C 发酵时间/d-1 0+1 0.5 1.0 1.5 20 25 30 2 3 4
1.3.3 分析检测
总酚含量的测定:采用福林-酚试剂法[22];O2-自由基清除率的测定:参考文献[23];DPPH自由基清除率的测定:参考文献[24];ABTS自由基清除率的测定:参考文献[25];总酸的测定:按照GB/T 12456—2021《食品安全国家标准食品中总酸的测定》规定的酸碱指示剂滴定法;有机酸:按照GB 5009.157—2016《食品安全国家标准食品有机酸的测定》;粗多糖:按照SN/T 4260—2015《出口植物源食品中粗多糖的测定苯酚-硫酸法》;乙醇的测定:按照GB/T 12143—2008《饮料通用分析方法》;葡萄糖、果糖、蔗糖、甘油、山梨醇含量的测定:参考文献[26]。
1.3.4 数据处理
使用SPSS 25.0进行方差分析,使用Origin 2021软件进行绘图。
2 结果与分析
2.1 发酵工艺优化单因素试验结果
发酵温度、发酵时间、接种量对黄桃酵素总酚含量的影响见图1。由图1a可知,随着发酵时间在1~3 d范围内的延长,总酚含量逐渐增加;当发酵时间为3 d时,总酚含量达到最高值,为8.49 mg/mL;当发酵时间>3 d时,总酚含量逐渐下降。因此,确定最佳发酵时间为3 d。
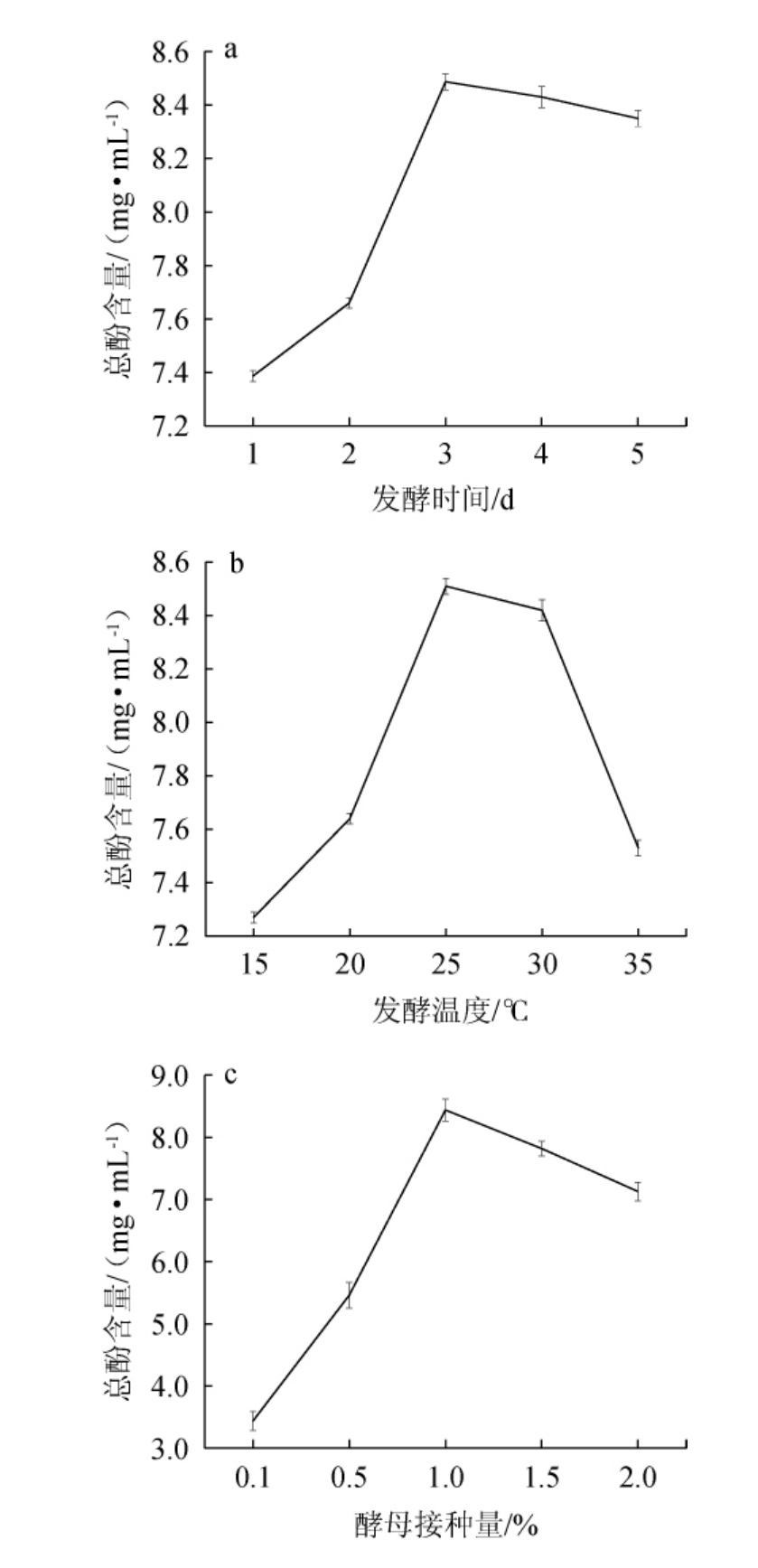
图1 发酵时间(a)、发酵温度(b)、酵母接种量(c)对总酚含量的影响
Fig.1 Effects of fermentation time (a), temperature (b) and yeast inoculum (c) on total phenol contents
由图1b可知,随发酵温度在15~25 ℃范围内的增加,总酚含量逐渐增加;当发酵温度为25 ℃时,总酚含量达到最高值,为8.51 mg/mL;当发酵温度>25 ℃时,总酚含量逐渐下降。因此,确定最佳发酵温度为25 ℃。
由图1c可知,当接种量为0.1%~1.0%时,总酚含量逐渐增加;当接种量为1.0%时,总酚含量达到最大值,为8.44 mg/mL;当接种量>1.0%时,总酚含量逐渐下降。因此,确定最佳接种量为1.0%。
2.2 发酵工艺优化响应面试验
2.2.1 响应面试验结果与分析
在单因素试验结果的基础上,选取接种量(A)、发酵温度(B)、发酵时间(C)三个因素为自变量,以总酚含量(Y)为响应值,采用Box-Behnken试验优化黄桃酵素的发酵工艺条件,试验设计及结果见表2。
表2 发酵条件优化响应面试验设计与结果
Table 2 Design and results of response surface tests for fermentation conditions optimization
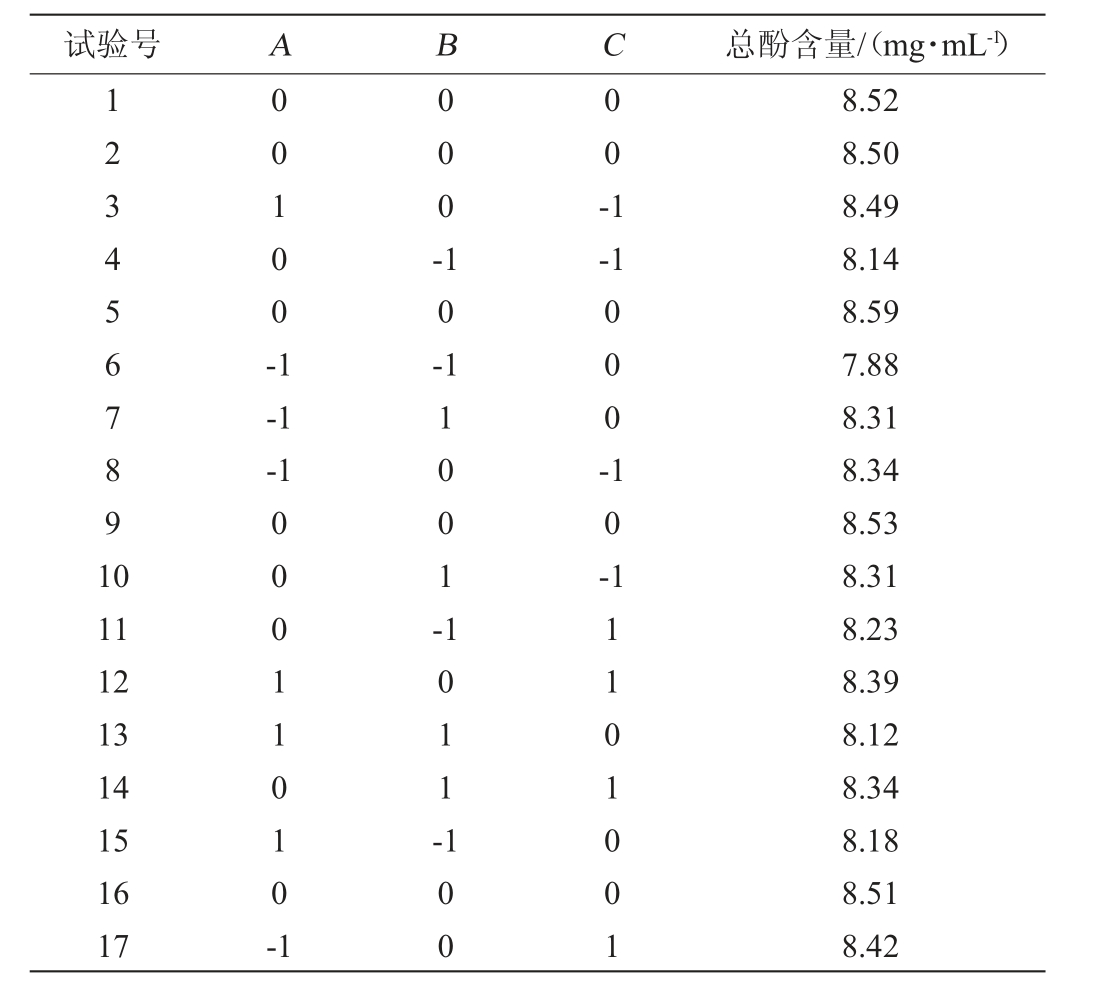
试验号 A B C 总酚含量/(mg·mL-1)1 2 3 4 5 6 7 8 9 1 0 0 0 1 0 0-1 0 0 0-0 0-1 1 0--1-1-1 0 0 0-1 0-11 12 13 14 15 16 17 0 0 0 1 1 0 1 0-1 1 1 0 0 1-1 0 1 1-1 0 0 1 1 1 0 1 0 0 1 8.52 8.50 8.49 8.14 8.59 7.88 8.31 8.34 8.53 8.31 8.23 8.39 8.12 8.34 8.18 8.51 8.42
采用Design-Expert10.0.4软件对表2的试验数据建立多元回归模型,拟合得到二次回归方程:Y=8.53+0.029A+0.081B+0.012C-0.12AB-0.045AC-0.015BC-0.13A2-0.28B2-6.25×10-3C2。
对回归方程进行方差分析,结果见表3。由表3知,回归模型极显著(P<0.01),失拟项不显著(P=0.505 1>0.05),表明模型拟合度较高。决定系数R2=0.984 8,调整决定系数R2Adj=0.965 2,表明此模型对实际试验方法拟合度和预测性都较好,适合黄桃酵素发酵工艺。变异系数(coefficient of variation,CV)=0.42%<1%,说明此试验的精密度和试验的重复性高,信噪比(S/N)=23.982>4,可知回归方程残差由随机误差引起,也表明可以用该模型对黄桃酵素发酵工艺条件进行预测和分析。由P值可知,一次项B,交互项AB,二次项A2、B2对总酚含量发酵影响极显著(P<0.01),交互项AC对总酚含量发酵影响显著(P<0.05),由F值可知,影响黄桃酵素发酵工艺条件因素为B>A>C,即发酵温度>酵母接种量>发酵时间。说明通过该多元回归方程模型得到的优化试验结果可靠性高,可用该模型分析和预测黄桃酵素的多酚含量。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
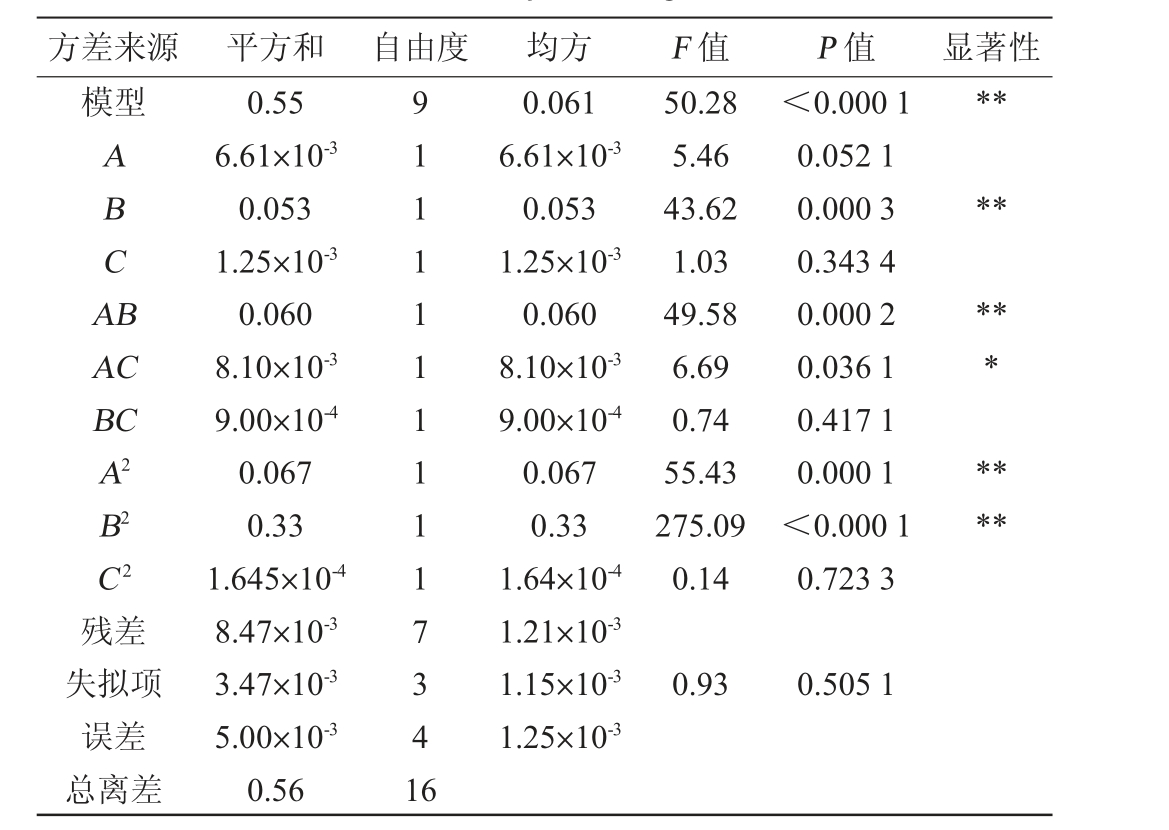
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著
(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**A B C A B**AC BC A2 B2 C2残差失拟项误差总离差0.55 6.61×10-3 0.053 1.25×10-3 0.060 8.10×10-3 9.00×10-4 0.067 0.33 1.645×10-4 8.47×10-3 3.47×10-3 5.00×10-3 0.56 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.061 6.61×10-3 0.053 1.25×10-3 0.060 8.10×10-3 9.00×10-4 0.067 0.33 1.64×10-4 1.21×10-3 1.15×10-3 1.25×10-3 50.28 5.46 43.62 1.03 49.58 6.69 0.74 55.43 275.09 0.14<0.000 1 0.052 1 0.000 3 0.343 4 0.000 2 0.036 1 0.417 1 0.000 1<0.000 1 0.723 3*******0.93 0.505 1
2.2.2 交互作用分析
等高线图可以反映两因素之间的交互作用,椭圆越扁,交互作用越强,反之则越弱[27]。利用Design-Expert 10.0.4软件对表3的试验数据进行二次多元回归拟合分析,得到各因素间交互作用对结果影响的响应曲面和等高线,结果见图2。由图2可知,酵母接种量和发酵温度、酵母接种量和发酵时间间交互作用的等高线呈椭圆形,对总酚含量影响较大。这与方差分析结果一致。
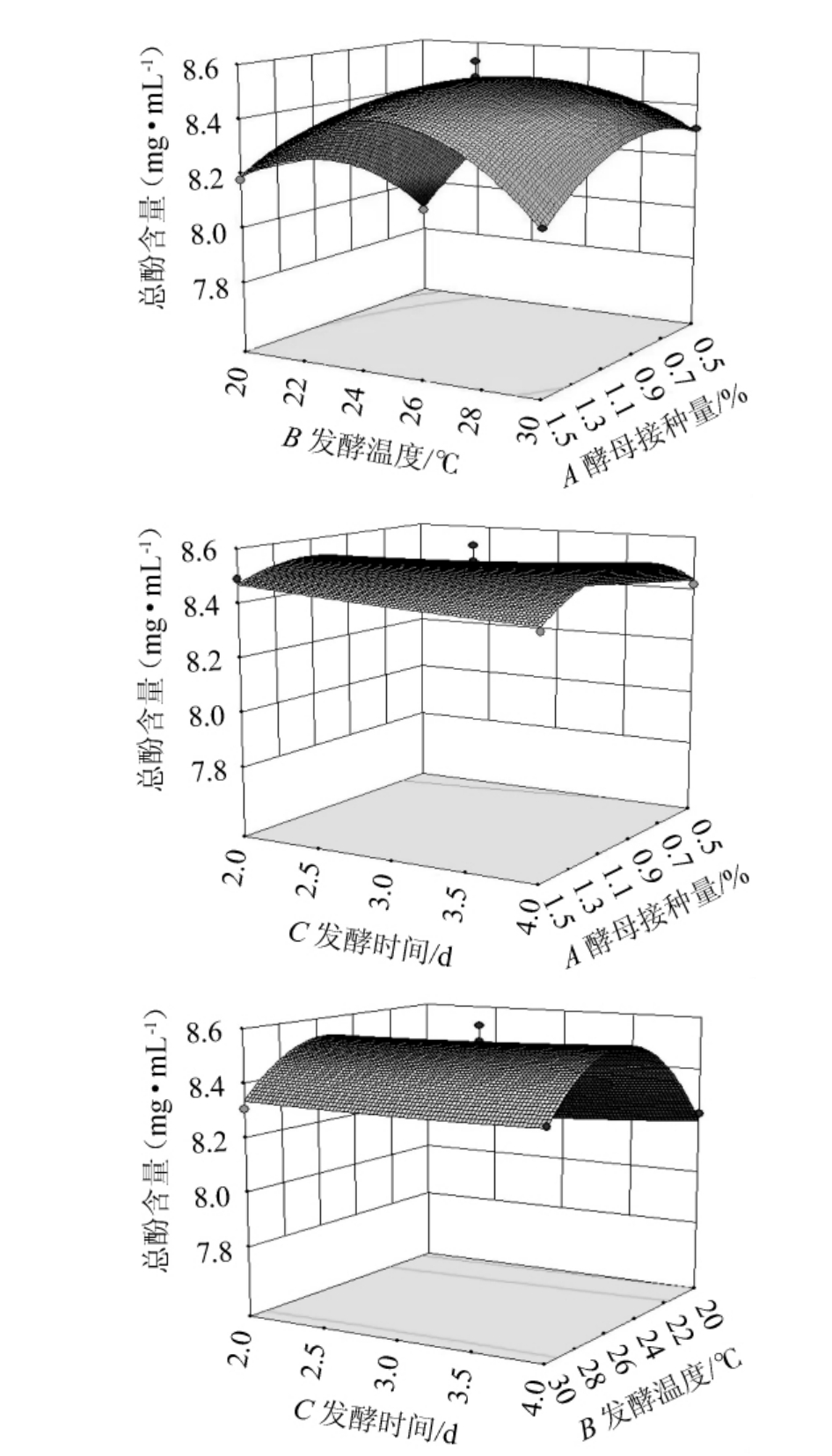
图2 各因素间交互作用对总酚含量影响的响应曲面及等高线
Fig.2 Response surface plots and contour lines of effects of interaction between each factor on total phenol contents
2.2.3 验证试验
采用Design-Expert10.0.4软件对模型优化求解,得到发酵的最佳工艺条件为:酵母接种量0.932%,发酵温度25.737 ℃,发酵时间4 d,在此优化条件下,总酚含量的预测值为8.555 mg/mL。对该模型的有效性及实用性进行验证试验,为了方便操作,将最佳工艺条件修正为:接种量1%,发酵温度25 ℃,发酵时间4 d。在此条件下进行3次验证试验,得到总酚含量实际平均值为8.54 mg/mL,实际值与预测值之间偏差较小,因此,通过响应面优化后的条件参数可靠,模型具有良好的实用性和应用价值。
2.3 黄桃酵素抗氧化活性测定结果
水果酵素的抗氧化活性与其总酚含量密切相关[28],黄桃酵素发酵后总酚含量为8.54 mg/mL,比对照组总酚含量(6.33 mg/mL)增加了34.91%。黄桃酵素O2-自由基清除率、DPPH自由基清除率、ABTS自由基清除率分别为78%、80%、85%,与对照组相比,优化发酵后O2-自由基清除率、DPPH自由基清除率、ABTS自由基清除率分别增加了23.8%、31.1%、26.9%,说明在发酵过程中有新的酚类物质产生且增强了抗氧化活性。潘梓源等[29]研究的桂圆酵素发酵时至少产生16种新的酚类物质,O2-自由基清除率、DPPH自由基清除率、ABTS自由基清除率均有不同程度提高,与樊秋元等[30]研究结果一致,表明发酵后黄桃酵素有良好的抗氧化活性。
2.4 黄桃酵素理化指标测定结果
黄桃酵素主要理化指标检测结果见表4,黄桃酵素中主要多元糖和多元醇含量检测结果见表5。由表4可知,黄桃酵素的总酸、有机酸、多糖含量分别为1.36 g/100 g、1 230 mg/kg、0.46 g/100 g,均符合QB/T 5323—2018《植物酵素》,且各指标的含量都显著增加,说明发酵过程中产生总酸、有机酸和多糖类物质。由表5可知,发酵后的黄桃酵素,蔗糖含量从66.23 g/L降到48.44 g/L,葡萄糖含量从46.79 g/L降到29.92 g/L,果糖含量从66.28 g/L降到33.94 g/L,产生了微量的山梨醇和甘油,山梨醇和甘油的存在会增加酵素的复杂性,赋予酵素一些的甜味,使酵素口感更为丰富,测定乙醇含量只有0.15 g/100 g,符合酵素行业标准QB/T 5323—2018《植物酵素》要求。
表4 黄桃酵素主要理化指标检测结果
Table 4 Determination results of major physicochemical indexes of yellow peach Jiaosu
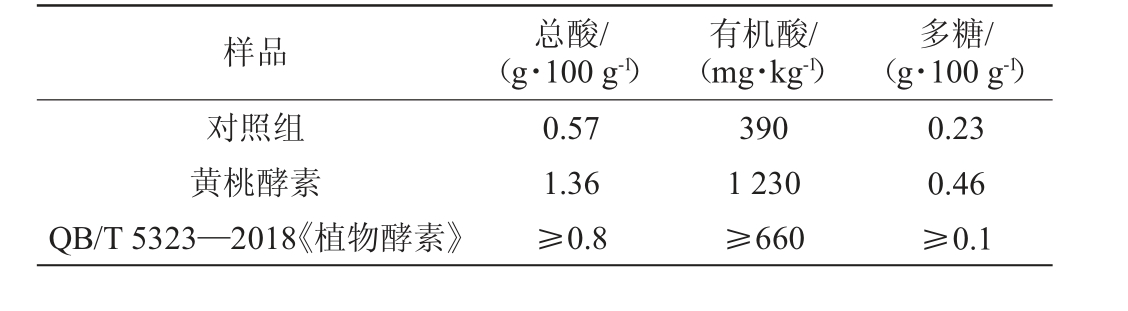
样品 总酸/(g·100 g-1)有机酸/(mg·kg-1)多糖/(g·100 g-1)对照组黄桃酵素QB/T 5323—2018《植物酵素》0.57 1.36≥0.8 390 1 230≥660 0.23 0.46≥0.1
表5 黄桃酵素中主要多元糖和多元醇含量检测结果
Table 5 Contents of main polysugars and polyols in yellow peach Jiaosu
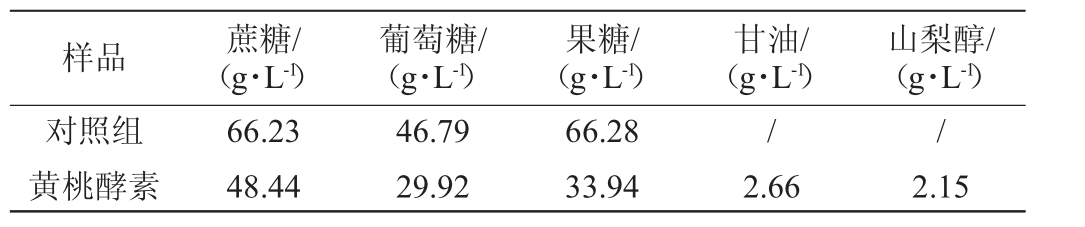
注:“/”表示未检出。
样品 蔗糖/(g·L-1)山梨醇/(g·L-1)对照组黄桃酵素葡萄糖/(g·L-1)果糖/(g·L-1)甘油/(g·L-1)66.23 48.44 46.79 29.92 66.28 33.94//2.66 2.15
3 结论
本研究采用炎陵黄桃为原料,利用酵母发酵制备黄桃酵素。通过响应面试验确定黄桃酵素最佳发酵工艺条件为:发酵时间4d、发酵温度25℃、酵母菌接种量1%。在此条件下,黄桃酵素总酚含量达到8.54 mg/mL,比发酵前(6.33 mg/mL)增加了34.91%;对O2-自由基、DPPH自由基、ABTS自由基具有良好的清除能力,表现出一定的抗氧化能力,这与多酚含量密切相关。发酵后特征性指标总酸、有机酸、多糖含量上升,符合轻工行业标准QB/T 5323—2018《植物酵素》要求。这一研究为开发和应用黄桃酵素作为天然抗氧化剂提供了重要的理论和数据支持,同时为当地特色水果黄桃进一步深加工提供了新的开发思路和实践指导。
[1]赵凯,王红,赵晓珍,等.5个黄桃品种在贵阳地区的引种评价[J].中国南方果树,2023,52(4):194-196,199.
[2]金丽梅,廖梓钊,隋世有,等.非油炸黄桃脆片的加工工艺[J].现代食品科技,2020,36(2):186-193.
[3]CAO S F,LIANG M H,SHI L Y,et al.Accumulation of carotenoids and expression of carotenogenic genes in peach fruit[J].Food Chem, 2017,214:137-146.
[4]DE VARGAS E F,JABLONSKI A,FLÔRES S H,et al.Waste from peach(Prunus persica) processing used for optimisation of carotenoids ethanolic extraction[J].Int J Food Sci Technol,2017,52(3):757-762.
[5]张胜康.常吃黄桃降脂降压[J].心血管病防治知识(科普版),2017(19):69.
[6]王卫东,黄德勇,郑义,等.响应面优化黄桃果酒发酵工艺[J].食品安全质量检测学报,2015,6(3):809-814.
[7]李白.湖南炎陵县黄桃产业助力乡村振兴实践路径[J].农业工程技术,2022,42(29):10-11.
[8]索婧怡,朱雨婕,陈磊,等.食用酵素的研究及发展前景分析[J].食品与发酵工业,2020,46(19):271-283.
[9]MUROOKA Y,YAMSHITA M.Traditional healthful fermented products of Japan[J].J Ind Microbiol Biotechnol,2008,35(8):791-798.
[10]CURIEL J A,PINTO D,MARZANI B,et al.Lactic acid fermentation as a tool to enhance the antioxidant properties of Myrtus communis berries[J].Microb Cell Fact,2015,14(1):1-10.
[11]李亚辉,马艳弘,张宏志,等.山药果蔬在乳酸菌发酵过程中组分及生物活性变化[J].食品科学,2017,38(10):137-142.
[12]LI Y Y,LIU H,QI H W,et al.Probiotic fermentation of Ganoderma lucidum fruiting body extracts promoted its immunostimulatory activity in mice with dexamethasone-induced immunosuppression[J].Biomed Pharmacother,2021,141:111909.
[13]赵菲,佟长青,李伟,等.羊栖菜酵素对小鼠肠道菌群结构和粪便差异代谢物的影响[J].大连海洋大学学报,2021,36(5):767-774.
[14]LONG X S,LIAO S T,LI E N,et al.The hypoglycemic effect of freezedried fermented mulberry mixed with soybean on type 2 diabetes mellitus[J].Food Sci Nutr,2021,9(7):3641-3654.
[15]DAI J,SHA R Y,WANG Z Z,et al.Edible plant jiaosu:manufacturing,bioactive compounds,potential health benefits,and safety aspects[J].J Sci Food Agr,2020,100(15):5313-5323.
[16] SEPTEMBRE-MALATERRE A, REMIZE F, POUCHERET P.Fruits and vegetables, as a source of nutritional compounds and phytochemicals:changes in bioactive compounds during lactic fermentation[J].Food Res Int,2018,104:86-99.
[17]GAROFALO C,BERBEGAL C,GRIECO F,et al.Selection of indigenous yeast strains for the production of sparkling wines from native Apulian grape varieties[J].Int J Food Microbiol,2018,285:7-17.
[18]LIN X,HU X P,WU W Y,et al.Evaluation of the volatile profile of wax apple(Syzygium samarangense)wines fermented with different commercial Saccharomyces cerevisiae strains[J].Food Sci Biotechnol,2018,28(3):657-667.
[19]KALAYCIOGˇLU Z,ERIM F B.Total phenolic contents,antioxidant activities, and bioactive ingredients of juices from pomegranate cultivars worldwide[J].Food Chem,2017,221:496-507.
[20]MA T T,LAN T,JU Y L,et al.Comparison of the nutritional properties and biological activities of kiwifruit(actinidia)and their different forms of products:towards making kiwifruit more nutritious and functional[J].Food Funct,2019,10(3):1317-1329.
[21]JOHNSON M H,LUCIUS A,MEYER T,et al.Cultivar evaluation and effect of fermentation on antioxidant capacity and in vitro inhibition of alpha-amylase and alpha-glucosidase by highbush blueberry(Vaccinium corombosum)[J].J Agr Food Chem,2011,59(16):8923-8930.
[22]齐伟辰,汲丽丽,李双燕,等.电磁裂解法提取大豆总酚及其抗氧化性研究[J].粮食与油脂,2023,36(5):44-48.
[23]史婷,刘伟,许弯,等.剁辣椒中抗氧化功能乳酸菌的筛选及应用研究[J].保鲜与加工,2021,21(5):47-55.
[24]SUN Y W,ZHANG S Y,LI H,et al.Assessments of probiotic potentials of Lactiplantibacillus plantarum strains isolated from Chinese traditional fermented food:phenotypic and genomic analysis[J].Front Microbiol,2022,13:895132.
[25] JEONG J B, DE LUMEN B O, JEONG H J.Lunasin peptide purified from Solanum nigrum L.protects DNA from oxidative damage by suppressing the generation of hydroxyl radical via blocking fenton reaction[J].Cancer Lett,2010,293(1):58-64.
[26]阿地拉·阿不都拉,蒲云峰,等.HPLC-RID法测定苹果中果糖山梨醇葡萄糖和蔗糖[J].农产品加工,2021(22):46-49.
[27]王娜,李鸿梅,吴洪峰,等.响应面法优化荷叶池沼公鱼鱼糕工艺配方[J].保鲜与加工,2019,19(4):150-155,161.
[28]李悦,张云娟,赵叶,等.复合水果酵素发酵过程中理化特性及抗氧化活性分析[J].食品工业,2022,43(12):138-142.
[29]潘梓源,林佳漫,邓乃铨,等.桂圆酵素的发酵工艺优化及其酚类化合物生物转化分析[J].中国酿造,2019,38(7):95-99.
[30]樊秋元,朱丹,牛广财,等.黑加仑酵素有机酸分析及其体外抗氧化性能研究[J].中国酿造,2019,38(5):159-163.