泡菜是中国最著名的传统发酵蔬菜之一,因其酸香爽脆的风味口感和有益健康的功效而受到消费者喜爱[1-2]。泡菜通常以萝卜、芥菜、豇豆、辣椒等新鲜蔬菜为原料,添加或不添加香辛料等辅料后与一定浓度的盐水或发酵老卤水混合后置于发酵坛中自然发酵而成[3-4]。泡菜通过半开放式的多代循环发酵工艺制成,其微生物组成将逐步演变为内部结构稳定的乳酸菌和酵母菌混合菌群体系[5]。研究表明,泡菜发酵中的主要乳酸菌有植物乳杆菌(Lactiplantibacillus plantarum)、耐乙醇片球菌(Pediococcus ethanolidurans)、短乳杆菌(Lactobacillusbrevis)、甘草乳杆菌(Liquorilacto bacillus nagelii)等,而酵母菌主要有毛棒毕赤酵母(Pichia manshurica)、少孢哈萨克斯坦酵母(Kazachstania exigua)等[3,6]。这些泡菜源微生物驱动产品发酵,导向特征风味,兼具益生功能。然而,大量活菌的泡菜发酵体系在后续包装贮运过程中可能导致产品因发酵而发生品质劣变,缩短产品保质期的问题[7-8]。传统灭菌技术采用的高温杀菌也是导致产品感官品质软化、风味劣变等的原因之一。
近年来,低温等离子体杀菌(cold plasma sterilization,CPS)技术因其能耗低、安全无污染及热效应低等优势受到越来越多的关注[9-10],在各类食品中得到应用,如畜禽肉、水产品、新鲜果蔬产品表面、蛋类产品以及香辛料等[11]。研究表明,CPS对于接种于畜禽肉表面以及新鲜果蔬表面的单核增生性李斯特菌、沙门氏菌、大肠杆菌、酿酒酵母、气单胞菌等微生物均有较好的杀灭效果[12-14]。不同于新鲜食品中较低的微生物载量和相对简单的菌群组成,发酵食品往往载有更为复杂的微生物体系,CPS对发酵食品中复杂菌群结构也具有一定的杀菌效果。研究表明,CPS可有效杀灭泡菜中的产气酵母和产膜酵母,缓解泡菜产品的胀袋和生花产膜问题[15-16]。因此,CPS技术在保障泡菜产品保质期品质稳定上具有潜在的应用意义。然而,目前CPS对泡菜源混合菌群模拟体系中微生物的杀菌效果研究还鲜有报道。
该研究制备泡菜源乳酸菌和酵母组成的混菌体系,考察不同低温等离子体(CPS)放电电压和处理时间对泡菜源微生物模拟混菌体系中植物乳杆菌、耐乙醇片球菌、甘草乳杆菌、毕赤酵母和少孢哈萨克斯坦酵母的杀菌效果,并评估混菌体系的产膜、产气、产酸和耐酸特性。旨在保证泡菜杀菌效果更安全、高效的同时,维持其品质,为泡菜产品的杀菌技术奠定理论和应用基础。
1 材料与方法
1.1 材料与试剂
新鲜红皮白萝卜:成都市生鲜市场;分离筛选自四川泡菜的植物乳杆菌(Lactiplantibacillus plantarum)、耐乙醇片球菌(Pediococcus ethanolidurans)、甘草乳杆菌(Liquorilactobacillus nagelii)及少孢哈萨克斯坦酵母(Kazachstania exigua)、毛榛毕赤酵母(Pichia manshurica):保存于四川省农业科学院农产品加工研究所;乳酸、氯化钠(均为分析纯):成都科隆试剂有限公司;MRS培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、孟加拉红培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
CPS-I型低温等离子灭菌设备:南京润屹有限公司;自动封膜包装机:浙江利强包装科技有限公司;LRH-150生化培养箱:上海一恒科学仪器有限公司;SynergyTM HTX多功能酶标仪:美国Bio Tek仪器有限公司;S210 SevenCompactTM型pH计:梅特勒-托利多仪器(上海)有限公司;Centrifuge 5810R冷冻离心机:艾本德(上海)国际贸易有限公司。
1.3 方法
1.3.1 菌种活化
将菌种保藏库中保藏的乳酸菌和酵母菌从-80℃冰箱中取出,常温解冻,将L.plantarum、P.ethanolidurans和L.nagelii分别划线于MRS平板上,K.exigua和P.manshurica划线于YPD平板上,乳酸菌于37 ℃恒温培养48 h,酵母菌于30 ℃培养24 h。挑取单菌落进行格兰氏染色和镜检,将单菌落进行继代培养后将L.plantarum、P.ethanolidurans和L.nagelii接种至MRS液体培养基,37 ℃培养18 h;K.exigua和P.manshurica接种至YPD液体培养基,30 ℃培养24 h,最终调整各菌株菌体浓度约为6.0 lg CFU/mL。
1.3.2 泡菜源混菌菌悬液的制备
使用市售新鲜红皮白萝卜经切分为2 cm×2 cm×5 cm的条状,置入打浆机打成匀浆,通过3层无菌纱布过滤后,于锅中100 ℃煮沸10 min,过滤残渣后,将澄清液在高压灭菌锅中经121 ℃,15 min灭菌后制备成无菌萝卜汁。将1.3.1所得的单菌培养液进行等比例混合,8 000 r/min离心10 min后收集沉淀,用等量无菌萝卜汁洗涤菌体沉淀并重悬,重复以上3次操作后将重悬菌液混合,得到混合菌悬液。
1.3.3 CPS参数对混菌体系中微生物的影响
在细胞孔板中每孔吸取制备的菌悬液600 μL,将细胞孔板放入聚丙烯包装盒中密封包装后,在低温等离子体冷杀菌系统中固定50 Hz放电频率下,设置不同放电电压和处理时间进行杀菌实验。以未杀菌处理为空白对照(CK组),分别考察9个处理组,分别命名为L-6(120 kV,6 min)、L-9(120 kV,9 min)、L-12(120 kV,12 min)、M-6(140 kV,6 min)、M-9(140 kV,9 min)、M-12(140 kV,12 min)、H-6(160 kV,6 min)、H-9(160 kV,9 min)、H-12(160 kV,12 min)对混菌体系中微生物存活率、产膜特性和产气特性的影响。
在上述试验结果的基础上,进一步研究同一处理时间下(9 min),不同电压(0、120 kV、140 kV、160 kV)对于混菌体系整体的微生物生长特性、产酸特性和耐酸特性的影响。
1.3.4 混菌体系中微生物存活率、产膜和产气特性的测定
(1)微生物存活率测定
各实验组处理后静置3 h,将菌悬液置于30 ℃恒温培养箱培养48 h,按照微生物计数[8]方法对样品的菌落总数进行测定,存活率计算公式如下:
式中:N1表示低温等离子体处理后测定的活菌数,lg(CFU/mL);N0表示处理前测定的活菌数,lg(CFU/mL)。
(2)产膜特性实验
无菌条件下,取10 mL无菌萝卜汁于空白培养皿中,将低温等离子体处理后的各菌悬液处理组以1%(V/V)的接种量接种于无菌萝卜汁中,30 ℃恒温培养24 h,观察并记录产膜情况(以产膜面积占整体平板面积的比例计)。
(3)产气特性实验
采用杜氏管发酵法[17]。在试管中加入5 mL萝卜汁,放入杜氏小管,121 ℃灭菌15 min,将低温等离子体处理后的菌液以1%(V/V)的接种量接种于无菌萝卜汁中,30 ℃恒温培养24 h,观察并记录产气情况(以产气体积占整个杜氏管体积计)。
1.3.5 混菌体系中微生物的生理特性检测
(1)生长特性实验
将杀菌处理后的菌悬液以1%(V/V)的接种量接种于无菌萝卜汁中,30 ℃恒温培养33 h。每隔3 h取样,采用酶标仪测定波长600 nm处的吸光度值,以时间(x)为横坐标轴,吸光度值(OD600 nm值)(y)为纵坐标轴,绘制低温等离子体处理后乳酸菌和酵母混菌体系的生长曲线[17]。
(2)产酸特性实验
经杀菌处理后的菌悬液按照1%(V/V)的接种量接种于无菌萝卜汁中,置于30 ℃恒温培养箱培养33 h,每隔3 h取样,用pH计测定低温等离子体处理后的发酵液pH,绘制产酸特性曲线[18]。
(3)耐酸特性实验
经杀菌处理后的菌液按照1%(V/V)的接种量接种于经乳酸调整为pH值3.5的无菌萝卜汁中,30 ℃恒温培养箱培养33 h,每隔3 h取样,采用酶标仪测定波长600 nm处的吸光度值,以时间(x)为横坐标轴,吸光度值(OD600 nm)(y)为纵坐标轴,绘制低温等离子体处理后泡菜源混菌体系在pH为3.5的无菌萝卜汁中的生长曲线[19]。
1.3.6 数据处理
采用SPSS 26.0 对数据进行方差分析、采用Duncan分析法进行多重比较;柱状图和折线图使用Origin 2021绘制。
2 结果与分析
2.1 不同处理对混菌体系微生物存活率的影响
由图1A可知,当电压为120 kV时,L-6组的各微生物存活率均为100%;L-9组所有微生物的存活率开始下降,其中Kazachstania exigua存活率较L-6时的存活率下降了69%;L-12组中P.ethanolidurans的存活率显著低于其他微生物(P<0.05),为21.3%;而L-9、L-12组的L.nagelii较L-6组的存活率分别降低了28.6%、29.21%,表明当在120 kV电压下杀菌时间达到9 min后,增加杀菌时间不能有效增加对L.nagelii的杀菌效果。由图1B可知,当电压为140 kV时,M-6组除了L.nagelii之外,其他乳酸菌的存活率均<40%,而2种酵母菌存活率<20%;M-9组中P.ethanolidurans、L.nagelii和Pichia manshurica较M-6分别降低了28.4%、57.9%和24%,而Kazachstania exigua的存活率略增加了1.38%,表明在此电压下的杀菌时间并不足以有效杀灭该菌。M-12组乳酸菌中L.nagelii的存活率下降率最高,较M-6降低85%,酵母菌中Pichia manshurica存活率下降最高,较M-6组降低了94%。由图1C可知,当电压为160 kV时,H-6、H-9、H-12组中各微生物的存活率分别为0%~15.2%、0%~11.9%和0%~0.63%;在此电压下最低杀菌时间(6 min)时就能将Pichia manshurica完全杀灭,与在泡菜原位体系中杀菌的研究结果一致[15],这可能与原核与真核微生物对低温等离子体的响应程度及机制差异有关[20-22]。当放电电压相同时,各微生物存活率均下降,但对不同微生物的杀菌效果存在差异。当杀菌时间为6 min时,随着电压在120~160 kV范围内增加,5种微生物的存活率范围分别为100%、20%~74.3%、0%~18.5%;当杀菌时间为9 min,随着电压的增加,5种微生物存活率分别从92.7%~30.9%降至11.9%~0%;杀菌时间为12 min,微生物存活率分别从74.5%~21.3%降至0.63%~0%,即时间相同时随着电压的增加微生物存活率逐渐降低,这与HOU X L等[23]的研究结果一致。当杀菌电压为140 kV时,低温等离子体对酵母菌的杀菌效果优于乳酸菌。
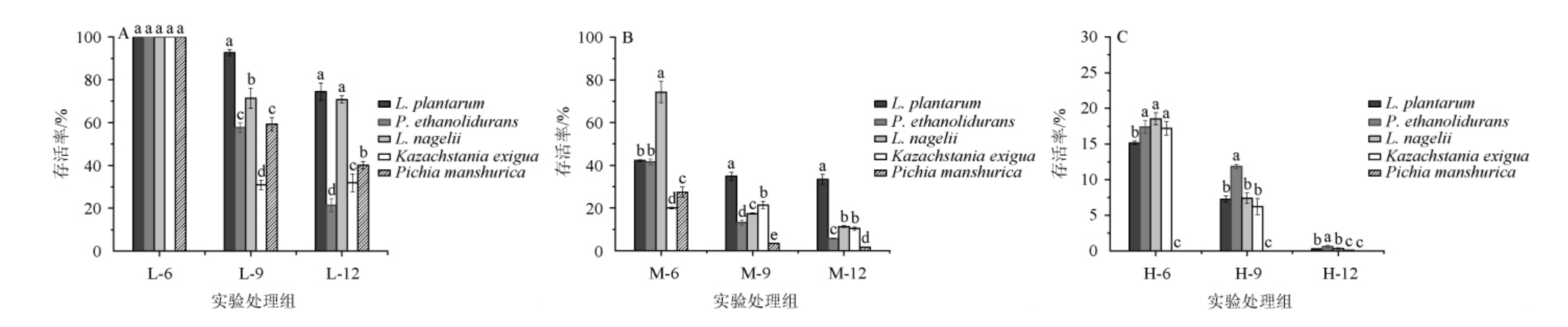
图1 不同处理对乳酸菌和酵母菌存活率的影响
Fig.1 Effects of different treatments on survival rate of lactic acid bacteria and yeasts
不同字母表示处理组间差异显著(P<0.05)。
2.2 不同杀菌参数对混菌体系中产膜及产气特性的影响
泡菜中膜璞腐败主要是由泡菜中一些产膜酵母如毕赤酵母等造成[24],已有研究发现低温等离子体能显著抑制单一产膜酵母及发酵泡菜体系中膜璞的生成[16,20]。由表1可知,CK、L-6、L-9和M-6处理组在培养24 h后完全被生物膜覆盖,处理组H-9和H-12中无生物膜生成。当处理时间≥9 min时,在处理时间相同条件下,放电电压越高,膜璞积累量越低,当放电电压≥140 kV时,在相同电压条件下,处理时间越长,膜璞积累量越低。
表1 不同处理对混菌体系中微生物产膜及产气的影响
Table 1 Effects of different treatments on film production and gas production of microorganisms in mixed microbial system
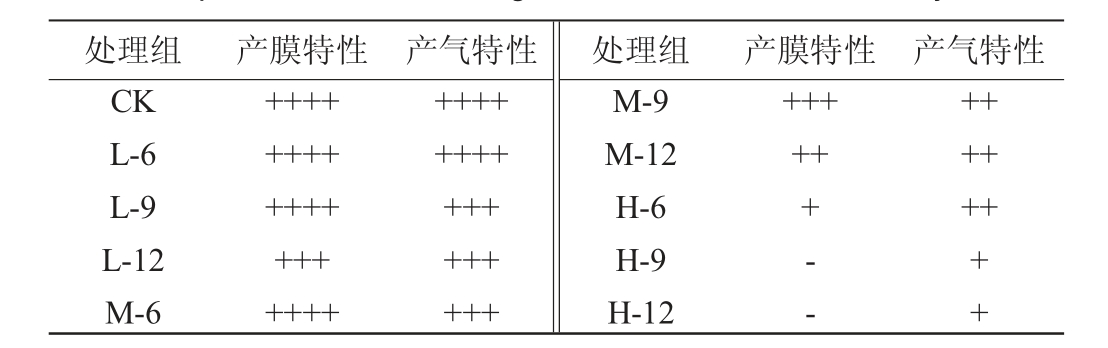
注:产膜特性组“-”表示平板中无膜璞产生;“+”表示产膜面积占平板面积1/4以下;“++”表示产膜面积在1/4~1/2之间;“+++”表示产膜面积在1/2~3/4之间;“++++”表示膜璞完全覆盖平板。产气特性组“+”表示产气体积占杜氏管体积1/4;“++”表示产气体积占杜氏管体积1/2;“+++”表示产气体积占杜氏管体积3/4;“++++”表示产气充满杜氏管体积。
处理组 产膜特性CK L-6 L-9 L-12 M-6+++++++++++++++++++产气特性 处理组 产膜特性 产气特性+++++++++++++++++M-9 M-12 H-6 H-9 H-12++++++- -++++++++
杀菌效果最差的L-6处理组产气情况与CK组一致。当处理时间相同时,随着放电电压的提高,混菌体系中的产气现象减弱。但在相同放电电压条件下,处理时间≥9 min时,如处理组L-9、L-12和M-9、M-12组中混菌体系的产气效果无较大差异,表明产气菌对电压的敏感度更高,而对处理时间的响应程度较低。曾骏[17]在探究传统四川泡菜发酵过程中酵母菌的动态变化规律和发酵性能中发现,Kazachstania exigua和Pichia manshurica都具有产气能力。因此,混菌体系的产气情况与实验处理后这两种微生物的存活率结果较为一致。综合考察混菌体系中的微生物存活率及其产膜产气特性,综合低能耗目标,确定处理时间为9 min,探究不同放电电压对混菌体系中微生物生长特性、产酸和耐酸特性的影响。
2.3 不同放电电压对混菌体系中微生物生长特性的影响
由图2可知,当时间为0~9 h时,在各放电电压下,模拟混菌体系中微生物均处于停滞期,但不同电压下混菌体系进入对数生长期的延滞时间略有差异。放电电压为120 kV时微生物生长进入对数期的时间与对照组几乎一致(9 h)。当放电电压为140 kV时,微生物的生长在一定程度上放缓,在12 h后进入对数期。当放电电压为160 kV时,微生物进入对数期的时间为15 h,较对照组延后了6 h;此时混菌体系在整个生长曲线测定周期内的OD600nm值最低。以上结果表明,140 kV及以上电压的低温等离子处理在一定时间内可以有效减缓泡菜源乳酸菌和酵母混菌体系的生长,与低温等离子体在果蔬保鲜上的应用研究结果一致[27-28]。
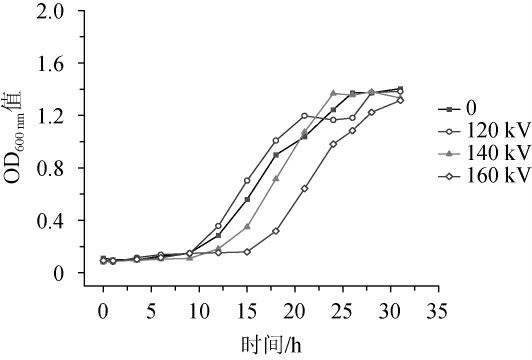
图2 不同放电电压条件下混菌体系中微生物生长曲线
Fig.2 Microbial growth curves of mixed microbial system under different discharge voltages
2.4 不同放电电压对混菌体系中微生物产酸特性的影响
由图3可知,泡菜源微生物混菌体系在同一处理时间(9 min)、不同放电电压下产酸能力整体趋势保持一致。随着处理时间在0~10 h内范围内增加,不同电压处理下混菌体系的pH值呈先增加后下降的趋势;当处理时间>10 h,pH值呈快速下降的趋势,这与发酵体系经低温等离子处理后微生物生长处于迟滞期的结果一致。不同处理组在0 h的pH值较低,这是由于CPS处理后产生的如NOx的产酸分子在培养液中形成HNO2、HNO3的酸化所导致[25];pH值略有增加的原因是,微生物的生物量增加,酸性分子挥发。当发酵时间为10~25 h,160 kV处理组的pH值下降趋势较缓慢;当发酵时间>25 h,pH下降趋于平缓;当发酵时间31 h,pH值最高,为4.12。乳酸菌代谢产生的有机酸是发酵蔬菜重要的呈味物质[26],但随着发酵时间的延长极易使泡菜产品过酸,影响口感品质[27]。因此,放电电压为160 kV,可降低发酵体系中的微生物,且在一定程度上抑制发酵产品的后酸化。
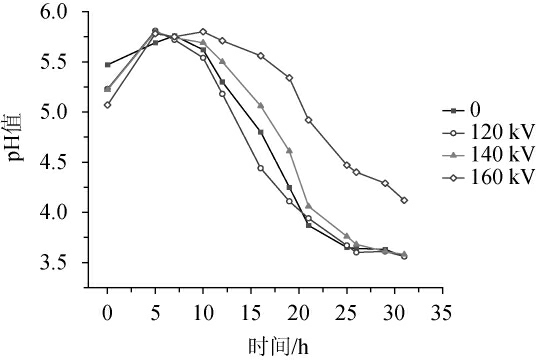
图3 不同放电电压条件下混菌体系的pH值变化
Fig.3 Changes of pH of mixed microbial system under different discharge voltages
2.5 不同放电电压对混菌体系中耐酸特性的影响
在pH为3.5的发酵体系中不同电压条件下混菌体系的OD600 nm值变化见图4。由图4可知,微生物生长趋势一致,在0~12 h内,微生物处于迟滞期;当时间为12~26 h,微生物处于对数期;当时间为29~31 h,微生物处于平稳期,而160 kV电压条件下,微生物达到对数期的时间(15 h)较其他处理处理(12 h)有所滞后。泡菜一般通过冷加工,因此除了保留其热敏性的营养成分外还提供了如乳酸菌等益生菌有关的益生功能[28-30]。此外,酵母菌对于发酵体系的稳定性及泡菜特征风味的形成也起到重要作用[31]。由于成熟泡菜的pH值一般在3.0~4.0之间[32],因此评估经低温等离子处理后微生物的耐酸特性,对保障其功能性微生物活性具有重要作用。以上实验结果表明,低温等离子体处理对于泡菜源乳酸菌和酵母混菌体系在酸性环境中的生长没有明显抑制。
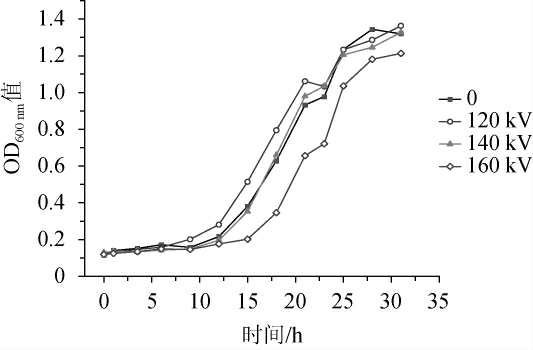
图4 不同放电电压条件下混菌体系的OD600 nm值变化
Fig.4 Changes of OD600 nm value of mixed microbial system under different discharge voltages
3 结论
研究了低温等离子在不同放电电压和杀菌时间下对泡菜源乳酸菌和酵母混菌体系杀菌效果的影响,并对混菌体系中的产膜、产气、产酸和耐酸特性等进行了相应评估。随着电压升高、处理时间的增长,5种微生物的存活率越低。当处理时间≥9 min时能有效抑制混菌体系中的膜璞积累和产气情况。放电电压在160 kV、处理时间9 min时能有效减缓泡菜源乳酸菌和酵母混菌体系的生长,此时混菌体系在发酵31 h时,生物量(OD600 nm值)较其他处理组最低,表明微生物产酸受到抑制从而缓解了发酵后酸化,且混合菌群的耐酸性没有受到影响。研究结果中微生物生长和生理的差异性揭示了低温等离子在提高泡菜贮运品质稳定性和安全性方面的潜力,为低温等离子体在泡菜等酸性发酵体系中的应用奠定基础。
[1] ZHAO N, LAI H M, WANG Y L, et al.Assessment of biogenic amine and nitrite production in low-salt Paocai during fermentation as affected by reused brine and fresh brine[J].Food Biosci,2021,41:100958.
[2]ZHAO N,LAI H M,HE W,et al.Reduction of biogenic amine and nitrite production in low-salt Paocai by controlled package during storage:a study comparing vacuum and aerobic package with conventional salt solution package[J].Food Control,2020,123:107858.
[3] HUANG Y L, GE L H, LAI H M, et al.Seasonal alteration of environmental condition-driven shift in microbiota composition,physicochemical attributes and organic compound profiles in aged Paocai brine during intermittent back-slopping fermentation[J].Food Biosci,2022,50:102111.
[4]ZHAO Y J,WANG Y,LI H Y,et al.Integrating metabolomics and metatranscriptomics to explore the formation pathway of aroma-active volatile phenolics and metabolic profile during industrial radish paocai fermentation[J].Food Res Int,2023,167:112719.
[5]史梅莓,伍亚龙,杨恺,等.四川泡菜中潜在益生性植物乳杆菌的筛选及安全性评价[J].食品工业科技,2022,43(22):165-172.
[6]李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
[7] YANG X Z,HU W Z,JIANG A L, et al.Effect of salt concentration on quality of Chinese northeast sauerkraut fermented by Leuconostoc mesenteroides and Lactobacillus plantarum[J].Food Biosci,2019,30:100412.
[8]葛黎红,李志威,黄玉立,等.包装填充介质对低温等离子体杀菌处理泡萝卜贮藏品质的影响[J].中国酿造,2023,42(2):175-181.
[9]SRUTHI N U,JOSNA K,PANDISELVAM R,et al.Impacts of cold plasma treatment on physicochemical, functional, bioactive, textural, and sensory attributes of food: A comprehensive review[J].Food Chem,2021,368:130809.
[10]张关涛,张东杰,李娟,等.低温等离子体技术在食品杀菌中应用的研究进展[J].食品工业科技,2022,43(12):417-426.
[11]黄明明.低温等离子体对金黄色葡萄球菌和鼠伤寒沙门氏菌杀菌机理及应用研究[D].南京:南京农业大学,2019.
[12] KIM B,YUN H,JUNG S,et al.Effect of atmospheric pressure plasma on inactivation of pathogens inoculated onto bacon using two different gas compositions[J].Food Microbiol,2011,28(1):9-13.
[13]JAHID I K,HAN N,HA S D.Inactivation kinetics of cold oxygen plasma depend on incubation conditions of Aeromonas hydrophila biofilm on lettuce[J].Food Res Int,2014,55:181-189.
[14] CRITZER F J, KELLY-WINTENBERG K, SOUTH S L, et al.Atmospheric plasma inactivation of foodborne pathogens on fresh produce surfaces[J].J Food Protect,2007,70(10):2290-2296.
[15]ZHAO N,GE L H,HUANG Y L,et al.Impact of cold plasma processing on quality parameters of packaged fermented vegetable(radish paocai)in comparison with pasteurization processing: Insight into safety and storage stability of products[J].Innov Food Sci Emerg,2020,60:102300.
[16]侯新磊,赵楠,葛黎红,等.低温等离子体对低盐泡菜生花腐败的抑制及贮藏期品质的影响[J].食品科学,2022,43(21):282-290.
[17]曾骏.传统四川泡菜发酵过程中酵母菌的动态变化规律及发酵性能研究[D].雅安:四川农业大学,2013.
[18]张文娟,陈安特,韩宇琴,等.酿酒酵母对萝卜泡菜发酵的影响[J].食品与发酵工业,2017,43(8):134-137.
[19]罗强,李幸洋,陈炼红,等.传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析[J].食品科学,2021,42(2):158-163.
[20]MOREAU M,ORANGE N,FEUILLOLEY M G J.Non-thermal plasma technologies: New tools for bio-decontamination[J].Biotechnol Adv,2008,26(6):610-617.
[21]XIANG Q S,LIU X F,LI J G,et al.Effects of dielectric barrier discharge plasma on the inactivation of Zygosaccharomyces rouxii and quality of apple juice[J].Food Chem,2018,254:201-207.
[22]王英.低温等离子体灭活苹果汁中耐高渗酵母的研究[D].杨凌:西北农林科技大学,2019.
[23]HOU X L,WANG J,MEI Y,et al.Antibiofilm mechanism of dielectric barrier discharge cold plasma against Pichia manshurica[J].Innov Food Sci Emerg,2023,85:103340.
[24]敖晓琳,蔡义民,夏姣,等.引起泡菜“生花”腐败微生物的分离鉴定[J].食品科学,2013,34(21):204-208.
[25]STOFFELS E,SAKIYAMA Y,GRAVES D B.Cold atmospheric plasma:Charged species and their interactions with cells and tissues[J].IEEE T Plasma Sci,2008,36(4):1441-1457.
[26]林龙镇,邹卫玲,李安章,等.产酸、耐酸乳酸菌的分离鉴定及益生特性[J].华南农业大学学报,2018,39(2):95-102.
[27]史巧,刘毕琴,汤回花,等.发酵蔬菜菌种应用及菌群调控研究进展[J].食品与发酵工业,2021,47(5):273-281.
[28]YANG Y L,FAN Y,LI T,et al.Microbial composition and correlation between microbiota and quality-related physiochemical characteristics in chongqing radish paocai[J].Food Chem,2022,369:130897.
[29]CAO J L,YANG J X,HOU Q C,et al.Assessment of bacterial profiles in aged,home-made Sichuan paocai brine with varying titratable acidity by PacBio SMRT sequencing technology[J].Food Control,2017,78:14-23.
[30] BERDING K,BASTIAANSSEN T,MOLONEY G M, et al.Feed your microbes to deal with stress:a psychobiotic diet impacts microbial stability and perceived stress in a healthy adult population[J].Mol Psychiatr,2023,28(2):601-610.
[31]袁海珊,刘功良,白卫东,等.产酯酵母在发酵食品中的应用研究进展[J].中国酿造,2023,42(1):15-20.
[32]段先兵,杨维占,钟叶芳.泡菜中硝酸盐、亚硝酸盐含量和pH值变化规律及影响因素探究[J].食品安全导刊,2019(3):184-186.