中华网柄牛肝菌(Retiboletus sinensis)是一种可食用的外生菌根真菌,属于牛肝菌科(Boletaceae)、网柄牛肝菌属(Retiboletus)。该属仅有7种1变种,其中6种分布在我国东南地区[1],能够与壳斗科植物形成外生菌根[2]。外生菌根共生体的生物学功能是将真菌从枯枝落叶层中或者从固化的矿物中吸收的矿质营养物质,如氮(N)和磷(P),交换为植物来源的碳水化合物[3]。这样,外生菌根植物就能够获得更多的氮和磷,从而提高其生长和竞争力[4-6]。此外,一些外生菌根真菌还能够产生植物激素,如生长素吲哚-3-乙酸(indole-3-acetic acid,IAA)和乙烯,从而影响共生植物根系的形态发育[7-8]。如在白杨和杨树与双色蜡蘑(Laccaria bicolor)的菌根共生体中,真菌产生的IAA和乙烯抑制了主根的生长,而促进了侧根的形成[7]。新侧根的形成又能够增加菌根的数量和分布[8]。
前期研究发现中华网柄牛肝菌在人工纯培养条件下能够诱导出子实体[9],具有实现人工栽培的可能性,并且其与共生植物形成的菌根共生体也具有重要的生态意义。然而,中华网柄牛肝菌作为一种外生菌根真菌,其液体发酵培养面临着诸多困难,如培养基成分、培养周期、菌丝体退化等。因此,本研究旨在通过响应面法优化中华网柄牛肝菌的液体发酵培养基,并探究其对共生黑松(Pinus thunbergii)植物内源激素含量的影响,为实现中华网柄牛肝菌的人工栽培和促进其与共生植物形成高效菌根共生体提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
中华网柄牛肝菌(Retiboletus sinensis):分离自山东省招远市小圆庙林场野外采集得到的子实体,保藏于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC)),编号为CGMCC NO.23887。
1.1.2 试剂
葡萄糖(分析纯):国药集团化学试剂有限公司;酵母膏、酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限公司;硫酸铵、硝酸钾、β-环糊精、K2HPO4、MgSO4、CaCl2·2H2O、NaCl、抗坏血酸、硫胺素、蔗糖(均为分析纯):国药集团化学试剂有限公司;酪蛋白水解物:上海士锋生物科技有限公司。
1.1.3 培养基
Modified Melin-Norkrans(MMN)培养基[10]:葡萄糖10 g/L,麦芽浸粉3 g/L,维生素B1 0.000 1 g/L,CaCl2·2H2O 0.05 g/L,NaCl 0.025 g/L,(NH4)2HPO4 0.25 g/L,MgSO4·7H2O 0.15 g/L,FeCl3 0.012 g/L,KH2PO4 0.5 g/L。
改良马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[11]:马铃薯200 g/L,葡萄糖20 g/L,蛋白胨5 g/L,K2HPO4 0.8 g/L,MgSO4 0.6 g/L,CaCl2·2H2O 0.05 g/L,NaCl 0.025 g/L,β-环糊精8 g/L,抗坏血酸0.001 5 g/L,琼脂20 g/L。液体培养基中不添加琼脂。
麦芽汁培养基[12]:45 g/L麦芽磨碎煮汁。
胡萝卜培养基[12]:胡萝卜200 g/L,葡萄糖20 g/L。
葡萄糖蛋白胨玉米浆(glucose peptone corn,GPC)培养基[12]:葡萄糖20 g/L,蛋白胨5 g/L,玉米浆10 g/L。
葡萄糖蛋白胨酵母膏(glucose peptone yeast extract paste,GPY)培养基[12]:葡萄糖20 g/L,蛋白胨5 g/L,酵母膏10 g/L。
Modified Norkrans'C(MNC)培养基[13]:KH2PO4 1 g/L,MgSO4·7H2O 0.5 g/L,ZnSO4 2 g/L,酒石酸铵0.5 g/L,柠檬酸铁10 g/L,硫胺素50 μg/L,酪蛋白水解物0.23 g/L,酵母浸粉0.5 g/L,葡萄糖10 g/L。
Hyponex-Yeast-Glucose(HYG)培 养 基[13]:Hyponex 1.5 g/L,酵母浸提物1 g/L,葡萄糖5 g/L,蔗糖5 g/L。
所有培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LDZX-50KB注立式压力蒸汽灭菌器:上海申安医疗器械厂;DGX-9043B-1鼓风干燥箱:上海福玛实验设备有限公司;RZH-380A智能人工气候箱:杭州汇尔仪器设备有限公司;WY-250B全温型恒温培养摇床:天津市泰斯特仪器有限公司;SW-CJ-IBU洁净工作台:苏州安泰空气技术有限公司;C21-HT2115HM多功能电磁炉:广东美的生活电器制造有限公司;PRACTUM213-1CN电子天平:赛多丽斯科学仪器(北京)有限公司;1100高效液相色谱仪:安捷伦科技有限公司。
1.3 方法
1.3.1 基础培养基的筛选
将中华网柄牛肝菌菌种于改良PDA培养基平板中,22 ℃暗培养30 d,备用。使用8 mm打孔器在长好中华网柄牛肝菌菌丝体的固体培养基中打孔,取大小一致的菌种块分别接种于MMN培养基、改良PDA液体培养基、麦芽汁培养基、胡萝卜培养基、GPC培养基、GPY培养基、MNC培养基、HYG培养基中。接种量为8块菌种块,22 ℃、150 r/min条件下暗培养20 d,培养完成后测定各培养基中牛肝菌菌丝体干质量,筛选优良的基础培养基。
1.3.2 中华网柄牛肝菌液体发酵培养基优化试验
(1)Plackett-Burman试验设计
在优良基础培养基基础上,以中华网柄牛肝菌菌丝干质量(Y)为考察指标,以磷酸二氢钾添加量(X1)、硫酸镁添加量(X2)、酒石酸铵添加量(X3)、硫酸锌添加量(X4)、柠檬酸铁添加量(X5)、硫胺素添加量(X6)、酪蛋白水解物添加量(X7)、酵母浸粉添加量(X8)、葡萄糖添加量(X9)共计9个因素进行Plackett-Burman试验,筛选出对菌丝体干质量影响显著的因素,试验因素与水平见表1。
表1 Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman tests
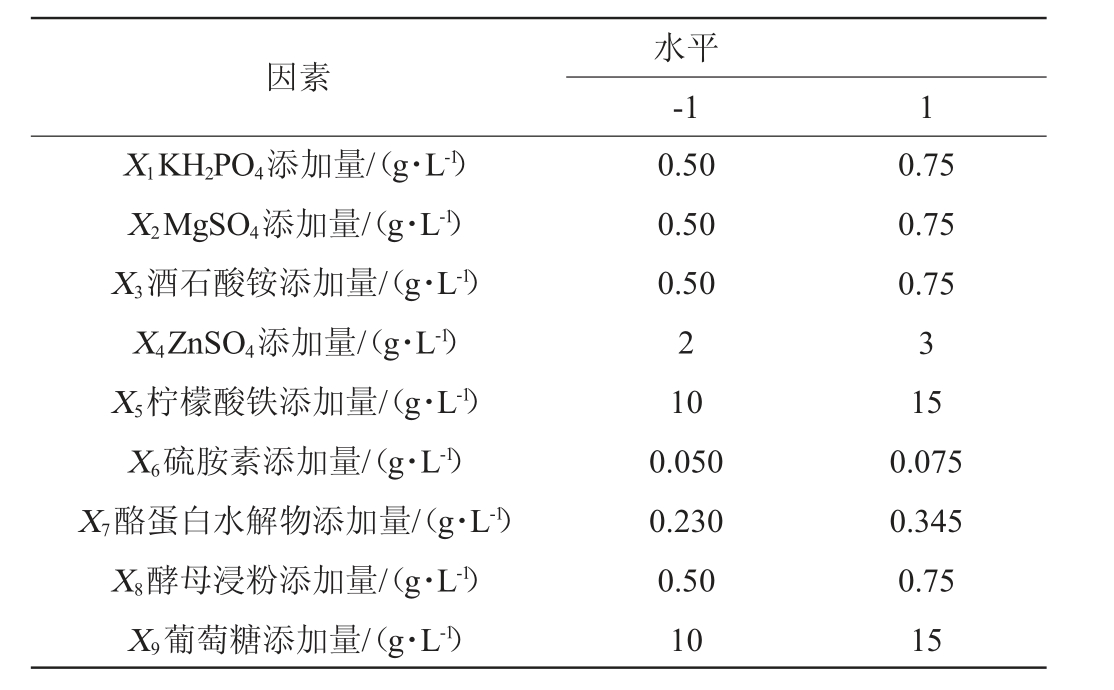
因素X1KH2PO4添加量/(g·L-1)X2MgSO4添加量/(g·L-1)X3酒石酸铵添加量/(g·L-1)X4ZnSO4添加量/(g·L-1)X5柠檬酸铁添加量/(g·L-1)X6硫胺素添加量/(g·L-1)X7酪蛋白水解物添加量/(g·L-1)X8酵母浸粉添加量/(g·L-1)X9葡萄糖添加量/(g·L-1)水平-1 1 0.50 0.50 0.50 2 10 0.050 0.230 0.50 10 0.75 0.75 0.75 3 15 0.075 0.345 0.75 15
(2)最陡爬坡试验
根据Plackett-Burman试验结果中显著因素的效应值确定步长及爬坡方向,以中华网柄牛肝菌菌丝体干质量为评价指标,筛选各因素的最适添加量。
(3)响应面试验
在Plackett-Burman试验和最陡爬坡试验的基础上,以中华网柄牛肝菌菌丝体干质量为响应值设计响应面试验,以求得中华网柄牛肝菌发酵的最佳液体培养基。
1.3.3 菌丝体干质量的测定
中华网柄牛肝菌液体培养20 d后,使用4层纱布过滤得到菌丝体,使用纯水反复冲洗过滤5次。将冲洗干净的菌丝体放于称量纸中,置于鼓风干燥箱中干燥,烘干至恒质量时取出称质量,即为菌丝体的干质量。
1.3.4 黑松菌根的合成
使用5%的次氯酸钠溶液浸泡黑松种子5 min,用无菌水冲洗5次,置于无菌蛭石中,在温度25 ℃、相对空气湿度60%条件下进行发芽培养,2周后在无菌环境中将发芽的无菌黑松幼苗接入到栽培基质(草炭土∶蛭石=3∶1)中,接入中华网柄牛肝菌液体菌种10 mL/瓶,菌丝球与实生苗根系相隔5 mm,瓶口使用封口膜(过滤口径4 μm)密封。移置温度25 ℃、空气相对湿度60%、光照周期16 h/d的培养室中培养60 d。将长有菌根的黑松苗根冲洗干净,置于体式镜下进行观察。取出一条菌根进行徒手切片,进行显微观察。
1.3.5 激素含量的测定
样品预处理:将无菌黑松根苗及黑松菌根苗的根茎叶置于流水中冲洗30 min,后用纯净水冲洗3次并清理干净植物根系残留的杂质。使用分析天平准确称取无菌黑松根苗及黑松菌根苗的根、茎、叶各2 g,通过液氮冷却后充分研磨,加入10 mL在3 ℃条件下保存的体积分数80%甲醇水溶液,置于3 ℃冰箱中冷藏8 h。
提取:将预处理后的样品置于低温离心机中,3 ℃、9 000 r/min离心10 min后,吸取上清液装入新离心管中,并置于3 ℃冰箱中冷藏。继续加入5 mL体积分数80%甲醇水溶液到剩余的沉淀物中,继续浸提4 h后放入低温离心机中,3 ℃、9 000 r/min离心10 min,合并两次离心的上清液。使用氮气吹干仪去除上清液中的甲醇后,将剩余液体和5 mL石油醚加入到分液漏斗中萃取脱色3次。使用1 mol/L柠檬酸调节溶液pH至3,加入乙酸乙酯萃取3次,合并3次萃取的有机相。使用氮气吹干仪将乙酸乙酯吹干,加入1 mL甲醇溶解,并使用0.22 μm针头式有机过滤器过滤后待测[11]。
测定:采用HPLC法测定植物玉米素(zeatin,ZT)、生长素吲哚-3-乙酸(IAA)、赤霉素(gibberellin acid,GA)和脱落酸(abscisic acid,ABA)4种激素在黑松菌根苗及无菌根苗根、茎、叶中的含量[14]。HPLC条件为ZORBAX SB-C18毛细管色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇0.06%甲酸水溶液,梯度洗脱(0~15 min,48.7%甲醇;15~20 min,50.7%甲醇;20~30 min,50.8%甲醇),流速1.0 mL/min,柱温25 ℃,进样量20 μL,检测波长260 nm(ZT、IAA、ABA)、220 nm(GA)。
1.3.6 数据处理与分析
每个试验重复3次,结果用“平均值±标准差”表示。采用Prism 9.0与Design expert 10.0进行数据分析与处理。
2 结果与分析
2.1 最适培养基的筛选
不同培养基对中华网柄牛肝菌菌丝体干质量的影响见图1。由图1可知,中华网柄牛肝菌除了在胡萝卜培养基中不能正常生长外,在其他6种培养基中均可正常生长,其在MNC培养基中菌丝体干质量最高,达到2.55 g/L;其次为麦芽汁培养基和改良PDA液体培养基,菌丝体干质量分别为2.46 g/L和2.12 g/L。其余4种培养基的培养效果差异不显著(P>0.05)。因此,确定中华网柄牛肝菌的最优培养基为MNC培养基。
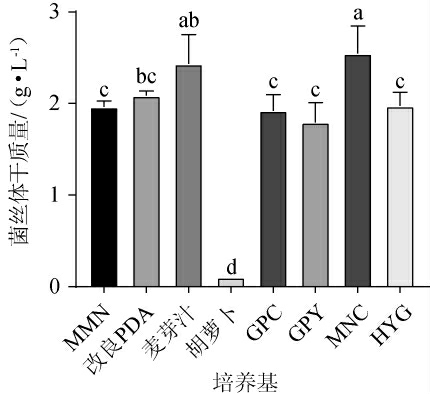
图1 中华网柄牛肝菌基础培养基的筛选结果
Fig.1 Screening results of Retiboletus sinensis basic medium
不同小写字母表示差异显著(P<0.05)。
2.2 中华网柄牛肝菌液体发酵培养基的优化
2.2.1 Plackett-Burman试验结果
采用Design-Expert 10.0软件对表2结果进行多元一次回归拟合,得到一次回归方程为:Y=2.74-0.0142X1-0.0075X2+0.005 8X3+0.007 5X4-0.025X5-0.000 8X6+0.037 5X7+0.034 2X8+0.100 8X9。
表2 Plackett-Burman试验设计及结果
Table 2 Design and results of Plackett-Burman tests
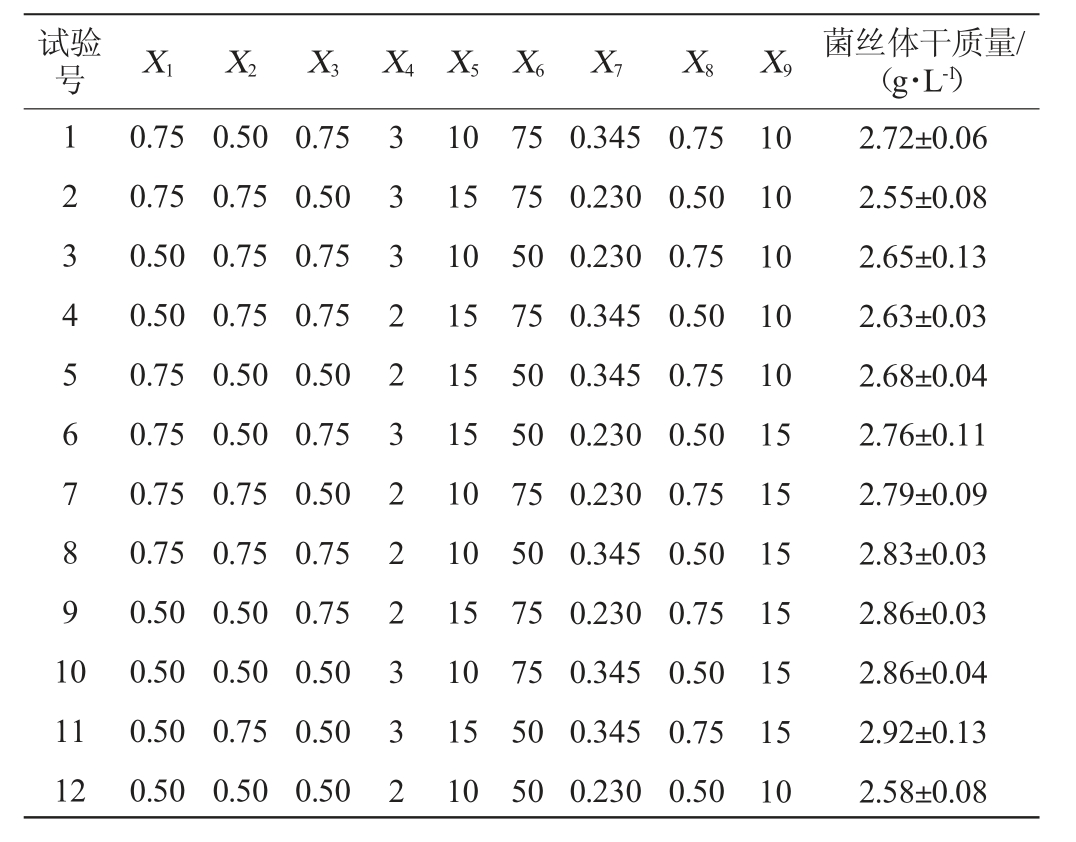
试验号 X1 X2 X3 X4 X5 X6 X7 X8 X9 菌丝体干质量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 11 12 0.75 0.75 0.50 0.50 0.75 0.75 0.75 0.75 0.50 0.50 0.50 0.50 0.50 0.75 0.75 0.75 0.50 0.50 0.75 0.75 0.50 0.50 0.75 0.50 0.75 0.50 0.75 0.75 0.50 0.75 0.50 0.75 0.75 0.50 0.50 0.50 3 3 3 2 2 3 2 2 2 3 3 2 10 15 10 15 15 15 10 10 15 10 15 10 75 75 50 75 50 50 75 50 75 75 50 50 0.345 0.230 0.230 0.345 0.345 0.230 0.230 0.345 0.230 0.345 0.345 0.230 0.75 0.50 0.75 0.50 0.75 0.50 0.75 0.50 0.75 0.50 0.75 0.50 10 10 10 10 10 15 15 15 15 15 15 10 2.72±0.06 2.55±0.08 2.65±0.13 2.63±0.03 2.68±0.04 2.76±0.11 2.79±0.09 2.83±0.03 2.86±0.03 2.86±0.04 2.92±0.13 2.58±0.08
由表3可知,模型显著(P<0.05),具有统计学意义。决定系数(R2)=0.995,表明拟合良好,12组试验中菌丝体干质量的变化的99.5%是由所选9个因素造成的。由表3亦可知,酪蛋白水解物添加量(X7)、酵母浸粉添加量(X8)、葡萄糖添加量(X9)对中华网柄牛肝菌菌丝体干质量的影响显著(P<0.05),且其效应值为正值,说明酪蛋白水解物、酵母浸粉、葡萄糖添加量对菌丝体干质量的影响为正效应,以此3个因素进行最陡爬坡试验并根据其效应值确定爬坡方向。其他不显著的因素根据其效应的正负,分别选择高水平或低水平添加量进行添加,即KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,ZnSO4 3 g/L,酒石酸铵0.75 g/L,柠檬酸铁10 g/L,硫胺素50 μg/L。
表3 Plackett-Burman试验回归模型方差分析
Table 3 Regression model variance analysis of Plackett-Burman tests
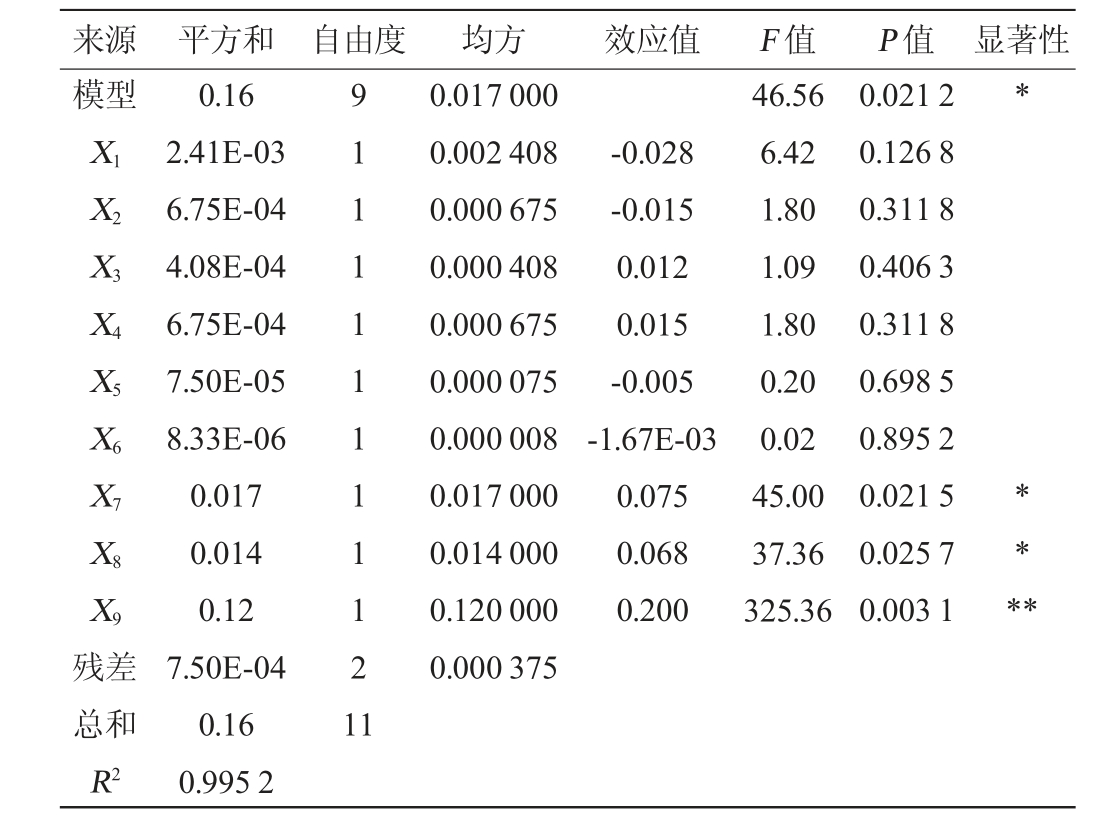
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。下同。
来源 平方和 自由度 均方 效应值 F 值模型P 值 显著性X1 X2 X3 X4 X5 X6 X7 X8 X9-0.028-0.015 0.012 0.015-0.005-1.67E-03 0.075 0.068 0.200 46.56 6.42 1.80 1.09 1.80 0.20 0.02 45.00 37.36 325.36 0.021 2 0.126 8 0.311 8 0.406 3 0.311 8 0.698 5 0.895 2 0.021 5 0.025 7 0.003 1*****残差总和9 1 1 1 1 1 1 1 1 1 2 1 1 0.017 000 0.002 408 0.000 675 0.000 408 0.000 675 0.000 075 0.000 008 0.017 000 0.014 000 0.120 000 0.000 375 R2 0.16 2.41E-03 6.75E-04 4.08E-04 6.75E-04 7.50E-05 8.33E-06 0.017 0.014 0.12 7.50E-04 0.16 0.995 2
2.2.2 最陡爬坡试验
根据Plackett-Burman试验结果设计最陡爬坡试验,试验设计及结果见表4。
表4 最陡爬坡试验设计及结果
Table 4 Design and results of the steepest ascent
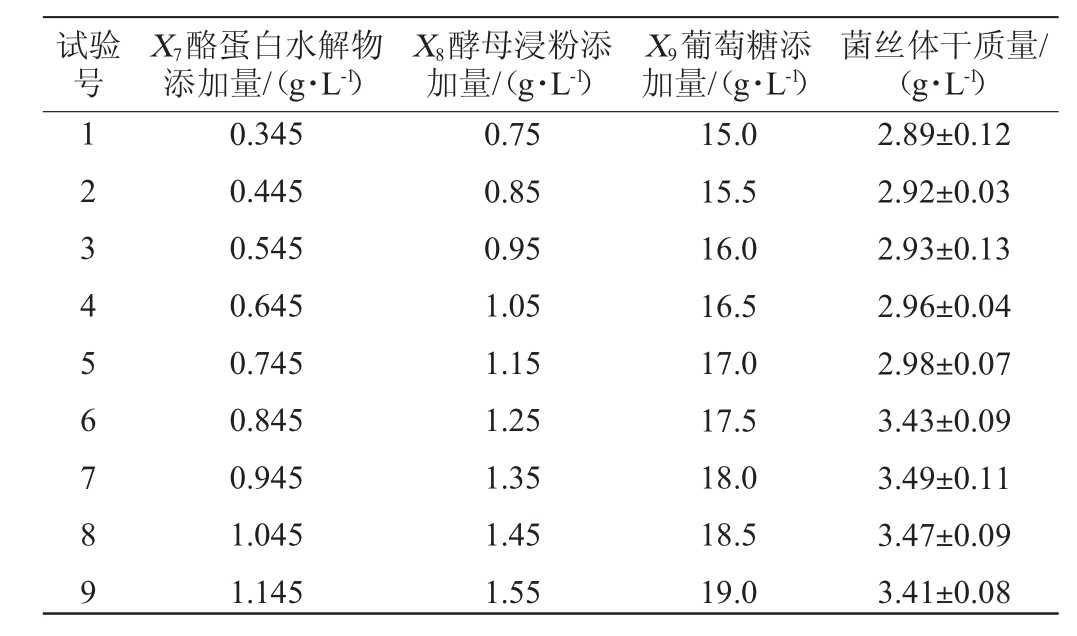
试验号X7酪蛋白水解物添加量/(g·L-1)X8酵母浸粉添加量/(g·L-1)X9葡萄糖添加量/(g·L-1)菌丝体干质量/(g·L-1)1 2 3 4 5 6 7 8 9 0.345 0.445 0.545 0.645 0.745 0.845 0.945 1.045 1.145 0.75 0.85 0.95 1.05 1.15 1.25 1.35 1.45 1.55 15.0 15.5 16.0 16.5 17.0 17.5 18.0 18.5 19.0 2.89±0.12 2.92±0.03 2.93±0.13 2.96±0.04 2.98±0.07 3.43±0.09 3.49±0.11 3.47±0.09 3.41±0.08
由表4可知,在第7组试验条件下,即酪蛋白水解物添加量0.945 g/L、酵母浸粉添加量1.35 g/L、葡萄糖添加量18 g/L时,中华网柄牛肝菌菌丝体干质量达到最大值,为3.49 g/L,因此以第7组试验因素水平作为响应面试验的中心水平。
2.2.3 响应面优化试验
以中华网柄牛肝菌的菌丝体干质量为响应值(Y),以酪蛋白水解物添加量(A)、酵母浸粉添加量(B)及葡萄糖添加量(C)为考察因素,采用Design-Expert10.0软件设计响应面试验,试验设计及结果见表5,方差分析见表6。
表5 响应面试验设计及结果
Table 5 Design and results of response surface tests
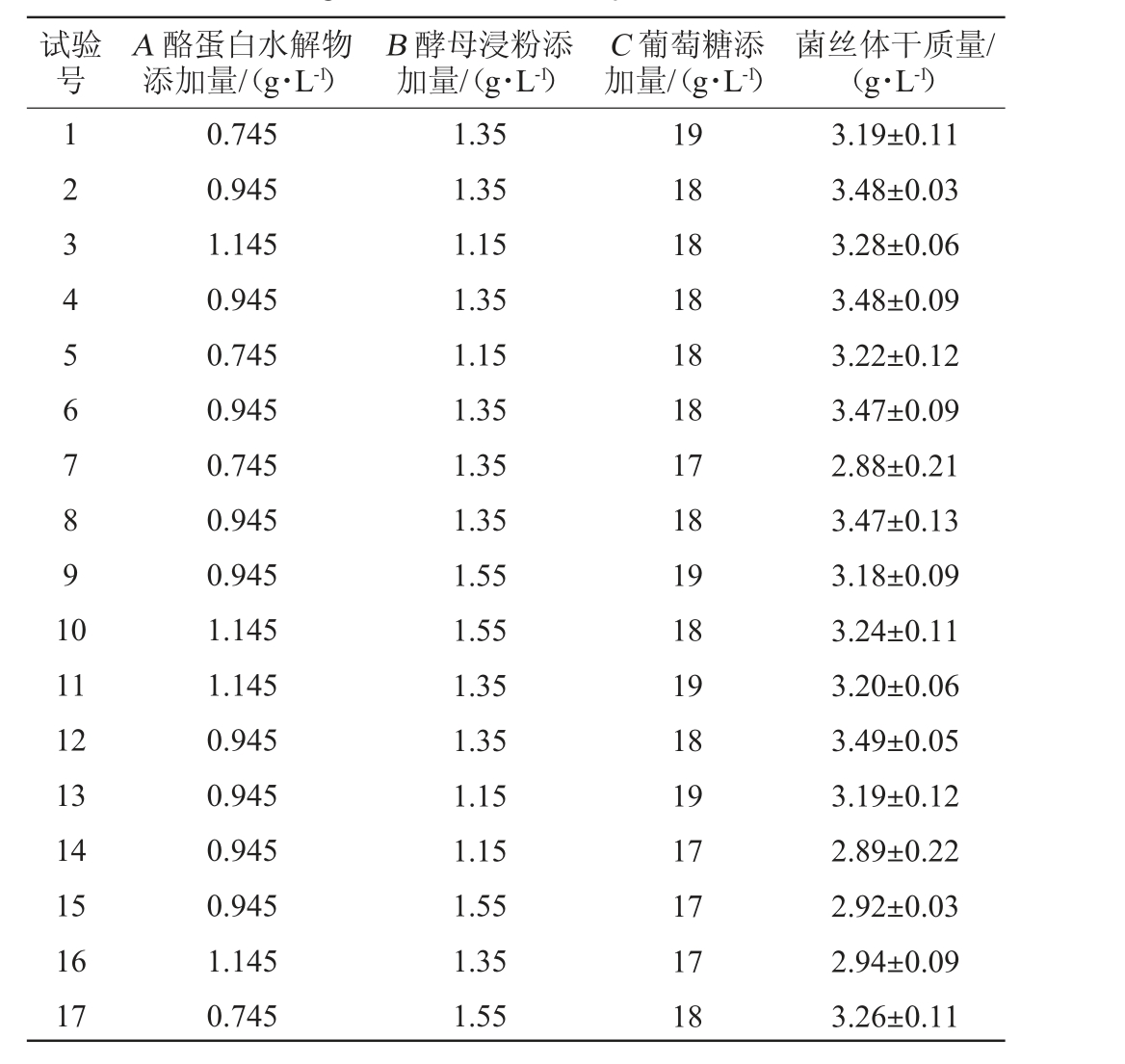
试验号A 酪蛋白水解物添加量/(g·L-1)B 酵母浸粉添加量/(g·L-1)C 葡萄糖添加量/(g·L-1)菌丝体干质量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 0.745 0.945 1.145 0.945 0.745 0.945 0.745 0.945 0.945 1.145 1.145 0.945 0.945 0.945 0.945 1.145 0.745 1.35 1.35 1.15 1.35 1.15 1.35 1.35 1.35 1.55 1.55 1.35 1.35 1.15 1.15 1.55 1.35 1.55 19 18 18 18 18 18 17 18 19 18 19 18 19 17 17 17 18 3.19±0.11 3.48±0.03 3.28±0.06 3.48±0.09 3.22±0.12 3.47±0.09 2.88±0.21 3.47±0.13 3.18±0.09 3.24±0.11 3.20±0.06 3.49±0.05 3.19±0.12 2.89±0.22 2.92±0.03 2.94±0.09 3.26±0.11
表6 回归模型方差分析
Table 6 Variance analysis of regression model
变异来源 平方和 自由度 均方和 F 值 P 值 显著性模型A B C A B********AC BC A2 B2 C2残差失拟项纯误差总和7.35E-01 1.51E-03 5.00E-05 1.60E-01 1.60E-03 6.25E-04 4.00E-04 5.12E-02 5.84E-02 4.18E-01 4.55E-04 1.75E-04 2.80E-04 7.35E-01 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.081 7 0.001 5 0.000 0 0.159 6 0.001 6 0.000 6 0.000 4 0.051 2 0.058 4 0.418 5 0.000 1 0.000 1 0.000 1 1 256.155 4 23.269 2 0.769 2 2 455.576 9 24.615 4 9.615 4 6.153 8 787.372 5 898.141 7 6 437.736 8<0.000 1 0.001 9 0.409 5<0.000 1 0.001 6 0.017 3 0.042 2<0.000 1<0.000 1<0.000 1********0.833 3 0.541 3不显著
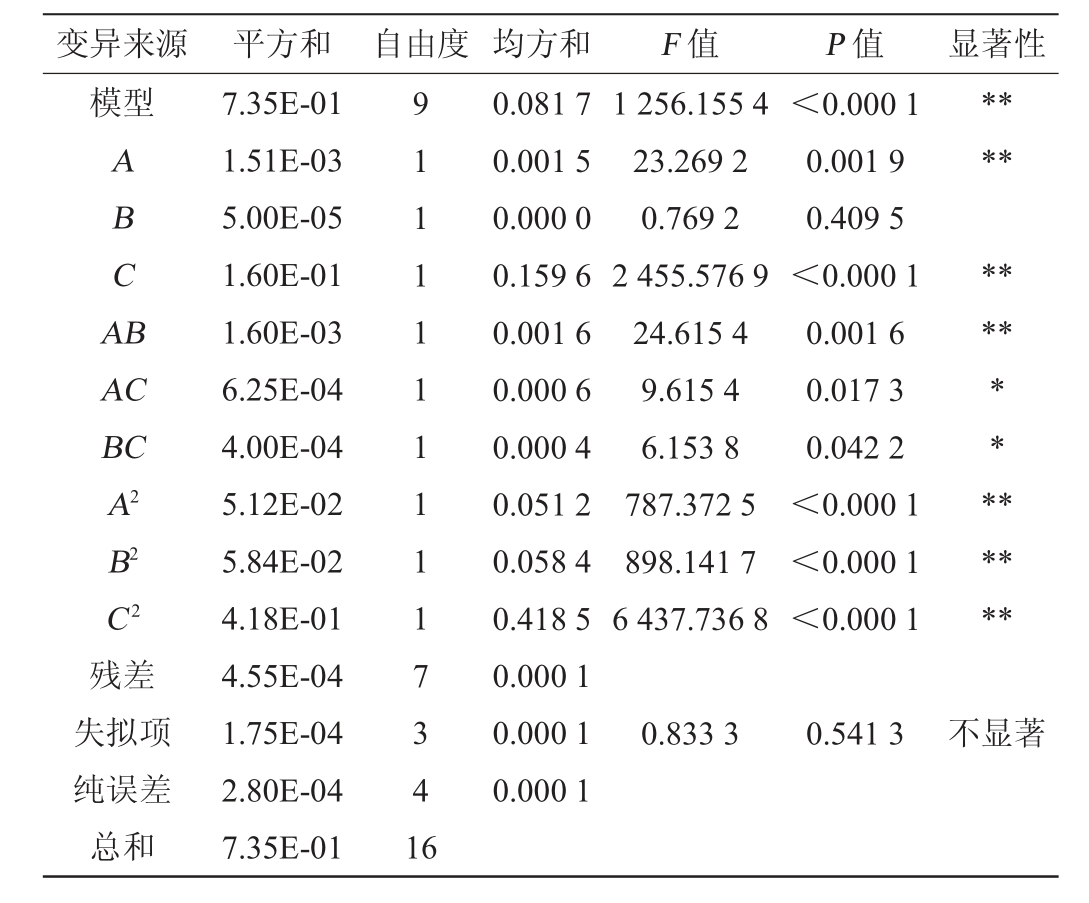
采用Design-Expert10.0软件对表5试验结果进行多元二次回归拟合分析,得到回归方程:Y=3.48+0.013 8A+0.002 5B+0.141 3C-0.02AB-0.012 5AC-0.01BC-0.110 3A2-0.117 8B2-0.315 2C2。
由表6可知,模型P<0.01,极显著,失拟项P>0.05,不显著,说明回归模型拟合真是水平,选择合理[15-16]。决定系数R2为0.999 4,调整决定系R2adj为0.976 2,表明影响菌丝体干物质积累影响有99.94%是由此3个因素引起的,回归方程拟合程度高[17]。由表6亦可知,一次项A、C、交互项AB及二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AC、BC对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。根据F值的大小可知,3个因素对中华网柄牛肝菌菌丝体干质量的影响顺序为葡萄糖添加量>酪蛋白水解物添加量>酵母浸粉添加量。各因素间交互作用对中华网柄牛肝菌菌丝体干质量影响的响应面及等高线见图2。
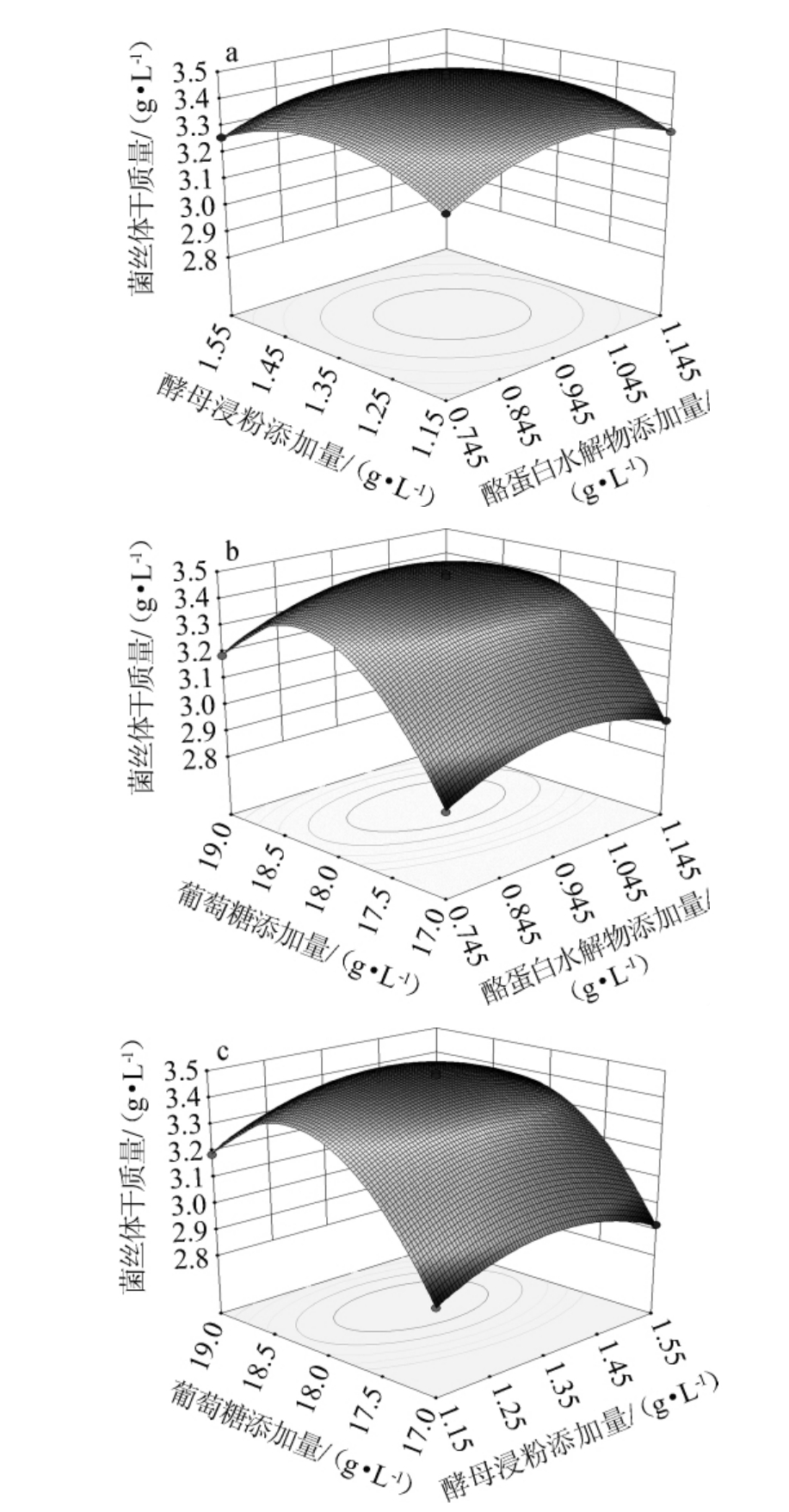
图2 各因素间交互作用对中华网柄牛肝菌菌丝体干质量影响的响应面及等高线图
Fig.2 Response surface plots and contour lines of effects of interaction between various factors on dry mass of mycelium of Retiboletus sinensis
由图2可知,各响应曲面呈向上的凸面,说明中华网柄牛肝菌菌丝体干质量存在最大值;等高线为椭圆形,说明各因素间的交互作用对中华网柄牛肝菌菌丝干物质积累的影响显著,这与方差分析结果一致。
采用Design-Expert 10.0软件对多元二次回归方程进行求解,得到最优液体发酵培养基为:葡萄糖添加量18.2 g/L,酪蛋白水解物添加量0.99 g/L,酵母浸粉添加量1.35 g/L,在条件下培养20 d,菌丝体干质量理论值最高,达到3.49 g/L。在此条件下进行5次重复验证试验,得到菌丝体干物质量为(3.43±0.11)g/L,与理论值基本一致,说明该模型有效,可以较好地预测中华网柄牛肝菌的菌丝体生物量。
2.3 菌根合成及激素含量的测定
2.3.1 黑松菌根形态
黑松菌根的形态见图3。由图3可知,中华网柄牛肝菌与黑松结合形成的菌根为二叉分枝结构,并且具有少量未分枝的棒状结构,菌根没有明显的菌丝套,但是具有明显的哈氏网,分布在根系的内皮层及外皮层中,符合裸子植物外生菌根的特征。
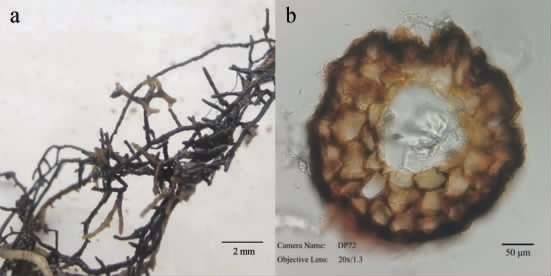
图3 黑松菌根苗根部多级二叉分枝结构(a)及横切片(b)
Fig.3 Multiple-level diehotomous branching structure (a) and horizontal section (b) in root of Pinus thunbergii mycorrhizal seedlings
2.3.2 激素含量的测定
黑松接种中华网柄牛肝菌后,黑松有菌根及无菌根苗的激素含量及根、茎、叶中各部位激素含量见图4~图5。
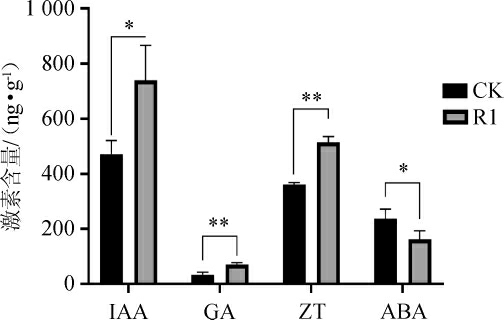
图4 黑松菌根苗中激素含量的测定结果
Fig.4 Determination results of hormone contents of Pinus thunbergii mycorrhizal seedlings
CK:无菌黑松根苗;R1:中华网柄牛肝菌黑松根苗。下同。
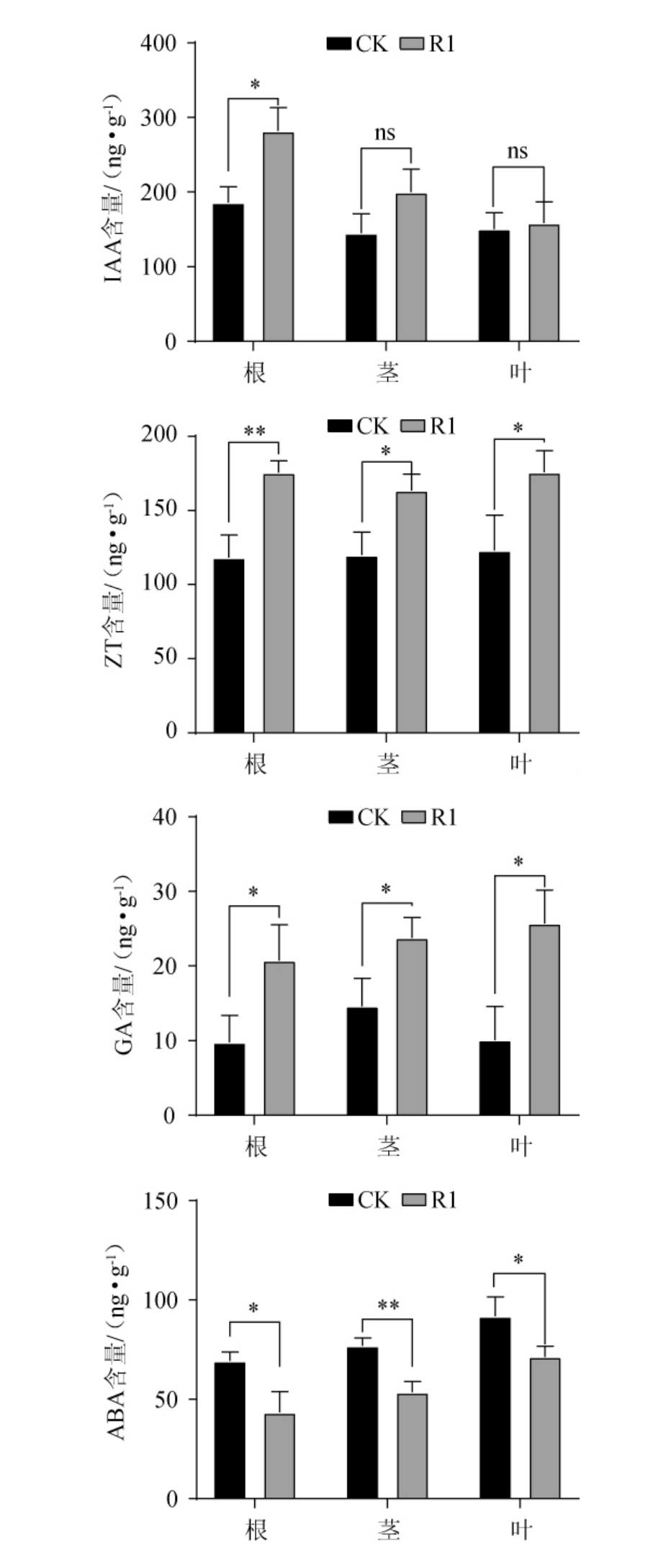
图5 黑松菌根苗根、茎、叶中激素含量的测定结果
Fig.5 Determination results of hormone contents in roots, stems and leaves of Pinus thunbergii mycorrhizal seedlings
由图4~5可知,接种中华网柄牛肝菌后,黑松菌根苗(R1)中IAA、ZT及GA含量较无菌根苗(CK)分别提高33.0%、42.5%、102.0%,ABA含量降低29.0%。黑松菌根苗(R1)根、茎、叶中的IAA、ZT、GA含量较无菌根苗(CK)升高,ABA含量降低。与未接种的黑松(CK)相比,黑松菌根苗(R1)根、茎、叶中的IAA含量分别提高51.6%、37.9%、5.3%。IAA的主要成分是吲哚乙酸,其可以使植物生长的更加强壮,增强植物根系的发育[18-19]。黑松菌根苗(R1)根、茎、叶中的ZT含量分别提高48.4%、36.4%、42.7%。ZT可以调控植物气孔的开合,能够控制光合作用速率,本研究中经过接种的植物根、茎、叶中的ZT含量得到不同程度的提高,真菌的侵入影响到了其共生体内的ZT含量,从而影响到了光合作用相关有机物的合成[20-21]。GA可以调控IAA含量,防止器官脱离,打破种子休眠,参与了调节植物生长和发育中的各种重要过程[22]。黑松菌根苗(R1)根、茎、叶中GA含量分别提高105%、62.6%、155%。GA在黑松针叶中含量变化最大,在根和茎中的含量变化相对较少。GA能够增强针叶的光合作用,促进叶片的增大,茎的伸长和花的诱导[23]。黑松菌根苗(R1)根、茎、叶中的ABA含量分别降低37.3%、27.5%、22.2%,ABA含量的降低能减缓进植物气孔的闭合[24],促进植物根系的生长[25]。
3 结论
本研究首先从7种供试培养基中筛选出中华网柄牛肝菌的最适液体发酵基础培养基为MNC培养基,随后在此基础上,通过Plackett-Burman试验、最陡爬坡试验及响应面试验得到中华网柄牛肝菌的最优液体发酵培养基为:KH2PO4 0.5 g/L,MgSO4·7H2O 0.5 g/L,ZnSO4 3 g/L,酒石酸铵0.75 g/L,柠檬酸铁10 g/L,硫胺素50 μg/L,酪蛋白水解物0.99 g/L,酵母浸粉1.35 g/L,葡萄糖18.2 g/L。在此条件下,中华网柄牛肝菌菌丝体干质量最大,为3.43 g/L。黑松苗经过接种中华网柄牛肝菌后,菌根为二叉分支结构并且显微结构具有明显哈氏网,黑松菌根苗IAA、ZT及GA含量分别提高33.0%、42.5%、102.0%,ABA含量降低29.0%。本研究结果为外生菌根科学的应用提供了理论依据。
[1]ZENG N K,LIANG Z Q,WU G,et al.The genus Retiboletus in China[J].Mycologia,2016,108(2):363-380.
[2]曾念开,梁志群.中国网柄牛肝菌属的分类[C]//中国菌物学会第六届会员代表大会(2014年学术年会)暨贵州省食用菌产业发展高峰论坛会议摘要.贵阳,2014.
[3] FELLER B, DANCˇÁK M, HRONEŠ M, et al.Mycorrhizal structures in mycoheterotrophic Thismia spp.(Thismiaceae):functional and evolutionary interpretations[J].Mycorrhiza,2022,32:269-280.
[4]MEYER A,GROTE R,PLOOE A,et al.Integrating mycorrhiza in a complex model system:effects on ecosystem C and N fluxes[J].Eur J Forest Res,2012,131(6):1809-1831.
[5]MEYER A,GROTE R,BUTTERBACH-BAHL K.Simulating mycorrhiza contribution to forest C-and N cycling-the MYCOFON model[J].Plant And Soil,2010,327(2):493-517.
[6]SUN X G,ZHAO Y Z,DING G J.Morphogenesis and metabolomics reveal the compatible relationship among Suillus bovinus, Phialocephala fortinii,and their co-host,Pinus massoniana[J].Microbiol Spectrum,2023,11(5):1423-1453.
[7] FELTEN J, KOHLER A, MORIN E, et al.The ectomycorrhizal fungus Laccaria bicolor stimulates lateral root formation in poplar and arabidopsis through auxin transport and signaling[J].Plant Physiol,2009,151(4):1991-2005.
[8]SPLIVALLO R,FISCHER U,GOBEL C,et al.Truffles regulate plant root morphogenesis via the production of auxin and ethylene[J].Plant Physiol,2009,150(4):2018-2029.
[9]王建瑞,谭钤文,刘宇,等.一株中华网柄牛肝菌菌株及诱导产生子实体的方法:CN114317280B[P].2023-05-05.
[10]姜喜铃,丁万隆,邢晓科.不同培养基对兰科药用植物手参原球茎共生真菌的分离效果[J].菌物学报,2022,41(6):952-961.
[11]谭钤文,刘元涛,刘一鹏,等.褐环乳牛肝菌液体发酵培养基的优化[J].中国酿造,2022,41(5):148-152.
[12]程显好,刘林德,董洪新,等.蜜环菌菌丝体液体培养条件的优化[J].中药材,2007(5):509-512.
[13] SHISHIKURA M, TAKEMURA Y, SOTOME K, et al.Four mycelial strains of Entoloma clypeatum species complex form ectomycorrhizalike roots with Pyrus betulifolia seedlings in vitro,and one develops fruiting bodies 2 months after inoculation[J].Mycorrhiza,2020,31(1):1-12.
[14]尹大川祁金玉.褐环乳牛肝菌对樟子松生长的调控——影响激素和代谢产物含量[J].菌物学报,2021,40(10):2811-2820.
[15]袁越锦,赵旭彤,熊奉奎,等.响应面法优化酿酒酵母培养基及培养条件[J].中国酿造,2023,42(8):158-165.
[16]孟芳,兰亚杰,冀权,等.响应面法优化枸杞果醋醋酸发酵工艺[J].中国酿造,2023,42(6):218-224.
[17]颜建虹,张祥瑞,卢红梅,等.响应面法优化刺梨白兰地原料酒发酵工艺[J].中国酿造,2023,42(6):186-191.
[18] DI MAMBRO R, DE RUVO M, PACIFICI E, et al.Auxin minimum triggers the developmental switch from cell division to cell differentiation in the Arabidopsis root[J].P Natl Acad Sci,2017,114(36):7641-7649.
[19]KOMAKI S,SUGIMOTO K.Control of the plant cell cycle by developmental and environmental cues[J].Plant Cell Physiol,2012,53(6):953-964.
[20]李苏涛,陈思齐,李妍,等.3种植物生长调节剂对不同干旱胁迫下巨菌草光合指标的影响[J].草业科学,2021,38(12):2406-2420.
[21]朱俊杰,王天顺,牙禹,等.茎用莴苣肉质茎内绿色组织光合特性探析[J].中国蔬菜,2021(3):71-77.
[22] HU L C, WANG X M, LIU H X, et al.Mechanisms of exogenous GA3-induced inhibition of seed development in southern highbush blueberry(Vaccinium darrowii)[J].Sci Hortic,2023,322:112430.
[23] XIE J B,TIAN J X, DU Q Z, et al.Association genetics and transcriptome analysis reveal a gibberellin-responsive pathway involved in regulating photosynthesis[J].J Exp Bot,2016,67(11):3325-3338.
[24]李乐,李丹宁,杨叶研,等.干旱胁迫下紫花苜蓿叶片代谢组分析及气孔调节物质的筛选[J].草地学报,2023,31(9):2671-2683.
[25]王恺.低钾胁迫下外源生长素和脱落酸调控玉米苗期根系生长发育的机理[D].沈阳:沈阳农业大学,2022.