由血纤维蛋白聚集形成的血栓栓塞性疾病是当前临床上患病率、致残率、死亡率均高的疾病之一,严重威胁人类的生命健康[1-4],其中心血管疾病(cardiovascular disease,CVDs)是造成全球人口死亡率和残疾率升高的主要原因[4-5]。目前,临床上治疗血栓栓塞性疾病常用的手段是溶栓疗法,如组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)、链激酶、尿激酶、重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)、替奈普酶、瑞替普酶等[6-7]。但是这些药物存在副作用大、价格昂贵等缺点,甚至有时会引起过敏反应和胃肠道及颅内出血等症状[7-9],因此,寻找其他可替代的新的纤溶酶来源势在必行。
1987年日本学者SUNI H等[10-14]从日本发酵食品纳豆中提取出具有溶栓活性的纳豆激酶(nattokinase,NK),对其抗栓、溶栓能力进行研究,发现纳豆激酶溶栓作用时间长、安全性好。由于纳豆激酶来源于食品,无毒副作用,且口服有效,为溶栓药物的开发提供了一种方向。受此启发,越来越多的学者从发酵食品中分离出能够分泌纤溶酶的菌株。刘雪等[15-18]从豆豉中分离出能够分泌豆豉纤溶酶的菌株,鉴定为芽孢杆菌属(Bacillus sp.),进一步研究发现豆豉纤溶酶分子质量小,可通过消化道直接吸收,具有良好的抗凝与溶栓效果,无毒副作用,对血细胞无溶解作用,预期在预防和治疗血栓性疾病方面具有重要的开发前景。
作为豆豉纤溶酶供体的枯草芽孢杆菌(Bacillussubtilis)DC-1生殖快、易培养,但由于分离自豆豉,产豆豉纤溶酶活性有限。因此,本研究以其为出发菌株,采用紫外诱变选育高产豆豉纤溶酶的菌株,并以豆豉纤溶酶活力为评价指标,采用单因素试验及正交试验对其产酶条件进行优化,以期进一步提高豆豉纤溶酶产生菌的产酶能力,为开发心脑血管等疾病相关保健产品与新型溶栓药物提供更多可用资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
枯草芽孢杆菌(Bacillus subtilis)DC-1:本实验室从豆豉中分离保存。
1.1.2 试剂
凝血酶(40~300 NIH U/mg):上海碧云天生物技术有限公司;尿激酶(120 000 IU/mg)、巴比妥酸(分析纯):上海阿拉丁生化科技股份有限公司;人纤维蛋白原:生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
液体发酵培养基[17]:牛肉膏1%、蛋白胨1%、氯化钠0.5%,121 ℃高压蒸汽灭菌20 min。
固体培养基:液体培养基中添加2%琼脂。纤维蛋白平板:参见文献[19]。
1.2 仪器与设备
TGW16台式高速微量离心机:长沙英泰仪器有限公司;HZQ-A恒温培养振荡器:常州冠军仪器制造有限公司;BJ-1CD超净工作台:上海博迅实业有限公司。
1.3 方法
1.3.1 豆豉纤溶酶活性测定
采用纤维蛋白平板法测定纤溶酶活性[19]。取纤维蛋白平板,用外径3 mm自制打孔器打孔,将菌液8 000 r/min离心10 min,取上清液10 μL分别加到纤维蛋白平板孔中,静置5 min。37 ℃培养16 h后,测定透明圈直径。参照尿激酶酶活,表征样品纤溶酶酶活[19-20]。纤溶酶酶活力计算公式如下:
式中:D表示标准尿激酶透明圈的直径,mm;d表示待测样品透明圈的直径,mm:1和2表示测量透明圈垂直两条直径。
1.3.2 紫外线诱变选育
选择功率30 W,照射距离35 cm,对涂布在平板上的枯草芽孢杆菌DC-1进行紫外诱变,分别诱变10 s、20 s、30 s、40 s、50 s,然后于暗室中37 ℃培养48 h,统计不同紫外线诱变条件下菌株DC-1的致死率。在致死率达85%左右的诱变条件下,挑取诱变菌株活化,以4%(V/V)的接种量接种于初始pH为7.0的液体发酵培养基中,装液量为80 mL/250 mL,37 ℃、180 r/min振荡培养36 h,然后测定豆豉纤溶酶活力,以出发菌株DC-1为对照,筛选豆豉纤溶酶活力高的菌株。
1.3.3 诱变菌株的遗传稳定性研究
将活化的诱变菌株以4%(V/V)的接种量转接到装液量为80 mL/250 mL,初始pH为7.0的液体发酵培养基中,37 ℃振荡培养36 h后,记为一代,然后以同样的接种量将前述菌液转接于新鲜液体发酵培养基中,继续培养36 h记为下一代,连续传代9次,每传代一次测定豆豉纤溶酶活力,考察诱变菌株的遗传稳定性。
1.3.4 诱变菌株发酵条件优化单因素试验
采用单因素轮换法依次考察装液量(60 mL/250 mL、70mL/250mL、80mL/250mL、90mL/250mL、100mL/250mL)、接种量(1%、2%、3%、4%、5%)、发酵温度(28 ℃、31 ℃、34 ℃、37 ℃)及初始pH(6.0、6.5、7.0、7.5、8.0)对诱变菌株发酵产豆豉纤溶酶活的影响。
1.3.5 诱变菌株发酵条件优化正交试验
在单因素试验基础上,选取对豆豉纤溶酶活影响较大的因素,以发酵温度(A)、发酵初始pH值(B)和接种量(C)为考察因素,以豆豉纤溶酶活力为评价指标,采用正交设计助手v3.2设计3因素3水平的L9(33)正交试验,试验因素与水平见表1。
表1 诱变菌株DC-V5发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization of mutagenic strain DC-V5
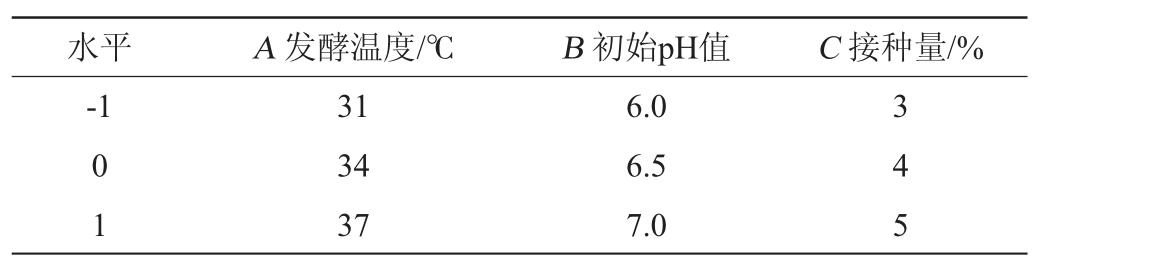
水平 A 发酵温度/℃ B 初始pH值 C 接种量/%-1 0 1 31 34 37 6.0 6.5 7.0 3 4 5
1.3.6 数据分析
使用SPSS 22.0对正交试验结果进行方差分析,使用OriginPro 2021作图。
2 结果与分析
2.1 紫外诱变条件的确定
紫外线诱变时间对枯草芽孢杆菌DC-1致死率的影响见图1。由图1可知,当紫外诱变30 s时,菌株DC-1的致死率达86%,紫外诱变40 s时,致死率高达98%。有研究发现,致死率为80%~90%时筛选到正突变的概率较高[21],所以选择紫外线诱变时间为30 s。
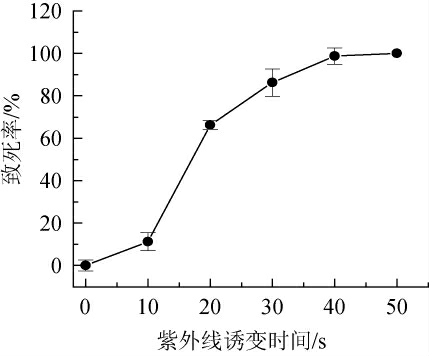
图1 紫外线诱变时间对枯草芽孢杆菌DC-1致死率的影响
Fig.1 Effect of ultraviolet mutagenesis time on lethality of Bacillus subtilis DC-1
2.2 诱变菌株的筛选与遗传稳定性研究
枯草芽孢杆菌DC-1在紫外线下诱变30 s后,筛选到6株细胞株,编号为DC-V1~DC-V6,对其产豆豉纤溶酶活力进行测定,结果见图2。由图2可知,与出发菌株DC-1(CK)相比,菌株DC-V3、DC-V5、DC-V6的豆豉纤溶酶活力显著升高(P<0.05),且菌株DC-V5的豆豉纤溶酶活力最高,为(381.75±23.78)IU/mL。因此,选择诱变株DC-V5为高产豆豉纤溶酶活力的菌株,并对其进行传代培养,考察遗传稳定性,结果见图3。
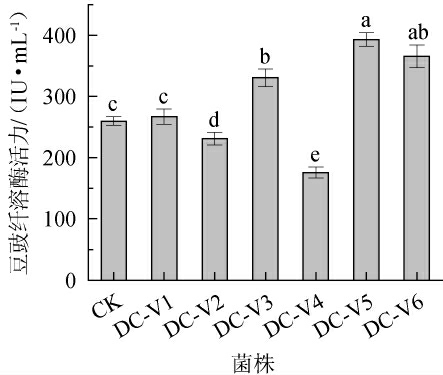
图2 高产豆豉纤溶酶活力诱变菌株的筛选
Fig.2 Screening of mutagenic strains with high yield Douchi fibrinolytic enzyme activity
不同小写字母表示差异显著(P<0.05)。下同。
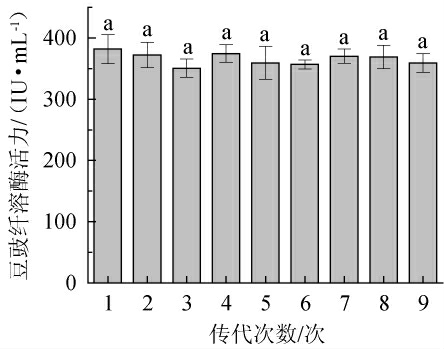
图3 诱变菌株DC-V5的遗传稳定性试验结果
Fig.3 Results of genetic stability tests of mutagenic strain DC-V5
由图3可知,菌株DC-V5连续传代9次,诱变菌株DC-V5的豆豉纤溶酶活无显著差异(P>0.05),表明诱变菌株DC-V5产豆豉纤溶酶能力遗传稳定。
2.3 诱变菌株DC-V5产豆豉纤溶酶活力发酵工艺优化
2.3.1 单因素试验
装液量、接种量、发酵温度及初始pH对诱变菌株DC-V5产纤溶酶活的影响见图4。
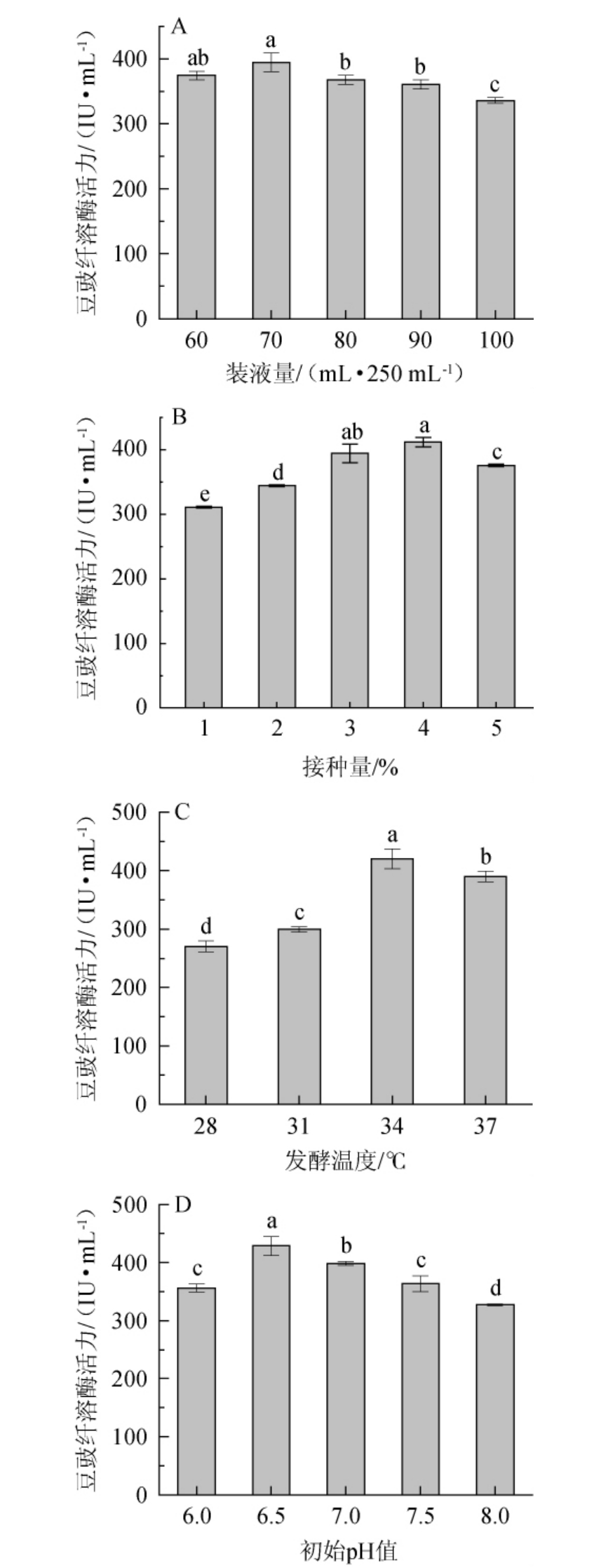
图4 不同影响因素对诱变菌株DC-V5产豆豉纤溶酶活的影响
Fig.4 Effect of different influence factors on the activity of Douchi fibrinolytic enzyme produced by mutagenic strain DC-V5
在同样的转速条件下,装液量的多少会影响培养液溶氧量的变化,进而影响好氧细胞的生长[22]。由图4A可知,随着装液量的升高,豆豉纤溶酶活力呈先升高后下降的趋势。当装液量为70 mL/250 mL时,豆豉纤溶酶活力最高,为(394.41±14.48)IU/mL,因此,确定最佳装液量为70 mL/250 mL。
初始菌体接种量较大,可以较快达到稳定期,使菌体产酶提前,但是过高的接种量,由于菌体生长过快,造成培养基内溶氧不足反而会影响菌体产酶速率[20]。由图4B可知,随着接种量的升高,豆豉纤溶酶活力呈先升高后下降的趋势,当接种量为4%时,豆豉纤溶酶活力最高,为(411.66±7.04)IU/mL,除与3%接种量组的酶活无显著差异外,显著高于其余接种量条件下的纤溶酶活力,因此,确定最佳接种量为4%。张振坤等[23]研究发现,芽孢杆菌产纤溶酶活力与菌体呈部分偶联关系,即菌株接种一段时间后才开始产纤溶酶,当菌株进入衰退期后,培养液中的纤溶酶活力还继续上升,但菌株产纤溶酶速率下降。因此推测,在相同发酵周期内,接种量多可以提高芽孢杆菌产纤溶酶活力。本研究中接种量为3%、4%、5%时,诱变菌株DC-V5产纤溶酶活力显著高于接种量1%和2%的组(P<0.05),因此,选择接种量3%、4%、5%进行正交试验。
温度或pH不仅会影响微生物的生长和代谢,还会影响酶的活力与稳定性[24-25]。由图4C可知,随着培养温度的升高,豆豉纤溶酶活力呈先升高后下降的趋势。当发酵温度为34 ℃时,纤溶酶活力最高,为(420.16±16.99)IU/mL。因此,确定最佳发酵温度为34 ℃。由图4D可知,随着初始pH值的升高,豆豉纤溶酶活力呈先升高后下降的趋势,当初始pH值为6.5时,豆豉纤溶酶活力最高,为(428.50±16.38)IU/mL。因此,确定最佳初始pH值为6.5。
2.3.2 正交试验
为了进一步提高诱变菌株DC-V5产豆豉纤溶酶的能力,在单因素试验基础上,确定装液量为70 mL/250 mL,选取影响较大的因素发酵温度(A)、初始pH(B)和接种量(C)为考察因素,以豆豉纤溶酶活力为评价指标,进行3因素3水平的正交试验,试验因素与水平见表2,方差分析见表3。
表2 诱变菌株DC-V5发酵条件优化正交试验设计及结果
Table 2 Design and results of orthogonal experiments for fermentation conditions optimization of mutagenic strain DC-V5
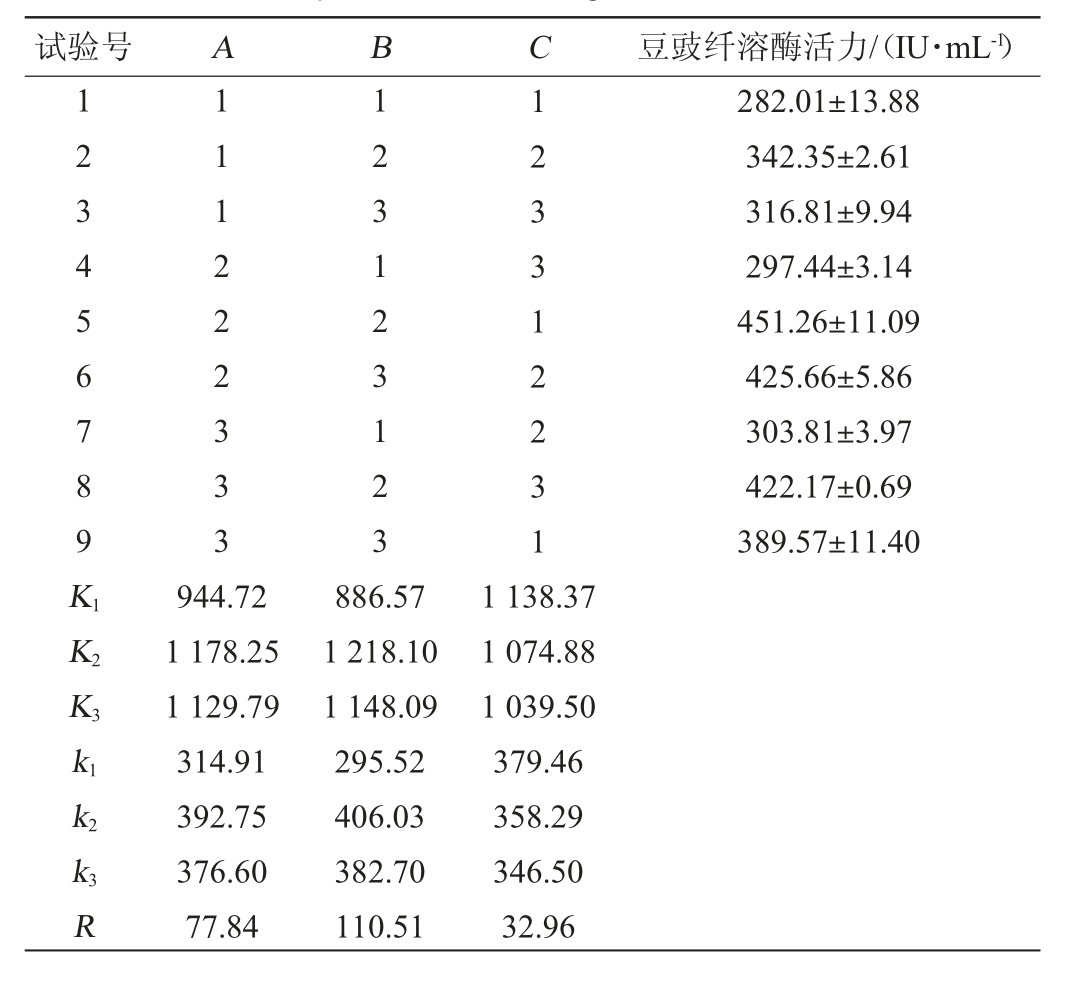
试验号 A B C 豆豉纤溶酶活力/(IU·mL-1)1 2 3 4 5 6 7 8 9 K1 K2 K3 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 3 1 2 2 3 1 282.01±13.88 342.35±2.61 316.81±9.94 297.44±3.14 451.26±11.09 425.66±5.86 303.81±3.97 422.17±0.69 389.57±11.40 k1 k2 k3 R 944.72 1 178.25 1 129.79 314.91 392.75 376.60 77.84 886.57 1 218.10 1 148.09 295.52 406.03 382.70 110.51 1 138.37 1 074.88 1 039.50 379.46 358.29 346.50 32.96
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
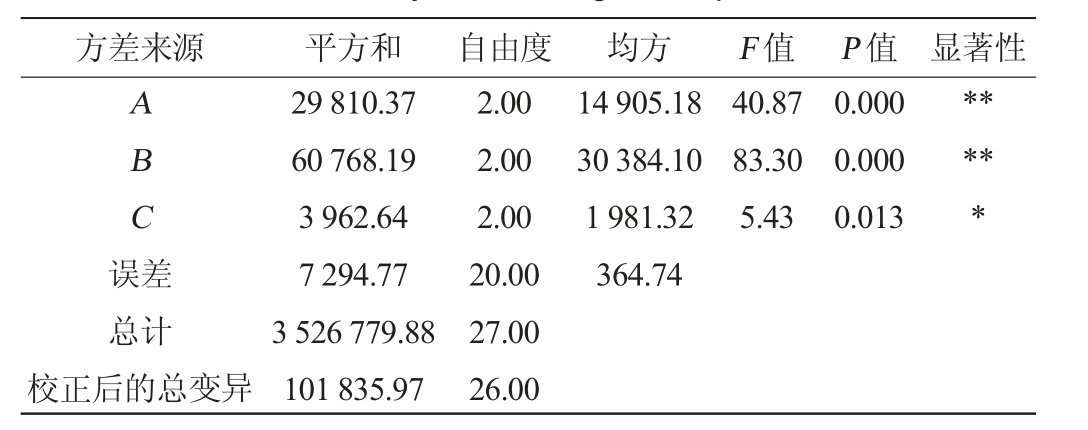
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著
(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性A B C误差14 905.18 30 384.10 1 981.32 364.74 40.87 83.30 5.43 0.000 0.000 0.013*****总计校正后的总变异29 810.37 60 768.19 3 962.64 7 294.77 3 526 779.88 101 835.97 2.00 2.00 2.00 20.00 27.00 26.00
由表2极值R值的大小可看出各因素对诱变菌株DC-V5发酵产豆豉纤溶酶活的影响顺序依次为初始pH(B)>发酵温度(A)>接种量(C),最优发酵工艺组合为序号5,即A2B2C1。根据各因素k值大小确定最优发酵工艺组合也为A2B2C1,即发酵温度34 ℃,初始pH 6.5,接种量3%。在此条件下,豆豉纤溶酶活为(451.26±11.09)IU/mL,是出发菌株枯草芽孢杆菌DC-1的豆豉纤溶酶活力(259.66±7.31)IU/mL的1.74倍。由表3可知,发酵温度和初始pH对结果影响极显著(P<0.01),接种量对结果影响显著(P<0.05)。虽然经过突变后酶活有了一定的提高,但是比侯静[16]从水豆豉中分离鉴定的贝莱斯芽孢杆菌(Bacillus velezensis)所产纤溶酶活力(826.25 IU/mL),以及翁美芝等[26]分离的嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)所产纤溶酶活力(527.49 IU/mL)要低,不过高于周倩等[27]筛选的凝结芽孢杆菌(Bacillus coagulans)所产纤溶酶活力(383.1 IU/mL),说明DC-V5的产豆豉纤溶酶能力虽然较发酵条件优化前的原始菌株有了一定的提高,但是还有进一步提高的空间。有研究报道,培养基中的碳源、氮源、无机盐离子等对芽孢杆菌产纤溶酶活力均有影响[20,22,24],本试验为后续通过优化培养基配方进一步提高诱变菌株DC-V5产豆豉纤溶酶能力提供了基础。
3 结论
采用紫外线对分离自豆豉中的枯草芽孢杆菌DC-1诱变30 s,通过纤维蛋白平板法选育出一株高产豆豉纤溶酶活力且稳定遗传的诱变菌株DC-V5。通过单因素试验及正交试验确定诱变菌株DC-V5产豆豉纤溶酶的最优发酵条件为装液量70 mL/250 mL,接种量3%,发酵温度34 ℃,初始pH值为6.5。在此条件下,其豆豉纤溶酶活力最高,为(451.26±11.09)IU/mL,是发酵条件优化前出发菌株DC-1的1.74倍。
[1]PARVEEN A R,DEVIKA R.Fibrinolytic enzyme-An overview[J].Curr Pharm Biotechnol,2022,23(11):1336-1345.
[2]AARON M W,GARY E R.Global burden of thrombosis:Epidemiologic aspects[J].Circ Res,2016,118(9):1340-1347.
[3]CAO X,ZHAO Z P,KANG Y T,et al.The burden of cardiovascular disease attributable to high systolic blood pressure across China,2005-18:a population-based study[J].The Lancet Public Health,2022,7(12):e1027-e1040.
[4]GREGORY A R,GEORGE A M,CATHERINE O J,et al.Global burden of cardiovascular diseases and risk factors, 1990-2019: Update from the GBD 2019 Study[J].J Am Coll Cardiol,2020,76(25):2982-3021.
[5]YUSUF S,JOSEPH P,RANGARAJAN S,et al.Modifiable risk factors,cardiovascular disease,and mortality in 155 722 individuals from 21 highincome,middle-income,and low-income countries(PURE):A prospective cohort study[J].Lancet,2020,395(10226):795-808.
[6]ELMIRA M,HOORIA S G,KARIM M,et al.Reteplase:Structure,function,and production[J].Adv Biomed Res,2019,8(1):19-25.
[7]郁明昊,闫敏,林强,等.溶栓治疗缺血性脑卒中的研究进展[J].中西医结合心血管病电子杂志,2021,9(15):4-6.
[8]AHAMED N A,IBRAHIM A A,SARAH A,et al. In vitro thrombolytic potential of fibrinolytic enzyme from Brevibacterium sp.isolated from the root of the plant,Aloe castellorum[J].Journal of King Saud University-Science,2022,34(3):101868-101874.
[9]杨新春,温绍君,李志忠,等.溶栓药物在动脉血栓栓塞性疾病中的应用及其评价[J].中华内科杂志,2006,45(6):522-523.
[10]SUNI H,HAMADA H,TSUSHIMA H,et al.A novel fiber nolic enzyme(nattokinase)in the vegetable cheese natto,a typical and popular soybean food in the Japanese diet[J].Experientia,1987,43(20):1110-l1l1.
[11] CHEN H, MCGOWAN E M, REN N, et al.Nattokinase: A promising alternative in prevention and treatment of cardiovascular diseases[J].Biomark Insights,2018,13:1-8.
[12] NAVID J, FARZANEH V, ELAHE S F, et al.Nattokinase: Structure,applications and sources[J].Biocatal Agr Biotechnol,2023,47:102564-102573.
[13]姚明静,杨杨,范婧,等.纳豆激酶的微生物生产及其生理功能的研究进展[J].食品工业科技,2022,43(14):435-444.
[14] LI D, HOU L, HU M, et al.Recent Advances in nattokinase-enriched fermented soybean foods:A review[J].Foods,2022,11(13):1867-1886.
[15]刘雪.豆豉纤溶酶产生菌的筛选及基因的克隆与表达研究[D].济南:山东师范大学,2011.
[16]侯静.豆豉纤溶酶高产菌株的筛选、发酵条件优化及酶的分离纯化[D].哈尔滨:东北林业大学,2011.
[17]王昶.豆豉纤溶酶高产菌株XY-1的诱变育种及产酶条件研究[D].武汉:华中科技大学,2014.
[18]沈畅萱,王修俊,黄珊.豆豉纤溶酶等微生物源纤溶酶的研究与应用进展[J].中国酿造,2017,36(8):6-10.
[19]周雨亭.贝莱斯芽孢杆菌纤溶酶的纯化、性质研究及体内外溶栓效果的评价[D].南宁:广西大学,2023.
[20]邓永平,刘晓兰,韩杨,等.中度嗜酸放线菌YY21液体发酵产纤溶酶条件的研究[J].食品工业科技,2017,38(14):131-136.
[21]马振贵,马伟超,蒲建平,等.马铃薯渣高效降解菌的紫外诱变选育及发酵试验[J].中国酿造,2011,30(1):123-126.
[22]牟光庆,孙园,霍贵成.豆豉纤溶酶产生菌的产酶条件优化[J].中国酿造,2007,26(2):30-33.
[23]张振坤,王玉娇,霍玲玲,等.一株产纤溶酶芽孢杆菌的分离鉴定与产酶特性[J].中国酿造,2016,35(9):64-67.
[24]庞光武,梁智群.海洋枯草芽孢杆菌产纤溶酶的诱变育种与发酵工艺优化[J].中国生物工程杂志,2022,42(12):27-36.
[25]陈桂光,李文杰,黄梅华,等.产纤溶酶海洋枯草芽孢杆菌的发酵工艺研究[J].食品工业科技,2012,33(24):249-252.
[26]翁美芝,邓雄伟,王立元,等.淡豆豉炮制过程中产纤溶酶微生物的筛选和鉴定[J].中草药,2020,51(24):6221-6228.
[27]周倩,朱琦琦,何维,等.一株产纤溶酶凝结芽孢杆菌的筛选及其生物学特性[J].基因组学与应用生物学,2020,39(4):1642-1649.