金银花(Lonicera japonica Thunb)为忍冬科忍冬属植物,在我国有98种,广泛分布于西南、华南等地[1]。自古被誉为清热解毒的良药,有极高药用价值,已收入《2020版中国药典》[2],在药典中绿原酸提取率是评价金银花优劣的重要依据之一。但金银花在加工过程中产生大量废渣,且没有得到充分利用,不仅造成资源浪费,而且对环境造成污染。金银花废渣中含有绿原酸、黄酮类化合物和多糖等有效成分[3],具有抗氧化、抗炎、抗肥胖和抗肿瘤等生物活性[4-5]。目前,金银花废渣被直接丢弃或加工为饲料[6],严重制约了产业的发展,开展金银花废渣的综合利用具有一定的现实意义。
发酵法是用于改善食品风味和功能组分的最古老的技术之一[7]。近年来,多菌种混合发酵优势不断呈现,已成为科学研究的热点,在果汁[8]、果酒[9]、乳酪[10]、食醋[11]加工中得到广泛的应用。研究表明,微生物发酵工艺有利于酚类化合物的高效提取[12]。徐文流等[13]发现金银花经红曲霉固体发酵后,绿原酸提取率增加,抗氧化能力提高。张枫源等[14]研究发现,利用枯草芽孢杆菌发酵金银花露残液能增加绿原酸提取率,增量为(193.03±47.60)μg/mL;尽管曲霉和枯草芽孢杆菌发酵均可以提高金银花中绿原酸含量,但主要集中于单一菌种发酵,效率较低;随着研究的不断深入,发现不同的微生物组合发酵较单一微生物发酵能得到更多的营养物质[15-16]。因此也有必要对不同微生物组合发酵金银花产绿原酸的条件进行研究。
目前国内外有关多菌种混合发酵多应用在改善发酵产品的感官品质,对发酵过程中功能成分提取率变化及活性差异的报道较少[16]。因此,本研究以金银花废渣为研究对象,利用枯草芽孢杆菌(Bacillus subtilis)、黑曲霉(Aspergillus niger)混合发酵体系,优化枯草芽孢杆菌-黑曲霉发酵金银花废渣的工艺;同时,基于金银花发酵提取液,研究比较发酵提取液、未发酵提取液的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS+)自由基以及Fe3+还原力差异,以期为多菌发酵金银花残渣提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
黑曲霉(Aspergillus niger)、枯草芽孢杆菌(Bacillus subtilis):北京生物保藏中心;金银花:采自云南玉溪;MRS肉汤培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖液体培养基:广东环凯微生物有限公司;绿原酸标准品(纯度≥95%):上海源叶生物科技有限公司;甲醇、乙腈(均为色谱纯):德国默克公司。其余试剂均为国产分析纯。
1.2 仪器与设备
Infiniti 1220型高效液相色谱(high performance liquid chromatography,HPLC)仪、MuLtiskan FC型酶标仪:美国安捷伦仪器有限公司;BH-1000超净工作台:赛默飞世尔科技有限公司;25B智能生化培养箱:常州澳华仪器有限公司;L720R-3型离心机:浙江塞德仪器设备有限公司;QL-902型漩涡振荡仪:海门其林贝尔仪器制造有限公司;HWS24型数显恒温水浴锅:国华电器有限公司;BCD-649WDGK冰箱:青岛海尔股份有限公司;TS-211B恒温摇床:上海天呈实验仪器制造有限公司。
1.3 试验方法
1.3.1 菌种活化
将-80 ℃冰箱冻存的菌种(枯草芽孢杆菌、黑曲霉)放于4 ℃冰箱解冻24 h;每只试管分装9 mL MRS液体培养基和PDA液体培养基后于121 ℃高压灭菌锅中灭菌15 min;取1 mL解冻菌液分装于试管中,枯草芽孢杆菌于37 ℃培养箱培养20 h,黑曲霉于30 ℃培养箱培养48 h,培养后放于4 ℃冰箱储存。
1.3.2 菌悬液制备、扩大培养
将培养的黑曲霉用接种环挑取一环接入100 mL灭菌的马铃薯葡萄糖培养基中,于30 ℃培养2 d,枯草芽孢杆菌采用同样的方式接种到100 mL灭菌的MRS培养基中,37 ℃培养2 d。
1.3.3 金银花废渣发酵工艺
将金银花95 ℃浸泡30 min后的残渣烘干(60 ℃,24 h)粉碎,过60目筛,得到金银花废渣。称量金银花废渣10 g于锥形瓶中,按料液比1∶20(g∶mL)加入蒸馏水制成悬浊液60 ℃水浴30 min,放无菌工作台冷却后分别按1%(V/V)接入活化培养的枯草芽孢杆菌、黑曲霉菌液(1∶1)复配,封口后放置摇床(140 r/min,37 ℃条件下培养72 h)作为发酵组;未接入菌液的组作为未发酵组。
1.3.4 绿原酸含量及提取率测定
参考董珊等[17]的方法并稍作修改。将金银花废渣发酵液离心(4 000 r/min,5 min)后取上清液备用,精确移取金银花发酵液上清液1 mL于10 mL离心管中,加体积分数70%甲醇9 mL,60 ℃水浴超声30 min,经0.22 μm有机系滤膜过滤,未发酵金银花液按同样方法处理,得待测样品溶液。
精密称量绿原酸标准品50.0 mg于50 mL离心管中,以体积分数70%甲醇溶解,并定容至50 mL,得到1 000 mg/L绿原酸标准储备溶液。配制得到20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L的绿原酸标准使用溶液。
高效液相色谱条件:安捷伦C18(5 μm,4.6 mm×250 mm)色谱柱;流动相0.2%冰乙酸水(A)和乙腈(B);流速1.0mL/min;洗脱条件0~35 min,5%~38.5%B;35~40 min,38.5%~80%B;40~45 min,80%~5%B;柱温40℃;检测波长327 nm;进样量10 μL。以吸光度值(y)为纵坐标,绿原酸质量浓度(x)为横坐标,得到绿原酸标准曲线回归方程为y=43.316x-1.009 5,R2=0.999 8,根据标准曲线回归方程计算绿原酸含量。计算绿原酸提取率,计算公式如下:
式中:W为样品中绿原酸提取率,%;C为样品溶液绿原酸质量浓度,mg/L;V为样品定容体积,mL;F为稀释倍数;M为样品质量,g;1 000为单位换算系数。
1.3.5 发酵条件优化单因素试验
固定绿原酸发酵基础条件为发酵时间3 d,发酵温度32 ℃,葡萄糖添加量为3%,接种量为1.5%进行单因素试验,考察发酵时间(24 h、48 h、72 h、96 h、120 h),发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、葡萄糖添加量(1%、2%、3%、4%、5%)、接种量(0.5%、1.0%、1.5%、2.0%、2.5%)对枯草芽孢杆菌-黑曲霉混合发酵金银花废渣中绿原酸提取率的影响。
1.3.6 发酵条件优化响应面优化试验
采用Box-Behnken设计优化提取条件。基于单因素试验选择发酵时间(A)、发酵温度(B)、葡萄糖添加量(C)、接种量(D)4个变量作为自变量,以绿原酸提取率为响应值,设计4因素3水平的响应面优化试验,试验因素与水平见表1。
表1 绿原酸提取条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface methodology for extraction conditions optimization of chlorogenic acid

水平 A 发酵时间/h B 发酵温度/℃ C 葡萄糖添加量/% D 接种量/%-1 0 1 48 72 96 30 32 34 2 3 4 1.0 1.5 2.0
1.3.7 金银花发酵物及提取物中绿原酸抗氧化活性研究(1)DPPH自由基清除能力的测定
参照ROMANET R等[18]的测定方法并适当修改。取100 μL适当稀释的样品提取液,加入0.9 mL现配的DPPH储备液,充分混合后,于室温下,避光反应60 min后,于波长517 nm下测吸光度值。DPPH自由基清除率计算公式如下:
式中:A0为对照组吸光值;Ai为样品组吸光度值;Aj为空白组吸光度值。
(2)ABTS+自由基清除能力的测定
参照YANG L等[19]的制备方法并适当修改。取9 mL适当稀释的样品提取液,加入1 mL ABTS+溶液,充分混合后,于室温下,避光反应10 min后,于波长734 nm下测吸光度值。ABTS自由基清除率计算公式如下:
式中:A0为空白组吸光度值;AS为样品组吸光度值。
(3)Fe3+还原力的测定
还原力测定参照KHADHRI A等[20]的测定方法并适当修改。取500 μL的上清液加入400 μL的蒸馏水和100 μL的三氯化铁水溶液,于波长700 nm下测吸光度值。铁离子还原力计算公式如下:
式中:A0为对照组溶液吸光度值;A1为待测样液吸光度值。
1.3.8 数据处理与分析
采用SPSS 25.0软件最小显著差异法(least significance difference,LSD)进行方差分析(analysisofvariance,ANOVA),并用不同小写字母表示差异显著(P<0.05);采用Design Expert 10.0进行响应面设计试验及数据统计,GraphPad Prism 8软件绘图。
2 结果与分析
2.1 绿原酸的测定
绿原酸标准品及金银花废渣提取液样品的高效液相色谱测定结果见图1。由图1A可知,通过绿原酸标品确定绿原酸保留时间,确定绿原酸保留时间在13.5 min附近,由图1B可知,金银花废渣提取液样品含有绿原酸物质,色谱峰分离效果良好。
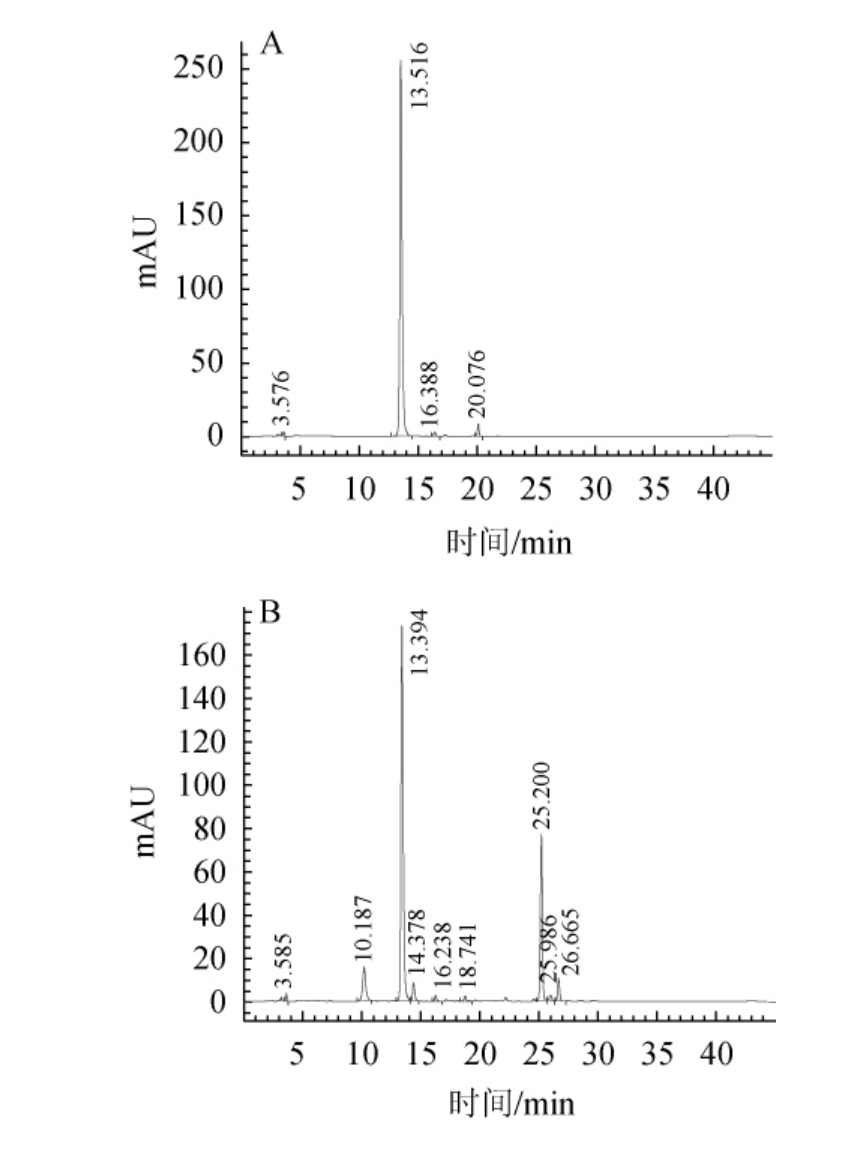
图1 绿原酸标准品(A)及金银花废渣提取液(B)的高效液相色谱图
Fig.1 High performance liquid chromatogram of chlorogenic acid standard (A) and Lonicera japonica waste residue extract (B)
2.2 金银花废渣发酵工艺的研究
2.2.1 发酵时间的选择
发酵时间是影响金银花废渣发酵工艺的重要因素之一,不同发酵时间对金银花废渣提取液中绿原酸提取率的影响见图2。
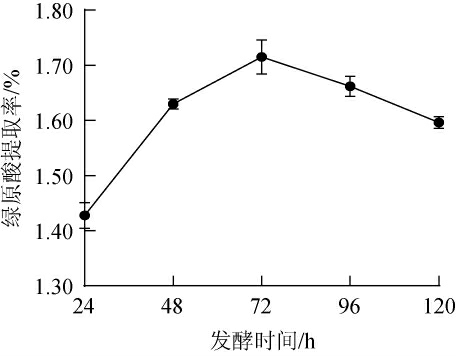
图2 不同发酵时间对金银花废渣提取液中绿原酸提取率的影响
Fig.2 Effect of different fermentation time on the extraction rates of chlorogenic acid from honeysuckle waste residue extracts
由图2可知,随着发酵时间的延长,金银花废渣中绿原酸积累不断增加,并在第72小时达到最大值,提取率为1.72%,这是因为枯草芽孢杆菌-黑曲霉迅速增值并代谢产生代谢酶,促进了金银花废渣中绿原酸的快速释放,也有可能菌种的发酵合成了一定量的绿原酸。超过72 h后,绿原酸提取率逐渐降低,主要是因为微生物的快速增值,消耗了一定了的绿原酸[21]。故确定发酵时间为72 h。
2.2.2 发酵温度的选择
温度是对菌株生长发育和代谢最直接的影响因素[22],不同发酵温度对金银花废渣提取液中绿原酸提取率的影响见图3。由图3可知,在26~34 ℃的发酵温度区间,金银花废渣提取液中绿原酸的提取率呈先升高后下降的变化趋势。在发酵温度32 ℃时,绿原酸的提取率达到最大值,为1.70%,其原因是适宜的发酵温度能让菌株繁殖速度增加,菌种发酵相关的代谢酶系活性增强,使发酵液中绿原酸提取率增加。超过32 ℃后,温度过高不适宜菌种繁殖,导致其活性、代谢和转化绿原酸的能力受到影响[23],致使绿原酸的提取率呈下降趋势。故确定发酵温度为32 ℃。
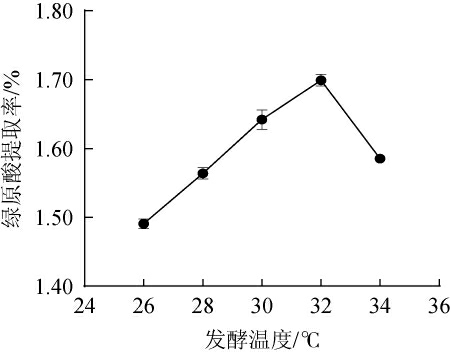
图3 不同发酵温度对金银花废渣提取液中绿原酸提取率的影响
Fig.3 Effect of different fermentation temperature on the extraction rates of chlorogenic acid from honeysuckle waste residue extract
2.2.3 葡萄糖添加量的选择
葡萄糖可为微生物的生长提供最基本的能量[24],不同葡萄糖添加量对金银花废渣提取液中绿原酸提取率的影响见图4。
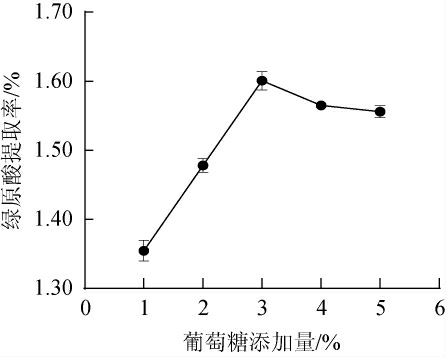
图4 不同葡萄糖添加量对金银花废渣提取液中绿原酸提取率影响
Fig.4 Effect of different glucose addition on the extraction rates of chlorogenic acid from honeysuckle waste residue extract
由图4可知,绿原酸提取率与葡萄糖添加量在1%~3%范围内呈正相关;在葡萄糖添加量为3%时绿原酸提取率达到峰值,为1.60%,当葡萄糖添加量>3%后,绿原酸提取率下降。葡萄糖作为微生物发酵的优质碳源,当其添加较少时,枯草芽孢杆菌-黑曲霉会得不到充足的碳源供应而出现明显自溶的现象[25],添加量过多导致枯草芽孢杆菌-黑曲霉渗透失水过多死亡,抑制菌种生长造成绿原酸的损耗。故确定葡萄糖添加量为3%。
2.2.4 接种量的选择
接种量对发酵周期和菌株代谢产酶均具有较大影响[26]。不同接种量对金银花废渣提取液中绿原酸提取率的影响见图5。由图5可知,金银花废渣提取液中绿原酸提取率随菌种接种量增加呈先上升后下降的趋势。在接种量为1.5%时,提取液中绿原酸的提取率达到最高,为1.64%,接种量超过1.5%后,绿原酸提取率逐渐下降。其原因可能是接种量少时,菌种在发酵液中繁殖慢不能有效对金银花废渣进行发酵,导致功能性成分释放较少;接种量过多,会导致菌体生长过快、过稠,造成营养物质损失并产生过多的代谢废物,同时消耗了绿原酸等有效成分[27]。故确定接种量为1.5%为宜。
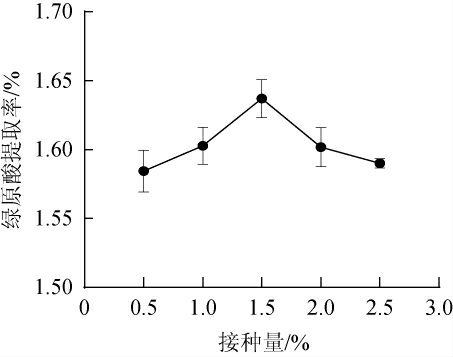
图5 不同接种量对金银花废渣中绿原酸提取率的影响
Fig.5 Effect of different inoculum on the extraction rates of chlorogenic acid from honeysuckle waste residue extract
2.3 响应面试验优化分析
采用Design Expert 10.0软件中的Box-Behnken程序进行分析,基于单因素试验选择发酵时间(A)、发酵温度(B)、葡萄糖添加量(C)、接种量(D)4个变量作为自变量,以绿原酸提取率(Y)为响应值,共设计29个试验点,试验设计与结果见表2。
表2 绿原酸提取条件优化响应面试验结果与分析
Table 2 Results and analysis of response surface methodology for extraction conditions optimization of chlorogenic acid
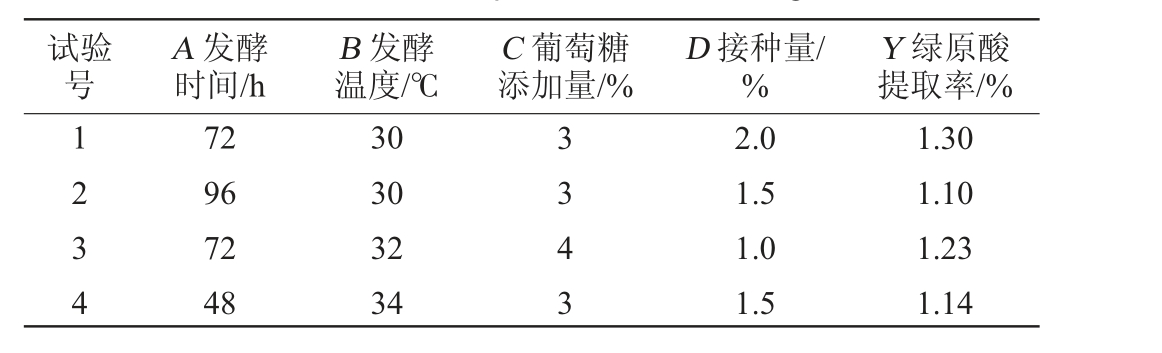
试验号A 发酵时间/h B 发酵温度/℃C 葡萄糖添加量/%D 接种量/%Y 绿原酸提取率/%1 2 3 4 72 96 72 48 30 30 32 34 3 3 4 3 2.0 1.5 1.0 1.5 1.30 1.10 1.23 1.14
续表
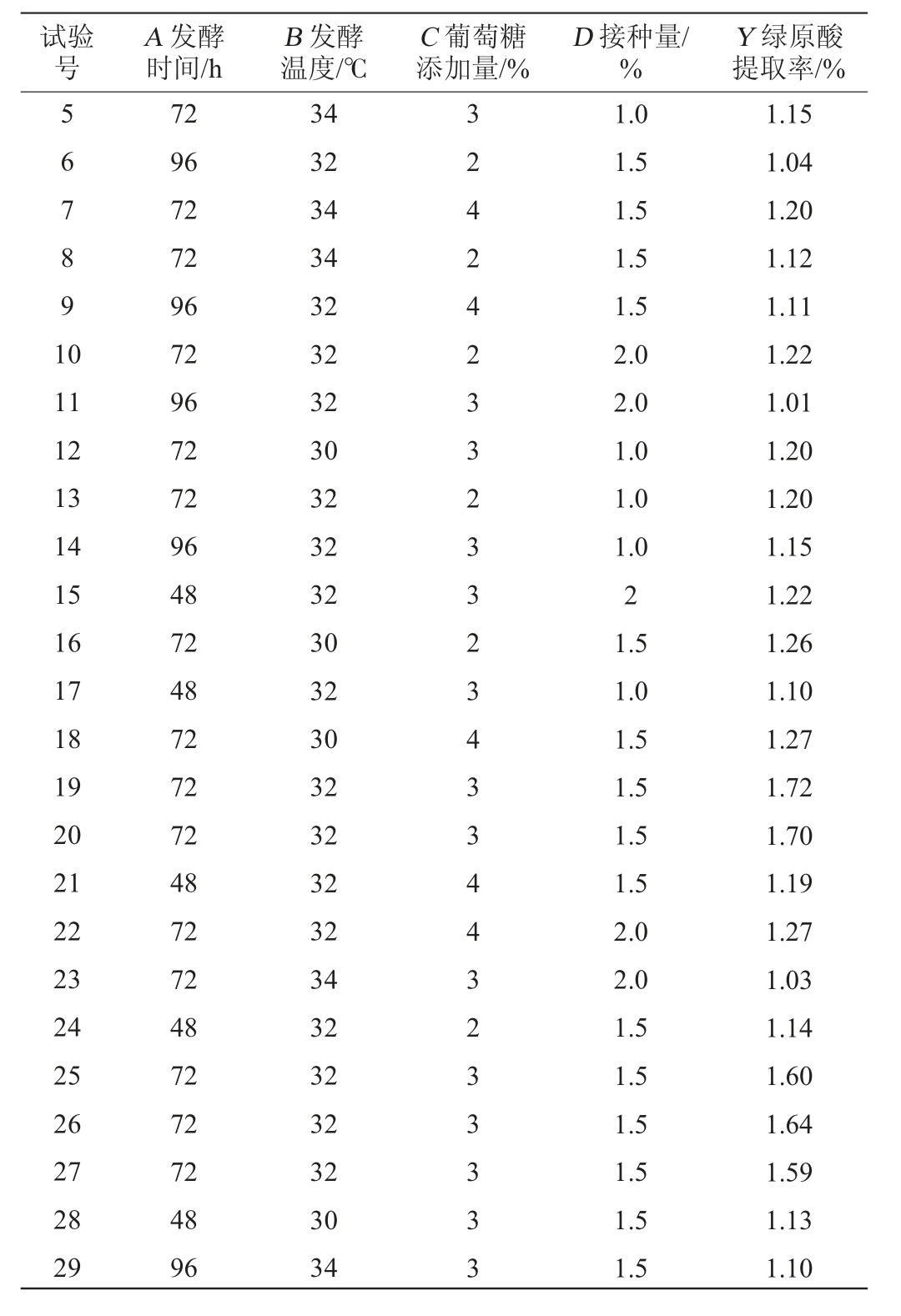
试验号A 发酵时间/h B 发酵温度/℃C 葡萄糖添加量/%D 接种量/%Y 绿原酸提取率/%5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 72 96 72 72 96 72 96 72 72 96 48 72 48 72 72 72 48 72 72 48 72 72 72 48 96 34 32 34 34 32 32 32 30 32 32 32 30 32 30 32 32 32 32 34 32 32 32 32 30 34 3 2 4 2 4 2 3 3 2 3 3 2 3 4 3 3 4 4 3 2 3 3 3 3 3 1.0 1.5 1.5 1.5 1.5 2.0 2.0 1.0 1.0 1.0 2 1.5 1.0 1.5 1.5 1.5 1.5 2.0 2.0 1.5 1.5 1.5 1.5 1.5 1.5 1.15 1.04 1.20 1.12 1.11 1.22 1.01 1.20 1.20 1.15 1.22 1.26 1.10 1.27 1.72 1.70 1.19 1.27 1.03 1.14 1.60 1.64 1.59 1.13 1.10
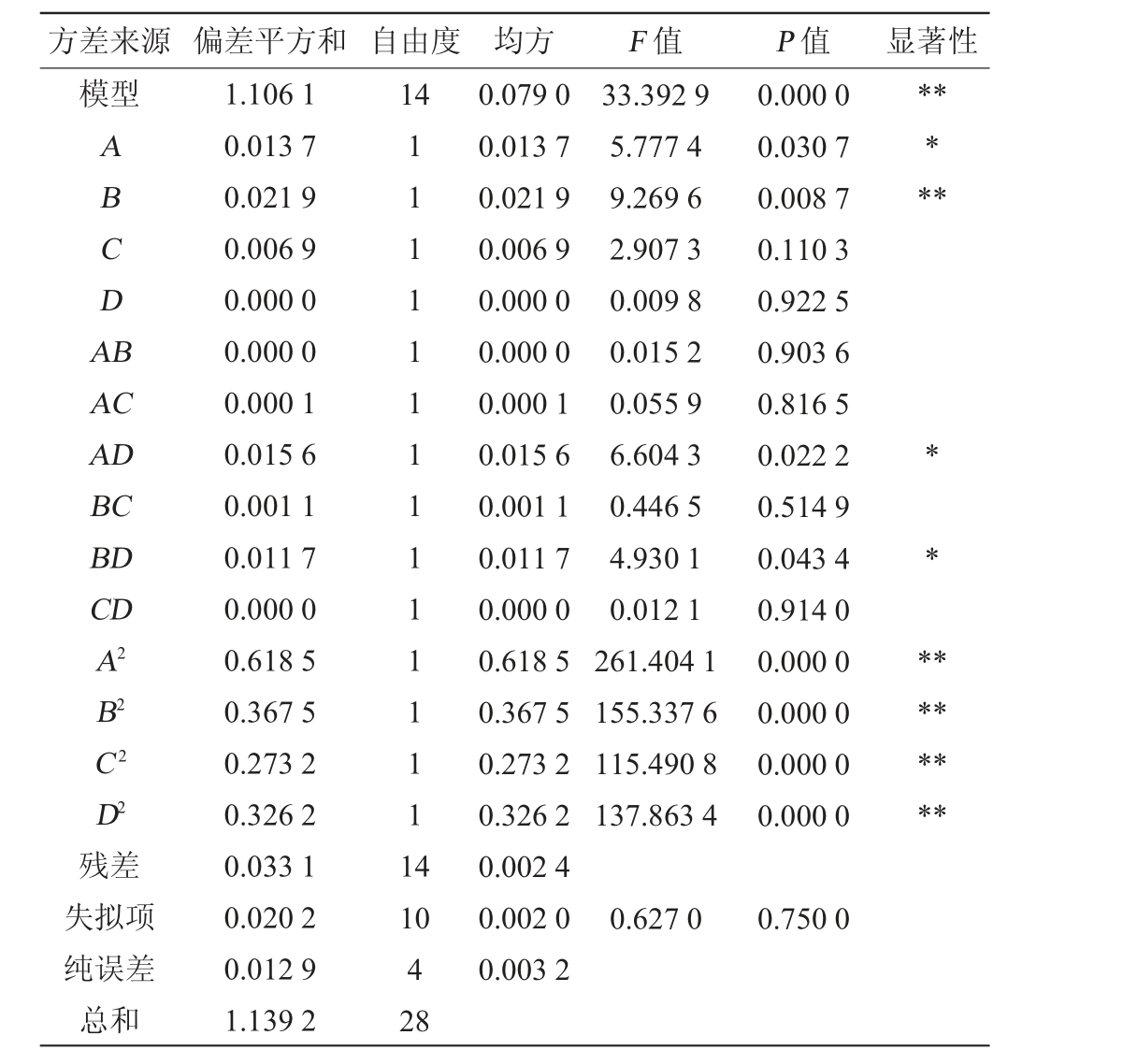
根据表2中的数据得到回归方程为:Y=1.648-0.034A-0.043B+0.024C+0.001D-0.003AB+0.006AC-0.063AD+0.016BC-0.054BD+0.003CD-0.309A2-0.238B2-0.205C2-0.224D2,对 模 型进行方差分析,结果见表3。
表3 响应面试验结果方差分析
Table 3 Variance analysis of response surface test results
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
方差来源 偏差平方和 自由度 均方 F 值 P 值 显著性模型14 A B C D A B*****AC AD BC BD CD A2** **B2 C2 D2 33.392 9 5.777 4 9.269 6 2.907 3 0.009 8 0.015 2 0.055 9 6.604 3 0.446 5 4.930 1 0.012 1 261.404 1 155.337 6 115.490 8 137.863 4 0.000 0 0.030 7 0.008 7 0.110 3 0.922 5 0.903 6 0.816 5 0.022 2 0.514 9 0.043 4 0.914 0 0.000 0 0.000 0 0.000 0 0.000 0******残差失拟项纯误差总和1.106 1 0.013 7 0.021 9 0.006 9 0.000 0 0.000 0 0.000 1 0.015 6 0.001 1 0.011 7 0.000 0 0.618 5 0.367 5 0.273 2 0.326 2 0.033 1 0.020 2 0.012 9 1.139 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 10 4 28 0.079 0 0.013 7 0.021 9 0.006 9 0.000 0 0.000 0 0.000 1 0.015 6 0.001 1 0.011 7 0.000 0 0.618 5 0.367 5 0.273 2 0.326 2 0.002 4 0.002 0 0.003 2 0.627 0 0.750 0
由表3可知,模型极显著(P<0.01),失拟项(P=0.750>0.05)不显著,说明模型是合理的,模型决定系数R2为0.970 9,说明该模型能较好的反映枯草芽孢杆菌-黑曲霉混合发酵金银花废渣中绿原酸提取率与发酵时间、发酵温度、葡萄糖添加量和接种量的关系。模型中的R2与调整决定系数R2Adj的差异<0.2,说明观测值与预测值的相关性较高,变异系数为3.91%,说明试验数据具有较高的精度与可靠性。其中一次项B、二次项A2、B2、C2、D2对响应值影响极显著(P<0.01);发酵时间(A)、交互项AD、BD对响应值影响显著(P<0.05)。各影响因素对响应值的影响性排序为发酵温度(B)>发酵时间(A)>葡萄糖添加量(C)>接种量(D)。
等高线图可直观反映出各因素交互作用对绿原酸提取率的影响,等高线越接近于椭圆,该因素对绿原酸提取率影响越大。以提取液中绿原酸提取率为响应值的响应面和等高线见图6。由图6可知,AD、BD交互作用的等高线图呈椭圆状,且曲率半径大于图AB、AC、BC、CD,说明AD、BD的交互作用比AB、AC、BC、CD显著性更高,直观分析结果和方差分析结果基本吻合。4个因素相互作用的6个响应面3D图均呈开口朝下的降落伞状,曲面陡峭且有最高点,表明绿原酸提取率存在最大值,且在该试验设计的测量范围内。
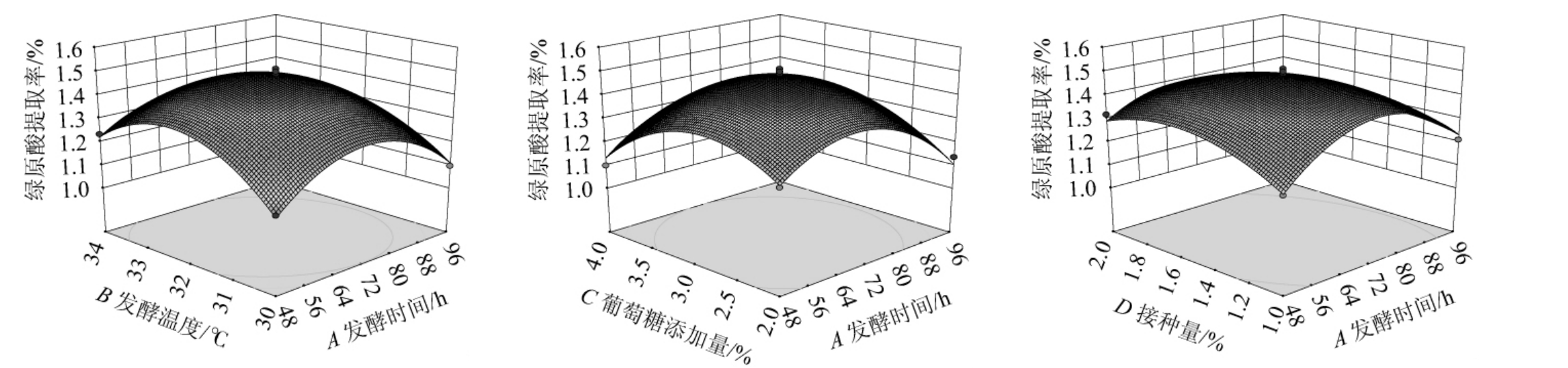
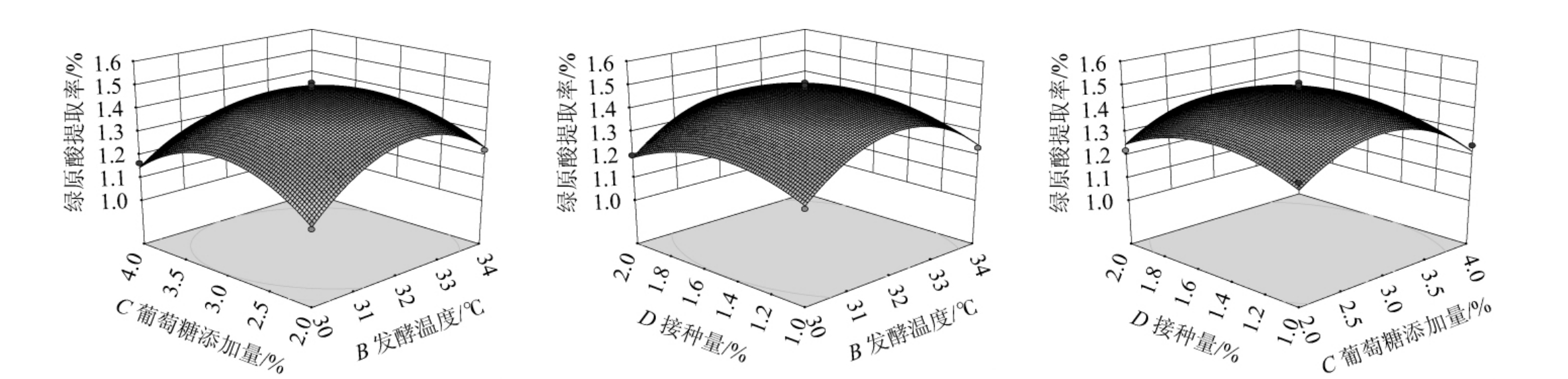
图6 各因素交互作用对绿原酸提取率影响的响应面与等高线
Fig.6 Response surface plots and contour lines of effects of interaction between each factor on extraction rates of chlorogenic acid
2.4 最佳工艺条件及验证试验
响应面优化试验得到枯草芽孢杆菌-黑曲霉混合发酵金银花废渣提高提取液中绿原酸提取率的最佳工艺条件为发酵时间70.654 h,发酵温度31.820 ℃,葡萄糖添加量3.054%,接种量1.511%,预测绿原酸提取率为1.652%。
为验证响应面模型的可靠性,考虑到实际生产操作,将枯草芽孢杆菌-黑曲霉混合发酵提取金银花废渣中绿原酸提取率的工艺条件调整为发酵时间71 h,发酵温度32 ℃,葡萄糖添加量为3%,接种量1.5%。在此条件下进行了3组平行验证试验,得到了绿原酸提取率平均实际值为1.63%,与预测值偏差0.02%,说明回归模型拟合效果好且优化参数可用于后续试验。
2.5 发酵前后金银花废渣提取液抗氧化活性研究
金银花提取液对DPPH、ABTS自由基清除率和Fe3+还原力的测定结果见图7。由图7a可知,发酵前后金银花提取液对DPPH自由基有一定的清除作用,清除能力随着质量浓度的增大而增强。试验中以维生素C(vitamin C,VC)作为阳性对照,在相同质量浓度下对DPPH自由基的清除作用能力大小顺序为VC>发酵组>未发酵组。当质量浓度为100 mg/L时,VC组、发酵组、未发酵组对DPPH自由基的清除率分别为96.73%、86.64%、82.96%。在测试浓度范围内(80~100 mg/L)发酵组对DPPH自由基的清除率显著大于未发酵组(P<0.05)。
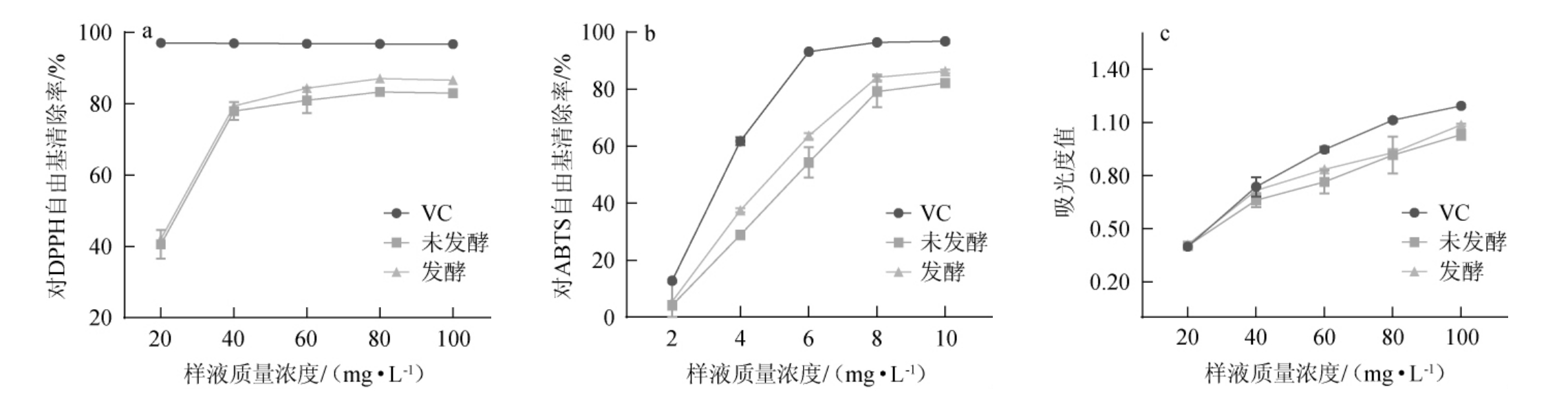
图7 金银花废渣提取液的DPPH自由基清除能力(a)、ABTS自由基清除能力(b)和Fe3+还原力(c)
Fig.7 DPPH radical scavenging capacity (a), ABTS radical scavenging capacity (b) and Fe3+reducing power (c) of honeysuckle waste residue extract
由图7b可知,在2~10 mg/L质量浓度范围内,样品对ABTS自由基清除率随着质量浓度增加而升高,试验中以VC作为阳性对照,在相同质量浓度下对ABTS自由基的清除作用能力大小顺序为VC>发酵组>未发酵组。当质量浓度为10 mg/L时,VC、发酵组、未发酵组的清除率分别为96.81%、86.34%、82.17%。当质量浓度较小(20 mg/L)时发酵组与未发酵组对ABTS自由基清除率没有显著性差异(P>0.05),随着质量浓度在4~10 mg/L范围内的增加,发酵组对ABTS自由基清除活性显著大于未发酵组(P<0.05)。
由图7c可知,在20~100 mg/L质量浓度范围内,相同浓度发酵组和未发酵组铁离子还原能力比VC低,但还原能力与质量浓度之间呈显著的量效关系。当质量浓度为100 mg/L时,VC、发酵组、未发酵组的铁离子还原力分别为1.19、1.09、1.03。当质量浓度为20~80 mg/L时,发酵组与未发酵组对铁离子还原力没有显著性差异(P>0.05),质量浓度增加至100 mg/L时,发酵组对铁离子还原力显著大于未发酵组(P<0.05)。
综上,在测试浓度范围内,与未发酵组相比,发酵组提取液的DPPH、ABTS自由基清除率和Fe3+还原力均有一定提高,说明发酵金银花废渣能增强其抗氧化能力。这可能由于多菌种混合发酵可使酚类物质的提取率增加导致,发酵组提取液中绿原酸物质提取率提高也进一步证明了此结果。
3 结论
本研究基于单因素试验结合Box-Behnken响应面试验优化枯草芽孢杆菌-黑曲霉混合发酵提取金银花废渣中绿原酸的条件,其最佳提取条件为发酵时间71 h,发酵温度32 ℃,葡萄糖添加量3%,接种量1.5%。在此优化提取条件下,与未发酵的金银花废渣相比,绿原酸提取率由1.12%增加至1.63%。同时,而3种方法对金银花废渣提取液抗氧化能力的评价结果基本一致,抗氧化能力的强弱为发酵组>未发酵组。金银花废渣发酵提取液较未发酵组具有更强的抗氧化活性。多菌种联合发酵金银花废渣可提高提取液中绿原酸提取率及其抗氧化能力,本研究可为金银花废渣提取液活性成分富集及其综合利用提供一定的技术支撑和理论依据。
[1]LU A, ZHONG S, CHEN J, et al.Removal of Cr(VI) and Cr(lll) from aqueous solutions and industrial wastewaters by natural clino-pyrrhotite[J].Environ Sci Technol,2006,40(9):3064-3069.
[2]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2020:1088.
[3]张敏敏,赵志国,刘倩,等.基于离线2D-HPLC-DPPH-ESI-Q-TOF/MS联用技术的金银花抗氧化成分系统筛选研究[J].中草药,2021,52(11):3193-3200.
[4]杜叶青,段治康,董舒卉,等.基于网络药理学的金银花活性成分抗炎作用机制的研究[J].中国药物化学杂志,2019,29(2):96-102.
[5]吴娇,王聪,于海川.金银花中的化学成分及其药理作用研究进展[J].中国实验方剂学杂志,2019,25(4):225-234.
[6]王曼,敖翔,何健.发酵金银花渣饲料对生长肥育猪生长性能和肉品质的影响[J].养猪,2020(4):14-16.
[7]HENDY J,REST M,ALDENDERFER M,et al.Cultures of fermentation:living with microbes:an introduction to supplement 24[J].Curr Anthropol,2021,62(Suppl.24):102-108.
[8] DEY B T,CHAKRABORTY S,JAIN K K, et al.Antioxidant phenolics and their microbial production by submerged and solid state fermentation process:A review[J].Trends Food Sci Technol,2016,53:60-74.
[9] XU A, XIAO Y, HE Z, et al.Use of Non-Saccharomyces yeast co-fermentation with Saccharomyces cerevisiae to improve the polyphenol and volatile aroma compound contents in Nanfeng tangerine wines[J].J Fungi,2022,8(2):128.
[10]朱丹实,吴逗逗,沈雨思,等.多菌种混合发酵果蔬汁的研究进展[J].中国食品学报,2021,21(10):343-352.
[11]ZHAO X X,XUE Y,TANG F X,et al.Quality improvement of jujube wine through mixed fermentation with Saccharomyces cerevisiae and Bacillus licheniformis[J].LWT-Food Sci Technol,2022,164:113444.
[12]LI Y D,WANG J H,WANG T,et al.Differences between Kazak cheeses fermented by single and mixed strains using untargeted metabolomics[J].Foods,2022,11(7):966.
[13]徐文流,贝琦,梁诗雅,等.红曲霉发酵提高金银花的抗氧化活性[J].现代食品科技,2020,36(9):47-53.
[14]张枫源,代珍珠,向福,等.利用金银花蒸馏残液生物转化绿原酸工艺优化[J].中国酿造,2019,38(9):134-137.
[15]ZHENG Y,ZHAO C M,LI X W,et al.Kinetics of predominant microorganisms in the multi-microorganism solid-state fermentation of cereal vinegar[J].LWT-Food Sci Technol,2022,159:113209.
[16]TAN M,CARO Y,SHUM C A,et al.Evaluation of mixed-fermentation of Saccharomyces cerevisiae with Saprochaete suaveolens to produce natural fruity beer from industrial wort[J].Food Chem,2021,346:128804.
[17]董珊,肖伟敏,彭祖茂,等.HPLC法同时测定金银花等样品中6种绿原酸异构体的提取率[J].食品科技,2020,45(3):300-306.
[18]ROMANET R,SARHANE Z,BAHUT F,et al.Exploring the chemical space of white wine antioxidant capacity:A combined DPPH,EPR and FT-ICR-MS study[J].Food Chem,2021,355:129566.
[19]YANG L,AGUILAR Z,QU F,et a.Enhanced antimicrobial activity of silver nanoparticles-Lonicera japonica Thunb combo[J].IET Nanobiotechnol,2016,10(1):28-32.
[20]KHADHRI A,BOUALI I,BELKHIR S,et al.In vitro digestion,antioxidant and antiacetylcholinesterase activities of two species of Ruta:Ruta chalepensis and Ruta montana[J].Pharmaceut Biol,2017,55(1):101-107.
[21]沈燕飞.乳酸菌发酵苹果原浆过程中的基本组分与抗氧化活性变化[D].杭州:浙江工业大学,2019.
[22]胡楠,杨强强,雷鸣,等.响应面法优化蓝莓生料乳酸菌发酵工艺[J].食品科技,2021,46(6):20-28.
[23]王奇盛,高瑞杰,缪礼鸿,等.酵母菌混合发酵制备米酒及其工艺优化[J].中国酿造,2022,41(7):155-161.
[24]ABDEL RAHMAN M A,HASSAN S E D,ALREFAEY H M A,et al.Efficient co-utilization of biomass-derived mixed sugars for lactic acid production by Bacillus coagulans Azu-10[J].Fermentation,2021,7(1):28-45.
[25]刘毓锋.益生菌发酵水果饮料工艺及品质变化研究[D].广州:华南理工大学,2020.
[26]汪姣玲,李加兴,岳元媛.植物乳杆菌和肠膜明串珠菌混合发酵泡萝卜的工艺优化[J].食品工业科技,2023,44(3):172-182.
[27]RAFAT W,BEATA D,DOROTA D,et al.Verification of the conditions for determination of antioxidant activity by ABTS and DPPH assays-a practical approach[J].Molecules,2021,27(1):50.