脂肽是由芽孢杆菌属(Bacillus)产生的一类低分子质量生物表面活性剂,这类活性物质具有独特的两亲性分子结构,由氨基酸相互结合形成极性亲水的肽键与由脂肪酸烃链组成的非极性疏水基构成[1]。因此,脂肽类表现出多样的生物活性,如抗菌、抗炎、环境修复和降低表面张力等生物活性[2-4]。根据合成脂肽的基因簇和化学结构的差异,枯草芽孢杆菌(Bacillus subtilis)所产脂肽主要有表面活性素(surfactin)、伊枯草菌素(iturin)、泛革素(fengycin)等3大家族[5]。表面活性素是于1968年在研究微生物代谢产物对纤溶系统和凝血系统的影响时,发现了几种枯草芽孢杆菌(Bacillus subtilis)分泌到培养液中的强效凝血抑制剂,分离出的抑制剂为白色针状物[6]。由于它的高表面活性超过了十二烷基磺酸钠,因此被命名为“表面活性素(surfactin)”。表面活性素家簇是由7个α-氨基酸残基的短肽与链长12~17个碳原子的β-羟基脂肪酸通过内酯键交联组成的环状脂肽。表面活性素在细胞中利用脂肽在水介质中的β-片层结构形成马鞍形构象,从而赋予表面活性素分子广泛的生物活性。如抗菌[7]、抗癌[8]、抗真菌[9-10]、抗病毒[11]、溶栓[12]和环境修复[13-14]等生物活性。表面活性素作为生物表面活性剂或生防制剂与化学表面活性剂或农药相比有以下优点:毒性相对低[15]、生物降解性高、环境兼容性高、极端条件(温度、酸碱度和盐离子浓度)比活性高,以及可以利用可再生原料生产的能力等[16-19]。
培养基及培养条件对芽孢杆菌的抗菌脂肽合成具有显著影响。HA S等[20]研究结果表明,耗氧速率(oxygen uptake rate,OUR)与表面活性素产量呈正相关,过高转速和芽孢的形成都会降低Bacillus subtilis Y9培养物中表面活性素的产率。陈亮等[21]利用单因素试验及响应面法对Bacillus subtilis LM2303脂肽发酵工艺条件进行优化,结果表明,优化后脂肽产量较优化前提高1.6倍。姚树林等[22]利用Taguchi法优化解淀粉芽孢杆菌(Bacillusamyloliquefaciens)fmb50产表面活性素的发酵培养基,结果表明,玉米粉、硝酸铵和P对表面活性素产量有显著影响,优化后的培养基较Landy培养基发酵表面活性素产量提高了15%,生产成本下降了40%。张晓云等[23]对Bacillussubtilis BAB-1菌株脂肽发酵培养基进行优化,结果表明,熊果苷是菌株BAB-1产生表面活性素的最佳碳源。乔俊卿等[24]优化Bacillus subtilis T-500高产脂肽类抗生素的发酵工艺条件后表面活性素产量提高48.2%。乔俊卿等[25]优化芽孢杆菌工程菌株B9BD发酵培养基后的表面活性素产量提高5.6倍。
本研究以一株产表面活性素的生防B.subtilis G10菌株为研究对象,利用酸沉淀和甲醇抽提法相结合提取表面活性素,对其表面活性及抑菌性能进行测定,并通过单因素试验和正交试验优化B.subtilis G10合成表面活性素的发酵条件及培养基组成,以期提高菌株B.subtilis G10发酵表面活性素的产量,为该菌株的生防研究和应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
枯草芽孢杆菌(Bacillus subtilis)G10、酿酒酵母(Saccharomyces cerevisiae)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus):由河南大学微生物学实验室提供保藏。
1.1.2 试剂
葡萄糖(分析纯):北京奥博星生物技术有限责任公司;L-谷氨酸、MgSO4、KCl、KH2PO4和MnSO4(均为分析纯):北京索莱宝科技有限公司;甲醇、FeSO4·7H2O、CuSO4·5H2O、盐酸(均为分析纯):天津市科密欧化学试剂有限公司。
1.1.3 培养基
菌种活化和保藏培养基为LB培养基[26]。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母抽提物10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 L,pH自然。
发酵培养基为Landy液体培养基:葡萄糖20 g,L-谷氨酸5 g,MgSO4 0.5 g,KCl 0.5 g,KH2PO4 1 g,FeSO4·7H2O 0.15 g,MnSO4 0.5 g,CuSO4·5H2O 0.16 g,蒸馏水1 L,pH 7[27],均于105 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
GR60DA高压蒸汽灭菌锅:美国致微公司;Re-5298旋转蒸发仪:上海亚荣生化仪器厂;LRH-250恒温培养箱:上海一恒科学仪器有限公司;imark酶标仪:美国伯乐公司;FA124分析天平:上海舜宇恒平科学仪器有限公司;H-1850R高速冷冻离心机:湖南湘仪设备有限公司;QHZ-98A全温度振荡培养箱:太仓华大实验仪器科技有限公司。
1.3 方法
1.3.1 表面活性素粗提物的制备
菌种活化:将B.subtilis G10菌株先接种于LB固体培养基活化,28 ℃培养16~18 h;然后接种LB液体培养基进行摇瓶扩大培养,转速150 r/min,28 ℃恒温培养16~18 h,菌悬液4 ℃保藏备用。
表面活性素的提取:将活化菌种接种于Landy液体培养基,28 ℃恒温,150 r/min摇瓶发酵48 h,培养完毕后,将菌悬液4 ℃,8 000 r/min离心30 min,收集上清液;上清液用盐酸调节pH值为2.0,放置4 ℃冰箱内过夜,然后离心,条件同上,收集沉淀[22]。用2 mol/L氢氧化钠将沉淀调至pH为7.0,真空冷冻干燥,加入甲醇抽提,得到表面活性素的甲醇溶液,利用旋转蒸发仪蒸干甲醇,得到生物表面活性素粗提物。
1.3.2 表面活性素表面活性检测
取直径为9 cm的培养皿,倒入40 mL蒸馏水,放置于桌面,在其中央滴入20 μL原油,原油会在水面上形成一个圆形油膜,取表面活性素提取液20 μL滴入油膜中心,盖上皿盖,透过皿盖用直尺测量其排油圈直径。
1.3.3 表面活性素的抑菌活性试验
以酿酒酵母(Saccharomyces cerevisiae)、大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)作为测试表面活性素抑菌活性的目标菌。分别将E.coli和S.aureu先接种于LB固体培养基活化,37 ℃培养16~18 h;然后接种LB液体培养基进行摇瓶扩大培养,转速150 r/min,37℃恒温培养16~18 h,菌悬液4 ℃保藏备用。将S.cerevisiae接种YPD培养基活化;将S.cerevisiae菌株先接种于YPD固体培养基活化,28 ℃培养16~18 h;然后接种YPD液体培养基进行摇瓶扩大培养,转速150 r/min,28 ℃恒温培养16~18 h;活化后的菌种调整浓度为108CFU/mL菌悬液,4℃保藏备用。
取E.coli和S.aureus菌悬液各0.2 mL涂布LB培养基平板,取S.cerevisiae菌悬液0.2 mL涂布YPD培养基平板;在三者平板内各加入3个牛津杯(相隔距离相等),在每个平板的牛津杯内分别加入50 μL、100 μL、150 μL的表面活性素提取液,E.coli和S.aureus 37 ℃恒温培养,S.cerevisiae 28 ℃恒温培养48 h。对照组中的牛津杯加等量无菌水,测定抑菌圈直径。试验重复3次。
1.3.4 表面活性素发酵条件优化
将以上活化的B. subtilis G10菌悬液以5%的接种量接种于盛有Landy液体培养基的三角瓶中,培养基装液量30 mL/250 mL,培养条件固定为发酵培养转速150 r/min,发酵培养基初始pH 7,培养温度为28 ℃振荡培养48 h。分别对发酵转速(150 r/min、200 r/min、220 r/min、240 r/min)、发酵培养基初始pH(6.0、6.5、7.0、7.5、8.0)和发酵温度(25 ℃、28 ℃、30 ℃、37 ℃、40 ℃)进行优化,培养结束提取表面活性素,测定其产量。
1.3.5 表面活性素发酵培养基组成优化
固定发酵条件为B.subtilis G10菌株悬液接种量为5%,培养基装液量为30 mL/250 mL,发酵培养基初始pH值为7.5、转速为200 r/min,发酵温度为30 ℃,发酵时间48 h。
单因素试验:以Landy培养基为基础培养基,分别以质量浓度为20 g/L的蔗糖、淀粉、果糖、甘露醇替换葡萄糖,其他成分不变;分别以质量浓度为5.0 g/L的牛肉膏、蛋白胨、酵母抽提物和NH4Cl替换L-谷氨酸,其他成分不变;分别将发酵培养基中MgSO4、KCl、FeSO4·7H2O、MnSO4和CuSO4·5H2O的添加量增加30%,其他成分不变。在单因素试验结果的基础上,分别考察葡萄糖添加量、L-谷氨酸添加量、MnSO4添加量对表面活性素产量的影响。
正交试验:根据单因素试验结果,选择葡萄糖添加量(A)、L-谷氨酸添加量(B)和MnSO4添加量(C)3个影响显著的因素进行L9(34)正交试验设计,以表面活性素产量为评价指标,获得表面活性素发酵最佳培养基组成。正交试验设计因素与水平见表1。
表1 发酵培养基组成优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation medium components optimization
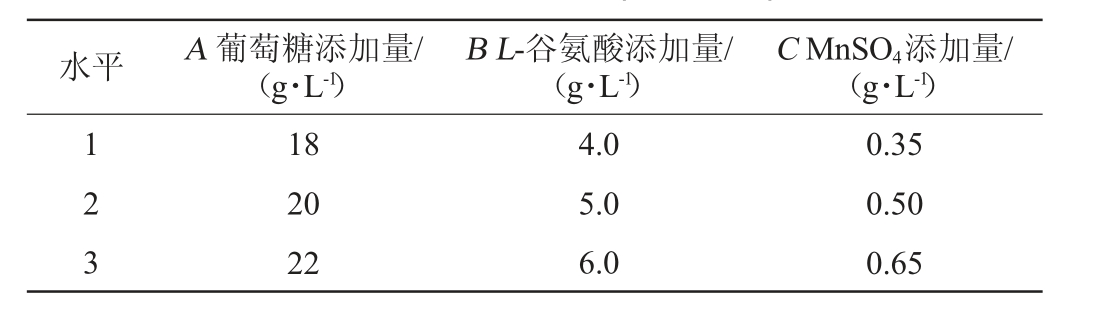
水平 A 葡萄糖添加量/(g·L-1)B L-谷氨酸添加量/(g·L-1)C MnSO4添加量/(g·L-1)1 2 3 18 20 22 4.0 5.0 6.0 0.35 0.50 0.65
1.3.6 数据分析
试验采用Excel 2007对数据进行统计分析。
2 结果与分析
2.1 表面活性素表面活性测定
B.subtilis G10菌株产表面活性素排油圈活性见图1。
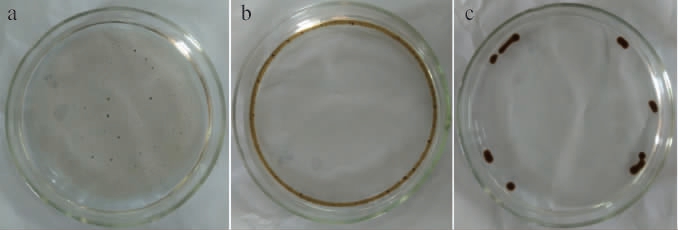
图1 枯草芽孢杆菌G10产表面活性素排油圈活性
Fig.1 Exclusive oil circle activity of surfactin produced by Bacillus subtilis G10
由图1a可知,当原油滴入培养皿中形成平均直径约7 cm的褐色半透明油膜。由图1b可知,将表面活性素提取液加入后,其表现出很明显的表面活性,油膜迅速向边缘扩散,形成一条紧贴培养皿壁的原油带。由图1c可知,后油带断裂,渐渐凝聚成黑色的油珠。
2.2 表面活性素的抑菌活性
表面活性素提取液对E.coli、S.aureus和S.cerevisiae的抑制作用见表2。由表2可知,表面活性素对E.coli和S.aureus平均抑菌直径分别为1.8 cm和1.9 cm;表面活性素对S.cerevisiae的平均抑菌直径为1.4 cm。结果表明,表面活性素对细菌抑制作用相对强,对真菌的抑制作用相对弱。
表2 表面活性素提取液对菌株的抑菌圈直径检测结果
Table 2 Determination results of antibacterial activity of surfactin extract on strains cm
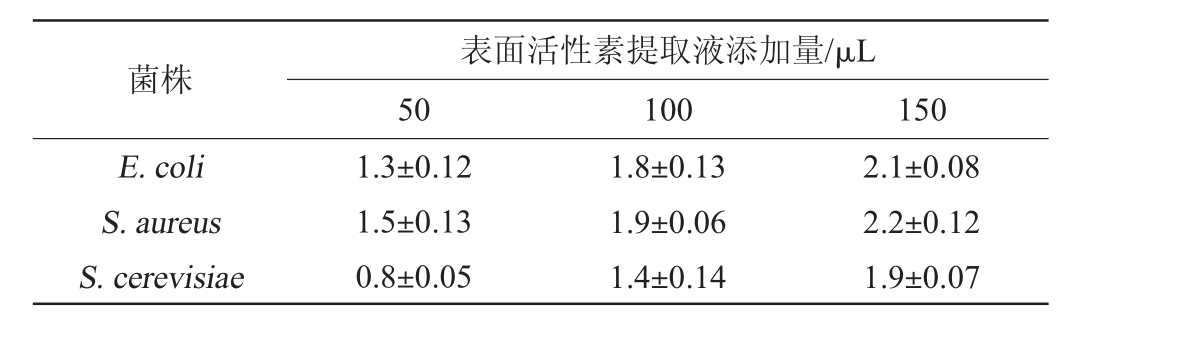
菌株E.coli S.aureus S.cerevisiae表面活性素提取液添加量/μL 50 100 150 1.3±0.12 1.5±0.13 0.8±0.05 1.8±0.13 1.9±0.06 1.4±0.14 2.1±0.08 2.2±0.12 1.9±0.07
2.3 培养条件优化单因素试验结果
2.3.1 转速对表面活性素产量的影响
转速对表面活性素产量影响见图2。由图2可知,当转速为150~200 r/min时,表面活性素产量逐渐增加;当转速为200 r/min时,表面活性素产量最高,为8.84 g/L;当转速>200 r/min时,表面活性素产量降低。因此,确定培养B.subtilis G10菌株的最佳转速为200 r/min。
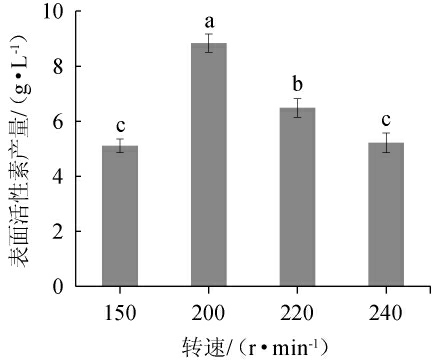
图2 转速对表面活性素产量的影响
Fig.2 Effect of rotational speed on surfactin yield
小写字母表示差异显著(P<0.05)。下同。
2.3.2 初始pH值对表面活性素产量的影响
初始pH值对表面活性素产量影响见图3。由图3可知,当初始pH值为6.0~7.5时,表面活性素产量逐渐增加;当初始pH值为7.5时,表面活性素产量最高,为8.989 g/L;当初始pH值>7.5时,表面活性素产量下降。因此,确定初始pH值为7.5。
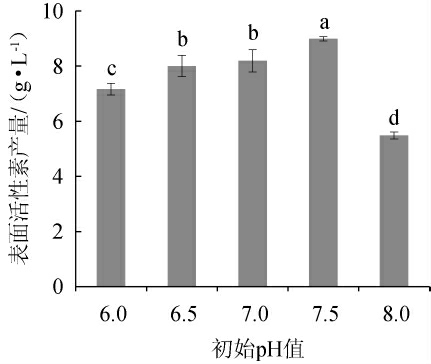
图3 初始pH值对表面活性素产量的影响
Fig.3 Effect of pH on surfactin yield
2.3.3 发酵温度对表面活性素产量的影响
发酵温度对表面活性素产量影响见图4。由图4可知,当发酵温度为25~30 ℃时,表面活性素产量逐渐增加;当发酵温度为30 ℃时,表面活性素产量达到最高,为9.110 g/L;当发酵温度>30 ℃时,表面活性素产量下降。因此,确定最佳发酵温度为30 ℃。
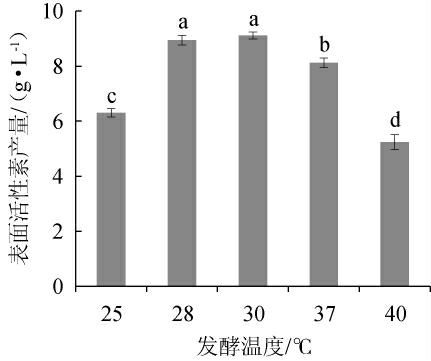
图4 发酵温度对表面活性素产量的影响
Fig.4 Effect of fermentation temperature on surfactin yield
2.4 培养基组成优化单因素试验结果
2.4.1 碳源对表面活性素产量的影响
碳源对表面活性素产量的影响见图5。
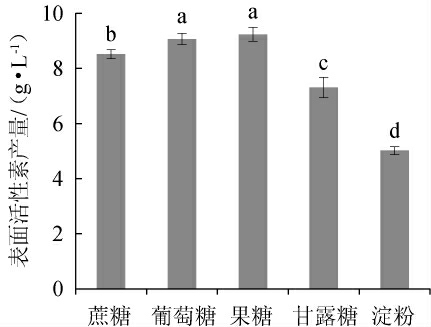
图5 碳源对表面活性素产量的影响
Fig.5 Effect of carbon source on surfactin yield
由图5可知,以葡萄糖和果糖作为碳源时,表面活性素产量较高,分别为9.063 g/L和9.231 g/L,两者没有显著性差异(P>0.05);以蔗糖和甘露糖为碳源时,表面活性素产量较低,分别为8.520 g/L和7.310 g/L;以淀粉为碳源时,表面活性素产量最低。因此,确定最佳碳源为葡萄糖。
2.4.2 氮源对表面活性素产量的影响
氮源对表面活性素产量的影响见图6。由图6可知,以L-谷氨酸为氮源时,该菌株表面活性素产量最高,为8.989 g/L;以酵母抽提物为氮源,其表面活性素产量显著高于蛋白胨、牛肉膏(P<0.05);以NH4Cl为氮源时,其产量最低,为2.895 g/L。因此,确定最佳氮源为L-谷氨酸。
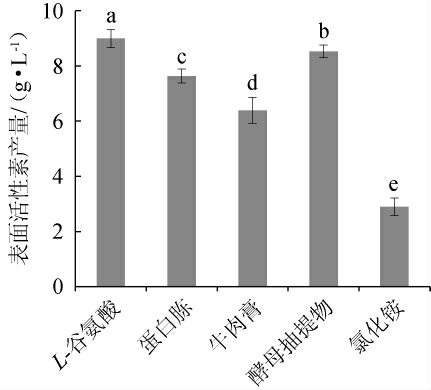
图6 氮源对表面活性素产量的影响
Fig.6 Effect of nitrogen source on surfactin yield
2.4.3 无机盐对表面活性素产量的影响
无机盐对表面活性素产量的影响见图7。由图7可知,对照组表面活性素产量为8.882 g/L,增加Cu2+和Fe2+的量对表面活性素合成有抑制作用,表面活性素产量分别为6.865 g/L和7.537 g/L;增加Mn2+与Mg2+量时,对表面活性素产量有促进作用,分别为9.236 g/L和9.129 g/L;通过对试验分析,增加Landy培养基中Mn2+或Mg2+的量,可适当提高表面活性素产量,MnSO4添加量增加对表面活性素表量影响最大。
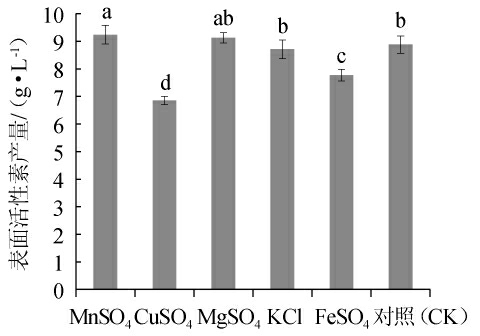
图7 无机盐对表面活性素产量的影响
Fig.7 Effect of inorganic salt on surfactin yield
2.5 发酵培养基组成优化正交试验结果与分析
选择A(葡萄糖添加量)、B(L-谷氨酸添加量)和C(MnSO4添加量)3个影响显著的因素为评价因素,以表面活性素产量为评价指标进行3因素3水平的正交试验设计,正交试验结果与分析见表3,方差分析见表4。
表3 发酵培养基组成优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for fermentation medium composition optimization
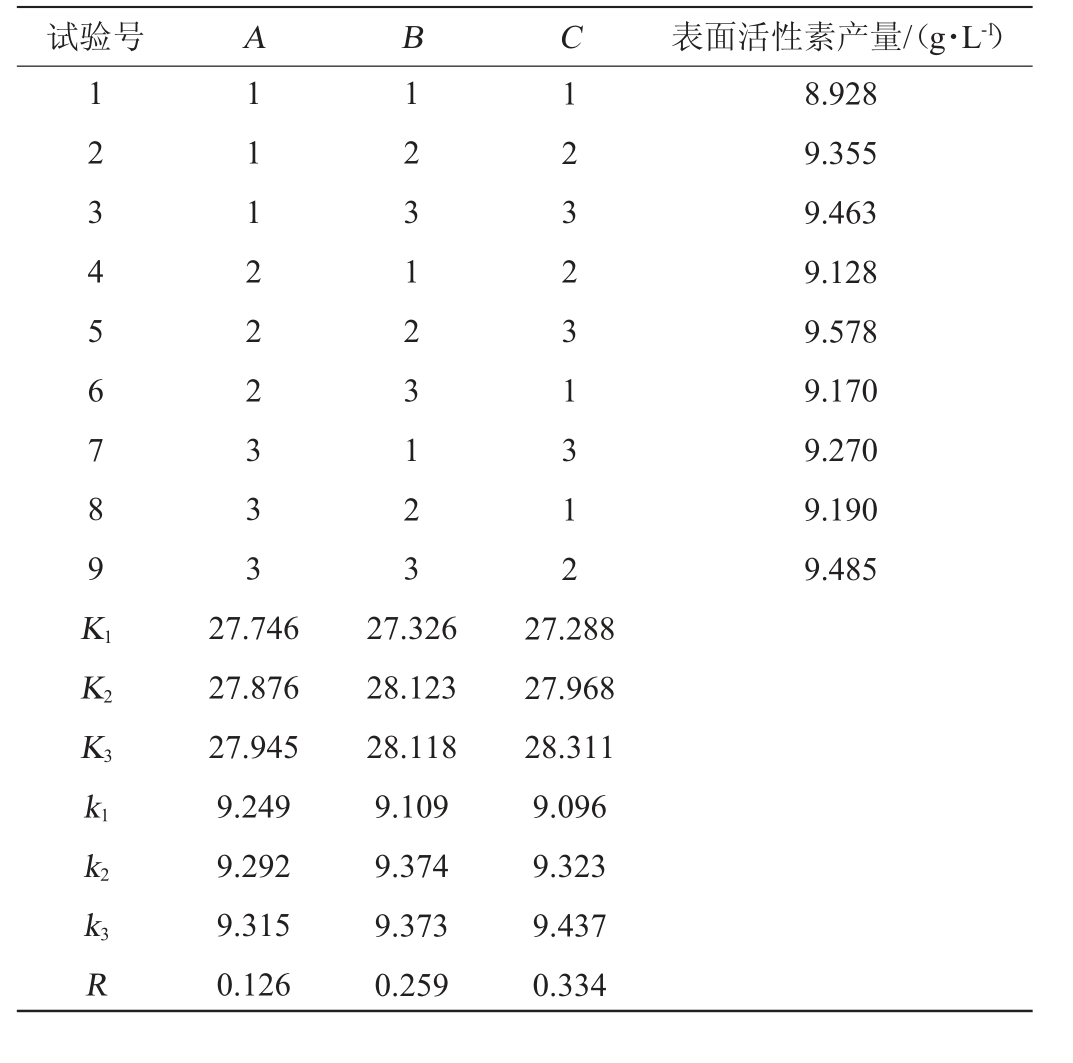
试验号 A B C 表面活性素产量/(g·L-1)1 2 3 4 5 6 7 8 9 K1 K2 K3 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 8.928 9.355 9.463 9.128 9.578 9.170 9.270 9.190 9.485 k1 k2 k3 R 27.746 27.876 27.945 9.249 9.292 9.315 0.126 27.326 28.123 28.118 9.109 9.374 9.373 0.259 27.288 27.968 28.311 9.096 9.323 9.437 0.334
表4 正交试验结果方差分析
Table 4 Variance analysis of orthogonal experiment results
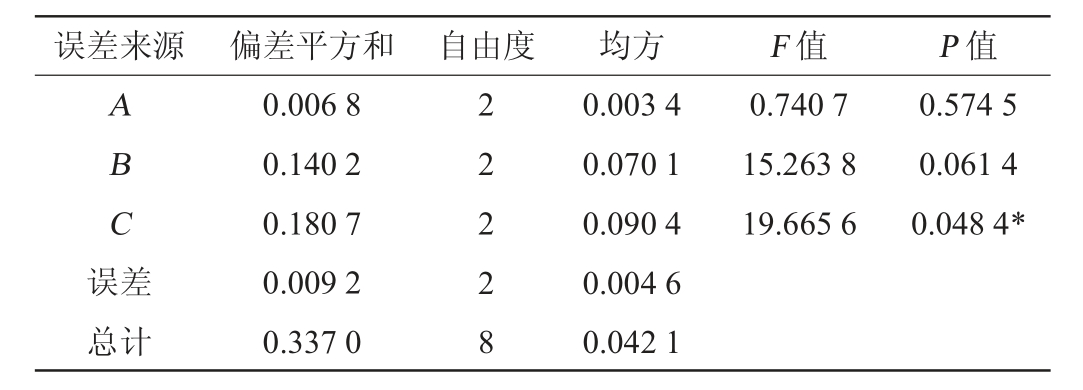
注:“*”表示对结果影响显著(P<0.05)。
误差来源 偏差平方和 自由度 均方 F 值 P 值A B C误差0.740 7 15.263 8 19.665 6 0.574 5 0.061 4 0.048 4*总计0.006 8 0.140 2 0.180 7 0.009 2 0.337 0 2 2 2 2 8 0.003 4 0.070 1 0.090 4 0.004 6 0.042 1
对B.subtilis G10菌株表面活性素产量影响的3个因素主要次序为C>B>A,添加MnSO4对表面活性素产量有显著影响(P<0.05),L-谷氨酸的影响次之,葡萄糖影响最小。最佳培养基组合方案为A3B2C3,即葡萄糖添加量22 g/L,L-谷氨酸添加量5.0 g/L和MnSO4添加量0.65 g/L。因正交试验未涉及此A3B2C3组合,需要对此组合方案进行试验验证。利用优化后的条件对菌株B.subtilis G10进行发酵,测定表面活性素的产量,试验重复3次,在该优化条件下得到表面活性素产量为9.89 g/L,验证结果表面活性素产量比正交试验其他组合高,表明该工艺可行。
3 结论
本研究利用酸沉降和甲醇抽提法相结合分离纯化得到表面活性素粗提物,经排油圈法检测表面活性素有较好的表面活性;表面活性素对E.coli、S.aureus和S.cerevisiae细菌和真菌都有一定的抑制作用;通过单因素分析及正交试验优化了B.subtilis G10菌株合成表面活性素的发酵工艺条件。优化后的发酵条件为:发酵培养基起始pH值为7.5,摇瓶转速为200 r/min,培养温度为30 ℃;培养基组分为:葡萄糖22 g/L,L-谷氨酸5.0 g/L,MgSO4 0.5 g/L,KCl 0.5 g/L,KH2PO4 1 g/L,FeSO4·7H2O 0.15 g/L,MnSO4 0.65 g/L,CuSO4·5H2O 0.16 g/L。在此优化条件下发酵表面活性素的平均产量为9.89 g/L,其产量提高了46.7%。这说明研究中采用的优化策略可以有效提高菌株的表面活性素产量。
[1] REGINEA M D, MARIUSA P.Interfacial properties of surfactin[J].J Colloid Interf Sci,1992,153(1):285-291.
[2] FUJITA S, YOKOTA K.Disease suppression by the cyclic lipopeptides iturin A and surfactin from Bacillus spp.against Fusarium wilt of lettuce[J].J Gen Plant P,2019,85(1):44-48.
[3]LUO C P,ZHOU H F,ZOU J C,et al.Bacillomycin L and surfactin contribute synergistically to the phenotypic features of Bacillus subtilis 916 and the biocontrol of rice sheath blight induced by Rhizoctonia solani[J].Appl Microbiol Biotechnol,2015,99:1897-1910.
[4] LAIRD M, PICCOLI D, WESELOWSKI B, et al.Surfactin-producing Bacillus velezensis 1B-23 and Bacillus sp.1D-12 protect tomato against bacterial canker caused by Clavibacter michiganensis sub sp.michiganensis[J].J Plant Pathol,2020,102(2):451-458.
[5]谢鑫,张踞林,王红宁,等.芽孢杆菌中天然脂肽类抗生素的合成及作用机制研究进展[J].中国抗生素杂志,2021,46(5):362-370.
[6]KAKINUMA A,OUCHIDA A,SHIMA T,et al.Confirmation of the structure of surfactin by mass spectrometry[J].Agr and Biol Chem,1969,33(11):1669-1671.
[7]CHEN W C,JUANGRS,WEI Y H.Applications of a lipopeptide biosurfactant,surfactin,produced by microorganisms[J].Biochemi Eng J,2015,103:158-169.
[8]TANK J G,PANDY R V.Anti-proliferative activity of surfactins on human cancer cells and their potential use intherapeutics[J].Peptides,2022,155:170836.
[9]WEN C Y,YIN Z G,WANG K X,et al.Purification and structural analysis of surfactin produced by endophytic Bacillus subtilis EBS05 and its antagonistic activity against Rhizoctonia cerealis[J].Plant Pathol J,2011,27(4):342-348.
[10]郭蔓,张朝正,赵华.贝莱斯芽孢杆菌抑尖孢镰刀菌脂肽类物质的鉴定[J].中国酿造,2021,40(12):35-39.
[11]任鹏举,谢永丽,张岩,等.枯草芽孢杆菌OKB105产生的surfactin防治烟草花叶病毒病及其机理研究[J].中国生物防治学报,2014,30(2):216-221.
[12] WANG Y, TIAN J H, SHI F F, et al.Protective effect of surfactin on copper sulfate-induced inflammation,oxidative stress,and hepatic injury in zebra fish[J].Microbiol Immun,2021,65:410-421.
[13] SILVEIRA T C, GOMES W E, TONON G C, et al.Residual biomass from surfactin production is a source of arginase and adsorbed surfactin that is useful for environmental remediation[J].World J Microbiol Biot,2021,37:123-130.
[14] PINKAS D, FISER R, KOZLIK P, et al. Bacillus subtilis cardiolipin protects its own membrane against surfactin induced perme abilization[J].BBA Biomembranes,2020,1862(10):183405.
[15] JOVANA D, SBASTIEN L, FRANOIS C, et al.Mycosubtilin and surfactin are efficient,low ecotoxicity molecules for the biocontrol of lettuce downy mildew[J].Appl Microbiol Biot,2014,98(14):6255-6264.
[16]ALINE W Z,ALEXSANDRA V,CCRISTINO J A,et al.New sustainable alternatives to reduce the production costs for surfactin 50 years after the discovery[J].Appl Microbiol Biot,2019,103(21):8647-8656.
[17] ANDRADE C J,BRROS F F C, ANDRADE L M, et al.Ultrafiltration based purification strategies for surfactin produced by Bacillus subtilis LB5A using cassava wastewater as substrate[J].J Chem Technol Biot,2016,91(12):3018-3027.
[18]王俊芳,王淼.枯草芽孢杆菌ComQXPA群体感应系统及其潜在生防应用[J].河南农业科学,2019,48(6):8-13.
[19]CLAUDIA P M,KASCHUK J J,FROLLINI E,et al.Potential use of the liquor from sisal pulp hydrolysis as substrate for surfactin production[J].Ind Crop Prod,2016,66:239-245.
[20]HA S,KIM H M,CHUM H H,et al.Effect of oxygen supply on surfactin production and sporulation in submerged culture of Bacillus subtilis Y9[J].Appl Sci,2018,8(9):1660-1668.
[21]陈亮,毛晶晶,宇光海,等.响应面法优化Bacillus subtilis抗菌脂肽发酵工艺条件[J].食品科技,2015,40(4):17-21.
[22]姚树林,陆兆新,吕凤霞,等.Taguchi法优化Bacillus amyloliquefaciens fmb50产surfactin工业发酵培养基[J].北京化工大学学报(自然科学版),2012,39(4):77-83.
[23]张晓云,郭庆港,王培培,等.不同碳氮源对枯草芽胞杆菌BAB-1产抗菌脂肽的影响[J].中国生物防治学报,2021,37(2):251-258.
[24]乔俊卿,刘邮洲,张荣胜,等.枯草芽胞杆菌T-500产脂肽类抗生素的摇瓶发酵工艺优化[J].南京农业大学学报,2018,41(3):447-455.
[25]乔俊卿,孙凯,刘永锋,等.芽胞杆菌工程菌株B9BD产表面活性素发酵培养基优化[J].中国生物防治学报,2022,38(2):383-392.
[26]沈萍,陈向东.微生物学试验[M].北京:高等教育出版社,2018:58-59.
[27]张颖,王俊芳.芝麻立枯病生防菌G10菌株生防特性分析[J].江苏农业科学,2018,46(9):87-90.