我国茶叶种植历史悠久,茶叶的种类及种植面积均居于世界前列,拥有源远流长的茶文化[1]。茶叶中的营养成分丰富,包括茶多酚、茶多糖、咖啡因、茶氨酸、矿物质、维生素等[2-3]。近年来,随着枸杞(Lycium barbarum)的营养健康产品逐步开发,枸杞芽叶的养生价值日益受到重视。枸杞芽叶中富含多酚、黄酮、枸杞多糖、类胡萝卜素等多种功能成分,部分成分含量甚至高于枸杞果实[4-5]。枸杞芽茶保留了芽尖所含的功能成分,具有抗氧化、降血脂、抑菌以及保肝等多种功效作用[6-7],此外,玉米须中含有丰富的多酚、黄酮类、多糖、生物碱等物质,能够与枸杞芽茶中的活性成分共同消除活性氧自由基,具有强的抗氧化活性[8]。目前,枸杞芽叶以初加工产品为主,深加工产品的研发较少,阻碍了对其功能物质的开发和利用[9]。
茶醋是一款茶叶养生饮品,具有很好的保健作用,具有广阔的潜在市场[10]。近年来,由于国家对宁夏现代枸杞全产业链升级发展的大力支持,枸杞产业得到了多样化发展的推动,这也促进了枸杞深加工产品的研发。目前,关于枸杞深加工产品的研究主要集中在枸杞果醋工艺优化,然而有关枸杞茶醋的研究报道较少[11]。XIA T等[12]以枸杞鲜果为原料发酵制备枸杞果醋,并对其发酵工艺进行研究。结果表明,最佳发酵工艺为醋酸菌接种量10%,发酵温度30 ℃,发酵时间5 d,在此条件下,果醋的总酸度最高,为6.72 g/100 mL。经发酵后,多酚和黄酮类物质含量分别增加29.4%和65.7%,且抗氧化活性增强。孟芳等[13]以枸杞干果为原料酿造枸杞果醋,并通过响应面分析法进行工艺优化。结果表明,枸杞果醋的最佳发酵工艺条件为:醋酸菌接种量6%,发酵温度30 ℃,初始pH值为5.5,在此条件下,感官评分(83.5分)和总酸(4.93 g/100 mL)最高。
为了促进枸杞深加工产品的多元化,本研究以宁夏无果枸杞芽茶为主要原料,进行茶醋产品的深加工开发研究,采用单因素试验优化其醋酸发酵工艺,并对其功能活性成分及抗氧化活性进行研究,以期为枸杞茶醋产品的研发提供实验依据,推动枸杞深加工产业的进一步发展。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
枸杞芽茶、玉米须(鲜):宁夏香草生物技术有限公司;酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司;巴氏醋杆菌(Acetobacter pasteurianus)AC-2005:本实验室。
1.1.2 试剂
氢氧化钠、酚酞(均为分析纯):无锡市晶科化工有限公司;白砂糖(食品级):济南源飞伟业化工有限公司;柠檬酸(分析纯):苏州恒锐化工原料有限公司;酵母膏(生化试剂):武汉吉业升化工有限公司;福林酚(分析纯):四川省维克奇生物科技有限公司;无水乙醇(分析纯):广州市华欣化工科技有限公司;无水碳酸钠(分析纯):潍坊海之源化工有限公司;亚硝酸钠(分析纯):广州市宜生贸易有限公司;硝酸铝(分析纯):山东旭光化工有限公司。
1.1.3 培养基
醋酸发酵培养基[14]:酵母膏2%、葡萄糖2%,121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
BSA124S高精度电子天平:广东正一实验装备有限公司;JC-1086A全波长酶标仪:青岛聚创环保集团有限公司;AXTG16G台式高速离心机:盐城市安信实验仪器有限公司;DZKW-C电热恒温水浴锅:河南沃林仪器设备有限公司;PB-10 pH计(精确度为0.01):广东正一实验装备有限公司;WZS S1手持折光仪:佛山南北潮电子商务有限公司;JCMJG18L高压灭菌锅:青岛精诚仪器仪表有限公司。
1.3 方法
1.3.1 枸杞茶醋发酵工艺
枸杞芽茶、玉米须→浸提→混合→调糖、调酸→酒精发酵→醋酸发酵→离心、调配→灭菌、装罐→枸杞茶醋成品
操作要点:
枸杞茶汤的制备:将枸杞芽茶粉碎,过60目筛,以茶水质量比1∶40(g∶mL)加入蒸馏水,60℃水浴条件下浸提30 min,浸提后进行过滤,得到枸杞茶汤。
玉米须浆水提液制备:将玉米须用清水洗净后,取300 g加入1 L蒸馏水打浆,得到玉米须浆,将其于1 L蒸馏水中浸泡并煎煮15 min,取煎煮液进行过滤,得到玉米须浆水提液。
混合:将枸杞茶汤与玉米须浆水提液按体积比2∶1混合得到枸杞茶混合液。
调糖、调酸:在枸杞茶混合液中加入一定量的白砂糖将糖度调至22~24°Bx,用50%柠檬酸溶液调整pH至5.0。
酒精发酵:加入0.2%酿酒酵母,20 ℃条件下进行酒精发酵,当总糖含量<5 g/L时,发酵结束,得枸杞茶酒(初始pH、酒精度分别是3.5、9%vol)。
醋酸发酵:取枸杞茶酒作为发酵液,向发酵液中加入10%巴氏醋杆菌AC-2005,30 ℃条件下进行醋酸发酵,发酵6 d,得到枸杞茶醋。
离心、调配:将枸杞茶醋进行离心(8 000 r/min、10 min)处理,得到澄清醋液,加入5%白砂糖进行调配。
灭菌、装罐:在35~45 ℃、140~160 MPa条件下进行均质杀菌处理,并在无菌条件下,装入无菌包装容器中,即得枸杞茶醋成品。
1.3.2 枸杞茶醋醋酸发酵工艺优化单因素试验
在1.3.1工艺条件的基础上,考察初始酒精度(6%vol、7%vol、8%vol、9%vol、10%vol)、醋酸菌接种量(4%、7%、10%、13%、16%)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、初始pH(2.5、3.0、3.5、4.0、4.5)对枸杞茶醋总酸含量的影响。
1.3.3 枸杞茶醋醋酸发酵工艺优化正交试验
在单因素试验的基础上,以枸杞茶醋的总酸含量为评价指标,以初始酒精度(A)、醋酸菌接种量(B)、发酵温度(C)、初始pH值(D)为考察因素,采用正交试验设计4因素3水平的正交试验,从而确定枸杞茶醋的最优醋酸发酵工艺。正交试验因素与水平见表1。
表1 枸杞茶醋醋酸发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for Lycium barbarum tea vinegar fermentation process optimization

水平 A 初始酒精度/%vol B 醋酸菌接种量/%C 发酵温度/℃ D 初始pH值1 2 3 8 9 1 0 7 10 13 28 30 32 3.0 3.5 4.0
1.3.4 功能活性成分的测定
总酚含量的测定:采用福林酚法,结果以mg没食子酸当量(gallic acid equivalent,GAE)/mL表示[15];总黄酮含量的测定:参考文献[16],结果以mg芦丁当量(rutin equivalen,RE)/mL表示;甜菜碱、类胡萝卜素含量的测定:参考文献[17]。
1.3.5 体外抗氧化活性分析
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率的测定:参考文献[18];2,2'-联氮-双-3-乙基-苯并噻唑-6-磺酸(2,2'-azino-bis(3-ethylben zthiazoline-6-sulfonic acid),ABTS)自由基清除率的测定:参照文献[19];铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)的测定:参考文献[20]。
1.3.6 理化指标测定
pH值测定:使用pH计;总酸含量的测定:参照GB/T 12456—2008《食品中总酸的测定》的滴定法;还原糖含量的测定:参考GB/T 5009.7—2008《食品中还原糖的测定》的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法;可溶性固形物含量的测定:使用手持折光仪。
1.3.7 数据分析
采用GraphPad Prism 8.0.1进行数据处理和制图,采用SPSS 19.0软件进行方差分析。
2 结果与分析
2.1 枸杞茶醋醋酸发酵工艺优化
2.1.1 初始酒精度对总酸含量的影响
醋酸菌可利用乙醇脱氢酶先将乙醇分解为乙醛,最后经乙醛脱氢酶分解为乙酸,从而使醋酸菌获得能量和生长所需的碳源。因此,乙醇在醋酸菌生长代谢过程中发挥重要[21]。不同初始酒精度对总酸含量的影响见图1。
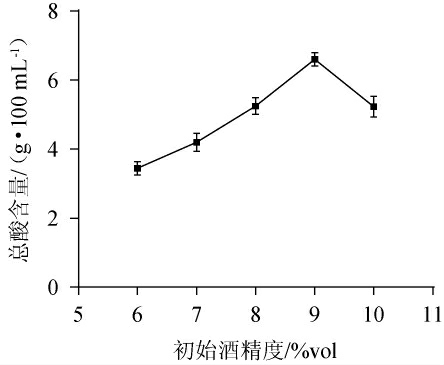
图1 初始酒精度对枸杞果醋醋酸发酵的影响
Fig.1 Effect of initial alcohol content on acetic acid fermentation of Lycium barbarum tea vinegar
由图1可知,当初始酒精度为6%vol~9%vol时,总酸含量随着酒精度的增加而增加;当初始酒精度为9%vol时,总酸含量达到最大值6.60 g/100 mL;当初始酒精度>9%vol之后,总酸含量呈下降趋势。分析原因可能是初始酒精度过低,醋酸菌繁殖速度较慢,产酸能力较低,一定程度上增加酒精度会增强相关酶活性,从而为醋酸菌生长创造良好条件;初始酒精度过高,醋酸菌的活性受到抑制,从而导致产酸量减少[22]。因此,确定最佳初始酒精度为9%vol。
2.1.2 醋酸菌接种量对总酸含量的影响
醋酸菌接种量的大小决定产酸量的多少,适当添加醋酸菌,醋酸发酵速率会随之增快,但接入过量的醋酸菌会使醋酸菌生长代谢过程中所需的营养物质增加,从而抑制醋酸发酵过程,导致醋酸含量下降[23-24]。因此,考察醋酸菌接种量对总酸含量的影响,结果见图2。
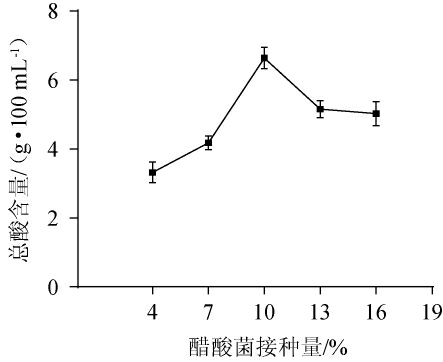
图2 醋酸菌接种量对枸杞茶醋醋酸发酵的影响
Fig.2 Effect of acetic bacteria inoculum on acetic acid fermentation of Lycium barbarum tea vinegar
由图2可知,当醋酸菌接种量为4%~10%时,随着接种量的增加,总酸含酸量呈上升趋势;当醋酸菌接种量为10%时,总酸含量最高可达6.64 g/100 mL;当醋酸菌接种量>10%之后,总酸含量呈下降趋势。醋酸菌接种量过高会使菌群过度积压,对有限的储备物质进行竞争,导致菌群生长代谢的不平衡,菌株代谢活动受阻,产酸量也随之下降[25]。因此,确定最佳醋酸接种量为10%。
2.1.3 发酵温度对总酸含量的影响
醋酸发酵的最适生长温度一般在28~32 ℃之间,不同的醋酸菌菌株对温度的适应性也会存在一定的差异[26]。因此,考察不同发酵温度对枸杞茶醋醋酸发酵产酸量的影响,结果见图3。
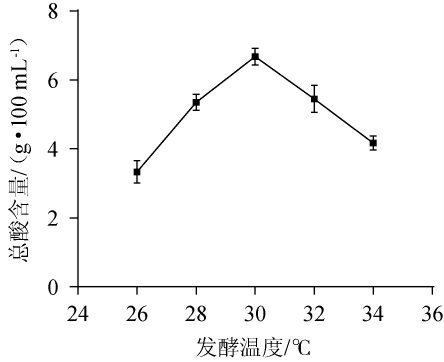
图3 发酵温度对枸杞茶醋醋酸发酵的影响
Fig.3 Effect of fermentation temperature on acetic acid fermentation of Lycium barbarum tea vinegar
由图3可知,当发酵温度在26~30 ℃之间,随着发酵温度的升高,总酸含量呈逐渐上升的趋势;当发酵温度为30 ℃时,总酸含量达到最高,为6.67 g/100 mL;当发酵温度>30 ℃之后,总酸含量呈下降趋势。这是由于温度过低时,一些醋酸菌内部酸性代谢酶的活性不能得到较好的激活,适当提高温度也能够刺激酶的活性,增强细胞膜渗透性,使得营养物质更容易进入细胞内,从而提高产酸量。但温度过高,使细胞代谢活动过快,从而增加了副产物的生成,影响了产酸[27]。为了使枸杞茶醋得到更高的总酸含量,选择最佳发酵温度为30 ℃。
2.1.4 初始pH值对总酸含量的影响
不同初始pH值对枸杞茶醋醋酸发酵产酸量的影响见图4。由图4可知,当初始pH值为2.5~3.5之间时,随着初始pH值的升高,产酸量呈上升趋势;当初始pH值为3.5时,总酸含量最高,为6.69 g/100 mL;当初始pH值>3.5之后,总酸含量逐渐下降。这是由于适宜的pH条件下,生长的细菌都能够正常进行代谢,但当pH过低时,会产生大量的抑制物,从而影响细菌的正常生长和代谢,进而降低产酸量;pH过高,抑制了醋酸菌的生长繁殖和代谢,导致产酸量下降[28]。因此,选择最佳初始pH值为3.5。
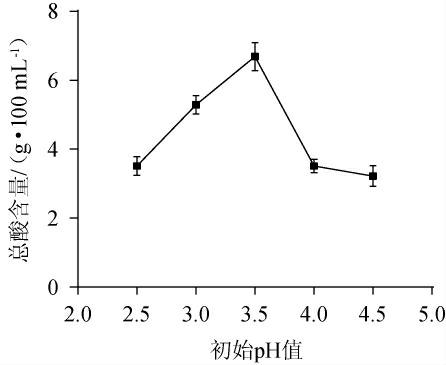
图4 初始pH值对枸杞茶醋醋酸发酵的影响
Fig.4 Effect of initial pH on acetic acid fermentation of Lycium barbarum tea vinegar
2.2 枸杞茶醋醋酸发酵工艺优化正交试验结果与分析
以单因素试验为基础,以总酸含量为评价指标,分别选取初始酒精度(A)、醋酸菌接种量(B)、发酵温度(C)和初始pH值(D),进行L9(34)正交试验,试验结果与分析见表2,方差分析见表3。
表2 枸杞茶醋醋酸发酵工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for Lycium barbarum tea vinegar fermentation process optimization
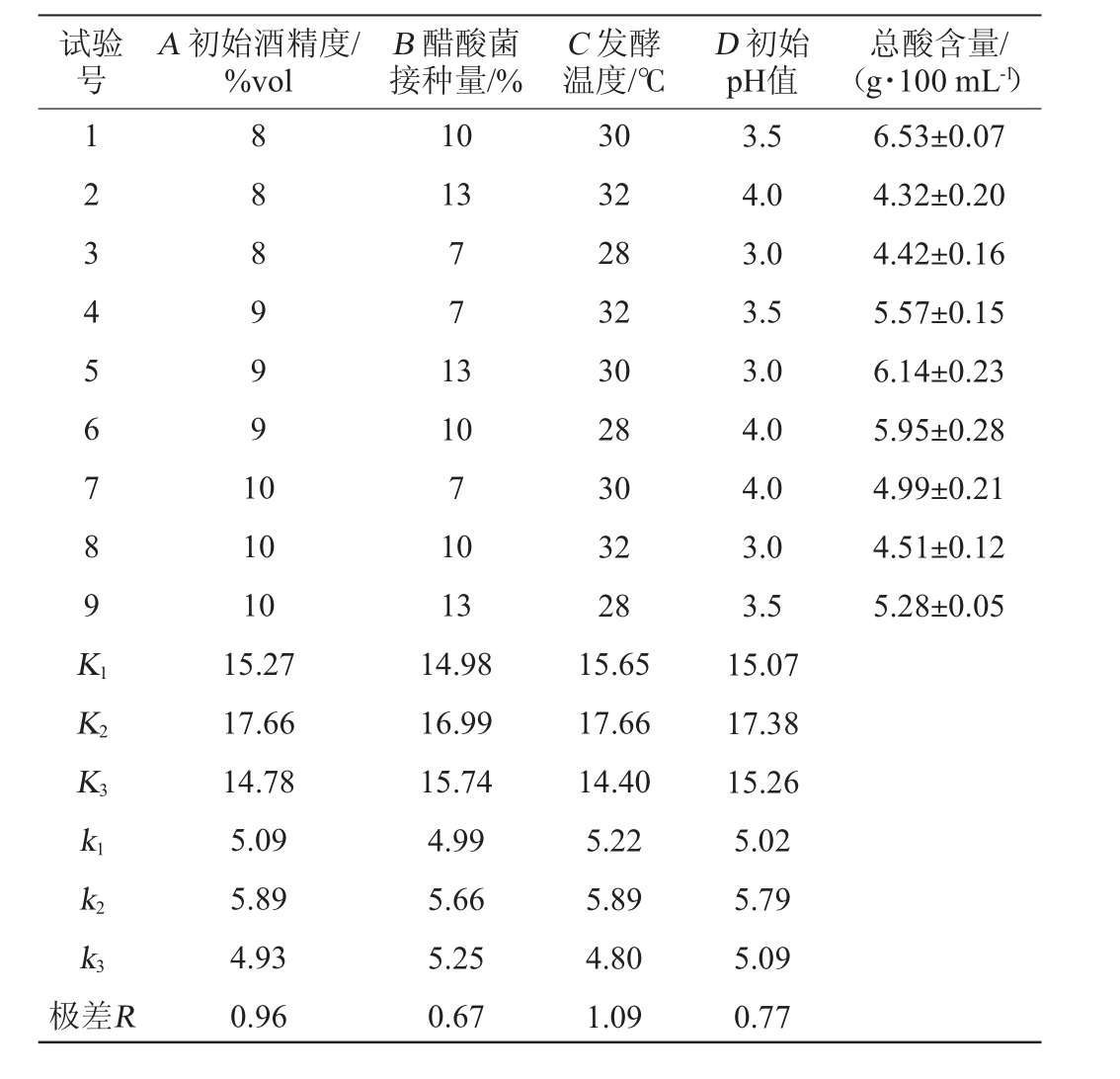
试验号A 初始酒精度/%vol B 醋酸菌接种量/%C 发酵温度/℃D 初始pH值总酸含量/(g·100 mL-1)1 2 3 4 5 6 7 8 9 K1 K2 K3 8 8 8 9 9 9 1 0 10 13 7 7 1 3 6.53±0.07 4.32±0.20 4.42±0.16 5.57±0.15 6.14±0.23 5.95±0.28 4.99±0.21 4.51±0.12 5.28±0.05 k1 k2 k3极差R 10 10 15.27 17.66 14.78 5.09 5.89 4.93 0.96 10 7 10 13 14.98 16.99 15.74 4.99 5.66 5.25 0.67 30 32 28 32 30 28 30 32 28 15.65 17.66 14.40 5.22 5.89 4.80 1.09 3.5 4.0 3.0 3.5 3.0 4.0 4.0 3.0 3.5 15.07 17.38 15.26 5.02 5.79 5.09 0.77
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal test results
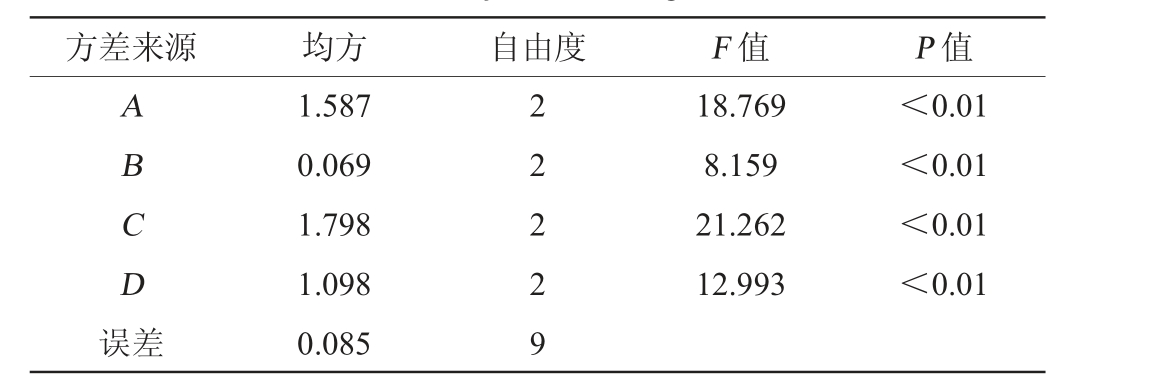
注:F0.05值=3.555。
方差来源 均方 自由度 F 值 P 值A B C D误差1.587 0.069 1.798 1.098 0.085 2 2 2 2 9 18.769 8.159 21.262 12.993<0.01<0.01<0.01<0.01
由表2可知,通过极差分析可知,影响枸杞茶醋总酸含量的因素从高至低依次为发酵温度、初始酒精度、初始pH值和醋酸菌接种量,最优发酵工艺组合为A2B2C2D2,即初始酒精度9%vol、醋酸菌接种量10%、发酵温度30 ℃、初始pH值3.5。
由表3可知,初始酒精度、醋酸菌接种量、发酵温度、初始pH值对枸杞茶醋总酸含量均有极显著影响(P<0.01),与极差分析结果一致,结果可信。经3次平行验证试验可知,采用组合A2B2C2D2发酵工艺得到的总酸含量为7.10 g/100 mL,高于1号试验组的总酸含量。因此,确定枸杞醋醋酸发酵的最优工艺条件:初始酒精度9%vol、醋酸菌接种量10%、发酵温度30 ℃、初始pH值3.5。
2.3 枸杞茶醋功能活性成分分析
枸杞茶富含多种有益成分,如多酚、黄酮、甜菜碱和类胡萝卜素,可以提供多种保健作用[29]。多酚被称为“天然抗氧化剂”,可以降低胆固醇、预防心血管疾病[30];总黄酮对人体有抗氧化、降低胆固醇、抗癌等作用[31];甜菜碱是一种维生素B族成员VB14,具有代谢脂肪、增强肝脏功能、保护心脏等作用[32];类胡萝卜素是一种存在于植物中的营养素,在保护视力、提高免疫系统功能方面有显著功效[33],因此,测定枸杞茶醋发酵前后总酚、总黄酮、甜菜碱、类胡萝卜素的含量,结果见表4。由表4可知,枸杞茶混合液经过发酵后,总酚含量从0.75 mg GAE/mL显著升高至2.27 mg GAE/mL(P<0.05),这与杨杰[34]利用酵母菌和醋酸菌对百香果进行发酵后多酚的变化趋势相同。枸杞茶混合液经过发酵后,总黄酮含量从0.47 mg RE/mL显著上升至0.94 mg RE/mL(P<0.05),分析其原因可能是酵母和乙酸菌能够分解茶叶中的复杂化合物,特别是多酚类化合物,使其转化为可溶性的物质,这些物质包括黄酮和其他酚类化合物等,从而使总黄酮含量上升[35]。枸杞茶醋发酵前后甜菜碱的含量无显著变化(P>0.05)。枸杞茶混合液经过发酵后,类胡萝卜素含量从0.75 mg/mL显著下降为0.62 mg/mL(P<0.05),分析原因可能是类胡萝卜素作为抗氧化剂会与氧气反应,并逐渐转化成色素类物质,导致其含量下降。
表4 枸杞茶醋发酵前后功能活性成分含量的变化
Table 4 Changes of functional active components in Lycium barbarum tea vinegar before and after fermentation
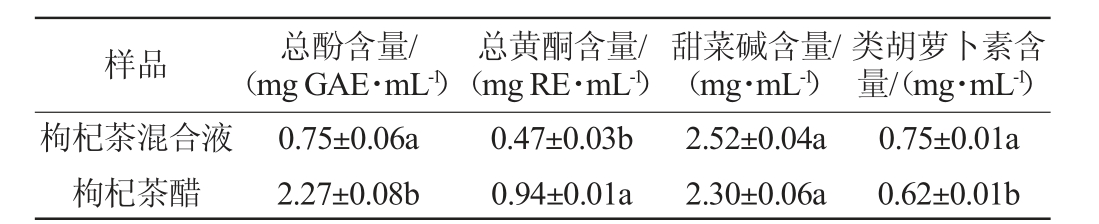
注:不同小写字母表示差异显著(P<0.05)。下同。
样品 总酚含量/(mg GAE·mL-1)类胡萝卜素含量/(mg·mL-1)枸杞茶混合液枸杞茶醋总黄酮含量/(mg RE·mL-1)甜菜碱含量/(mg·mL-1)0.75±0.06a 2.27±0.08b 0.47±0.03b 0.94±0.01a 2.52±0.04a 2.30±0.06a 0.75±0.01a 0.62±0.01b
2.4 枸杞茶醋体外抗氧化活性分析
抗氧化活性是指化合物在化学反应中能够减少或阻止氧的损伤或转化为其他物质的能力,具有抗氧化活性的化合物可以帮助减少自由基损伤,并保护细胞和组织的健康[36]。因此,通过测定DPPH、ABTS自由基清除率及FRAP评价枸杞茶醋的体外抗氧化活性,结果见表5。由表5可知,枸杞茶混合液经过发酵后,DPPH、ABTS自由基清除率和FRAP显著上升(P<0.05),枸杞茶醋的DPPH、ABTS自由基清除率和FRAP分别为(20.27±0.08)%、(12.71±0.02)%、(11.68±0.07)%。抗氧化活性值增高,可能是因为醋酸菌代谢活动产生了酚类物质,进而提高了抗氧化活性[12]。
表5 枸杞茶醋发酵前后抗氧化活性的变化
Table 5 Changes of antioxidant activity of Lycium barbarum tea vinegar before and after fermentation
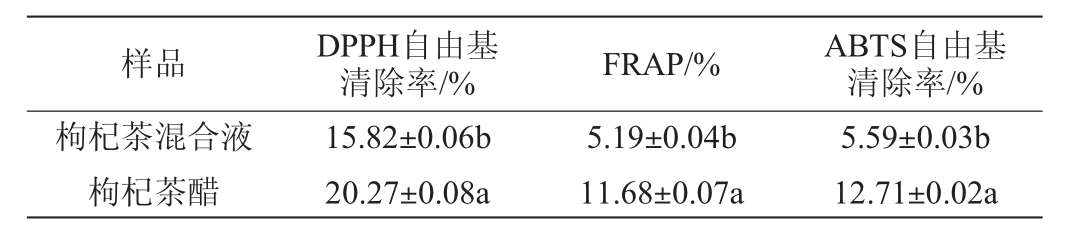
样品 DPPH自由基清除率/% FRAP/% ABTS自由基清除率/%枸杞茶混合液枸杞茶醋15.82±0.06b 20.27±0.08a 5.19±0.04b 11.68±0.07a 5.59±0.03b 12.71±0.02a
2.5 枸杞茶醋理化指标分析
通过测定枸杞茶醋的pH值、总酸、还原糖和可溶性固形物含量发现,枸杞茶醋的pH值为3.56±0.02,总酸含量为7.10 g/100 mL,还原糖含量为1.70 mg/mL和可溶性固形物含量为9.28 g/100 mL,其理化指标符合NY/T 2987—2016《绿色食品果醋饮品》的要求。
3 结论
以枸杞芽茶和玉米须为原料发酵制备枸杞茶醋,以总酸含量为评价指标,通过单因素试验与正交试验优化枸杞茶醋的醋酸发酵工艺。结果表明,枸杞茶醋的最优醋酸发酵工艺为初始酒精度9%vol,醋酸接种量10%,发酵温度30 ℃,初始pH值3.5,在此条件下,总酸含量最高,为7.10 g/100 mL,pH值为3.56,还原糖含量为1.70 mg/mL,可溶性固形物含量为9.28 g/100 mL,其理化指标符合相关标准要求。与发酵前相比,枸杞茶醋中的功能活性成分总酚(2.27 mg/mL)和总黄酮含量(0.94 mg/mL)显著升高(P<0.05),甜菜碱含量(2.30 mg/mL)无显著变化(P>0.05),类胡萝卜素含量(0.62 mg/mL)显著下降(P<0.05);抗氧化能力显著升高(P<0.05),DPPH自由基清除率、FRAP值、ABTS自由基清除率分别为(20.27±0.08)%、(11.68±0.07)%和(12.71±0.02)%,说明枸杞茶醋,有益机体健康,对于促进枸杞的深加工产品创新研发具有广泛应用前景。
[1]彭凯雄,郑钰涵,徐天泽,等.茶叶活性成分的功能及其健康食品研究进展[J].粮食与油脂,2023,36(3):17-20.
[2]LIN X R,MU J J,CHEN Z Z,et al.Stabilization and functionalization of selenium nanoparticles mediated by green tea and Pu-Erh tea polysaccharides[J].Ind Crop Prod,2023,194:116312.
[3] YASMIN A, MEDHAT E, WISAM T, et al.L-theanine attenuates nicotine reward and withdrawal signs in mice[J].Neurosci Lett, 2023, 807:137279.
[4]DU G G,QING Y D,WANG H Z,et al.Effects of Tibetan kefir grain fermentation on the physicochemical properties,phenolics,enzyme activity,and antioxidant activity of Lycium barbarum (Goji berry) juice[J].Food Biosci,2023,53:102555.
[5]董建方,冯天霞,朱银龙,等.芽茶枸杞果酒的酿造工艺研究[J].酿酒科技,2022(8):90-97.
[6]GAYAN C, WEE S C.Thermal and pH stability of natural anthocyanin colourant preparations from black goji berry[J].Food Chem Adv,2023,2:100236.
[7]栾倩,樊毅,张淼,等.枸杞芽叶高纯度有效成分的制备及抗氧化活性研究[J].中国现代中药,2021,23(2):332-339.
[8]李宗锴,张金玲,郭丽娜,等.玉米须化学成分研究进展[J].化工时刊,2022,36(7):23-31.
[9]杨佳玲,吴月,杨梅.区域茶叶的发展现状及对策研究——以宁夏枸杞芽茶为例[J].现代商业,2019(20):88-89.
[10]戴宇樵,张拓,刘亚兵,等.可食用茶叶微生物产品研究进展[J].贵茶,2022(2):5-12.
[11]刘敦华,刘军,李佩佩,等.枸杞深加工产品开发现状及研究进展[J].食品科学技术学报,2020,38(4):10-20.
[12] XIA T, QIANG X, GENG B, et al.Changes in the phytochemical and bioactive compounds and the antioxidant properties of wolfberry during vinegar fermentation processes[J].Int J Mol Sci,2022,23(24):15839.
[13]孟芳,兰亚杰,冀权,等.响应面法优化枸杞果醋醋酸发酵工艺[J].中国酿造,2023,42(6):218-224.
[14]李少鹏,夏婷,张竹君,等.枸杞果酒发酵工艺优化及营养功能成分分析[J].中国酿造,2021,40(7):94-100.
[15]CHEN C F,WU S Q,LI Y R,et al.Effects of different acetic acid bacteria strains on the bioactive compounds volatile compounds and antioxidant activity of black tea vinegar[J].LWT-Food Sci Technol, 2022, 171:114131.
[16] MENG F B, LEI Y T, LI Q Z, et al.Effect of Lactobacillus plantarum and Lactobacillus acidophilus fermentation on antioxidant activity and metabolomic profiles of loquat juice[J].LWT-Food Sci Technol,2022,171:114104.
[17]李少鹏.枸杞果醋醋酸发酵工艺优化及主要成分研究[D].天津:天津科技大学,2022.
[18] SIRIVIBULKOVIT K, NOUANTHAVONG S, SAMEENOI Y.Paperbased DPPH assay for antioxidant activity analysis[J].Anal Sci, 2018,34(7):795-800.
[19]GULCIN I˙.Antioxidants and antioxidant methods:an updated overview[J].Arch Toxicol,2020,94(3):651-715.
[20]JONES A,ACQUAVIVA A,DENNIS G R,et al.Bioactive screening of complex tea samples using the ferric reducing antioxidant power assay incorporating reaction flow HPLC columns for post column derivatisations[J].Microchem J,2018,138:197-202.
[21]ROCA-DOMÈNECH G,CORDERO-OTERO R,ROZÈS N,et al.Metabolism of Schizosaccharomyces pombe under reduced osmotic stress conditions afforded by fed-batch alcoholic fermentation of white grape must[J].Food Res Int,2018,113:401-406.
[22]SONG J,ZHANG J H,KANG S J,et al.Analysis of microbial diversity in apple vinegar fermentation process through 16S rDNA sequencing[J].Food Sci Nutr,2019,7(4):1230-1238.
[23]YASSUNAKA H N,SUREK M,SARTORI D,et al.Role of acetic acid bacteria in food and beverages[J].Food Technol Biotechnol,2023,61(1):85-103.
[24] HE Y, XIE Z, ZHANG H, et al.Oxidative fermentation of acetic acid bacteria and its products[J].Front Microbiol,2022,13:879246.
[25]付蝶.山西老陈醋源巴氏醋杆菌2416发酵产酸优化及菌剂制备研究[D].晋中:山西农业大学,2022.
[26]陈丽娜,符丽丽,罗志辉,等.龙眼果醋发酵工艺研究[J].现代食品,2018(9):170-175.
[27]ILKIN Y S,GULDEN K,PIYANAT C,et al.Investigation of the microbiota associated with traditionally produced fruit vinegars with focus on acetic acid bacteria and lactic acid bacteria[J].Food Biosci, 2022, 47:101636.
[28] SOUMAHORO S, OUATTARA H G, DROUX M, et al.Acetic acid bacteria(AAB)involved in cocoa fermentation from Ivory Coast:species diversity and performance in acetic acid production[J].J Food Sci Technol,2020,57(5):1904-1916.
[29]李晓莺,张曦燕,闫亚美,等.黑果枸杞芽茶香气成分及营养成分[J].食品工业,2019,40(5):176-179.
[30]张文娟,刘雪娜,李丽维,等.茶多酚生理机制及其保健食品研发进展[J].食品研究与开发,2023,44(5):217-224.
[31]李淼儿,王明华,王桂林,等.玉米苞叶黄酮提取纯化及其功能研究进展[J].山东化工,2022,51(24):84-85,90.
[32] ZHANG J Y, WANG C, CHEN C K, et al.Glycine betaine inhibits postharvest softening and quality decline of winter jujube fruit by regulating energy and antioxidant metabolism[J].Food Chem, 2023, 410:135445.
[33]SIMKIN A J.Carotenoids and apocarotenoids in planta:Their role in plant development,contribution to the flavour and aroma of fruits and flowers,and their nutraceutical benefits[J].Plants,2021,10(11):2321.
[34]杨杰.百香果果醋发酵工艺及发酵过程中的特征化学成分研究[D].柳州:广西科技大学,2021.
[35]CHEN L,WANG H,YE Y,et al.Structural insight into polyphenol oxidation during black tea fermentation[J].Food Chem,2023,17:100615.
[36]WU X P,WANG Z C,LI D Y,et al.Fabrication of Fe3C/Fe-N-C nanozymes-based cascade colorimetric sensor for detection and discrimination of tea polyphenols[J].Chinese J of Anal Chem,2023,51:100243.