杨梅(Morella rubra)是我国传统特色水果,主要分布于我国云南、贵州、福建、浙江等省,目前有杨梅、毛杨梅、青杨梅和云南杨梅4个种[1]。杨梅富含钙、磷、铁、钾等矿物质以及多种生物活性成分(如杨梅苷、黄酮醇、花青素),具有抗氧化,抗糖尿病,抗炎、抗癌的功效以及保护心脏、神经、肝脏活性[2-6]。新鲜杨梅果肉构造独特,极易受到损伤,不易运输,易出现大量新鲜杨梅积累或腐烂,导致其不能够大规模远销,严重制约产业的可持续健康发展。将杨梅鲜果加工制成杨梅酒,不仅有效减少杨梅损耗、挽回损失,而且因杨梅酒保留鲜果中的主要营养成分具有较高的营养价值和保健功效,可提高其附加值。杨梅酒主要分为浸泡型和发酵型,目前,杨梅酒的加工和研究逐渐从浸泡型转向发酵型杨梅酒[7]。徐国军等[8]以浙江宁波杨梅为原料,经榨汁后,人工接种优良酵母菌株到杨梅汁中进行发酵,酿造出具有医疗和保健的功效的杨梅果酒。姚茂君等[9]以杨梅为原料,以活性干酵母为发酵菌种,生产干红杨梅酒。蒋益虹等[10]通过添加红曲增加了杨梅果酒的色泽,并筛选出最佳酵母菌种。发酵菌种是决定发酵型杨梅酒的口感、色泽和风味的关键因素之一。
果酒中的风味物质主要是在酵母菌生长代谢过程中形成的。在果酒酿造过程中,非挥发性香气前体物质以糖苷结合态的形式存在于水果中,在酵母菌相关酶的作用下,解离出游离态风味物质,如酯类、醇类、有机酸类、醛酮类、含硫化合物以及萜烯类等,赋予果酒独特的风味[11]。改善果酒风味的酵母菌主要包括克鲁维毕赤酵母(Pichia kluyveri)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、东方伊萨酵母(Issatchenkia orientalis)、季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)、铁红假丝酵母(Candida pulcherrima)、美极梅奇酵母(Metschnikowia pulcherrima)、柠檬形克勒克酵母(Kloeckera opiculata)、隐球酵母(Cryptococcus aerius)等[12]。目前,应用于果酒酿造的酵母菌大多是商业活性干酵母,尽管这些酵母也可用于杨梅酒的生产,但是通常用商业酵母进行发酵不利于生产出具有地区特色的杨梅酒,同质化现象严重。目前,杨梅果酒生产中采用的菌种多数为葡萄糖用酵母,尚未找到杨梅果酒专用酿造菌种,因此,优质杨梅果酒的酿造需筛选训化出适宜杨梅果酒生产加工的酵母。
本研究从云南杨梅发酵液中筛选出发酵性能优良的酵母菌,对筛选酵母菌进行产酯、产乙醇能力、产H2S能力、耐受性等酿酒特性分析,并对其进行形态特征和分子生物学鉴定,旨在为云南杨梅酒酿造提供优良酵母菌。
1 材料与方法
1.1 材料与试剂
1.1.1 材料及菌株
野生杨梅:采摘于云南省曲靖市师宗县高良乡。
1.1.2 试剂
2×Mix:南京诺唯赞生物科技股份有限公司;引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'):昆明擎科生物科技有限公司;葡萄糖、无水乙醇、焦亚硫酸钾等(均为分析纯):昆明品美科技有限公司。
1.1.3 培养基
2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)上层培养基:0.5 g/LTTC,0.5 g/L葡萄糖,15 g/L琼脂,煮沸2 min。
TTC下层培养基:0.4 g/L MgSO4,1 g/L KH2PO4,1.5 g/L酵母浸出粉,2 g/L蛋白胨,10 g/L葡萄糖,20 g/L琼脂于1 L蒸馏水中,调节pH至5.5,121 ℃高压灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)产酯筛选培养基:20g/L蛋白胨,10g/L酵母浸粉,20g/L葡萄糖,4 g/L三丁酸甘油酯,20 g/L琼脂,121 ℃高压灭菌15 min。
麦芽汁琼脂培养基、酵母浸出粉胨葡萄糖琼脂培养基、酵母浸出粉胨葡萄糖液体培养基、赖氨酸培养基、BIGGY琼脂(bismuth sulfite glucose glycine yeast agar,BIGGY)培养基:青岛科技工业园海博生物技术有限公司;WL营养琼脂鉴别培养基:青岛日水生物技术有限公司。
1.2 仪器与设备
PHX-280H生化培养箱:上海一恒科学仪器有限公司;YP-B30002电子天平:上海光正医疗仪器有限公司;YXQ-100G立式压力蒸气灭菌器:上海博迅实业有限公司医疗设备厂;聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国应用生物系统公司;PowerPacTM HC十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)仪:美国BIO-RAD公司;凝胶成像系统:Gene Company Limited;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;ZD-85AB多功能冷冻气浴恒温振荡器、T6新世纪紫外可见光分光光度计:常州润华电器有限公司;BCD-452WDPR冰箱:海尔智能股份有限公司;P70D20TL-D4微波炉:广东格兰仕微波生活电器制造有限公司;PHS-3C精密pH计:上海仪电科学仪器股份有限公司;7GL-16M台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 杨梅发酵液的制备
称取200 g野生杨梅,加入200 mL无菌水,用榨汁机榨汁后置于500 mL无菌的三角瓶中,在28 ℃的恒温培养箱中自然发酵5 d[13],即得杨梅发酵液。
1.3.2 酵母菌的分离纯化
取自然发酵5 d的野生杨梅发酵液,采用梯度稀释法,将发酵液依次稀释获得10-4、10-5、10-6稀释液,吸取100 μL上述稀释液涂布在含有抗生素的YPD培养基和麦芽汁培养基上,在28 ℃条件下恒温培养48 h。挑取有典型酵母形态的单菌落,于YPD固体培养基上划线分离纯化,重复3次[14]。
1.3.3 形态特征鉴定
将分离出来的单菌落,接种YPD液体培养基活化24 h后,稀释后涂布至WL琼脂培养基28 ℃培养5 d后观察并记录菌落颜色与形态,进行初步归类[15]。挑取少量菌体于载玻片上,用0.1%生理盐水稀释,盖上盖玻片,于显微镜(油镜)下观察,观察记录酵母菌的无性繁殖方式及细胞形状。
1.3.4 酵母菌的发酵能力测定
采用杜氏管发酵法[16],按2%(V/V)接种量接种到内置杜氏小管的灭菌YPD液体培养基中,在28 ℃条件下,按照菌株产气量多少为评价指标筛选具有较强发酵能力的酵母菌[17]。
1.3.5 酵母菌产乙醇、产酯及产硫化氢能力测定
利用TTC平板显色的深浅来判定酵母菌的产乙醇能力[18]。采用三丁酸甘油酯琼脂平板透明法,若出现透明水圈,则说明酵母产酯,根据透明圈大小判断酵母菌产酯能力[19]。酵母菌产硫化氢能力的测定参照闫兴敏等[18]的方法。
1.3.6 酵母菌的耐受性实验
参照文献[20]的方法并做部分调整,以YPD培养基为基础培养基,将筛选的菌株活化后分别以2%(V/V)的接种量接种于不同的乙醇体积分数(4%、6%、8%、10%、12%、14%、16%、18%)、葡萄糖质量浓度(200 g/L、250 g/L、300 g/L、350 g/L、400 g/L)、pH值(2.8、3.0、3.5、4.0)、温度(4 ℃、15 ℃、25 ℃、35 ℃、40 ℃)的YPD液体培养基中,在28 ℃条件下静置培养24 h,在波长600 nm处测定吸光度值(OD600 nm值),考察菌株对乙醇、葡萄糖、pH、温度的耐受性。
1.3.7 分子生物学鉴定
参照文献[21]的方法提取酵母菌株基因组DNA。以ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')为引物扩增酵母菌26S rDNA D1/D2区[22]。PCR扩增体系(25 μL):DNA模板1 μL、ITS 1和ITS 4各0.5 μL、Taq PCR Master Mix 11 μL、dd H2O 12 μL。PCR扩增程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃、40 s,72 ℃、1 min,30个循环,72 ℃延伸8 min。将PCR扩增产物送至昆明擎科生物科技有限公司测序。将测序结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,利用MEGA X[23]软件中的邻接法(neighbor-joining,NJ)构建系统发育树,分析菌株的分类地位。
1.3.8 数据处理
数据的初步处理使用Microsoft Excel 2016软件,采用SPSS 22.0软件进行数据分析处理,方差分析采用Duncan检验法,每组实验3个重复。采用Graphpad Prism 9.1软件进行绘图。
2 结果与分析
2.1 酵母菌的分离纯化及形态鉴定
采用纯培养技术从云南杨梅自然发酵液中共分离到59株菌。从WL培养基上选具有典型酵母菌落特征的菌落,进行形态观察和镜检,结果表明共分离到17株菌,编号JYR-1~JYR-17,且这17株菌符合酵母菌形态特征,部分代表菌株在菌落特征以及显微镜检结果见图1。
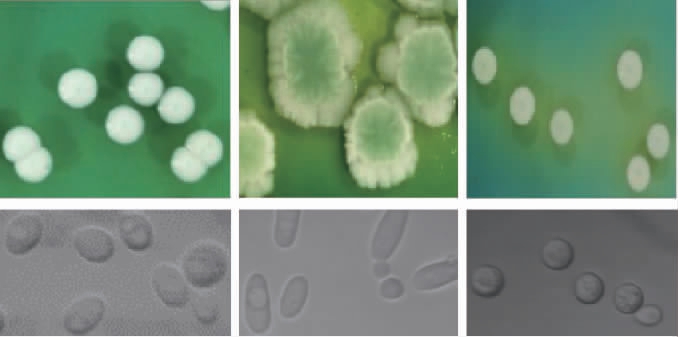
图1 部分酵母菌在WL培养基上的菌落特征以及显微形态(×100)
Fig.1 Colony characteristics and microscopic morphology of some yeasts on WL medium (×100)
2.2 酵母菌的发酵性能
通过观察菌株在杜氏管中产气情况,可以筛选出有高效的发酵速率的菌株。17株菌的杜氏小管产气结果见表1。由表1可知,有5株菌(JYR-5,JYR-12,JYR-14,JYR-15,JYR-17)在24 h内使杜小管充满气体,有6株菌(JYR-6,JYR-7,JYR-8,JYR-11,JYR-13,JYR-16)48 h内充满气体;有6株菌(JYR-1,JYR-2,JYR-3,JYR-4,JYR-9,JYR-10)产气较慢。菌株在YPD培养基中都形成白色沉淀。总体而言,菌株JYR-5,JYR-12,JYR-14,JYR-15,JYR-17发酵性能较好。
表1 筛选酵母菌杜氏小管产气情况
Table 1 Gas-producing capacity of screened yeast strains in Durham fermentation tubes
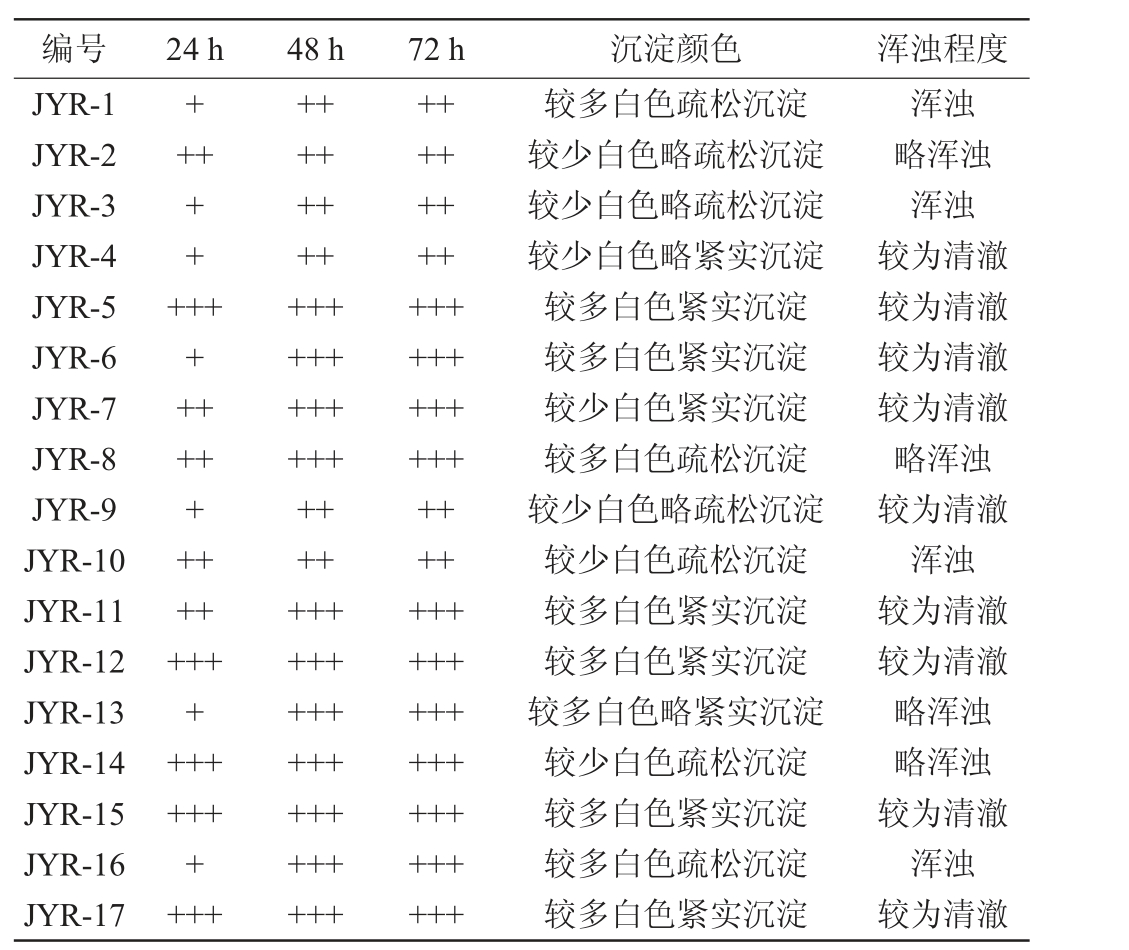
注:“+、++、+++”分别表示产气达到杜氏小管体积的1/3、2/3、全部。
编号 24 h 48 h 72 h 沉淀颜色 浑浊程度JYR-1 JYR-2 JYR-3 JYR-4 JYR-5 JYR-6 JYR-7 JYR-8 JYR-9 JYR-10 JYR-11 JYR-12 JYR-13 JYR-14 JYR-15 JYR-16 JYR-17++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++较多白色疏松沉淀较少白色略疏松沉淀较少白色略疏松沉淀较少白色略紧实沉淀较多白色紧实沉淀较多白色紧实沉淀较少白色紧实沉淀较多白色疏松沉淀较少白色略疏松沉淀较少白色疏松沉淀较多白色紧实沉淀较多白色紧实沉淀较多白色略紧实沉淀较少白色疏松沉淀较多白色紧实沉淀较多白色疏松沉淀较多白色紧实沉淀浑浊略浑浊浑浊较为清澈较为清澈较为清澈较为清澈略浑浊较为清澈浑浊较为清澈较为清澈略浑浊略浑浊较为清澈浑浊较为清澈
2.3 酵母菌的产乙醇、产酯、产硫化氢能力测定
2.3.1 筛选菌株的产乙醇能力测定
筛选菌株的TTC显色效果如图2所示。
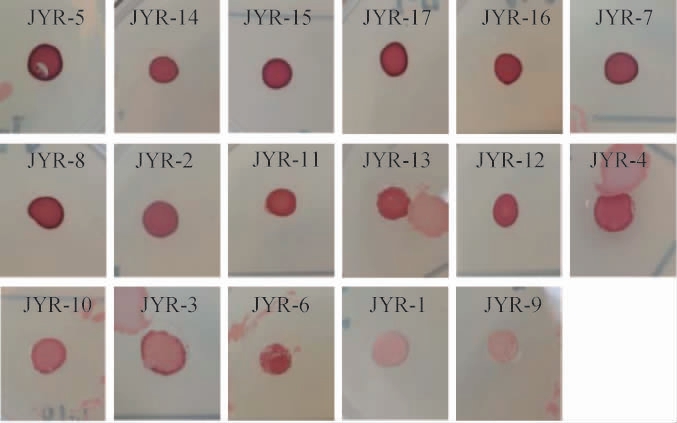
图2 筛选酵母菌产乙醇能力测定结果
Fig.2 Determination results of ethanol production capacity of screened yeasts
由图2可知,通过TTC显色法从17株酵母菌中得到菌落呈深红色的有10株(JYR-2,JYR-5,JYR-7,JYR-8,JYR-11,JYR-13,JYR-14,JYR-15,JYR-16,JYR-17),表明其产酒精能力最强,5株呈现红色(JYR-3,JYR-4,JYR-6,JYR-10,JYR-12),表明其产酒精能力较强,2株呈现淡粉色(JYR-1,JYR-9),表明其产乙醇能力最弱。
2.3.2 筛选菌株的产酯能力测定
三丁酸甘油酯为白色近油状液体,略有脂肪香气。酵母菌产生的酯酶能分解三丁酸甘油酯,菌落周围会出现透明圈,透明圈直径与酯酶活性成正相关。利用含三丁酸甘油酯的YPD培养基培养酵母菌,根据形成透明圈大小判断产酯能力,菌株的产酯能力测定结果见表2。由表2可知,17株菌的透明圈与菌落直径的比值均>1,且菌株JYR-17的透明圈与菌落直径的比值最大,说明17株菌均有产酯能力,其中,菌株JYR-17产酯能力最强。
表2 筛选酵母菌产酯能力测定结果
Table 2 Determination results of ester production capacity of screened yeasts
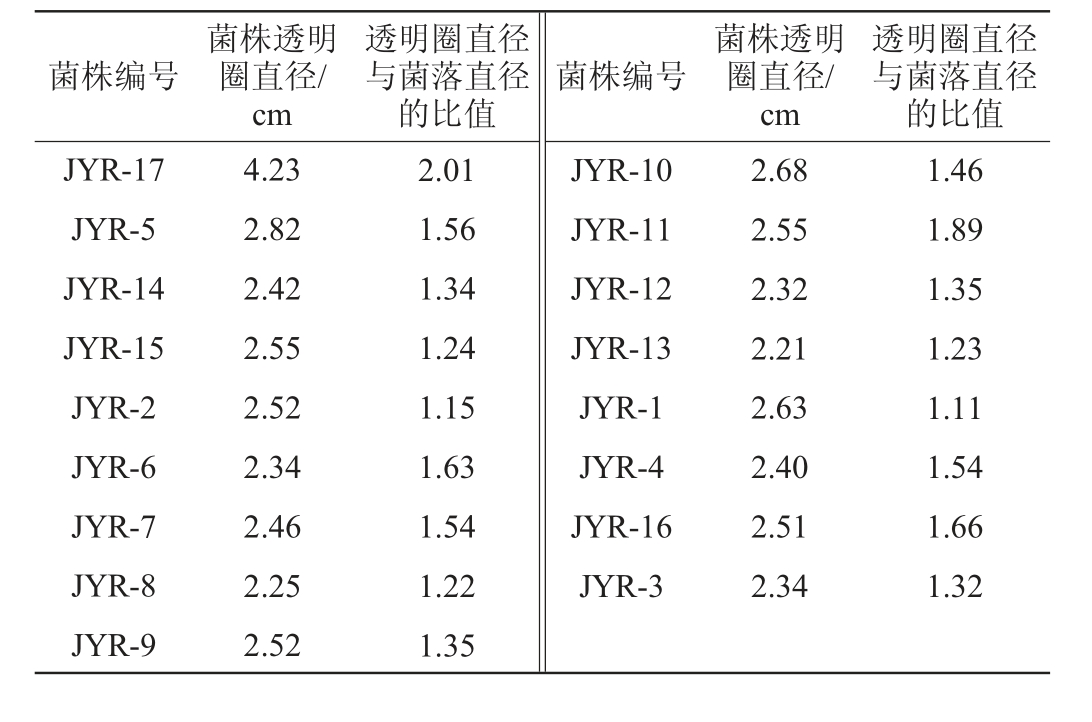
菌株编号菌株透明圈直径/cm透明圈直径与菌落直径的比值菌株编号菌株透明圈直径/cm透明圈直径与菌落直径的比值JYR-17 JYR-5 JYR-14 JYR-15 JYR-2 JYR-6 JYR-7 JYR-8 JYR-9 4.23 2.82 2.42 2.55 2.52 2.34 2.46 2.25 2.52 2.01 1.56 1.34 1.24 1.15 1.63 1.54 1.22 1.35 JYR-10 JYR-11 JYR-12 JYR-13 JYR-1 JYR-4 JYR-16 JYR-3 2.68 2.55 2.32 2.21 2.63 2.40 2.51 2.34 1.46 1.89 1.35 1.23 1.11 1.54 1.66 1.32
H2S具有臭鸡蛋味,在果酒中H2S含量的增加会影响果酒品质[24],所以需要筛选低产H2S的菌株。经BIGGY培养基可以检测酵母菌产H2S能力,菌落颜色越深表明产H2S能力越强。17株酵母菌的产H2S能力测定结果见图3。

图3 筛选酵母菌产H2S能力测定结果
Fig.3 Determination results of H2S production capacity of screened yeasts
由图3可知,菌株JYR-10、JYR-3、JYR-1、JYR-2、JYR-16、JYR-15产H2S能力较强,菌株JYR-17、JYR-9、JYR-4、JYR-7、JYR-14、JYR-6、JYR-12、JYR-8、JYR-11、JYR-13、JYR-5 产H2S能力较弱,适合酿造果酒。
综合17株酵母菌发酵性能,产酯、产乙醇以及产H2S能力,选择JYR-5、JYR-14、JYR-17三株菌进行后续实验。
2.4 优良酵母菌耐受性
2.4.1 乙醇耐受性
酵母菌在厌氧条件下发酵产物有乙醇,随着发酵时间延长,乙醇不断积累对酵母菌细胞有毒害作用,抑制其生长[25]。酵母菌对乙醇耐受力能力越强,更有利于发酵。3株菌株对乙醇的耐受性实验结果见图4。
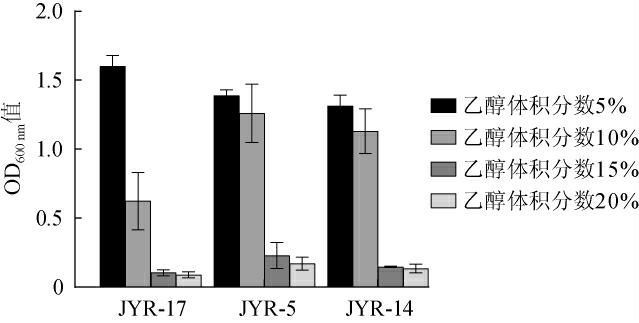
图4 不同乙醇体积分数对酵母菌JYR-17、JYR-5以及JYR-14生长的影响
Fig.4 Effect of different alcohol content on the growth of yeast JYR-17, JYR-5 and JYR-14
由图4可知,菌株JYR-17、JYR-5、JYR-14在乙醇体积分数为5%时均具有较高的OD600nm值,其中菌株JYR-17的OD600 nm值最大。当乙醇体积分数为10%时,菌株JYR-5、JYR-14具有较高的OD600 nm值。在乙醇体积分数为15%和20%时,3株菌的乙醇耐受性(OD600nm值<0.5)均较弱,在培养基中微量生长或不生长。表明菌株JYR-17能耐受5%的乙醇体积分数,菌株JYR-5、JYR-14能耐受10%的乙醇体积分数。
2.4.2 pH值耐受性
pH对酵母菌的生长代谢和生物活性有较大影响,能影响细胞间的代谢传递及酶活性,在较低或较高的pH下会影响酵母菌的生长代谢能力[26]。3株菌在不同pH值条件下的耐受实验结果见图5。
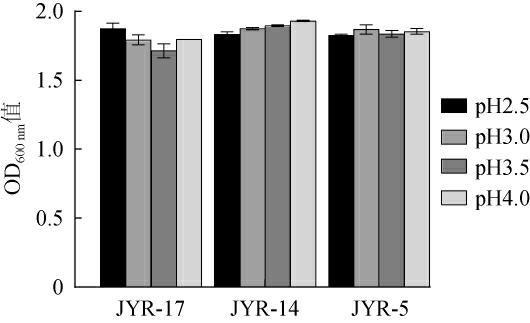
图5 不同pH对酵母菌JYR-17、JYR-5以及JYR-14生长的影响
Fig.5 Effect of pH on the growth of yeast JYR-17,JYR-5 and JYR-14
由图5可知,当培养基的pH值为2.5~4.0时,菌株JYR-17、JYR-5、JYR-14均能正常生长;说明菌株JYR-17、JYR-5、JYR-14能耐受pH值为2.5的生长环境。
2.4.3 温度耐受性
温度是影响酵母菌生长的重要因素,适宜的温度条件下,酵母菌快速生长。温度影响酵母菌酶的活性和其对营养物质的吸收能力,而不同的酵母菌对温度的耐受性也不同[27]。不同温度对酵母生长的影响结果见图6。
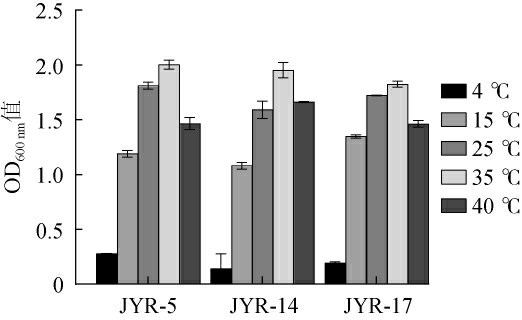
图6 不同温度对酵母菌JYR-17、JYR-5以及JYR-14生长的影响
Fig.6 Effect of temperature on the growth of yeast JYR-17, JYR-5 and JYR-14
由图6可知,在4 ℃条件下,菌株JYR-17、JYR-5、JYR-14生长均受到明显抑制;在15 ℃条件下,菌株JYR-5、JYR-14生长受到一定抑制;在25℃、35 ℃、40 ℃条件下,菌株JYR-17、JYR-5、JYR-14均能正常生长;说明菌株JYR-17、JYR-5、JYR-14能耐受40 ℃的温度。
2.4.4 SO2耐受性
在酿酒过程中,适量的SO2不仅能除了抑制杂菌的生长外,还能对酒起到抗氧化和护色的作用[28],所以需筛选有良好SO2耐受性的酵母菌,从而提升云南杨梅酒的品质,不同SO2质量浓度对酵母生长的影响见图7。
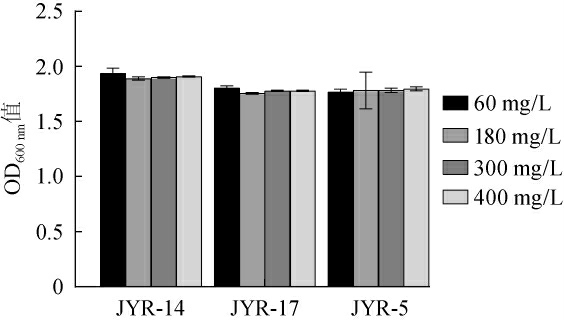
图7 不同SO2质量浓度对酵母菌JYR-17、JYR-5以及JYR-14生长的影响
Fig.7 Effect of SO2 concentration on the growth of yeast JYR-17,JYR-5 and JYR-14
由图7可知,当SO2质量浓度分别为60 mg/L、180 mg/L、300 mg/L和400 mg/L时,菌株JYR-17、JYR-5、JYR-14均能正常生长;说明菌株JYR-17、JYR-5、JYR-14能耐受400 mg/L的SO2质量浓度。
2.4.5 葡萄糖耐受性
高浓度葡萄糖对酵母菌生长有一定的影响,从而影响其酿酒特性[29]。不同葡萄糖质量浓度对酵母生长的影响结果见图8。
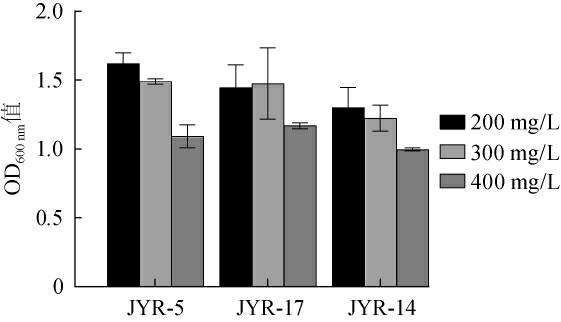
图8 不同葡萄糖质量浓度对酵母菌JYR-17、JYR-5以及JYR-14生长的影响
Fig.8 Effect of glucose concentration on the growth of yeast JYR-17,JYR-5 and JYR-14
由图8可知,随着葡萄糖质量浓度的增加,菌株JYR-5、JYR-17和JYR-14的生长受到一定影响。当葡萄糖质量浓度为200 mg/L和300 mg/L时,菌株JYR-5、JYR-17、JYR-14均能正常生长;当葡萄糖质量浓度为400 mg/L时,菌株JYR-5、JYR-17、JYR-14生长受到一定抑制;说明菌株JYR-17、JYR-5、JYR-14能耐受300 mg/L的葡萄糖质量浓度。
2.5 筛选酵母菌分子生物学鉴定
提取菌株DNA作为模板,利用NL1和NL4引物对其26S rDNA的D1/D2区进行PCR扩增,将PCR扩增产物送至昆明硕擎生物科技有限公司测序,序列比对结果见表3,构建系统发育树,结果见图9。
表3 3株酵母菌序列比对结果
Table 3 Sequence comparison results of 3 strains of yeasts
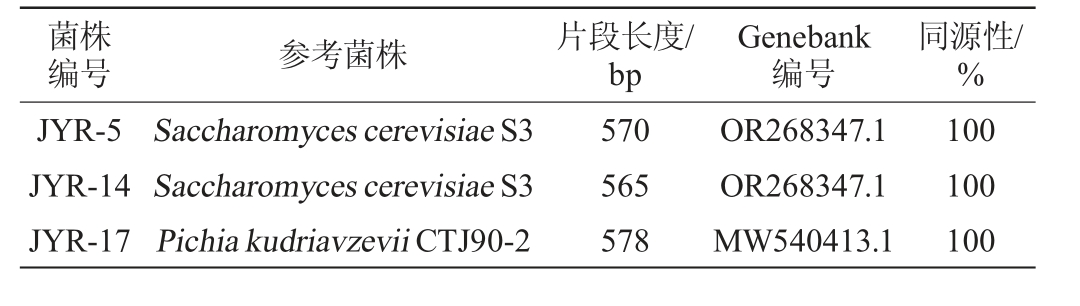
菌株编号 参考菌株 片段长度/bp Genebank编号同源性/%JYR-5 JYR-14 JYR-17 Saccharomyces cerevisiae S3 Saccharomyces cerevisiae S3 Pichia kudriavzevii CTJ90-2 570 565 578 OR268347.1 OR268347.1 MW540413.1 100 100 100

图9 基于26S rDNA基因序列酵母菌JYR-17、JYR-5以及JYR-14的系统发育树
Fig.9 Phylogenetic tree of yeast JYR-17, JYR-5 and JYR-14 based on 26S rDNA gene sequences
由表3和图9可知,菌株JYR-5、JYR-14与酿酒酵母(Saccharomyces cerevisiae)PC3相似度为100%,菌株JYR-17与库德里阿兹威毕赤酵母(Pichia kudriavzevii)CTJ90-2相似度为100%。由图9可知,菌株JYR-5、JYR-14与酿酒酵母(Saccharomycescerevisiae PC3)聚于一枝,菌株JYR-17与库德里阿兹威毕赤酵母(Pichia kudriavzevii CTJ90-2)聚于一枝,亲缘关系最近。由此确定,菌株JYR-5、JYR-14为酿酒酵母(Saccharomyces cerevisiae),菌株JYR-17为库德里阿兹威毕赤酵母(Pichia kudriavzevii)。
3 结论
本研究以自然发酵的云南杨梅为原材料,使用YPD培养基和麦芽汁培养基分离纯化获得56株酵母菌,经杜氏小管产气实验发现JYR-2,JYR-5,JYR-7,JYR-8,JYR-11,JYR-13,JYR-14,JYR-15,JYR-16,JYR-17这10株菌发酵性能较好,结合产脂、产乙醇、耐受性实验表明,菌株JYR-5、JYR-14、JYR-17产脂产乙醇能力较强,且耐受性较好。通过形态学观察和分子生物学鉴定,菌株JYR-5、JYR-14为酿酒酵母(Saccharomyces cerevisiae),JYR-17是库德里阿兹威毕赤酵母(Pichia kudriavzevii)。通过从云南杨梅发酵液筛选出的3株酿酒特性良好的酵母菌为今后杨梅酒及其他果酒的酿造提供酵母资源,对进一步促进云南杨梅产业发展具有一定意义。
[1]陈方永.我国杨梅研究现状与发展趋势[J].中国南方果树,2012,41(5):31-36.
[2] YAN S,ZHANG X,WEN X,et al.Purification of flavonoids from Chinese bayberry(Morella rubra Sieb.et Zucc.)fruit extracts and alpha-glucosidase inhibitory activities of different fractionations[J].Molecules,2016,21:1148.
[3]LIU Y,ZHAN L,XU C,et al.alpha Glucosidase inhibitors from Chinese bayberry(Morella rubra Sieb.et Zucc.) fruit: Molecular docking and interaction mechanism of flavonols with different B-ring hydroxylations[J].RSC Adv,2020,10:29347-29361.
[4] LIU Y L, QIAN J F, LI J J, et al.Hydroxylation decoration patterns of flavonoids in horticultural crops: chemistry, bioactivity and biosynthesis[J].Hortic Res,2022,9:uhab068.
[5]SUN C,ZHENG Y,CHEN Q,et al.Purification and anti-tumour activity of cyanidin-3-O-glucoside from Chinese bayberry fruit[J].Food Chem,2012,131:1287-1294.
[6]GENG Y Q,XIE Y,LI W,et al.Toward the bioactive potential of myricitrin in food production: state-of-the-art green extraction and trends in biosynthesis[J].Crit Rev Food,2023:1-27.
[7]周超超,高毕远,陈竹韵,等.浸泡型和发酵型杨梅酒酿造技术研究进展[J].农产品加工,2022(22):80-84.
[8]徐国军,陆胜民.杨梅酒的酿制工艺[J].食品科技,2003,28(1):66-67.
[9]姚茂君,刘洪,李军,等.干红杨梅酒的生产工艺研究[J].食品与发酵工业,2002,28(11):70-72.
[10]蒋益虹,郑晓冬.杨梅果酒新工艺的研究[J].中国食品学报,2003(2):35-40.
[11] RUIZ J, KIENE F, BELDA I, et al.Effects on varietal aromas during wine making:A review of the impact of varietal aromas on the flavor of wine[J].Appl Microbiol Biot,2019,103:7425-7450.
[12] TOFALO R,SCHIRONE M,TELERA G C,et al.Influence of organic viticulture on non-Saccharomyces wine yeast populations[J].Ann Microbiol,2011,61(1):57-66.
[13]刘慧.现代食品微生物学[M].北京:中国轻工业出版社,2011:278-288.
[14]张小勤,潘晓姗,李东,等.贵州产地刺梨果酒产酒精酵母的筛选及其发酵性能研究[J].中国酿造,2022,41(12):97-102.
[15]刘帅,王志磊,周世斌,等.适合鲜食葡萄酿酒的酵母筛选及其发酵特性研究[J].食品与发酵工业,2023,49(22):110-118.
[16]申鹏森,田争福,田晓菊,等.一株降解氨基甲酸乙酯酿酒酵母菌的筛选及鉴定[J].食品与发酵工业,2022,48(9):20-25.
[17]巩丽莉,周迪,卢玲,等.贺兰山东麓优良本土酿酒酵母筛选及发酵特性分析[J].微生物学通报,2023,50(9):4021-2044.
[18]闫兴敏,姜娇,高辉,等.优良本土酿酒酵母的酿酒特性及产香能力初析[J].食品与发酵工业,2022,48(4):62-68.
[19]徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.
[20]董琦楠,叶冬青,梁艳英,等.高产酸本土非酿酒酵母菌株的筛选及发酵性能研究[J].中国酿造,2021,40(8):70-75.
[21]GOODWIN D C,LEE S B.Microwave miniprep of total genomic DNA from fungi; plants; protists and animals for PCR[J].Biotechniques,1993,15(3):438-441.
[22]刘沛通,许丹丹,许引虎,等.4株本土非酿酒酵母的发酵特性[J].食品科学,2021,42(14):86-93.
[23]KUMAR S,STECHER G,LI M,et al.MEGA X:molecular evolutionary genetics analysis across computing platforms[J].Mol Biol Evol,2018,35(6):1547.
[24]ANCO-LUESMA E,SÁENZ-NAVAJAS M P,VALENTIN D,et al.Study of the effect of H2S,MeSH and DMS on the sensory profile of wine model solutions by Rate-All-That-Apply(RATA)[J].Food Res Int,2016,87:152-160.
[25] QIU Z L, JIANG R R.Improving Saccharomyces cerevisiae ethanol production and tolerance via RNA polymerase Ⅱsubunit R pb7[J].Biotechnol Biofuels,2017,10(1):125.
[26]王辉,袁婷玉,白卫东,等.青梅自然发酵液中酵母菌的分离鉴定及特性研究[J].食品科技,2021,46(8):16-21.
[27]张二豪,何萍,刘盼盼,等.西藏沙棘酵母菌的分离鉴定及其产香特性分析[J].食品科学,2022,43(20):207-215.
[28]阎贺静,时月,刘畅,等.玫瑰香干红葡萄酒自然发酵过程中优势酵母分离鉴定及其应用潜力分析[J].食品科学,2017,38(22):124-131.
[29]冯文倩,王倩,刘延琳,等.低产乙醇本土有孢汉逊酵母的筛选及酿造特性[J].食品与发酵工业,2021,47(21):9-17.