馕是我国新疆地区最具有地域特色的传统主食之一,其历史悠久,具有保存时间长、便于携带、食用方便等优点[1-4]。20世纪80年代,速发型干酵母被引入我国,因其使用便捷,产气能力强,传统发酵剂逐渐被取代[5]。直到现在仍然还有很多地区使用传统发酵剂制作馕饼,且形成偏爱,主要是因为速发型活性干酵母菌种单一,相较于传统发酵面团中的混合菌群发酵而言,不及后者发酵后的风味和醇厚的香气。
馕面团又称老酵、酵头、老肥、面种、面头等[6],其中优势菌群为乳酸菌和酵母菌,还存在其他菌群,甚至是一些有害杂菌,这与国外发酵面包所用的酸面团具有相似之处。于静等[7]从新疆馕面团中鉴定到优势菌群分别为戊糖乳杆菌(Lactobacillus pentosus)和酿酒酵母(Saccharomyces cerevisiae),除此之外还分离出表皮葡萄球菌(Staphylococ cus epidermidis)等,说明可能存在有害菌。酵母菌在面团里主要起着分解面粉中淀粉与糖分,生成二氧化碳气体与乙醇的作用,为馕提供良好的风味;乳酸菌能够产生一定的生物活性物质,从而达到抑菌、延长保质期、增加营养价值、改善风味等目的[8-10]。
新疆地大物博,传统馕面团品种繁多,各地馕面团微生物各异,发酵后馕的口感、风味也千差万别。为进一步了解我国新疆地区馕面团中优势微生物的菌群组成,本试验对新疆吐鲁番市、喀什地区伽师县以及疏勒县三个县市的馕面团样品中的乳酸菌和酵母菌进行分离、纯化和鉴定;因发酵馕面团中的优势微生物与传统馒头发酵的微生物一致,故将其应用于馒头发酵中,探究风味差异,为丰富发酵剂的微生物菌群提供一定理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
2022年7月采集新疆吐鲁番市、喀什地区伽师县和疏勒县不同家庭长期手工制作的发酵馕面团,密封袋取样,样品贴标后运回实验室,冷藏于4 ℃的冰箱中保存备用[11]。
高筋小麦粉:山东永乐食品有限公司;高活性干酵母:安琪酵母股份有限公司。
1.1.2 试剂
氢氧化钠(分析纯):天津市圣奥化学有限责任公司;革兰氏染液:珠海贝索生物技术有限公司;丙三醇(分析纯):比克曼生物科技有限公司;核酸染料、聚合酶链式反应(polymerase chain reaction,PCR)裂解液:日本TaKaRa公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose agar,YPD)培养基、MRS固体培养基、MRS肉汤培养基:北京奥博星生物科技有限公司;
1.2 仪器与设备
ME104E电子分析天平:瑞士Mettler Toledo公司;SWCJ-2F型双人双面净化工作台:苏州净化设备有限公司;ZWY-2102C全温振荡器:上海智城分析仪器制造有限公司;LDZF-751-2立式压力蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂;E221生物显微镜:麦克奥迪实业集团有限公司;SHELLABG112电热恒温培养箱:宁波市科技园区新江南仪器有限公司;5810R高速冷冻离心机、Mastercycler nexus GSX1梯度PCR仪:德国Eppendorf有限公司;DYY-6C型电泳仪:北京六一生物科技有限公司;ZF-20D暗箱式紫外分析仪:河南省百年仪器有限公司;GCMS-QP2020NX单四级杆型气相色谱-质谱联用(gas chromatography-mass spectrography,GC-MS)仪:日本Shimadzu公司。
1.3 试验方法
1.3.1 菌株的分离
根据玛依古丽·库尔班等[6]的方法,略有修改。将三份发酵馕面团分别梯度稀释至10-10,分别取10-3~10-10的梯度稀释液各0.1 mL涂布于MRS琼脂培养基和YPD固体培养基上,每个梯度做3个平行,MRS培养基于37 ℃恒温培养箱倒置培养48 h[12],YPD培养基于28 ℃恒温培养箱倒置培养48 h。挑取疑似酵母菌的白色单菌落,划线于YPD固体培养基;挑取疑似乳酸菌半透明小单菌落,划线于MRS固体培养基[13],重复操作5~6次直至确定为纯菌。将分离获得的纯菌株分别经液体培养后与体积分数为50%的丙三醇等量混合制成甘油保藏菌,置于-80 ℃备用[11]。
1.3.2 分离菌株的鉴定
形态学观察:将分离得到的乳酸菌和酵母菌分别划线接种于MRS固体培养基、YPD固体培养基上,分别置于37 ℃、28 ℃的恒温培养箱中培养48 h后,观察菌落大小、表面形态、凸起情况、菌落形状、边缘情况、表面光泽、菌落质地、菌落颜色和透明程度等,记录菌落的形态特征[6]。随后对乳酸菌进行革兰氏染色[12],采用生物显微镜观察乳酸菌与酵母菌的细胞特征[14]。
分子生物学鉴定:分别在MRS和YPD固体培养基上接种已纯化的乳酸菌(37 ℃培养48 h)和酵母菌(28 ℃培养48 h),PCR管中加入50 μL裂解液,用灭菌牙签挑取单菌落置于裂解液中混合均匀,95 ℃金属浴裂解15 min后,2 000 r/min离心5 min,取裂解后的上清液2 μL为PCR扩增的脱氧核糖核酸(deoxyribonucleic acid,DNA)模板。
以乳酸菌基因组DNA为模板,27F(5'-AGAGTTTGATCCTGGCTCA-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')为引物PCR扩增16S rDNA基因序列[15];以酵母菌基因组DNA为模板,ITS1(5'-GTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')为引物PCR扩增酵母菌ITS基因序列[16-17]。PCR扩增体系:DNA模板2 μL、引物各2 μL、2×Power Taq PCR MasterMix 25 μL、补充双蒸水(ddH2O)至50 μL。乳酸菌16S rDNA PCR扩增条件为:94 ℃预变性10 min;94 ℃变性30 s,54 ℃退火60 s,72 ℃延伸90 s,35个循环;72 ℃再延伸10 min,4 ℃保存;酵母菌ITS基因序列的PCR扩增条件为:94 ℃变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min,4 ℃保存。
将PCR扩增产物送至杨凌天润奥科生物科技有限公司进行测序,返回的基因序列提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库上,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)与已知序列进行同源比对,利用MEGA 11.0软件中的邻接法(neighbor joining,NJ)法构建系统发育树[18]。
1.3.3 优良菌株的筛选
乳酸菌的产酸试验:分离到的乳酸菌经MRS肉汤培养基培养48 h后,根据王嘉琪等[19]的方法测定产酸量。
酵母菌的产气试验:根据胡楠等[20]的方法,略有修改。取酵母菌菌液100 μL至含有杜氏小管的10 mL YPD液体培养基试管内,于28 ℃培养48 h,记录培养24 h、36 h和48 h时的产气量,初步判断酵母菌的产气性能,筛选发酵能力强的优良酵母菌。
1.3.4 馒头发酵试验
为探究优良酵母和乳酸菌发酵对馒头发风味物质的影响,以安琪市售酵母为对照,将3种菌株用水稀释至活菌数为108 CFU/mL后分别接种于面团中,面团发酵至各菌体活菌数达到108 CFU/g,再以10 g发酵面团作为面引子发酵50 g面团制作馒头。其中,将以分离的乳酸菌和酵母菌发酵的面团以1∶1、1∶2、1∶3的接种比例分别添加至面团中制备馒头[21-22],并命名为样品1、样品2和样品3,将只添加优良酵母和安琪酵母的馒头分别命名为样品4和样品5。参照文献[23]对馒头进行感官评价。
1.3.5 挥发性风味物质的检测参考刘艳红等[24-25]的方法利用气相色谱-质谱联用仪测定馒头中的挥发性风味物质。
1.3.6 数据处理
每一组实验平行测定3次,结果用“平均值±标准差”表示,采用SPSS Statistics 26对数据进行处理,采用Origin 2021绘图。
2 结果与分析
2.1 菌株的分离
采用传统培养分离方法从发酵馕面团中共分离得到36株乳酸菌和51株酵母菌。
2.2 分离菌株的鉴定结果
2.2.1 形态学鉴定
根据菌落形态和细胞形态可将分离得到的36株乳酸菌和51株酵母菌菌株初步分为4种乳酸菌和3种酵母菌,结果见表1,每种菌株中代表菌株的菌落及细胞形态见图1和图2。由表1和图1可知,4种乳酸菌菌落形态相近,菌落呈乳白色的半透明圆形、小而光滑、边缘整齐、低凸起、湿润、易挑起,革兰氏染色结果均为阴性。菌株TR4等的细胞最小,呈单球或双球排列;菌株JR3等的细胞呈长杆状;菌株TR21和SR1等的细胞呈短杆状。由表1和图2可知,3种酵母菌菌落形态不一,菌株JJ1和SJ1等的菌落呈乳白色不透明的圆形,菌株SJ3等的菌落呈白色、褶皱、不光滑。菌株JJ1等的细胞呈圆形或椭圆形,排列方式以单个为主,出芽繁殖;菌株SJ1等的细胞为椭圆形,出芽繁殖后不断裂,形成较规则的分枝状假菌丝;菌株SJ3等的细胞多为椭圆形,分裂后成簇、成链排列形成假菌丝。
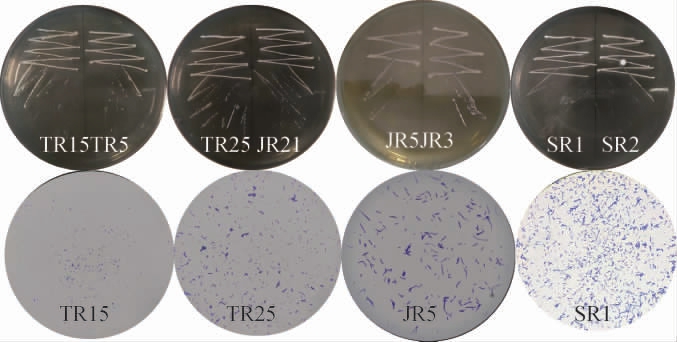
图1 4种乳酸菌菌株的形态学特征
Fig.1 Morphological characteristics of 4 strains of lactic acid bacteria

图2 3种酵母菌的形态学特征
Fig.2 Morphological characteristics of 3 strains of yeasts
表1 分离菌株的菌落及细胞形态特征
Table 1 Colony and cell characteristics of isolated strains

菌种 种类 菌株 菌落形态 细胞形态乳酸菌酵母菌1 2 3 4 1 2 3 TR4、TR5、TR6、TR7、TR8、TR9、TR10、TR11、TR12、TR13、TR14、TR15、TR16、TR17、TR18、TR19、TR20 TR21、TR22、TR23、TR24、TR25、JR21、SR3 JR3、JR5、JR6、JR7、JR8、JR10、JR12、JR13、JR19、JR20 SR1、SR2 JJ1、JJ2、JJ3、JJ4、JJ5、JJ6、JJ8、JJ9、JJ10、JJ11、JJ12、JJ13、JJ14、JJ16、JJ17、JJ18、JJ19、JJ20、TJ1、TJ2、TJ3、TJ4、TJ7、TJ9、TJ11、TJ12、TJ13、TJ14、TJ15、TJ16、TJ20、SJ6、SJ12、SJ13、SJ14、SJ15、SJ17 SJ1、SJ2、SJ5、SJ7、SJ8、SJ9、SJ10、SJ11、SJ16、SJ18、SJ20 SJ3、SJ4、SJ19菌落呈乳白色的半透明圆形状态、小而光滑、边缘整齐、低凸起、湿润、易挑起菌落呈乳白色的不透明圆形状态、大而光滑、边缘整齐、凸起、湿润、易挑起菌落呈乳白色的不透明圆形状态、大而光滑、边缘整齐、凸起、湿润、易挑起菌落呈白色的不透明状态、大而光滑、边缘褶皱呈锯齿状、高凸起、干燥、易挑起单球或双球排列短杆状长杆状短杆状圆形或椭圆形椭圆形椭圆形
2.2.2 分子生物学鉴定
选取代表乳酸菌菌株JR5、TR15、TR25和SR1及代表酵母菌菌株JJ8、SJ19、SJ10进行分子生物学鉴定,结果见图3。由图3可知,乳酸菌菌株JR5、TR15、TR25和SR1分别与旧金山乳杆菌(Lactobacillus sanfranciscensis)、粪肠球菌(Enterococcus faecalis)、植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(Lactobacillus fermentum)聚于一支,亲缘关系最近。酵母菌株JJ8、SJ19、SJ10分别与酿酒酵母(Saccharomyces cerevisiae)、膜毕赤酵母(Pichia membranifaciens)、发酵毕赤酵母(Pichia fermentans)聚于一支,亲缘关系最近。结合形态学特征,最终将36株乳酸菌鉴定为4个种,分别为旧金山乳杆菌(Lactobacillus sanfranciscensis)10株,植物乳杆菌(Lactobacillus plantarum)7株,发酵乳杆菌(Lactobacillus fermentum)2株,粪肠球菌(Enterococcus faecalis)17株;将51株酵母菌鉴定为3个种,分别为发酵毕赤酵母(Pichia fermentans)11株,膜毕赤酵母(Pichia membranifaciens)3株和酿酒酵母(Saccharomyces cerevisiae)37株。
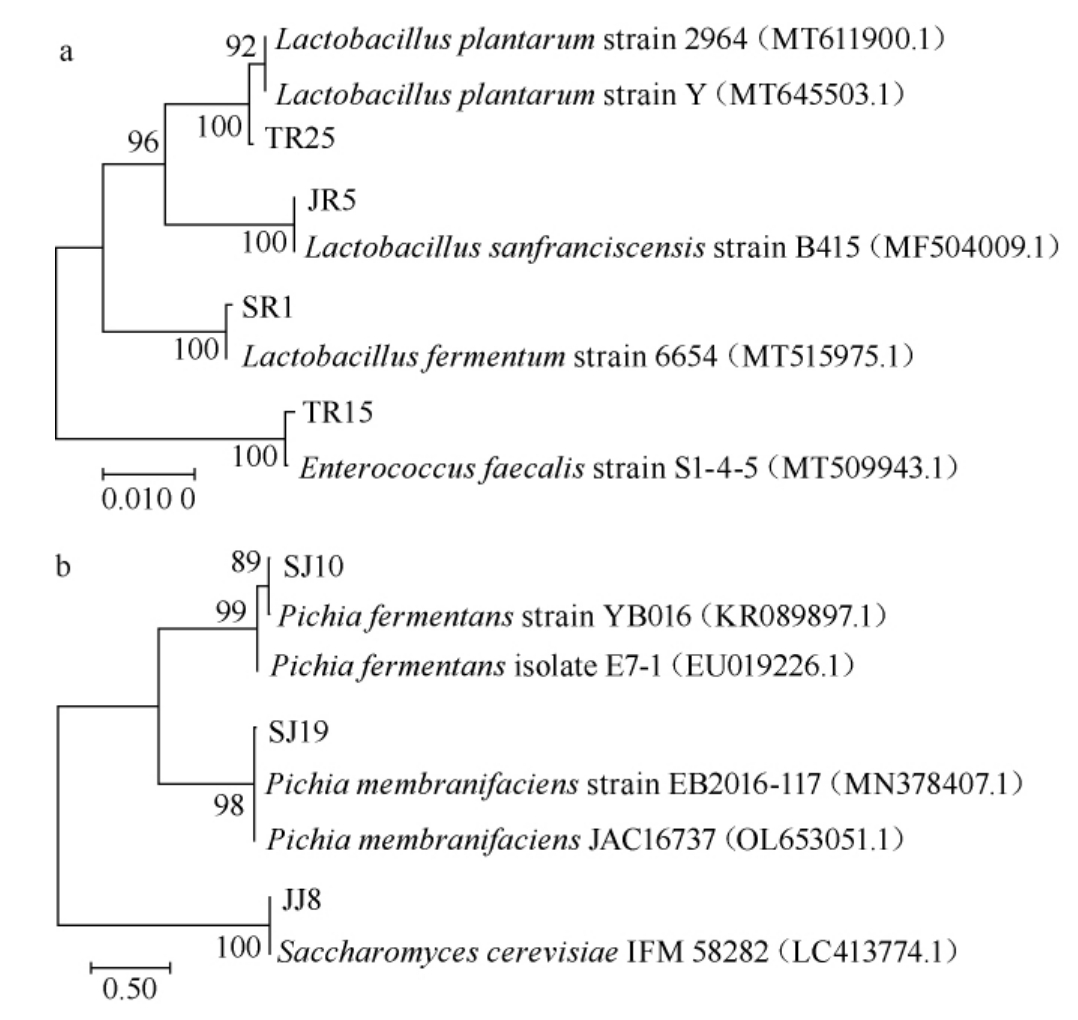
图3 分离乳酸菌(a)和酵母菌(b)菌株的系统发育树
Fig.3 Phylogenetic tree of isolated lactic acid bacteria (a) and yeasts (b)
2.3 不同发酵馕面团样品中菌株的分离情况
不同发酵馕面团样品中分离菌株的分布情况见表2。
表2 不同发酵馕面团样品中乳酸菌和酵母菌的分离菌株数
Table 2 Isolated strains number of lactic acid bacteria and yeasts in different fermented naan sourdough samples
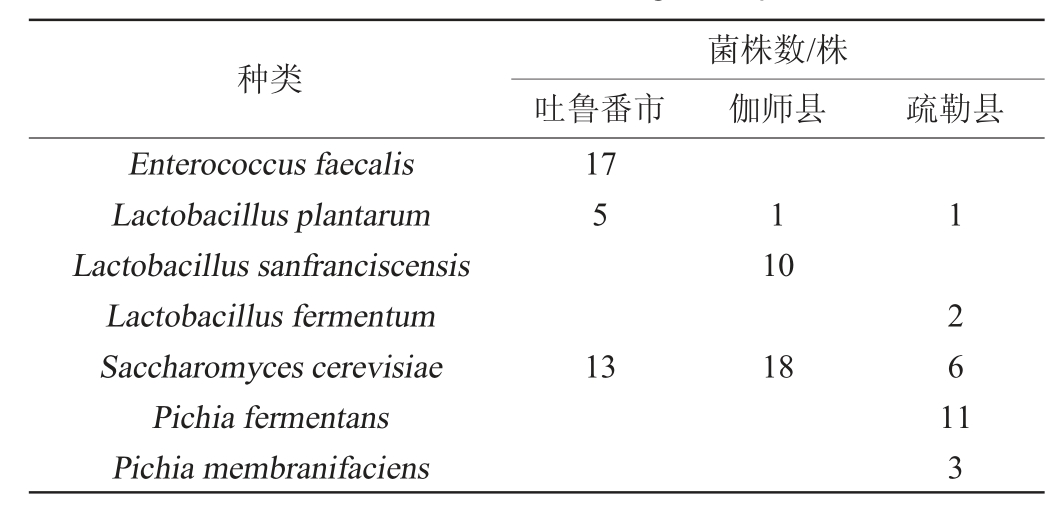
种类Enterococcus faecalis Lactobacillus plantarum Lactobacillus sanfranciscensis Lactobacillus fermentum Saccharomyces cerevisiae Pichia fermentans Pichia membranifaciens吐鲁番市菌株数/株伽师县 疏勒县17 5 1 10 13 18 1 2 6 1 1 3
由表2可知,3个样品中均检测到了植物乳杆菌和酿酒酵母,3个样品中均检测到了2种乳酸菌,粪肠球菌仅在吐鲁番市样品中被发现,旧金山乳杆菌仅在伽师县样品中发现,疏勒县样品中酵母菌种类最多,且发酵毕赤酵母和膜毕赤酵母仅在该样品中被检出。值得注意的是,所有样品中乳酸菌的种类组成都不一样,说明不同县市间传统发酵面团中的优势菌群既存在统一性、又富有特性,可能与区域环境、制作工艺、使用年限等存在相关性。
2.4 分离乳酸菌的产酸情况
36株乳酸菌菌株的产酸情况见表3。由表3可知,不同乳酸菌菌株的产酸能力不同,植物乳杆菌的产酸能力最强,为113.55~127.8 g/L;其次是旧金山乳杆菌,产酸量为28.35~66.00 g/L;然后是粪肠球菌,产酸量为32.70~48.30 g/L;发酵乳杆菌产酸量最少,为10.95~21.45 g/L。由此可见,乳酸菌的种类直接决定发酵面团的酸度。
表3 分离乳酸菌菌株的产酸能力测定结果
Table 3 Determination results of acid production capacity of isolated lactic acid bacteria
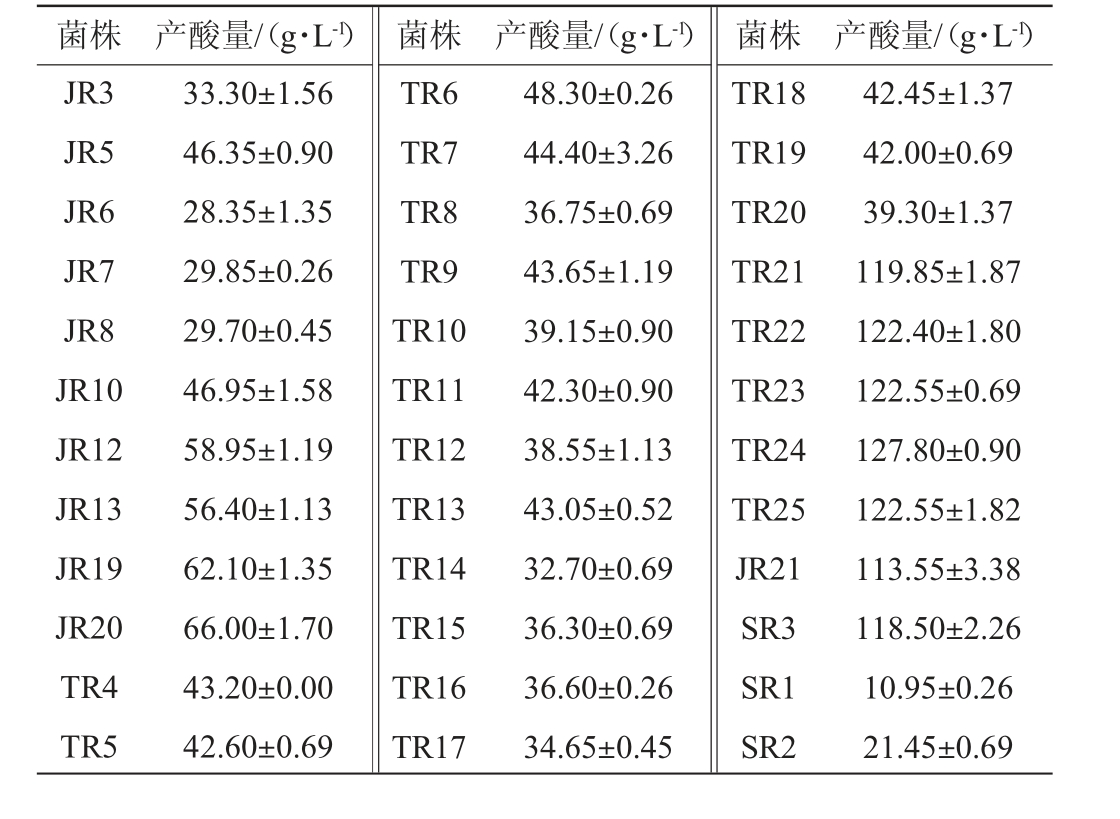
菌株 产酸量/(g·L-1) 菌株 产酸量/(g·L-1) 菌株 产酸量/(g·L-1)JR3 JR5 JR6 JR7 JR8 JR10 JR12 JR13 JR19 JR20 TR4 TR5 33.30±1.56 46.35±0.90 28.35±1.35 29.85±0.26 29.70±0.45 46.95±1.58 58.95±1.19 56.40±1.13 62.10±1.35 66.00±1.70 43.20±0.00 42.60±0.69 TR6 TR7 TR8 TR9 TR10 TR11 TR12 TR13 TR14 TR15 TR16 TR17 48.30±0.26 44.40±3.26 36.75±0.69 43.65±1.19 39.15±0.90 42.30±0.90 38.55±1.13 43.05±0.52 32.70±0.69 36.30±0.69 36.60±0.26 34.65±0.45 TR18 TR19 TR20 TR21 TR22 TR23 TR24 TR25 JR21 SR3 SR1 SR2 42.45±1.37 42.00±0.69 39.30±1.37 119.85±1.87 122.40±1.80 122.55±0.69 127.80±0.90 122.55±1.82 113.55±3.38 118.50±2.26 10.95±0.26 21.45±0.69
2.5 分离酵母菌的产气情况
51株酵母菌菌株的产气情况见表4。由表4可知,51株酵母菌株均能产气,其中酿酒酵母和发酵毕赤酵母产气最快,在培养24 h时几乎充满气体,膜毕赤酵母发酵能力较弱,24 h时不产气,36 h充满气体。
表4 分离酵母菌菌株的产气能力测定结果
Table 4 Determination results of gas production capacity of isolated yeasts
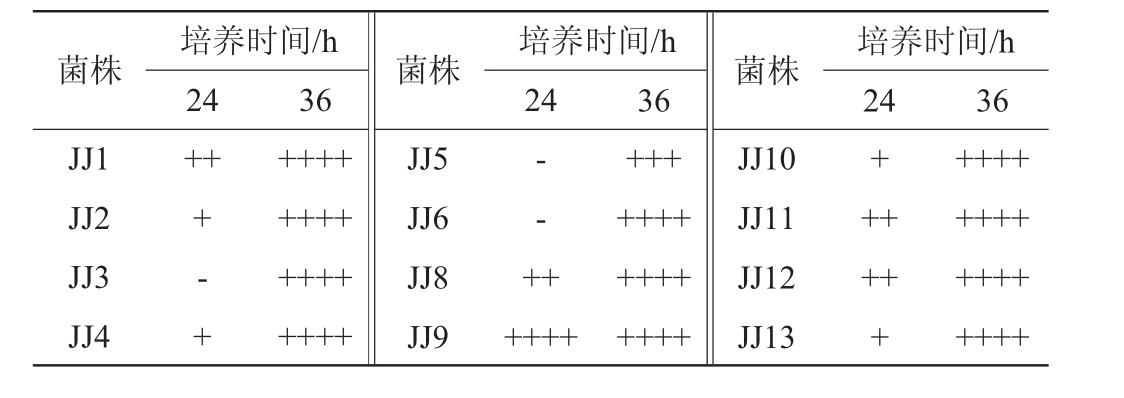
培养时间/h 24 36菌株 菌株JJ1 JJ2 JJ3 JJ4菌株 培养时间/h 36 24 36++++- +++++++++++++++++JJ5 JJ6 JJ8 JJ9++++培养时间/h 24+++++++++++++++-- ++JJ10 JJ11 JJ12 JJ13+++++++++++++++++++++
续表
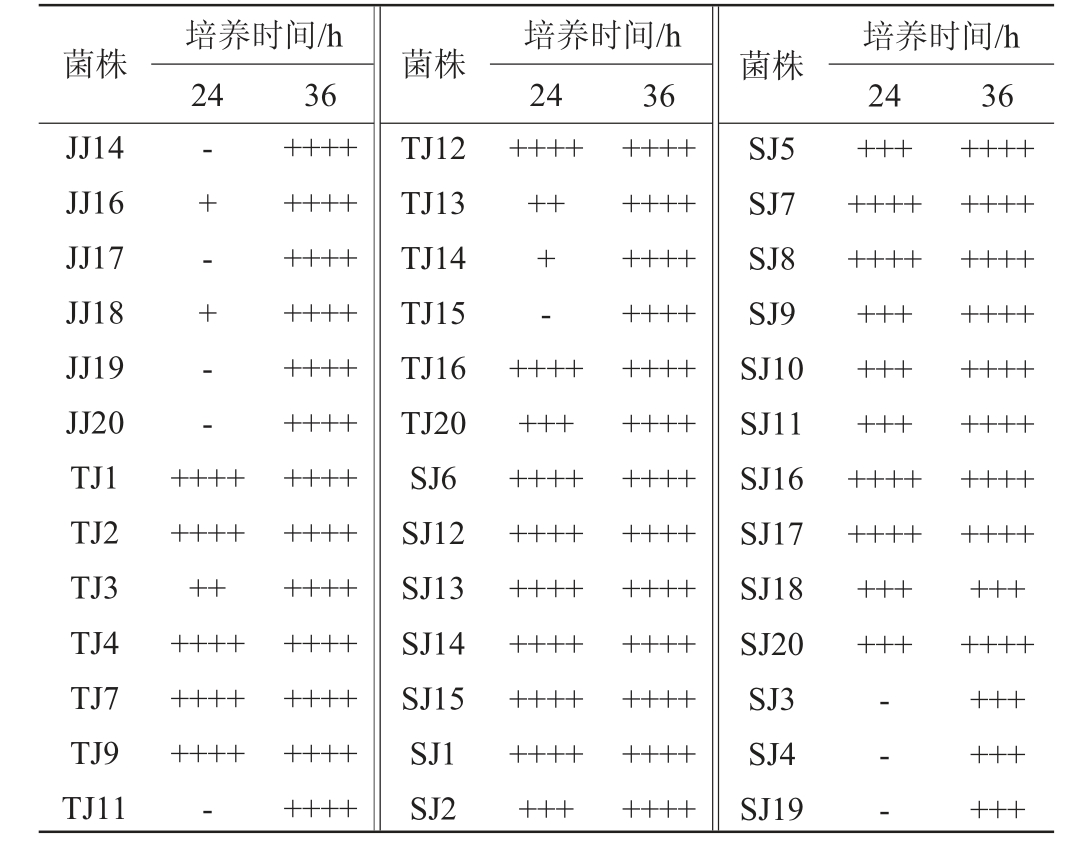
注:“-”表示没有产气;“+”表示产气量约为杜氏小管体积的1/4;“++”表示产气量约为杜氏小管体积的1/2;“+++”表示产气量约为杜氏小管体积的“3/4”;“++++”表示产气量约为杜氏小管体积。
培养时间/h 24 36菌株 菌株JJ14 JJ16 JJ17 JJ18 JJ19 JJ20 TJ1 TJ2 TJ3 TJ4 TJ7 TJ9 TJ11菌株 培养时间/h 36 24 36-+ - + - -+++++++-++++++++++++++++++++++-++++++++++++++++++++++++++++++++++++++++++++++++++++TJ12 TJ13 TJ14 TJ15 TJ16 TJ20 SJ6 SJ12 SJ13 SJ14 SJ15 SJ1 SJ2++++++++++++++++++++++++++++++++++培养时间/h 24++++++++++++++++++++++++++++++++++++++++++++++++++++SJ5 SJ7 SJ8 SJ9 SJ10 SJ11 SJ16 SJ17 SJ18 SJ20 SJ3 SJ4 SJ19++++++++++++++++++++++++++++++++++-- -++++++++++++++++++++++++++++++++++++++++++++++++
2.6 发酵馒头的感官评定及挥发性风味分析
2.6.1 感官评定
以安琪酵母为对照,通过乳酸菌产酸能力分析及酵母菌产气能力分析,挑选植物乳杆菌TR24、发酵毕赤酵母SJ1为菌种发酵面团制备馒头。结果发现,5组馒头(样品1~5)的发酵时间分别为4 h、3.5 h、3 h、3 h和2.5 h,说明随着酵母菌数量增多,产气越快,且安琪酵母的产气速率高于发酵毕赤酵母。5组馒头的感官评分见图4。由图4可知,样品2(乳酸菌与酵母菌比例为1∶2)的感官评分最高,为87分,其酸度适中,组织结构良好。
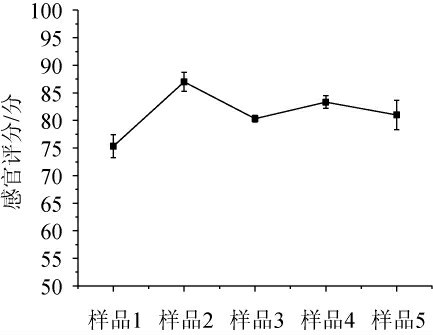
图4 不同发酵馒头样品的感官评分
Fig.4 Sensory scores of different fermented Mantou samples
2.6.2 挥发性风味分析
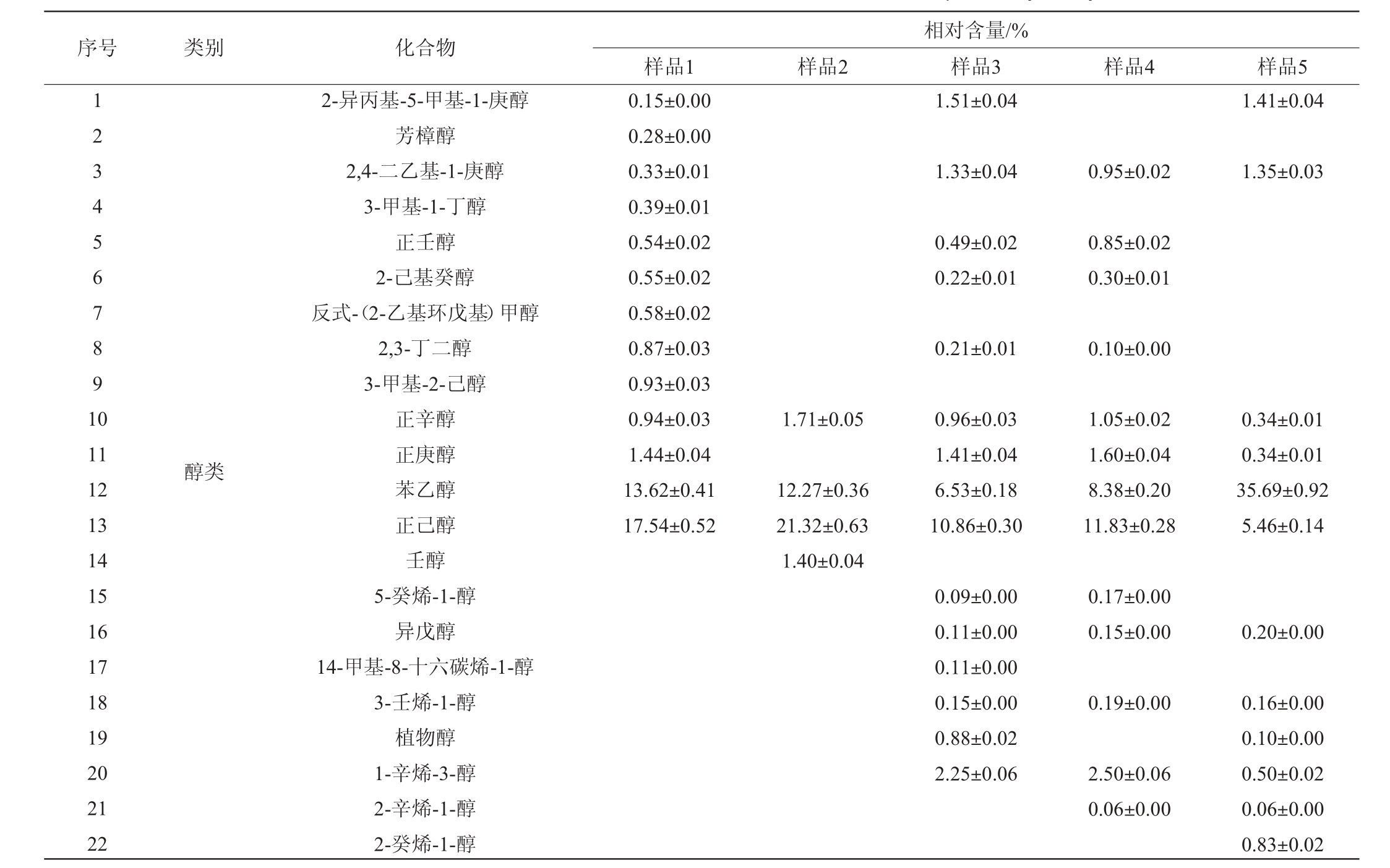
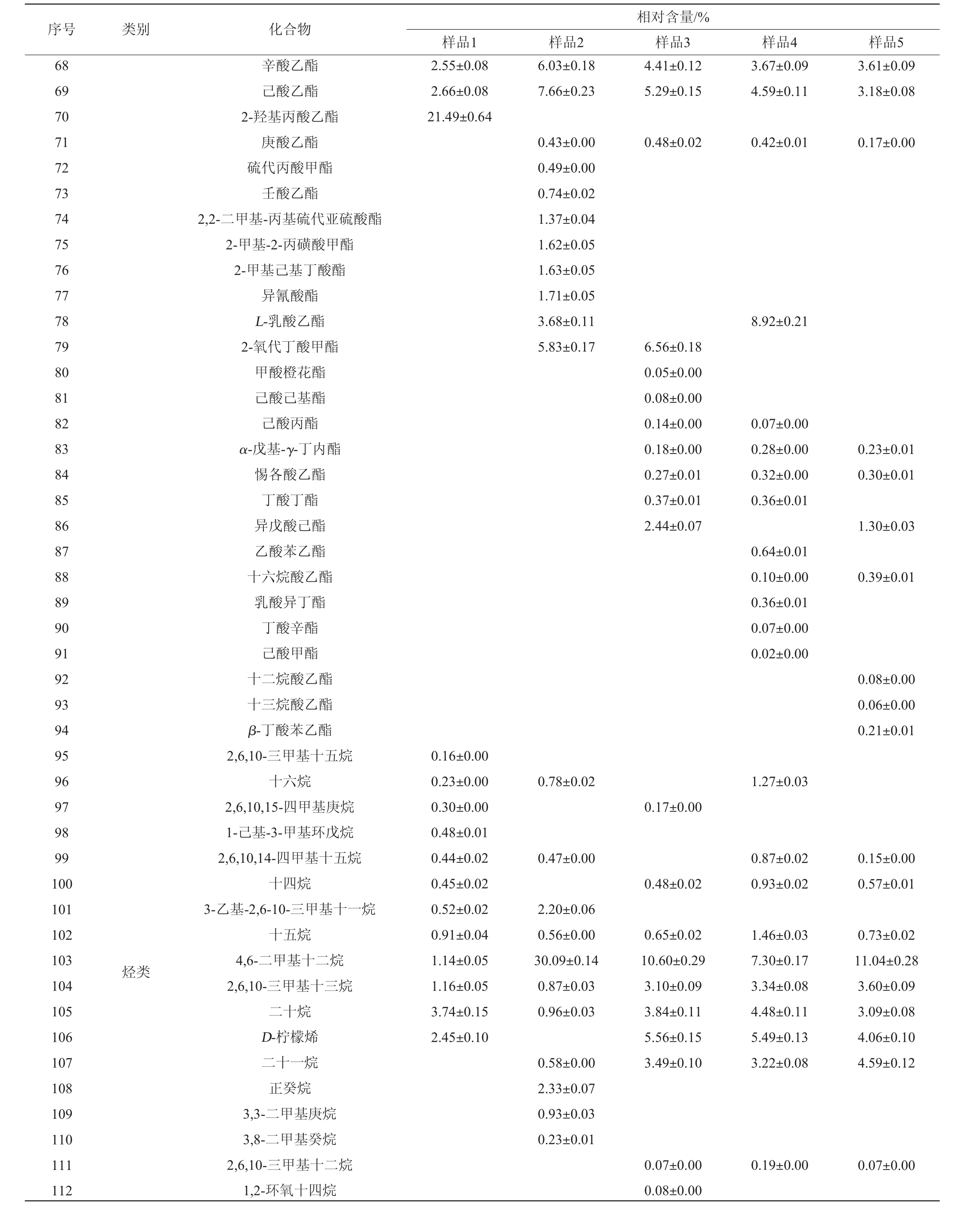
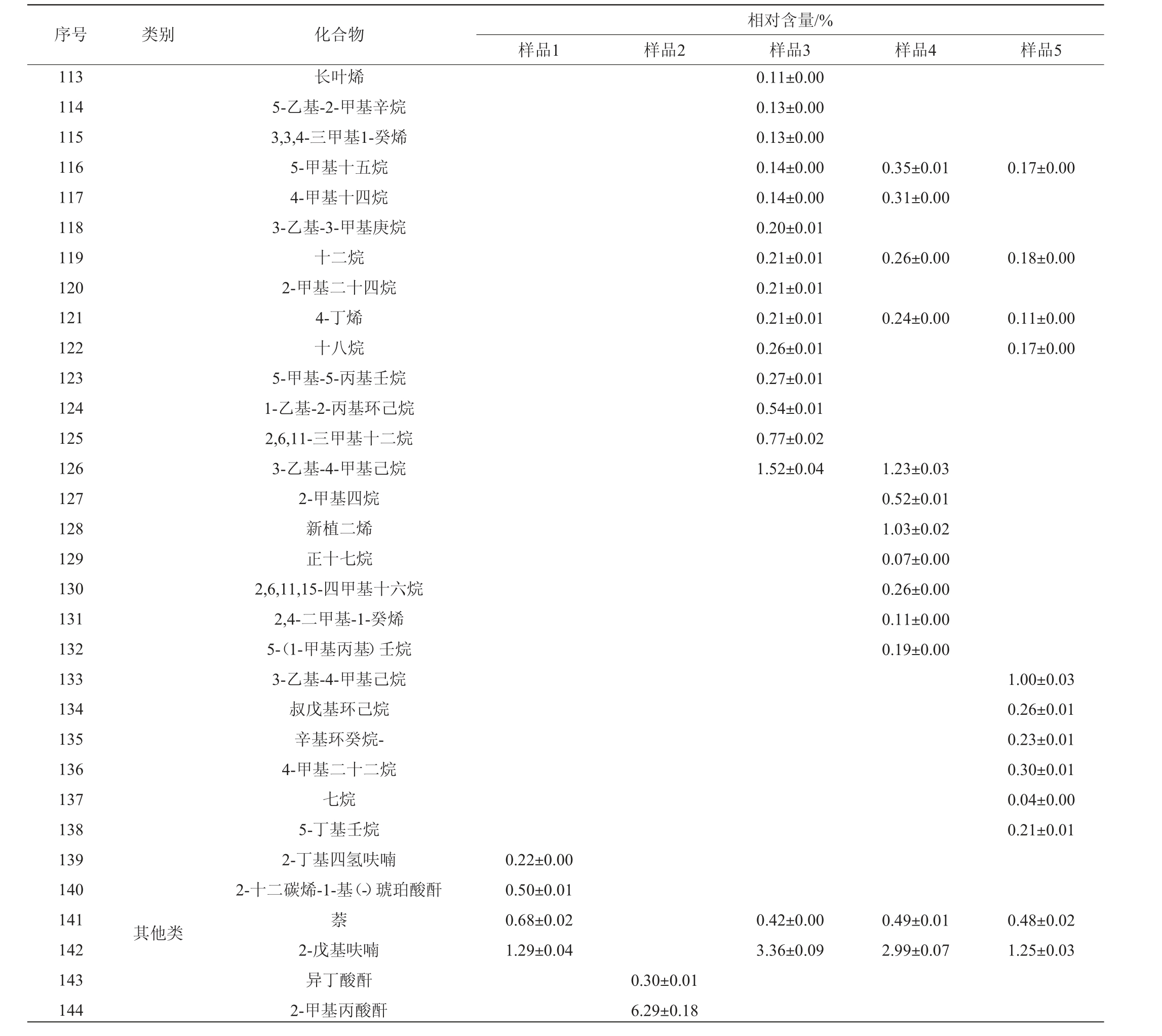
采用GC-MS测定5组发酵馒头样品的挥发性风味成分,结果见表5。
表5 不同发酵馒头样品中挥发性风味物质GC-MS分析结果
Table 5 Results of volatile flavor substances in different fermented Mantou samples analyzed by GC-MS
序号 类别 化合物1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22醇类2-异丙基-5-甲基-1-庚醇芳樟醇2,4-二乙基-1-庚醇3-甲基-1-丁醇正壬醇2-己基癸醇反式-(2-乙基环戊基)甲醇2,3-丁二醇3-甲基-2-己醇正辛醇正庚醇苯乙醇正己醇壬醇5-癸烯-1-醇异戊醇14-甲基-8-十六碳烯-1-醇3-壬烯-1-醇植物醇1-辛烯-3-醇2-辛烯-1-醇2-癸烯-1-醇样品1 样品2 0.15±0.00 0.28±0.00 0.33±0.01 0.39±0.01 0.54±0.02 0.55±0.02 0.58±0.02 0.87±0.03 0.93±0.03 0.94±0.03 1.44±0.04 13.62±0.41 17.54±0.52 1.71±0.05 12.27±0.36 21.32±0.63 1.40±0.04相对含量/%样品3 样品4 样品5 1.51±0.04 1.41±0.04 1.33±0.04 0.95±0.02 1.35±0.03 0.49±0.02 0.22±0.01 0.85±0.02 0.30±0.01 0.21±0.01 0.10±0.00 0.96±0.03 1.41±0.04 6.53±0.18 10.86±0.30 1.05±0.02 1.60±0.04 8.38±0.20 11.83±0.28 0.34±0.01 0.34±0.01 35.69±0.92 5.46±0.14 0.09±0.00 0.11±0.00 0.11±0.00 0.15±0.00 0.88±0.02 2.25±0.06 0.17±0.00 0.15±0.00 0.20±0.00 0.19±0.00 2.50±0.06 0.06±0.00 0.16±0.00 0.10±0.00 0.50±0.02 0.06±0.00 0.83±0.02
续表

序号 类别 化合物23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67醛类酮类酸类酯类14-甲基-8-十六碳烯-1-醇1-二十烷醇2-乙酰基-1-辛醇2-丁基辛醇苯乙醛椰子醛2-壬烯醛庚醛苯甲醛辛烷醛己醛壬醛癸醛2-辛烯醛3-羟基丁醛2-庚烯醛2-丁基-2-辛烯醛7-十六碳烯醛十一醛甲基庚烯酮香叶基丙酮1,3-二叔丁基氮丙啶-2-酮顺式-2-硝基-4-叔丁基环己酮4,5-辛二酮丙酮樟脑2-庚酮2-壬酮6,10-二甲基-5,9-十一双烯-2-酮5,9-二甲基-2-癸酮2-辛基环己酮2-甲基3-庚酮庚酸正十六烷酸正癸酸己酸4-甲基壬酸亚油酸邻苯二甲酸二丁酯癸酸乙酯己酸丁酯乙酸苯乙酯乙酸己基酯乳酸异戊酯2-甲基己基丁酸酯样品1 样品2 0.31±0.00 0.31±0.00 0.36±0.01 0.42±0.01 0.44±0.01 1.35±0.02 2.22±0.07 3.96±0.12 0.82±0.02 1.11±0.03 0.54±0.00 3.10±0.09 1.44±0.04 2.16±0.06 0.65±0.02 0.48±0.00 0.56±0.00 0.57±0.00 1.46±0.04 2.93±0.09 0.30±0.01 0.19±0.00 0.24±0.00 0.45±0.01 0.65±0.02 0.72±0.02 0.96±0.03 1.14±0.03 1.89±0.06 0.53±0.00 1.02±0.03 0.70±0.02相对含量/%样品3 样品4 样品5 0.11±0.06 0.07±0.04 0.21±0.00 1.08±0.03 0.56±0.02 1.28±0.03 0.71±0.02 0.49±0.02 0.40±0.02 1.85±0.05 2.07±0.06 3.76±0.10 1.15±0.03 0.73±0.02 0.30±0.01 0.17±0.00 0.11±0.00 0.09±0.00 0.65±0.02 1.37±0.03 1.49±0.03 2.90±0.07 0.79±0.02 1.09±0.03 0.30±0.01 0.21±0.00 0.13±0.00 0.30±0.01 0.89±0.02 2.22±0.06 2.27±0.06 1.13±0.03 0.51±0.02 1.48±0.04 0.09±0.00 1.31±0.03 0.93±0.02 0.06±0.00 0.10±0.00 0.34±0.19 1.09±0.04 0.03±0.00 0.07±0.00 0.05±0.00 0.13±0.00 0.19±0.00 0.06±0.00 0.20±0.00 0.23±0.01 0.06±0.00 0.07±0.00 0.07±0.06 0.40±0.01 0.10±0.00 0.13±0.00 0.06±0.00 0.18±0.00 0.63±0.02 0.36±0.01 1.21±0.03 0.95±0.02 0.55±0.01 0.63±0.01 1.77±0.05 0.47±0.02 1.49±0.03 0.96±0.02 0.08±0.00 0.26±0.01 0.95±0.02 0.70±0.02 0.49±0.02 0.80±0.02
续表
序号 类别 化合物68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112烃类辛酸乙酯己酸乙酯2-羟基丙酸乙酯庚酸乙酯硫代丙酸甲酯壬酸乙酯2,2-二甲基-丙基硫代亚硫酸酯2-甲基-2-丙磺酸甲酯2-甲基己基丁酸酯异氰酸酯L-乳酸乙酯2-氧代丁酸甲酯甲酸橙花酯己酸己基酯己酸丙酯α-戊基-γ-丁内酯惕各酸乙酯丁酸丁酯异戊酸己酯乙酸苯乙酯十六烷酸乙酯乳酸异丁酯丁酸辛酯己酸甲酯十二烷酸乙酯十三烷酸乙酯β-丁酸苯乙酯2,6,10-三甲基十五烷十六烷2,6,10,15-四甲基庚烷1-己基-3-甲基环戊烷2,6,10,14-四甲基十五烷十四烷3-乙基-2,6-10-三甲基十一烷十五烷4,6-二甲基十二烷2,6,10-三甲基十三烷二十烷D-柠檬烯二十一烷正癸烷3,3-二甲基庚烷3,8-二甲基癸烷2,6,10-三甲基十二烷1,2-环氧十四烷样品1 样品2 2.55±0.08 2.66±0.08 21.49±0.64 6.03±0.18 7.66±0.23 0.43±0.00 0.49±0.00 0.74±0.02 1.37±0.04 1.62±0.05 1.63±0.05 1.71±0.05 3.68±0.11 5.83±0.17 0.16±0.00 0.23±0.00 0.30±0.00 0.48±0.01 0.44±0.02 0.45±0.02 0.52±0.02 0.91±0.04 1.14±0.05 1.16±0.05 3.74±0.15 2.45±0.10 0.78±0.02 0.47±0.00 2.20±0.06 0.56±0.00 30.09±0.14 0.87±0.03 0.96±0.03 0.58±0.00 2.33±0.07 0.93±0.03 0.23±0.01相对含量/%样品3 样品4 样品5 4.41±0.12 5.29±0.15 3.67±0.09 4.59±0.11 3.61±0.09 3.18±0.08 0.48±0.02 0.42±0.01 0.17±0.00 8.92±0.21 6.56±0.18 0.05±0.00 0.08±0.00 0.14±0.00 0.18±0.00 0.27±0.01 0.37±0.01 2.44±0.07 0.07±0.00 0.28±0.00 0.32±0.00 0.36±0.01 0.23±0.01 0.30±0.01 1.30±0.03 0.64±0.01 0.10±0.00 0.36±0.01 0.07±0.00 0.02±0.00 0.39±0.01 0.08±0.00 0.06±0.00 0.21±0.01 1.27±0.03 0.17±0.00 0.48±0.02 0.87±0.02 0.93±0.02 0.15±0.00 0.57±0.01 0.65±0.02 10.60±0.29 3.10±0.09 3.84±0.11 5.56±0.15 3.49±0.10 1.46±0.03 7.30±0.17 3.34±0.08 4.48±0.11 5.49±0.13 3.22±0.08 0.73±0.02 11.04±0.28 3.60±0.09 3.09±0.08 4.06±0.10 4.59±0.12 0.07±0.00 0.08±0.00 0.19±0.00 0.07±0.00
续表
序号 类别 化合物113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144其他类长叶烯5-乙基-2-甲基辛烷3,3,4-三甲基1-癸烯5-甲基十五烷4-甲基十四烷3-乙基-3-甲基庚烷十二烷2-甲基二十四烷4-丁烯十八烷5-甲基-5-丙基壬烷1-乙基-2-丙基环己烷2,6,11-三甲基十二烷3-乙基-4-甲基己烷2-甲基四烷新植二烯正十七烷2,6,11,15-四甲基十六烷2,4-二甲基-1-癸烯5-(1-甲基丙基)壬烷3-乙基-4-甲基己烷叔戊基环己烷辛基环癸烷-4-甲基二十二烷七烷5-丁基壬烷2-丁基四氢呋喃2-十二碳烯-1-基(-)琥珀酸酐萘2-戊基呋喃异丁酸酐2-甲基丙酸酐样品1 样品2 0.22±0.00 0.50±0.01 0.68±0.02 1.29±0.04 0.30±0.01 6.29±0.18相对含量/%样品3 样品4 样品5 0.11±0.00 0.13±0.00 0.13±0.00 0.14±0.00 0.14±0.00 0.20±0.01 0.21±0.01 0.21±0.01 0.21±0.01 0.26±0.01 0.27±0.01 0.54±0.01 0.77±0.02 1.52±0.04 0.35±0.01 0.31±0.00 0.17±0.00 0.26±0.00 0.18±0.00 0.24±0.00 0.11±0.00 0.17±0.00 1.23±0.03 0.52±0.01 1.03±0.02 0.07±0.00 0.26±0.00 0.11±0.00 0.19±0.00 1.00±0.03 0.26±0.01 0.23±0.01 0.30±0.01 0.04±0.00 0.21±0.01 0.42±0.00 3.36±0.09 0.49±0.01 2.99±0.07 0.48±0.02 1.25±0.03
由表5可知,样品4和5中分别检测出75和67种挥发性风味物质,其中相同的物质有45种。相对含量差值>1%的醇类物质有苯乙醇、2-异丙基-5-甲基-1-庚醇、正庚醇、苯乙醇、正己醇、1-辛烯-3-醇、2-丁基辛醇,酯类的乳酸异戊酯、己酸乙酯、L-乳酸乙酯、异戊酸己酯,醛类物质有2-辛烯醛,酯类类物质有己酸乙酯、L-乳酸乙酯、异戊酸己酯,烃类物质有十六烷、4,6-二甲基十二烷、二十烷、D-柠檬烯、二十一烷、3-乙基-4-甲基己烷、新植二烯、3-乙基-4-甲基己烷,其他类物质有2-戊基呋喃、2-甲基丙酸酐。总体来看两类酵母发酵的馒头在醇类和酯类物质的相对含量上差异较大,筛选的发酵毕赤酵母相较于传统安琪酵母醇类物质有所降低和酯类物质有所增加;在醛类、酯类和烃类物质的数量上也有一定差异,因此,筛选的发酵毕赤酵母菌株可应用于寻求与传统安琪酵母风味不同的馒头开发上。
由表5亦可知,样品1、2、3分别检测出50种、42种、75种挥发性风味物质,其中相同的物质有15种,说明3个馒头样品中各类挥发性风味物质的种类差异较大。植物乳杆菌和发酵毕赤酵母混菌发酵时,发酵毕赤酵母添加量对两种菌的生长和代谢产物有一定影响,进而形成了不同的风味物质成分。将感官评价得分最高的样品2和样品4进行对比,可知添加乳酸菌菌株使馒头挥发性风味物质发生较大变化,增加了醇类和酯类物质的相对含量(醇类物质由29.42%增加至36.70%;酯类物质由24.40%增至35.33%),降低了烃类物质的相对含量(由33.12%降至9.91%)。将样品2和样品5进行对比,可知筛选的乳酸菌和发酵毕赤酵母混菌发酵与传统安琪酵母发酵相比,醇类(由46.62%降至36.7%)、醛类(由9.09%降至7.05%)、烃类物质(由30.57%降至9.91%)降低,酮类(由1.53%增加至3.07%)、酯类(由12.73%增加至35.33%)升高,从而形成不同于安琪酵母的风味。
3 结论
通过传统培养分离方法从采集自新疆吐鲁番市、喀什地区伽师县及疏勒县的三份发酵馕面团样品中共分离纯化得到36株乳酸菌和51株酵母菌,通过形态观察及分子生物学技术鉴定发现乳酸菌共有4种,分别为旧金山乳杆菌(Lactobacillus sanfranciscensis)、植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(Lactobacillus fermentum)和粪肠球菌(Enterococcus faecalis);酵母菌种共3种,分别为发酵毕赤酵母(Pichia fermentans)、膜毕赤酵母(Pichia membran ifaciens)和酿酒酵母(Saccharomyces cerevisiae)。从数量和分布上看,酿酒酵母(37株)占比酵母菌总数的72%,为优势菌株。乳酸菌中植物乳杆菌产酸量最大,为113.55~127.8 g/L;酵母菌中酿酒酵母和发酵毕赤酵母产气较快。以安琪酵母为对照,选择优良的菌株发酵制备馒头,结果发现,发酵毕赤酵母与安琪酵母单独发酵馒头时,在醇类和酯类物质的种类和相对含量上差异较大,风味差异明显;植物乳杆菌与发酵毕赤酵母混菌发酵时,随着发酵毕赤酵母添加量增加,可降低馒头中醇类、醛类和烃类物质的相对含量,增加酮类和酯类物质的相对含量,从而形成不同于安琪酵母发酵馒头的风味;当植物乳杆菌与发酵毕赤酵母添加比例为1∶2时,馒头的感官评分最高,为87分。
[1]仇成功,丁帅杰,李仙爱,等.全麦粉的添加对油馕面团品质的影响[J].食品科学,2022,43(18):55-61.
[2]杨蕾,刘军,王孟楠,等.国内外馕制品研究进展[J].食品工业,2023,44(6):209-213.
[3] MUEEN-UD-DIN G, ANJUM F M, NAWAZ H.Quality of flat bread(Naan)from Pakistani wheat varieties[J].Pakistan J Agr Sci,2007,44(1):171-175.
[4]王毅,郭英,杨晓琴.喀什特色馕的营养成分分析和评价[J].现代食品,2022,28(23):205-208.
[5]刘同杰,李云,吴诗榕,等.传统酸面团中细菌与酵母菌的分离与鉴定[J].现代食品科技,2014,30(9):114-120.
[6]玛依古丽·库尔班,米尔班古丽·阿卜杜如苏力,麦合甫再木·阿不都热合曼,等.新疆地方特色馕面团优良酵母菌的筛选[J].安徽农业科学,2015,43(17):302-305.
[7]于静,许倩,李芬,等.新疆7地区馕用酸面团微生物多样性分析[J].食品研究与开发,2023,44(2):183-189.
[8]方靖,陈中,林伟锋,等.乳酸菌发酵剂对直接发酵法生产面包品质的影响[J].食品工业科技,2013,34(10):212-214.
[9]王雪婷,廖钰婷,何瑞,等.传统酸面团中优良菌种的筛选、鉴定及在苦荞麸皮馒头中的应用[J].食品科技,2017,42(2):156-164.
[10]SIVASANKARAN C,AROCKIASWAMY W J,RAMAUNJAM P,et al.Prevention of bread spoilage and to enhance the quality of bread by using lactic acid bacteria[J].Int J ChemTech Res,2014,6(9):4161-4165.
[11]尹雪,郭雪峰,帕提古丽·毛拉红,等.传统发面面肥中乳酸菌的分离与鉴定[J].食品工业科技,2017,38(14):141-145.
[12]孙禹,马艳,王之超,等.海兰褐蛋鸡盲肠中乳酸菌的分离与鉴定[J].饲料研究,2023,46(5):61-64.
[13]魏艳,曾小群,潘道东,等.新疆地区不同酸奶中优势乳酸菌的分离与鉴定[J].中国食品学报,2012,12(12):161-166.
[14]姜蕾.焉耆葡萄产区非酿酒酵母菌的筛选及呈香效应研究[D].石河子:石河子大学,2019.
[15]马莉,刘慧燕,方海田,等.产γ-氨基丁酸乳酸菌的分离鉴定及其发酵条件优化[J].中国酿造,2022,41(7):94-100.
[16]田辉,谢引荣,王琰,等.三种传统发酵食品中酵母菌的分离鉴定与特性分析[J].中国酿造,2022,41(3):87-92.
[17]熊荣园,王黎明,魏玲,等.柑橘及桑葚中优质酵母菌的筛选及鉴定[J].中国酿造,2023,42(4):163-167.
[18]宁亚维,赵忠情,孙颖,等.抗龋齿口腔益生乳酸菌的筛选[J].食品科学,2023,44(10):195-204.
[19]王嘉琪,吕铭守,凃婧,等.云南建水酸浆豆腐中乳酸菌的生长特性[J].食品工业科技,2018,39(8):90-94.
[20]胡楠,雷鸣,王硕.传统发酵蓝莓饮料中酵母菌的分离鉴定及筛选[J].中国酿造,2019,38(12):58-62.
[21]黄承芳,曹珂珂,李虹,等.燕麦馒头制作工艺的优化[J].安徽农学通报,2020,26(24):144-146.
[22]付丽红,刘璐婕,张茹,等.小米混合面团特性及馒头制作工艺研究[J].食品研究与开发,2021,42(20):63-70.
[23]乞萌,魏冠棉,李丽娜,等.不同酵母发酵面团特性分析及其对馒头品质的影响[J/OL].食品科学,1-16.http://kns.cnki.net/kcms/detail/11.2206.TS.20231010.0845.012.html.
[24]刘艳红,康佳茜,肖诗雨,等.益生菌对馒头感官品质及风味的影响[J].中国食品学报,2023,23(2):164-172.
[25]吴庆,卜晓苑,辛世华,等.传统酸面团菌群结构及其风味物质分析[J].中国粮油学报,2023,38(4):42-50.