畜禽养殖中,抗生素的不合理使用导致细菌耐药性和药物残留等问题日益严峻。因此,寻找安全、绿色、无污染的抗生素替代品成为必然。葡萄糖氧化酶(glucose oxidase,GOD)和乳酸菌作为绿色添加剂,以其安全、无残留、益生作用成为研究的热点。葡萄糖氧化酶(GOD)是一种需氧脱氢酶,以β-D-葡萄糖氧化还原酶为主要成分。GOD绝大部分来源于微生物,主要是青霉和黑曲霉[1]。目前,葡萄糖氧化酶已被广泛应用于饲料业、食品业和医药等领域[2]。1999年我国农业部将GOD定为允许使用的12种饲料酶制剂添加剂之一,以清除体内肠道病原菌的生存环境为目的[3-5]。GOD能够专一氧化葡萄糖生成葡萄糖酸和过氧化氢,具有抑制病原菌和霉菌生长的作用,促进乳酸菌等厌氧菌的增殖[6-8]。同时乳酸菌具有调节肠道菌群平衡、促进动物生长和提高饲料转化率等作用[9-10]。大量研究表明,GOD还具有部分抗生素效果,能够提高动物生产性能、保护肠道健康和增强动物免疫力等作用[11-12]。马菲璐等[13]研究发现,在仔猪日粮中添加200 mg/kg GOD,平衡肠道微生物环境,改善生长性能,提升免疫功能。荆新堂等[14]研究发现,在饮水中添加100 U/L GOD能够提高肉鸡生长性能和养殖效率。李嘉辉等[15]研究发现,在产蛋后期蛋种鸡日粮中添加500 mg/kg GOD可显著改善产蛋率和料蛋比,提高蛋壳厚度和哈氏单位。段鹏[16]研究发现,在肠道感染的乳猪日粮中添加乳酸菌,可以提高平均日增重,提高乳猪营养物质消化率,改善生长性能。李祖凤等[17]研究发现,复合乳酸菌能够显著提高犊牛平均日增重、降低料重比、抑制大肠杆菌增殖和提升免疫力等效果。目前,相关研究主要集中在单一GOD或乳酸菌制剂替代抗生素上,两者联合应用研究较少。
大肠杆菌(Escherichia coli)和沙门氏菌(Salmonella)是两种重要的人畜共患病致病菌,严重威胁畜禽健康、食品安全、人类健康和公共安全[18]。大肠杆菌是肠道内最多、最常见的一种病原菌,少数血清型的大肠杆菌具有致病性,可引起严重的肠道感染[19-20]。沙门氏菌是最常见的食源性致病菌,也是一种人畜共患疾病[21]。两者均属于肠道菌,常混合感染,且发病症状相似,给我国养殖业带来严重损失[22]。GOD和乳酸菌均可降低畜禽胃肠道pH值,抑制大肠杆菌和沙门氏菌等致病微生物的生长[23]。
体外抑菌试验能快速评价待测样品的抑菌性能。单春乔等[24]研究发现,GOD对不同来源致病菌具有抑菌性,且在一定浓度范围内随浓度增加抑菌性能增强。汤海鸥等[6]开展了GOD体外抑菌试验,发现其对大肠杆菌和沙门氏菌生长具有明显的抑制效果,低剂量时也具有良好的抑制大肠杆菌生长的作用。孙悦等[25]研究发现,乳酸菌可通过膜损伤发挥拮抗作用抑制大肠杆菌生长。葡萄糖氧化酶(GOD)和乳酸菌作为绿色添加剂,以其安全、无残留,益生作用成为研究的热点。葡萄糖氧化酶和乳酸菌都有抑菌性能,开发具有抑菌抗炎作用的微生态制剂时,需要考虑葡萄糖氧化酶是否可以和乳酸菌一起使用,不会对乳酸菌生长造成影响。
本研究采用牛津杯法研究GOD和乳酸菌对鸡源、猪源大肠杆菌和沙门氏菌抑菌作用,以期为开发具有抑菌作用的复合GOD和乳酸菌产品提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂耐高温葡萄糖氧化酶(GOD)(酶活性为2 000 U/g):由济南某公司提供。其他试剂均为国产分析纯。
1.1.2 培养基
营养肉汤培养基、营养琼脂培养基、MRS肉汤培养基、MRS琼脂培养基、伊红美兰琼脂培养基:青岛海博生物技术有限公司。
1.1.3 菌株
病原菌:鸡源大肠杆菌(Escherichia coli)O1、O2和O78;猪源大肠杆菌(Escherichia coli)K88和K99;沙门氏菌(Salmonella)0129、0526和0533;植物乳杆菌(Lactobacillus plantarum)BLCC2-0015、BLCC2-0126和BLCC2-0410;所有菌株均由山东宝来利来生物工程股份有限公司菌种资源保藏中心保存。
1.2 仪器与设备
HPX-9082MBE电热恒温培养箱:上海博迅实业有限公司;SW-CJ-2F(2)超净工作台:苏州安泰空气技术有限公司;DHG-9140A电热鼓风干燥箱:常州诺基仪器有限公司;HH-4恒温水浴锅:国华电器有限公司;THZ-C恒温振荡器:扬州培英实验仪器有限公司。
1.3 方法
1.3.1 病原菌的制备
复苏冻干病原菌菌种制成菌悬液,用灭菌生理盐水稀释,均匀涂布于营养琼脂培养基平板上,37 ℃培养16 h。挑取单菌落接种于营养肉汤培养基上,于37 ℃、180 r/min条件下振荡培养16 h,4 ℃保存,备用。
1.3.2 抑菌试验
(1)不同酶活GOD对病原菌抑菌性能的影响
将GOD用灭菌的乙酸盐缓冲液分别稀释成10 U/mL、20 U/mL、50 U/mL、100 U/mL、200 U/mL、500 U/mL 和1 000 U/mL共7个浓度,用滤膜过滤除菌,然后将稀释好的酶液分别与0.2 g/mL葡萄糖溶液等体积混合,37 ℃温育30 min后采用牛津杯法检测抑菌性能。于37 ℃恒温培养箱中培养18~24 h,测定抑菌圈直径。每个样品做3个平行。
(2)温度对GOD抑菌性能的影响
取10.0 g GOD样品分别置于37 ℃、45 ℃、55 ℃、65 ℃、75 ℃干燥烘箱中处理10 min,然后用灭菌的乙酸盐缓冲液配制成20 U/mL的GOD溶液,用滤膜过滤除菌,再与0.2 g/mL葡萄糖溶液等体积混合,37 ℃温育30 min后采用牛津杯法检测抑菌性能。于37 ℃恒温培养箱中培养18~24 h,测定抑菌圈直径。每个样品做3个平行。
(3)乳酸菌对病原菌抑菌性能的影响
将植物乳杆菌BLCC2-0015、BLCC2-0126和BLCC2-0410按照2%接种量分别接种到MRS肉汤培养基中,37 ℃恒温培养箱静置培养24 h,采用牛津杯法检测植物乳杆菌发酵液对病原菌的抑菌性能。
1.3.3 数据处理
试验数据用Excel 2013软件进行初步处理后,采用SPSS 13.0进行统计分析,采用One-way ANOVA进行方差分析,最小显著差数(least significant difference,LSD)法进行组间多重比较,结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 不同酶活GOD对病原菌的抑制效果
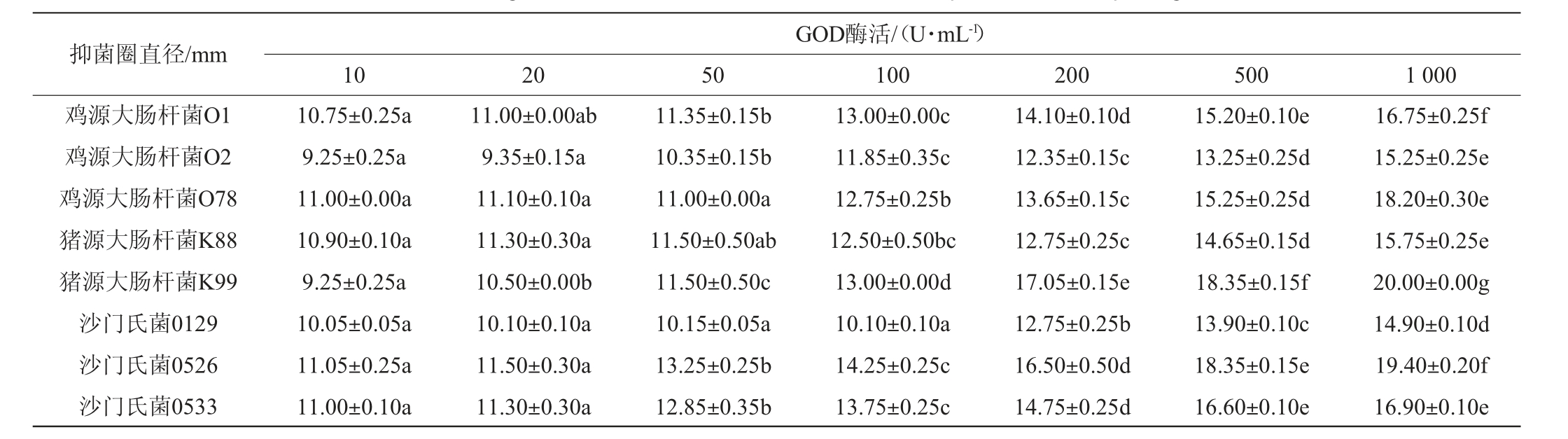
不同酶活GOD对大肠杆菌和沙门氏菌的抑制作用见表1。由表1可知,GOD酶活为10 U/mL和20 U/mL时对鸡源大肠杆菌O1和O2的抑制作用无显著差异(P>0.05),之后随GOD酶活的增加抑菌效果显著增加(P<0.05);GOD酶活为10 U/mL、20 U/mL和50 U/mL之间对鸡源大肠杆菌O78的抑菌效果差异不显著(P>0.05)。GOD酶活为100 U/mL、200 U/mL、500 U/mL和1 000 U/mL时抑菌效果均显著高于50 U/mL(P<0.05),且相互间差异均显著(P<0.05)。
表1 不同酶活葡萄糖氧化酶对病原菌抑菌性能的影响
Table 1 Effect of different glucose oxidase activities on bacteriostatic performance of pathogenic bacteria
注:同行数据肩标不同小写字母表示差异显著(P<0.05),含相同小写字母或无字母表示差异不显著(P>0.05)。下同。
抑菌圈直径/mm鸡源大肠杆菌O1鸡源大肠杆菌O2鸡源大肠杆菌O78猪源大肠杆菌K88猪源大肠杆菌K99沙门氏菌0129沙门氏菌0526沙门氏菌0533 GOD酶活/(U·mL-1)10 20 50 100 200 500 1 000 10.75±0.25a 9.25±0.25a 11.00±0.00a 10.90±0.10a 9.25±0.25a 10.05±0.05a 11.05±0.25a 11.00±0.10a 11.00±0.00ab 9.35±0.15a 11.10±0.10a 11.30±0.30a 10.50±0.00b 10.10±0.10a 11.50±0.30a 11.30±0.30a 11.35±0.15b 10.35±0.15b 11.00±0.00a 11.50±0.50ab 11.50±0.50c 10.15±0.05a 13.25±0.25b 12.85±0.35b 13.00±0.00c 11.85±0.35c 12.75±0.25b 12.50±0.50bc 13.00±0.00d 10.10±0.10a 14.25±0.25c 13.75±0.25c 14.10±0.10d 12.35±0.15c 13.65±0.15c 12.75±0.25c 17.05±0.15e 12.75±0.25b 16.50±0.50d 14.75±0.25d 15.20±0.10e 13.25±0.25d 15.25±0.25d 14.65±0.15d 18.35±0.15f 13.90±0.10c 18.35±0.15e 16.60±0.10e 16.75±0.25f 15.25±0.25e 18.20±0.30e 15.75±0.25e 20.00±0.00g 14.90±0.10d 19.40±0.20f 16.90±0.10e
对猪源大肠杆菌K88和K99的抑制作用:在GOD酶活为100 U/mL时对菌株K88的抑菌效果显著高于10 U/mL和20 U/mL(P<0.05),和50 U/mL时差异不显著(P>0.05)。GOD酶活为200 U/mL、500 U/mL和1 000 U/mL时抑菌效果差异均显著(P<0.05)。GOD对菌株K99具有较强的抑菌效果,各浓度间抑菌效果差异均显著(P<0.05)。
对沙门氏菌0129、0526和0533的抑制作用:GOD对沙门氏菌0526抑菌效果最强,其次是沙门氏菌0533,对这两株沙门氏菌抑菌效果在GOD酶活50 U/mL时显著高于20 U/mL(P<0.05),且随GOD酶活的升高抑菌效果增强,1 000 U/mL时对沙门氏菌0526抑菌圈直径最大,达到19.40 mm。
总之,GOD对不同来源致病菌均具有抑菌性,且在一定浓度范围内随酶活增加抑菌性能增强,在最低剂量10 U/mL时也具有良好的抑菌作用。
2.2 温度对GOD抑菌性能的影响
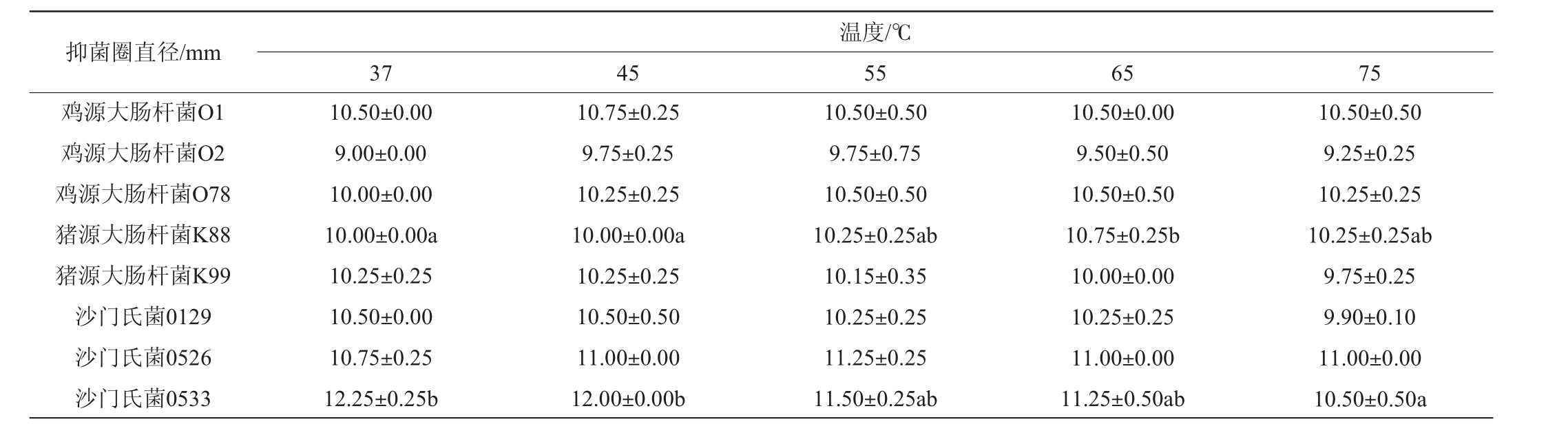
温度对GOD抑菌性能的影响结果见表2。由表2可知,在37~75 ℃范围内不同温度处理GOD对鸡源大肠杆菌O1、O2和O78的抑菌作用均无显著性差异(P>0.05);不同温度处理GOD对猪源大肠杆菌K99抑菌作用无显著性差异(P>0.05)。对猪源大肠杆菌K88,65 ℃时抑菌作用最强,抑菌圈直径为10.75 mm,显著高于37 ℃和45 ℃(P<0.05),但和55 ℃和75 ℃差异均不显著(P>0.05);不同温度处理GOD对沙门氏菌0129和0526抑菌作用均无显著性差异(P>0.05)。37 ℃处理GOD时对沙门氏菌0533的抑菌作用最强,显著高于75 ℃时(P<0.05),和45 ℃、55 ℃和65 ℃时抑菌作用差异不显著(P>0.05)。
表2 温度对葡萄糖氧化酶抑菌性能的影响
Table 2 Effect of temperature on the antibacterial activity of glucose oxidase
抑菌圈直径/mm鸡源大肠杆菌O1鸡源大肠杆菌O2鸡源大肠杆菌O78猪源大肠杆菌K88猪源大肠杆菌K99沙门氏菌0129沙门氏菌0526沙门氏菌0533温度/℃37 45 55 65 75 10.50±0.00 9.00±0.00 10.00±0.00 10.00±0.00a 10.25±0.25 10.50±0.00 10.75±0.25 12.25±0.25b 10.75±0.25 9.75±0.25 10.25±0.25 10.00±0.00a 10.25±0.25 10.50±0.50 11.00±0.00 12.00±0.00b 10.50±0.50 9.75±0.75 10.50±0.50 10.25±0.25ab 10.15±0.35 10.25±0.25 11.25±0.25 11.50±0.25ab 10.50±0.00 9.50±0.50 10.50±0.50 10.75±0.25b 10.00±0.00 10.25±0.25 11.00±0.00 11.25±0.50ab 10.50±0.50 9.25±0.25 10.25±0.25 10.25±0.25ab 9.75±0.25 9.90±0.10 11.00±0.00 10.50±0.50a
总之,GOD酶在37~75 ℃干热处理10 min后都具有较好的抑菌活性,65 ℃时对猪源大肠杆菌K88和37 ℃时对沙门氏菌0533抑菌作用最强,各温度处理对其余病原菌抑菌作用无显著差异(P>0.05)。
2.3 乳酸菌对病原菌抑菌性能的影响
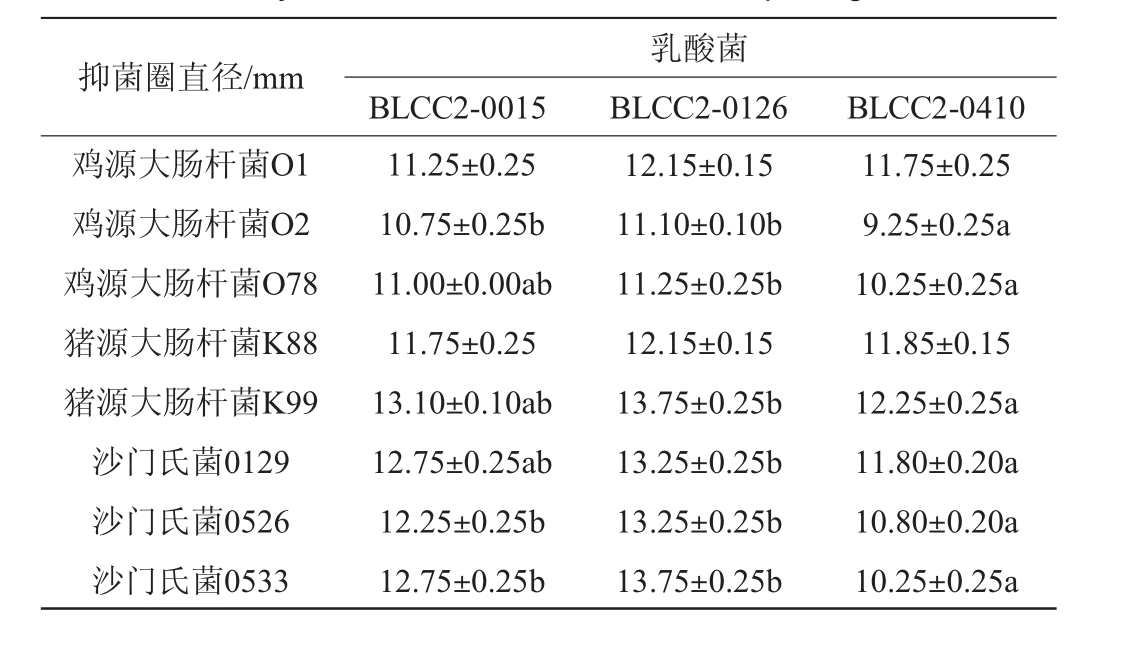
乳酸菌对病原菌的抑制作用结果见表3。由表3可知,植物乳杆菌BLCC2-0015、BLCC2-0126和BLCC2-0410对8种被试病原菌均有抑制作用。植物乳杆菌BLCC2-0126对被试8种病原菌的抑制作用最强,其中对鸡源大肠杆菌O2、鸡源大肠杆菌O78、猪源大肠杆菌K99、沙门氏菌0129、沙门氏菌0526和沙门氏菌0533的抑制作用显著高于乳酸菌BLCC2-0410(P<0.05),与植物乳杆菌BLCC2-0015抑制作用差异不显著(P>0.05)。整体来看,菌株BLCC2-0126抑菌性能最强,后续可选取菌株BLCC2-0126进行共培养试验。
表3 乳酸菌对病原菌的抑制作用
Table 3 Inhibitory effect of lactic acid bacteria on pathogenic bacteria
抑菌圈直径/mm鸡源大肠杆菌O1鸡源大肠杆菌O2鸡源大肠杆菌O78猪源大肠杆菌K88猪源大肠杆菌K99沙门氏菌0129沙门氏菌0526沙门氏菌0533 BLCC2-0015乳酸菌BLCC2-0126 BLCC2-0410 11.25±0.25 10.75±0.25b 11.00±0.00ab 11.75±0.25 13.10±0.10ab 12.75±0.25ab 12.25±0.25b 12.75±0.25b 12.15±0.15 11.10±0.10b 11.25±0.25b 12.15±0.15 13.75±0.25b 13.25±0.25b 13.25±0.25b 13.75±0.25b 11.75±0.25 9.25±0.25a 10.25±0.25a 11.85±0.15 12.25±0.25a 11.80±0.20a 10.80±0.20a 10.25±0.25a
3 结论
本研究主要采用牛津杯法评价GOD和植物乳杆菌对病原菌抑菌作用,共培养法检测GOD对植物乳杆菌的抑制作用,评估两者能否共用。结果显示,牛津杯法检测到GOD对不同来源致病菌均具有抑菌性,且在一定浓度范围内随浓度增加抑菌性能增强,在最低酶活10 U/mL时具有良好的抑菌作用。65 ℃干热处理10 min依然具有较好的抑菌活性;3株被试乳酸菌中以BLCC2-0126的抑制作用最强。
[1]王佰涛,王一雯,许杰,等.葡萄糖氧化酶的应用及其在饲料中的作用机理[J].中国饲料,2019(15):6-11.
[2]陈景岩,耿启泉,常娟,等.葡萄糖氧化酶和嗜酸乳杆菌与小檗碱配伍对大肠杆菌生长的抑制作用[J].安徽农业科学,2020,48(20):95-98,122.
[3]孙颖雪.日粮中添加葡萄糖氧化酶对丹系大白母猪肠道健康、繁殖性能和泌乳性能的应用研究[D].沈阳:沈阳农业大学,2017.
[4]夏超,邓露.葡萄糖氧化酶的作用机理及其在动物生产中的研究进展[J].饲料研究,2023,46(18):165-169.
[5]王鑫,戴求仲,林谦,等.葡萄糖氧化酶在畜禽饲粮中的应用研究进展[J].饲料研究,2021,44(5):145-147.
[6]汤海鸥,高秀华,姚斌,等.葡萄糖氧化酶体外抑菌和产酸效果试验研究[J].饲料工业,2015,36(10):13-16.
[7]罗同阳,高庆华,董聪,等.葡萄糖氧化酶体外应用效果的试验研究[J].饲料研究,2021(9):84-87.
[8]王恒毅,马义国.饲粮中添加葡萄糖氧化酶对蛋鸡生产性能的影响[J].家禽科学,2020(1):20-22.
[9]高晶萍.葡萄糖氧化酶和乳酸菌制剂对肉鸡生产性能、免疫功能和盲肠菌群结构的影响[D].张家口:河北北方学院,2020.
[10]高晶萍,孙嘉咛,李献华,等.葡萄糖氧化酶与乳酸菌联合对肉鸡生长性能及免疫功能的影响[J].饲料研究,2021,23:45-49.
[11]TANG H,YAO B,GAO X,et al.Effects of glucose oxidase on the growth performance,serum parameters and faecal microflora of piglets[J].South Afr J Animal Sci,2016,46(1):14-20.
[12]黄菲,王曦,曹云鹤.葡萄糖氧化酶在动物饲料中的作用机理及研究进展[J].动物营养学报,2022,34(9):5500-5515.
[13]马菲璐,唐志远.葡萄糖氧化酶对仔猪生长性能、免疫功能和肠道微生物的影响[J].中国饲料,2022,8:50-53.
[14]荆新堂,陈锋亮,于东,等.饮水中添加葡萄糖氧化酶对肉鸡生长性能的影响[J].饲料广角,2018(8):44-46.
[15]李嘉辉,李生杰,龚建刚,等.葡萄糖氧化酶对产蛋后期蛋种鸡产蛋性能、孵化性能及抗氧化能力的影响[J].动物营养学报,2021,33(10):5617-5626.
[16]段鹏.乳酸菌和芽孢杆菌对肠道感染的乳猪生长性能、养分消化和免疫功能的影响[J].中国饲料,2023(6):41-44.
[17]李祖凤,孔伟.复合乳酸菌制剂对犊牛生长、肠道菌群与免疫性能的影响[J].现代畜牧科技,2023(5):15-18.
[18]赵倩,谢全喜,徐海燕,等.壳寡糖抑菌性能的研究[J].中国酿造,2021,40(3):44-47.
[19]赫鸣睿.大肠杆菌毒力因子及耐药机制研究进展[J].现代畜牧科技,2018(9):4-5.
[20]刘娇,陈志敏,郑爱娟,等.葡萄糖氧化酶对大肠杆菌攻毒肉鸭生长性能、免疫功能及肠道健康的影响[J].中国农业科学,2021,54(22):4917-4930.
[21]谢雨龙,覃巧思,李佳连.沙门氏菌检测方法研究进展[J].轻工科技,2020,36(9):139-141.
[22]徐翔飞,黄盼,崔雪梅,等.猪大肠埃希氏菌和沙门氏菌双重PCR检测方法的建立[J].浙江农业科学,2023,64(4):957-963.
[23]侯瑾,李迎秋.葡萄糖氧化酶的研究进展及其在饲料工业中的应用[J].江苏调味副食品,2016(3):9-12.
[24]单春乔,马大川,刘秋晨,等.葡萄糖氧化酶抑菌、产酸及耐受性试验[J].黑龙江畜牧兽医,2020(13):116-121.
[25]孙悦,刘佳伊,陈璐,等.抗耐药性大肠杆菌乳酸菌的筛选及抑菌机制[J].食品科学,2021,42(2):121-127.