清香型白酒具有清香纯正,醇甜柔和,自然谐调,余味爽净的特点[1],深受我国人民的喜爱。牛栏山二锅头白酒属于清香型白酒,其酿造过程是开放式的多菌种固态发酵方式,主要以高粱等谷物为原料,大曲为糖化发酵剂,采用清蒸清茬酿造工艺、固态地缸发酵、清蒸流酒[2]。酒醅则一般指在池内正在进行发酵或者已经发酵完成的粮食的混合物,是白酒酿造过程中的专业工艺术语。在发酵过程中,酒醅中的淀粉会在微生物与多种酶作用下经过糖酵解形成葡萄糖,最后由葡萄糖发酵成酒精[3],游离氨基酸作为微生物生长代谢赖以生存的氮源来源之一,在微生物发酵过程中,在一定程度上决定了微生物的生长情况和代谢物的产生,产生风味物质[4-5]。游离氨基酸是多种香气成分的前体物质,在高温堆积和高温蒸馏过程中可与碳水化合物发生美拉德反应,是形成白酒风味的重要原因[6-8]。另外,游离氨基酸还是酸、酯等香气成分的重要前体物质,对白酒的风味及口感形成起着重要作用[4,9]。国内外学者对于蒸馏酒中的氨基酸已有较多研究[10-12],张庄英等[10]对不同香型白酒原酒和成品酒的氨基酸种类和含量进行分析,发现酱香型和浓香型原酒中氨基酸种类最多,成品酒中酱香型白酒氨基酸种类最多。吴钱弟等[11]对酱香型白酒酿造中第四、五轮次基酒的加曲酒醅、入池酒醅和出池酒醅的游离氨基酸组成进行分析,在第四轮次和第五轮次酒醅分别检测到23种和21种氨基酸,出池酒醅中游离氨基酸含量最高,加曲酒醅中的游离氨基酸含量最低,堆积发酵和窖池发酵过程会产生大量的游离氨基酸。AQUINO F W等[12]研究了巴西甘蔗酒、朗姆酒和威士忌中的20种氨基酸,发现脯氨酸含量最高,氨基酸与其风味和质量参数存在一定关系。游离氨基酸也是清香型白酒中重要的香味组成和多种香气成分的重要前体物质,其在酒醅发酵过程中游离氨基酸含量和动态变化研究较少。
本研究通过定量检测不同发酵阶段的酒醅中游离氨基酸含量与变化趋势,同时对酵母菌数量、乙醇含量、总酸和pH值的动态变化进行探究,旨在为研究牛栏山白酒的发酵过程机理和香气成分提供理论基础,为进一步指导白酒酿造生产提供参考。
1 材料与方法
1.1 材料与试剂
酒醅样品:取自北京顺鑫农业股份有限公司牛栏山酒厂酿造车间,分别于入池前后的第0、2、3、5、9、11、13、17、22、28、36、45天进行取样,其中第0天入缸酒醅直接从入缸前拌好大曲的蒸粮中取样,用特制的取样器从取样点表面垂直插入缸里进行取样,每次采集3个取样点,将3个点的样品混合均匀后,分装成3份,置于-80 ℃冰箱保存。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:葡萄糖20 g,酵母粉10 g,蛋白胨10 g,去离子水1 000 mL,pH4.0,115 ℃高温灭菌30 min。
1.1.3 试剂
17种氨基酸标准品(组氨酸、丝氨酸、精氨酸、甘氨酸、天冬氨酸、谷氨酸、苏氨酸、丙氨酸、脯氨酸、半胱氨酸、赖氨酸、酪氨酸、蛋氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸)(纯度均>99%):美国Waters公司;AccQ·TagTM衍生化试剂、AccQ·Tag Ultra 洗脱液A液、B液:美国Waters公司;超纯水:Milli-Q超纯水仪制取;磷酸二氢铵(分析纯):天津市光复精细化工研究所;磷酸(分析纯):北京化工厂;乙醇、甲醇、乙腈(均为色谱纯):美国Fisher公司。
1.2 仪器与设备
ACQUITY UPLC H-Class超高效液相色谱仪:美国沃特世Waters公司;Milli-Q Reference超纯水仪:美国默克Millipore公司;HY-2漩涡混匀仪:上海雷磁科学仪器厂;MS204TS万分之一分析天平;FE22-Standard pH仪:梅特勒-托利多仪器有限公司;GDANA电热板:广州格丹纳仪器有限公司;5840R型离心机:德国Eppendorf公司;BSC-1100ⅡA2型生物安全柜:北京东联哈尔仪器制造有限公司;SPX-320型生化培养箱:宁波江南仪器厂;DHG-9140A烘干箱:上海一恒种子仪器有限公司。
1.3 方法
1.3.1 酒醅发酵过程中酵母菌数量的测定
按照四分法对不同发酵时间的酒醅进行混合取样,准确称取10 g酒醅于90 mL无菌水中,置于摇床180 r/min振荡10 min。制备的菌悬液计为10-1梯度,在无菌环境下吸取1 mL菌悬液于9 mL无菌水中,计为10-2,然后依次稀释为10-3、10-4、10-5、10-6梯度。使用灭菌枪吸取不同梯度液各0.1 mL,分别涂布至分离培养基平板中,设置3个平行和空白对照。根据酵母菌的培养条件进行28 ℃恒温培养,培养时间根据菌落的生长情况而定,一般为24~48 h。根据培养结果挑选菌落数在30~300的平板进行计数,乘以稀释倍数计算不同酵母菌的菌落数量[13]。
1.3.2 酒醅发酵过程中乙醇含量、总酸和pH值的测定
乙醇含量:采用蒸馏-酒精计法[14]。
总酸:使用酸碱中和法对酒醅中的总酸含量进行测定[15-16]。
pH值:准确称量10 g酒醅,加入90 mL无菌水,静置20 min后利用pH仪进行pH值测定。
1.3.3 酒醅发酵过程中游离氨基酸的测定
(1)酒醅样品前处理
准确称取5 g酒醅置于50 mL离心管中,加入50 mL、70 ℃的超纯水,振荡均匀后,50 ℃超声40 min,使用离心机在10 000 r/min、4 ℃条件下离心15 min,取上清液,经0.22 μm微孔滤膜过滤,收集在50 mL容量瓶中,最后用超纯水定容至50 mL,-20 ℃保存备用。取100 μL上述处理好的溶液于2 mL微量离心管中,加入250 μL色谱纯乙腈振荡摇匀,以去除待测样品中的蛋白质。使用离心机在10 000 r/min、4 ℃条件下离心3 min。取离心后的上清液100 μL于进样瓶中备用。
(2)氨基酸衍生化处理
首先将前处理后得到的样品上清液取10 μL,转移至1 mL TrueViewTM最大回收样品瓶中,短时加热AccQ·TagTM衍生化试剂,确保试剂得到充分溶解,将70 μL AccQ缓冲液加入最大回收样品瓶中,在涡旋状态下加入20 μL AccQ·Tag衍生化试剂,涡旋混合15 s,然后在室温条件下放置1 min,将瓶口用石蜡膜封口,放在55 ℃烘箱内加热10 min后待测。氨基酸混合标准品的衍生化处理采用相同方法。
(3)超高效液相色谱条件
沃特世ACQUITY UPLC FLR系统;AccQ·Tag TM Ultra色谱柱(2.1 mm×100 mm);流动相A、B、C、D:AccQ·Tag Ultra A洗脱液、体积分数10%AccQ·Tag Ultra B洗脱液(水∶AccQ·Tag Ultra B=90∶10)、水、AccQ·Tag Ultra B洗脱液;流速:0.7 mL/min;柱温35 ℃;样品室温度20 ℃;进样体积10 μL;检测波长260 nm;按照洗脱程序:T(min)/A(%)/B(%)/C(%)/D(%):0/2/0/98/0、5.49/9/80/11/0、7.10/8/15.6/57.9/18.5、7.69/7.8/0/70.9/21.3、7.99/4/0/36.3/59.7、8.68/2/0/98/0、10.2/2/0/98/0进行洗脱,进样时间为10 min。
定性定量方法:通过17种氨基酸标准溶液的保留时间对样品中的游离氨基酸进行定性,以17种氨基酸标准溶液的质量浓度(x)为横坐标,以UPLC检测出的出峰面积(y)为纵坐标,构建标准曲线,按照标准曲线回归方程计算样品中的游离氨基酸含量。
1.3.4 数据处理
采用Origin 8.5,Excel 2016,SPSS,SIMC-P 15.0软件对实验数据进行处理。
2 结果与分析
2.1 酵母菌数量与乙醇含量在酒醅发酵过程中的变化情况
酵母菌是酒醅发酵过程中重要的微生物之一,能够决定乙醇以及一些香气成分的产生[17],酒醅中乙醇含量的变化是判断窖池发酵情况正常与否的重要依据之一[18]。由图1可知,在酒醅发酵过程中,酵母菌数量呈现先增加后减少的趋势,在发酵初期(0~3 d)时,变化较为缓慢,发酵3~11 d开始急剧增长呈上升趋势,在发酵中期(9~13 d)数量保持平稳,并在11 d时达到最高值77.7×106 CFU/mL,发酵13~17 d时呈现大幅度的下降,发酵22~45 d一直处在较低的数量。
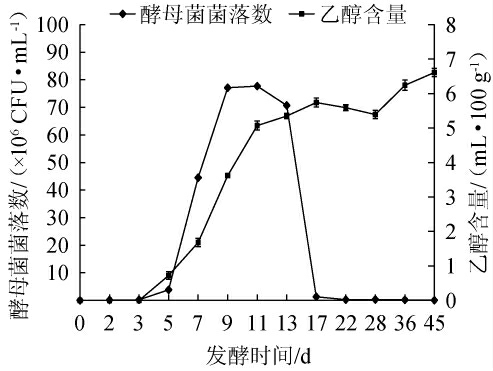
图1 酒醅发酵过程中酵母菌数量、乙醇含量的变化
Fig.1 Changes of yeast counts and ethanol contents in fermented grains during fermentation
乙醇含量在发酵过程中呈整体上升趋势,在3~11 d时乙醇含量增长最快,此后缓慢增长,在发酵45 d时达到最高值6.61 mL/100 g。在酒醅发酵前期,乙醇含量与酵母菌数量的增长趋势相近,呈现出正相关性,这可能是因为在酒醅发酵前期,淀粉被大量消耗快速降解,环境中营养物质丰富,酵母菌代谢旺盛并开始大量生长繁殖,乙醇也开始增加,在发酵中后期,乙醇逐渐积累,并且发酵后期营养物质减少,二者都在一定程度上抑制了酵母菌的生长繁殖,反过来影响乙醇的产量,导致发酵中期乙醇含量增长放缓,基本维持稳定。
2.2 总酸与pH在酒醅发酵过程中的变化情况
在酒醅发酵过程中,总酸和pH作为环境因素,均能够对酒醅中微生物的代谢产生影响,同时,总酸还是决定白酒品质的关键因素之一[18]。总酸指酒醅样品最终能释放出的氢离子数量,pH值与氢离子的平衡有关,代表物质在溶液中释放氢离子(或氢氧根)的能力[19]。由图2可知,总酸含量在发酵过程中呈整体上升趋势,在发酵0~7 d总酸含量的增长速度较为缓慢,发酵9~22 d开始急剧增长呈上升趋势,酒醅入缸时的总酸度为0.54 g/g,在发酵36 d时总酸含量达到最高值5.27 g/g。
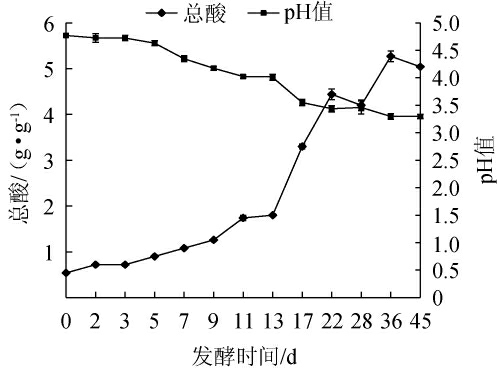
图2 酒醅发酵过程中pH值和总酸含量的变化
Fig.2 Changes of pH value and total acid contents in fermented grains during fermentation
酒醅的pH值与总酸呈现出负相关,随着发酵时间进行,逐渐下降,由酒醅开始入池的pH值4.77降低至3.28。这是因为酒醅在发酵过程中,在各种微生物及酶系的作用下,产生大量的有机酸,所以导致总酸增加,促使发酵体系的pH值降低[20]。
2.3 游离氨基酸在酒醅发酵过程中的变化情况
2.3.1 氨基酸标准曲线回归方程的建立
17种氨基酸混合标准溶液的标准曲线回归方程见表1。由表1可知,回归方程的线性较好,相关系数(R2)符合要求,表明超高效液相色谱工作性能稳定,能够对酒醅中的游离氨基酸进行准确的测定。17种氨基酸混合标准溶液的UPLC分析色谱图见图3。由图3可知,17种氨基酸通过超高效液相色谱能够做到良好的分离。
表1 17种氨基酸线性回归方程及相关系数
Table 1 Linear regression equations and correlation coefficients of 17 amino acids

有机酸种类 线性回归方程 相关系数(R2)组氨酸(His)丝氨酸(Ser)精氨酸(Arg)y=4.02e+005x+5.18e+002 y=3.86e+005x+1.40e+003 y=3.98e+005x+5.65e+002 0.999 2 0.998 7 0.999 2
续表
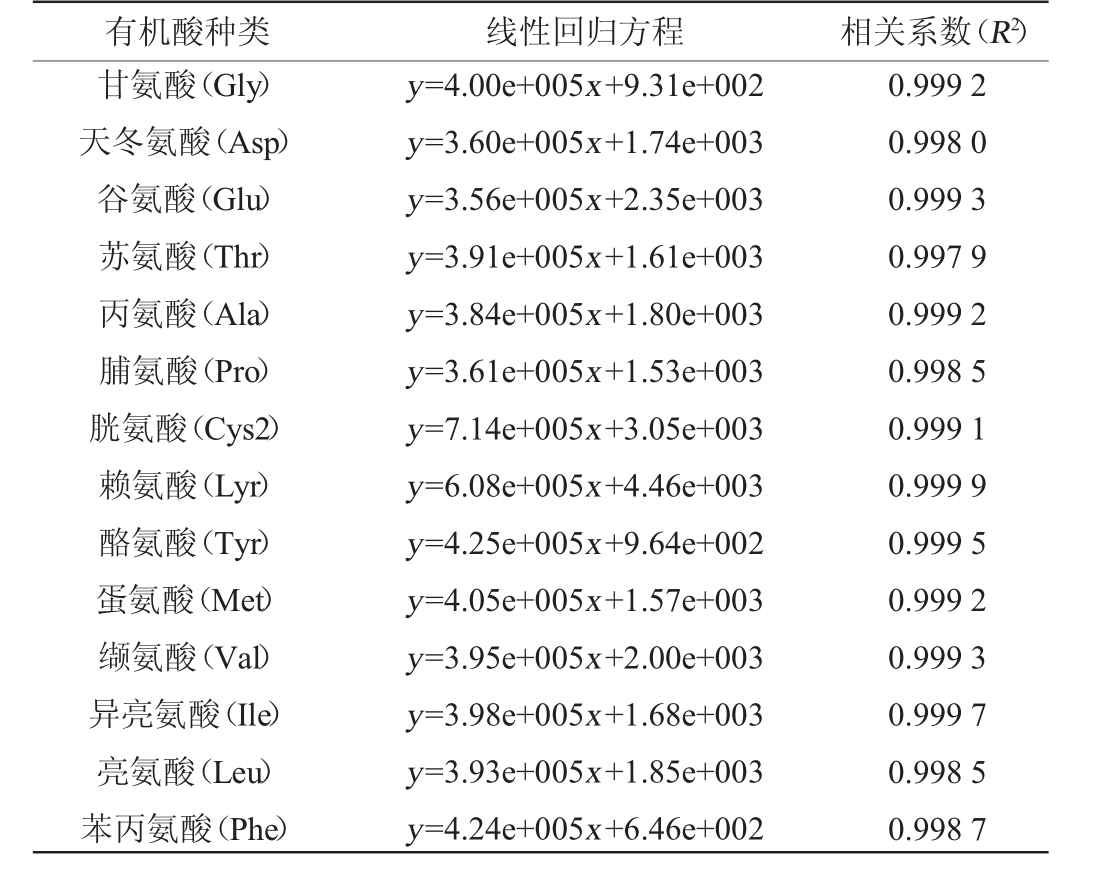
有机酸种类 线性回归方程 相关系数(R2)甘氨酸(Gly)天冬氨酸(Asp)谷氨酸(Glu)苏氨酸(Thr)丙氨酸(Ala)脯氨酸(Pro)胱氨酸(Cys2)赖氨酸(Lyr)酪氨酸(Tyr)蛋氨酸(Met)缬氨酸(Val)异亮氨酸(Ile)亮氨酸(Leu)苯丙氨酸(Phe)y=4.00e+005x+9.31e+002 y=3.60e+005x+1.74e+003 y=3.56e+005x+2.35e+003 y=3.91e+005x+1.61e+003 y=3.84e+005x+1.80e+003 y=3.61e+005x+1.53e+003 y=7.14e+005x+3.05e+003 y=6.08e+005x+4.46e+003 y=4.25e+005x+9.64e+002 y=4.05e+005x+1.57e+003 y=3.95e+005x+2.00e+003 y=3.98e+005x+1.68e+003 y=3.93e+005x+1.85e+003 y=4.24e+005x+6.46e+002 0.999 2 0.998 0 0.999 3 0.997 9 0.999 2 0.998 5 0.999 1 0.999 9 0.999 5 0.999 2 0.999 3 0.999 7 0.998 5 0.998 7
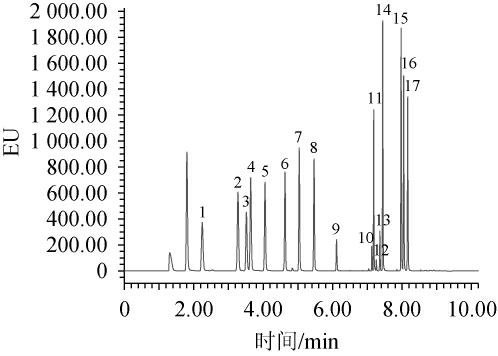
图3 17种氨基酸混合标准品UPLC色谱图
Fig.3 UPLC chromatogram of 17 kinds of amino acid mixture standards
1.组氨酸(His)、2.丝氨酸(Ser)、3.精氨酸(Arg)、4.甘氨酸(Gly)、5.天冬氨
酸(Asp)、6.谷氨酸(Glu)、7.苏氨酸(Thr)、8.丙氨酸(Ala)、9.脯氨酸(Pro)、10.胱氨酸(Cys2)、11.赖氨酸(Lys)、12.酪氨酸(Tyr)、13.蛋氨酸(Met)、14.缬氨酸(Val)、15.异亮氨酸(Ile)、16.亮氨酸(Leu)、17.苯丙氨酸(Phe)。
2.3.2 游离氨基酸在酒醅发酵过程中含量变化
游离氨基酸是酵母菌发酵过程中的主要可同化含氮物,对酵母菌的生长、碳源消耗和防止发酵过程停滞等均有重要影响[20]。由表2可知,在牛栏山二锅头白酒酒醅发酵过程中,酒醅中的游离氨基酸种类丰富,共检测出15种氨基酸(丝氨酸、精氨酸、天冬氨酸、谷氨酸、苏氨酸、丙氨酸、脯氨酸、半胱氨酸、赖氨酸、酪氨酸、蛋氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸)。在发酵0 d时,酒醅中的游离氨基酸总含量为34.38 mg/g,随着发酵的进行,游离氨基酸的含量也发生了显著的变化,各游离氨基酸含量和总含量均呈上升趋势,在发酵17 d时游离氨基酸总含量达到了最高值,为232.93 mg/g。
表2 酒醅发酵过程中游离氨基酸含量的变化
Table 2 Changes of free amino acid contents in fermented grains during fermentation process
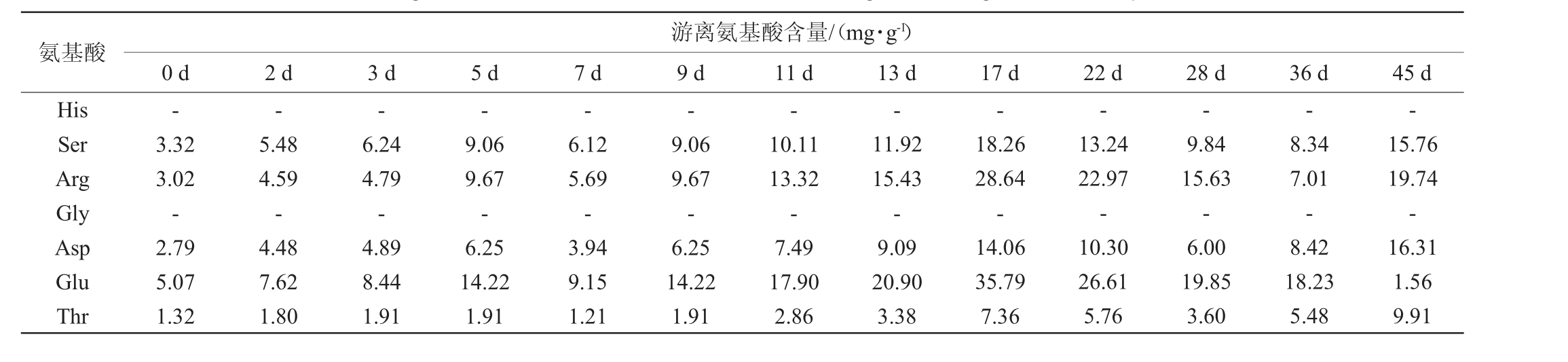
氨基酸His Ser Arg Gly Asp Glu Thr游离氨基酸含量/(mg·g-1)0 d 2 d 3 d 5 d 7 d 9 d 11 d 13 d 17 d 22 d 28 d 36 d 45 d——————-3.32 3.02-2.79 5.07 1.32 5.48 4.59-4.48 7.62 1.80 6.24 4.79-4.89 8.44 1.91 9.06 9.67-6.25 14.22 1.91 6.12 5.69-3.94 9.15 1.21 9.06 9.67-6.25 14.22 1.91 10.11 13.32-7.49 17.90 2.86 11.92 15.43-9.09 20.90 3.38 18.26 28.64-14.06 35.79 7.36 13.24 22.97-10.30 26.61 5.76 9.84 15.63-6.00 19.85 3.60 8.34 7.01-8.42 18.23 5.48 15.76 19.74-16.31 1.56 9.91
续表
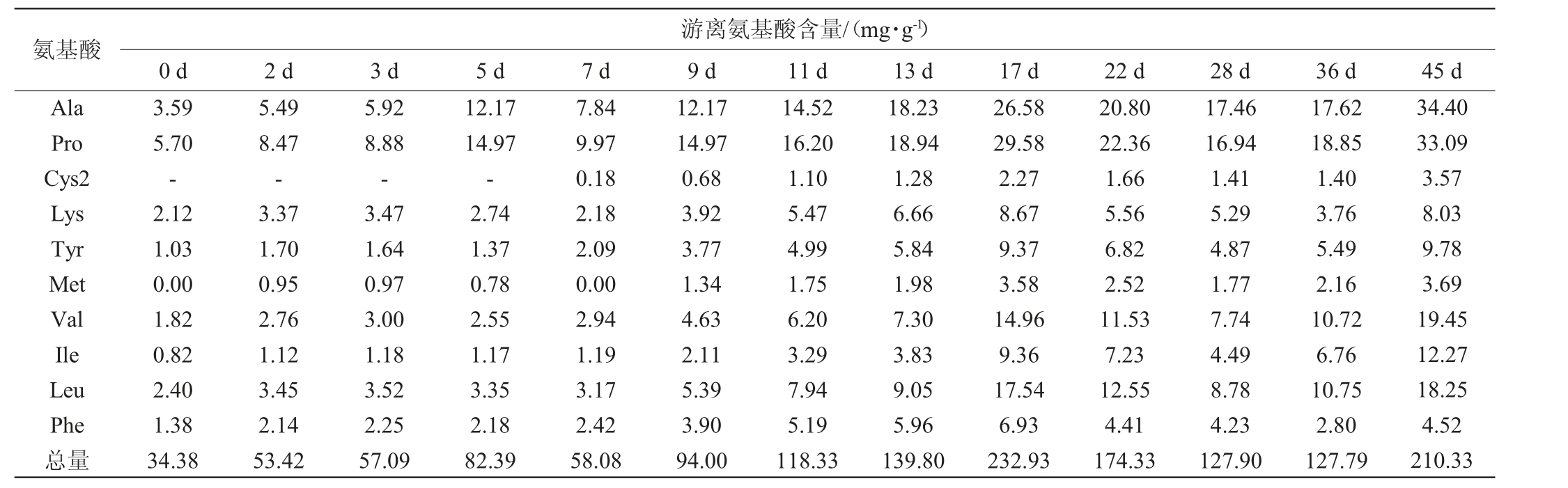
注:“-”表示未检出。
氨基酸Ala Pro Cys2 Lys Tyr Met Val Ile Leu Phe总量游离氨基酸含量/(mg·g-1)0 d 2 d 3 d 5 d 7 d 9 d 11 d 13 d 17 d 22 d 28 d 36 d 45 d 3.59 5.70-2.12 1.03 0.00 1.82 0.82 2.40 1.38 34.38 5.49 8.47-3.37 1.70 0.95 2.76 1.12 3.45 2.14 53.42 5.92 8.88-3.47 1.64 0.97 3.00 1.18 3.52 2.25 57.09 12.17 14.97-2.74 1.37 0.78 2.55 1.17 3.35 2.18 82.39 7.84 9.97 0.18 2.18 2.09 0.00 2.94 1.19 3.17 2.42 58.08 12.17 14.97 0.68 3.92 3.77 1.34 4.63 2.11 5.39 3.90 94.00 14.52 16.20 1.10 5.47 4.99 1.75 6.20 3.29 7.94 5.19 118.33 18.23 18.94 1.28 6.66 5.84 1.98 7.30 3.83 9.05 5.96 139.80 26.58 29.58 2.27 8.67 9.37 3.58 14.96 9.36 17.54 6.93 232.93 20.80 22.36 1.66 5.56 6.82 2.52 11.53 7.23 12.55 4.41 174.33 17.46 16.94 1.41 5.29 4.87 1.77 7.74 4.49 8.78 4.23 127.90 17.62 18.85 1.40 3.76 5.49 2.16 10.72 6.76 10.75 2.80 127.79 34.40 33.09 3.57 8.03 9.78 3.69 19.45 12.27 18.25 4.52 210.33
在发酵17 d后,游离氨基酸总含量开始呈现下降趋势,发酵结束(45 d)时总含量为210.33 mg/g,发酵结束时含量最高的3种游离氨基酸依次为丙氨酸(34.40 mg/g,占总含量16.35%)、脯氨酸(33.09 mg/g,占总含量15.73%)、精氨酸(19.74 mg/g,占总含量9.39%)。含量最低的3种游离氨基酸分别为谷氨酸(1.56 mg/g,占总含量0.74%)、半胱氨酸(3.57 mg/g,占总含量1.70%)、精氨酸(3.69 mg/g,占总含量1.75%)。这是由于酒醅发酵前中期,酒醅中氧气含量充足,营养物质丰富,微生物代谢旺盛,酿酒原料中的蛋白质被分解成小分子肽和氨基酸,使游离氨基酸含量增加。酒醅发酵后期,氧气减少耗尽,厌氧微生物数量增多,厌氧微生物对蛋白质水解能力较低,使得相应氨基酸含量因微生物菌体生长的消耗而逐渐下降[21]。
对比含量较高的丙氨酸、脯氨酸与含量最低的谷氨酸在酒醅发酵过程中的变化情况可知,随着发酵的进行,这3种氨基酸的含量都发生了显著的变化,第0~36 d变化趋势类似,呈快速上升趋势。发酵36 d后,谷氨酸的含量快速下降,在发酵结束时含量变成最低,并且明显低于发酵开始时的含量,从0 d的5.07 mg/g降低至45 d时的1.56 mg/g,但是在17 d时,谷氨酸含量达到的最高值为35.79 mg/g,是整个发酵过程中各游离氨基酸中最高值,这可能和某些风味物质的形成密切相关,如谷氨酸可在谷氨酸脱氢酶的作用下生成氨,与2,3-丁二醇生成香味物质四甲基吡嗪[22]。游离氨基酸也可以作为酵母菌等微生物的氮源使用,合成蛋白质用于酵母菌体生长及合成各种酶类[23]。酒醅发酵过程中游离氨基酸的净增长量取决于酵母菌等微生物对氨基酸消耗作用,以及对蛋白质水解作用的相对强弱,当菌体对氨基酸的消耗速率大于菌株水解蛋白质生成氨基酸的速率时,表现为氨基酸含量的负增长[24]。
2.3.3 游离氨基酸在酒醅发酵过程中的差异性分析
主成分分析(principal component analysis,PCA)是针对数据样本规律未知的情况下,借助线性变换法对多指标进行降维处理,保证信息尽量完整的同时,支持多个指标的转化和同步分析,提取得出较少综合变量的一种多元统计学分析手段[25]。运用SIMC-P 15.0软件对12个酒醅样品的15种游离氨基酸样本进行PCA,结果如图4所示。以主成分PC1为X轴,以PC2为Y轴,建立不同发酵时间下的酒醅样品得分图,PC1的方差贡献率为98.3%,PC2的方差贡献率为1.16%,前两个主成分的累计方差贡献率达到99.46%,由此说明可以很好的反映原始数据的变异信息。
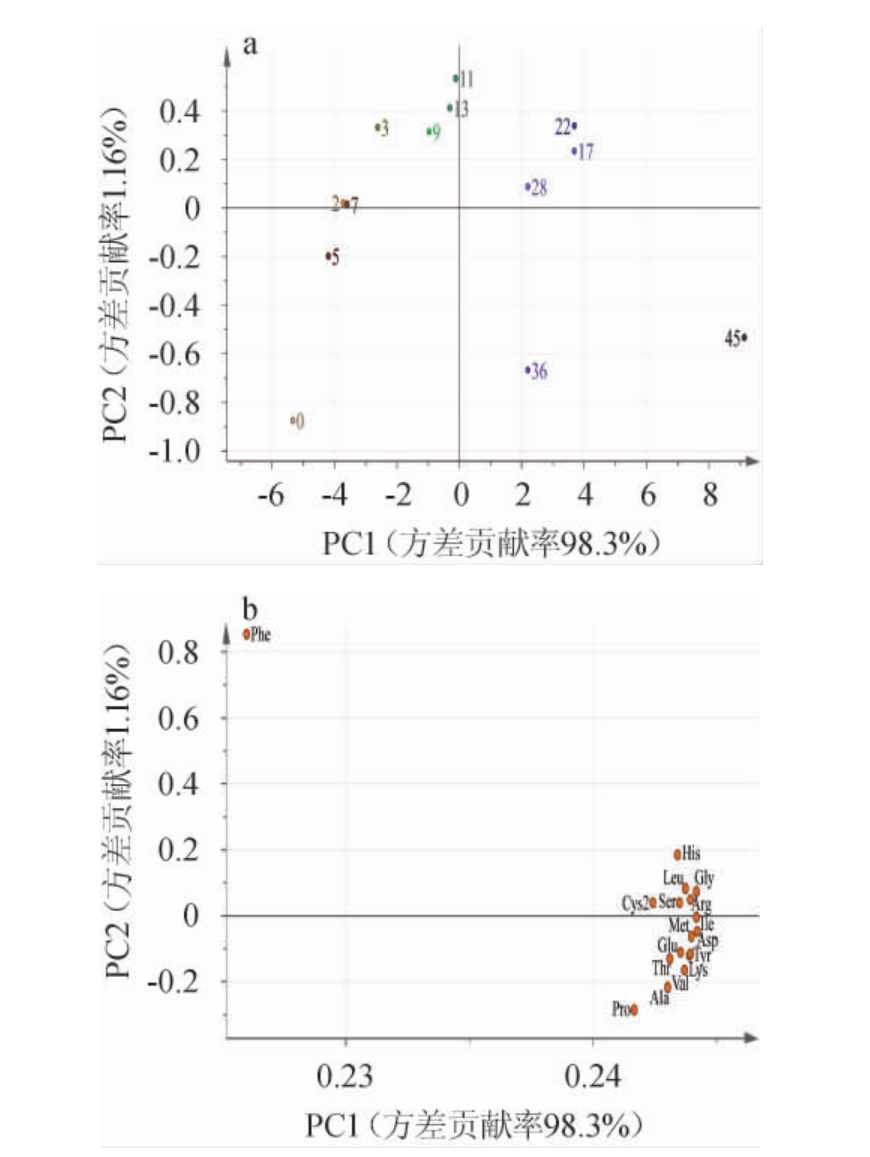
图4 酒醅中游离氨基酸主成分分析得分图(a)及载荷图(b)
Fig.4 Score chart (a) and load chart (b) of principal component analysis of free amino acids in fermented grains
由图4a可知,不同发酵时间酒醅的散点能够被完全区分开,聚类趋势非常明显,表明酒醅发酵时间与游离氨基酸的种类有直接关系,17 d、22 d、28 d酒醅都在第一象限,36 d、45 d酒醅都在第四象限。同时对比图4b,大量的游离氨基酸种类集中在第一和第四象限,表明在酒醅发酵后期,酒醅中含有更多种类的游离氨基酸,在17 d、22 d、28 d的酒醅中,组氨酸、亮氨酸、甘氨酸、胱氨酸、丝氨酸、精氨酸这6种游离氨基酸的含量较高,在36 d、45 d的酒醅中,蛋氨酸、异亮氨酸、谷氨酸、天冬氨酸、苏氨酸、酪氨酸、赖氨酸、缬氨酸、丙氨酸、脯氨酸这10种游离氨基酸的含量较高。
3 结论
本研究以牛栏山二锅头白酒酿造过程中的酒醅为实验材料,利用超高效液相色谱定量分析不同发酵阶段的酒醅中游离氨基酸含量和动态变化,同时对酒醅发酵过程中酵母菌数量、乙醇含量、总酸和pH值的动态变化进行分析研究。结果表明,酵母菌数量呈现先增加后减少的趋势,最高值为77.7×106 CFU/mL,乙醇含量呈现整体上升趋势,最高值为6.61 mL/100 g,在酒醅发酵前期,酵母菌数量与乙醇含量的增长趋势相近,呈现出正相关。总酸随发酵过程不断增加,由0.54 g/g增加至5.27 g/g,pH值不断降低,由4.77降为3.28,在酒醅发酵过程中,酒醅总酸与pH值呈现出负相关。
酒醅中检测到15种游离氨基酸,分别是丝氨酸、精氨酸、天冬氨酸、谷氨酸、苏氨酸、丙氨酸、脯氨酸、半胱氨酸、赖氨酸、酪氨酸、蛋氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸。游离氨基酸总含量呈现先上升后下降的趋势,发酵第17天时,游离氨基酸总含量达到最高值为232.93 mg/g,谷氨酸含量达到的最高值为35.79 mg/g,是整个发酵过程中各游离氨基酸中最高值。发酵结束时含量最高的3种游离氨基酸依次为丙氨酸(34.40 mg/g,占总含量16.35%)、脯氨酸(33.09 mg/g,占总含量15.73%)、精氨酸(19.74 mg/g,占总含量9.39%),含量最低的游离氨基酸为谷氨酸(1.56 mg/g,占总含量0.74%)。谷氨酸的快速减少可能和某些风味物质的形成密切相关。主成分分析结果表明,酒醅发酵时间与游离氨基酸的种类有直接关系,在酒醅发酵后期,酒醅中含有更多种类、更高含量的游离氨基酸。游离氨基酸作为白酒风味成分的重要前体物质,对白酒的口感和风味有重要的影响,对提升牛栏山二锅头白酒质量品质和科学化酿造具有重要意义,因此研究发酵过程中游离氨基酸的生成机理及动态变化,可以为牛栏山二锅头白酒风味成分的形成机理研究提供理论基础和实验依据。
[1]王薇,吴群,徐岩.清香型白酒固态酿造过程中酵母种群结构和多样性分析[J].微生物学通报,2012,39(9):1272-1279.
[2]王勇,范文来,徐岩,等.液液萃取和顶空固相微萃取结合气相色谱-质谱联用技术分析牛栏山二锅头酒中的挥发性物质[J].酿酒科技,2008(8):99-103.
[3]杨磊,程铁辕,吴树坤,等.沉香型白酒酒醅理化特性及细菌群落结构研究[J].中国酿造,2020,39(2):109-114.
[4]张巧玲,吕锡斌,秦兴,等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造,2019,38(4):53-57.
[5] LIU P, WANG Y, YE D, et al.Effect of the addition of branched-chain amino acids to non-limited nitrogen synthetic grape must on volatile compounds and global gene expression during alcoholic fermentation[J].Aust J Grape Wine Res,2018,24(2):197-205.
[6]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[7]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[8] MENG W, XIAO D G, WANG R M.Enhanced production of tetramethylpyrazine in Bacillus licheniformis BL1 by bdhA disruption and 2,3-butanediol supplementation[J].World J Microbiol Biotech,2016,32(3):46.
[9]PROCOPIO S,SPRUNG P,BECKER T.Effect of amino acid supply on the transcription of flavour-related genes and aroma compound production during lager yeast fermentation[J].LWT-Food Sci Technol,2015,63(1):289-297.
[10]张庄英,范文来,徐岩.不同香型白酒中游离氨基酸比较分析[J].食品工业科技,2014,35(17):280-284,288.
[11]吴钱弟,周榆林,王久明,等.酱香型白酒第四,五轮次基酒中游离氨基酸分析[J].中国酿造,2020,39(5):54-59.
[12]AQUINO F W,BOSO L M,CARDOSO D R,et al.Amino acids profile of sugar cane spirit(Cachaca),rum,and whisky[J].Food Chem,2008,108(2):784-793.
[13]李晴,于晓涛,刘轩墀,等.牛栏山二锅头发酵过程中有机酸的变化规律[J].中国酿造,2021,40(10):83-88.
[14]梁晓静.浓香型酒醅窖期发酵参数变化规律研究[J].酿酒科技,2011(1):65-67.
[15]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007:651.
[16]周新虎,陈翔,杨勇,等.浓香型白酒窖内参数变化规律及相关性研究(Ⅰ):理化参数[J].酿酒科技,2012(4):30-34.
[17]罗青春,郑佳,赵东,等.浓香型白酒中优势乳酸菌和酵母菌间的相互关系[J].应用与环境生物学报,2019,25(5):1192-1199.
[18]黄治国,侯海波,罗惠波.浓香型酒醅发酵过程中乙醇和总酸变化规律研究[J].中国酿造,2012,31(6):53-56.
[19]LIU J,WU Q,WANG P,et al.Synergistic effect in core microbiota associated with sulfur metabolism in spontaneous Chinese liquor fermentation[J].Appl Environ Microbiol,2017,83(24):1-15.
[20]马岩石,姜明,刘振艳,等.酿酒酵母QY-1发酵过程中有机酸及游离氨基酸变化分析[J].中国酿造,2019,38(10):1125-128.
[21]PROCOPIO S,KRAUSE D,HOFMANN T,et al.Significant amino acids in aroma compound profiling during yeast fermentation analyzed by PLS regression[J].LWT-Food Sci Technol,2013,51(2):423-432.
[22]XU Y,SUN B,FAN G,et al.The brewing process and microbial diversity of strong flavour Chinese spirits: A review[J].J I Brewing,2017,123(1):5-12.
[23]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[24]申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[25]聂元皓,徐岩,吴群,等.芳香族化合物前体物质酪氨酸和苯丙氨酸在白酒中的来源解析[J].食品与发酵工业,2018,44(10):1-6.
[26] ZHENG J, LIANG R, ZHANG L, et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J].Food Res Int,2013,54(1):660-666.