豆豉是一种微生物发酵制成的豆制品,最具代表性的豆豉产品为Douchi(中国)、Natto(日本)、Cheongguk jang(韩国)、Tempeh(印度尼西亚)等[1]。豆豉按照参与发酵的微生物不同可分为毛霉型、曲霉型、根霉型和细菌型豆豉[2]。豆豉含有丰富的蛋白质、糖、一系列酶以及维生素等[3]。在发酵过程中,豆豉中的碳水化合物可水解产生糖类,部分蛋白质降解为多肽和游离氨基酸,脂类物质在发酵过程中经水解、氧化反应生成酯类、醇类、醛类、酸类化合物,赋予发酵豆制品特有的香气,纤维素水解为纤维素二糖和葡萄糖并进一步形成其他低分子物质和高分子物质,如与氨基酸作用生成色素等[4-5]。《本草纲目》记载豆豉具有开胃增食、消食化滞、发汗解表、驱风散寒、除烦平喘、解山岚瘴气、治水土不服等疗效[6]。研究表明,豆豉有多种健康功能,如降血压[7]、抗氧化活性[8]和降血糖作用[9]等。
细菌型豆豉发酵快速,生产周期短,风味独特,含有丰富的蛋白质、维生素、氨基酸等营养成分,还含有蛋白酶、淀粉酶、纤溶酶、活性肽、异黄酮、低聚糖等生理活性成分[10]。我国细菌型豆豉生产历史悠久,主要分布在云南、贵州和山东地区,芽孢杆菌、微球菌、乳酸菌是细菌型豆豉中常见微生物。谭小琴[11]利用高通量测序技术对西南地区细菌型豆豉的优势菌群进行研究,结果表明,细菌型豆豉中优势菌以芽孢杆菌属(Bacillus)为主。传统发酵淡豆豉中枯草芽孢杆菌(Bacillus subtilis)是常见发酵菌种,且被大量报道用于食用豆豉的发酵,为优势发酵菌[12]。芽孢杆菌参与豆豉发酵的机理主要是菌种在蒸煮过的大豆中繁殖,在此过程中细菌分泌的相关酶系降解蛋白质、脂肪、碳水化合物,使多肽、游离氨基酸、游离脂肪酸、低聚糖、多糖等营养物质含量上升,赋予豆豉特有的鲜香滋味,促进宿主肠道营养的吸收[13-14]。目前,我国细菌型豆豉生产仍以自然发酵为主,生产规模小、产品生产有一定季节性限制,自然发酵豆豉中微生物种类繁多、发酵能力差异大、菌种酶活性低,导致产品质量不稳定[15]。因此,纯种发酵成为促进细菌型豆豉品质提升的研究热点[13]。枯草芽孢杆菌是细菌型豆豉主要发酵微生物[12],用其作为接种菌剂发酵豆豉缩短了生产周期、促进了品质形成[16]。然而,纯种发酵的细菌型豆豉存在风味单一的问题,而多种具有优良产酶特性的芽孢菌种混合发酵,菌种间通过共生关系优势互补可以促进生长,有利于发酵[17]。因此,筛选豆豉中各种具有良好产酶能力的优势菌种对缩短豆豉发酵周期和提高豆豉产品质量尤为重要。
云南易门豆豉以其色、香、味俱全闻名,是云南传统发酵豆制品,极具地方特色。本研究从易门豆豉中分离筛选获得产淀粉酶、蛋白酶、脂肪酶和纤维素酶的芽孢杆菌,利用水解圈法初筛、摇瓶发酵复筛得到产酶菌株,并对产酶较高的菌株进行生长性能分析和分子生物学鉴定。以期为研发豆豉发酵菌剂提供理论依据,对云南传统发酵豆制品微生物资源多样性开发利用、指导实际生产奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
豆豉:取自云南玉溪市易门县;采样时间:2022年5月;豆豉经过泡豆8~10 h,蒸煮4 h,冷却后于室温下发酵3 d,第4天拌料腌制1 d,定型,真空封口蒸汽灭菌后得到成品。采集拌料前豆豉(ND)和拌料后豆豉(NB)进行芽孢杆菌的分离纯化。
1.1.2 试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠、磷酸氢二钠、磷酸二氢钠、对硝基苯酚、棕榈酸对硝基苯酯、阿拉伯胶、Tris-HCl(均为分析纯):上海麦克林生化科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;革兰氏染色试剂盒、福林酚:北京索莱宝科技有限公司;碳酸钠、氢氧化钠、氯化钠、可溶性淀粉、羧甲基纤维素钠(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
淀粉酶筛选培养基:可溶性淀粉10 g,蛋白胨10 g,牛肉粉3 g,氯化钠5 g,琼脂15 g,纯水1 000 mL。
蛋白酶筛选培养基:酪蛋白10 g,蛋白胨5 g,酵母粉2.5 g,KH2PO4 0.3 g,MgSO4 0.5 g,氯化钠1 g,琼脂15 g,纯水1 000 mL。
脂肪酶筛选培养基:蛋白胨10 g,氯化钠5 g,CaCl20.6 g,吐温-80 10 mL,琼脂15 g,纯水1 000 mL。
纤维素酶筛选培养基:羧甲基纤维素钠(carboxymethylcellulose sodium-Na,CMC-Na)10 g,蛋白胨10 g,牛肉粉3 g,氯化钠5 g,琼脂15 g,纯水1 000 mL。
淀粉酶发酵培养基:可溶性淀粉20 g,蛋白胨20 g,Na2HPO4 5 g,MgSO4 0.1 g,氯化钠0.1 g,纯水1 000 mL。
蛋白酶发酵培养基:酪蛋白5 g,酵母粉1 g,葡萄糖1 g,K2HPO4 4 g,KH2PO4 0.5 g,MgSO4 0.1g,纯水1 000 mL。
脂肪酶发酵培养基:酵母粉5 g,葡萄糖5 g,氯化钠5 g,纯水1 000 mL。
纤维素酶发酵培养基:CMC-Na 10 g、酵母粉3 g、蛋白胨5 g、氯化钠1 g、硫酸镁1 g、磷酸氢二钾1 g,纯水1 000 mL。
胰酪大豆胨琼脂培养基(tryptone soybean agar,TSA)、胰酪大豆胨液体培养基(tryptone soybean broth,TSB):广东环凯微生物科技有限公司。
1.2 仪器与设备
LDZX-50L立式压力蒸汽灭菌锅:上海申安医疗器械厂;SW-CJ-1FD超净工作台:苏州安泰空气技术有限公司;DHP-9162电热恒温培养箱、DHG-9240A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;FE28 pH计:梅特勒-托利多仪器(上海)有限公司;HH-6高精度数显恒温水浴锅:上海力辰邦西仪器科技有限公司;UV-5100紫外分光光度计:上海元析仪器有限公司;Sorvall ST 16R高速冷冻离心机、JS-THERMO Varioskan Flash全波长多功能酶标仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 芽孢杆菌的分离纯化
称取10 g豆豉样品与90 mL的0.85%生理盐水混合,300 r/min条件下匀浆1 min。将匀浆液80 ℃水浴15 min,热处理以筛选芽孢杆菌,取1 mL水浴后的匀浆液进行10倍梯度稀释,取稀释梯度为10-3~10-6梯度的菌悬液涂布到TSA培养基平板上,37 ℃条件下培养24 h;挑出形态有差异、长势良好的菌落形态,重复划线3次分离得到单菌落,将菌落转接至TSB培养基中,37 ℃扩大培养12~16 h。采用甘油管藏法保存于-80 ℃冰箱备用。
1.3.2 形态学观察
将纯化后保存在-80 ℃甘油管中的菌株活化并接种于TSB培养基中,37 ℃培养8~16 h用于革兰氏染色,显微镜观察菌株形态特征。
1.3.3 产酶菌株初筛(1)产淀粉酶菌株初筛
将纯化后保存在-80 ℃甘油管中的菌株活化后吸取2.5 μL菌液接种在淀粉酶筛选培养基中,于37 ℃培养48 h,加入适量卢戈氏碘液染色,记录透明圈直径(D)与菌落直径(d)的比值(D/d),选取比值较大的菌株复筛[18]。
(2)产蛋白酶菌株初筛
将纯化后保存在-80 ℃甘油管中的菌株活化后吸取2.5 μL菌液接种在蛋白酶筛选培养基上,37 ℃培养48 h,观察透明圈的形成,计算透明圈直径(D)与菌落直径(d)的比值(D/d),选取比值较大的菌株复筛[19]。
(3)产脂肪酶菌株初筛
将纯化后保存在-80 ℃甘油管中的菌株活化后吸取2.5 μL菌液接种在脂肪酶筛选培养基上,37 ℃培养48 h,观察钙沉淀圈的形成,计算钙沉淀圈直径(D)与菌落直径(d)的比值(D/d),选取比值较大的菌株复筛[20]。
(4)产纤维素酶菌株初筛
将纯化后保存在-80 ℃甘油管中的菌株活化后吸取2.5 μL菌液接种在CMC-Na培养基上,37 ℃培养48 h,用0.1%刚果红溶液浸泡平板10 min,再用1 mol/L NaCl溶液脱色30 min,倒掉溶液后观察透明圈的形成,计算透明圈直径(D)与菌落直径(d)的比值(D/d),选取比值较大的菌株复筛[21]。
1.3.4 产酶菌株复筛
(1)产淀粉酶菌株酶活力测定
挑选D/d≥2的初筛菌株活化,将菌液按接种量1%接种至50 mL TSB培养基中,于37 ℃,150 r/min振荡培养24 h,然后调菌液OD600 nm值约为1;将调好的菌液按5%接种量接种至50 mL淀粉发酵培养基,于37 ℃,150 r/min振荡培养48 h,收集发酵液于50 mL的EP管中,5 000 r/min离心15 min,取上清液[22],采用DNS法测淀粉酶活力[23]。淀粉酶酶活单位定义:1 mL粗酶液在40 ℃条件下,1 min水解淀粉生成1 μg葡萄糖所需酶量定义为1个酶活单位(U/mL)。淀粉酶活力计算公式如下:
式中:x为吸光度值对应的标准曲线中葡萄糖的质量浓度,mg/mL;n为发酵上清液稀释倍数;V为上清液体积,mL;T为反应时间,min。
(2)产蛋白酶菌株酶活力的测定
挑选D/d≥1.9的初筛菌株活化,将菌液按接种量1%接种至50 mL TSB培养基中,于37 ℃,150 r/min振荡培养24 h,然后调菌液OD600 nm值约为1;将调好的菌液按5%接种量接种至50 mL蛋白酶发酵培养基,于37 ℃,150 r/min振荡培养48 h,收集发酵液于50 mL的EP管中,5 000 r/min离心15 min,取上清液,采用福林酚法测定蛋白酶活力[24]。蛋白酶酶活单位定义:1 mL粗酶液在40 ℃条件下,1 min水解酪蛋白生成1 μg 酪氨酸所需酶量定义为1个酶活单位(U/mL)。蛋白酶活力计算公式如下:
式中:x为吸光值对应的标准曲线中酪氨酸质量浓度,μg/mL;V为酶液使用体积,mL;4为反应液总体积,mL;n为样品的稀释倍数;1/10为反应时间10 min,以1 min计。
(3)产脂肪酶菌株酶活力测定
挑选D/d≥1.3的初筛菌株活化,将菌液按接种量1%接种至50 mL TSB培养基中,于37 ℃、150 r/min振荡培养24 h,然后调菌液OD600 nm值约为1;将调好的菌液按5%接种量接种至50 mL)脂肪酶发酵培养基[17],于37 ℃、150 r/min振荡培养72 h,收集发酵液于50 mL的EP管中,5 000 r/min离心15 min,取上清液,采用对硝基苯酚法测定脂肪酶活力[25]。脂肪酶酶活单位定义:1 mL粗酶液在40 ℃条件下,1 min水解棕榈酸对硝基苯酯生成1 μmol对硝基苯酚所需酶量定义为1个酶活单位(U/mL)。脂肪酶活力计算公式如下:
式中:x为吸光值对应的标准曲线中对硝基苯酚的浓度,μmol/L;n为发酵上清液稀释倍数;V为上清液体积,mL;T为反应时间,min。
(4)产纤维素酶菌株酶活力的测定
挑选D/d≥3的初筛菌株活化,将菌液按接种量1%接种至50 mL TSB培养基中,于37 ℃、150 r/min振荡培养24 h,然后调整菌液OD600 nm值约为1;将调好的菌液按5%接种量接种至50 mL淀粉发酵培养基,于37 ℃、150 r/min振荡培养48 h,收集发酵液于50 mL的EP管中,5 000 r/min离心15 min,取上清液,采用DNS法测定纤维素酶活力[23,26]。纤维素酶酶活单位定义:1 mL粗酶液在40 ℃条件下,1 min水解CMC-Na生成1 μg葡萄糖所需酶量定义为1个酶活单位(U/mL)。纤维素酶活力计算公式如下:
式中:x为吸光度值对应的标准曲线中葡萄糖的质量浓度,mg/mL;n为发酵上清液稀释倍数;V为上清液体积,mL;T为反应时间,min。
1.3.5 生长曲线测定
取活化后的菌液按体积分数1%分别接入TSA液体培养基中,150 r/min,37 ℃培养24 h,每隔2 h取发酵液,以灭菌后的TSA液体培养基为空白对照,采用分光光度计测定培养液OD600nm值。
1.3.6 菌株分子生物学鉴定
使用细菌DNA提取试剂盒获取菌株DNA,用16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGYTACCTTGTTACGACTT-3')作为上下游引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系(50 μL):2 Exp Taq buffer 25 μL,DNA模板2 μL,引物27F 1 μL,引物1492R 1 μL,dd H2O 21 μL;PCR扩增条件:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,35个循环;72 ℃最后延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测DNA浓度后,送往生工生物工程(上海)股份有限公司进行DNA序列测定。测得菌株16S rDNA序列后,在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库使用基本局部比对搜索工具(basic local alignment search tool,BLAST)软件进行同源性对比,构建系统发育树。
1.3.7 数据统计与分析
所有实验进行3次重复,采用SPSS 19.0软件统计处理数据,使用GraphPad Prism 8.0软件对实验数据进行统计与制图,采用One-way ANOVA进行方差分析和Duncan多重比较进行各数据之间的显著性分析。P<0.05表示各组数据之间的差异具有统计学意义。
2 结果与分析
2.1 分离纯化及形态特征分析
共分离纯化获得64株菌,多数菌落呈不规则圆形,乳白色,较黏稠,不透明,64株菌均表现为革兰氏阳性,细胞形态呈杆状。代表菌株NB-13的菌落形态及细胞形态见图1。
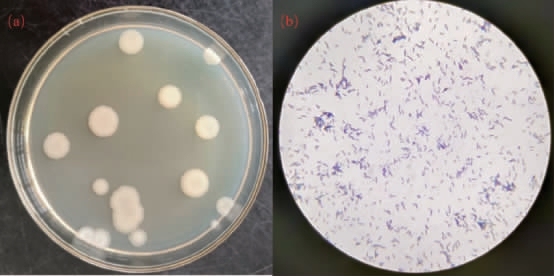
图1 菌株NB-13的菌落形态(a)及细胞形态(b)
Fig.1 Colony morphology (a) and cell morphology (b) of strain NB-13
2.2 产淀粉酶、蛋白酶、脂肪酶和纤维素酶菌株的初筛
2.2.1 产淀粉酶菌株初筛结果
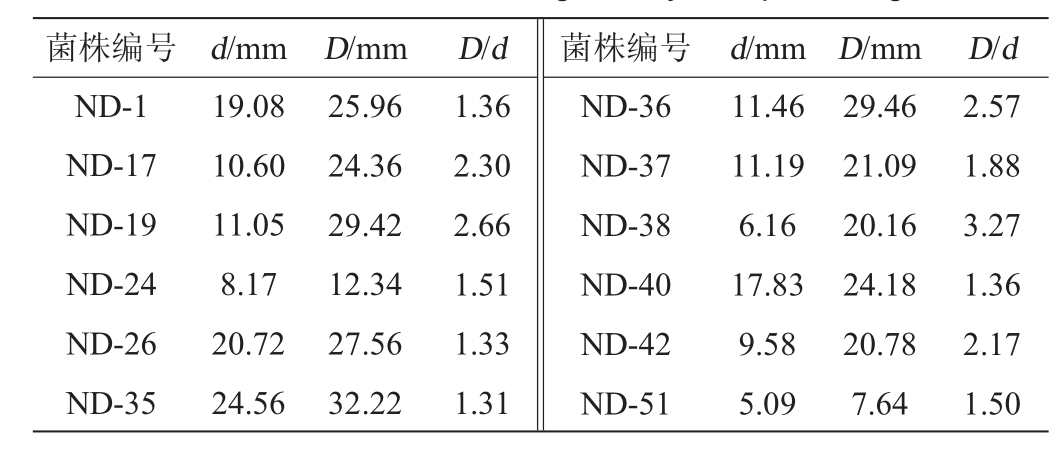
采用淀粉酶筛选培养基对样品中分离出的芽孢杆菌进行初筛,结果见表1。由表1可知,产生淀粉水解圈的有30株,菌株D/d范围为1.30~3.27,其中菌株ND-38的D/d值最大,为3.27。选取D/d≥2的7株菌株ND-17、ND-19、ND-36、ND-38、ND-42、NB-13和NB-28,对其淀粉酶活力进行测定。
表1 产淀粉酶菌株初筛结果
Table 1 Results of initial screening of amylase-producing strains
菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ND-1 ND-17 ND-19 ND-24 ND-26 ND-35 19.08 10.60 11.05 8.17 20.72 24.56 25.96 24.36 29.42 12.34 27.56 32.22 1.36 2.30 2.66 1.51 1.33 1.31 ND-36 ND-37 ND-38 ND-40 ND-42 ND-51 11.46 11.19 6.16 17.83 9.58 5.09 29.46 21.09 20.16 24.18 20.78 7.64 2.57 1.88 3.27 1.36 2.17 1.50
续表
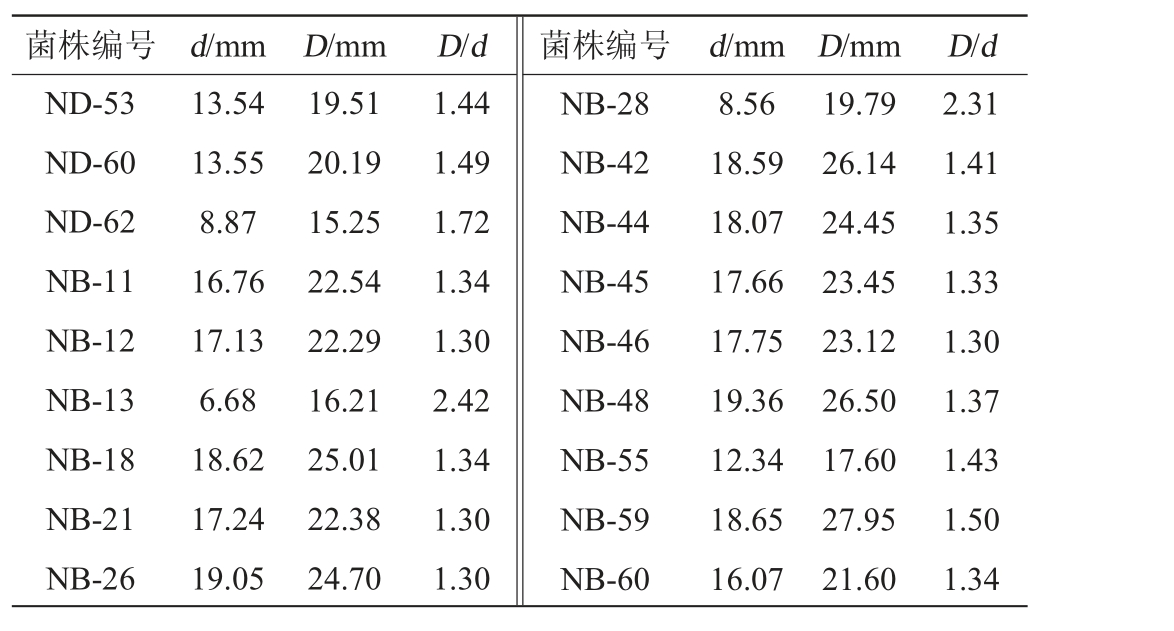
菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ND-53 ND-60 ND-62 NB-11 NB-12 NB-13 NB-18 NB-21 NB-26 13.54 13.55 8.87 16.76 17.13 6.68 18.62 17.24 19.05 19.51 20.19 15.25 22.54 22.29 16.21 25.01 22.38 24.70 1.44 1.49 1.72 1.34 1.30 2.42 1.34 1.30 1.30 NB-28 NB-42 NB-44 NB-45 NB-46 NB-48 NB-55 NB-59 NB-60 8.56 18.59 18.07 17.66 17.75 19.36 12.34 18.65 16.07 19.79 26.14 24.45 23.45 23.12 26.50 17.60 27.95 21.60 2.31 1.41 1.35 1.33 1.30 1.37 1.43 1.50 1.34
2.2.2 产蛋白酶菌株初筛结果
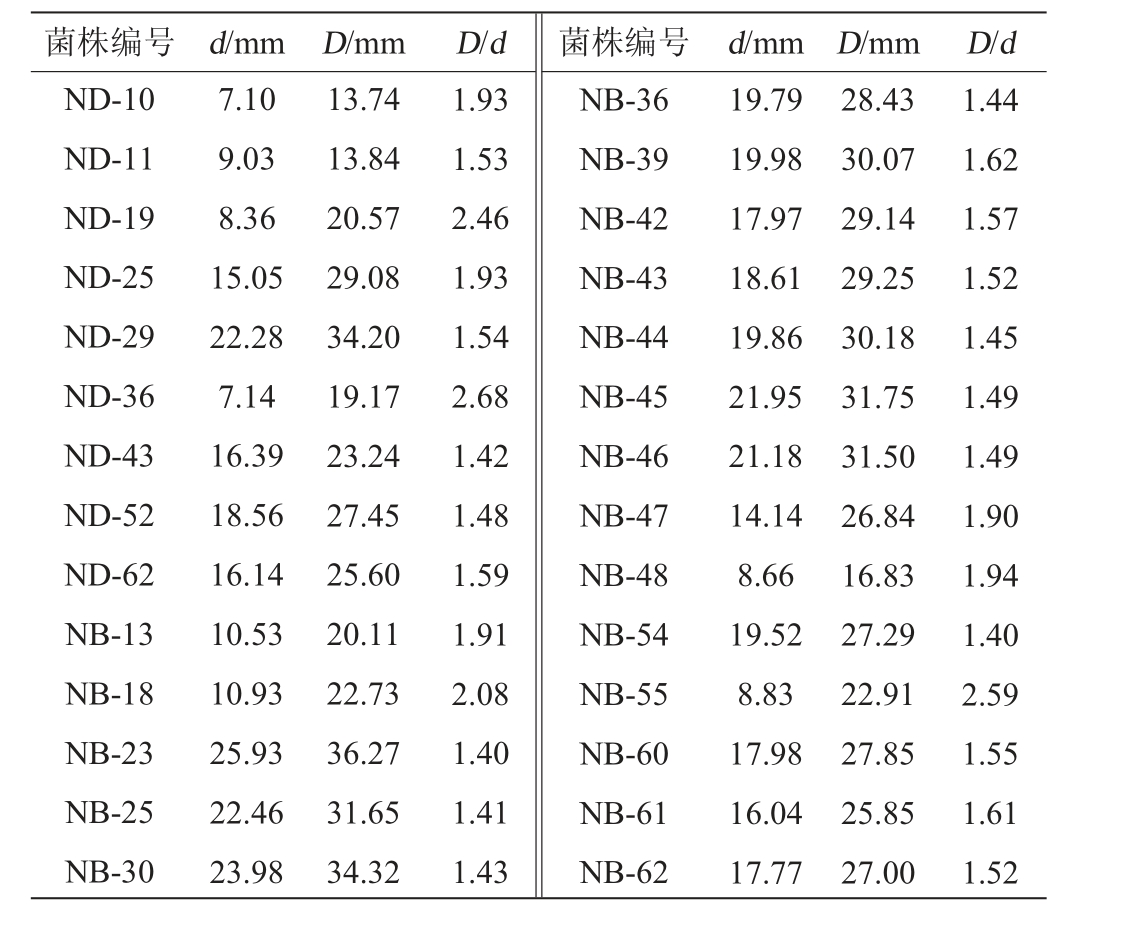
采用蛋白酶筛选培养基对样品中分离出的芽孢杆菌进行初筛,结果见表2。由表2可知,产生蛋白水解圈的有28株,菌株D/d范围为1.40~2.68,其中菌株ND-36的D/d值最大,为2.68。选取D/d≥1.9的9株菌株ND-10、ND-19、ND-25、ND-36、NB-13、NB-18、NB-47、NB-48和NB-55,对其蛋白酶活力进行测定。
表2 产蛋白酶菌株初筛结果
Table 2 Results of initial screening of protease-producing strains
菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ND-10 ND-11 ND-19 ND-25 ND-29 ND-36 ND-43 ND-52 ND-62 NB-13 NB-18 NB-23 NB-25 NB-30 7.10 9.03 8.36 15.05 22.28 7.14 16.39 18.56 16.14 10.53 10.93 25.93 22.46 23.98 13.74 13.84 20.57 29.08 34.20 19.17 23.24 27.45 25.60 20.11 22.73 36.27 31.65 34.32 1.93 1.53 2.46 1.93 1.54 2.68 1.42 1.48 1.59 1.91 2.08 1.40 1.41 1.43 NB-36 NB-39 NB-42 NB-43 NB-44 NB-45 NB-46 NB-47 NB-48 NB-54 NB-55 NB-60 NB-61 NB-62 19.79 19.98 17.97 18.61 19.86 21.95 21.18 14.14 8.66 19.52 8.83 17.98 16.04 17.77 28.43 30.07 29.14 29.25 30.18 31.75 31.50 26.84 16.83 27.29 22.91 27.85 25.85 27.00 1.44 1.62 1.57 1.52 1.45 1.49 1.49 1.90 1.94 1.40 2.59 1.55 1.61 1.52
2.2.3 产脂肪酶菌株初筛结果
采用脂肪酶筛选培养基对样品中分离出的芽孢杆菌进行初筛,结果见表3。由表3可知,产生明显钙沉淀圈的有16株,菌株D/d范围为1.10~1.74,其中菌株NB-24的D/d值最大,为1.74。选取D/d≥1.3的5株菌株ND-21、NB-9、NB-16、NB-24和NB-38,对其脂肪酶活力进行测定。
表3 产脂肪酶菌株初筛结果
Table 3 Results of initial screening of lipase-producing strains

菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ND-18 29.90 34.39 1.15 NB-16 12.40 16.36 1.32
续表
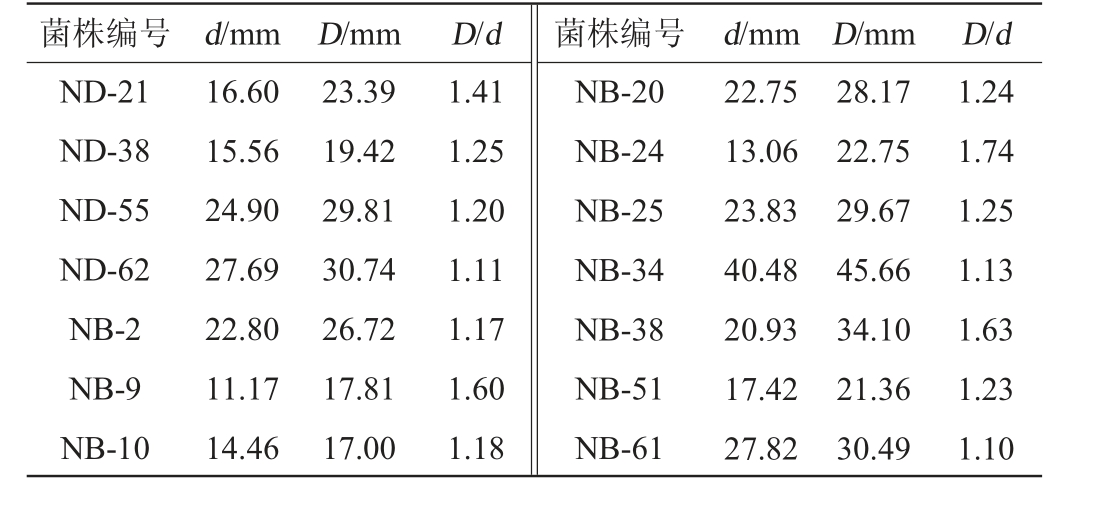
菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ND-21 ND-38 ND-55 ND-62 NB-2 NB-9 NB-10 16.60 15.56 24.90 27.69 22.80 11.17 14.46 23.39 19.42 29.81 30.74 26.72 17.81 17.00 1.41 1.25 1.20 1.11 1.17 1.60 1.18 NB-20 NB-24 NB-25 NB-34 NB-38 NB-51 NB-61 22.75 13.06 23.83 40.48 20.93 17.42 27.82 28.17 22.75 29.67 45.66 34.10 21.36 30.49 1.24 1.74 1.25 1.13 1.63 1.23 1.10
2.2.4 纤维素酶初筛结果
采用纤维素酶筛选培养基对样品中分离出的芽孢杆菌进行初筛,结果见表4。由表4可知,产生明显透明圈的有24株,菌株D/d范围为1.32~3.71,其中菌株ND-38的D/d值最大,为3.71。选取D/d≥3的7株菌株ND-17、ND-32、ND-38、ND-51、NB-16、NB-38和NB-55,对其纤维素酶活力进行测定。
表4 产纤维素酶菌株初筛结果
Table 4 Results of initial screening of cellulase-producing strains
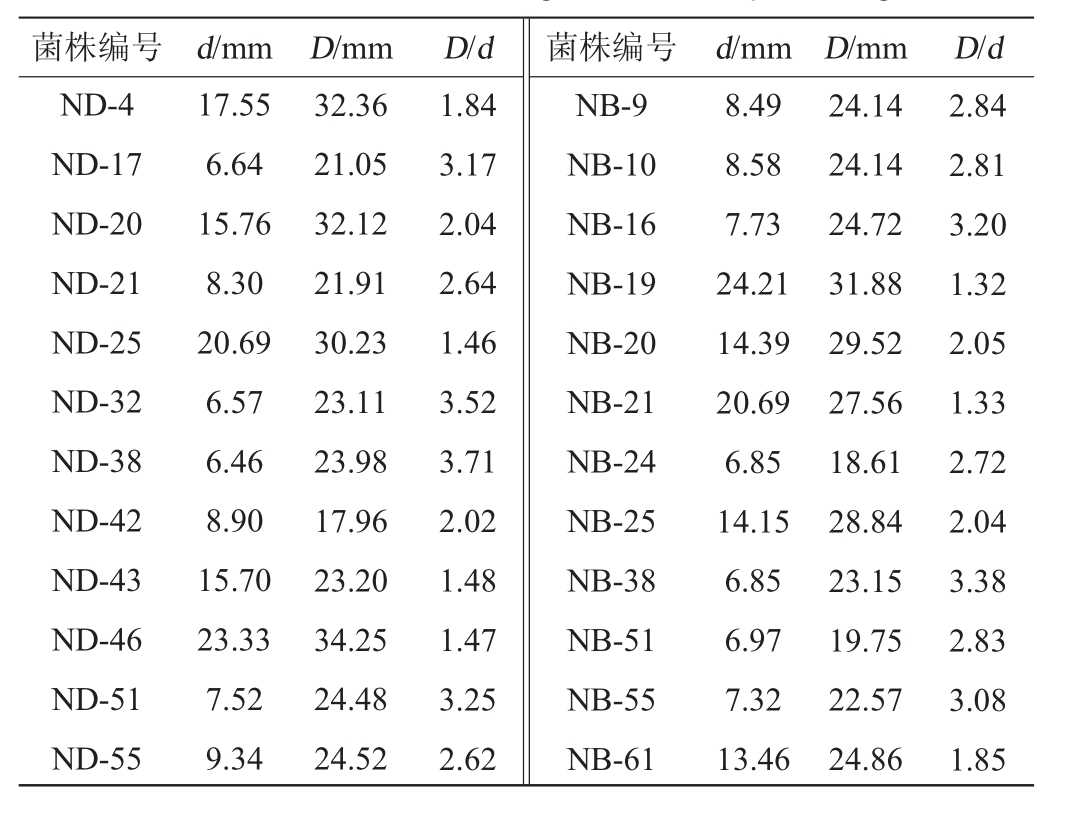
菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ND-4 ND-17 ND-20 ND-21 ND-25 ND-32 ND-38 ND-42 ND-43 ND-46 ND-51 ND-55 17.55 6.64 15.76 8.30 20.69 6.57 6.46 8.90 15.70 23.33 7.52 9.34 32.36 21.05 32.12 21.91 30.23 23.11 23.98 17.96 23.20 34.25 24.48 24.52 1.84 3.17 2.04 2.64 1.46 3.52 3.71 2.02 1.48 1.47 3.25 2.62 NB-9 NB-10 NB-16 NB-19 NB-20 NB-21 NB-24 NB-25 NB-38 NB-51 NB-55 NB-61 8.49 8.58 7.73 24.21 14.39 20.69 6.85 14.15 6.85 6.97 7.32 13.46 24.14 24.14 24.72 31.88 29.52 27.56 18.61 28.84 23.15 19.75 22.57 24.86 2.84 2.81 3.20 1.32 2.05 1.33 2.72 2.04 3.38 2.83 3.08 1.85
2.3 产淀粉酶、蛋白酶、脂肪酶和纤维素酶菌株的复筛
2.3.1 菌株产淀粉酶活力测定结果
D/d≥2的7株菌的淀粉酶活力测定结果见图2。由图2可知,菌株NB-13的淀粉酶活力显著高于其他菌株(P<0.05),淀粉酶活力为100.64 U/mL,而菌株ND-17、ND-19、ND-36、ND-38和NB-28淀粉酶活力分别为55.38 U/mL、81.21 U/mL、83.20 U/mL、57.26 U/mL和83.56 U/mL,但菌株ND-42淀粉酶活力偏低,仅为5.18 U/mL。游勇等[27]从白酒大曲中筛选出产淀粉酶的地衣芽孢杆菌在37 ℃下培养60 h时酶活为53.42 U/mL;周佳慧等[28]从酱醪筛选出产淀粉酶的解淀粉芽孢杆菌,该菌在37 ℃培养12 h时酶活为31.17 U/mL;王磊等[29]从土壤中筛选出产淀粉酶的枯草芽孢杆菌,该菌在37 ℃培养48 h时酶活为19.76 U/mL。本实验筛选的菌株NB-13有一定的产淀粉酶优势。
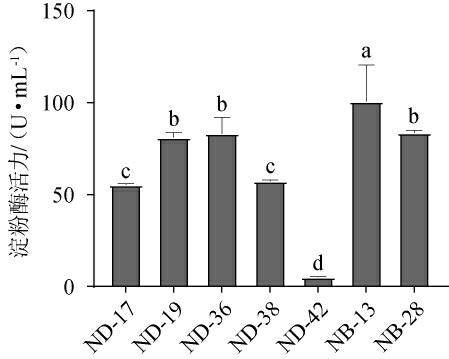
图2 筛选菌株产淀粉酶活力测定结果
Fig.2 Determination results of amylase activities produced by screened strains
不同字母表示差异显著(P<0.05),下同。
2.3.2 菌株产蛋白酶活力测定结果
D/d≥1.9的9株菌的蛋白酶活力测定结果见图3。由图3可知,菌株NB-13产蛋白酶活力显著高于其他菌株(P<0.05),达到34.30U/mL,而菌株ND-10、ND-19、ND-25、ND-36、NB-18、NB-47、NB-48和NB-55蛋白酶活力分别为17.85 U/mL、24.01U/mL、20.00U/mL、18.23U/mL、15.73U/mL、18.28U/mL、21.05 U/mL和16.92 U/mL。与彭昀等[30]从庆阳豆豉中筛选出蛋白酶酶活为25.37 U/mL的枯草芽孢杆菌和董科等[31]从市售水豆豉中筛选出的蛋白酶酶活为24.52 U/mL的贝莱斯芽孢杆菌相比,本实验筛选的菌株NB-13产蛋白酶活力较高。
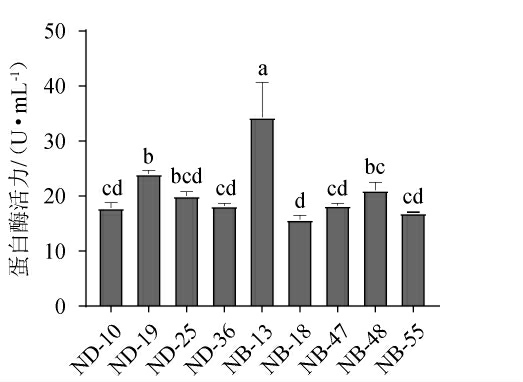
图3 筛选菌株产蛋白酶活力测定结果
Fig.3 Determination results of protease activities produced by screened strains
2.3.3 菌株产脂肪酶活力测定结果
D/d≥1.3的5株菌的脂肪酶活力测定结果见图4。由图4可知,菌株ND-21产脂肪酶活力显著高于其他菌株(P<0.05),达到39.95 U/mL,而菌株NB-9、NB-16、NB-24和NB-38脂肪酶活力分别为25.43 U/mL、11.77 U/mL、31.27 U/mL和0.92 U/mL。刘延波等[32]从酒曲筛选出产脂肪酶的枯草芽孢杆菌在37 ℃培养24 h时酶活为15.09 U/mL;徐伟芳等[33]从食堂附近土壤筛选出产脂肪酶的甲基营养型芽孢杆菌在30 ℃培养24 h时酶活为21.22 U/mL。因此,本研究筛选的菌株ND-21产脂肪酶活力较高。
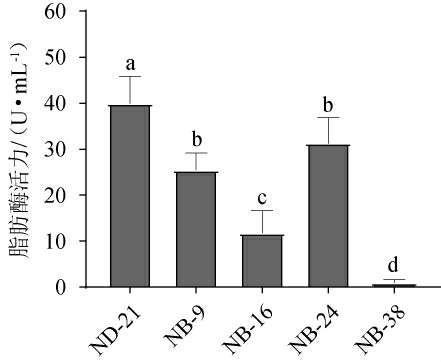
图4 筛选菌株产脂肪酶活力测定结果
Fig.4 Determination results of lipase activities produced by screened strains
2.3.4 菌株产纤维素酶活力测定结果
D/d≥3的7株菌的纤维素酶活力测定结果见图5。由图5可知,菌株ND-38和NB-55纤维素酶活力显著高于其他菌株(P<0.05),酶活力分别为1.65 U/mL和1.72 U/mL,而菌株ND-17、ND-32、ND-51、NB-16和NB-38纤维素酶活力分别为1.12 U/mL、0.76 U/mL、0.86 U/mL、0.52 U/mL、0.46 U/mL。江学斌等[34]从14株细菌中筛选出产纤维素酶的枯草芽孢杆菌LW006也得出相似的结果,该菌在37 ℃下培养24 h时酶活力为1.22U/mL。而何深宏等[35]从57株菌株中筛选出的解淀粉芽孢杆菌X10在37 ℃下培养48 h时酶活力为31.9 U/mL;表明本研究筛选菌株产纤维素酶能力还有不足。分析原因可能是不同地理气候特征和来源的产纤维素酶芽孢杆菌具有一定差异性。本研究筛选的菌株ND-38和NB-55产纤维素酶活力较高。
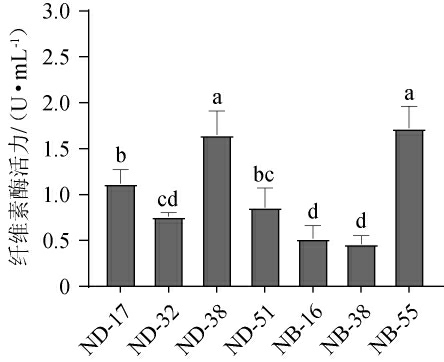
图5 筛选菌株产纤维素酶活力测定结果
Fig.5 Determination results of cellulase activities produced by screened strains
2.4 菌株生长曲线分析
本研究在150r/min,37℃条件下继续探究了菌株ND-21、ND-38、NB-13和NB-55这4株的生长能力,结果见图6。由图6可知,4株菌生长迟滞期较短,为0~2 h,在此期间生长速度较为缓慢,2~10 h期间为分离株的生长对数期,菌株快速生长,菌株活性在此期间最强,12 h后达到对数末期,菌株生长速度逐渐减缓,进入生长稳定期。本研究的菌株生长趋势与宋萌萌等[36]研究一致。在本研究中,不同菌株生长时期所持续的时间基本一致,但最终积累的菌量不同,其中相同时间内菌株ND-21和NB-13富集的菌量较多,菌株NB-55次之,菌株ND-38富集的菌量最少。
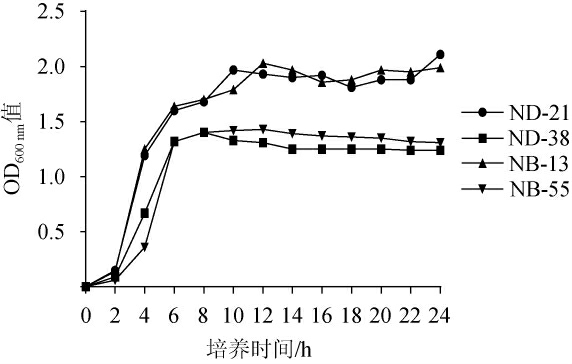
图6 筛选菌株生长曲线
Fig.6 Growth curves of screened strains
2.5 芽孢杆菌分子生物学鉴定
将菌株ND-21、ND-38、NB-13和NB-55经16S rDNA测序,均得到长度约为1 500 bp的序列,测序结果在NCBI数据库中进行同源性对比,从GenBank数据库中获得有关种属的公认标准序列数据,采用系统发育树方法,对菌株进行种水平鉴定,结果见图7。
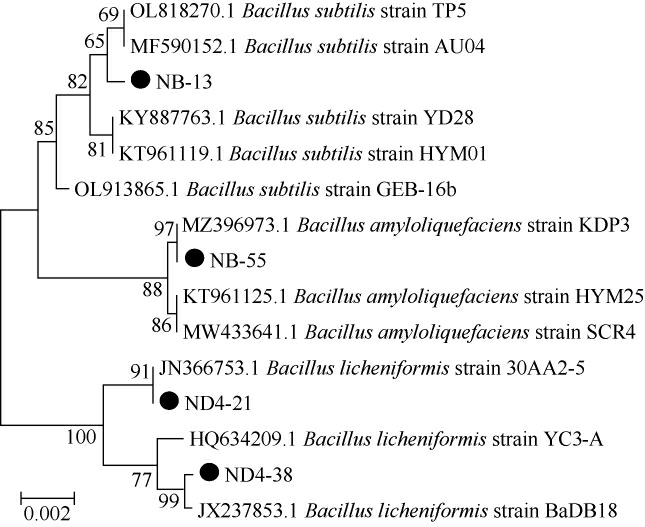
图7 基于16S rDNA基因序列构建4株筛选菌株的系统发育树
Fig.7 Phylogenetic tree for four screened strains based on 16S rDNA gene sequences
由图7可知,菌株NB-13与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近;菌株ND-21和ND-38与地衣芽孢杆菌(Bacillus licheniformis)聚于一支,亲缘关系最近;菌株NB-55与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)聚于一支,亲缘关系最近。本研究鉴定菌株与NCBI平台上的同源性均达到99%以上。
与本研究相似,ZHANG Y Z等[37]对八宝豆豉中优势微生物鉴定发现,芽孢杆菌在整个后发酵过程中表现出绝对优势。LI L等[38]通过高通量测序分析了传统发酵豆豉中优势细菌属为芽孢杆菌。这表明芽孢杆菌是豆豉中的主要菌种,是豆豉发酵不可缺少的菌种。
3 结论
本研究从云南易门豆豉中分离得到64株芽孢杆菌,并对其进行产酶特性试验,发现芽孢杆菌大多能分泌淀粉酶、蛋白酶、脂肪酶和纤维素酶,但不同菌株间存在特异性。产淀粉酶和蛋白酶活力较好的菌株NB-13,其被鉴定为枯草芽孢杆菌(Bacillus subtilis),产纤维素酶活力较好的菌株NB-55,其被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),产脂肪酶活力较好的菌株ND-21、产纤维素酶活力较好的菌株ND-38,均被鉴定为地衣芽孢杆菌(Bacillus licheniformis)。4株菌生长活力良好,具有豆豉商业发酵剂的开发潜力。
[1]周婉婷.豆豉中风味蛋白酶菌株的筛选及混菌发酵剂的研究[D].上海:上海海洋大学,2022.
[2]王竞一.生产性保护模式下传统工艺类非物质文化遗产的创业之路研究——以永川豆豉为例[J].中国调味品,2018,43(5):171-174,200.
[3] LI H, FENG F Q, SHEN L R, et al.Nutritional evaluation of different bacterial douchi[J].Asia Pac J Clin Nutr,2007,16(1):215-221.
[4]贾东旭.豆豉中芽孢杆菌的分离、鉴定与应用研究[D].贵阳:贵州大学,2009.
[5]王继刚.浏阳豆豉优势微生物分离及其豆豉制备工艺优化[D].长沙:湖南农业大学,2021.
[6]郑折民.谈古老的纳豆制品在现代健康市场的作用[J].中国品牌与防伪,2023(S1):59-60.
[7] CHALID S Y.Angiotensin converting enzyme inhibitor activity of the soybean tempeh protein as functional food[J].Int J Geomate,2019,16(56):73-78.
[8]LEE J H,HWANG C E,SON K S,et al.Comparisons of nutritional constituents in soybeans during solid state fermentation times and screening for their glucosidase enzymes and antioxidant properties[J].Food Chem,2019,272:362-371.
[9]SU H K,CHEN W C,LU J H,et al.The effects of using tempeh as a supplement for type 2 diabetes[J].Food Sci Nutr,2023,11(6):3339-3347.
[10]尹召军,陈卫平,张凤英.细菌型豆豉生理活性物质的研究进展[J].中国粮油学报,2011,26(3):119-123,128.
[11]谭小琴.西南地区传统细菌型豆豉品质特点及微生物群系研究[D].重庆:西南大学,2021.
[12]朱海针,龙凯,梁永红,等.Biolog技术监测淡豆豉发酵炮制过程中微生物种类动态变化[J].中国实验方剂学杂志,2015,21(17):14-17.
[13]王浩宇.细菌型豆豉的发酵工艺优化及风味品质形成研究[D].重庆:西南大学,2022.
[14]林智平.纳豆枯草芽孢杆菌的研究[J].中国品牌与防伪,2023(S1):61-62.
[15]周婉婷,侯宏伟,贺瑞琦,等.豆豉中产蛋白酶菌株的酶学性质及风味酶基因挖掘[J].食品与发酵工业,2022,48(24):181-193.
[16]高梦颖,王浩宇,谭小琴,等.自然及人工接种发酵对细菌型豆豉食用品质的影响研究[J].食品与发酵工业,2023,49(13):136-143.
[17]何华美,李淑珍,陈丹霞,等.芽孢杆菌混合发酵工艺条件的优化[J].中国酿造,2014,33(4):56-60.
[18]MELAD AL-AWSY S A O,AMAL AL OBAIDI.Production of amylase enzyme from thermophilic bacteria using agricultural wastes as a substrate[J].Aust J Basic Appl Sci,2017,11(13):158-164.
[19]LIU Y B,FU J Y,WANG L L,et al.Isolation,identification,and wholegenome sequencing of high-yield protease bacteria from Daqu of Zhang-Gong Laojiu[J].Plos One,2022,17(4):0264677.
[20]PHAM V K J,CHANG S,CHUNG W.Investigation of lipolytic-secreting bacteria from an artificially polluted soil using a modified culture method and optimization of their lipase production[J].Microorganisms,2021,9(12):2590.
[21] RAJESH R, GUMMADI S N.α-Amylase and cellulase production by novel halotolerant Bacillus sp.PM06 isolated from sugarcane pressmud[J].Biotechnol Appl Biochem,2022,69(1):149-159.
[22]田瑞杰.中温大曲原核微生物群落解析及高产淀粉酶菌株的筛选与应用探究[D].郑州:郑州轻工业大学,2022.
[23]张雪.一株解淀粉芽孢杆菌的特性及抑菌活性研究[D].大连:大连工业大学,2018.
[24]陈茏.产蛋白酶菌株的筛选及酶学性质的研究[D].南昌:南昌大学,2020.
[25]史程风.产低温脂肪酶酵母菌的筛选、产酶条件优化及酶学性质研究[D].南阳:南阳师范学院,2022.
[26]唐春蕾.海洋解淀粉芽孢杆菌发酵培养条件优化研究[D].烟台:烟台大学,2021.
[27]游勇,吴晓玉,廖家富,等.特香型白酒大曲中一株耐热产淀粉酶地衣芽孢杆菌的分离和鉴定[J].酿酒科技,2022(3):17-24.
[28]周佳慧,林礼钊,吴惠贞,等.酱醪中耐盐高产酶菌株的筛选、分离和鉴定及其生化特性分析[J].中国调味品,2022,47(12):1-6,12.
[29]王磊,陈宇飞,杨柳.产淀粉酶芽孢杆菌的分离和鉴定[J].食品研究与开发,2017,38(6):175-178.
[30]彭昀,杨富民,康红霞,等.庆阳豆豉优势菌株的分离鉴定[J].食品与发酵工业,2013,39(4):58-63.
[31]董科,陈宇航,沈丹芸,等.水豆豉中高产豆豉纤溶酶的菌株筛选、鉴定及生长性能研究[J].中国调味品,2019,44(9):85-89.
[32]刘延波,邢星月,赵志军,等.高产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2019,38(7):54-59.
[33]徐伟芳,黄涛杨,周敏,等.一株脂肪酶产生菌的筛选鉴定及其酶学性质研究[J].西南大学学报(自然科学版),2017,39(5):62-69.
[34]江学斌,成雪鸿,马苗鹏,等.产纤维素酶芽孢杆菌的鉴定与酶活力比较[J].广东农业科学,2022,49(4):116-122.
[35]何深宏,程方俊,罗干,等.解淀粉芽孢杆菌高产纤维素酶菌株的筛选与鉴定[J].福建农业学报,2020,35(7):781-787.
[36]宋萌萌,黄天然,周兴虎,等.烧鸡中产芽孢菌的分离鉴定及耐受性比较研究[J].肉类研究,2021,35(10):18-24.
[37]ZHANG Y Z,LIN X N,JI Y Q,et al.Characterization and correlation of dominant bacteria and volatile compounds in post-fermentation process of Ba-bao Douchi[J].Food Res Int,2022,160:111688.
[38]LI L,RUAN L,JI A,et al.Biogenic amines analysis and microbial contribution in traditional fermented food of Douchi[J].Sci Rep,2018,8(1):12567.