薏米是一种优质杂粮,含有丰富的淀粉、蛋白质和脂肪等多种营养物质[1-2]。但由于薏米中脂肪含量较高,是小米和小麦的2~3倍,极易发霉变质,导致贮存期短[3-5]。薏米中淀粉含量约为65%,仅次于大米、小麦和玉米,可作为酿酒的主要原料[1]。采用薏米为原料酿制的酒醪具有比糯米酒醪更优的保健功效[6]。以前的研究主要集中在改善薏米酒醪的营养品质及功能特性[1-2,5],而对薏米酒醪挥发性成分和风味强化的研究还尚未报道。
酒醪中大多数挥发性化合物是由酒精发酵过程中酵母菌生长代谢所产生,如酯类、醇类及酸类化合物[7]。酒醪的香气特征与酵母菌高度相关[8]。目前,商业活性干酵母被广泛用于米酒酒醪的生产,保证了发酵过程的可控性和稳定性以及酒醪品质的可预测性[9]。与自然发酵的酒醪相比,接种商业酿酒酵母(Saccharomyces cerevisiae)发酵酒醪的挥发性风味物质组成呈现简单且单一的现象,缺少自然发酵过程中非酿酒酵母(non-Saccharomyces)的协同增效作用[10]。越来越多的研究表明,非酿酒酵母对酒醪风味品质有积极影响[10-11]。非酿酒酵母可产生活性相对较高的关键胞外酶,如β-葡萄糖苷酶、脂肪酶、蛋白酶和碳硫裂解酶,这些酶有利于酯类、醇类及醛类化合物的产生[12]。不同非酿酒酵母与酿酒酵母混合发酵对产品风味品质具有不同影响,因此,选出适合薏米酒醪发酵的非酿酒酵母尤为重要。
因此,本研究分别采用商业酿酒酵母(SC)单菌发酵,商业酿酒酵母分别与非酿酒酵母德尔布有孢圆酵母(Torulaspora delbrueckii)(TD)、东方伊萨酵母(Issatchenkia orientalis)(IO)、粟酒裂殖酵母(Schizosaccharomyces pombe)(SP)混合发酵对薏米酒醪理化特性、色泽和挥发性风味物质组成的影响,以期提高薏米酒醪品质,为调控优化薏米酒醪发酵工艺及风味品质提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
薏米:安徽初野生物科技有限公司;商业酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司;德尔布有孢圆酵母(Torulaspora delbrueckii)CICC 1004、东方伊萨酵母(Issatchenkia orientalis)CICC 31693、粟酒裂殖酵母(Schizosaccharomyces pombe)CICC 31215:中国工业微生物菌种保藏管理中心(China center of industrial culture collection,CICC)。
1.1.2 化学试剂
葡萄糖、硫酸铜、酒石酸钾纳、氢氧化钠、冰乙酸、亚铁氰化钾、亚加蓝等(均为分析纯):国药集团化学试剂有限公司;2-辛醇(色谱纯):北京索莱宝科技有限公司;α-淀粉酶(酶活10万U/g)、糖化酶(酶活20万U/g):南京鸿佑生物科技有限公司。
1.1.3 培养基
麦芽汁培养基、酵母浸出粉胨葡萄糖培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
FA2204N型电子分析天平:三丰精密量仪(上海)有限公司;PHS-2F型实验室pH计:青岛明博环保科技有限公司;HH-11-8型电热恒温水浴锅:杭州艾普仪器设备有限公司;BPC-70F型智能生化培养箱:上海一恒科学仪器有限公司;DDF-1.5KW型恒温加热炉电炉:上海左乐仪器有限公司;SD9012A型色度仪:上海昕瑞仪器仪表有限公司;KH20R-II型高速冷冻离心机:河南兄弟仪器设备有限公司;7890B-5977C型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 菌株活化液的制备
将商业活性干酵母溶于适量温水(35 ℃)中,接入1%(V/V)酵母水溶液于酵母浸出粉胨葡萄糖培养基中进行活化,置于30 ℃培养20 h,6 000 r/min离心10 min,弃去上清液,用无菌生理盐水重悬,得到活菌数约为1×107 CFU/mL菌液[1]。
将德尔布有孢圆酵母、东方伊萨酵母和粟酒裂殖酵母甘油保藏管接入麦芽汁培养基进行活化,置于30 ℃培养24 h,连续活化两代,6 000 r/min离心10 min,收集沉淀,用无菌生理盐水重悬沉淀,最终得到各菌株活菌数约为1×107 CFU/mL菌液[1]。
1.3.2 酒醪的制备
称取新鲜无霉变的薏米,温水(60 ℃)浸泡6 h,沥干后,105℃蒸煮15min,加入薏米质量4倍的无菌水进行打浆,添加0.05%α-淀粉酶,混匀后置于75 ℃液化4 h,冷却至55 ℃后添加0.05%糖化酶,混匀后置于55 ℃糖化8 h,装罐备用[1-2]。
将1%商业酿酒酵母菌液接种至薏米糖化液为对照组(SC);分别将1%商业酿酒酵母菌液与1%德尔布有孢圆酵母菌液、1%东方伊萨酵母菌液、1%粟酒裂殖酵母菌液混合接种至薏米糖化液中为实验组[1],样品分别标记为SC、TD+SC、IO+SC、SP+SC。接种后混匀,置于30 ℃静置发酵48 h,10 000 r/min离心10 min,收集上清液,备用。
1.3.3 理化指标的检测
酒精度的测定:参照GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》;还原糖的测定:参照GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》;pH值的测定:参照GB 5009.237—2016《食品安全国家标准食品pH值的测定》。
1.3.4 颜色参数的测定
将适量样品转移至比色皿,置于色度仪中,对样品颜色参数进行测定,测定模式为反射,读数以CIE1976色度空间值L*值、a*值及b*值表示[13]。
1.3.5 挥发性风味物质的测定
顶空固相微萃取条件:吸取5mL样品上清液,置于20mL顶空瓶中,加入1.5gNaCl和10μL2-辛醇(内标,0.56mg/mL),密封,50℃水浴15min,将萃取针(DVB/CAR/PDMS50/30μm)插入顶空瓶顶部,50 ℃顶空吸附45 min,随后将萃取针在230 ℃高温下插入GC,解吸附5 min[10]。
GC条件:采用HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);以氦气(He)作为载气,流速1.0 mL/min;不分流进样;进样口温度230 ℃;升温程序为初始温度35 ℃保持5 min,以4 ℃/min升温至130 ℃,保持3 min,再以10 ℃/min升温至230 ℃,保持3 min;MS条件:电子电离(electron ionization,EI)源,离子源和四极杆温度分别为230 ℃和150 ℃,电子能量70 eV,质谱扫描范围25~380 m/z[10]。
定性定量分析:通过各挥发性风味物质的保留指数和质谱数据与美国国家标准技术研究所(national institute of standards and technology,NIST)11数据库进行匹配,筛选匹配度>80%的化合物进行定性分析,采用峰面积归一法进行定量分析[14]。
1.3.6 数据处理
所有实验结果均平行测定3次,实验结果以“平均值±标准差”表示。使用GraphPad Prism 8.0和Excel 2017软件绘制图表。利用SPSS 19.0软件对数据进行单因素方差分析(analysis of variance,ANOVA),P<0.05表示显著性差异。采用R 4.0.1软件对挥发性风味化合物数据进行线性判别分析(linear discriminant analysis,LDA)。
2 结果与分析
2.1 非酿酒酵母对薏米酒醪基础理化指标的影响
由表1可知,SC组酒精度最高,可达8.49%vol,显著高于其他三组(P<0.05)。这是由于酿酒酵母经过长达数千年的人工驯化,可通过糖酵解途径定向将原料中糖类物质转化为乙醇[15]。此外,TD+SC组、IO+SC组和SP+SC组中还原糖含量分别为8.61 g/L、8.07 g/L和8.95 g/L,显著低于SC组(9.53 g/L)(P<0.05),表明非酿酒酵母的加入会加强原料中还原糖的消耗。非酿酒酵母的繁殖代谢也需要糖类物质作为碳源,与酿酒酵母混合发酵会引起糖类物质的竞争,从而加速原料中糖类物质的消耗[16]。SC组和IO+SC组的pH值分别为4.71和4.70,二者无显著差异(P>0.05),而TD+SC组和SP+SC组的pH值分别下降至4.65和4.64,与SC组和IO+SC组差异显著(P<0.05)。该结果与LIU S X等[17]研究结果相一致,与纯酿酒酵母相比,推测接种德尔布有孢圆酵母混合发酵会增加苹果酸和柠檬酸的含量。综上,非酿酒酵母和酿酒酵母共发酵会影响薏米酒醪的酒精度、pH和还原糖含量。
表1 薏米酒醪的基础理化指标检测结果
Table 1 Determination results of basic physicochemical indexes of coix seed wine mash
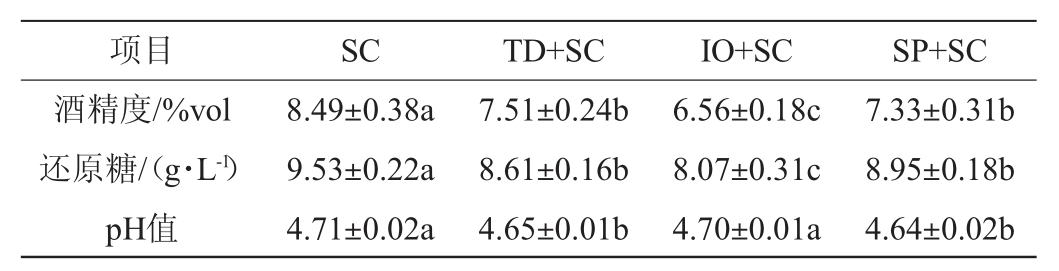
注:同行不同小写字母表示差异显著(P<0.05),下同。
项目 SC TD+SC IO+SC SP+SC酒精度/%vol还原糖/(g·L-1)pH值8.49±0.38a 9.53±0.22a 4.71±0.02a 7.51±0.24b 8.61±0.16b 4.65±0.01b 6.56±0.18c 8.07±0.31c 4.70±0.01a 7.33±0.31b 8.95±0.18b 4.64±0.02b
2.2 非酿酒酵母对薏米酒醪颜色参数的影响
薏米酒醪在发酵期间色泽变化主要由微生物代谢作用引起的。根据CIE1976标准,L*值、a*值和b*值从0至100分别表示从暗到亮,从绿到红,从蓝到黄[13]。薏米酒醪的颜色参数测定结果见图1。由图1可知,薏米酒醪的L*值从高到低排序为:IO+SC组(51.06)>SP+SC组(48.91)>TD+SC组(48.72)>SC组(47.48)。此外,在SC组中观察到最高的红色和黄色,其a*值和b*值分别为-1.75和5.39,其次为TD+SC组、SP+SC组和IO+SC组,表明非酿酒酵母的加入会改变薏米酒醪色泽。综上可知,接种商业酿酒酵母与非酿酒酵母混合发酵可以增加薏米酒醪的亮度。
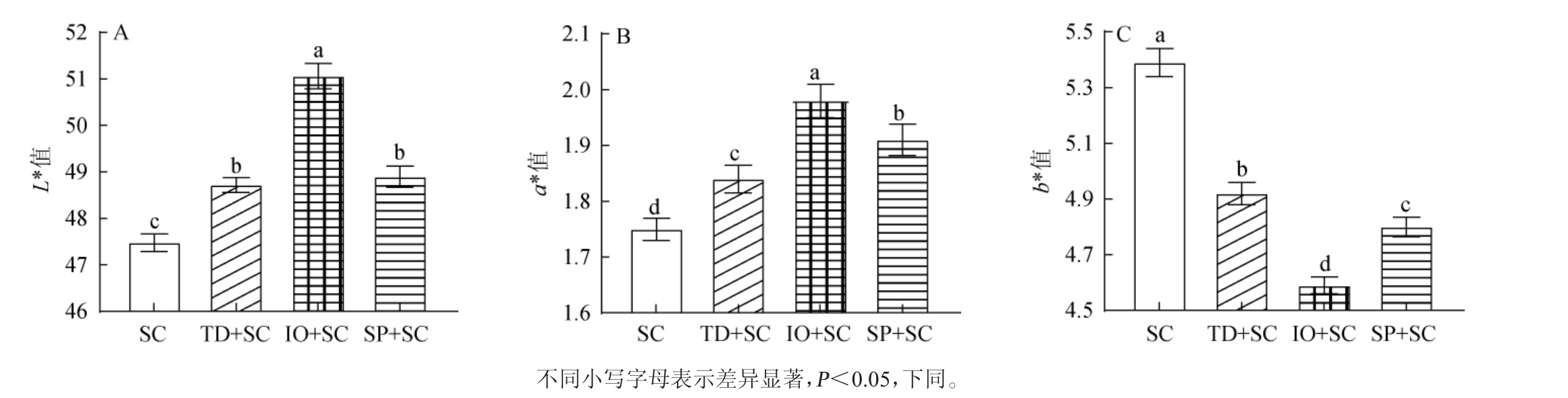
图1 薏米酒醪的颜色参数
Fig.1 Color parameters of coix seed wine mash
2.3 非酿酒酵母对薏米酒醪挥发性风味物质的影响
挥发性风味物质是酒醪品质的重要组成部分,对酒醪的感官特征非常重要[14]。薏米酒醪中挥发性风味物质含量检测结果见表2。由表2可知,4组样品中共检测出50种挥发性风味化合物,其中,SC组检出43种挥发性风味物质,而TD+SC组、IO+SC组和SP+SC组分别检出49种、48种和48种挥发性风味物质。表明商业酿酒酵母与非酿酒酵母混合发酵可以增加薏米酒醪中挥发性风味物质的种类。
表2 薏米酒醪中挥发性风味物质含量检测结果
Table 2 Determination results of volatile flavor substances contents in coix seed wine mash
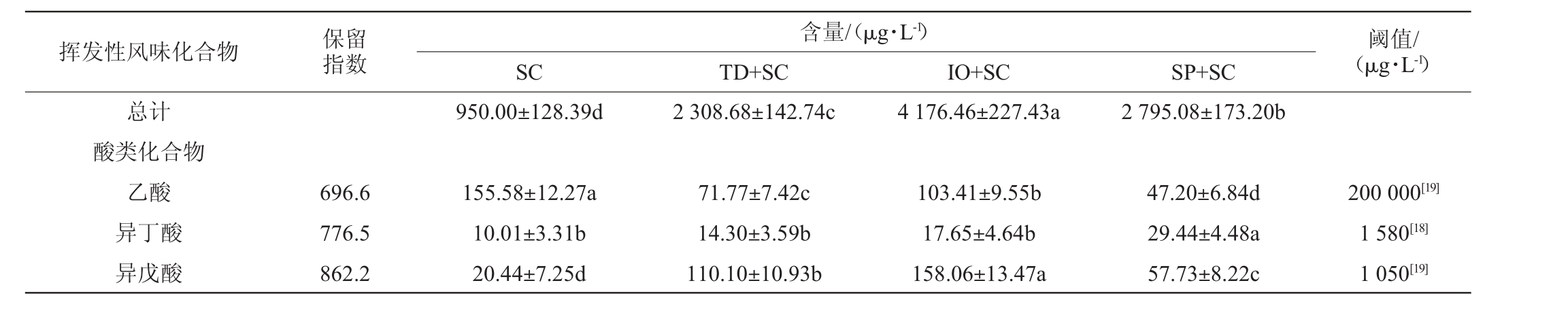
挥发性风味化合物 保留指数含量/(μg·L-1)SC TD+SC IO+SC SP+SC阈值/(μg·L-1)总计酸类化合物乙酸异丁酸异戊酸696.6 776.5 862.2 950.00±128.39d 155.58±12.27a 10.01±3.31b 20.44±7.25d 2 308.68±142.74c 71.77±7.42c 14.30±3.59b 110.10±10.93b 4 176.46±227.43a 103.41±9.55b 17.65±4.64b 158.06±13.47a 2 795.08±173.20b 47.20±6.84d 29.44±4.48a 57.73±8.22c 200 000[19]1 580[18]1 050[19]
续表

注:“ND”表示未检出;“-”表示未查到阈值。
挥发性风味化合物 保留指数含量/(μg·L-1)SC TD+SC IO+SC SP+SC阈值/(μg·L-1)己酸壬酸癸酸总计醛类化合物异丁醛异戊醛苯甲醛辛醛苯乙醛壬醛葵醛总计酮类化合物2-戊酮3-羟基-2-丁酮2-庚酮2-壬酮总计其他类化合物萘十二烷十五烷2,4-二叔丁基苯酚总计1 004.1 1271.8 1364.8 26.90±3.06a 4.86±3.37b 23.71±3.74a 241.50±17.39b 7.44±2.99c 15.20±3.02a 15.30±3.45b 234.11±19.74b 21.83±2.73ab 6.46±2.87b 17.44±3.31ab 324.85±23.43a 15.62±2.49b 8.17±3.59b 19.58±3.08ab 177.74±15.20c 2 520[19]3 560[19]1 000[18]552.8 647.1 962.6 1 006.5 1 044.9 1 104.4 1 206.0 215.74±15.32a ND ND 4.54±2.38a 10.39±3.12c 8.62±2.77c 39.88±4.44a 279.17±21.39a 142.51±12.44b 23.37±6.94b 15.48±3.01a 3.80±2.11a 13.51±2.23c 13.31±2.59bc 15.29±3.17bc 227.27±17.74b 108.22±11.05c 58.12±11.12a 3.25±2.32b 4.27±2.44a 19.14±2.30b 16.27±3.03b 11.04±2.75c 220.31±16.43b 64.43±8.73d 14.88±5.77b 6.60±2.55b 3.96±2.42a 37.29±4.55a 25.80±3.75a 17.36±2.29b 170.32±17.20c 2 902[18]68[18]990[19]40[18]25[18]15[18]71[18]676.3 707.7 889.5 1 090.8 4.16±2.04c 254.81±18.76c 2.13±1.77b 1.72±0.43a 262.82±24.39c 12.44±3.31b 330.05±25.46b 7.34±2.08a 1.33±0.58a 351.16±28.74b 8.29±3.07bc 295.70±24.09bc 4.22±1.92ab 1.89±0.49a 310.10±27.43bc 20.45±3.95a 732.22±57.33a 5.17±2.21ab ND 757.84±35.21a 35[18]259[19]140[19]200[19]1 182.0 1 199.7 1 499.2 1 504.6 33.98±4.78a 62.77±5.11a 26.65±5.18a 256.53±21.07a 379.93±22.39a 29.77±4.24a 40.40±3.29c 29.23±5.82a 239.33±22.75a 338.73±20.75a 30.40±3.95a 45.39±4.08bc 20.50±4.77a 263.05±24.62a 359.39±23.43a 36.03±4.86a 51.82±3.87b 23.74±4.56a 231.84±22.39a 343.43±19.21a 159[18]--3 580[18]
2.3.1 醇类化合物
醇类化合物是酒醪中主要香气物质,主要呈水果香、花香,适宜浓度可促进酒醪香气的协调性[14]。SC组醇类化合物含量最高,可达3 656.77 μg/L,而TD+SC组、IO+SC组和SP+SC组中醇类化合物含量分别为2 878.81 μg/L、1 337.80 μg/L和2 212.80 μg/L,各组之间差异显著(P<0.05),与ZHANG B Q等[20]研究结果相一致。酒醪发酵中大多数醇类化合物是酵母通过埃里希途径和糖代谢产生的氨基酸代谢产物[10]。然而,与纯酿酒酵母发酵相比,一些非酿酒酵母的参与会增加高级醇类化合物含量[21]。不一致的结果归因于不同非酿酒酵母的菌株特异性及发酵条件的差异。本研究结果强调,采用本实验所用非酿酒酵母与商业酿酒酵母混合发酵,可显著降低薏米酒醪中醇类化合物含量,可能是非酿酒酵母的参与改变了酿酒酵母的氨基酸代谢分解,从而影响挥发性醇类物质的产生[10]。
2.3.2 酯类化合物
酯类化合物可能是酒醪中最重要的风味物质,大多数酯类具有花、果的芳香气味,可增加酒醪香气的复杂性和典型性[14]。TD+SC组、IO+SC组和SP+SC组中酯类化合物含量分别为2 308.68 μg/L、4 176.46 μg/L和2 795.08 μg/L,均显著高于SC组(950.00 μg/L)(P<0.05),且各组之间差异显著(P<0.05),与ZHANG B Q等[20]研究结果相一致。乙酯类化合物是酵母菌发酵的主要代谢产物,其含量通常在酯类化合物中最高。酒醪中乙酯类化合物的生成是由酸类化合物最初通过酰基辅酶A合成酶与辅酶A结合形成酰基辅酶A化合物,在酵母菌发酵过程中通过酰基辅酶A的酶解,与乙醇反应生成乙酯类化合物[22]。此外,接种非酿酒酵母混合发酵有利于提高薏米酒醪中乙酸酯类化合物含量,主要由乙酸异戊酯和乙酸苯乙酯的含量增加,与RENAULT P等[23]研究结果相一致。因此,混合发酵薏米酒醪中酯类化合物含量的增加表明非酿酒酵母和商业酿酒酵母之间的相互作用对乙酯和乙酸酯类化合物的产生具有协同作用。
2.3.3 酸类化合物
酸类化合物大部分来源于酵母菌代谢的副产物[14]。SC组和TD+SC组中酸类化合物含量分别为241.50 μg/L和234.11 μg/L,二者无显著差异(P>0.05),而IO+SC组中酸类化合物含量增加至324.85 μg/L,SP+SC组酸类化合物含量减少至177.74 μg/L,均与SC组和TD+SC组差异显著(P<0.05)。SP+SC组酸类化合物含量减少主要归因于乙酸含量的降低,与SC组相比,SP+SC组中乙酸含量降低了69.67%,这可能与参与乙酸生产的乙醛脱氢酶低转录水平表达有关[24]。薏米酒醪中也发现了几种脂肪酸,如异丁酸、异戊酸、己酸、壬酸、癸酸。SC组中异戊酸含量显著低于其他组(P<0.05)与SC组相比,IO+SC组中异戊酸含量显著提高6.7倍,这可能与东方伊萨酵母中脂肪酸合成酶的高转录水平表达有关。综上,非酿酒酵母的菌株特异性对薏米酒醪中挥发性酸类化合物含量具有显著影响。
2.3.4 醛酮类及其他类化合物
醛酮类化合物可通过醇氧化形成,这些化合物与其他化合物结合,可能会产生奇妙的芳香,有助于增强整体芳香的复杂性和平衡性[14]。SC组醛类化合物含量最高,可达279.17 μg/L,显著高于其他3组(P<0.05)。非酿酒酵母和酿酒酵母混合发酵组中醛类化合物含量降低归因于异丁醛含量的减少,与SC组相比,TD+SC组、IO+SC组和SP+SC组中异丁醛含量分别减少了33.94%、49.84%和70.14%,与接种非酿酒酵母混合发酵中异丁酸含量增加相一致。SP+SC组酮类化合物含量最高,可达757.84 μg/L,显著高于其他3组(P<0.05),其主要来源于3-羟基-2-丁酮含量的增加。与SC组相比,SP+SC组3-羟基-2-丁酮含量提高1.9倍。此外,SC组、TD+SC组、IO+SC组和SP+SC组中其他类化合物含量分别为379.93 μg/L、338.73 μg/L、359.39 μg/L和343.43 μg/L,各组之间无显著差异(P>0.05)。
2.4 薏米酒醪挥发性风味物质的线性判别分析
利用线性判别分析鉴定不同发酵工艺制备薏米酒醪的标志性挥发性风味化合物,结果见图2。由图2可知,SC组标志性挥发性风味化合物主要为正戊醇、2,3-丁二醇、苯乙醇、异戊醇、癸醛、异丁醛、乙酸等,这些挥发性风味化合物在SC组的含量显著高于其他3组(P<0.05)。德尔布有孢圆酵母的参与增加了正癸醇、2-甲基丁醇、丁二酸二乙酯、己酸乙酯、辛酸乙酯、乙酸异戊酯、苯甲醛和壬酸等挥发性风味物质的含量。东方伊萨酵母的加入会引起异戊酸和乙酯类化合物(如苯甲酸乙酯、苯乙酸乙酯、癸酸乙酯、乳酸乙酯、乙酸苯乙酯、乙酸乙酯、异丁酸乙酯)的含量增加,有利于增强薏米酒醪的花果香。而接种粟酒裂殖酵母混合发酵则有利于乙酸异丁酯、丁酸乙酯、苯乙醛、壬醛、异丁酸、2-戊酮和3-羟基-2-丁酮等挥发性风味物质含量的增加,其中苯乙醛和3-羟基-2-丁酮有助于薏米酒醪产生花果香和奶香气息[25]。

图2 薏米酒醪中挥发性风味物质的热图分析及生物标志物鉴定
Fig.2 Heatmap analysis and biomarker identification of volatile flavor substances in coix seed wine mash
2.5 薏米酒醪中香气化合物的分析
挥发性风味物质的重要性在很大程度上取决于其香气活性值,通常香气活性值>1的化合物被认为对薏米酒醪的香气有直接贡献[26]。所有发酵组别中香气活性值>1挥发性风味化合物含量分析见图3。
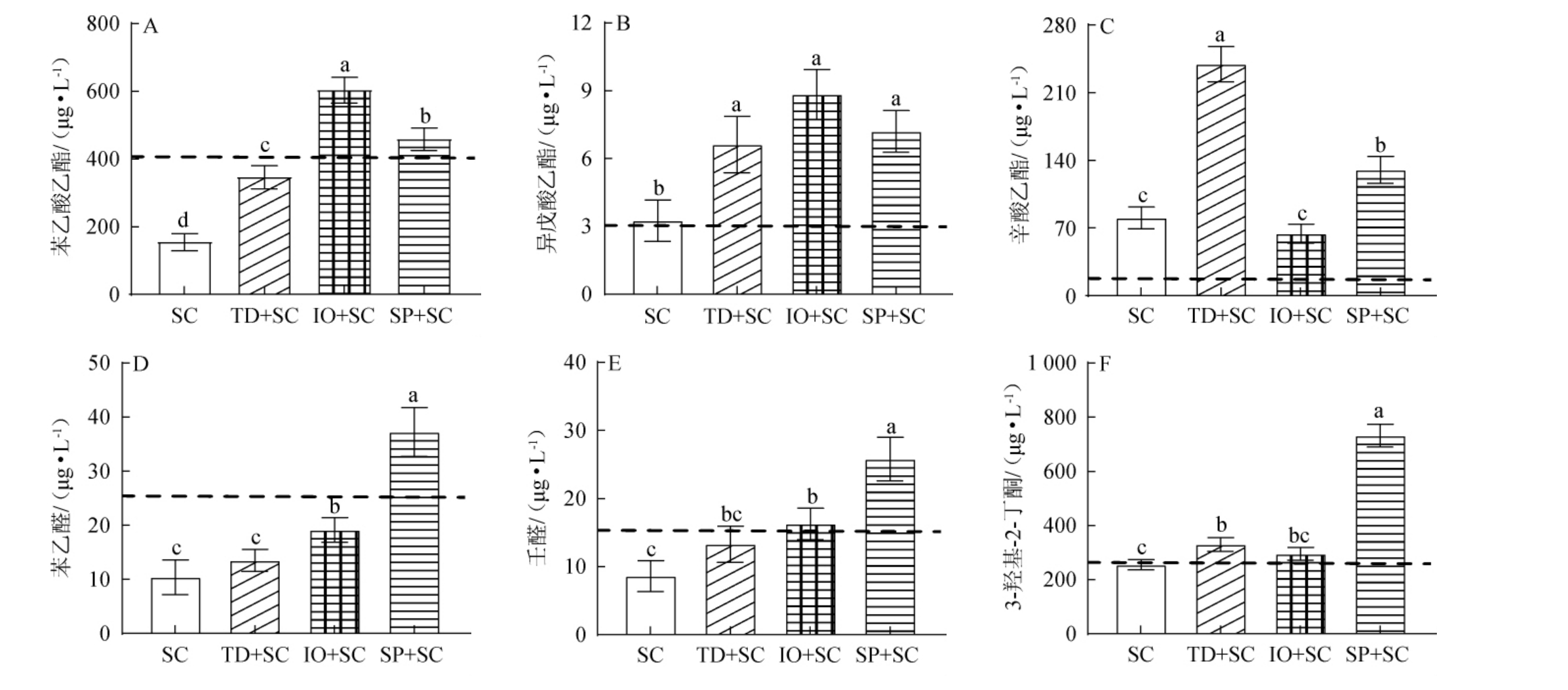
图3 薏米酒醪中挥发性风味化合物的分析
Fig.3 Analysis of volatile flavor substances in coix seed wine mash
虚线表示该挥发性风味化合物的阈值。
由图3A~C可知,苯乙酸乙酯、异戊酸乙酯和辛酸乙酯主要为薏米酒醪提供水果香和蜂蜜香。SC组和TD+SC组中苯乙酸乙酯含量分别为154.03 μg/L和346.60 μg/L,低于其香气阈值,而IO+SC组和SP+SC组中苯乙酸乙酯含量均高于其香气阈值。TD+SC组、IO+SC组和SP+SC组中异戊酸乙酯含量分别为6.62 μg/L、8.84 μg/L和7.20 μg/L,均显著高于SC组(3.25 μg/L)(P<0.05)。苯乙酸乙酯和辛酸乙酯分别被鉴定为IO+SC组和TD+SC组的标志性挥发性风味化合物。其中,TD+SC组中辛酸乙酯含量均优于其他3组。
由图3D~3F可知,苯乙醛和壬醛可赋予薏米酒醪提供玫瑰香和花果香,仅有SP+SC组的苯乙醛含量高于其香气阈值,可达37.29 μg/L,显著高于其他3组(P<0.05),而其他三组苯乙醛含量低于其香气阈值,表明仅在SP+SC组具有苯乙醛的特殊香气。IO+SC组和SP+SC组中壬醛含量高于其香气阈值,其含量分别为16.27 μg/L和25.80 μg/L,而SC组和TD+SC组中壬醛含量则低于其香气阈值。苯乙醛和壬醛被鉴定为SP+SC组的标志性挥发性化合物,突出了粟酒裂殖酵母与商业酿酒酵母混合发酵对薏米酒醪玫瑰香和花果香的增效性。C组3-羟基-2-丁酮含量仅为254.81 μg/L,低于其香气阈值,显著低于其他3组(P<0.05)。TD+SC组、IO+SC组和SP+SC组中3-羟基-2-丁酮含量均高于其香气阈值,表明接种非酿酒酵母混合发酵有利于3-羟基-2-丁酮的积累,增加薏米酒醪的奶香气息。综上,接种非酿酒酵母混合发酵不仅可以提高薏米酒醪中总挥发性风味物质含量,还能增加6种薏米酒醪香气化合物含量,提升酒醪的花果香、蜂蜜香、玫瑰香及奶香气息。
3 结论
本研究探究了非酿酒酵母和商业酿酒酵母混合发酵对薏米酒醪基础理化特性、色泽和挥发性风味物质的影响。与纯商业酿酒酵母相比,混合发酵会降低薏米酒的pH值,使酒精度和还原糖含量分别降低0.98%vol~1.93%vol和6.09%~15.32%,混合发酵可增加酒醪的亮度。混合发酵可以增加挥发性风味化合物的种类,可以使挥发性酯类化合物提高1.4~3.4倍,尤其是乙酯类化合物。此外,与纯商业酿酒酵母相比,粟酒裂殖酵母与商业酿酒酵母混合发酵可显著增加苯乙醛、壬醛和3-羟基-2-丁酮的含量,提高薏米酒醪的果香和奶香气息。正戊醇、2,3-丁二醇,苯乙醇等物质是商业酿酒酵母发酵薏米酒醪的标志性挥发性风味化合物,而正癸醇、2-甲基丁醇、丁二酸二乙酯等物质、异戊酸、苯甲酸乙酯、苯乙酸乙酯等物质,乙酸异丁酯、丁酸乙酯、苯乙醛等物质分别是德尔布有孢圆酵母、东方伊萨酵母、粟酒裂殖酵母与商业酿酒酵母混合发酵薏米酒醪的标志性挥发性风味化合物。以上结果表明,非酿酒酵母和商业酿酒酵母混合发酵有助于提高薏米酒醪的色泽及风味品质,有利于精准调控薏米酒醪的风味。
[1]宋运霞.接种方式对薏米酒醪品质的影响[J].食品科技,2022,47(12):97-103.
[2]李静.植物乳杆菌混菌发酵对薏米酒醪品质的影响[J].中国食品添加剂,2022,33(5):88-94.
[3]李欢欢,肖志刚.薏米营养及活性成分研究现状[J].农产品加工,2018(20):54-56.
[4]李永富,张晶晶,史锋,等.薏仁米贮藏过程中油脂氧化规律及原因探究[J].中国粮油学报,2020,35(10):48-55.
[5]李静.非酿酒酵母发酵薏米酒醪的特性研究[J].中国食品添加剂,2022,33(6):45-52.
[6]肖琳,付月,王美婷,等.薏米醪糟发酵过程中代谢产物的分析[J].中国食品学报,2021,21(10):233-239.
[7]许强,杨素红,谭溪莉,等.混菌发酵桑葚酒工艺优化及挥发性成分分析[J].中国酿造,2022,41(5):60-66.
[8] TUFARIELLO M, FRAGASSO M, PICO J, et al.Influence of non-Saccharomyces on wine chemistry:A focus on aroma-related compounds[J].Molecules,2021,26(3):644-651.
[9]LIU S,LAAKSONEN O,LI P,et al.Use of non-Saccharomyces yeasts in berry wine production:Inspiration from their applications in winemaking[J].J Agr Food Chem,2022,70(3):736-750.
[10] WANG Y,QI X Y,FU Y, et al.Effects of Torulaspora delbrueckii cofermented with Saccharomyces cerevisiae on physicochemical and aromatic profiles of blueberry fermented beverage[J].Food Chem,2023,409:135284.
[11]LI J,HONG M,QI B.Impact of Torulaspora delbrueckii during fermentation on aromatic profile of vidal blanc icewine[J].Front Microbiol,2022,13:860128.
[12] QIU S, CHEN K, LIU C, et al.Non-Saccharomyces yeasts highly contribute to characterisation of flavour profiles in greengage fermentation[J].Food Res Int,2022,157:111391.
[13]王玉荣,张俊英,潘婷,等.籼米米酒和糯米米酒品质的评价[J].食品与发酵工业,2017,43(1):186-191.
[14]桂江平,于化泓,余勃,等.基于GC-MS江西米酒风味物质的分析及品质比较[J].中国酿造,2023,42(1):231-237.
[15]龚文玲,传均强,徐洪磊,等.商业酿酒酵母发酵百香果果酒的品质及抗氧化性分析[J].中国酿造,2023,42(3):135-139.
[16]MUNÑOZ-REDONDO J M,PUERTAS B,CANTOS-VILLAR E,et al.Impact of sequential inoculation with the non-Saccharomyces T. delbrueckii and M. pulcherrima combined with Saccharomyces cerevisiae strains on chemicals and sensory profile of rosé wines[J].J Agr Food Chem,2021,69(5):1598-1609.
[17]LIU S X,LAAKSONEN O,KORTESNIEMI M,et al.Chemical composition of bilberry wine fermented with non-Saccharomyces yeasts(Torulaspora delbrueckii and Schizosaccharomyces pombe) and Saccharomyces cerevisiae in pure,sequential and mixed fermentations[J].Food Chem,2018,266:262-274.
[18]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[19]王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J].食品科学,2022,43(14):264-271.
[20] ZHANG B Q,TANG C,YANG D Q,et al.Effects of three indigenous non-Saccharomyces yeasts and their pairwise combinations in co-fermentation with Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines[J].Food Chem,2022,368:130807.
[21]ZHANG B Q,LUAN Y,DUAN C Q,et al.Use of Torulaspora delbrueckii co-fermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J].Front Microbiol,2018,9:606.
[22] TONDINI F, LANG T, CHEN L, et al.Linking gene expression and oenological traits: Comparison between Torulaspora delbrueckii and Saccharomyces cerevisiae strains[J].Int J Food Microbiol,2019,294:42-49.
[23]RENAULT P,COULON J,DE REVEL G,et al.Increase of fruity aroma during mixed T.delbrueckii/S.cerevisiae wine fermentation is linked to specific esters enhancement[J].Int J Food Microbiol,2015,207:40-48.
[24]WANG N,ZHU Y,ZHU R,et al.Revealing the co-fermentation of Saccharomyces cerevisiae and Schizosaccharomyces pombe on the quality of cider based on the metabolomic and transcriptomic analysis[J].LWTFood Sci Technol,2022,168:113943.
[25]袁国亿,何宇淋,王春晓,等.米酒风味品质形成相关因素的研究进展[J].食品与发酵工业,2022,48(9):286-294.
[26]陈乐乐,史海波,申芳嫡,等.基于分子感官和稳定性评价戊糖乳杆菌AB-8对薏仁米的发酵过程[J].食品与发酵工业,2022,48(17):136-142.