中国白酒是多元、多微、固态发酵产品,幽雅的香气成分、舒适的风味成分、有益健康的活性成分是中国白酒的精华[1-3]。其中浓香型白酒销量最高,占中国白酒消费总量的70%以上[4],因入口甜、落口绵、绵柔甘洌、窖香浓郁、香味协调、尾净余长等特点而广受消费者的喜爱[5-6]。浓香型白酒酿造主要采用中高温大曲,大曲依靠自然界带入的各种微生物在曲坯上富集生长,以获得各种有益于发酵和酿酒的微生物[7-8],主要起着糖化发酵、提供菌源、投粮以及生香的作用,是影响白酒产量、品质、香型与风格的重要因素,也是目前酿酒品控的核心指标之一[9-10]。
中高温大曲发酵前期利用微生物繁殖活动自然升温,在发酵过程中霉菌、酵母菌和细菌等大量繁殖[11-13]。其中霉菌尤以根霉菌(Rhizopus)生长最为明显,根霉菌是接合菌亚门、接合菌纲、毛霉目、毛霉科真菌中的一个大属,以孢囊孢子和接合孢子繁殖。根霉菌落疏松或稠密,最初呈白色,后变为灰褐色或黑褐色[14]。根霉在土壤、粪便、稻草及空气等环境中广泛存在,特别是在高温、高湿度以及通风不良的条件下生长良好。主要着生于大曲发酵培养的前期(低温高湿环境下),两曲坯间相靠更易生长,少量的根霉可能对大曲的综合能力有益,但数量过多时会对大曲的外观和色泽等感官品质产生影响[15-17]。冬春季是中高温大曲一次翻曲前发酵过程中曲坯表面霉菌数量骤增且转黑的高发季节。霉菌数量骤增和转黑等特点与当地气候环境、制曲工艺参数设置等多种因素有关。因此,探究有效的大曲表面霉菌控制技术至关重要。
目前对大曲质量的判断主要依赖于长期积累的生产经验和部分理化性质,这使得大曲的生产质量充满不稳定性[18]。鉴于霉菌控制对于中高温大曲的重要性,本研究在原有制曲工艺的基础上,对大曲生产过程中关键控制点进行合理调整,还从曲坯表面取样分离鉴定出霉菌菌株,同时探讨了安曲间距、覆盖物、一次翻曲时间以及霉菌擦拭等对曲坯表面霉菌生长情况以及感官和理化指标等的影响,探索冬春季中高温大曲表面霉菌生长的控制方法,旨在为今后中高温大曲制曲工艺定型提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料本试验所使用中高温大曲样品、稻草、糠壳及麻片均由四川郎酒股份有限公司制曲技术中心提供。
1.1.2 主要试剂
真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:广东环凯微生物科技有限公司;氯化钠(分析纯):成都金山化学试剂有限公司。
1.1.3 培养基
虎红培养基、霉菌液体培养基、乳酸酚棉蓝染色液:青岛海博生物公司。
1.2 仪器与设备
XH-B涡旋混合仪:无锡德普仪器制造有限公司;ME104TE分析天平:梅特勒(中国)有限公司;TGC-16C台式离心机:上海精密科学仪器有限公司;LRH-250恒温恒湿培养箱:上海一恒科学仪器有限公司;Milli-Q Reference超纯水系统:美国Millipore公司。
1.3 方法
1.3.1 中高温大曲表面霉菌的分离纯化[19]
使用无菌棉签蘸取大曲表面异常霉菌于生理盐水(10 mL)中,在涡旋混合仪中振荡均匀后逐步稀释至10-6,然后分别从不同稀释梯度菌悬液中吸取100 μL,均匀涂布于虎红固体平板上,置于30 ℃恒温恒湿培养箱中静置培养24~48 h。待霉菌长成后,挑取菌落进一步分离纯化,直至分离得到单菌落。
1.3.2 霉菌菌株形态学鉴定
参照《真菌鉴定手册》[20]对分离纯化得到的霉菌菌株进行形态学鉴定。
1.3.3 霉菌菌株分子生物学鉴定
霉菌菌株的分子生物学鉴定试验参照吴锦兰等[21]的方法。
1.3.4 制曲工艺流程及操作要点
小麦→润麦→粉碎→拌料→机制成曲→入房安曲→翻曲(保温培菌)→半成品→贮存
结合先前制曲生产经验,对中高温大曲生产过程中关键控制点工艺参数进行合理调整,主要操作要点如下:
润麦:用水量按粮水比100∶(3~5)计,水温为80 ℃左右,时长控制在3~4 h内。
粉碎:未通过20目筛的麸皮占30%~40%。
拌料:加水拌和后的麦粉含水量为36%~38%。
安曲:安曲采用一顺风方式排列,安曲结束后晾曲时间为0.5~1.5 h,使用稻草或麻片等进行完全覆盖保温。
翻曲(保温培菌):曲坯发酵期间进行三次翻曲。安曲后3~7 d,品温升至45~58 ℃,进行第一次翻曲,根据硬度翻为1~3层,底层按横三竖三方式排列,2~3层按横二竖二方式排列;第一次翻曲结束后2~4 d进行二次翻曲,操作同一次翻曲;第二次翻曲结束后3~7 d进行三次翻曲,根据品温翻为6~8层,各层均横三竖三方式排列。使用稻草或麻片进行完全覆盖保温。
发酵:根据仓内升温、湿度情况进行保温排潮,整个曲坯仓内发酵周期控制在20~25 d。
贮存:曲坯发酵结束后转运至成品仓贮存,贮存品温控制为30 ℃以内,贮存时间为≥4月。
1.3.5 不同控霉措施对曲坯品质的影响
不同安曲间距对曲坯表面霉菌生长影响:曲坯制备完成后入室,安曲间距分别控制为1.0~1.5 cm、1.5~2.0 cm和2.0~2.5 cm,观察后期大曲表面霉菌生长情况。
不同覆盖物对曲坯表面霉菌生长影响:进行安曲工作时,根据提前设置试验点,选择不同覆盖物对曲坯进行全覆盖(方案一:使用厚度为12~15 cm稻草对曲坯进行全覆盖;方案二:使用厚度为3~4 cm麻片对曲坯进行全覆盖;方案三:先使用厚度6~8 cm稻草对曲坯进行全覆盖,再使用厚度为2~3 cm麻片对曲坯进行二次全覆盖),探索不同覆盖物对大曲表面霉菌生长影响。
不同一次翻曲时间对曲坯表面霉菌生长影响:曲坯安曲工作结束后进行保温培菌,分别设置一次翻曲时间为3 d、4 d和5 d,研究不同一次翻曲时间对大曲表面霉菌生长影响。
1.3.6 霉菌擦拭控制情况
曲坯入仓后,保持安曲间距为2.0~2.5 cm、选择厚度为12~15 cm稻草作为覆盖物、调整一次翻曲时间为安曲后第3天,在一次翻曲时,各选取12块曲坯进行试验,翻曲时未进行霉菌擦拭的6块为常规样,进行霉菌擦拭的其余6块为试验样(霉菌擦拭方法:将干燥无霉变草秆挽成草把,用草把擦拭曲坯表面霉菌,直至肉眼观察不可见),统一堆置,并作好标记,观察霉菌擦拭对后期曲坯感官品质及理化指标的影响。
1.3.7 试验曲坯感官评定及理化指标测定
参照炊伟强等[22]的方法,组织3名制曲技术人员作为感官评定小组,对试验曲坯断面和香气情况进行分析,并记录感官评定结果。参照文献[23]中的方法对试验曲坯水分、酸度、糖化力、液化力、发酵力及酯化力等指标进行测定。
1.3.8 数据处理与分析
资料录入、整理和分析釆用EXCEL 2019和MEGA 7.0,统计学处理采用SPSS 26.0,使用ORIGIN 2019软件绘图。
2 结果与分析
2.1 霉菌分离鉴定结果
2.1.1 菌株的分离
使用无菌棉签蘸取曲坯表面异常霉菌于生理盐水(10 mL)中,在涡旋混合仪中振荡均匀后逐步稀释至10-6,然后吸取100 μL菌悬液均匀涂布于虎红固体平板上,置于30℃恒温恒湿培养箱培养24~48h后,平板上长出白色霉菌。采用点种法对其分离纯化3次直至得到单菌落,命名为L1。
2.1.2 菌株的鉴定
(1)形态观察
菌株L1的菌落及菌丝结构见图1。由图1(A)可知,菌落在固体平板上初期呈现白色,后期变成灰褐色,孢囊老熟后为黑色,呈棉絮状蔓延至整个平板,由图1(B)可知,其孢子囊球形或近球形,孢囊孢子球形或近球形,孢囊梗有分枝,无假根或假根不发达,囊轴、囊托呈倒梨形。结合菌落形态特征和镜检结果,初步判定分离出的霉菌菌株为根霉(Rhizopus)。
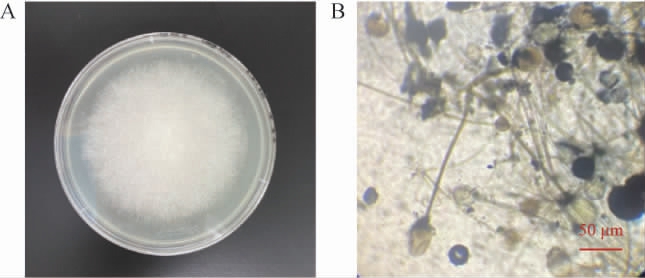
图1 菌株L1的菌落(A)及菌丝(B)形态
Fig.1 Colony (A) and mycelial (B) morphology of strain L1
(2)分子生物学鉴定
经聚合酶链式反应(polymerase chain reaction,PCR),对扩增得到的ITS rDNA序列进行测序,并将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析。结果发现,菌株L1与Rhizopusarrhizus112.07(GenBank登录号:NR_103595.1)ITS rDNA具有最高的序列同源性。利用MEGA 7.0[24-25]生物学软件分析菌株L1相关菌株的ITS rDNA基因,并构建系统发育树,结果见图2。由图2可知,菌株L1与Rhizopus arrhizus同属一个分支,综合菌落形态、细胞形态和分子生物学结果,鉴定菌株L1为少根根霉(Rhizopus arrhizus)。
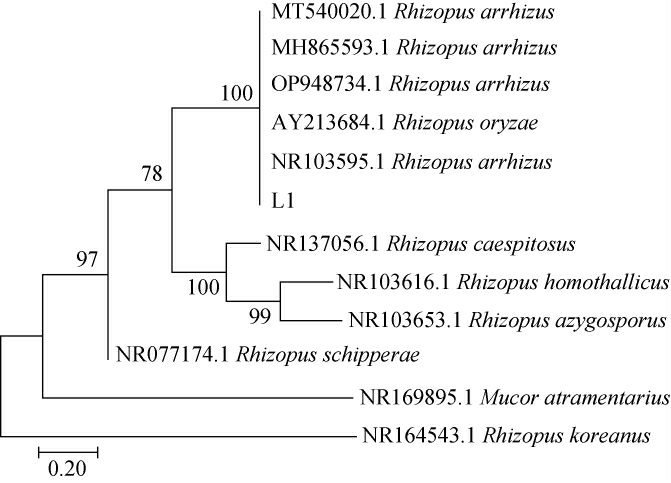
图2 基于ITS rDNA基因序列菌株L1的系统发育树
Fig.2 Phylogenetic tree of strain L1 based on ITS rDNA gene sequence
2.2 不同安曲间距对曲坯表面霉菌生长的影响
不同安曲间距对曲坯表面霉菌生长的影响见表1。由表1可知,安曲间距对曲坯表面霉菌生长影响较大,各试验组在一定时间内霉菌长度和颜色均不相一致,安曲间距1.0~1.5 cm时,安曲24 h就有90%的曲坯表面长出白色霉菌,随着安曲间距的逐渐增大,曲坯表面霉菌生长速度逐渐减缓,颜色由白色变为灰褐色再转换为黑褐色的时间逐渐延长;安曲间距为2.0~2.5 cm时,安曲后36~48 h,只有50%曲坯表面长出白色霉菌。这可能是安曲间距的增大使得曲坯间排潮效果更好,避免高湿度条件,从而能在一定程度上减缓微生物霉菌的生长。但安曲间距并不是越大越好,否则会导致曲坯间微生物转移困难,无法达到良好的走水效果(未走水曲坯皮张厚、封火圈明显)。因此,合理控制安曲间距对曲坯质量提升非常重要,以安曲间距为2.0~2.5 cm时对曲坯表面霉菌控制效果最好。
表1 不同安曲间距对曲坯表面霉菌生长的影响
Table 1 Effects of different Anqu spacing on the growth of molds on the surface of Daqu

安曲间距/cm 霉菌生长情况(白色—灰褐色—黑褐色)1.0~1.5 安曲后24 h时,90%曲坯表面长出白色霉菌,长度约为3 mm;24~72 h内,长度快速变长,颜色由白色快速转换为灰褐色再迅速转换为黑褐色;96 h时,霉菌长度达到最大值(约为10 mm),颜色全部转换为黑褐色。
续表

安曲间距/cm 霉菌生长情况(白色—灰褐色—黑褐色)1.5~2.0 2.0~2.5安曲后24~48 h,70%曲坯表面长出白色霉菌,长度约为2.5 mm;48~72 h内,长度逐渐变长,颜色由白色较快转换为灰褐色再逐渐转换为黑褐色;120 h时,霉菌长度达到最大值(约为8 mm),颜色全部转换为黑褐色。安曲后36~48 h,50%曲坯表面长出白色霉菌,长度约为2 mm;48~96 h内,长度缓慢变长,颜色由白色缓慢转换为灰褐色再逐渐转换为黑褐色;120 h时,霉菌长度达到最大值(约为6 mm),颜色全部转换为黑褐色。
2.3 不同覆盖物对曲坯表面霉菌生长影响
不同覆盖物对曲坯表面霉菌生长的影响见表2。由表2可知,覆盖物对曲坯表面霉菌生长影响较大,各试验组在一定时间内霉菌长度和颜色均不相同,霉菌长度和颜色转变速度由快到慢依次为:麻片、稻草、稻草+麻片。稻草富集了制曲过程的丰富的微生物、酶和香味物质[26],其良好骨力和透气性不仅可以起到保温排潮作用,还可以增加曲房环境微生物群落多样性[27],其对于大曲保温培菌来说是极为关键的。而麻片相较于稻草来说具有更好保温效果,但其透气性较差、排潮效果不好,对曲坯表面霉菌生长有益但对曲坯品质来说是不利的。稻草+麻片保温效果良好,但在稻草上层覆盖的麻片易聚集曲房内水汽,导致曲坯水分不易挥发。结合三种不同覆盖物对曲坯表面霉菌生长情况影响结果来看,说明稻草作为覆盖物对于大曲品质调控是非常必要的,以厚度为12~15 cm稻草作为覆盖物对于曲坯表面霉菌生长控制效果最好。
表2 不同覆盖物对曲坯表面霉菌生长的影响
Table 2 Effects of different mulch on the growth of molds on the surface of Daqu

覆盖物 霉菌生长情况(白色—灰褐色—黑褐色)稻草(方案一)麻片(方案二)稻草+麻片(方案三)安曲后36~48 h,50%曲坯表面长出白色霉菌,长度约为2 mm;48~96 h内,长度缓慢变长,颜色由白色缓慢转换为灰褐色再逐渐转换为黑褐色;120 h时,霉菌长度达到最大值(约为6 mm),颜色全部转换为黑褐色。安曲后24 h时,90%曲坯表面长出白色霉菌,长度约为3 mm;24~72 h内,长度快速变长,颜色由白色快速转换为灰褐色再迅速转换为黑褐色;96 h时,霉菌长度达到最大值(约为10 mm),颜色全部转换为黑褐色。安曲后24~48 h,70%曲坯表面长出白色霉菌,长度约为2.5 mm;48~72 h内,长度逐渐变长,颜色由白色较快转换为灰褐色再转换为黑褐色;120 h时,霉菌长度达到最大值(约为8 mm),颜色全部转换为黑褐色。
2.4 不同一次翻曲时间对曲坯表面霉菌生长影响
不同一次翻曲时间(3 d、4 d、5 d)对曲坯表面霉菌生长的影响结果见表3。由表3可知,安曲后3 d进行一次翻曲时,霉菌生长受到抑制,曲坯表面色泽未受到影响;4 d进行一次翻曲时,霉菌生长不明显,曲坯表面色泽已受到影响;5 d进行一次翻曲时,霉菌缓慢生长,曲坯表面色泽已明显变劣。长期以来,中高温大曲一次翻曲时间大多依据“曲坯发酵有硬度、表面有菌丝,有明显米酒味”的感官标准进行一次翻曲,鲜少以微生物生长状态来作为一次翻曲时间的判定依据。本试验结果表明,一次翻曲时间控制为安曲后3 d时,曲坯表面霉菌生长得到有效控制,可能与及时的一次翻曲达到良好排潮作用,避免霉菌成为曲坯表面的优势菌群,使得其他有益微生物能够正常生长繁殖有关[28]。
表3 不同一次翻曲时间对曲坯表面霉菌生长的影响
Table 3 Effects of different first Fanqu time on the growth of molds on the surface of Daqu

一次翻曲时间/d 霉菌生长情况3 4 5翻曲时50%曲坯表面长出白色霉菌,翻曲后霉菌生长受到抑制,曲坯表面色泽未受到影响翻曲时70%曲坯表面长出灰褐色霉菌,翻曲后霉菌生长不明显,曲坯表面色泽已受到影响翻曲时90%曲坯表面长出黑褐色霉菌,翻曲后霉菌缓慢生长,曲坯表面色泽已明显变劣
2.5 霉菌擦拭对曲坯后期感官品质和理化指标的影响
霉菌擦拭对曲坯后期(半成品曲)感官品质影响结果见表4。由表4可知,霉菌擦拭对曲坯气味和色泽影响不明显,试验样(擦拭霉菌)菌丝比常规样(未擦拭霉菌)更为明显和饱满,且曲心不存在少量窝水现象,但两组均存在皮张厚、封火圈明显的现象。说明霉菌擦拭后能为曲坯菌丝生长营造更适宜的环境,增加曲坯透气性,促进曲心水分挥发,使得曲坯不存在窝水现象。
表4 霉菌擦拭对半成品曲感官品质影响
Table 4 Effect of molds wiping on the sensory quality of semi-finished koji

样品 断面 气味试验样常规样断面色泽一致,菌丝明显,曲心干燥,皮张厚,封火圈明显断面色泽一致,菌丝较明显,曲心有少量水分,皮张厚,封火圈明显曲香浓郁,有少量焦香,无异味曲香浓郁,有少量焦香,无异味
霉菌擦拭对曲坯后期(半成品曲)理化指标影响结果见表5。由表5可知,试验样水分含量(13.9%)低于常规样(14.0%),试验样糖化力和酯化力均高于常规样,这可能与霉菌擦拭后可为曲坯中产酶微生物生长繁殖提供适宜条件有关。霉菌擦拭方法虽然能在一定程度上减轻已生成霉菌对曲坯表面色泽的影响,但要从根本上解决霉菌成为曲坯表面优势菌群,还是要结合霉菌生理生长特性来合理调控。
表5 霉菌擦拭对半成品曲理化指标影响
Table 5 Effect of molds wiping on the physicochemical indexes of semi-finished koji

样品 水分/%发酵力/[g·(g·72 h)-1]试验样常规样酸度/(mmol·10 g-1)糖化力/[mg·(g·h)-1]酯化力/[mg·(25 g·7 d)-1]13.9 14.0 1.3 1.2 783.3 741.3 643.0 637.7 0.2 0.3
3 结论
长期以来,中高温大曲生产都是开放式作业,且工艺操作步骤较多,只有将生产过程中的关键控制点及参数设置调控好,做好保温排潮,才能避免曲坯中不良微生物成为优势菌群,为制曲过程中的有益微生物生长繁殖营造适宜环境,最终制得优质大曲。本研究在冬春季适时采取控霉措施,在原有制曲工艺的基础上,控制安曲间距为2.0~2.5 cm、选择厚度为12~15 cm稻草作为覆盖物、调整一次翻曲时间为安曲后第3天、一次翻曲时增加霉菌擦拭操作,能有效控制曲坯表面霉菌生长,保证曲坯有益微生物正常生长,也在一定程度上提高糖化力和酯化力指标,对曲坯质量提升具有良好效果。同时,在条件允许的情况下,在冬季中高温大曲生产中可以考虑增设辅助升温系统来保障仓内曲坯的正常升温。
[1]张亮,王志强,汤承友,等.汤沟中高温大曲制曲工艺控制探析[J].酿酒,2022,49(6):31-33.
[2]WANG G,JING S,WANG X,et al.Evaluation of the perceptual interaction among ester odorants and nonvolatile organic acids in Baijiu by GC-MS,GC-O,odor threshold,and sensory analysis[J].J Agric Food Chem,2022,70(43):13987-13995.
[3]CHENG P,FAN W,XU Y.Determination of Chinese liquors from different geographic origins by combination of mass spectrometry and chemometric technique[J].Food Control,2014,35(1):153-158.
[4]FAN W,QIAN M C.Identification of aroma compounds in Chinese'Yanghe Daqu'liquor by normal phase chromatography fractionation followed by gas chromatography[sol]olfactometry[J].Flavour Frag J,2006,21(2):333-342.
[5] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[6] QIAN Y, ZHANG L, SUN Y, et al.Differentiation and classification of Chinese Luzhou-flavor liquors with different geographical origins based on fingerprint and chemometric analysis[J].J Food Sci,2021,86(5):1861-1877.
[7]WU Q,CHEN L,XU Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2013,166(2):323-330.
[8]XU M L,YU Y,RAMASWAMY H S,et al.Characterization of Chinese liquor aroma components during aging process and liquor age discrimination using gas chromatography combined with multivariable statistics[J].Sci Rep,2017,7(1):39671.
[9]刘慧,涂璇,吕育财,等.中高温大曲在制曲过程中微生物区系演替特征及功能研究[J].食品与发酵工业,2022,48(22):180-186.
[10] ZHENG X W, TABRIZI M R, NOUT M J R, et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[11]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[12]PAN Q,HUANG J,ZHANG S,et al.Response of microbiota to exogenous inoculation improved the enzymatic activities of medium-temperature Daqu[J].Front Microbiol,2022,13:1047041.
[13]WANG C,SHI D,GONG G.Microorganisms in Daqu:a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008,24:2183-2190.
[14] GHOSH B, RAY R R.Current commercial perspective of Rhizopus oryzae:a review[J].J Appl Sci,2011,11(14):2470-2486.
[15]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:26-32.
[16]姚灵丹,鞠笑,TIMOTHY Y J,等.少根根霉多样化的生长动力学模型[J].微生物学通报,2019,46(1):42-53.
[17]DAS R K,BRAR S K.Enhanced fumaric acid production from brewery wastewater and insight into the morphology of Rhizopus oryzae 1526[J].Appl Biochem Biotech,2014,172(6):2974-2988.
[18]FAN G,FU Z,TENG C,et al.Effects of aging on the quality of roasted sesame-like flavor Daqu[J].BMC Microbiol,2020,20(1):1-16.
[19]贺德贵,邢利民,盛明健,等.浙江玫瑰醋异常发酵微生物的鉴定及控制途径探索[J].中国酿造,2021,40(11):43-48.
[20]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:497-501.
[21]吴锦兰,李静怡,白云,等.袋装酸笋中优势腐败霉菌的分离与鉴定[J].农产品加工,2023,572(6):70-72,76.
[22]炊伟强.大曲传统感官评价与其内在质量、理化指标的关系[D].无锡:江南大学,2010.
[23]中华人民共和国工业和信息化部.QB/T4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
[24]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究[J].中国酿造,2023,42(9):79-84.
[25] TAMURA K, STECHER G, KUMAR S.MEGA11: molecular evolutionary genetics analysis version 11[J].Mol Biol Evol,2021,38(7):3022-3027.
[26]张原頔,沈毅,程伟,等.三代全长高通量测序分析新稻草和陈稻草的微生物特征[J].中国酿造,2022,41(9):24-30.
[27]王西,陈波,张亚东,等.高温大曲安曲投入老草的应用研究[J].酿酒科技,2020(12):88-91.
[28]齐欢,黄婷,白莉圆,等.翻曲次数对西凤酒大曲质量影响的研究[J].酿酒,2021,48(5):35-40.