乙偶姻(acetoin,ACT)学名3-羟基-2-丁酮,是一种具有特殊奶油香味的挥发性化合物,可使白酒酒体丰满、后味圆润[1]。乙偶姻可和主要由氨基酸转化而来的氨经过非酶促反应生成白酒中重要风味物质四甲基吡嗪,对酱香型白酒意义重大[2]。在高温大曲的制备过程中,芽孢杆菌具有利用芽孢应对胁迫环境的特性,成为高温条件下的优势细菌之一,能够代谢产生乙偶姻、吡嗪等风味物质和淀粉酶、蛋白酶等多种酶类,对大曲及白酒酿造过程中的各种生化反应具有推动作用[3-4]。
近年来乙偶姻的微生物合成法受到越来越多的关注,产乙偶姻菌株的选育及其相关代谢的研究也较多[5]。康雪梅等[6]选育获得了一株高产乙偶姻的中村芽孢杆菌(Bacillus nakamurai)k11,其在pH 3.0的酸性条件下能生长且能保存80%以上的酶活。FAN Y X等[7]从日本传统食品纳豆中分离出一株产乙偶姻的芽孢杆菌(Bacillus)SF4-3,发酵培养后乙偶姻产量可达到33.9 g/L。黄实宽等[8]以小麦粉为基质,采用枯草芽孢杆菌分别与酿酒酵母等几种酵母菌共发酵检测分析其代谢特征。XU B Y等[9]在大曲中接种芽孢杆菌,发现22个微生物属的相对丰度发生了显著的变化,促进了大曲的糖化、发酵和风味生产。目前,对芽孢杆菌在产乙偶姻能力和相关微生物菌群方面研究较多,对产乙偶姻菌株对固态混菌发酵产物影响的研究较少。
本研究采用肌酸比色法从酱香型大曲中筛选分离产乙偶姻菌株,结合形态学观察及分子生物学技术对其进行鉴定,并将其应用于固态混菌发酵,考察其对发酵产物理化指标、有机酸及挥发性风味物质的影响。旨在将筛选产乙偶姻菌株应用于白酒生产,以期提高白酒中吡嗪类物质,尤其是重要功能物质四甲基吡嗪(tetramethylpyrazine,TTMP)的含量,从而提高白酒的功能保健作用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大曲样品、酱香型曲母:四川某酱香酒厂。
1.1.2 试剂
肌酸一水、1-萘酚(均为分析纯):上海生工生物工程股份有限公司;乙酸正戊酯、亚甲基蓝(均为分析纯):成都市科隆化学品有限公司;有机酸标准品(纯度均≥98%):成都德思特生物技术有限公司;植物脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京擎科生物科技股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
营养肉汤(nutrient broth,NB)培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基、溶菌肉汤(lysozyme broth,LB)培养基:青岛日水生物技术有限公司。
固体发酵培养基[10]:取小麦720 g(干质量),加入8%水拌匀润粮3 h,再用粉碎机粉碎为粗粒及麦皮和细粉(粗粒及麦皮不可通过20目筛,细粉要求通过20目筛),以小麦粉粗细比为3∶2比例混匀,按小麦细粉量的4%添加酒厂酱香型曲母,按粗粒及麦皮量的38%添加水,混合均匀。每份瓷盘分装60 g后堆积,盖上纱布,置于培养箱中培养。
1.2 仪器与设备
LS-l201生化培养箱:美国Fisher Scientific公司;ST2100实验室pH计:奥豪斯仪器(常州)有限公司;ZWYR-D2403恒温培养振荡器:上海智城分析仪器制造有限公司;DM500光学显微镜:德国徕卡仪器有限公司;7890A/5975B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国Agilent公司;LC-2030C 3D Plus高效液相色谱(highperformance liquid chromatography,HPLC)仪:岛津企业管理(中国)有限公司。
1.3 方法
1.3.1 产乙偶姻菌株的分离纯化
将10 g酱香型大曲分别加入240 mL NB、YPD、PDB液体培养基中,于37 ℃、180 r/min 条件下振荡培养2 d。取富集液按10倍系列梯度稀释至10-6,取稀释度为10-4~10-6的菌液稀释液涂布于NB、YPD、PDB琼脂培养基上,37 ℃恒温培养1 d。挑取不同形态的菌落重复划线分离多次得到单菌株,于斜面培养基编码保藏。
1.3.2 产乙偶姻菌株的筛选
选用肌酸显色法筛选可以合成乙偶姻的菌株。将1 g 1-萘酚,0.1 g 肌酸与4 g NaOH配制成100 mL肌酸混合液,将从大曲中分离得到的菌株接种于1 mL混合液的试管中,使肌酸混合液迅速变为红色的菌株则为能产乙偶姻的菌株[11]。
1.3.3 产乙偶姻菌株的鉴定
形态学观察:将分离筛选的菌株划线于分离时对应的培养基上,观察并记录单菌落的颜色、形态、透明度、大小、表面隆起等菌落特征,采用革兰氏染色后,在显微镜下观察菌株细胞形态特征。
分子生物学鉴定:使用DNA提取试剂盒(通用型)提取菌株DNA,以提取的筛选菌株的DNA样品为模板,细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')为引物,加入一定量的1×TSE101金牌mix进行聚合酶链式反应(polymerase chain reaction,PCR)扩增16S rRNA基因序列。PCR扩增体系(50 μL):1×TSE101金牌mix 45 μL,27F(10P)2 μL,1492R(10P)2 μL,DNA模板1 μL。PCR扩增程序:98 ℃预变性3 min;98 ℃变性3 min,55 ℃退火15 s,72 ℃延伸15 s,共39次循环;72 ℃再延伸5 min。PCR扩增用琼脂糖凝胶电泳进行验证,由北京擎科生物科技股份有限公司进行序列分析。测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local comparison search tool,BLAST)同源性比对,得到相似性最高的序列,采用邻接(neighbor-joining,NJ)法构建进化树,确定其种属。
1.3.4 固态混菌发酵试验
设计固态混菌发酵试验模拟生产实践中的大曲发酵过程,模拟温度变化,构建空白组和加菌组固态混菌发酵体系,并检测大曲发酵过程中相关指标变化。在前24 h 的发酵过程中,温度保持室温25 ℃,在第24小时开始缓慢升温,每4 h温度上升2 ℃,直至第72 h发酵温度上升到50 ℃,保持该温度恒温培养至第120小时结束。以不加菌悬液的发酵醅为空白对照组,命名为M0组,以分别培养12 h、24 h、48 h 后按麦粉量的10%接种菌悬液(菌悬液的制作为将从大曲中筛选鉴定得到的菌株接至斜面,37 ℃培养48 h后,每支试管用10 mL已灭菌生理盐水洗脱。用血球计数板对菌悬液进行计数,根据计数结果适当稀释,使最终细菌的含量为106 CFU/mL的发酵醅为实验组,并分别命名为M1组、M2组、M3组。培养时间0~120 h,鉴于变温发酵节点,在0、24 h、72 h、120 h 时每组各取一次样品进行检测。
1.3.5 固态混菌发酵产物分析检测
(1)理化指标
水分含量测定:参考GB 5009.3—2016《食品中水分的测定》;还原糖含量测定:参考GB 5009.7—2016《食品中还原糖的测定》;总酸含量测定:参考GB 12456—2021《食品中总酸的测定》;pH值的测定:采用pH计法。
(2)挥发性风味物质
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)-气相色谱-质谱联用(GC-MS)法对固态混菌发酵产物中挥发性风味物质[12],略作改动。
样品前处理:称取2 g固态混菌发酵产物放入顶空萃取瓶中,吸取20 μL 1.05 g/L乙酸正戊酯作为内标物,使用保鲜膜密封瓶口处,60 ℃下预热10 min后放入顶空进样器,萃取50 min,通过顶空固相微萃取与GC-MS联用测定。
气相色谱条件:DB-1MS熔断石英毛细管色谱柱(60 mm×0.25 mm×0.25 μm);升温程序:40 ℃保持1 min,再以5 ℃/min开温至180 ℃,保持5 min,总运行时间为50 min。
质谱条件:离子源温度230 ℃,四级杆温度150 ℃,离子化方式为电子电离(electronic ionization,EI)源,电子能量70 eV,质量扫描范围为45~500 amu。
定性、定量分析:检测得到香气成分的保留时间和质谱数据,与相关文献以及美国国家标准技术研究所(national institute of standards and technology,NIST)05质谱库进行匹配定性,仅报道匹配度≥70%的化合物;采用内标法进行定量。
(3)有机酸含量
采用HPLC对混菌发酵产物中有机酸进行测定[13],略作改动。
定性、定量分析:根据标准品出峰的保留时间对发酵醅中几种有机酸进行定性分析;采用外标法定量,以标准品的质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制有机酸标准曲线,通过标准曲线回归方程计算样品中各有机酸含量。
1.3.6 数据处理及统计分析
实验数据通过Excel 2021和SPSS26.0软件进行统计分析。采用Origin 2018、R软件4.1.3、Gephi 0.9.2软件绘图,每组试验重复3次。
2 结果与分析
2.1 产乙偶姻菌株分离筛选
将大曲样品富集培养、分离纯化后,根据细菌菌落形态特征,选取不同形态的菌落,
在培养基上进行平板划线,放置于37 ℃培养箱中恒温培养至长出单菌落。挑选细菌单菌落,用接种环刮一小环菌于装有1 mL肌酸混合液的试管中,最终在马铃薯葡萄糖琼脂培养基上获得了一株能使肌酸液迅速变红的产乙偶姻菌株编号为A12F_C118。
2.2 产乙偶姻菌株A12F_C118鉴定
2.2.1 形态学观察
将筛选得到的产乙偶姻菌株A12F_C118分离纯化后,进行特征菌落形态和细胞形态观察,结果如图1所示,该菌株的菌落形态为圆形、不透明、乳白色、凸起、边缘整齐、表面湿润光滑、粘稠。对该菌株进行革兰氏染色,呈现紫色,聚集成链状,说明该菌株为革兰氏阳性菌。
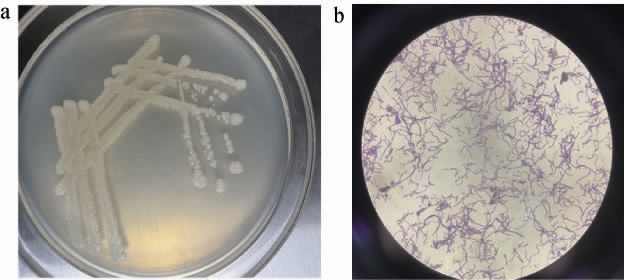
图1 菌株A12F_C118的菌落形态(a)及细胞形态(b)
Fig.1 Colony morphology (a) and cell morphology (b) of strain A12F_C118
2.2.2 分子生物学鉴定
对来自产乙偶姻菌株A12F_C118的16S rRNA基因片段进行测序,将拼接好的序列在NCBI数据库(blast.ncbi.nlm.nih.gov)中进行比对,获得与测序菌株相近的种、属序列,通过NJ 法构建菌株A12F_C118的系统发育树,结果见图2。由图2可知,序列比对结果为菌株A12F_C118与Bacillus sonorensis的相似性>99%。故鉴定菌株A12F_C118为索诺拉沙漠芽孢杆菌(Bacillus sonorensis)。

图2 基于16S rDNA基因序列的菌株A12F_C118系统发育树
Fig.2 Phylogenetic tree of strain A12F_C118 based on 16S rDNA gene sequence
2.3 固态混菌发酵产物理化指标分析
对混菌发酵产物的水分[14]、还原糖、总酸与pH值进行测定,结果见图3。由图3a可知,接种菌株A12F_C118后固态混菌发酵产物的水分含量整体高于空白组,水分含量先小幅上升后持续下降,最后维持在6.79%~7.89%,且M1组整体水分含量最高。由图3b可知,接种菌株A12F_C118后固态混菌发酵产物的还原糖含量整体低于空白组,还原糖含量先上升后下降,且M1组整体最高,M3组整体最低,可能是接种菌株的实验组加入的菌株生长代谢对加大了对还原糖的消耗。由图3c可知,接种菌株A12F_C118后固态混菌发酵产物的总酸含量整体高于空白组,总酸含量先增后减,M3组整体最高,可能是接种菌种适宜发酵后期的高温环境,代谢产生更多酸类物质,后期反应生成酯类等[15]。由图3d可知,固态混菌发酵产物的pH值变化均呈现先降低后升高的趋势,总体波动不大。接种菌株A12F_C118使固态混菌发酵产物水分含量有所增加,还原糖含量相对降低,总酸含量增高,pH有所下降,且M1组最终水分消耗最少为7.89%、还原糖含量、pH值最高分别为0.09 g/100 g、6.41,M3组最终总酸最高为0.93 mmol/10 g。
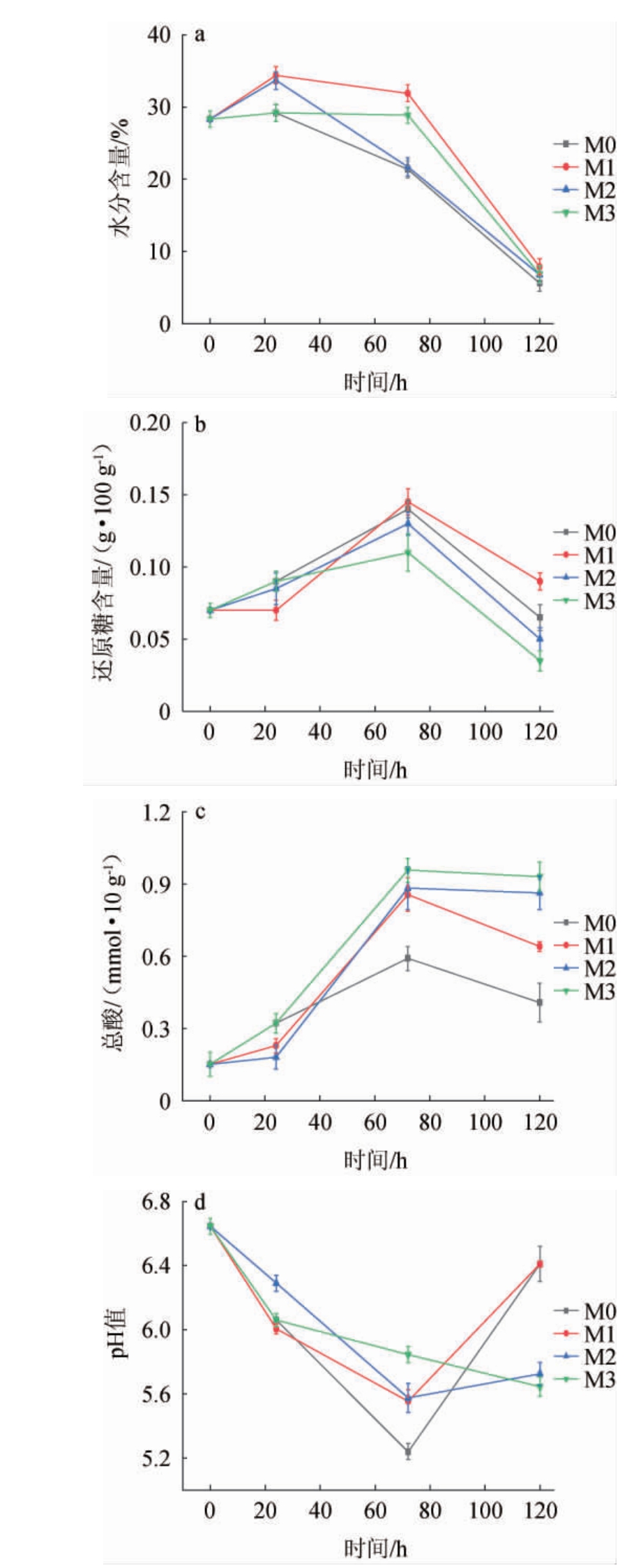
图3 固态混菌发酵产物理化指标的变化
Fig.3 Changes of physicochemical indexes of solid-state multi-microbial fermentation products
2.4 固态混菌发酵产物挥发性风味物质分析
以小麦为原料,接种酱香型母曲后固态混菌发酵产物为空白对照组,分别在发酵培养12 h、24 h、48 h后接种菌株A12F_C118的固态混菌发酵产物为实验组。通过HS-SPMEGC-MS检测实验组和对照组固态混菌发酵过程中的挥发性风味物质,结果见图4。由图4可知,共鉴定出51种挥发性风味物质,包括4种醇、9种酯、14种烷、3种醛、2种酮、4种酚、3种萘、7种其他物质以及5种吡嗪。相较于空白组,大部分挥发性风味物质含量在接种菌株A12F_C118后均得到了提升。醇类物质中正戊醇、苯乙醇、2-乙基-1-己醇、仲辛醇等醇类物质含量在接种菌株A12F_C118后均有不同程度的增长,这些醇类化合物贡献了白酒中的醇香、水果香和甜香,是酱香型白酒甜香风味的基本组成物质[16]。酯类物质中苯乙酸乙酯、己酸乙酯、庚酸乙酯、苯甲酸乙酯等酯类物质的含量在接种菌株A12F_C118后均有一定程度的增长,相比之下乙酸乙酯、辛酸乙酯和月桂酸乙酯的含量增长更加显著,而苯乙酸乙酯、己酸乙酯、庚酸乙酯、苯甲酸乙酯等酯类物质是构成酱香型白酒风味的骨架物质,对白酒风味影响较大[17]。对于吡嗪类物质,为白酒提供特殊风味,且四甲基吡嗪是白酒中的健康因子[18],发酵醅中四甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基吡嗪、三甲基吡嗪和2-甲基吡嗪五种吡嗪物质的含量在接种菌株A12F_C118后均有不同程度的增长,其中四甲基吡嗪、2,5-二甲基吡嗪和三甲基吡嗪三种吡嗪含量增长较显著,另外两种吡嗪增长不明显。而各组乙偶姻含量先增后减,且接种菌株A12F_C118的组在第3天时乙偶姻含量皆高于空白组,可见乙偶姻的含量变化与四甲基吡嗪含量变化密切相关,二者相互转化。菌株A12F_C118使固态混菌发酵产物醇类、酯类、吡嗪类等多种挥发性风味物质含量增加,提升风味。
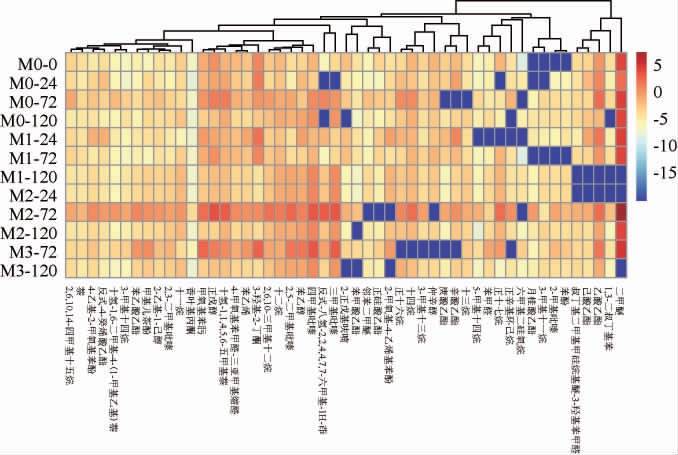
图4 固态混菌发酵产物中挥发性风味物质聚类分析热图
Fig.4 Heat map for cluster analysis of volatile flavor substances in solid-state multi-microbial fermentation products
2.5 菌株A12F_C118对混菌发酵体系挥发性风味物质网络结构的影响
基于共现网络分别构建空白组和实验组挥发性物质网络以认识菌株A12F_C118对固态混菌发酵体系挥发性风味物质的影响,结果见图5。

图5 固态混菌发酵产物中挥发性风味物质的共现网络分析
Fig.5 Co-occurrence network analysis of volatile flavor substances in solid-state multi-microbial fermentation products
a为对照组;b为实验组。
由图5可知,通过计算网络模型的拓扑系数发现,对照组共现网络共有53个节点和206条边,模块化为0.917;实验组共现性网络共有53个节点和350条边,模块化为0.613。实验组网络中的节点数目与对照组一样,边数却明显比对照组多,这说明实验组挥发性物质之间的联系更强、更复杂。共现网络中的模块化是指网络中的节点构成内部联系较强,而与外部联系较弱的部分,模块化越低说明物质之间相互作用的传递性越强[19]。实验组的模块化系数(0.613)低于对照组(0.917),这可能是由于菌株A12F_C118产生的代谢产物与混菌体系自身产生的物质间的相互作用导致的[6]。对风味进行进一步分析,对照组中,乙偶姻独属于0模块,四甲基吡嗪、三甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基吡嗪、2-乙基-1-己醇同在6模块;实验组中,乙偶姻、己酸乙酯、苯甲酸乙酯、仲辛醇、正戊醇同在0模块,四甲基吡嗪、三甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基吡嗪、2-乙基-1-己醇同在2模块,可见两组发酵醅的吡嗪类物质之间联系更强,但乙偶姻与吡嗪类物质所在模块间有相关联系。结果表明,接种菌株A12F_C118增加了挥发性代谢产物的复杂性,乙偶姻与四甲基吡嗪紧密相关。
2.6 固态混菌发酵产物有机酸分析
草酸和乙酸为大曲制备过程中的主体有机酸,乙酸也是形成乙酸乙酯的重要前体物质,对于大曲中风味的形成具有重要作用,苹果酸是三羧酸循环的中间产物,而乳酸是白酒中重要的呈香呈味物质,也是最重要的非挥发性有机酸之一,琥珀酸是由丙酮酸通过苹果酸、富马酸和一些氨基酸的分解形成的代谢物,它很容易与其他分子反应形成酯[20-23]。采用液相色谱法测定固态混菌发酵过程有机酸变化[24-25],结果见图6。
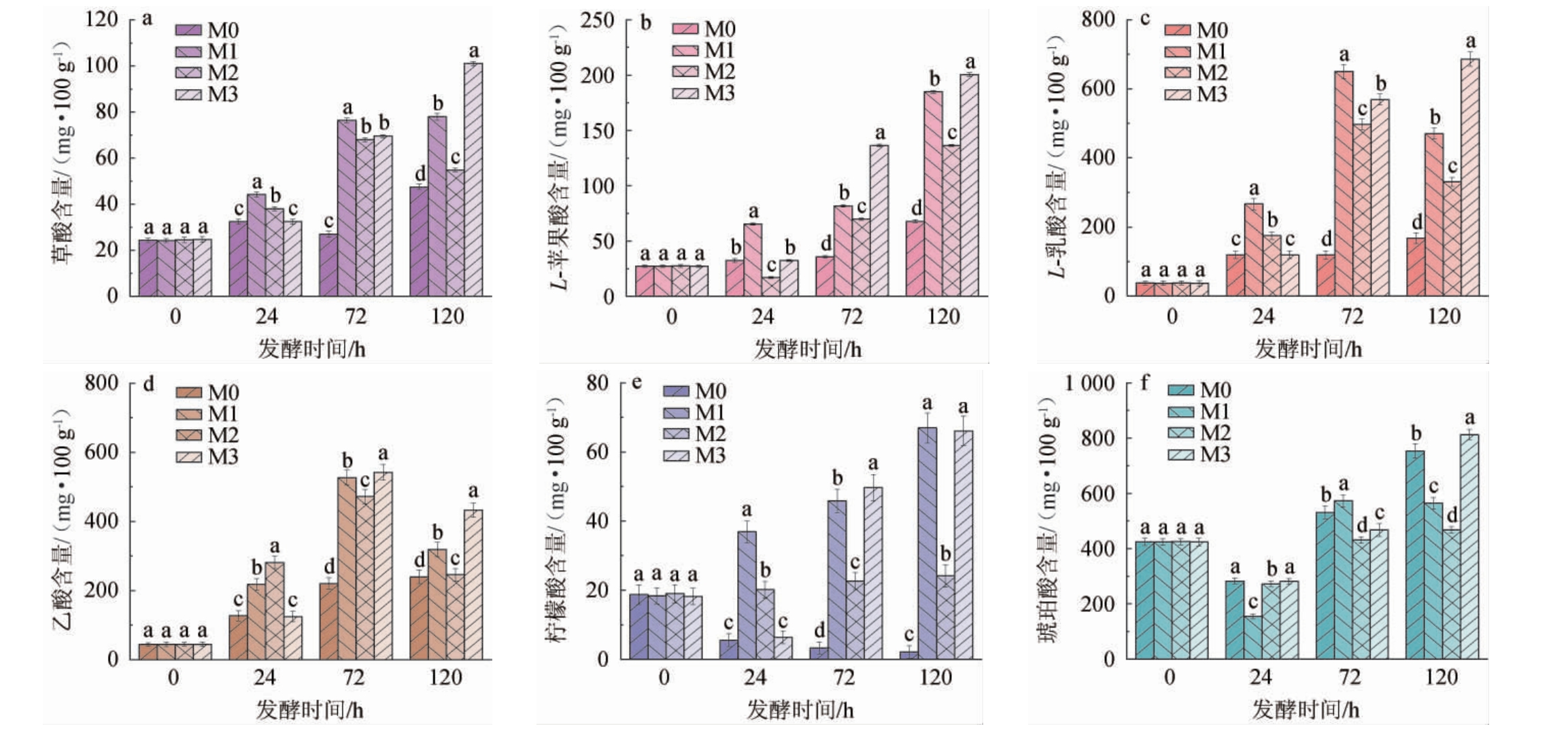
图6 固态混菌发酵产物中有机酸含量变化
Fig.6 Changes of organic acids contents in solid-state multi-microbial fermentation products
不同小写字母代表差异显著(P<0.05)。
由图6可知,共检出6种有机酸,分别为草酸、L-苹果酸、L-乳酸、乙酸、柠檬酸和琥珀酸,其中草酸、乙酸、L-苹果酸、L-乳酸、柠檬酸含量在M1、M2、M3组的固态混菌发酵产物中皆高于空白组,且在120 h时,M1组的固态混菌发酵体系中的草酸、L-苹果酸、L-乳酸、乙酸含量较其他组别高,柠檬酸在空白组中是不断减少的,而在M1、M2、M3组中的含量是逐渐增加的,菌株A12F_C118对固态混菌发酵体系中的柠檬酸的合成具有促进作用,尤其是在72~120 h时,M1、M2、M3组中柠檬酸含量迅速增加;琥珀酸在M0、M1、M2、M3组中含量逐渐增加,各组之间的含量变化较为接近,但是在120 h时M1组中出现含量降低,而M2组增长趋势减缓,M0、M3组增长显著。菌株A12F_C118对固态混菌发酵过程中草酸、L-苹果酸、L-乳酸、乙酸、柠檬酸的合成皆有促进作用,但对琥珀酸的影响不明显。
3 结论
本研究从酱香型大曲中筛选得到一株产乙偶姻的菌株A12F_C118,其被鉴定为索诺拉沙漠芽孢杆菌(Bacillus sonorensis)。通过菌株A12F_C118进行固态混菌发酵实验,并对发酵产物的理化指标、有机酸含量和挥发性风味物质进行分析,结果表明,在固态混菌发酵过程中,接种菌株A12F_C118后发酵醅水分含量稍微上升,还原糖总体消耗增大,总酸总体增加,pH值变化不大,而菌株A12F_C118对固态混菌发酵体系草酸、L-苹果酸、L-乳酸、乙酸、柠檬酸的合成皆有促进作用。相较于空白组,菌株A12F_C118对混菌发酵产物的吡嗪类物质含量的增加皆有促进作用,对四甲基吡嗪、2,5-二甲基吡嗪和三甲基吡嗪三种吡嗪含量增长较显著。本研究所筛选得到的产乙偶姻的菌株A12F_C118对可对固态混菌发酵体系的有机酸、吡嗪类物质含量等方面有积极影响,为酱香型大曲的微生物与风味研究提供一定理论基础。
[1]王家东,刘丹彤,王馨宇,等.山西老陈醋酿造过程四甲基吡嗪形成规律及稳定性研究[J].食品与发酵工业,2022,48(15):62-68.
[2]冯国杨,杨波,邢俊德,等.发酵食品中四甲基吡嗪的检测、来源及其微生物合成途径研究进展[J].中国酿造,2022,41(4):1-6.
[3]YANG Y,ZOU Y F,ZENG K J,et al.Effect of Bacillus subtilis fortified inoculation on the microbial communities in different niches of Daqu[J].J Biosci Bioeng,2022,134(5):407-415.
[4]李丹,张文学.基于MALDI-TOF-MS技术筛选及鉴定大曲中芽孢杆菌[J].中国酿造,2023,42(7):121-125.
[5]张燕婕.乙偶姻高产菌株选育及其发酵研究[D].无锡:江南大学,2013.
[6]康雪梅,罗雯,郭建,等.固态食醋自然发酵醋醅中生淀粉酶产生菌的筛选及初步应用[J].中国调味品,2023,48(10):78-84.
[7] FAN Y X, TIAN Y J, ZHAO X Y, et al.Isolation of acetoin-producing Bacillus strains from Japanese traditional food-natto[J].Prep Biochem Biotech,2013,43(6):551-564.
[8]黄实宽,陈雄,姚娟,等.小麦基质下枯草芽孢杆菌与酵母共发酵代谢特征[J].中国酿造,2020,39(5):157-161.
[9]XU B Y,XU S S,CAI J,et al.Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J].LWT-Food Sci Technol,2022,160:113214.
[10]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2021:69-70.
[11]张玲玲,罗惠波,黄丹,等.一株高产乙偶姻芽孢杆菌菌株筛选及发酵条件优化[J].现代食品科技,2021,37(5):71-81.
[12]YANG L,FAN W L,XU Y,et al.GCGC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type Daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol,2021,146:111416.
[13]宋雪苗,马世源,李子健,等.苹果内生菌Torulaspora delbrueckii强化对苹果醋风味物质合成的影响[J].食品科学,2023,44(20):330-342.
[14]黄实宽.不同酒类微生物纯种混菌固态发酵的风味变化研究[D].武汉:湖北工业大学,2020.
[15]邓永建,陆震鸣,张晓娟,等.不同乳酸菌对液态发酵米醋总酸及风味物质的影响[J].食品科学,2020,41(22):97-102.
[16]莫新良,杨亮,滕明德,等.一种典型酱香型白酒甜香风味酒挥发性香气成分分析[J].中国酿造,2022,41(8):235-240.
[17]张晓婕,邱树毅,曾庆军,等.不同工艺酱香型白酒挥发性物质差异分析[J].食品科学,2022,43(18):279-285.
[18] WEN A Y, YANG Z J, LIU N, et al.Dynamic correlation between tetramethylpyrazine and influencing factors in Bacillus subtilis-fermented dehulled adlay[J].Food Biosci,2023,52:102355.
[19]WANG C X,LIN Z Y.An efficient approximation of betweenness centrality for uncertain graphs[J].IEEE,2019,7:61259-61272.
[20]谈冲,艾梅,陈良强,等.影响酱香型白酒一轮次发酵乳酸积累的因素[J].食品与发酵工业,2023,49(20):9-16.
[21]CONRAD R,LIU P F,CLAUS P.Fractionation of stable carbon isotopes during acetate consumption by methanogenic and sulfidogenic microbial communities in rice paddy soils and lake sediments[J].Biogeosciences,2021,18(24):6533-6546.
[22]张莉方,徐宁莉,陶瑾,等.高耐酸酒酒球菌常压室温等离子体诱变选育及其苹果酸-乳酸发酵研究[J].微生物学报,2023,63(10):4000-4015.
[23]TRAN V G,MISHRA S,BHAGWAT S S,et al.An end-to-end pipeline for succinic acid production at an industrially relevant scale using Issatchenkia orientalis[J].Nat Commun,2023,14(1):6152.
[24] EROGˇUL D, KIBAR H, S,EN F, et al.Role of postharvest oxalic acid treatment on quality properties, phenolic compounds, and organic acid contents of nectarine fruits during cold storage[J].Horticulturae,2023,9(9):1021.
[25]KIM S R,PARK J Y,PARK E Y.Effect of ethanol,phytic acid and citric acid treatment on the physicochemical and heavy metal adsorption properties of corn starch[J].Food Chem,2023,431:137167.