高温大曲以小麦等谷物为主要原料,在开放环境中进行固态生料发酵。作为酱香型白酒酿造过程中的糖化发酵剂,高温大曲为酱酒发酵提供丰富的酶系和菌系,其对酱酒的出酒率和风味品质起着至关重要的作用[1-2]。高温大曲的制曲温度最高可到达60~65 ℃,由于曲块在制曲车间所处的位置不同,各个曲块发酵时的微生态环境如温度、湿度和氧气含量等存在差异,从而导致成品高温大曲的颜色有所不同,主要包括白色大曲、黄色大曲和黑色大曲[3]。SHI W等[4]对同一车间白色、黄色和黑色大曲微生物类群进行分析发现,海洋芽孢杆菌属(Oceanobacillus)和芽孢杆菌属(Bacillus)是大曲中的优势细菌属,且在白色大曲中的相对含量最高,其次是黄色大曲。DENG L等[5]对不同颜色高温大曲微生物组成进行分析发现,Bacillus是所有大曲中共有的优势细菌属,且在白色和红色大曲中相对含量明显偏高。WANG C L等[6]对不同发酵阶段茅台高温大曲进行解析发现,Bacillus在大曲发酵过程中具有主导地位。由此可知,Bacillus是高温大曲主要细菌类群之一,进一步探究不同颜色高温大曲间Bacillus差异对解析高温大曲细菌类群具有重要意义。
Bacillus属于需氧或兼性厌氧型微生物,生长环境广泛,具有耐酸、耐高温和耐酒精等特点,是酒曲发酵中主要功能菌群之一[7-9]。王鹏[10]将地衣芽孢杆菌(Bacillus licherniformis)制成强化大曲应用到酒醅发酵中,结果发现强化大曲可以增强白酒的香气特征。黄晓宁等[11]将产淀粉酶和产蛋白酶能力较强的地衣芽孢杆菌(Bacillus licherniformis)和枯草芽孢杆菌(Bacillus subtilis)应用到酒醅中进行强化发酵,结果发现这2株菌可显著提高酒醅中的挥发性物质含量。吴徐建等[12]对酱香型酒醅来源的一株耐酒精能力较强的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)进行分析,结果发现该菌能代谢产生丙酸乙酯、丁酸乙酯、庚酸乙酯和苯乙酸乙酯等酯类物质。因此,探究高温大曲中Bacillus群落结构并对其可培养分离株进行分析,对后续高温大曲生产过程中Bacillus的应用及优良菌株的筛选具有一定的指导意义。
前期通过高通量测序技术对湖北省襄阳市某酱香型白酒厂高温大曲细菌菌群多样性进行研究,发现芽孢杆菌为优势细菌属之一[13],本研究在此基础上对高温大曲中芽孢杆菌相对含量>2.0%的样品进行筛选,基于高通量测序技术和传统纯培养技术相结合的方法对大曲中芽孢杆菌多样性进行解析,以期为襄阳地区大曲品质优化以及白酒产业的进一步发展提供可供参考的理论依据。
1 材料与方法
1.1 材料与试剂
高温大曲样品:湖北省襄阳市某酱香型白酒厂制曲车间;大豆酪蛋白琼脂(tryptone soybean agar,TSA)培养基:青岛海博生物技术有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;引物M13F/M13R和27F/1495R:天一辉远(武汉)生物科技有限公司;10×聚合酶链式反应(polymerase chain reaction,PCR)Buffer、DNA聚合酶、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)Mix:北京全式金生物技术有限公司;Axygen清洁试剂盒:康宁生命科学吴江有限公司;2×PCR Buffer、rTaq酶、克隆载体pMDR18-T Vector:宝生物工程大连有限公司;大肠杆菌(Escherichia coli)top10感受态细胞:湖北省食品配料工程技术研究中心制备。其他试剂均为国产分析纯。
1.2 仪器与设备
800Y粉碎机:永康市铂欧五金制品有限公司;Fluor Chem FC3化学发光凝胶成像系统:美国Protein Simple公司;微量紫外分光光度计ND-2000C:美国Thermo公司;Illumina MiSeq高通量测序平台:美国Illumina公司;R920型机架式服务器:美国DELL公司;Veriti FAST梯度PCR仪:美国ABI公司;HR40-IIB2生物安全柜:海尔集团电子商务有限公司;琼脂糖凝胶电泳系统:北京六一生物科技有限公司。
1.3 试验方法
1.3.1 测序数据的获取
前期采集自湖北省襄阳市某酱香型白酒厂的黑色、白色和黄色高温大曲测序数据各10份(https://www.mg-rast.org/,编号:mgp96594)[13],从中筛选出优势菌属Bacillus相对含量>2.0%的样品,共获得12份高温大曲样品。其中,白色高温大曲样品8份,编号为B3、B4、B5、B6、B7、B8、B9和B10,黄色高温大曲样品4份,编号为Y3、Y4、Y5和Y8。
1.3.2 生物信息学分析
使用实验室自编脚本,将12份高温大曲样品中隶属于Bacillus的序列提取出来,经过合并处理后使用QIIME(v1.9.1)平台对测序数据进行分析,主要操作流程包括[14-15]:采用PyNAST软件进行序列比对和校准,按照97%相似度对序列进行操作分类单元(operational taxonomic units,OTUs)划分,使用Greengene数据库进行物种注释与相对含量计算,基于UniFrac距离进行β多样性分析,计算相同测序深度下α多样性指数(超1(Chao1)指数、发现物种数、香农(Shannon)指数和辛普森(Simpson)指数)。
1.3.3 高温大曲芽孢杆菌的分离与鉴定
参照王庆等[16]的方法稍作修改,称取10 g粉碎后大曲于装有90 mL无菌生理盐水的锥形瓶中,37 ℃振荡30 min后置于水浴锅中80 ℃水浴15 min。采用倍比稀释法和平板划线法,取100 μL适宜梯度的稀释液涂布于TSA固体培养基上,37 ℃恒温培养48 h观察其菌落形态,挑取疑似芽孢杆菌的单菌落进行划线,使用30%甘油对纯化菌株进行低温保藏(-80 ℃)。参照袁蕊等[17]的方法,对疑似芽孢杆菌菌株进行DNA提取、PCR扩增和目的片段的测序,将测序返回的有效序列上传至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行同源性比对并申请登录号。
1.3.4 数据处理
使用Excel 2016进行数据处理,应用多元方差分析(multivariate analysis of variance,MANOVA)对白色大曲和黄色大曲中Bacillus群落结构的差异性进行分析,使用Origin 2017绘制主坐标分析(principal co-ordinates analysis,PCoA)图,使用R软件(v4.1.0)中ggplot2和reshape2安装包绘制气泡图,使用R软件中RColorBrewer、rio和plotrix安装包绘制花瓣图,使用软件BioEdit、MEGA7.0和R软件中tidyverse、treeio和ggtree安装包构建系统发育树。
2 结果与分析
2.1 高温大曲样品中芽孢杆菌菌群的多样性分析
使用MiSeq高通量测序技术对12份高温大曲样品的Bacillus菌群α多样性进行分析,结果见表1。
表1 高温大曲样品中芽孢杆菌菌群的测序及α多样性分析结果
Table 1 Sequencing and alpha diversity analysis results of Bacillus in high-temperature Daqu samples
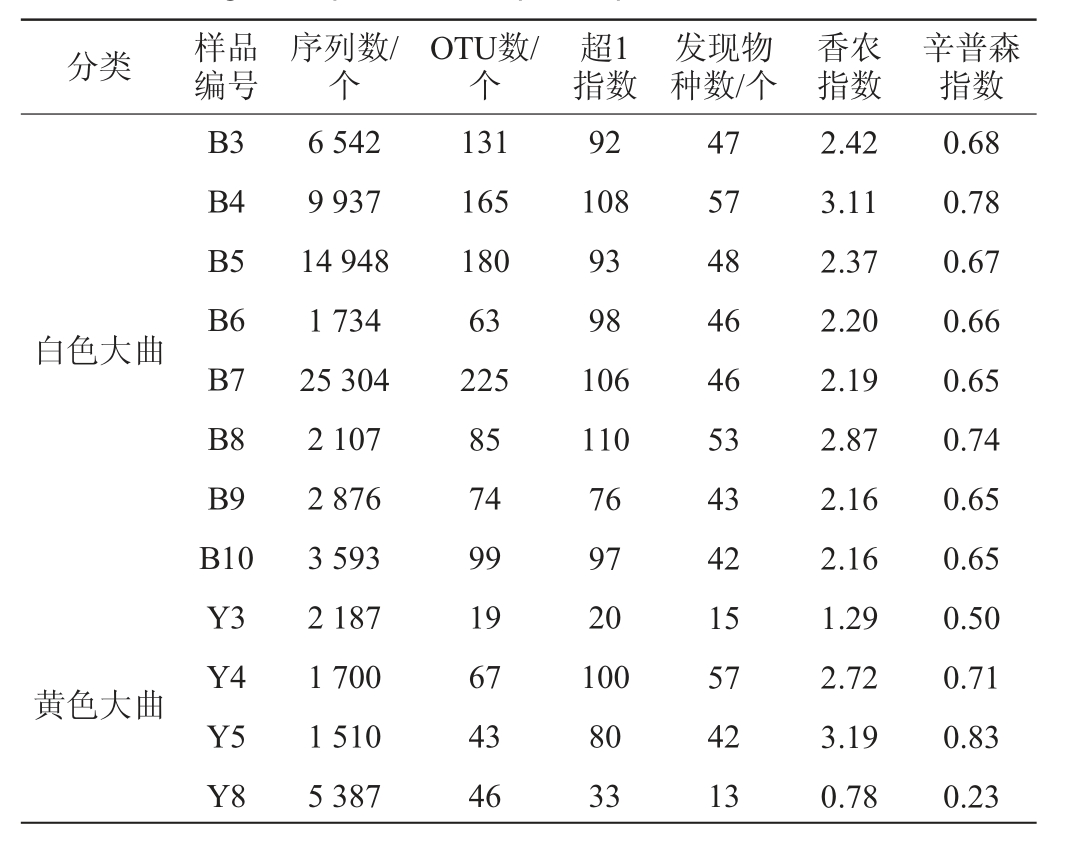
分类 样品编号序列数/个OTU数/个超1指数发现物种数/个香农指数辛普森指数白色大曲黄色大曲B3 B4 B5 B6 B7 B8 B9 B10 Y3 Y4 Y5 Y8 6 542 9 937 14 948 1 734 25 304 2 107 2 876 3 593 2 187 1 700 1 510 5 387 131 165 180 63 225 85 74 99 19 67 43 46 92 108 93 98 106 110 76 97 20 100 80 33 47 57 48 46 46 53 43 42 15 57 42 13 2.42 3.11 2.37 2.20 2.19 2.87 2.16 2.16 1.29 2.72 3.19 0.78 0.68 0.78 0.67 0.66 0.65 0.74 0.65 0.65 0.50 0.71 0.83 0.23
由表1可知,基于高通量测序技术,12份高温大曲样品共产生了77 825条具有代表性的序列,按照97%相似度阈值对序列进行划分且去除嵌合体序列后共获取1 197个OTU,其中白色大曲样品共有1 022个OTU,黄色大曲样品共有175个OTU。经Mann-Whitney检验发现,当测序量为710条序列时,白色大曲样品中Bacillus的超1指数和发现物种数显著偏高(P<0.05),而两组样品中香农指数和辛普森指数差异均不显著(P>0.05)。由此可知,白色大曲和黄色大曲样品中Bacillus丰富度存在显著差异,且白色大曲样品Bacillus菌群的丰富度更高。
为进一步分析白色大曲和黄色大曲样品之间的关系,本研究基于加权UniFrac距离进行了β多样性分析,结果见图1。
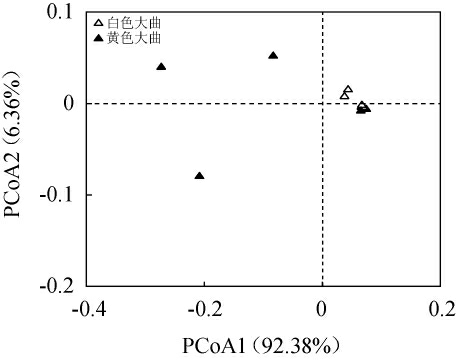
图1 基于加权UniFrac距离高温大曲样品中芽孢杆菌菌群的β多样性分析
Fig.1 Beta diversity analysis of Bacillus in high-temperature Daqu samples based on weighted UniFrac distance
由图1可知,基于加权UniFrac距离,PCoA1和PCoA2的累计方差贡献率为98.73%,表明β多样性分析可以较好的反映两组样品之间的关系。由图1亦可知,白色大曲样品空间分布较为集中,黄色大曲样品空间排布较为分散,且两组样品之间重叠较少,具有较为明显的分离趋势。经过MANOVA发现,白色大曲和黄色大曲样品中Bacillus群落结构存在显著差异(P<0.05)。由此表明,白色大曲样品Bacillus群落结构较为相似,且白色大曲和黄色大曲样品之间存在较大差异。
前期通过对黑色、白色和黄色3种颜色高温大曲样品中细菌菌群多样性进行分析发现,Bacillus在白色和黄色大曲样品中平均相对含量均>1%,在黑色大曲样品中平均相对含量则<1%,且Bacillus亦是白色大曲样品中细菌群落的生物标志物[13]。Bacillus是严格需氧型或兼性厌氧型的有荚膜微生物,其在含氧量较高的大曲中含量明显偏高[18]。因此,主要分布于曲房的上层和周边位置,充分暴露在空气中的白色大曲样品中Bacillus含量显著偏高,而分布于高温潮湿且氧气含量较少的中间层的黑色大曲样品中Bacillus含量显著偏低,黄色大曲样品则分布于两者之间,这也是导致不同颜色高温大曲中Bacillus含量存在差异的主要原因之一。
2.2 高温大曲样品中芽孢杆菌菌群的OTU分析
按照97%相似度对高温大曲样品中Bacillus序列进行划分,共获得1 197个高质量OTU,其中白色大曲样品中平均相对含量>1%的OTU共有6个,结果见图2。
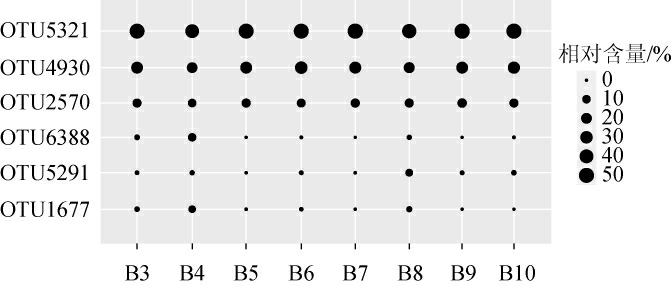
图2 白色大曲样品中平均相对含量>1%的操作分类单元
Fig.2 Operational taxonomic unit with average relative content>1%in white Daqu samples
由图2可知,白色大曲样品中平均相对含量>1%的OTU包 括OTU5321、OTU4930、OTU2570、OTU6388、OTU5291和OTU1677,分别占样品总序列数的47.89%、25.60%、11.70%、1.59%、1.54%和1.38%,累积占比为88.70%。由图2亦可知,同一个OTU在不同样品之间分布较为均匀。由此表明,白色大曲各样品中Bacillus群落结构相似度较高,这与上述β多样性分析结果一致。黄色大曲样品中平均相对含量>1%的OTU共有8个,结果见图3。
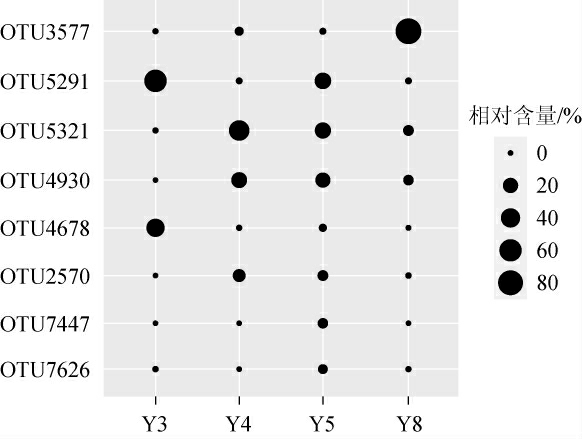
图3 黄色大曲样品中平均相对含量>1%的操作分类单元
Fig.3 Operational taxonomic unit with average relative content>1%in yellow Daqu samples
由图3可知,黄色大曲样品中平均相对含量>1%的OTU包括OTU3577、OTU5291、OTU5321、OTU4930、OTU4678、OTU2570、OTU7447和OTU7626,分别占样品总序列数的22.49%、21.90%、19.42%、11.83%、9.00%、4.35%、1.27%和1.01%,累积占比为91.29%。由图3亦可知,同一个OTU在不同样品之间存在明显差异。由此表明,黄色大曲各样品中Bacillus群落结构存在较大差异,这与上述β多样性分析结果一致。
若某一个OTU存在于所有样品中则定义为核心OTU[19],高温大曲各样品中OTU分布情况见图4。
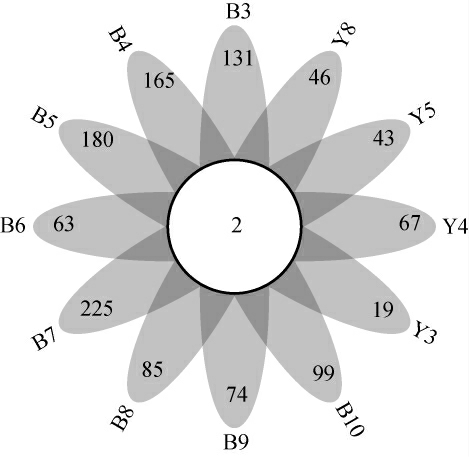
图4 高温大曲样品中操作分类单元花瓣图
Fig.4 Petal diagram of operational taxonomic unit in high-temperature Daqu samples
由图4可知,12份高温大曲样品中核心OTU共有2个,分别为OTU5321和OTU5291。结合图3可知,白色大曲样品中核心OTU5321和OTU5291分别占总序列数的47.89%和1.54%,累积包含序列占总序列数的49.43%;黄色大曲样品中核心OTU5321和OTU5291分别占总序列数的19.42%和21.90%,累积包含序列占总序列数的41.32%。由此可知,白色大曲和黄色大曲样品中Bacillus群落结构存在相似性和差异性。
为了便于进行分析,在系统发生学研究或群体遗传学研究中,需要人为的对来自同一个样本的序列进行归类操作(cluster),不仅可以减少后续分析的数据量,同时也可以减少由于序列分辨率不够导致的误差[20]。基于此,本研究按照97%的相似度阈值对所有序列进行OTU划分,并选取OTU中具有代表性的序列与数据库进行同源性分析,从而实现种水平的OTU划分[14]。一般情况下,基于16S rRNA基因序列能够精确分类到属水平,对于种水平的分类却不够可信[21]。因此,为了进一步明确高温大曲中Bacillus的物种分类学地位,通过传统纯培养技术对大曲中可培养Bacillus进行分离鉴定,实现种水平的物种分类。
2.3 高温大曲样品中芽孢杆菌的分离鉴定
基于传统纯培养技术,从12份高温大曲样品中共分离纯化出42株疑似芽孢杆菌分离株,其中白色大曲样品中共有28株,黄色大曲样品中共有14株,部分分离株的菌落形态和细胞形态见图5。
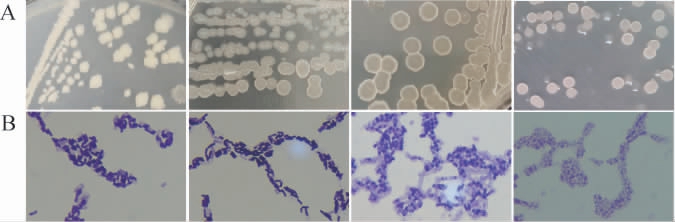
图5 部分分离菌株的菌落形态(A)和细胞形态(B)
Fig 5 Colony morphology (A) and cell morphology (B) of some isolated strains
由图5可知,分离株菌落呈现白色、乳白色或淡黄色,不透明,边缘不规则,表面较为湿润,菌体均为杆状。为了进一步明确菌株的分类学地位,将42株疑似芽孢杆菌分离株的16S rDNA序列上传至NCBI的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对分析,并绘制了系统发育树用以展示分离株与标准菌株之间的进化关系,结果见图6。
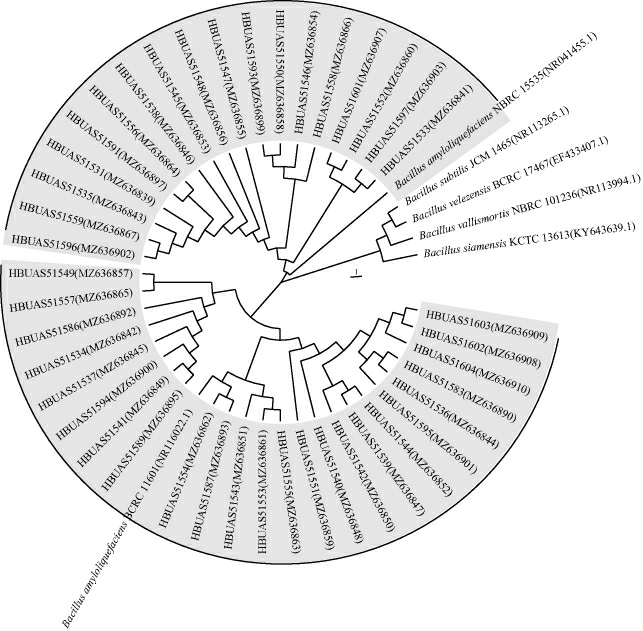
图6 高温大曲样品中芽孢杆菌分离株的系统发育树
Fig.6 Phylogenetic tree of Bacillus isolates in high-temperature Daqu samples
由图6可知,白色大曲和黄色大曲样品中可培养芽孢杆菌分别为28株和14株,其中HBUAS51549、HBUAS51557和HBUAS51586等24株菌与标准菌株Bacillus amyloliquefaciens BCRC 11601处于同一分支,分离株HBUAS51596、HBUAS51559和HBUAS51535等18株菌与标准菌株Bacillus amyloliquefaciens NBRC 15535处于同一分支,且所有分离株与标准菌株的同源性均>99%。由此可知,高温大曲中获取的分离株均被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),表明B.amyloliquefaciens为高温大曲中Bacillus的主要可培养菌种。
已有研究报道,B.amyloliquefaciens具有广谱抑菌性,能产生多种酶类,且是酱香型白酒酿造体系中重要的产香功能细菌[22]。LI H等[23]对茅台酱香大曲进行分析发现,B.licheniformis、B.subtilis和B.amyloliquefaciens为大曲优势菌种,且对茅台酒主要风味成分的产生具有不可忽视的作用。黄永光等[24]对从茅台酱香型白酒生产用大曲和酒醅中分离出的产酱香风味的B.amyloliquefaciens进行发酵发现,该菌株发酵可使代谢风味物质更加丰富,包括吡嗪类物质、醛类、酮类和酯类等香气物质成分。张小龙等[25]通过对贵州某酒厂高温大曲中分离出的2株B.amyloliquefaciens进行风味分析发现,这2株菌的发酵产物中芳香类物质和杂环化合物种类较多,包含四甲基吡嗪、庚醇、苯甲醛、2-戊基呋喃、壬酮、愈创木酚、三甲基吡嗪和异丁酸乙酯等多种香气物质,其中吡嗪类物质含量较高。综上可知,高温大曲中富含丰富的B.amyloliquefaciens,其对白酒酿造中香气成分的产生具有不可忽视的作用。
3 结论
白色大曲和黄色大曲样品中Bacillus群落结构存在明显差异,较之黄色大曲,白色大曲样品中Bacillus的丰富度更高,且白色大曲之间Bacillus群落结构较为相似。两种大曲中Bacillus群落结构亦存在相似性,高温大曲中核心OTU共有2个,其在白色大曲和黄色大曲中累积包含序列数分别为49.43%和41.32%。通过传统纯培养技术共得到42株芽孢杆菌,白色大曲和黄色大曲中各分离纯化出28株和14株,均被鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)。综上可知,较之黄色大曲,白色大曲Bacillus群落结构的丰富度更高,且B.amyloliquefaciens为白色大曲和黄色大曲中Bacillus的主要可培养菌种。
[1]刘茗铭,赵金松,边名鸿,等.高温大曲中微生物的研究进展[J].酿酒,2021,48(5):8-11.
[2]GAN S H,YANG F,SAHU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor[J].Front Microbiol,2019,10:1540.
[3]唐清兰,张奶英,徐姿静,等.剑南春酒曲培养过程细菌群落结构变化规律的研究[J].酿酒,2021,48(6):35-41.
[4]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156:111298.
[5]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11:588117.
[6] WANG C L, SHI D J, GONG G L.Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008,24:2183-2190.
[7]张宗启.酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技,2021(3):92-99.
[8]熊海涛.芽孢杆菌启动子的筛选及功能分析[D].南宁:广西大学,2019.
[9]周平,罗惠波,黄丹,等.中高温大曲中一株耐热地衣芽孢杆菌耐受性及产酶特性的初步研究[J].食品科技,2016,41(11):14-20.
[10]王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学,2017.
[11]黄晓宁,刘晶晶,韩北忠,等.基于酶学特性筛选大曲来源芽孢杆菌用于强化酿酒[J].食品科学,2021,42(10):218-224.
[12]吴徐建,吴群,徐岩.一株耐受酒精解淀粉芽孢杆菌(Bacillus amyloliquefaciens CGMCC 6262)的研究[J].工业微生物,2014,44(4):7-12.
[13]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[14]李俊锋.基于16S rRNA和宏基因组高通量测序的微生物多样性研究[D].北京:清华大学,2015.
[15]NIU T Y,XU Y Q,CHEN J N,et al.Bacterial taxonomic and functional profiles from Bohai Sea to northern Yellow Sea[J].Front Microbiol,2023,14(2):1139950.
[16]王庆,王超彦,徐海林,等.高温大曲中高产四甲基吡嗪芽孢杆菌的分离鉴定及发酵条件优化[J].中国酿造,2022,41(10):125-129.
[17]袁蕊,王学江,李峰.一株枯草芽孢杆菌的分离鉴定及其发酵条件优化[J].化学与生物工程,2019,36(7):35-38.
[18] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese Strong-flavor liquor brewing process[J].Front Microbiol, 2019, 10: https://doi.org/10.3389/fmicb.2019.00056.
[19]ZHANG Q Q,LI D,ZHANG W,et al.Comparative analysis of the bacterial diversity of Chinese fermented sausages using high-throughput sequencing[J].LWT-Food Sci Technol,2021,150:111975.
[20]田建军,张开屏,杨明阳,等.应用Illumina MiSeq测序技术比较风干肉中细菌多样性和微生物安全性[J].食品科学,2019,40(8):33-40.
[21]JANDA J M, ABBOTT S L.16S rRNA gene sequencing for bacterial identification in the diagnostic laboratory:pluses,perils,and pitfalls[J].J Clin Microbiol,2007,45(9):2761-2764.
[22]孙利林.基于转录组学探究温度胁迫对解淀粉芽孢杆菌JP-1风味代谢的影响[D].贵阳:贵州大学,2020.
[23]LI H,LIAN B,DING Y H,et al.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Ann Microbiol,2014,64:1659-1669.
[24]黄永光,杨国华,张肖克,等.产酱香风味芽孢杆菌类菌株发酵代谢产物及其酶分析研究[J].酿酒科技,2013(1):41-45.
[25]张小龙,陆安谋,王晓丹,等.酱香大曲中产酱香细菌的分离与鉴定[J].酿酒科技,2013(11):4-8.