白酒是我国传统的蒸馏酒,以高粱为主要原料,辅以大米、小麦、豌豆等多种粮食,经蒸煮、发酵、蒸馏而成[1-2]。酿造原料、发酵工艺和自然环境的差异铸就了白酒风格迥然各异。在发酵过程中,原料中淀粉、蛋白质等大分子物质被微生物分解为还原糖、氨基酸等小分子营养物质和酒精、二氧化碳及多种香气物质[2]。经过长达数月的发酵,这些物质随着水分的迁移流入窖池底部,从而形成黄水[3]。黄水富集了酒糟和泥窖中的营养物质,为窖池中有益微生物的生长繁殖提供理想环境,有利于白酒风味的形成,对白酒品质产生重大影响[2,4-5]。
黄水是固态发酵白酒的主要副产物,是一种棕黄色或褐色,具有较大黏度和特殊臭味的液体。据估计,每生产1 000 kg白酒,大约会产生300~400 kg黄水[6]。由于黄水的产量大、物质杂,若不加处理肆意排放,不仅会导致资源浪费,还会严重污染环境,影响生态健康[7]。为了适当处理黄水,目前大多数酒厂都采用将黄水回流窖池进行发酵,以维持窖池微生物生态系统稳定[8]。尽管黄水的回收已经在一定程度上避免黄水浪费。然而,黄水富含碳水化合物、含氮化合物、有机酸、风味物质和各种功能微生物,具有开发生物活性成分的巨大潜力[5,8]。黄水对常见食源性致病菌和腐败微生物的生长具有强大的抑制作用,还具有抗菌特性,表明黄水可被开发为一种食品防腐剂[9]。黄水中微生物资源丰富,富含大量经长期驯化,适应于高酸、高酒精浓度等极端环境的微生物菌群,有利于新功能的挖掘[8]。因此,黄水具有巨大的生物活性物质开发和功能微生物挖掘的潜力。
目前对黄水的研究主要集中在黄水的形成机理、理化性质及抑菌性能评价等方面[3,7,10],缺少对黄水中原核微生物群落结构及其影响因素的综合评估,特别是鲜见在酒厂不同车间之间的差异报道。了解不同车间窖池黄水的差异,有利于更好的完善黄水回收和高附加值利用的策略。因此,该研究采用高通量测序技术分析两个不同车间黄水的理化特性和原核微生物群落结构组成,旨在揭示理化因子对群落多样性及组成的影响比例,为黄水的生产调控和功能微生物挖掘提供数据基础。
1 材料与方法
1.1 材料与试剂
黄水:四川省某白酒酒厂;氢氧化钠、酚酞、硫酸铜、酒石酸钾纳、亚铁氰化钾、乙酸锌、盐酸(均为分析纯):国药集团化学试剂有限公司;PowerWaterR脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、HotStarTaqR DNA聚合酶:德国QIAGEN公司;引物:武汉华大基因科技有限公司。
1.2 仪器与设备
FA20004P型电子分析天平:三丰精密量仪有限公司;PHS-6F型实验室pH计:青岛明博环保科技有限公司;DYY-2型电泳仪、THBC-470型凝胶成像仪:拓赫机电科技(上海)有限公司;Illumina Miseq测序平台:武汉华大基因科技有限公司。
1.3 方法
1.3.1 样品采集
黄水于2022年6月采集自四川省某白酒酒厂,随机选择两个车间(分别为A和B)中各6个窖池,从每个窖池底部收集大约500 mL黄水于玻璃瓶中,密封后立即置于冰盒(0~4 ℃)中运回实验室,置于-80 ℃贮存,待测。
1.3.2 理化检测
pH:pH计测定;酒精度:参照国标GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》进行测定;总酸:参照国标GB 12456—2021《食品安全国家标准食品中总酸的测定》测定;不挥发酸:参照国标GB 18187—2020《酿造食醋》测定;还原糖:参照国标GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》测定;淀粉:参照国标GB 5009.9—2016《食品安全国家标准食品中淀粉的测定》测定;总酯、固形物:参照国标GB/T 10345—2007《白酒分析方法》测定;乙醛:参照国标GB 29972—2013《食品安全国家标准食品添加剂乙醛二乙缩醛》测定;甲醇:参照国标GB 5009.266—2016《食品安全国家标准食品中甲醇的测定》测定。
1.3.3 DNA提取及高通量测序
采用QIAGEN PowerWaterR DNA Kit提取样品DNA。利用NaneDrop 2000型超微量分光光度计检测DNA浓度,使用原核微生物16S rRNA V3-V4可变区通用引物(338F:5'-ACTCCTACGGGAGGCAGCA-3'和806R:5'-GGACTACHVGGGTWTCTAAT-3')对样品进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:DNA模板1 μL,上下游引物各1 μL,去离子水7 μL;PCR扩增条件:94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,30次循环[11]。每个样本3个重复,合并同一样本的PCR产物,用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,洗脱后委托武汉华大基因科技有限公司基于Illumina Miseq测序平台完成16S rDNA V3-V4高变区序列测序[11]。
1.3.4 序列分析
利用qiime2[12]中DADA2插件切除序列引物片段,弃去未匹配引物的序列,然后进行质控、去噪、拼接、去嵌合体等步骤,获得扩增子序列变体(amplicon sequence variants,ASVs),随后将ASV特征序列与Silva 138数据库中参考序列进行比对,从而获取每个ASV的分类学信息,删除不能在门水平上注释的ASV,合并ASV特征序列和ASV表格[13]。
1.3.5 统计分析
采用GraphPad Prism 10软件绘图,利用R 4.0.1软件计算微生物多样性,对微生物群落进行主坐标分析(principal co-ordinates analysis,PCoA)、相似性分析(analysis of similarities,ANOSIM)和线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析,并对理化因子和优势微生物属进行冗余分析(redundancy analysis,RDA)、普鲁克分析(Procrustes analysis,PA)和方差分解分析(variance partitioning analysis,VPA)。使用SPSS 21.0软件对数据进行单因素方差分析(analysis of variance,ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 黄水的理化特性
黄水的理化指标可以反映窖泥微生物的代谢活性[14],不同车间黄水的理化指标测定结果见图1。由图1可知,A车间黄水pH值为3.12~3.21,平均值为3.16,极显著低于B车间(3.62~3.77,平均值为3.7(P<0.01))。黄水中总酸含量也随着pH值的变化而变化,呈现A车间极显著高于B车间(P<0.01)。总酸含量是白酒发酵品质的关键指标,因为乳酸菌在酒醅发酵过程中产生大量乳酸,导致黄水变酸,pH值降低[8]。乳酸是黄水中主要的不挥发酸,不同车间不挥发酸含量差异极显著(P<0.01)。A车间黄水中不挥发酸含量为2.08~2.22 g/100 mL,平均值为2.15 g/100 mL,极显著高于B车间(1.31~1.48 g/100 mL,平均值为1.39 g/100 mL(P<0.01))。B车间黄水中不挥发酸含量占总酸含量的比例约为71%,低于A车间(约84%),表明不挥发酸是黄水的主要呈酸物质,推测可能乳酸菌是黄水中数量最多的一类微生物。此外,乙醇和还原糖是通过微生物产生的酶分解淀粉原料而生成,这些物质也是黄水理化特性的主要组成部分[7]。A车间黄水酒精度为4.75%vol~4.98%vol,平均值为4.85%vol,极显著高于B车间(3.22~3.49%vol,平均值为3.36%vol(P<0.01))。而黄水中还原糖含量与酒精度的变化呈相反的趋势,A车间极显著低于B车间(P<0.01)。酿酒过程中微生物可将原料的可发酵性糖转为乙醇,转化效率越高,说明其微生物所产生的酒化酶活性越高,从而获得更多乙醇[15]。不同车间黄水淀粉含量与酒精度的变化相一致,呈现A车间极显著高于B车间(P<0.01)。综上可知,不同车间黄水的理化指标差异极显著(P<0.01)。
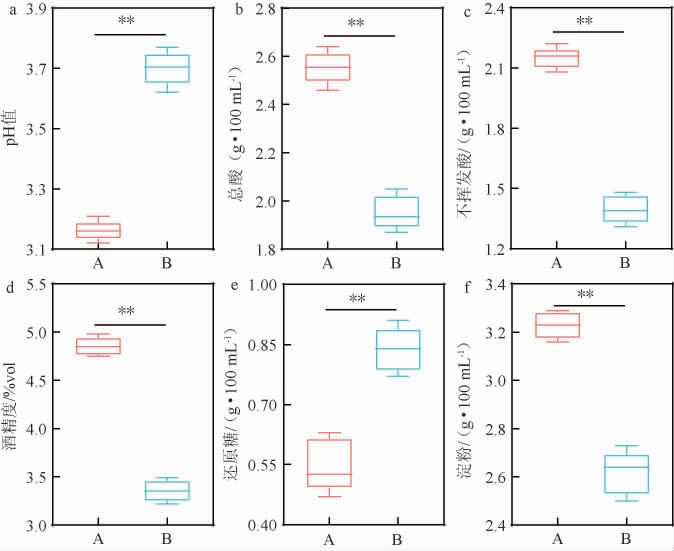
图1 不同车间黄水的理化指标
Fig.1 Physicochemical indexes of Huangshui of different workshops
“**”表示差异极显著(P<0.01),A和B表示两个不同车间,下同。
2.2 黄水微生物多样性分析
利用高通量测序技术对2个车间共12个黄水样品进行测序分析,共从原核微生物16S rRNA V3-V4可变区序列中获得了1 086 150条优质序列。2个车间黄水样品微生物α-多样性参数结果见表1。
表1 不同车间黄水原核微生物群落序列数量和α 多样性参数的分析
Table 1 Analysis of sequence number and α diversity parameters of Huangshui prokaryotic microbial communities of different workshops

注:表中数字表示“平均值±标准差”,同列小写字母不同表示差异显著(P<0.05)。
多样性指标 优质序列数目/条 ASV数量/个 Shannon指数 Chao1指数 Simpson指数 覆盖率/%车间A车间B 88 943±8216a 92 082±6953a 243±37b 387±41a 1.68±0.15b 2.56±0.27a 346.63±52.45b 469.78±48.19a 0.48±0.03b 0.73±0.04a 99.84±0.14a 99.91±0.06a
由表1可知,A车间和B车间的平均每个黄水样品优质序列分别为88 943条和92 082条,二者之间无显著差异(P>0.05)。此外,所有黄水ASV的覆盖度均>99.5%,说明测序结果足以反映黄水原核微生物多样性,能满足后续分析要求[16]。通过原核微生物数据库注释,A车间黄水平均ASV数量为243个,显著低于B车间(平均ASV数量为387个)(P<0.05),与KANG J等[17]研究结果相一致。基于ASV序列结果,对不同车间黄水进行Alpha多样性分析,根据Shannon指数、Chao1指数和Simpson指数对样品原核微生物物种组成进行综合评价[11]。其中Shannon指数和Simpson指数反映样品群落多样性,其值越大代表样品中原核微生物的多样性越高;而Chao1指数则反映样品群落的丰富度,其值越小代表样品中原核微生物的物种数越少[11]。B车间黄水的平均Shannon指数、Chao1指数和Simpson指数分别为2.56、469.78和0.73,显著高于A车间黄水样品(P<0.05)。通常,pH是塑造原核微生物群落组成和多样性的主要因素之一,pH越低,微生物数量和多样性越低,能适应其酸性环境的原核微生物越少[18]。不同车间黄水中原核微生物数量和多样性的变化与图1结果相一致。综上,不同车间黄水的原核微生物丰富度和多样性均差异显著(P<0.05)。
将黄水中高维原核微生物群落数据经过欧式距离算法降维至平面矩阵中,利用样品在平面矩阵的投影反映样品之间差异。不同车间黄水原核微生物群落组成的差异见图2。由图2可知,PCoA第一轴可解释物种方差贡献率为72.6%,而PCoA第二轴则可解释方差贡献率14.4%,共计87%。说明黄水的大部分物种群落差异可用PCoA前两轴进行解释。此外,不同分类对组间群落差异解释度R2为0.943,A车间黄水位于坐标轴左侧,而B车间位于右侧,说明组间差异远大于组内差异,不同车间原核微生物群落组成不同。随后,利用ANOSIM分析进一步评价不同车间黄水原核微生物组成差异。结果可知,不同车间黄水群落组成差异显著(P=0.002)(P<0.05),表明微生物通过改变群落组成来适应更高酸且更低pH的复杂环境[18]。
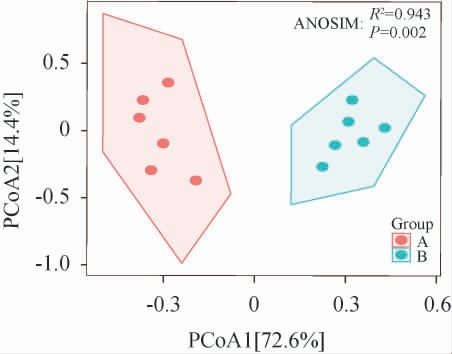
图2 不同车间黄水原核微生物群落组成的差异
Fig.2 Differences in the composition of Huangshui prokaryotic microbial communities of different workshops
2.3 群落结构分析
2.3.1 微生物群落门水平的差异
不同车间黄水原核微生物群落门水平的差异结果见图3。由图3可知,经数据库注释,所有黄水中共检出5个微生物菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、互养菌门(Synergistota)、放线菌门(Acinobacteriota),其中厚壁菌门占绝对优势,在A车间各黄水中相对丰度均>99.5%,而在B车间相对丰度为87.95%~89.45%。这与GAO L等[19]研究结果相一致。此外,B车间黄水中变形菌门、拟杆菌门、互养菌门和放线菌门的相对丰度分别为4.09%~4.51%、3.55%~4.42%、1.83%~2.31%和0.79%~0.94%,而这些原核微生物几乎不能在A车间被检出。由此可知,厚壁菌门(Firmicutes)是黄水主要原核微生物来源,但不同车间之间存在一定的差异。
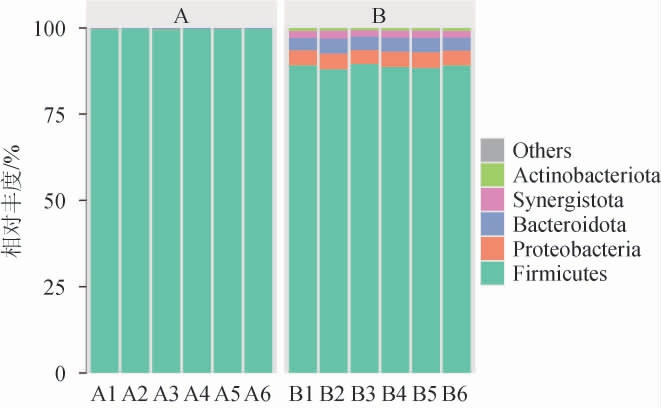
图3 不同车间黄水原核微生物群落门水平的差异
Fig.3 Differences of Huangshui prokaryotic microbial communities of different workshops in the phylum level
Others表示相对丰度<0.5%的集合,下同。
2.3.2 微生物群落属水平的差异
所有黄水共检测出69个微生物菌属,不同车间黄水原核微生物群落属水平的差异结果见图4。
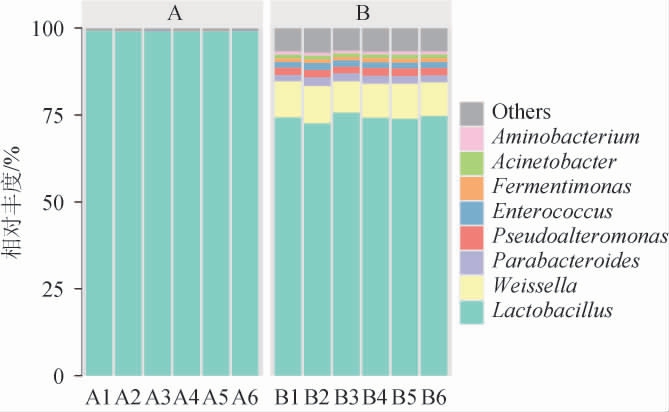
图4 不同车间黄水原核微生物群落属水平的差异
Fig.4 Differences of Huangshui prokaryotic microbial communities of different workshops in the genus level
由图4可知,乳酸杆菌属(Lactobacillus)是黄水中绝对优势菌属,但不同车间黄水的相对丰度存在差异,A车间黄水中乳酸杆菌属的相对丰度为98.00%~98.52%(平均值为98.33%),而B车间相对丰度仅为72.34%~75.74%(平均值为74.16%)。该结果与GAO Z等[3]研究结果相一致,表明乳酸杆菌属在发酵谷物中占优势地位,通常被认为是白酒发酵过程中的核心原核微生物[20]。黄水中乳酸杆菌属占优势,可能是发酵后期氧气的消耗和窖底黄水酸度的增加,促进乳酸杆菌属的生长繁殖。此外,乳酸杆菌属在参与挥发性风味物质的生物合成方面的基因表达活跃,有助于改善白酒风味[21-22]。B车间黄水中魏斯氏菌属(Weissella)和肠球菌属(Enterococcus)的相对丰度为8.99%~10.65%(平均值为9.89%)和1.66%~2.03%(平均值为1.77%),高于A车间,表明魏斯氏菌属和肠球菌属有利于葡萄聚糖、异麦芽低聚糖等低聚糖的合成,这些糖类物质会促进乳酸杆菌属的生长繁殖,而乳酸杆菌属生长代谢所产生的乳酸导致黄水pH下降,不利于魏斯氏菌属和肠球菌属的生长繁殖[17]。此外,副拟杆菌属(Parabacteroides)、假交替单胞菌属(Pseudoalteromonas)、发酵单胞菌属(Fermentimonas)、不动杆菌属(Acinetobacter)和氨基酸杆状菌属(Aminobacterium)是B车间黄水的优势原核微生物,其相对丰度分别为1.88%~2.48%(平均值为2.19%)、1.96%~2.23%(平均值为2.13%)、1.05%~1.18%(平均值为1.11%)、1.04%~1.11%(平均值为1.08%)和0.77%~0.95%(平均值为0.84%),高于A车间。这也是B车间黄水具有更高的原核微生物群落多样性和丰富度的原因。假交替单胞菌属属于假交替单胞菌科,其物种可广泛存在于植物、土壤、海洋、水、沉积物等不同生境,表明其具有多变的代谢能力和普遍的环境适应潜力[23]。不动杆菌是一种革兰氏阴性菌,在大曲中占优势,与有机酸、糖、氨基酸及其衍生物的产生呈正相关[24]。因此,不动杆菌可能参与白酒发酵过程中碳水化合物和氨基酸的代谢,从而影响白酒风味。综上,黄水中原核微生物群落结构不同,导致不同车间黄水理化特性不同,但不同车间黄水的乳酸杆菌属(Lactobacillus)均占绝对优势。
2.4 差异原核微生物分析
为进一步区分不同车间黄水的原核微生物差异,对其进行LEfSe分析,鉴定不同车间黄水的标志性原核微生物,不同车间黄水原核微生物群落的LEfSe分析结果见图5。由图5可知,总共有24种属于不同科水平的原核微生物在不同车间黄水中存在显著差异(P<0.05),包括放线菌科(Actinomycetaceae)、动球菌科(Planococcaceae)、乳酸杆菌科(Lactobacillaceae)、肠球菌科(Enterococcaceae)、明串珠菌科(Leuconostocaceae)、假交替单胞菌科(Pseudoalteromonadaceae)、梭菌科(Clostridiaceae)、Desulfotomaculales、Synergistaceae等。B车间黄水表现出较高的肠球菌科、假交替单胞菌科和梭菌科相对丰度,而在A车间发现较高的乳酸杆菌科和Desulfotomaculales。这与GAO L等[19]研究结果相一致。梭菌是白酒发酵过程中的重要功能微生物之一,为白酒提供己酸乙酯、丁酸乙酯等重要挥发性风味物质的前体,有利于改善白酒的风味[25]。因此,不同发酵环境会选择不同的原核微生物类群,导致不同车间黄水的标志性原核微生物组成差异巨大。
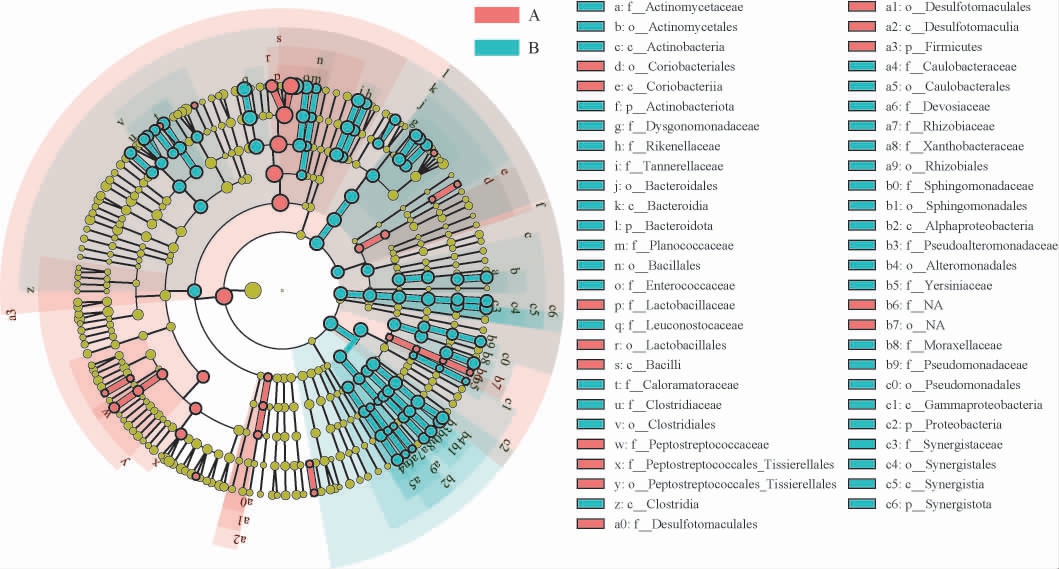
图5 不同车间黄水原核微生物群落的线性判别分析效应大小分析
Fig.5 Linear discriminant analysis effect size analysis of Huangshui prokaryotic microbial communities of different workshops
2.5 原核微生物与理化因子相关性分析
为探究理化因子对黄水原核微生物群落的贡献,采用PA分析明确不同车间黄水驱动因素差异,结果见图6。
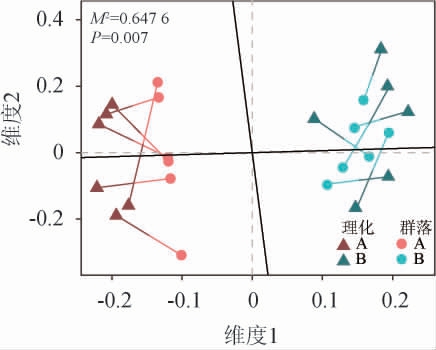
图6 不同车间黄水原核微生物与理化因子的普鲁克分析
Fig.6 Procrustes analysis of Huangshui prokaryotic microorganisms and physicochemical factors of different workshops
由图6可知,PA分析结果表明理化因子对黄水原核微生物群落的贡献显著(偏差平方和M2=0.647 6,P=0.007),并且不同车间黄水差异显著(P<0.05)。不同车间黄水的理化因子和原核微生物群落分别位于坐标轴的两侧,且组间差异大于组内差异,说明不同车间黄水原核微生物群落组成结构差异的驱动因素不同。
为明确理化因子与黄水原核微生物的相关性,使用RDA分析不同理化指标和主要优势菌属之间的相关性,其中两个向量间的夹角为锐角时,表示存在正相关,反之为负相关[26],结果见图7。
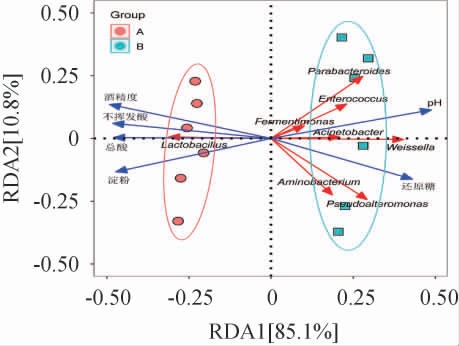
图7 不同车间黄水原核微生物与理化因子的冗余分析
Fig.7 Redundancy analysis of Huangshui prokaryotic microorganisms and physicochemical factors in different workshops
由图7可知,理化因子对黄水原核微生物群落前两轴的解释贡献度分别为85.1%和10.8%,共95.9%,可区分不同车间黄水。A车间黄水原核微生物群落与总酸、酒精度、不挥发酸和淀粉含量呈正相关,主要是这些理化因子与乳酸杆菌属呈正相关;B车间黄水原核微生物群落与pH和还原糖含量呈正相关,这些理化因子主要与副拟杆菌属、肠球菌属、发酵单胞菌属、不动杆菌属、魏斯氏菌属、Aminobacterium和假交替单胞菌属呈正相关。故酒精度、不挥发酸、总酸和淀粉含量是A车间黄水原核微生物群落形成的主要理化因子,pH和还原糖含量是B车间黄水原核微生物群落形成的主要理化因子。
将pH、总酸、不挥发酸和酒精度作为环境因子,还原糖和淀粉含量作为内生因子,通过VPA分析明确环境因子与内生因子对黄水原核微生物群落变异的贡献[13,27],结果见图8。由图8可知,所有理化因子可共同解释黄水原核微生物群落的38.5%变异,而环境因子和内生因子则分别可解释群落变异的18.3%和7.9%。此外,35.3%的原核微生物群落结构变异不能用所测理化指标进行解释,表明还有其他因素会影响黄水原核微生物群落结构。
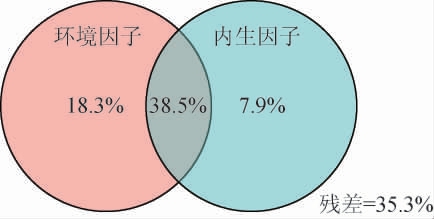
图8 黄水原核微生物与理化因子的方差分解分析
Fig.8 Variance partitioning analysis of Huangshui prokaryotic microorganisms and physicochemical factors
2.6 黄水原核微生物对原酒品质的影响
原酒理化指标是对原酒分级的重要依据,不同车间原酒的理化指标测定结果见图9。由图9可知,A车间原酒酒精度为63.20%vol~64.70%vol,平均值为64.07%vol,与B车间原酒酒精度(63.40%vol~64.60%vol,平均值为64.00%vol)无显著差异(P>0.05)。A车间和B车间原酒固形物含量分别为0.24~0.34 g/L和0.25~0.34 g/L,平均值分别为0.28 g/L和0.30 g/L。不同车间原酒酒精度和固形物含量均符合T/SPAQ0010S—2023《川酒浓香型白酒原酒》中酒精度≥60.0%vol和固形物含量≤0.40 g/L的要求。A车间原酒总酸含量为0.57~0.66 g/L,平均值为0.62 g/L,极显著高于B车间(0.40~0.51 g/L,平均值为0.45 g/L)(P<0.01),与黄水中总酸的结果相一致。通过传统甑桶蒸馏方式,可将酒醅中酸类物质带入至原酒中,赋予清香、爽口的口感,增加口感层次和复杂性。酯类物质是白酒中种类最多的一类香味物质,对白酒香气和口感起着至关重要的作用[28]。A车间原酒总酯含量为2.97~3.16g/L,平均值为3.07g/L,极显著高于B车间(2.68~2.87g/L,平均值为2.76 g/L)(P<0.01),符合GB/T 10781.1—2021《白酒质量要求第1部分:浓香型白酒》中高度优级酒总酯含量≥2.00 g/L。此外,不同车间原酒中乙醛和甲醇的含量均无显著差异(P>0.05)。通常优质白酒中乙醛含量超过20 mg/100 mL,而原酒中甲醇含量远低于GB 8951—2016《食品安全国家标准蒸馏酒及其配制酒生产卫生规范》中限量标准0.6 g/L的要求。综上所述,不同车间黄水原核微生物差异会影响原酒品质,尤其是酸酯的含量。
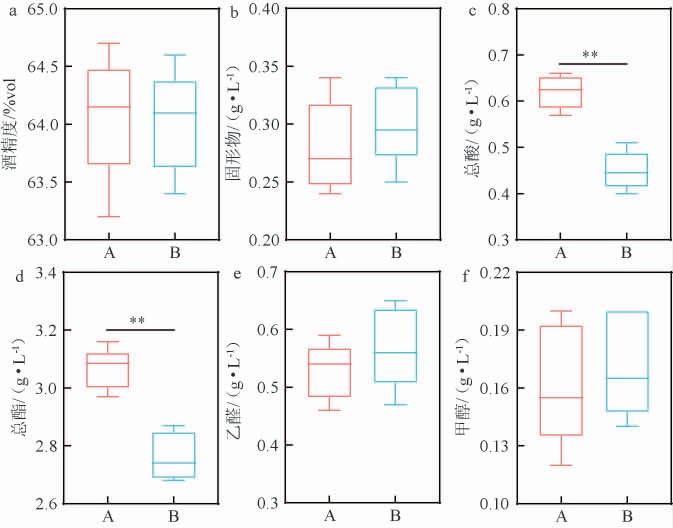
图9 不同车间原酒的理化指标
Fig.9 Physicochemical indexes of base liquor of different workshops
为进一步探究黄水原核微生物对原酒品质的贡献,采用相关性分析明确黄水主要原核微生物与原酒理化指标的关系,结果见图10。
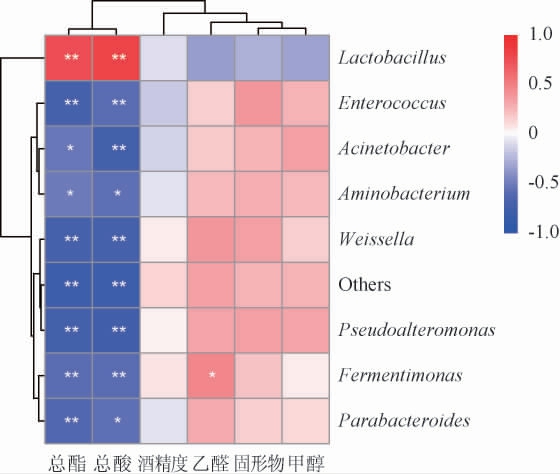
图10 黄水主要原核微生物与原酒理化指标的相关性分析
Fig.10 Correlation analysis between main prokaryotic microorganisms of Huangshui and physicochemical indexes of base liquor
由图10可知,乳酸杆菌属与原酒总酸和总酯呈极显著正相关(P<0.01),而黄水中其它属的主要原核微生物则与总酸和总酯呈显著负相关(P<0.05)或极显著负相关(P<0.01)。此外,原酒乙醛与黄水中发酵单胞菌属(Fermentimonas)呈显著正相关(P<0.05),可通过改变黄水中发酵单胞菌属(Fermentimonas)的相对丰度来调控原酒乙醛含量。
3 结论
本研究探究了同一家酒厂不同车间黄水的原核微生物群落及理化特性,并明确了理化因子对原核微生物群落的贡献。结果表明,不同车间黄水的pH、总酸、不挥发酸、酒精度、还原糖和淀粉含量等理化指标均差异极显著(P<0.01),并且不同车间黄水原核微生物群落的多样性、丰富度和结构组成差异显著(P<0.05)。厚壁菌门在黄水原核微生物中占绝对优势,但不同车间的相对丰度存在一定差异。在属水平,A车间黄水中乳酸杆菌属的相对丰度为98%~98.52%,而B车间相对丰度仅为72.34%~75.74%,且所属的乳酸杆菌科可作为A车间的标志性原核微生物。PA分析和VPA分析结果都表明,理化因子显著影响黄水原核微生物群落组成,所测得理化因子可共同解释黄水原核微生物群落的38.5%变异。此外,不同车间黄水原核微生物群落差异会影响原酒酸酯的含量。综上,不同车间黄水原核微生物群落结构差异与理化因子显著相关,了解理化因子对原核微生物的影响,可为黄水为原料筛选功能菌株提供数据基础。
[1]LIU Y,LI H,DONG S,et al.Dynamic changes and correlations of microbial communities, physicochemical properties, and volatile metabolites during Daqu fermentation of Taorong-type Baijiu[J].LWT-Food Sci Technol,2023,173(1):114-122.
[2]李可,范志刚,王俊芳,等.浓香型白酒发酵黄水中微生物群落结构解析[J].食品与生物技术学报,2015,34(11):1155-1161.
[3] GAO Z, WU Z, ZHANG W.Effect of pit mud on bacterial community and aroma components in yellow water and their changes during the fermentation of Chinese strong-flavor liquor[J].Foods,2020,9(3):372.
[4]LIU M K,TANG Y M,GUO X J,et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].Msystems,2020,5(2):101-128.
[5]张榆俊,张宿义,张楷正,等.浓香型白酒发酵过程中黄水与酒醅的相关性[J].中国酿造,2023,42(5):35-40.
[6]冯兴垚,邓杰,谢军,等.白酒酿造副产物黄水综合利用现状浅析[J].中国酿造,2017,36(2):6-9.
[7]郭双海.黄水的化学组分、微生物组成及综合利用研究进展[J].中国酿造,2023,42(7):25-29.
[8]王子豪,黄平,郑佳,等.白酒酿造副产物黄水研究现状及综合利用研究进展[J].中国酿造,2023,42(4):20-28.
[9]XU Y,SHENG J,LIU A.Antimicrobial properties and stability of yellow water,a byproduct of Chinese liquor fermentation[J].Food Sci,2017,38(15):122-126.
[10]徐亚超,盛杰,刘安军.白酒发酵副产物黄水抑菌特性及稳定性研究[J].食品科学,2017,38(15):122-126.
[11]孟镇,张媛媛,胡雯钦,等.湖南地区酱香型白酒酒醅细菌多样性及其与基酒风味物质相关性分析[J].中国酿造,2023,42(6):28-36.
[12]BOLYEN E,RIDEOUT J R,DILLON M R,et al.Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J].Nature Biotechnol,2019,37(8):852-857.
[13]唐慧芳,黄钧,周荣清,等.空间异质性对大曲微生物群落的影响[J].食品科学,2023,44(14):206-215.
[14]韩永胜,刘兴平,敖宗华,等.不同窖龄黄水的差异性及其对酒质影响的研究[J].酿酒,2014,41(1):36-39.
[15]CHAI L J,QIAN W,ZHONG X Z,et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Appl Environ Microbiol,2021,87(17):e00885-21.
[16]邹恬杏,苏伟,母应春,等.洞酿酱香酒第四轮次酒醅发酵过程中微生物群落与挥发性代谢物分析[J].中国酿造,2023,42(6):64-71.
[17]KANG J,SUN Y,HUANG X,et al.Unraveling the microbial compositions, metabolic functions, and antibacterial properties of Huangshui, a byproduct of Baijiu fermentation[J].Food Res Int,2022,157(7):62-74.
[18]JIAO S,LU Y.Soil pH and temperature regulate assembly processes of abundant and rare bacterial communities in agricultural ecosystems[J].Environ Microbiol,2020,22(3):1052-1065.
[19]GAO L, XIE F, REN X, et al.Correlation between microbial diversity and flavor metabolism in huangshui:A by-product of solid-state fermentation Baijiu[J].LWT-Food Sci Technol,2023,181(5):162-173.
[20] JIAO W, XIE F, GAO L, et al.Identification of core microbiota in the fermented grains of a Chinese strong-flavor liquor from Sichuan[J].LWT-Food Sci Technol,2022,158(3):113-140.
[21] DU H, SONG Z, XU Y.Ethyl carbamate formation regulated by lactic acid bacteria and nonconventional yeasts in solid-state fermentation of Chinese Moutai-flavor liquor[J].J Agr Food Chem,2018,66(1):387-392.
[22]ZHAO Q S,YANG J G,ZHANG K Z,et al.Lactic acid bacteria in the brewing of traditional Daqu liquor[J].J I Brewing,2020,126(1):14-23.
[23]ZHENG K,DONG Y,LIANG Y,et al.Genomic diversity and ecological distribution of marine Pseudoalteromonas phages[J].Marine Life Sci Technol,2023,36(14):1-15.
[24]ZHANG Y,SHEN Y,CHENG W,et al.Understanding the shifts of microbial community and metabolite profile from wheat to mature Daqu[J].Front Microbiol,2021,12(7):714-726.
[25]WU L,FAN J,CHEN J,et al.Chemotaxis of Clostridium strains isolated from pit mud and its application in Baijiu fermentation[J].Foods,2022,11(22):36-39.
[26]陈绍依,郎莹,邱树毅,等.茅台镇不同区域酱香大曲微生物群落结构及生产性能对比[J].食品科学,2023,44(14):134-143.
[27]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156(6):119-210.
[28] JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63(5):18-28.