浓香型白酒由于采用敞开式、多菌种发酵的固态法生产模式,故受地理环境和气候条件等影响较大,形成了“川派”、“江淮派”和“北方派”等不同风格特征的浓香型白酒[1]。河套酒业集团座落于素有“塞外粮仓”之称的河套平原,是内蒙古最大的浓香型白酒生产企业,也是北方地区较早生产大曲浓香型白酒的厂家之一[2]。近些年,随着白酒行业的深度调整,河套酒业也凭借其“淡雅绵柔”的酒体风格正在被全国的消费者所熟知和认可,河套酒也一跃成为“北方派”浓香型白酒的典型代表。
浓香型白酒窖内发酵是由多菌种和酶系共同参与的一个非常复杂的固态发酵过程[3]。糟醅是白酒酿造的主体,发酵微生物以糟醅为载体,进行着复杂的物质和能量的传递、交换和代谢作用,生成各类代谢产物和风味物质[4-5],最终形成浓香型白酒与众不同的成分构成和风味特征[6-9]。水分、酸度、淀粉和残糖(还原糖)含量是反映糟醅发酵情况的重要理化参数,因此糟醅的理化指标检测对白酒的酿造生产至关重要。由于泥窖是一个相对独立的生态系统,故窖内不同空间环境的微生态不同。微生物的生长代谢与环境因素联系紧密,使得窖池中不同糟醅层的发酵效果不同,最终导致不同糟醅层所产原酒存在差异[10]。王思浓等[11]研究了“川派”泸型浓香型白酒不同窖龄窖池上、中、下三层糟醅理化指标的变化规律并对照分析了二者的异同,发现了不同窖龄、不同空间层次各理化指标的变化幅度不同会导致微生物的生产环境与繁殖水平出现差异。刘学国[12]对河南浓香型白酒窖壁糟醅的理化指标和风味物质变化规律进行了研究,发现随着发酵的进行窖壁糟醅的水分含量升高,淀粉含量下降至稳定趋势,总酸和还原糖先上升后下降,pH值、氨基酸态氮和总酯呈下降趋势,这个重要的发现可作为表征浓香型白酒糟醅发酵过程中微生物菌群的代谢水平进而为人工监测提供理论依据。敖灵等[13]采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用技术,对泸州老窖泸型酒酿造过程中上、中、下层糟醅的主要挥发性风味物质的变化规律进行分析,并基于酯类物质进行主成分分析(principal component analysis,PCA),结果发现,三层糟醅的主要挥发性风味物质在不同层糟醅发酵过程中的变化趋势相似且醇类物质相对含量变化不明显,发酵结束时主要挥发性物质的含量为上层>下层>中层;PCA结果表明,泸型酒发酵过程分为以乙酸乙酯和丁酸乙酯为特征酯类物质的发酵前期和以乳酸乙酯和己酸乙酯为特征酯类物质的发酵后期两个阶段。运用相同的方法,卫春会等[14]分析了五粮浓香型糟醅中主要风味物质及其空间分布的差异,同样通过PCA法探究了糟醅在发酵过程中的主要风味物质及其前体物的变化规律,发现浓香型白酒糟醅主要包括18种酯类、10种醇类、8种酸类和2种白酒健康因子(4-甲基愈创木酚和4-乙基愈创木酚)共计38种挥发性风味物质;在糟醅不同空间层,上层的风味物质仅有18种,但酸类和酯类比例更为协调,中层的风味物质有34种,且醇类、酸类和酯类质量浓度均高于上层和下层,下层糟醅的己酸及己酸乙酯质量浓度最高。张霞等[15]通过对五粮浓香整个发酵周期内糟醅理化指标变化规律研究,发现不同层次、不同位置(上中、上边、下中和下边)的理化指标呈现一定的规律。
由于浓香型白酒采用泥窖密封发酵,发酵容器的特殊性给研究糟醅的取样工作带来了极大的难度,大多数研究都是针对取样相对容易的入窖糟和出窖糟理化数据的监控,也有部分学者虽然进行过不同空间层次发酵过程糟醅理化和风味物质的研究,但也仅仅局限在“川派”浓香型白酒,对“北方派”浓香型白酒相关研究报道极少。因此,本研究通过跟踪研究“北方派”浓香型白酒发酵过程中不同空间层次糟醅理化指标和主要挥发性风味物质的动态变化规律,为探明北方浓香型白酒的酿造机理、丰富浓香型白酒酿造的科学理论及提高白酒酿造的工艺控制水平和白酒品质提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
糟醅样品:取自河套酒业北方第一窖车间某班组的三个正常生产窖池;无水乙醇(分析纯):天津市富宇精细化工有限公司;甲酸(分析纯):赛默飞世尔科技(中国)有限公司;叔戊醇、乙酸正戊酯、2-乙基正丁酸(均为分析纯):上海晶纯试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
KDC-40低速离心机:安徽中科中佳科学仪器有限公司;BRUKER-MPA近红外光谱仪:布鲁克(中国)光谱仪器公司;ZTJ电子天平:杭州万特衡器有限公司;vortex-2G560E涡旋振荡器:美国Scientifi Cindustries公司;Agilent 6890 GC气相色谱仪:安捷伦科技(中国)有限公司;HZQ-2低温恒温振荡器:常州市国旺仪器制造有限公司。
1.3 方法
1.3.1 样品采集
选取河套酒业北方第一窖车间某一班组的三个正常生产窖池作为生物学重复,跟踪一个完整发酵周期(约62 d),试验取样时间为北方地区春夏之交的4~6月份。分别在0 d(入窖)、7 d、16 d、23 d、37 d、49 d和62 d(出窖)这七个时间点取糟醅样进行检测分析。窖池深度200 cm,窖帽高约40 cm,总高约240cm;糟醅从窖帽顶端按纵向分上层糟(0~80cm)、中层糟(80~170 cm)、底层糟(170~240 cm),按横向分中心区域(中心区30 cm以内环带)和窖边区域(距池边5~20 cm环带),具体取样点见图1,将窖池中糟醅按上、中、下三层和中心、窖边两个区域交错分为6个点,分别是TC(上层中心点)、TO(上层窖边点)、MC(中层中心点)、MO(中层窖边点)、BC(底层中心点)和BO(底层窖边点),每个点都采用多点取样法,混合均匀。将取得的糟醅样品放入无菌袋并密封,及时送实验室进行理化指标和挥发性风味物质分析。需要特别说明的是,河套酒业生产工艺采用双轮底发酵工艺来提升酒质,即在开窖时将大部分糟醅取出拌粮和辅料进行混蒸混烧馏酒,在窖底层留下少部分发酵情况好的糟醅拌入大曲等进行再次发酵,本试验中BC(底层中心点)和BO(底层窖边点)这两个位置点取样糟醅就是这种再次发酵的双轮底糟醅。
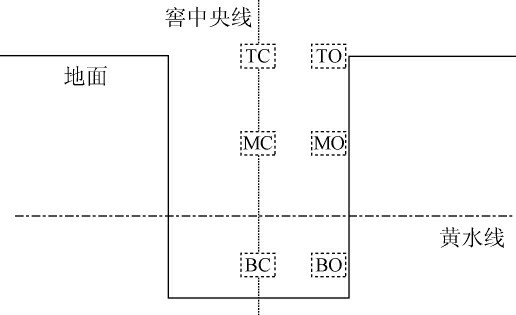
图1 不同空间层次糟醅取样示意图
Fig.1 Sampling diagram of fermented grains at different spatial levels
1.3.2 理化指标测定
利用河套酒业已经建立的糟醅理化指标的模型预测未知糟醅样品的近红外光谱图,同时得到这些糟醅理化指标的近红外分析结果。光谱测试条件:光谱测试谱区波数范围为12 000~4 000 cm-1,光谱分辨率为8 cm-1,扫描次数为64次[16-17]。
1.3.3 主要挥发性风味物质的测定
前处理方法[18-19]:称取10 g糟醅样品于100 mL三角瓶中,加入50 mL体积分数50%乙醇溶液,搅拌均匀,在35 ℃、20 r/min条件下振荡浸提30 min,4 000 r/min离心5 min,取离心上清液过0.22 μm尼龙滤膜,取10 mL滤液,加入0.1 mL混合内标(16.2 mg/100 mL叔戊醇、17.58 mg/100 mL乙酸正戊酯、18.66 mg/100 mL 2-乙基正丁酸)待测。
气相色谱条件[20-21]:CP-WAX57CB色谱柱(50m×0.25mm×0.2μm);载气为氮气(N2),流速1mL/min;进样口温度230℃;柱流速1 mL/min;升温程序为起始温度35 ℃,保持4 min;以4 ℃/min升至80 ℃,以8 ℃/min升至210 ℃,保持13.5 min;分流比为33∶1;氢火焰离子化检测器(flame ionization detector,FID)温度240 ℃,氢气流速40 mL/min;空气流速为400 mL/min。
定性定量方法:根据保留时间定性;采用内标法进行半定量。
1.3.4 数据处理与分析
采用Microsoft Excel 2016、Origin 2021软件和ProcessOn在线作图等进行数据统计、分析以及作图。
2 结果与分析
2.1 不同空间层次糟醅理化指标的变化分析
2.1.1 水分含量的变化
水是发酵微生物不可或缺的重要物质,其直接或间接参与微生物的物质和能量代谢与交换,同时淀粉的糊化和糖化也离不开水,因此水分含量是糟醅发酵过程的主要控制因素之一[22]。入窖水分含量过高会使发酵前期糖化发酵过快,升温过猛,进而导致发酵不彻底,酸度上升快而引起淋浆;入窖水分含量过低会使粮粉吃不透水,不利于淀粉糊化和糖化发酵[23-24]。因此,考察了不同空间层次糟醅在整个发酵周期内的水分含量变化,结果见图2。
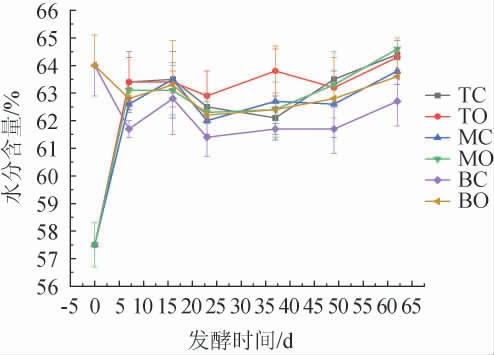
图2 不同空间层次糟醅水分含量的变化
Fig.2 Changes of moisture contents in fermented grains at different spatial levels
由图2可知,上层(TC、TO)和中层(MC、MO)入窖糟醅的水分含量都为57.5%,四个位置点糟醅水分含量在发酵过程中总体均呈先上升后下降再升高的趋势,底层(BC、BO)糟醅的初始水分含量为64%,总体变化规律是先下降后上升。TC、TO、MC与MO四个位置点的水分含量在发酵前7 d内急剧上升,可能由于发酵初期糟醅中氧气和营养物质含量充足,酵母菌和霉菌等好氧微生物快速生长繁殖,进行有氧呼吸代谢产生大量的水。发酵16 d后含水量呈现波动下降,可能是由于水分达到饱和状态,多余的水下淋到窖池底部汇积成为黄水[6],这期间也有通过酯化反应生成的水,但由于水的生成速度略小于水的下淋速度,所以呈现波动下降的趋势[23]。发酵23 d后上层糟TC与TO点和中层糟MC与MO点的水分含量都呈现不同步的波浪式缓慢上升。底层糟BC与BO点水分含量在发酵前7 d急速下降,7~23 d先升高后下降,第23天水分含量分别降到最低点(61.4%和62.2%),23 d后直至发酵结束,两个点的含水量都呈缓慢升高趋势。六个位置点糟醅在发酵结束时的水分含量有一定差异,TC与TO点基本一致都为64.3%左右,MO点(64.6%)高于MC点(63.8%),BO点(63.6%)高于BC(62.7%)点。
2.1.2 酸度的变化
糟醅酸度对发酵微生物的生长及代谢产物的形成有重要的影响,也是一项重要的发酵参数[25]。适宜的酸度能够抑制部分杂菌的生长繁殖进而保证酵母菌的正常代谢发酵,酸度过低会使前期发酵过猛,升酸幅度加大;酸度过高会抑制有益微生物的生长繁殖进而造成不升酸的现象[26]。同时,酸度过低或过高都不利于淀粉的糊化、糖化和发酵[27]。因此,跟踪检测了完整发酵周期内不同空间层次糟醅酸度的变化情况,结果见图3。
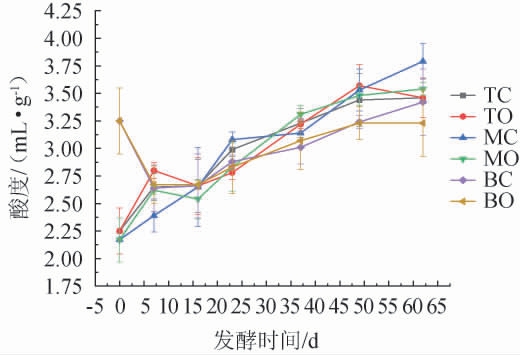
图3 不同空间层次糟醅酸度的变化
Fig.3 Changes of acidity in fermented grains at different spatial levels
由图3可知,TC、TO、MC和MO四个位置点糟醅的酸度总体趋势都是随着发酵时间的延长而逐渐升高,但是MC与MO点的上升幅度却明显不同。出窖时TC与TO点的酸度相同,都为(3.46±0.18)mL/g,而MC出窖时的酸度为(3.79±0.16)mL/g,明显高于MO点的酸度(3.54±0.06)mL/g。BC与BO点酸度在发酵前7 d急剧下降,分析原因可能是由于初始双轮底糟醅的高酸度抑制了产酸菌的生长繁殖,发酵7~16 d保持稳定,16 d后二者同步缓慢上升,这主要是因为发酵中后期,底层厌氧和兼性厌氧微生物生长繁殖速度减缓,而代谢作用却逐渐旺盛,代谢产酸导致糟醅酸度逐渐升高[15]。出窖时BC点酸度为(3.42±0.39)mL/g,明显高于BO点的酸度(3.23±0.36)mL/g。
2.1.3 残糖含量的变化
糟醅中还原糖是由各种淀粉酶水解淀粉而生成的,然后被酵母菌代谢利用生成乙醇,残糖含量可直接反映出糟醅发酵情况,一般出窖糟醅残糖含量以低于0.4%为宜[24]。本试验跟踪检测了一个完整发酵周期内不同空间层次糟醅残糖含量的变化,结果见图4。
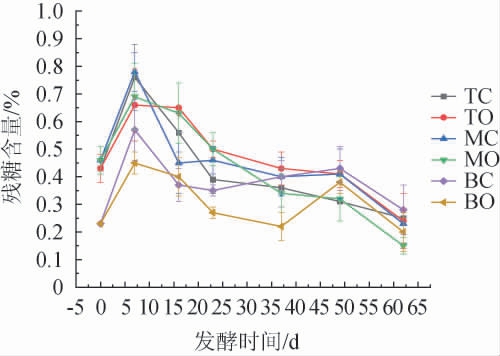
图4 不同空间层次糟醅残糖含量的变化
Fig.4 Changes of residual sugar contents in fermented grains at different spatial levels
由图4可知,六个位置点残糖含量都在发酵7 d时达到最高值,随后又逐渐降低,BC与BO点残糖含量在发酵中后期回升到一个小高峰后又缓慢下降直至发酵结束。发酵前7 d由于入窖糟醅中混入的大曲带入了大量的糖化酶以及产糖化酶的真菌,生成的还原糖远大于消耗的,故残糖含量急剧增加[19]。随着发酵进行到中后期,酵母菌等微生物代谢加快,同时酸度的升高抑制了淀粉酶的活性,还原糖消耗速度大于淀粉分解生成的速度,故残糖含量逐渐降低,这与张霞等[15]的研究结论一致。发酵23 d以后直至发酵结束,中、下层糟醅中心点残糖含量一直高于窖边点,出窖时MC点的残糖含量[(0.23±0.04)%]高于MO点[(0.15±0.03)%],BC点的残糖含量[(0.28±0.09)%]高于BO点[(0.20±0.07)%],充分说明窖边糟醅产酒发酵情况优于窖中心区域。
2.1.4 淀粉含量的变化
淀粉是发酵微生物生长繁殖所需的主要碳源,同时又是酒精发酵的物质基础,其在微生物作用下水解成葡萄糖等单糖,进一步在酒化酶的作用下生成乙醇,因此淀粉含量高低可以反映出糟醅中糖化菌糖化能力的强弱,也间接反映了白酒发酵过程的情况[28]。杨静等[29]研究表明,淀粉糖化和发酵的速度保持在相对动态平衡的状态,才能保证窖内糟醅发酵的正常进行,正常发酵的淀粉消耗幅度一般在6%~8%之间。因此,考察完整发酵周期内不同空间层次糟醅淀粉含量的变化情况,结果见图5。
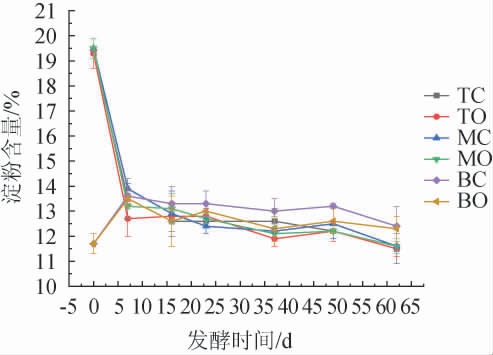
图5 不同空间层次糟醅淀粉含量的变化
Fig.5 Changes of starch contents in fermented grains at different spatial levels
由图5可知,中、上层四个位置点混粮糟醅的淀粉消耗幅度都介于6%~8%,说明本试验窖内糟醅发酵正常。TC、TO、MC和MO四个位置点淀粉含量在发酵前7 d同步急剧下降,7 d之后呈现同步缓慢下降,这是由于中、上层糟醅新混入的大曲中含有大量的糖化酶和糖化菌消耗了大量淀粉,发酵中后期由于酸度增加从而抑制了部分酶的活性,故淀粉含量呈现缓慢下降态势。BC与BO点淀粉含量在发酵前7 d快速增加,这是由于中、上层糟醅的淀粉含量随着水分下移到底层糟醅而引起的,7 d后由于新拌入的大曲中糖化酶等发挥作用使淀粉含量逐渐降低,BO点淀粉含量始终低于BC点。出窖时底层糟醅的淀粉含量约为12.3%~12.4%,中、上层的淀粉含量相近,约为11.5%~11.6%,因此底层糟醅淀粉含量要略高于中、上层,而窖中心点与窖边点的含量无明显差异。
2.2 不同空间层次糟醅中主要挥发性风味物质含量的变化分析
不同空间层次糟醅的发酵过程受窖内温度、酸度、水分、含氧量、微生物菌群等众多因素影响,反映结果为糟醅的风味物质随发酵时间变化存在差异[30-31]。本试验同时监测了“北方派”浓香型白酒不同空间层次糟醅发酵过程酯类、醛类、醇类和酸类等主要挥发性风味物质含量的变化。
2.2.1 主要酯类物质含量的变化
己酸乙酯、乳酸乙酯、乙酸乙酯和丁酸乙酯是浓香型白酒中四大主要酯类物质,其中己酸乙酯为主体香味成分,四大酯的含量及其量比关系决定了浓香型白酒的品质和风格[32]。由于乙酸乙酯易于挥发,本试验未能有效提取和检测到其含量,故只统计了己酸乙酯、乳酸乙酯和丁酸乙酯这三大酯的含量变化,结果见图6。
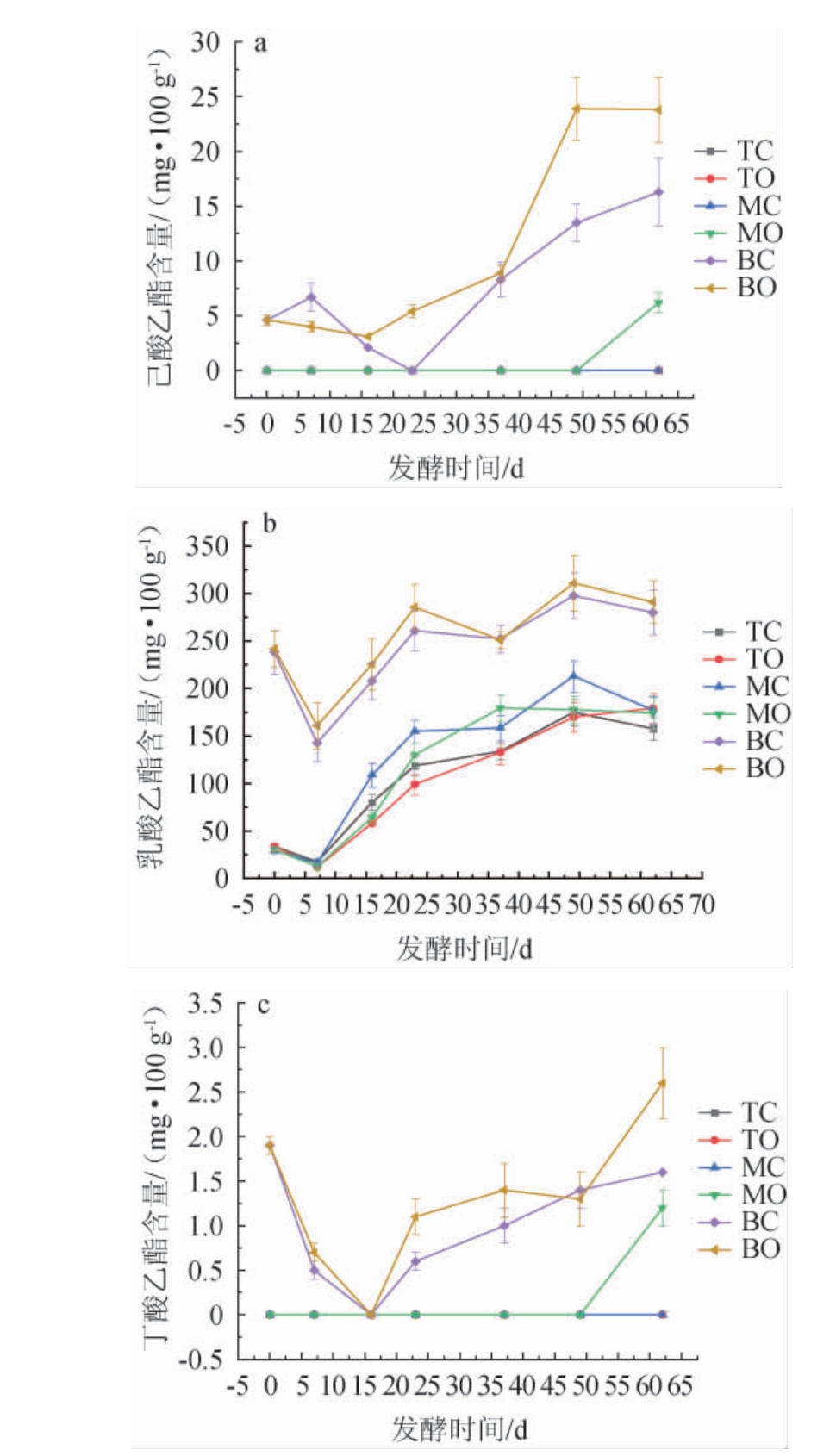
图6 不同空间层次糟醅主要酯类物质含量的变化
Fig.6 Changes of main esters contents in fermented grains at different spatial levels
由图6可知,TC、TO、MC三个位置点糟醅在整个发酵周期均未检测到己酸乙酯和丁酸乙酯的含量,只有MO点在发酵后期(49 d后)己酸乙酯和丁酸乙酯含量迅速增加,这说明中、上层糟醅中己酸乙酯和丁酸乙酯的生成主要靠贴近窖壁部分的中层糟醅在发酵后期生成。由于每个窖池都要留一部分上一轮已经发酵且未经蒸馏的糟醅压到窖底进行二次发酵的双轮底糟醅,故BC和BO点在发酵起始点的香味物质含量不为零且有一定差异。BC与BO点丁酸乙酯含量在发酵0~16 d都呈下降趋势,发酵16 d后都呈快速上升趋势,但BO点比BC点增长迅猛。BC与BO点的己酸乙酯含量在发酵0~23 d变化规律不同,BC点先短暂升高后又快速降到零点,而BO点则先缓慢降低之后又快速升高,发酵23 d之后两个点都呈快速升高趋势,直至发酵49 d后BC与BO点己酸乙酯增长速度放缓,这与卫春会等[14]研究得出的下层糟醅己酸乙酯含量在发酵进行到50 d后增加趋势放缓的结论基本一致。发酵终止时BO点己酸乙酯与丁酸乙酯含量要明显高于BC点的含量。这充分印证了高江婧等[33]研究得出的窖泥中的己酸菌等主体厌氧微生物不断迁移进入酒醅,使得酒醅中的己酸和丁酸等含量持续积累,进而与乙醇通过酯化反应生成相应的酯类的结论。六个位置点乳酸乙酯含量在发酵前7 d呈快速下降趋势,7 d以后,同层两个位置点同步呈现波浪式缓慢增加趋势,中、上层糟醅的乳酸乙酯含量增加了约4~5倍,而底层糟醅只增加了约20%。
2.2.2 主要醛类物质含量的变化
糟醅在发酵过程中会产生一定量的醛类物质,这些醛类物质一般为低级醛,如乙醛、乙缩醛,占总醛含量的98%以上[34],是白酒中香和味的纽带,主要对白酒的香气起平衡协调作用[35]。对乙醛和乙缩醛在发酵过程中的变化进行跟踪检测,结果见图7。
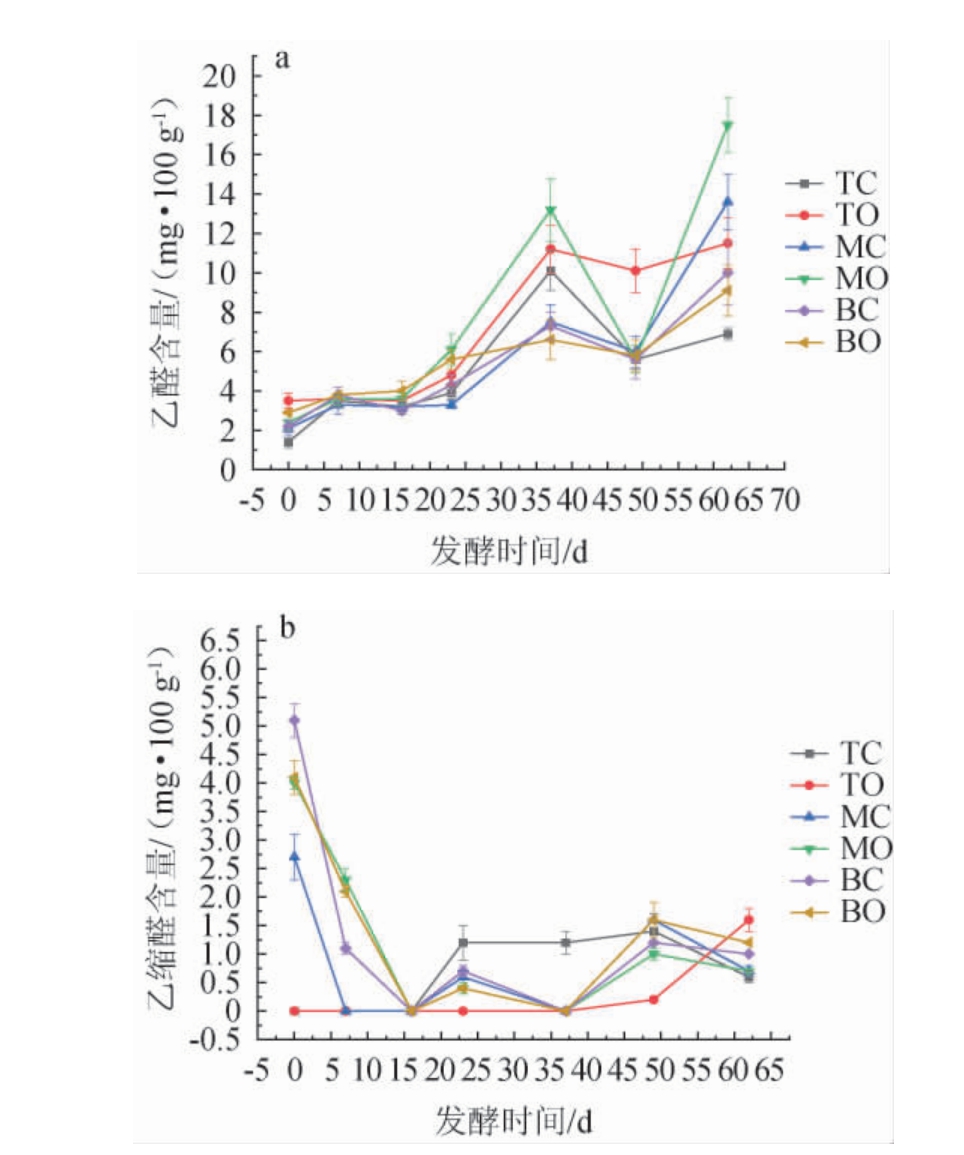
图7 不同空间层次糟醅主要醛类物质含量的变化
Fig.7 Changes of main aldehydes contents in fermented grains at different spatial levels
由图7a可知,乙醛在发酵0~16 d增长比较缓慢,23 d后开始迅猛增长,37 d达到一个小高峰,37~49 d又呈现快速下降趋势,49 d直至发酵结束呈快速上升态势,中层糟增长最猛,底层糟次之,上层糟增长最慢。发酵结束时,TO点乙醛含量为(11.5±1.5)mg/100 g,明显高于TC点的(6.9±0.3)mg/100 g,MO点含量为(17.5±1.4)mg/100 g,明显高于MC点的(13.6±1.4)mg/100 g,BC点乙醛含量为(10.0±1.6)mg/100g,明显高于BO点的(9.1±1.3)mg/100 g。由图7b可知,乙缩醛含量变化趋势与乙醛完全不同,TC点在发酵16~23 d迅猛增长,49~62 d急剧下降,而TO点则只在49~62 d呈快速增长态势,其他发酵时间都呈低含量稳定状态。MC、MO、BC与BO点在发酵0 d时的乙缩醛含量较高,在发酵前期呈急剧下降趋势,16 d以后呈波浪式缓慢升高态势。出窖时TO点的乙缩醛含量为(1.6±0.2)mg/100 g,明显高于TC点的(0.6±0.1)mg/100 g;MC与MO点乙缩醛含量一致都为0.7 mg/100 g;BO点与BC点含量相近约为1.0 mg/100 g。
2.2.3 主要有机酸含量的变化
糟醅中的有机酸种类很多,是浓香型白酒中重要的呈味物质,其在浓香型白酒中的绝对含量仅次于酯类含量[36]。对不同空间层次糟醅中的乙酸、己酸、丙酸和丁酸在整个发酵过程的变化进行检测,结果见图8。
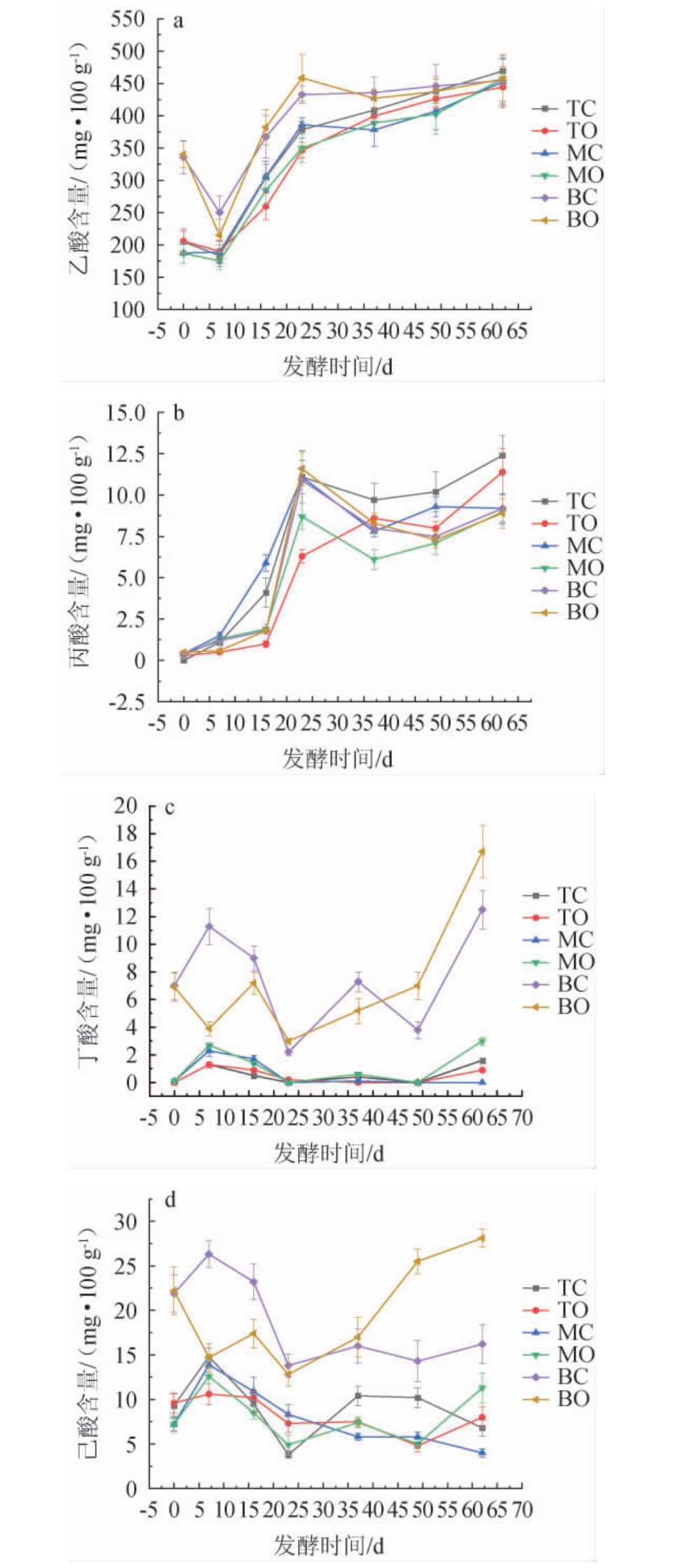
图8 不同空间层次糟醅主要有机酸含量的变化
Fig.8 Changes of main organic acid contents in fermented grains at different spatial levels
由图8可知,中、上层糟醅四个位置点的有机酸含量在发酵中前期只有乙酸是先下降后升高,其他3种酸(丙酸、丁酸和己酸)都是先升高后下降。这与刘凡等[37]研究得出的浓香酒醅中己酸、乙酸和乳酸含量在窖内发酵前期有一个降低的过程的结论不同,但与周新虎等[36-38]研究得出的在发酵结束时,乙酸、乳酸和丁酸含量均明显升高,己酸含量与发酵0 d相比无显著差异的结论相吻合。
由图8a可知,六个位置点乙酸含量都是在发酵0~7 d同步下降,7~23 d快速升高,23 d以后缓慢升高,出窖糟醅TC点乙酸含量为(469.2±18.0)mg/100 g,高于TO点[(444.0±31.7)mg/100 g],MC点与MO点和BC点与BO点乙酸含量无明显差异。徐勇等[39]对泸型酒酿造过程中上层和下层糟醅中的有机酸含量变化进行分析,发现上层和下层糟醅中乙酸含量变化趋势相似,都是在发酵前15 d先增加后减少,然后快速上升,在第18天达到最大,第18~21天快速下降,之后波动下降。因此,北方五粮浓香与四川泸型浓香二者在糟醅发酵过程中的乙酸变化规律有较大差异。
由图8b可知,六个位置点的丙酸含量在发酵0~23 d都处于增长态势,其中TC点比TO点增速快,MC点比MO点增速快,BC点与BO点变化接近。发酵23 d后六个位置点的丙酸含量都有一个回落,之后又有一个小幅上升态势,发酵结束时TC点丙酸含量为(12.4±1.2)mg/100 g,高于TO点[(11.4±1.4)mg/100 g],MC、MO、BC与BO点丙酸含量相近,约为9.0 mg/100 g。
由图8c可知,发酵前49 d,上层糟醅和中层糟醅各自的两个位置点丁酸含量几乎处于同步变化状态,发酵49 d之后直至结束,除MC点之外的其他三个点都发生了明显升高。发酵结束时,TC点丁酸含量为(1.6±0.2)mg/100 g,高于TO点[(0.9±0.1)mg/100 g];MO点丁酸含量为(3.0±0.3)mg/100 g,远高于MC点;BO点丁酸含量为(16.7±1.9)mg/100 g,明显高于BC点[(12.5±1.4)mg/100 g]。对照图8b可知,BC与BO点在发酵0~37 d的丁酸与己酸含量变化曲线非常相似,BC点是先升高后降低再升高,BO点是先降低后升高再降低再升高。发酵37 d直至结束,无论是己酸还是丁酸含量,BO点含量都要明显高于BC点。
由图8d可知,底层糟醅己酸含量明显高于中、上层,这是因为下层糟醅厌氧程度更高,更有利于己酸菌等厌氧菌在底层糟醅中代谢产生己酸。出窖时,TO点己酸含量为(8.0±1.2)mg/100 g,明显高于TC点[(6.8±0.9)mg/100 g];MO点己酸含量为(11.3±1.7)mg/100 g,明显高于MC点[(4.0±0.5)mg/100 g];BO点己酸含量为(28.1±3.9)mg/100g,明显高于BC点[(16.2±2.2)mg/100 g]。由此可以得出,靠近窖泥的窖边点己酸含量明显高于中心点。
2.2.4 不同空间层次糟醅中甲醇及杂醇油含量的变化分析
白酒糟醅在发酵过程中会产生少量的甲醇和杂醇油,甲醇为白酒中的有害成分,过量会引起人的失明或死亡。杂醇油为白酒中不可缺少的香味物质,但含量过高,与酸、酯等成分比例不协调,导致白酒含有异杂味[40]。糟醅中被检测到的正丙醇、正丁醇、异丁醇、异戊醇、仲丁醇等这些三个碳链以上的一价醇类统称为杂醇油,一般由原料中的氨基酸发酵而生成,是形成白酒独特风味的重要成分之一[33]。本试验中主要跟踪检测了异丁醇、正丙醇、仲丁醇、异戊醇、正丁醇和正己醇等含量变化,结果见图9,由于正己醇含量较低运用本试验中前处理和检测方法未能有效提取和检测到,故暂不做分析研究。
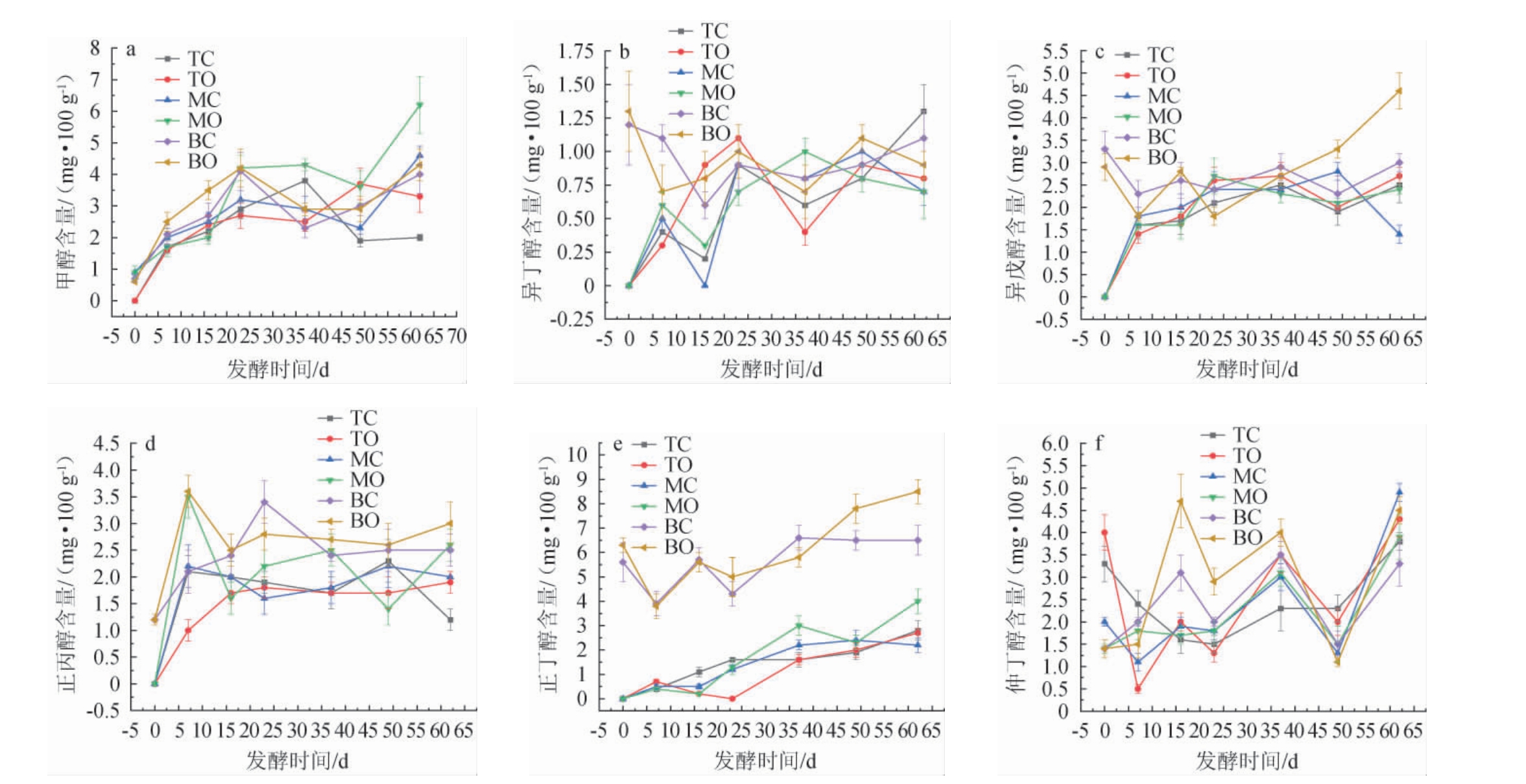
图9 不同空间层次糟醅甲醇及杂醇油含量的变化
Fig.9 Changes of methanol and fusel oil contents in fermented grains at different spatial levels
由图9a可知,六个位置点甲醇含量在发酵0~23 d都是呈缓慢升高趋势,其中MO点增幅明显高于MC点。发酵23 d后直至结束,TC与TO点的变化趋势完全不同,MC与MO点变化趋势完全一致,BC与BO点甲醇含量的变化趋势基本一致。出窖时TO点甲醇含量为(3.3±0.5)mg/100 g,高于TC点[(2.0±0.1)mg/100 g];MO点甲醇含量为(6.2±1.0)mg/100 g,高于MC点[(4.6±0.3)mg/100 g];BO点甲醇含量为(4.4±0.8)mg/100 g,高于BC点的[(4.0±0.6)mg/100 g]。由此得出,出窖时窖边点甲醇含量明显高于中心点。
由图9b可知,TC、TO、MC和MO四个位置点异丁醇含量呈波浪式上升,BC与BO点呈波浪式下降,出窖时TC点异丁醇含量为(1.3±0.2)mg/100 g,明显高于TO点[(0.8±0.2)mg/100 g],BC点异丁醇含量为(1.1±0.2)mg/100 g,明显高于BO点[(0.9±0.2)mg/100 g],MC点与MO点异丁醇含量相同,均为0.7 mg/100 g。
由图9c可知,TC、TO、MC和MO四个位置点的异戊醇含量在发酵0~7 d呈快速上升趋势,7~23 d继续缓慢上升。BC与BO点则在发酵0~7 d快速下降,7 d之后呈波浪式上升。发酵终点时,TO点异戊醇含量为(2.8±0.2)mg/100 g,高于TC点[(2.5±0.4)mg/100 g];MO点异戊醇含量为(2.4±0.1)mg/100 g,明显高于MC点[(1.4±0.2)mg/100 g];BO点异戊醇含量为(4.6±0.4)mg/100 g,明显高于BC点[(3.0±0.2)mg/100 g]。由此得出,出窖时窖边点的异戊醇含量明显高于同层中心点。
由图9d可知,TC、TO、MC、MO、BC和BO六个位置点正丙醇含量在发酵0~7 d都呈快速升高趋势,之后呈无规律变化状态。在发酵结束时,TO点正丙醇含量为(1.9±0.2)mg/100 g,明显高于TC点[(2.5±0.4)mg/100 g];MO点正丙醇含量为(2.6±0.3)mg/100 g,明显高于MC点[(2.0±0.0)mg/100 g];BO点正丙醇含量为(3.0±0.4)mg/100 g,明显高于BC点[(2.5±0.3)mg/100 g]。由此得出,出窖时同层糟醅窖边点正丙醇含量都明显高于中心点,与异戊醇变化一致。
由图9e可知,底层糟醅正丁醇含量明显高于中、上层糟醅,TC、TO、MC、MO四个位置点正丁醇含量都是呈缓慢上升趋势,发酵终点含量明显高于发酵起始点,出窖时MO点正丁醇含量为(4.0±0.7)mg/100 g,明显高于MC点[(2.2±0.3)mg/100 g];BC与BO点又经过一个轮次的完整发酵,出窖时的正丁醇含量都高于起始点的含量,发酵结束时BO点正丁醇含量为(8.5±1.1)mg/100 g,明显高于BC点[(6.5±0.7)mg/100 g]。
由图9f可知,上层糟醅(TC与TO)经过一个周期发酵其仲丁醇含量未发生明显变化,但中层和底层糟醅仲丁醇含量经过一个周期发酵,都发生了明显的升高:MC与MO点仲丁醇含量分别增长了1.45倍和1.78倍,BC与BO点仲丁醇含量分别增长了1.4倍和2.21倍,其中BC点增长幅度最大。
3 结论
通过对北方浓香型白酒发酵过程中糟醅理化指标和主要香味物质变化规律的研究,分析整个发酵周期糟醅的水分、酸度、淀粉、残糖等理化指标和酸、酯、醇、醛等风味物质含量的变化情况,结果发现不同空间层次六个位置点糟醅的理化指标和风味物质变化都呈现一定的规律。糟醅中水分、酸度、淀粉、丁酸、己酸、异戊醇、正丁醇含量在中、上层四个位置点的变化规律基本一致且与底层两个位置点的完全不同。糟醅中残糖、乳酸乙酯、乙醛、乙酸、丙酸和甲醇含量在六个位置点变化规律基本一致,而乙缩醛、异丁醇、正丙醇和仲丁醇在各个位置点变化却各有差异。己酸乙酯和丁酸乙酯在其中三个位置点均未检出,另外三个点有较大差异。底层的己酸和正丁醇含量明显高于中、上层,中、上层的乳酸乙酯增幅远大于底层,中、底层仲丁醇含量明显升高而上层无明显变化。中、底层中心点残糖含量明显高于窖边点,同层中心点与窖边点淀粉含量无明显差异,同层窖边点甲醇、己酸、正丙醇和异戊醇含量明显高于中心点,而异丁醇相反。己酸乙酯和丁酸乙酯主要依靠底层和中层窖边点糟醅在发酵中后期生成。
由此可见,北方浓香型白酒发酵过程中,可通过不同空间层次糟醅的理化指标和主要香味物质含量的变化规律来全方位判定糟醅发酵和代谢产物生成的情况,为北方浓香型白酒生产过程控制提供数据和理论支持。
[1]林生旺,邓洁,邹强,等.北方浓香酒企突出重围的思考[J].酿酒,2021,48(6):19-23.
[2]马飞,张智洋,刘红微.河套淡雅浓香型白酒工艺特点研究[J].酿酒,2015,42(6):41-43.
[3]ZHANG W X,QIAO Z W,SHIGEMATSU T,et al.Analysis of the bacterial community in Zaopei during production of Chinese Luzhou-flavor liquor[J].J I Brewing,2005,113(1):215-222.
[4]LIU J,WU Q,WANG P,et al.Synergistic effect in core microbiota associated with sulfur metabolism in spontaneous Chinese liquor fermentation[J].Appl Environ Microbiol,2017:AEM.01475-17.
[5]HU X,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016:2506.
[6] YAN S, WANG S, WEI G, et al.Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J].J I Brewing,2015,121(1):145-154.
[7]张文学,岳元媛,向文良,等.浓香型白酒酒醅中化学物质的变化及其规律性[J].四川大学学报(工程科学版),2005,37(4):44-48.
[8]ZHANG Y,ZHU X,LI X,et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strong-flavored liquor[J].BMC Microbiol,2017,17(1):196.
[9]HAN S,ZHANG W,LI P,et al.Characterization of aromatic liquor by gas chromatography and principal component analysis[J].Anal Lett, 2016,50(5):777-786.
[10]沈才萍,李喆,敖宗华,等.泸型酒生产中不同层糟醅微生物与白酒风味的关系[J].四川理工学院学报(自然科学版),2013,26(5):14-18.
[11]王思浓,张宿义,钟世荣,等.泸型酒新老窖池酒醅理化指标变化的分析研究[J].酿酒科技,2023(4):58-64.
[12]刘学国.浓香型白酒窖壁酒醅的理化指标及风味成分变化规律研究[J].食品安全导刊,2018(35):76.
[13]敖灵,梅军兰,郎召伟,等.泸型酒酿造过程中各层酒醅挥发性物质变化规律[J].中国酿造,2022,41(5):28-33.
[14]卫春会,郑自强,李浩,等.浓香型白酒酒醅发酵过程中风味物质时空差异分析[J].食品与发酵工业,2022,48(5):240-246.
[15]张霞,王中凯,郑佳,等.浓香型白酒发酵过程中酒醅理化指标变化规律研究[J].酿酒科技,2021(10):53-56.
[16]余松柏,赵小波,田敏,等.近红外光谱技术在快速检测白酒酒醅中的应用[J].酿酒科技,2021(2):59-64.
[17]姜福州,高景,尹家利,等.近红外光谱仪在白酒酒醅检测中的应用[J].检验检疫学刊,2020,30(3):34-36.
[18]韩旭,吴丽华,巩子路,等.气相色谱法测定酒醅中己酸的含量[J].酿酒,2021,48(6):113-115.
[19]王乐.基于微生物多样性分析探究北方浓香型白酒高级醇含量偏高的原因及解决措施[D].呼和浩特:内蒙古农业大学,2022.
[20]宋建阳,梁莉莹,岑定运,等.浓香型白酒发酵过程中酒醅微生物群落结构解析及其与风味物质的相关性[J].食品研究与开发,2023,44(14):86-92.
[21]朱明,殷红,靳喜庆,等.气相色谱-氢火焰离子化检测器法测定白酒中50种风味物质[J].中国酿造,2021,40(5):168-172.
[22]唐贤华,赵东,杨官荣,等.浓香型白酒发酵糟醅的质构特性与发酵参数分析[J].酿酒,2013,40(6):53-56.
[23]李璇,戚居胜,韩四海,等.浓香型白酒杜康酒醅发酵过程中理化指标变化规律[J].食品与发酵工业,2019,45(11):52-57.
[24]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:154-158.
[25]赖登燡,薛常有,潘华文.入窖七因素的变化规律及相互关系的研究(四):入窖酸度[J].酿酒科技,2011(4):43-45.
[26]王鹏,蒋超,常强,等.绵甜型白酒酿造过程中酒醅理化指标的变化规律[J].酿酒科技,2019(3):59-64.
[27]梁晓静.浓香型酒醅窖期发酵参数变化规律研究[J].酿酒科技,2011(1):65-67.
[28]黄治国,侯海波,罗惠波,等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造,2012,31(7):107-110.
[29]杨静,宰红玉,万春环,等.浓香型白酒窖池内酒醅成分动态分析研究[J].酿酒,2018,45(1):55-59.
[30]宫俐莉,李安军,孙金沅,等.溶剂辅助风味蒸发法与顶空-固相微萃取法结合分析白酒酒醅中挥发性风味成分[J].食品与发酵工业,2016,42(9):169-177.
[31]晋湘宜,蔡开云,陈萍,等.中国白酒酿酒微生物研究概述[J].酿酒,2020,47(5):16-21.
[32]李慧星,姚涵译,许彬,等.浓香型白酒酒醅微生物与酯类成分关联性定量模型的建立[J].中国酿造,2022,41(7):51-57.
[33]高江婧,任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.
[34]张卫卫,刘建学,韩四海,等.白酒基酒中醛类物质的傅里叶变换近红外光谱检测[J].食品科学,2016,37(6):111-115.
[35]宋波.白酒中各种成分对酒质的影响[J].酿酒科技,2011(12):65-67.
[36]周新虎,陈翔,杨勇,等.浓香型白酒窖内参数变化规律及相关性研究(Ⅲ):风味物质[J].酿酒科技,2012(6):47-51.
[37]刘凡,周新虎,陈翔,等.洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J].微生物学报,2018,58(12):2087-2099.
[38]陆其刚,甘广东,张广松,等.浓香型白酒酒醅发酵体系参数变化相互关系的分析研究[J].酿酒科技,2016(10):45-47,52.
[39]徐勇,郎召伟,沈咪娜,等.泸型酒酿造过程中上层和下层酒醅的有机酸变化分析[J].四川理工学院学报(自然科学版),2018,31(5):14-18.
[40]赵蒙,孙安,陈龙.发酵酒中高级醇的研究进展[J].中国酿造,2023,42(5):9-14.