浓香型大曲是用于酿造浓香型白酒的发酵剂,主要由小麦制成。小麦含有淀粉、蛋白质和非淀粉多糖等成分。谷物非淀粉多糖主要是β-葡聚糖,存在于糊粉层细胞壁中[1];淀粉内部的交联方式使其紧密包裹,影响淀粉的释放和降解[2];谷物非淀粉多糖还包括纤维素和半纤维素,而半纤维素、纤维素和木聚糖等又与淀粉存在不同程度交联结合,因此它们的降解可以进一步促进包埋淀粉的释放[3]。制作浓香大曲的过程利用微生物分泌各种酶对谷物多糖和蛋白质的降解,大曲中富含多糖降解等功能微生物群体,形成适合浓香型白酒酿造的自然复合体。研究发现,酒曲中富集淀粉酶、葡聚糖酶、木聚糖酶和蛋白酶等功能酶[4-5]。淀粉酶在大曲液化和糖化过程中起主要作用,对大曲质量有显著影响。研究表明,淀粉酶是大曲中的优势功能酶系[6-8]。宏转录组分析显示,在浓香型大曲中,α-内切淀粉酶的表达水平最高,其每千基对每百万读数(reads per kilobase million,RPKM)为465.7[9],说明其在系统中扮演重要角色。木聚糖酶能直接水解木聚糖生成低聚物[10-12],在酿酒业应用广泛[13]。β-葡聚糖酶能降低黏度[14]、破坏细胞壁结构,促进淀粉降解[15],提高白酒发酵产率。当前,这些功能酶系的研究主要关注它们在单一多糖降解中的协同作用,如纤维素酶、葡萄糖苷酶和内切胶凝酶[16]对纤维素的降解,内切木聚糖酶和β-糖苷酶[17]对木聚糖的降解,α-淀粉酶、β-淀粉酶和葡萄糖淀粉酶[18]对淀粉的降解。
大曲中酶系的研究至关重要,研究各种酶的协同作用也是必要的,范伟业[19]通过宏蛋白组学发现,在浓香大曲中检测到了922种酶,主要来自植物、动物和微生物。其中微生物酶占绝大多数(868种),反映了制作浓香大曲的复杂微生态环境。WANG B W等[6]基于蛋白质组学分析,建立的白酒发酵过程中酶系溯源分析结果显示:酒曲来源多个糖化酶的协同作用,优化糖化酶配比有利于提高乙醇发酵效率;王述荣等[20]利用从酒曲酒醅中筛选到的酵母菌、根霉菌和红曲霉生产复合酶制剂,并用于白酒生产中,结果显示复合酶制剂可提高出酒率7.21%,但是这些研究也只是研究一大类酶的协同降解作用和复合酶制剂对白酒生产的应用,不能清晰展示和比较其中关键酶的贡献,更不能深入解析大曲来源酶系的协同重要功能。GUO W Z等[21]通过蛋白组学分析,确认参与淀粉降解的关键酶主要是葡萄糖淀粉酶、α-淀粉酶和酸性α-淀粉酶,再通过在体外调节这些酶的比例,发现适量增加α-淀粉酶或酸性α-淀粉酶可以提高淀粉的降解效率;WANG J Y等[22]通过异源表达发现,8种编码α-淀粉酶对淀粉糖化的协同作用,SAHNOUN M等[23]从一种新分离的米曲霉中生产、纯化和表征了2种α-淀粉酶亚型(AmyA和AmyB),它们在淀粉糖化过程中表现出显著的协同效应。即使具有相同降解模式的酶也可能展现协同作用[24-25]。
前期研究基于宏转录组数据获取的酶基因信息,利用异源表达和亲和层析法,已成功获得浓香型大曲性能优异的耐高温的α-淀粉酶和内切葡聚糖酶[26-28],这些酶在淀粉和麦芽寡糖的水解中表现出不同的催化效率。此外来源于Thermoanaerobacteriumbryantiimel9T的木聚糖酶(TbXyn10A)及木糖苷酶(TbXyl39A、TbXyl52A)具有较好的木聚糖协同降解作用[29]。因此,本实验旨在研究α-淀粉酶和内切葡聚糖酶与木聚糖酶系的活性,并探究其在小麦降解中的协同作用。通过考察酶系及其不同酶的复配对小麦的降解情况,以及分析酶系与小麦降解的关系,以期优化大曲酶配方,提高白酒产量和品质。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒和菌株
pGAPZαA质粒、pET28a(+)质粒:北京全式金生物技术有限公司;pET-46Ek/LIC质粒:德国默克生物科学公司;大肠杆菌(Escherichia coli)DH5α、大肠杆菌(E.coli)BL21(含淀粉酶和葡聚糖酶基因NFAmy13B、NFEg16A)、毕赤酵母(Pichia pastoris)X33(酶基因NFAmy13A)、CodonPlus(DE3)RIPL大肠杆菌(E.coli)BL21表达菌(含酶基因TbXyn10A、TbXyl39A和TbXyl52A):本实验室保藏。
1.1.2 化学试剂
偶氮蓝交联(azurine crosslinked,AZCL)-葡聚糖、AZCL-直链淀粉、AZCL-木聚糖:爱尔兰Megazyme公司;高纯度低电渗琼脂糖:北京擎科生物科技股份有限公司;镍(Ni)-氮川三乙酸(nitrilotriacetic acid,NTA)SefinoseTM琼脂糖纯化树脂、SefinoseTMCL-6B交联琼脂糖凝胶:上海生工生物工程有限公司;卡那霉素、氨苄青霉素钠、博来霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、咪唑(均为分析纯):北京索莱宝科技有限公司。
1.1.3 培养基
LB液体培养基:5 g/L NaCl、10 g/L蛋白胨、5 g/L 酵母浸提物。121 ℃灭菌20 min。
LB固体培养基:LB液体培养基中加入15 g/L琼脂粉。121 ℃灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:1%酵母膏,2%蛋白胨,2%葡萄糖。121 ℃灭菌20 min。
YPD固体培养基:YPD液体培养基中加入1.5%琼脂粉。121 ℃灭菌20 min。
含卡那霉素、氨苄青霉素LB固体培养基:LB固体培养基中分别加入25 μg/mL卡那霉素、100 μg/mL氨苄青霉素。121 ℃灭菌20 min。
含博来霉素YPD固体培养基:YPD固体培养基中加入300 μg/mL博来霉素。
0.1%偶氮蓝交联-直链淀粉(AZCL-Amylose)、0.1%偶氮蓝交联-大麦-β-葡聚糖(AZCL-barley-β-glucan)、0.1%偶氮蓝交联-木聚糖(AZCL-Xylan)琼脂平板:25%Stock solution原液(0.58%磷酸、0.46%冰乙酸、0.496%硼酸)、1%高纯度低电渗琼脂糖中分别加入0.1%偶氮蓝交联-直链淀粉、0.1%偶氮蓝交联-大麦-β-葡聚糖、0.1%偶氮蓝交联-木聚糖,混匀。
1.2 仪器与设备
754N紫外分光光度仪:上海奥谱勒仪器有限公司;Legend Micro17台式低温离心机:美国Thermo Scientific公司;VCx500超声波细胞破碎机:美国Sonics&Materials公司;ReadMax 1200酶标仪:上海闪谱生物科技有限公司;IS-RDS3叠加式全温摇床:广州深华公司;JY300HE凝胶电泳仪、JY-SPCT电泳槽:北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 酶基因的诱导表达
分别在含卡那霉素和氨苄青霉素的LB固体培养基上划线含目的基因(pET28a+-NFAmy13B和-NFEg16A)E.coli BL21,37 ℃静置培养过夜。单克隆接种对应抗生素的LB液体培养基中,37 ℃、200 r/min振荡培养过夜。以0.1%接种量接种于200 mL LB液体培养基中,当OD600 nm值达0.6时加入IPTG诱导表达,16 ℃、200 r/min继续诱导培养24~25 h,得到含有可溶目的蛋白的菌液。
在含博来霉素的YPD固体培养基上划线含目的基因(pGAPZαA-NFAmy13A)的P.pastoris X33,30 ℃静置培养23 d。单克隆接种博来霉素YPD液体培养基中,30 ℃、250 r/min振荡培养过夜。以0.1%接种量接种于YPD液体培养基,30 ℃、200 r/min振荡培养2 d,得到含有目的蛋白的菌液。
在含氨苄青霉素钠和博来霉素的LB固体培养基上划线含目的基因(pET-46Ek/LIC-TbXyn10A、-TbXyl39A和-TbXyl52A)的CodonPlus(DE3)RIPL大肠杆菌(E. coli)BL21表达菌,37 ℃静置培养过夜。挑取单克隆菌落接种于含相同抗生素的10 mL LB,37 ℃、250 r/min振荡培养6 h。将上述预培养液接种于含相同抗生素的1 L LB液体培养基中,当OD600 nm值达0.3时加入IPTG,16 ℃、250 r/min振荡培养16 h,得到含有可溶目的蛋白的菌液。
1.3.2 蛋白的纯化与鉴定
将诱导的E.coliBL21菌液离心,用Tris缓冲液(50mmol/L Tris-HCl,300 mmol/L NaCl,pH7.5)重悬菌体,在4 ℃超声破碎30 min得裂解液。对于耐热蛋白,可在60 ℃高温处理裂解液去除热敏蛋白,12 000 r/min离心20 min除去细胞碎片。裂解液上清经Ni-NTA亲和层析柱纯化得重组蛋白。
对Pichia pastoris X33表达的重组蛋白,先离心,取培养液上清,再进行热处理(55 ℃水浴15 min)和冷处理(冰上冰浴10 min),浓缩后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定蛋白分子质量大小,最后与甘油混合保存。
1.3.3 酶活检测
将20 μL的α-淀粉酶(NFAmy13B:148 μmol/L和NFAmy13A:23 μmol/L)和内切β-葡聚糖酶(1 003 μmol/L)纯蛋白直接添加至含有0.1%偶氮蓝交联-直链淀粉(AZCLAmylose)和0.1%偶氮蓝交联-大麦-β-葡聚糖(AZCL-barleyβ-glucan)琼脂平板中,分别在37 ℃和60 ℃下孵育12 h和2 h。因为偶氮蓝染料被交联到底物上,当底物被特定的酶分解时,偶氮蓝染料被释放。交联染料的底物在水中不溶,但在酶作用下会释放出可溶性的蓝色产物,蓝色越深,圈越大,说明酶活性越高。进而初步确定两种淀粉酶和β-葡聚糖酶的活性。将20 μL的木聚糖酶(TbXyn10A)(462 μmol/L)、木糖苷酶(TbXyl39A)(447 μmol/L)和木糖苷酶(TbXyl52A)(438 μmol/L)纯蛋白及两两复配的酶添加至含有0.1%偶氮蓝交联-木聚糖(AZCL-Xylan)的固体平板中,37 ℃孵育3 h,观察固体酶活板中水解圈颜色和大小,初步确定木聚糖酶、木糖苷酶和两种酶复配的活性。样品编号设置A:α-淀粉酶NFAmy13B;B:α-淀粉酶NFAmy13A;C:β-葡聚糖酶NFEg16A;D:内切木聚糖酶和木糖苷酶。a:TbXyl39A;b:TbXyl52A;c:TbXyn10A;d:TbXyl39A+TbXyl52A;e:TbXyn10A+TbXyl39A;f:TbXyn10A+TbXyl52A。
1.3.4 不同酶及不同反应时间对小麦粉碎物降解的影响
(1)不同酶对小麦粉碎物降解的影响
首先小麦通过粉碎机粉碎,再过50目筛子,得到小麦粉碎物。小麦粉碎物加水,得到质量浓度为0.4 g/mL小麦粉碎物反应底物。在250 μL小麦粉碎物反应底物中分别添加1μg纯蛋白NFAmy13B、NFAmy13A、NFEg16A、TbXyn10A、TbXyl39A和TbXyl52A,在50 ℃和800 r/min 条件下反应4 h。反应结束后,在8 000 r/min离心1 min,取50 μL上清,并用pHBAH法检测其还原糖含量。
(2)不同反应时间对小麦粉碎物降解的影响
相同酶量的NFAmy13B、NFAmy13A和NFEg16A与250μL小麦粉碎物反应底物(0.4g/mL)混合后,分别在50℃、800 r/min下反应2 h、4 h和8 h。反应结束后,在8 000 r/min离心1 min,取50 μL上清,用pHBAH法检测其还原糖含量。
1.3.5 不同酶及添加量对小麦粉碎物降解的影响
将不同含量的NFAmy13B(0、0.005 μg、0.01 μg、0.05 μg、0.1 μg、0.2 μg、0.25 μg)与250 μL小麦粉碎物(0.4 g/mL)混匀后在50 ℃下反应4 h,通过测定其产物还原糖含量,确定NFAmy13B最佳添加量;将0.005 μg 的NFAmy13B与不同含量的NFAmy13A(0、0.1 μg、0.3 μg、0.5 μg)复配,考察两种酶不同条件下对小麦粉碎物降解的协同作用,并确定NFAmy13A的复配酶量;将0.005 μg 的NFAmy13B与不同含量NFEg16A(0、0.05 μg、0.3 μg、1 μg)复配,检验两种酶不同条件下对小麦粉碎物降解的协同作用,并确定NFEg16A的复配酶量;将0.005 μg 的NFAmy13B与不同含量TbXyn10A(0、0.05 μg、0.2 μg、0.4 μg)混合,检验两种酶不同组合对小麦粉碎物降解的协同作用,并确定TbXyn10A的复配酶量。
1.3.6 木聚糖酶和木糖苷酶对木聚糖降解的协同作用研究
先分别将0.425 μg的TbXyn10A、TbXyl39A、TbXyl52A与桦木木聚糖溶液(5 mg/mL)反应,再将相同添加量的TbXyn10A、TbXyl39A、TbXyl52A进行不同组合与桦木木聚糖溶液(5 mg/mL)在50 ℃反应4 h,组合分别为TbXyn10A与TbXyl39A、TbXyn10A与TbXyl52A、TbXyn10A与TbXyl39A和TbXyl52A。通过还原糖含量测定检验3种酶对桦木木聚糖底物的协同降解作用。
1.3.7 淀粉酶、葡聚糖酶、木聚糖酶和木糖苷酶对小麦粉碎物的协同降解
开展一系列酶及其组合对250μL小麦粉碎物(0.4g/mL)的降解实验。先分别将单个NFAmy13B(0.005μg)、NFAmy13A(0.3 μg)、NFEg16A(0.3 μg)、TbXyn10A(0.5 μg)、TbXyl39A(0.5μg)或TbXyl52A(0.5μg)与250μL小麦粉碎物(0.4 g/mL)在50 ℃反应4 h。再将不同酶的不同组合进行250 μL小麦粉碎物(0.4 g/mL)的降解实验,各酶添加量与上述相同,组合包括:NFAmy13B和NFAmy13A;NFAmy13B、NFAmy13A和NFEg16A;NFAmy13B、NFAmy13A、NFEg16A和TbXyn10A;NFAmy13B、NFAmy13A、NFEg16A、TbXyn10A和TbXyl39A;NFAmy13B、NFAmy13A、NFEg16A、TbXyn10A、TbXyl39A和TbXyl52A。各酶添加量情况见表1。通过测定小麦降解实验的还原糖含量,确认它们的降解作用,并对结果进行显著性分析。
表1 大曲复合酶系对小麦协同降解的各种酶添加量
Table 1 Addition of various enzymes in the synergistic degradation of wheat by Daqu complex enzyme system
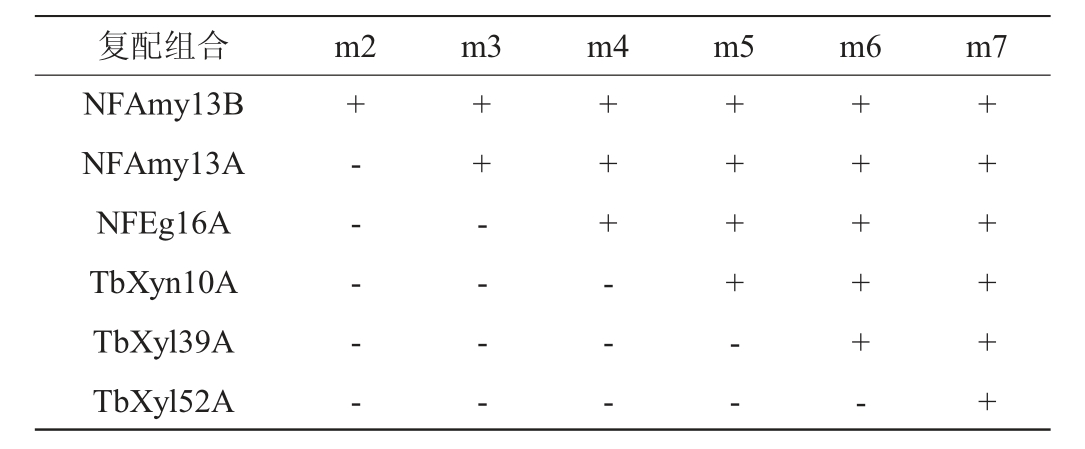
注:“+”表示加入了对应的酶;“-”表示未加入对应的酶。
复配组合 m2 m3 m4 m5 m6 m7 NFAmy13B NFAmy13A NFEg16A TbXyn10A TbXyl39A TbXyl52A+- - - - -++ - - - -++ + - - -++ + + - -++ + + + -++++++
1.3.8 数据处理
采用Excel 2021软件处理数据,使用SPSS 22.0软件对数据结果进行分析,采用Origin 2018软件绘图。
2 结果与分析
2.1 SDS-PAGE凝胶电泳与酶活检测
根据其氨基酸序列来预测分子质量,NFAmy13B、NFAmy13A、β-葡聚糖酶NFEg16A、TbXyn10A、TbXyl39A、TbXyl52A的分子质量分别约为61×103 Da、58×103 Da、34×103 Da、52.5×103 Da、99.5×103 Da、125.1×103 Da。纯化蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)结果见图1。由图1可知,NFAmy13B、NFAmy13A、β-葡聚糖酶NFEg16A、TbXyn10A、TbXyl39A、TbXyl52A 的 实 际 分 子质量大小分别与预测值相当。
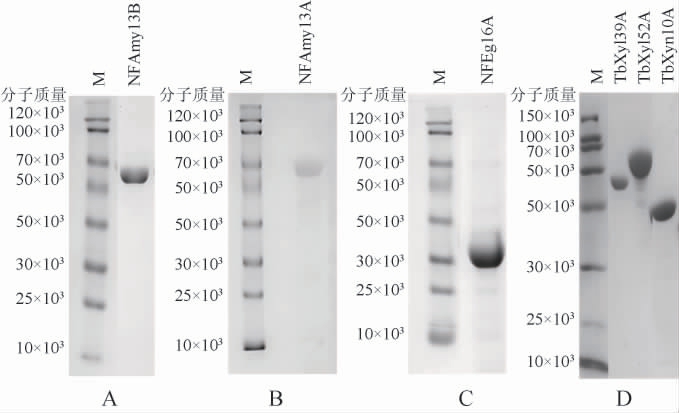
图1 纯化蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析结果
Fig.1 Analysis results of purified proteins by sodium dodecyl sulfate-polyacrylamide gel electrophoresis
因为偶氮蓝染料被交联到直链淀粉上,当直链淀粉被特定的酶分解时,偶氮蓝染料被释放。交联染料的底物在水中不溶,但在酶作用下会释放出可溶性的蓝色产物,蓝色越深,说明酶活性越高。不同的酶及其组合酶活检测结果见图2。
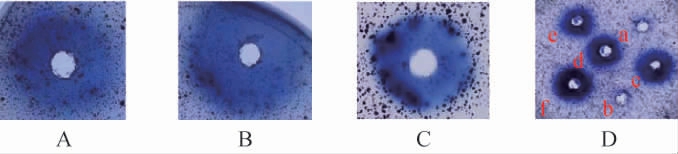
图2 不同酶及其组合酶活检测结果
Fig.2 Detection results of enzyme activities of different enzyme and their combinations
A:添加NFAmy13B;B:添加NFAmy13A;C:添加NFEg16A;
D:a:TbXyl39A;b:TbXyl52A;c:TbXyn10A;d:TbXyl39A+TbXyl52A;
e:TbXyn10A+TbXyl39A;f:TbXyn10A+TbXyl52A。
由图2A和2B可知,NFAmy13B和NFAmy13A均在含有AZCL-Amylose的琼脂糖平板上形成蓝色透明圈,表明它们具有水解淀粉的能力,酶活性较高。由图2C可知,在60 ℃反应12 h后形成蓝色圈,大麦-β-葡聚糖被NFEg16A分解,基于同样原理,由图2D可知,TbXyn10A在含有AZCL-barleyβ-glucan的琼脂板上产生明显的蓝色圈,也表明NFEg16A具有水解大麦-β-葡聚糖的能力,且酶活性较高。与此同时在AZCL-木聚糖的平板上,TbXyn10A呈现明显蓝色圈,TbXyl39A产生较浅蓝色圈,而TbXyl52A几乎没有蓝色圈,说明TbXyn10A具有显著降解木聚糖的能力,TbXyl39A也有较低降解作用,而TbXyl52A几乎没有。TbXyl39A和TbXyl52A复配后能产生明显的蓝色圈(图2D中d组合),表明它们在木聚糖降解中协同作用;TbXyn10A和TbXyl39A复配产生的蓝色圈(图2D中e组合)与TbXyn10A产生的蓝色圈大小相近,表明它们在木聚糖降解中协同作用不明显。而TbXyn10A和TbXyl52A复配产生深蓝色圈比TbXyn10A产生的蓝色圈稍显大,说明TbXyn10A分解木聚糖产生的产物能被TbXyl52A进一步分解,表明它们在木聚糖降解中具有协同作用。TbXyn10A、TbXyl39A和TbXyl52A这些酶在特定条件下对木聚糖的降解显示出不同程度的水解活性,初步证实TbXyl39A和TbXyl52A或TbXyn10A和TbXyl52A的组合表现出协同作用。
2.2 不同酶和不同反应时间对小麦粉碎物底物降解的影响
小麦含有丰富的长链淀粉,约占小麦淀粉总量的70%~75%,而在浓香大曲中,NFAmy13B对长链淀粉催化效率更高,NFAmy13A主要水解麦芽寡糖[27]。前期预实验中,两个淀粉酶在8 h反应后还原糖含量增加不显著,所以在研究不同反应时间淀粉酶对小麦粉碎物降解实验中选择反应2 h、4 h、8 h。而其他非淀粉酶单独降解小麦粉碎物时,不同时间下无明显差异,最终只呈现了反应4 h结果。不同的酶在不同时间对小麦粉碎物底物的降解作用见图3。由图3可知,NFAmy13B在不同时间段均能降解小麦产生大量的还原糖,还原糖产物随着时间递增,在8 h产生的还原糖最高为37.29 mmol/L;最主要的NFAmy13B在不同时间段产生的还原糖均比NFAmy13A高,说明它们具有较高的淀粉降解能力,而且NFAmy13B比NFAmy13A高,这也与文献报道一致[27]。由图3亦可知,NFAmy13B和NFAmy13A对小麦粉碎物的水解在4~8 h内均没有明显的递增趋势,NFEg16A在4 h直接降解小麦产生的还原糖均较低(<2 mmol/L)。TbXyn10A、TbXyl39A、TbXyl52A的水解产物浓度分别为1.30 mmol/L、1.78 mmol/L、0.94 mmol/L。因此,确定各种酶的降解反应时间为4 h。
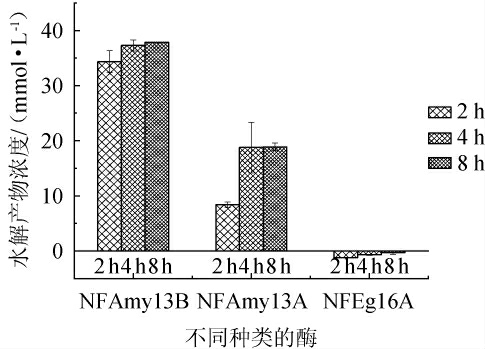
图3 不同酶在不同时间对小麦底物的降解作用
Fig.3 Degradation of wheat powder substrate by different enzyme at different time
2.3 不同酶及添加量对小麦粉碎物底物降解的影响
不同酶及添加量对小麦粉碎物底物降解的影响见图4。由图4A可知,随着NFAmy13B添加量增加,其水解小麦粉碎物的产物(还原糖)浓度增加,在添加量为0.005 μg时显著增加,而在添加量为0.05 μg之后,增加幅度放缓,其中当NFAmy13B添加量为0.005 μg时,产物浓度为25.7 mmol/L,表明微量NFAmy13B仍然能够降解小麦粉碎物,为了减少成本,保证效率,因此最后确定NFAmy13B的添加量为0.005 μg。在添加了0.005 μg NFAmy13B 的小麦粉碎物反应体系中,分别添加不同量的NFEg16A、NFAmy13A及TbXyn10A,在50 ℃反应4 h。由图4B可知,随NFEg16A添加量的增加,产生的还原糖含量不断增加,从35.4 mmol/L到62.5 mmol/L。前期实验证实NFEg16A单独降解小麦粉碎物的还原糖含量很少,因此可以合理推测,NFEg16A降解小麦中葡聚糖的同时能促进小麦中与葡聚糖交联淀粉的释放[2],进而提高了NFAmy13B对小麦粉碎物的降解效率,证实了它们的协同作用。与NFEg16A相类似,TbXyn10A单独降解小麦粉碎物时,产生的还原糖很少(图3),但增加其酶量,也能显著提高NFAmy13B对小麦粉碎物的降解作用,还原糖产物从35.4 mmol/L到50.9 mmol/L,这与文献[3]报道的半纤维素、纤维素和木聚糖的降解能通过促进包埋淀粉的释放从而促进淀粉的降解结果相一致。由图4C可知,随着NFAmy13A添加量的增加,NFAmy13B产生还原糖浓度从167.26 mmol/L提高至244.51 mmol/L。因此,NFAmy13A、NFEg16A及TbXyn10A,均与NFAmy13B在不同条件下有显著的协同作用。因此,在考虑成本的基础上,选择较低酶添加量,最后NFAmy13A和NFEg16A添加量为0.3 μg,TbXyn10A为0.5 μg,它们与NFAmy13B(0.005 μg)协同降解小麦得到的产物还原糖含量分别为204.82 mmol/L、58.3 mmol/L、50.9 mmol/L,分别获得较高的降解效率。其中NFAmy13A与NFAmy13B组合协同效应最佳,得到最高的还原糖产物量。
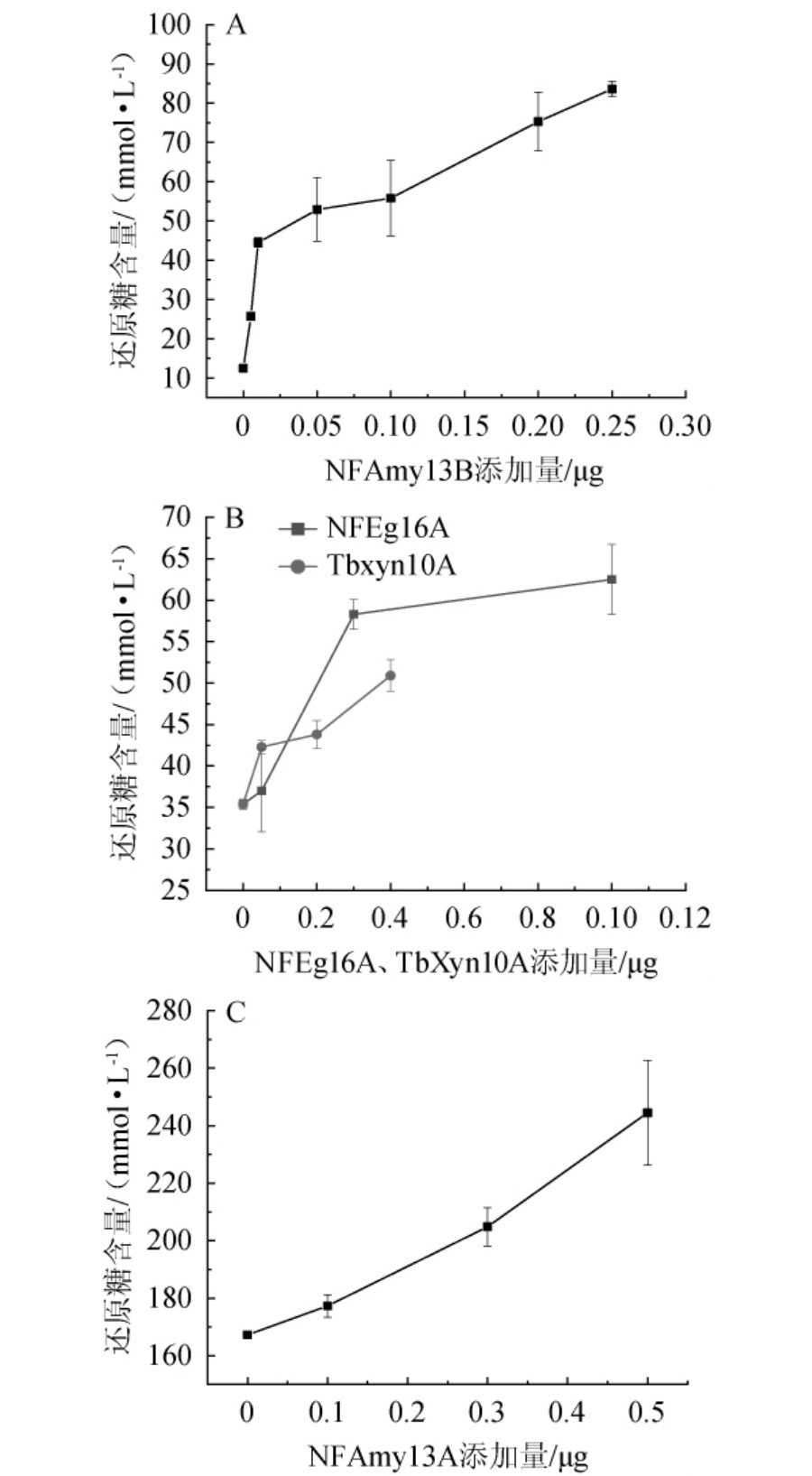
图4 不同酶及添加量对小麦粉碎物底物降解的影响
Fig.4 Effects of different enzymes and addition on degradation of wheat powder substrate
2.4 木聚糖酶系对底物木聚糖的协同降解的影响
木聚糖酶系对底物木聚糖的协同降解的影响见图5。由图5可知,TbXyn10A和TbXyl39A对桦木木聚糖降解后,产生的还原糖含量分别为3.57 mmol/L、3.40 mmol/L,而TbXyl52A作用产生的还原糖含量仅仅为0.20 mmol/L,说明TbXyn10A和TbXyl39A对桦木木聚糖表现出高水解作用,TbXyl52A几乎没有活性。但是在固体酶活实验中,TbXyn10A具有显著降解染料木聚糖的活性,TbXyl39A活性较小,TbXyl52A无活性。与文献[29]相一致,TbXyn10A是典型的木聚糖降解酶,TbXyl52A是典型木糖苷酶,不能降解木聚糖;而TbXyl39A除了是木糖苷酶[29],还能降解木聚糖,这可能与GH39家族能降解木聚糖成分相一致[31]。实验中合成底物AZCL-木聚糖是利用不溶的长链木聚糖包埋,它的降解反应是不溶长链木聚糖的降解作用;而天然桦木木聚糖底物含有不可溶长链木聚糖和可溶相对短小链的木聚糖,它的降解反应是这两种不同链长度的降解作用。因此可以合理推测,TbXyl39A能降解可溶的短小木聚糖,而TbXyn10A既能降解可溶的木聚糖,又可降解不可溶的木聚糖。与此类似,NFAmy13B主要专注于降解长链淀粉,而NFAmy13A则在高效降解短链淀粉方面发挥作用。
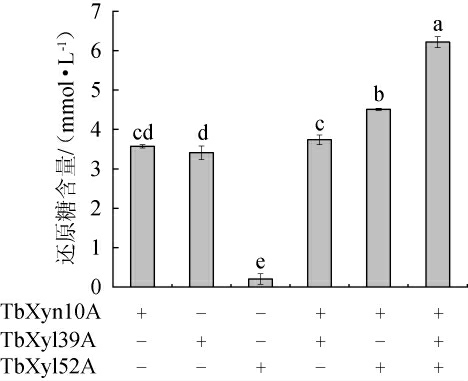
图5 TbXyn10A、TbXyl39A和TbXyl52A对桦木木聚糖降解的影响
Fig.5 Effects of TbXyn10A, TbXyl39A, and TbXyl52A on degradation of birchwood xylan
“+”表示加入了对应的酶;“-”表示未加入对应的酶。
不同小写字母表示差异显著(P<0.05)。下同。
当TbXyl39A与TbXyn10A复配时,增加的还原糖含量为3.57~3.73 mmol/L,再次说明它们存在竞争性协同作用,可能存在相同的降解底物。另一方面,TbXyl52A与TbXyn10A复配时,水解产物含量为4.51mmol/L,是TbXyn10A的1.26倍,该结果与2.1固体酶活实验结果(图2)一致,说明它们存在显著的协同作用,这与文献[29]报道的结果相一致,即TbXyn10A将木聚糖分解为较短得木聚寡糖,而TbXyl52A将木聚糖寡糖中的单个木糖分子从链的末端释放出来。当TbXyn10A、TbXyl39A和TbXyl52A一起复配时,TbXyn10A得到的水解产物含量提高到1.7倍。综上所述,TbXyn10A与TbXyl52A存在显著协同作用,TbXyn10A与TbXyl39A之间存在竞争性协同作用,三者组合之后,协同作用更明显。
2.5 大曲复合酶系对小麦底物协同降解
小麦是酿造白酒和制曲的主要原料,大曲复合酶系对小麦底物协同降解见图6。由图6可知,NFAmy13B单独作用于小麦时,降解得到的还原糖含量为5.12 mmol/L,NFAmy13A、TbXyn10A单独作用于小麦时,得到的还原糖的含量分别为0.60 mmol/L、1.72 mmol/L,而NFEg16A、TbXyl39A和TbXyl52A单独作用于小麦时,底物几乎没有被降解,所以,再次说明NFAmy13B单独作用小麦时,底物的水解效率最高。将NFAmy13B与NFAmy13A复配时,还原糖含量从5.12 mmol/L提高至7.54 mmol/L,水解产物还原糖含量提高了1.5倍。3种酶(NFAmy13B、NFAmy13A和NFEg16A)复配时,还原糖含量从5.12 mmol/L提高至13.40 mmol/L,产物含量提高了约2.6倍,表明它们具有协同作用。在3种酶(NFAmy13B、NFAmy13A和NFEg16A)基础上,再加入TbXyn10A进行复配时,还原糖含量为13.14 mmol/L,水解效率几乎不变。当TbXyl39A加入在四种酶组合(NFAmy13B、NFAmy13A、NFEg16A、TbXyn10A)时,还原糖含量为14.05 mmol/L,水解效率略有增加但不显著(P>0.05)。最后,当TbXyl52A加入5种酶组合(NFAmy13B、NFAmy13A、NFEg16A、TbXyn10A、TbXyl39A 和TbXyl52A)时,还原糖含量显著增加至14.64 mmol/L(P<0.05),相对于三种酶组合(NFAmy13B、NFAmy13A、NFEg16A)提高了约1倍。最后,6种酶的复配与NFAmy13B作用相比时,还原糖含量提高到约2.9倍。总体而言,6种酶在降解小麦粉碎物时,表明它们具有协同作用。所以,不同酶的复配对小麦粉碎物中还原糖的生成有显著协同作用,特别是NFAmy13B、NFAmy13A、NFEg16A、TbXyn10A、TbXyl39A 和TbXyl52A的组合,能显著提高水解效率。
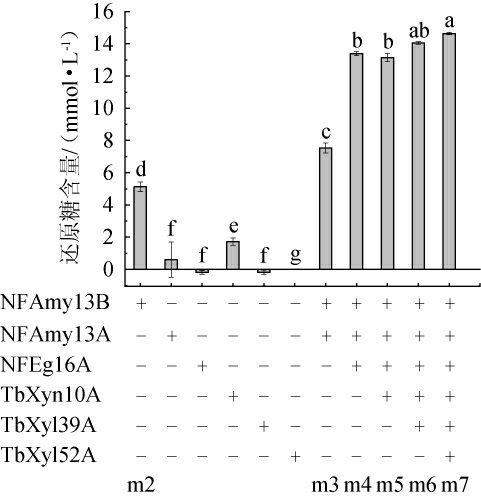
图6 大曲复合酶系对小麦底物协同降解
Fig.6 Synergistic degradation of wheat substrate by Daqu compound enzyme system
3 结论
大曲中的酶系对白酒风味至关重要。本研究通过从酒曲中筛选得到多个耐高温酶分子,包括α-淀粉酶NFAmy13B、NFAmy13A和内切葡聚糖酶NFEg16A。这些酶表现出较高的酶活性,并在小麦降解中展示了协同效应。NFAmy13B、NFAmy13A和TbXyn10A单独对小麦具有有效的降解能力,特别是NFAmy13B,单独作用时还原糖含量为5.12 mmol/L;当各酶进行复配时,NFAmy13A和NFEg16A可以提高NFAmy13B的降解效率,还原糖含量提升至7.54 mmol/L,增加了约2.6倍。进一步添加木聚糖酶TbXyn10A、TbXyl39A和TbXyl52A,小麦降解效率进一步提高,增加了约2.9倍左右。该研究强调了在优化复杂底物降解过程中,选择组合酶的重要性,并为工业酒精生产提供了实用策略,强调了提高效率和成本效益的潜力,为深入理解多酶协同降解机制及实际应用奠定了基础。
[1] LIU J Q, LIU W J, ZHU K.Throughfall kinetic energy and its spatial characteristics under rubber-based agroforestry systems[J].CATENA,2018,161:113-121.
[2]BURTON R A,FINCHER G B.(1,3;1,4)-β-D-glucans in cell walls of the poaceae, lower plants, and fungi: a tale of two linkages[J].Mol Plant,2009,2(5):873-882.
[3]CHRISTAKOPOULOS P,NERINCKX W,KEKOS D,et al.Purification and characterization of two low molecular mass alkaline xylanases from Fusarium oxysporum F3[J].J Biotechnol,1996,51(2):181-189.
[4] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[5] ZHENG X W, HAN B Z. Baijiu, Chinese liquor: History, classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[6]WANG B W,WU Q,XU Y,et al.Synergistic effect of multiple saccharifying enzymes on alcoholic fermentation for Chinese Baijiu production[J].Appl Environ Microbiol,2020,86(8):13-20.
[7]刘文虎,刘光钱,张芮,等.基于宏基因组解析中温大曲成熟前后的微生物群落功能差异[J/OL].生物工程学报:1-18[2024-01-31].https://doi.org/10.13345/j.cjb.230340.
[8]HE M W,JIN Y,LIU M M,et al.Metaproteomic investigation of enzyme profile in Daqu used for the production of Nongxiangxing Baijiu[J].Int J Food Microbiol,2023,400:110250.
[9] HUANG Y H, YI Z L, JIN Y L, et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese Nong-flavor liquor starter[J].Front Microbiol,2017,8:1747.
[10] CHAKDAR H,KUMAR M,PANDIYAN K,et al.Bacterial xylanases:biology to biotechnology[J].3 Biotech,2016,6(2):150.
[11]ALOKIKA,SINGH B.Production,characteristics,and biotechnological applications of microbial xylanases[J].Appl Microbiol Biot,2019,103(21-22):8763-8784.
[12] BEG Q K, KAPOOR M, MAHAJAN L, et al.Microbial xylanases and their industrial applications:a review[J].Appl Microbiol Biot,2001,56(3-4):326-338.
[13]郑彬,刘燕,张彩莹,等.酶制剂在玉米木薯混合原料酒精发酵中的应用研究[J].酿酒科技,2019(1):71-75,85.
[14] CELESTINO K R S, CUNHA R B, FELIX C R.Characterization of a β-glucanase produced by Rhizopus microsporus var.microsporus, and its potential for application in the brewing industry[J].BMC Biochem,2006,7(1):23.
[15]DE VRIES S,PUSTJENS A M,SCHOLS H A,et al.Effects of processing technologies combined with cell wall degrading enzymes on in vitro degradability of barley[J].J Anim Sci,2012,90(4):331-333.
[16]SRIVASTAVA N,SRIVASTAVA M,MISHRA P K,et al.Applications of fungal cellulases in biofuel production: Advances and limitations[J].Renew Sust Energ Rev,2018,82:2379-2386.
[17]JAMALDHEEN S B,THAKUR A,MOHOLKAR V S,et al.Enzymatic hydrolysis of hemicellulose from pretreated finger millet(Eleusine coracana) straw by recombinant endo-1,4-β-xylanase and exo-1,4-β-xylosidase[J].Int J Biol Macromol,2019,135:1098-1106.
[18]BRYJAK J.Glucoamylase,α-amylase and β-amylase immobilisation on acrylic carriers[J].Biochem Eng J,2003,16(3):347-355.
[19]范伟业.宏蛋白质组学解析浓香型大曲酶系组成[D].无锡:江南大学,2021.
[20]王述荣,陈翔,许乃义.YH-AM复合酶制剂在洋河大曲生产中的研究与应用[J].酿酒,2004,31(2):36-41.
[21]GUO W Z,YANG J H,HUANG T,et al.Synergistic effects of multiple enzymes from industrial Aspergillus niger strain O1 on starch saccharification[J].Biotechnol Biofuels,2021,14(1):225.
[22]WANG J Y,LI Y,LU F P.Molecular cloning and biochemical characterization of an α-amylase family from Aspergillus niger[J].Electron J Biot,2018,32:55-62.
[23] SAHNOUN M, BEJAR S, SAYARI A, et al.Production, purification and characterization of two α-amylase isoforms from a newly isolated Aspergillus oryzae strain S2[J].Process Biochem,2012,47(1):18-25.
[24] ZHANG S S, XU Z S, WANG T, et al.Endoglucanase improve the growth of homofermentative Lactobacillus spp.in ensilages[J].J Biotechnol,2019,295:55-62.
[25]MALGAS S,PLETSCHKE B I.The effect of an oligosaccharide reducing-end xylanase,BhRex8A,on the synergistic degradation of xylan backbones by an optimised xylanolytic enzyme cocktail[J].Enzyme Microb Tech,2019,122:74-81.
[26]CHEN L C,YI Z L,FANG Y,et al.Biochemical and synergistic properties of a novel alpha-amylase from Chinese nong-flavor Daqu[J].Microb Cell Factories,2021,20(1):80.
[27]YI Z L,FANG Y,HE K Z,et al.Directly mining a fungal thermostable α-amylase from Chinese Nong-flavor liquor starter[J].Microb Cell Factories,2018,17(1):30.
[28] ALI B, YI Z L, FANG Y, et al.Characterization of a fungal thermostable endoglucanase from Chinese Nong-flavor daqu by metatranscriptomic method[J].Int J Biol Macromol,2019,121:183-190.
[29] YI Z L,SU X Y,ASANGBA A E,et al.Xylan deconstruction by thermophilic Thermoanaerobacterium bryantii hemicellulases is stimulated by two oxidoreductases[J].Catalysts,2022,12(2):182.
[30]LIANG C N,ZHANG Y,JIA Y,et al.Engineering a carbohydrate-processing transglycosidase into glycosyltransferase for natural product glycodiversification[J].Sci Rep,2016,6(1):21051.
[31] MORRISON J M, ELSHAHED M S, YOUSSE N.A multifunctional GH39 glycoside hydrolase from the anaerobic gut fungus Orpinomyces sp.strain C1A[J].Peer J,2016,4:2289.