浓香型白酒是以高粱等粮谷类为原料,以大曲作为糖化发酵剂,经传统泥窖固态发酵,后蒸馏、陈酿储存、勾调而成的以己酸乙酯为主的复合香气白酒[1]。由其生产工艺可以看出,参与浓香型白酒酿造过程的微生物主要来源于大曲、酒醅和窖泥。白酒生产是开放式多菌种共同发酵[2],在酿造过程中,摊晾、入池等环节空气中悬浮的细菌和真菌以气溶胶的形式经自然沉降后附着在酒醅上从而参与发酵过程,并代谢产生风味物质影响白酒的品质。“茅台酒离不开茅台镇”、四川宜宾、泸州和贵州仁怀被称为“中国白酒金三角”[3],很好的诠释了地域优势。WANG X S等[4]研究发现,白酒酿造过程来源于周围环境的真菌可达20%~39%;张霞等[5]从五粮液车间空气分离筛选出73株酵母菌,酵母菌在白酒酿造过程具有糖化、产酒和生香的作用。因此,酿造微生态对白酒品质的影响重大。
前期关于大曲[6-8]、窖泥[9-10]及酒醅[11-12]微生物群落结构的研究甚多,然而,随着对白酒酿造微生物的深入挖掘,白酒酿造空气微生物也相继报道。饶家权等[13]对丰谷酒业不同季节、不同位置空气微生物进行研究,发现微生物数量以夏季最多,其次是秋、春季,冬季最少,但微生物种群以春、秋季节较多,冬、夏季较少,不同位置微生物种群和数量差异很大;杨开梅等[14]对浓香型习酒生产外环境细菌菌群多样性进行研究,发现空气中可培养细菌12种且以芽孢杆菌属(Bacillus sp.)为主;徐晨等[15]研究了西凤酒新老制酒车间不同季节空气微生物变化情况,结果表明,酵母菌浓度随季节变化显著,细菌和霉菌变化较小,而且横梗霉属(Lichtheimia sp.)及复膜酵母菌属(Saccharomycopsis sp.)是优势菌属。这些研究主要是利用自然沉降法采集空气微生物,然后进行富集培养、分离纯化,后期通过分子生物学方法或者生态学方法实现物种的鉴定。但是,传统培养方法耗时耗力,而且空气中可培养的微生物只有1%[16]。高通量测序技术是近年来发展起来的一项新技术,该技术能在短时间内对几十万甚至几百万条微生物基因序列进行测定[17]。
基于此,本研究采用空气微生物采样器结合滤膜过滤法采集趵突泉浓香型白酒厂不同区域空气微生物,利用高通量测序技术解析酒厂不同区域空气微生物的群落结构特征,以期为不同地域浓香型白酒质量风格差异及白酒酿造微生物溯源分析提供理论基础。
1 材料与方法
1.1 材料与试剂
空气样本:取自趵突泉酒厂;E.Z.N.ATMMag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:美国OMEGA公司;Qubit dsDNA HS分析试剂盒:赛默飞世尔科技(中国)有限公司;2×HieffRRobust聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Hieff NGSTM DNA Selection Beads:翌圣生物科技(上海)有限公司;醋酸纤维滤膜:上海兴亚净化材料厂。
1.2 仪器与设备
GL-88B漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6C电泳仪、DYCZ-21电泳槽:北京市六一仪器厂;FR-1000凝胶成像系统:上海复日科技有限公司;Q33238 QubitR4.0荧光计、Pico-21台式离心机:赛默飞世尔科技公司;ETC811PCR仪:北京东胜创新生物科技有限公司;0.5~10 μL Research plus移液器:艾本德股份有限公司;FA-A空气微生物采样器:盐城贝特电子有限公司。
1.3 方法
1.3.1 样品采集
采用FA-A撞击式空气采样器,采集趵突泉酒厂厂区(距离酿酒车间约1 km,CQ1)、酿酒车间外(距离酿酒车间约2 m,CJW1)、酿酒车间内(CJN1)的空气微生物样品,空气流量28.3 L/min,采样时间90 min,采样介质为无菌醋酸纤维滤膜(直径8 cm,孔径0.22 μm),每个采样点采集3次,采集后将同一个样本多个点的膜置于无菌离心管,-80 ℃冰箱中保存。
1.3.2 样品DNA提取及PCR扩增
空气样本的DNA按照E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒说明书进行提取。提取完成后利用琼脂糖凝胶电泳检测DNA的完整性,并用Qubit dsDNA HS分析试剂盒检测DNA质量浓度。以提取的总DNA为模板,以515F(5'-GTGCCAGCMGCCGCGGTAA-3')、909R(5'-CCCCGYCAATTCMTTTRAGT-3')为引物对细菌的V4-V5可变区基因序列进行PCR扩增,以ITSIF(5'-CTTGGTCATTTAGAGGAAGTAA-3')、ITS2(5'-GCTGCGTTCTTCATCGATGC-3')为引物对真菌ITS基因ITS1-ITS2区域进行PCR扩增。PCR扩增体系均为:2×HieffRRobust PCR Master Mix15 μL,上下游引物各1 μL,PCR产物15 ng,补双蒸水(ddH2O)至30 μL。PCR扩增程序均为:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环;72 ℃稳定延伸5 min。
1.3.3 高通量测序与数据分析
建库与测序由生工生物工程(上海)股份有限公司完成。下机测序得到的是双端序列数据,且测序序列中含有barcode序列,以及测序时加入的引物和接头序列。首先需要去除引物接头序列,再根据PE reads之间的overlap关系,将成对的reads拼接成一条序列,然后按照barcode标签序列识别并区分样品得到各样本数据,最后对各样本数据的质量进行质控过滤,得到各样本有效数据。
利用Usearch11软件,根据序列相似度>97%聚类得到操作分类单元(operational taxonomic unit,OTU)的代表序列。使用核糖体数据库项目(ribosomal database program,RDP)贝叶斯算法并将注释可信度设置为80%比对分类数据库,对OTU的代表序列进行物种注释分析,使用Mothur软件(version 3.8.31)进行α多样性分析。基于生信云平台和OriginPro 2022对获得的高通量测序数据进行比较和统计分析,绘制稀释性曲线、Venn图、微生物群落柱状图。
2 结果与分析
2.1 酒厂不同区域空气样品微生物群落α多样性分析
2.1.1 稀释性曲线
稀释性曲线可以用来比较不同样本中物种的丰富度,也可以用来说明样本的测序数据量是否足够。当曲线末端趋向平坦时,说明测序数据量合理,更多的数据量只会产生少量新的OTU,反之则说明测序深度不足以覆盖大多数菌,继续测序还可能产生较多新的OTU[18]。酒厂不同区域空气样品细菌和真菌菌群的稀释性曲线见图1。
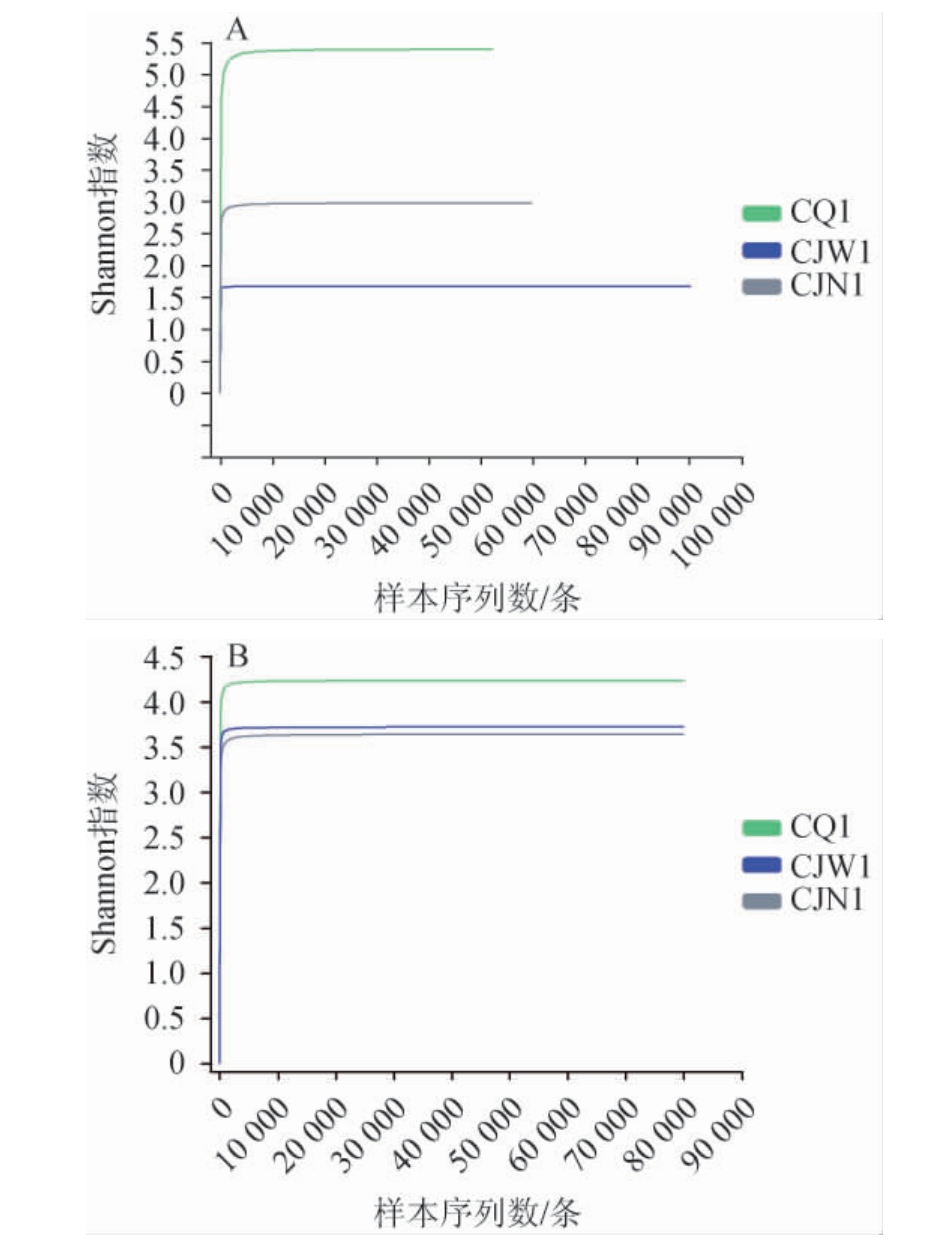
图1 酒厂不同区域空气样品细菌(A)和真菌(B)菌群的稀释性曲线
Fig.1 Dilution curves of bacteria (A) and fungi (B) in air samples of different distillery areas
由图1可知,随着采样序列数的增加,香农(Shannon)指数增加,当测序序列数>5 000条时,样品稀释曲线趋于平缓,表明每个样品测序数据量较为合理且测序深度充分,符合实际生物学信息,能够涵盖样品中绝大部分微生物的多样性信息。
2.1.2 酒厂不同区域空气样品微生物Alpha多样性分析
Alpha多样性是指一个特定区域或者生态系统内的多样性和群落的物种丰富度,常用Shannon指数、超1(Chao1)指数、ACE指数等评价数据结果[19]。本研究利用Illumina MiSeq测序技术平台选取Chao1指数、Shannon指数对趵突泉浓香型酒厂不同酿造区域真菌和细菌菌群在OTU水平上进行Alpha多样性分析,结果见表1。
表1 酒厂不同区域空气样品微生物群落Alpha多样性分析结果
Table 1 Alpha diversity analysis results of microorganisms in air samples of different distillery areas
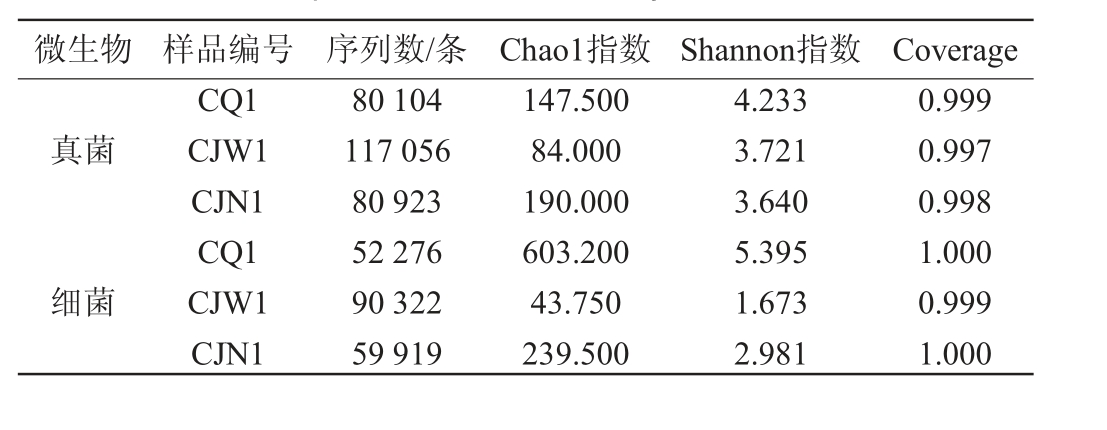
微生物 样品编号 序列数/条 Chao1指数 Shannon指数 Coverage真菌细菌CQ1 CJW1 CJN1 CQ1 CJW1 CJN1 80 104 117 056 80 923 52 276 90 322 59 919 147.500 84.000 190.000 603.200 43.750 239.500 4.233 3.721 3.640 5.395 1.673 2.981 0.999 0.997 0.998 1.000 0.999 1.000
由表1可知,3个样品中共得到真菌有效序列278 083条,平均每个样本92 694条;共得到细菌有效序列202 517条,平均每个样本67 506条,样品的Coverage均趋近于1,确保了测序数据的科学性和可靠性。Chao1指数是用来评估样本中OTU数目的多少,Chao1指数越大,OTU总数越多,表明物种丰富度越高;Shannon指数反映样品中微生物群落的多样性,Shannon指数越大,表明群落多样性越高[20]。由表1亦可知,对于真菌Chao1指数,样品CJN1>CQ1>CJW1,Shannon指数样品CQ1>CJW1>CJN1,说明酿酒车间内的真菌菌群最丰富,其次是厂区,酿酒车间外最少;但是厂区内的真菌菌群多样性最高,酿酒车间内、外的真菌菌群多样性差异不大。对于细菌Chao1指数,样品CQ1>CJN1>CJW1,Shannon指数样品CQ1>CJN1>CJW1,说明厂区内的细菌菌群最丰富,多样性最高,其次是车间内、酿酒车间外。综上所述,趵突泉酒厂厂区内微生物多样性最高,且以细菌为主;与之相比,酿酒车间内微生物的多样性指数并不高,说明经过特殊的酿酒环境长期选择和驯化,形成了一个独特而稳定的微生物区系。
2.1.3 OTU分布的Venn图
Venn图可以用来统计多个样本中共有和独有的OTU数目,直观的显示样本中OTU组成的相似性及特异性,酒厂不同区域空气样品中微生物OTU的Venn图见图2。
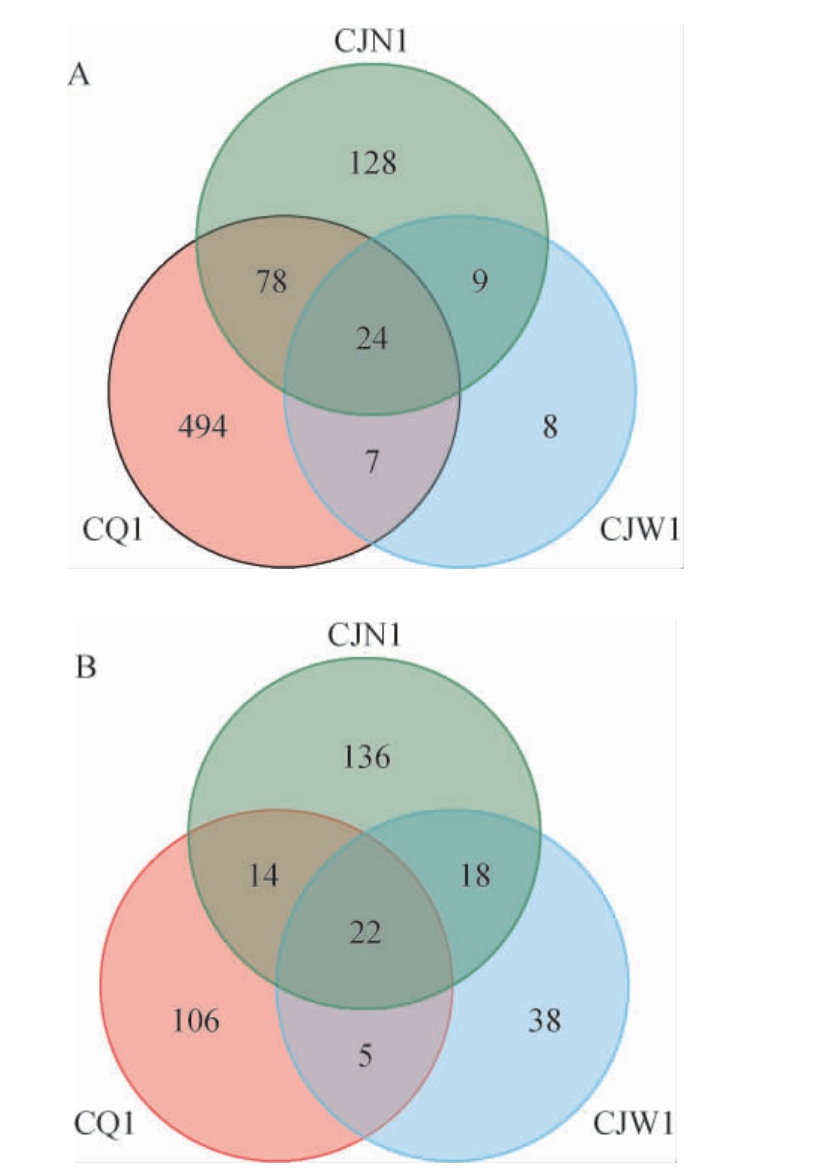
图2 酒厂不同区域空气样品细菌(A)和真菌(B)OTU的Venn图
Fig.2 Venn diagram of OTU of bacteria (A) and fungi (B) in air samples of different distillery areas
由图2可知,从趵突泉酒厂不同区域空气样品中共获得748个细菌OTU,厂区、酿酒车间外、酿酒车间内的细菌OTU数目分别为603个、48个、239个,共有的OTU数目为24个,独有的OTU数目分别为494个、8个、128个;共获得340个真菌OTU,厂区、酿酒车间外、酿酒车间内的真菌OTU数目分别为147个、84个、190个,共有的OTU数目为22个,独有OTU数目分别为136个、106个、39个。通过Venn图可以看出,趵突泉酒厂总体细菌类群比真菌类群更加丰富,原因可能是与真菌相比,细菌对环境具有更好的抗逆性和适应性[21]。结果表明,酒厂不同区域空气微生物存在一定的差异和相似性。
2.2 酒厂不同区域空气样品微生物群落结构分析
2.2.1 基于门水平酒厂不同区域空气样品微生物群落结构分析
在门水平上,从酒厂不同区域空气样品中共注释到20个细菌门,结果见图3。
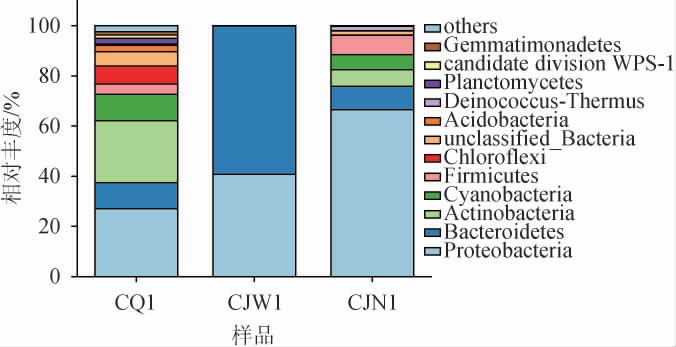
图3 基于门水平酒厂不同区域空气样品细菌群落结构
Fig.3 Structure of bacterial community constructure in air samples of different distillery areas based on phylum level
others:相对丰度<1%的菌门或菌属。下同。
由图3可知,厂区内空气样品的优势细菌门(相对丰度>1%)共有12个,相对丰度排名前5的细菌门分别为变形菌门(Proteobacteria)(27.08%)、放线菌门(Actinobacteria)(24.69%)、蓝藻菌门(Cyanobacteria)(10.54%)、拟杆菌门(Bacteroidetes)(10.31%)、绿弯菌门(Chloroflexi)(7.30%);酿酒车间外空气样品的优势细菌门为拟杆菌门(59.12%)和变形菌门(40.81%),且占绝对优势;酿酒车间内空气样品的优势细菌门为变形菌门(66.59%)、拟杆菌门(9.27%)、厚壁菌门(Firmicutes)(7.78%)、放线菌门(6.58%)、蓝藻菌门(5.98%)、Deinococcus-Thermus(1.77%)。不同区域空气样品共有的优势细菌门为变形菌门和拟杆菌门,变形菌门在酿酒车间内相对丰度高达66.59%,其包含如不动杆菌属等具有较强呼吸和发酵代谢作用的革兰氏阴性细菌,多在发酵前期占优势,可以利用葡萄糖等碳水化合物代谢产酸[22]。拟杆菌门中的某些微生物可以将糖类物质转化为小分子酸,是窖泥中重要的微生物[23],其在酿酒车间外相对丰度高达59.12%。厚壁菌门、放线菌门在酿酒车间内相对丰度分别为7.78%和6.58%,厚壁菌门主要由芽孢杆菌纲和梭菌纲等微生物组成,能代谢合成己酸,具有很强的环境适应性,能够在相对极端的条件保持生长[24]。放线菌门在土壤、海洋、植物体或其他恶劣自然环境中均能存活[25]。放线菌门、厚壁菌门及变形菌门也是大曲、窖泥和酒醅中的优势细菌门,在摊晾加曲、酒醅出池等生产过程中大曲、酒醅、窖泥中微生物与环境空气微生物会相互影响从而改变微生物群落结构[2]。Deinococcus-Thermus是酿酒车间独有的优势细菌门,其在茅台镇酿造区域[26]、酒鬼酒发酵车间空气[27]及泸州老窖制曲环境空气[28]中均有报道。
在门水平上,从酒厂不同区域空气样品中共注释到7个真菌门,结果见图4。由图4可知,厂区内的优势真菌门(相对丰度>1%)为子囊菌门(Ascomycota)(66.84%)和担子菌门(Basidiomycota)(21.54%);酿酒车间外的优势真菌门为子囊菌门(65.38%)、担子菌门(18.45%)、接合菌门(Zygomycota)(2.18%);酿酒车间内的优势真菌门为子囊菌门(75.16%)、担子菌门(9.93%)、接合菌门(6.95%)。厂区不同区域共有的优势真菌门为子囊菌门、担子菌门,两者在所有样品中相对丰度之和在88.38%~94.83%之间,占据绝对优势。子囊菌门是空气微生物的优势真菌菌群,也有研究发现,子囊菌门是浓香型白酒酿造酒醅的关键真菌微生物类群[29-30]。接合菌门是酿造车间内、外空气样品的共有优势真菌门,且在酿酒车间内高于酿酒车间外。
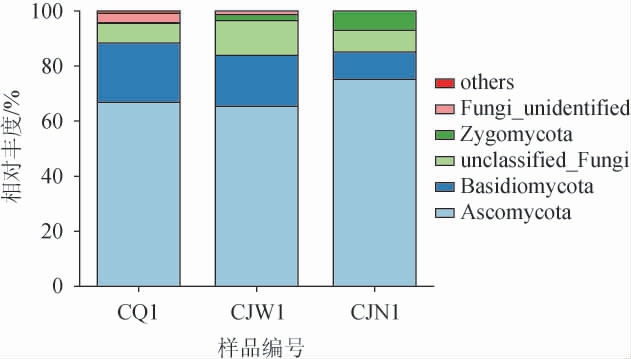
图4 基于门水平酒厂不同区域空气样品真菌群落结构
Fig.4 Structure of fungal community constructure in air samples of different distillery areas based on phylum level
综上所述,在门水平上,酒厂不同区域空气样品的真菌类群相似度较高,细菌类群差异较大;与厂区内空气样品相比较,酿酒车间内、外空气样品微生物类群更接近。
2.2.2 基于属水平酒厂不同区域空气样品微生物群落结构分析
在属水平上,采用高通量测序技术从酒厂不同区域空气样品中共注释到289个细菌属,其中优势细菌属(相对丰度>1%)有41个,结果见图5。由图5可知,厂区内空气样品的优势细菌属有28个,相对丰度排名前10的分别为链形植物属(Streptophyta)(9.65%)、不动杆菌属(Acinetobacter)(4.94%)、Kallotenue(4.09%)、微枝形杆菌属(Microvirga)(2.58%)、Segetibacter(2.12%)、微红微菌属(Rubellimicrobium)(2.02%)、节杆菌属(Arthrobacter)(2.02%)、黏结杆菌属(Adhaeribacter)(1.88%);酿酒车间外空气样品的优势细菌属有6个,分别为噬几丁质菌属(Chitinophaga)(30.55%)、黏液杆菌属(Mucilaginibacter)(28.37%)、劳尔氏菌属(Ral stonia)(23.30%)、草螺菌属(Herbaspirillum)(7.13%)、苯基杆菌属(Phenylobacterium)(3.70%)、中慢生根瘤菌属(Mesorhizobium)(2.38%);酿酒车间内空气样品的优势细菌属有15个,相对丰度排名前9的分别为苯基杆菌属(6.10%)、Streptophyta(5.83%)、不动杆菌属(4.68%)、副球菌属(Paracoccus)(2.44%)、金黄杆菌属(Chryseobacterium)(2.43%)、芽孢杆菌属(Bacillus)(1.78%)、奇异球菌属(Deinococcus)(1.67%)、乳酸杆菌属(Lactobacillus)(1.57%)、考克氏菌属(Kocuria)(1.08%)。
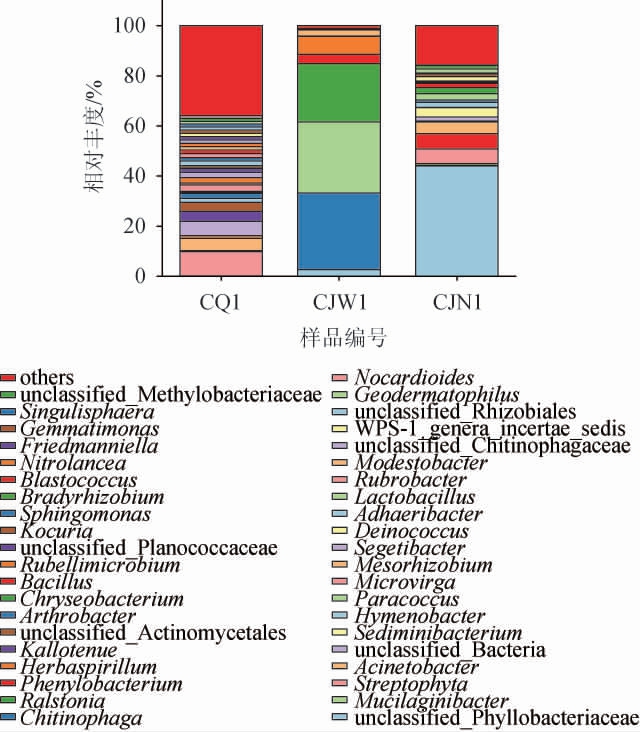
图5 基于属水平酒厂不同区域空气样品细菌群落结构
Fig.5 Structure of bacterial community constructure in air samples of different distillery areas based on genus level
由图5亦可知,酒厂不同区域空气样品无共同优势细菌属,不同区域空气细菌群落差异相对较大,这与饶家权等[13]的研究结果一致,分析原因可能是不同区域营养条件、环境因素各异使得微生物类群此消彼长所致。酿酒车间内空气样品绝对优势细菌属为苯基杆菌属,其对酿酒的作用尚不明确;芽孢杆菌属具有良好的耐热性,能产生淀粉酶、糖化酶、脂肪酶和蛋白酶以及四甲基吡嗪等风味物质[31];乳酸杆菌属是兼性厌氧菌,其代谢产物主要为乳酸,是合成酯类物质的前体物质,浓香型白酒是开放式生产,酒醅和大曲中的微生物对酿酒车间内细菌类群的影响较大[32]。副球菌属、奇异球菌属及考克氏属为酿酒车间内空气样品独有的优势细菌属,总相对丰度为5.08%。符长彪等[33]分析对比浓香型白酒在机械化和传统工艺条件下发酵环境中的微生物群落结构差异,发现副球菌属、奇异球菌属及考克氏属仅存在于机械化浓香型白酒酿造环境中,趵突泉酒厂浓香型白酒已打破传统酿造方式,成功向智能酿造转型,因此,推测这几种菌可能与机械化生产有关。
在属水平上,从酒厂不同区域空气样品中共注释到149个真菌属,其中优势真菌属(相对丰度>1%)有40个,结果见图6。由图6可知,厂区内空气样品的优势真菌属有28个,分别为大孢枝孢菌属(Davidiella)(15.45%)、链格孢属(Alternaria)(7.83%)、柯达酵母属(Kodamaea)(3.04%)、短梗霉属(Aureobasidium)(2.24%)、红酵母属(Rhodotorula)(2.21%)、隐球酵母属(Cryptococcus)(1.95%)、青霉属(Penicillium)(1.43%)、酵母属(Saccharomyces)(1.73%)等;酿酒车间外空气样品的优势真菌属有22个,分别为柯达酵母属(12.05%)、篮状菌属(Talaromyces)(6.69%)、链格孢属(5.51%)、大孢枝孢菌属(5.29%)、假丝酵母属(Candida)(3.49%)、镰刀菌属(Fusarium)(2.30%)、根毛霉属(Rhizomucor)(1.78%)、青霉属(1.35%)、隐球酵母属(1.11%)等;酿酒车间内空气样品优势真菌属有14个,分别为链格孢属(13.94%)、单端孢属(Trichhecium)(12.42%)、大孢枝孢菌属(11.04%)、青霉属(10.96%)、隐球酵母属(5.17%)、根毛霉属(4.40%)、假丝酵母属(4.40%)、柯达酵母属(4.19%)、曲霉属(Aspergillus)(2.28%)等。
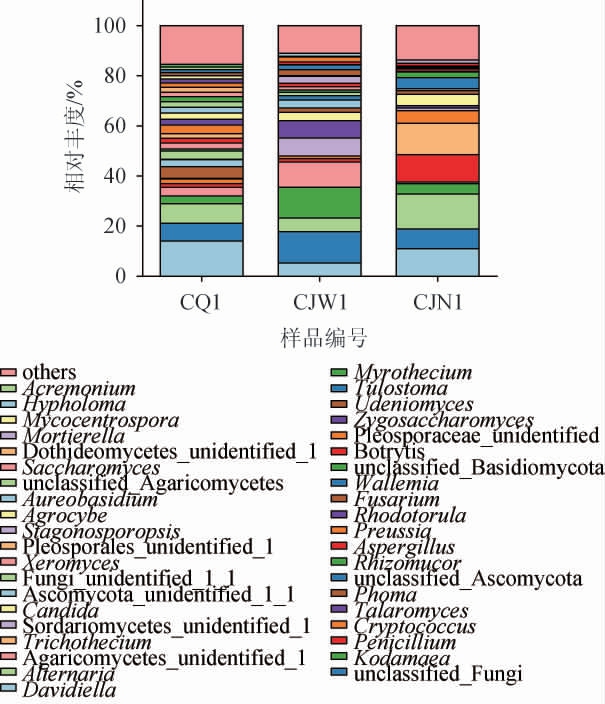
图6 基于属水平酒厂不同区域空气样品真菌群落结构
Fig.6 Structure of fungal community constructure in air samples of different distillery areas based on genus level
由图6亦可知,酒厂不同区域空气样品共有的优势真菌属有大孢枝孢菌属、链格孢属、柯达酵母属、隐球酵母属。从相对丰度来看,各菌属在不同区域空气样品中有所差异。柯达酵母属在厂区内、酿酒车间外、酿酒车间内的相对丰度分别为3.04%、12.05%、4.19%,该菌属是一类能够降解生物氨的菌株[34]。隐球酵母属在酿酒车间内相对丰度最高,为5.17%,在厂区内和酿酒车间外相对丰度分别为1.95%、1.11%,其具有发酵产酒精能力。酿酒车间内、外空气样品中均含有假丝酵母属,其在浓香型白酒中具有产香功能[35]。青霉属、曲霉属和根毛霉属是酿酒车间内的优势真菌属,总相对丰度为17.64%,霉菌属于好氧真菌,主要存在于发酵前期,是糖化酶和酸性蛋白酶的主要来源[36]。蒲岚等[37]从宜宾浓香型白酒窖房分离筛选出14株产糖化酶的菌株,其中有6株为曲霉属。张良等[38]对泸州古酿酒作坊内空气进行研究,发现曲霉菌主要为米曲霉和黑曲霉。由此可见,酿酒车间内空气真菌群落以酵母菌和霉菌为主,总相对丰度为31.4%。
综上所述,酒厂不同区域空气样品真菌菌群组成相似但相对丰度有所差异,这可能受环境因素影响所致,其次白酒酿造是开放式生产过程,各个环节均与空气接触,不适应大曲、酒醅、窖泥的微生物会被淘汰进入空气中,空气中的微生物也会依附大曲、酒醅中的营养物质繁殖从而进入到其中。
3 结论
本研究利用高通量测序技术对趵突泉浓香型酒厂不同区域空气样品中的细菌和真菌群落多样性进行分析,结果表明,厂区内空气样品的细菌菌群丰富度及多样性均最高;酿酒车间内空气样品的真菌菌群丰富度最高,而厂区空气样品的真菌菌群多样性最高,表明酿造车间内空气微生物经过长时间的淘汰选择、富集、驯化形成了一个与酿造环境相适应且相对稳定的微生物区系。从不同区域空气样品中共检测出748个细菌OTU、340个真菌OTU,共注释到20个细菌门、289个细菌属和7个真菌门、149个真菌属。酒厂不同区域空气样品细菌菌群差异较大,共有的优势细菌门为变形菌门和拟杆菌门,无共同优势细菌属;真菌菌群相似度较高,共有优势真菌门为子囊菌门和担子菌门,共有优势真菌属为大孢枝孢菌属、链格孢属、柯达酵母属、隐球酵母属,表明真菌由于能够形成孢子更易于从厂区环境中迁移,而细菌则倾向在不同环境中形成稳定而又有差异的群体。与厂区内空气样品微生物相比,酿酒车间内、外微生物群落更接近。此外,在酿酒车间内还发现了机械化浓香型白酒酿造特有的副球菌属、奇异球菌属及考克氏属。
[1]余乾伟.传统白酒酿造技术[M].北京:中国轻工业出版社,2010:61-69.
[2]吴建军.空气对浓香型白酒发酵的影响[D].无锡:江南大学,2004.
[3]唐亚,周永奎,乔宗伟,等.中国白酒金三角浓香型白酒产区气候独特性研究[J].食品与发酵科技,2013,49(6):60-67,79.
[4] WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2017,84(4):e02369-17.
[5]张霞,雷学俊,刘芳,等.五粮液车间空气中的特征酵母菌及其挥发性风味物质分析[J].食品与发酵工业,2021,47(17):242-249.
[6]徐千惠,饶家权,邹永芳,等.浓香型大曲储存期微生物群落演替及代谢产物的变化机制[J].食品科学,2023,44(10):1-15.
[7]丁芳,张原頔,蒋英丽,等.不同等级高温大曲微生物群落和代谢物的特征分析[J].中国酿造,2022,41(11):24-30.
[8]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2020,9(2):1003-1016.
[9]QIAN W,LU Z M,CHAI L J,et al.Differences of the structure,succession and function of Clostridial communities between Jiupei and pit mud during Luzhou-flavour Baijiu fermentation[J].Chin J Biotech,2020,36(6):1190-1197.
[10]曾丽云,袁玉菊,张倩颖,等.窖泥细菌群落结构与基酒挥发性组分相关性分析[J].食品科技,2017,42(2):9-13.
[11]左乾程,黄永光,朱家合,等.清酱香型白酒冬季发酵细菌群落演替及堆积过程细菌来源解析[J].食品科学,2021,42(12):145-152.
[12]肖辰,陆震鸣,张晓娟,等.泸型酒酒醅细菌群落的发酵演替规律[J].微生物学报,2019,59(1):195-204.
[13]饶家权,杜礼泉,唐聪,等.丰谷酒业酿酒区域空气中微生物分布状况的研究[J].酿酒,2018,45(6):74-78.
[14]杨开梅,胡峰,胡建锋,等.浓香型习酒酿造环境中细菌多样性的研究[J].酿酒科技,2015(10):51-54.
[15]徐晨,白莉圆,张艳,等.西凤酒制酒车间环境微生物分布特征研究[J].酿酒科技,2022(1):28-35.
[16]BRODIE EOIN L, DESANTIS TODD Z, PARKER JORDAN P, et al.Urban aerosols harbor diverse and dynamic bacterial populations[J].PNAS,2007,104(1):299-304.
[17]张丁予,章婷曦,王国祥.第二代测序技术的发展及应用[J].环境科学与技术,2016,39(9):96-102.
[18]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[19]陈申习,宿智新,张磊,等.基于高通量测序的清香型和酱香型酒曲真菌群落特征研究[J].中国酿造,2021,40(7):49-53.
[20]李斌,陈亚楠,孙旭,等.Illumina MiSeq高通量测序分析红谷黄酒酒曲微生物菌群多样性[J].中国酿造,2022,41(9):86-92.
[21]姜雪薇,马大龙,臧淑英,等.高通量测序分析大兴安岭典型森林土壤细菌和真菌群落特征[J].微生物学通报,2021,48(4):1093-1105.
[22]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[23]任海伟,孙一帆,王希,等.不同窖龄及位置浓香型白酒窖泥中细菌群落结构的差异性分析[J].食品与发酵工业,2023,49(9):103-111.
[24]WOLF M,MULLER T,DANDEKAR T,et al.Phylogeny of Firmicutes with special reference to mycoplasma(Mollicutes)as inferred from phosphoglycerate kinase amino acid sequence data[J].Int J Syst Evol Micr,2004,54(3):871-875.
[25]关统伟.塔里木盆地土壤放线菌区系及抗植物病原真菌的研究[D].乌鲁木齐:新疆农业大学,2007.
[26]胡小霞.茅台镇酱香型白酒酿造环境微生物群落结构研究[D].贵阳:贵州大学,2019.
[27]吴秋蕾,黎有有,邓丽颖,等.酒鬼酒发酵车间空气源细菌系统发育多样性研究[J].酿酒科技,2019(11):17-23.
[28]刘英杰,黄钧,唐慧芳,等.基于可培和免培法探究大曲生产环境空气微生物群落结构的时空性特征[J].食品工业科技,2022,43(14):144-154.
[29]SAFATOV A S,TEPLYAKOVA T V,BELAN B D,et al.Atmospheric aerosol fungi concentration and diversity in the south of western Siberia[J].Atmospheric Ocean Opt,2010,23:73-79.
[30] ZHANG W X, QIAO Z W, TANG Y Q, et al.Analysis of the fungal community in zaopei during the production of Chinese Luzhou-flavour liquor[J].J I Brewing,2012,113(1):21-27.
[31]ZHU B F,XU Y,FAN W L.High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp.using an endogenous precursor approach[J].J Ind Microbiol Biot,2010,37(2):179-186.
[32]陈蒙恩,赵聪,韩素娜,等.基于高通量测序的陶融型大曲微生物群落结构分析[J].食品科学,2021,42(8):106-113.
[33]符长彪,明红梅,张宿义,等.机械化与传统酿造方式下浓香型白酒酿造环境微生物群落结构对比分析[J].食品与发酵工业,2023,49(4):145-153.
[34]曾玉雪,罗惠波,等.浓香型大曲中降解生物胺菌株的筛选及应用[J].食品与发酵工业,2021,47(8):145-151.
[35]张建敏,杨康卓,刘芳,等.一株产香假丝酵母的筛选及其特征代谢风味物质分析[J].酿酒科技,2020(12):34-37,43.
[36]LV X C,HUANG Z Q,ZHANG W,et al.Identification and characterization of filamentous fungi isolated from fermentation starters for Hong Qu glutinous rice wine brewing[J].J Gen Appl Microbiol,2012,58(1):33-42.
[37]蒲岚,王涛,周宇科,等.宜宾多粮型白酒窖房空气中产糖化酶的霉菌[J].酿酒科技,2012(9):29-31,35.
[38]张良,李宗珍,张宿义,等.泸州古酿酒作坊空气曲霉菌初步研究[J].酿酒,2009,36(2):35-37.