葡萄酒的酿造工艺历经几千年的沉淀已经趋于完善,但近代葡萄酒微生物生态学的研究工作才使人们逐渐认识到酵母菌在其中的重要作用。非酿酒酵母(non-Saccharomyces yeasts,NS)是除酿酒酵母(Saccharomyces cerevisiae,SC)以外在酿酒过程中起作用的酵母菌。在过去几十年的研究中,对参与发酵过程的酵母的生理学、生物化学和分子生物学的研究也在不断深入。在此背景下,NS群体在酿造学中的代谢/酶活性潜力也得到了研究,同时也逐步反证了早期研究中“非酿酒酵母为葡萄酒酿造污染菌”的观点[1-2]。研究表明,NS对葡萄酒酿造可以产生一定的积极作用,包括增加葡萄酒的品种香气;控制葡萄酒酸度与乙醇含量;修饰葡萄酒芳香化合物;改善葡萄酒口感特性;提高颜色稳定性[3-6]。
随着经济发展,消费者对葡萄酒的风味品质要求不断提高。NS作为改良葡萄酒风味的工具之一,其菌株的分离、筛选需求也在不断增长以适应不同类型和风格的葡萄酒。但大多数NS乙醇耐受性低、发酵力不足、产乙醇能力差、存活时间短,因而在纯培养发酵中使用受限,只能与SC进行混合发酵(同时接种发酵或顺序接种发酵)[18]。在混合发酵中,各种酵母菌生长代谢并相互作用,最终影响葡萄酒的香气和滋味。专业的酿酒师多选用一种或多种NS制成的商业风味酵母菌剂,以获得口感和香气更稳定的葡萄酒。部分产区也倾向于利用本土NS以生产风味独特的葡萄酒。由于混合发酵的接种方式和接种比例不同,菌株的特异性不同,不同的报道中相同菌种的的发酵特性有所矛盾。
本文总结了自然发酵葡萄酒中NS的种类,自然发酵过程中NS的动态变化及其产酶特性,并阐述了非酿酒酵母对葡萄酒风味物质的影响,以期为NS商业化应用理论基础和对葡萄酒酿造工艺的改良提供参考。
1 非酿酒酵母的分类
目前,综合葡萄酒非酿酒酵母种类的研究结果,从葡萄表面、生长环境和葡萄酒自然发酵过程中分离出来的NS约有31个属、150多个种[7-11]。自然发酵葡萄酒中3种类型非酿酒酵母及应用见表1,其中美极梅奇酵母(Metschnikowia pulcherrima)、星形假丝酵母(Candida stellata)等已经被商业化以获得口感、香气优化的葡萄酒。BARATA A等[12]根据所表现的发酵性能相似性将NS分为3种类型:第一类是氧化型酵母,葡萄上常见但在葡萄酒发酵过程中数量极少且不进行乙醇发酵的酵母[13]。其中的黑酵母(Aureobasidium pullulans)因优良的果胶酶活性被用于浸渍过程以增强糖分的溶出。第二类是半发酵型酵母。这些酵母通常是葡萄酒发酵的早期阶段相对更丰富的酵母,但发酵能力通常很低、不能耐受高浓度乙醇[14]。但葡萄园汉逊酵母(Hanseniaspora vineae)、赞普林假丝酵母(Candia zemplinina)已经被证明可在10%左右的乙醇环境中存活[15]。第三类是发酵型酵母,通常存在于没有受到机械损伤和腐败菌感染的完整葡萄上,对乙醇的耐受度相对较高,具有低发酵活性。也有学者根据发酵能力和乙醇耐受力将NS分为半发酵型和发酵型两类:半发酵型酵母产酒精能力更弱、第一环境胁迫因子耐受性较弱,主要在发酵前期检出;发酵型酵母产酒精能力强,乙醇、SO2等环境胁迫因子耐受性强,主要在发酵中后期检出[16-17]。
表1 自然发酵葡萄酒中3种类型非酿酒酵母及应用
Table 1 Three types of non-Saccharomyces in spontaneous fermentation of wine and the applications
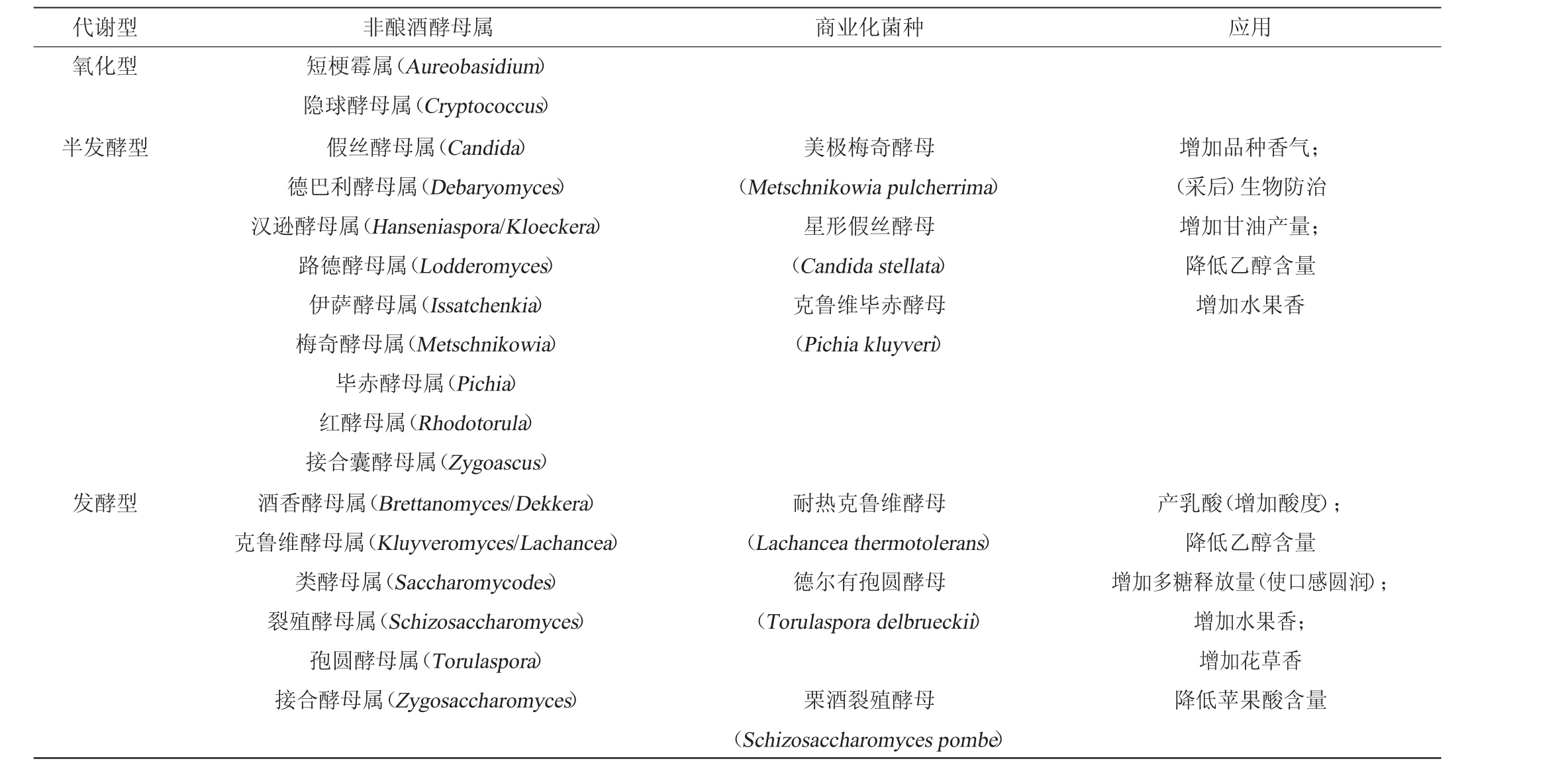
注:“/”后为该属部分特殊酵母的属名别称。
代谢型 非酿酒酵母属 商业化菌种 应用氧化型半发酵型美极梅奇酵母(Metschnikowia pulcherrima)星形假丝酵母(Candida stellata)克鲁维毕赤酵母(Pichia kluyveri)增加品种香气;(采后)生物防治增加甘油产量;降低乙醇含量增加水果香发酵型短梗霉属(Aureobasidium)隐球酵母属(Cryptococcus)假丝酵母属(Candida)德巴利酵母属(Debaryomyces)汉逊酵母属(Hanseniaspora/Kloeckera)路德酵母属(Lodderomyces)伊萨酵母属(Issatchenkia)梅奇酵母属(Metschnikowia)毕赤酵母属(Pichia)红酵母属(Rhodotorula)接合囊酵母属(Zygoascus)酒香酵母属(Brettanomyces/Dekkera)克鲁维酵母属(Kluyveromyces/Lachancea)类酵母属(Saccharomycodes)裂殖酵母属(Schizosaccharomyces)孢圆酵母属(Torulaspora)接合酵母属(Zygosaccharomyces)耐热克鲁维酵母(Lachancea thermotolerans)德尔有孢圆酵母(Torulaspora delbrueckii)栗酒裂殖酵母(Schizosaccharomyces pombe)产乳酸(增加酸度);降低乙醇含量增加多糖释放量(使口感圆润);增加水果香;增加花草香降低苹果酸含量
2 自然发酵中非酿酒酵母的动态变化
一般认为,自然发酵主要由NS触发,后由SC和少数耐受性较强的NS接替主导发酵的过程。19世纪80年代,这种酵母生长模式就已经在自然发酵葡萄酒中被观察到[22]。自然发酵葡萄酒中酵母菌演替一般趋势见图1。
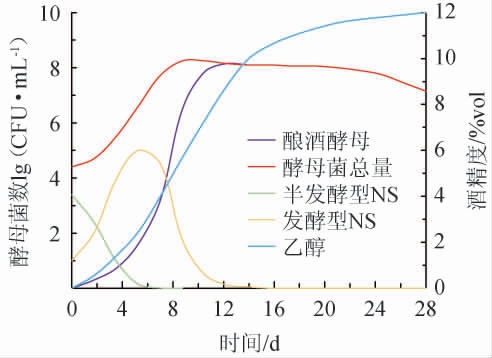
图1 自然发酵葡萄酒中酵母菌演替一般趋势
Fig.1 General trends of yeasts succession during spontaneous fermentation of wine
葡萄表面的NS以氧化型酵母Aureobasidium、Cryptococcus为主,有少量的Candida、Metschnikowia、Pichia、Hanseniaspora、Rhodotorula,其中Saccharomyces(尤其是SC)数量很少,NS在种类和数量上占绝对优势[19-21]。随着葡萄被破碎为葡萄醪,NS同步进入发酵阶段。此时,高浓度的NS在一定时间内调节环境底物浓度,释放高效的胞外酶,为SC的增殖提供有利帮助。简而言之,葡萄酒自然发酵过程中酵母菌菌群动态变化的一般趋势为:发酵早期阶段由半发酵型酵母快速消耗底物中的糖分[23],后具有低发酵活性和较强环境胁迫抗性的半发酵型/发酵型酵母菌占据优势地位[24]。前期NS生长更为活跃,与SC形成底物竞争作用使SC生长繁殖短暂停滞。当环境乙醇浓度逐渐增大则对NS产生抑制作用,NS细胞结构被破坏并开始死亡,同时SC迅速增殖并最终接替主导乙醇发酵[25]。
发酵早期阶段(前0~8 d),主要进行酵母菌的增殖。葡萄醪中碳源、氮源、维生素等有限营养底物被迅速利用(主要是葡萄糖),果糖/葡萄糖比值随之增大,糖代谢速率不断下降。此时具有低发酵活性、能快速利用葡萄糖的半发酵型NS如Candida、Hanseniaspora、Metschnikowia、Pichia在该阶段中较为活跃[26]。在该阶段亲果糖酵母菌如C.zemplinina,在混合发酵中与SC和其他NS葡萄糖代谢竞争较弱,可有效增加发酵动力学[27]。氮源的竞争主要是对氨基酸的竞争作用,与微生物对氨基酸的偏好性有关。东方伊萨酵母(Issatchenkia orientalis)与SC竞争代谢精氨酸、亮氨酸、半胱氨酸和苏氨酸,会导致SC利用的不足[28]。Hanseniaspora在整个发酵过程中都能被少量检出,主要活跃在发酵前3 d。该群体也与SC竞争消耗大量的氮,这可以解释Hanseniaspora总量在该阶段维持在较低水平的原因[29-30]。半发酵型酵母发酵能力弱,但对乙醇具有一定的耐受性,因此在发酵中存活时间较长。如Pichia kluyveri可耐受约4%vol~5%vol的乙醇,持续到发酵的前8 d左右都可以检测到。M.pulcherrima发酵活性相对较低,多数菌株只能耐受4%vol的乙醇[31-32]。但M.pulcherrima可能产生可与铁离子结合的蛋白,起到抑制需铁生长的腐败微生物的作用[33]。这几种半发酵型NS在发酵的前0~4 d较为活跃,随着乙醇浓度的逐渐升高,NS生长速率下降,直至死亡[34]。
发酵中后期阶段(8 d以后)主要进行乙醇发酵。在乙醇浓度、低pH、SO2、氧浓度、营养底物缺乏等条件影响下,只有少量NS适应并存活下来,SC成为最终的优势菌种。此时,NS同时受到环境pH值和乙醇浓度的影响,前者的降低可能造成后者对NS细胞的破坏能力增强。NS对低氧含量的耐受性更低,导致NS的竞争力逐渐下降。在7~13 d内NS种群数量下降,在发酵后期逐渐减少甚至消失[35]。到发酵末期,能被微量检出的NS主要是Brettanomyces、Schizosaccharomyces、Torulaspora、Zygosaccharomyces等发酵型酵母菌[33]。其原因是这些酵母对乙醇的耐受度更高。
SC和NS之间的营养物质竞争作用、乙醇含量等变化引起NS数量随发酵过程的进行演替并逐渐减少。除乙醇外,乙酸、中链脂肪酸、乙醛及其组合的协同作用也可能在葡萄酒发酵过程中对某些特定的NS产生抑制作用[36]。研究表明,细胞接触、群体感应也可能引起NS的死亡[37]。当某一微生物的数量达到一定丰度,其小分子信号的产生和传递识别可能影响酵母菌形态改变,导致菌体活性的改变[38]。某些酵母的蛋白质代谢物可能对另一类酵母菌具有毒性作用,导致酵母菌的裂解或死亡[39]。总而言之,在乙醇发酵启动前,NS在葡萄汁中快速增殖,并最终影响葡萄酒的成分结构与风味。其次,不同的NS在葡萄酒酿造过程中的持续时间、营养物的竞争力可能是决定代谢物生产水平、微生物代谢活力水平的重要因素。NS在发酵中的作用时间鲜有研究,但不同初始接种量的NS发酵后的代谢产物有所不同,可能是影响NS作用时间的重要因素。
3 产酶特性
SC胞外酶的表达量和种类都十分有限。现代基因测序技术表明,NS比SC具有更多编码胞外酶的基因,可在发酵过程中补充提供葡萄酒酿造过程所需的特殊胞外酶[40-41]。一些酶被分泌到细胞膜外分解细胞周围的复杂化合物和聚合物,为细胞生长提供营养和能量;另一些可将糖分直接转化为乙醇;其他酶则参与催化风味物质的产生。如H.uvarum分泌的水解酶有助于葡萄酒的花香风味形成[42];M.pulcherrima和C.stellate可以释放β-葡萄糖苷酶和C-S裂解酶,催化糖苷键结合的芳香前体,促进萜烯、硫醇和苯丙氨酸衍生物的释放[43]。然而菌群的动态变化使得水解酶的释放及其相关产物难以被控制和预测。
3.1 蛋白酶
蛋白酶水解蛋白质为可溶性肽与氨基酸,有助于避免葡萄酒因蛋白质过量造成的酒体浑浊的情况,也可防止可利用氮缺乏导致的发酵不完全[44-45]。氨基酸发酵后产生各种味道如鲜味、甜味、苦味、酸味和咸味等,也可经微生物代谢作为高级醇的合成前体,但目前葡萄酒发酵过程中的氨基酸含量与微生物代谢之间的关系尚未得到研究。C.zemplinina、汉逊德巴利酵母(Debaryomyces hansenii)、M.pulcherrima、膜璞毕赤酵母(Pichia membranifaciens)等NS均被检测出蛋白酶活性[46-49],能快速将蛋白质分解成氨基酸。ENGLEZOS V等[50]探究了C.zemplinina在酿酒中的潜在价值,发现77%的分离株都可以检测到蛋白酶活性,但蛋白酶在乙醇环境下具有低酶活性,且并不是所有蛋白酶都能在乙醇环境中起作用。因此,从葡萄酒中筛选得到的NS蛋白酶是否适应乙醇发酵环境还需要进一步探究。
3.2 β-葡萄糖苷酶
β-葡萄糖苷酶能水解底物中的糖苷键,改变醇、酯、酸、萜烯类和特定脂肪酸脂的组成[51-53]。其中,大部分萜烯以与糖的无嗅共价结合物形式存在。β-葡萄糖苷酶可以水解这种结合物,释放香味物质。成熟葡萄也含有β-葡萄糖苷酶,但酵母菌的糖苷酶活性与葡萄自身所含葡萄糖苷酶相比不受葡萄糖的抑制,对葡萄酒的香气形成作用更大。Brettanomyces、Candida、Debaryomyces、Hanseniaspora、Kluyveromyces、Pichia、Torulaspora、Metschnikowia、Saccharomycodes、Schizosaccharomyces等均被发现具有不同程度的葡萄糖苷酶活性[54-56]。其中,Brettanomyces、Debaryomyces、Hanseniaspora和Kluyveromyces皆比SC具有更强的产β-葡萄糖苷酶能力[57]。姚红红等[58]从葡萄酒产区筛选高产糖苷酶的H.uvarum、M.pulcherrima,其中M.pulcherrima菌株酶活力最高,可达13.642 mU/mL。任雪梅[59]从自然发酵酒样中筛选出了高产糖苷酶菌株M. pulcherrima、H. uvarum和T. delbrueckii,其中H.uvarum菌株酶活性最高,可达49.669mU/mL。
3.3 果胶酶
果胶酶使细胞壁被分解,令葡萄中的果汁更容易被压榨流出,释放更多包裹在葡萄皮中的色素和风味化合物[60-61]。NS/SC混合发酵的葡萄酒将比SC纯发酵的具有更低的浊度和更高的色谱识别强度。SC的果胶酶活性尚未被定性。因此,尽管葡萄成熟过程中的果胶酯酶和多聚半乳糖醛酸酶含量会不断增加,葡萄酒酿造过程中果胶酶的重要来源仍是NS。在已公开的研究数据中,Candida、Pichia、Kluyveromyces可以生产聚半乳糖醛酸酶;Candida、Pichia和Debaryomyces可以生产果胶酯酶[62]。MERIN M G等[63]研究表明,A.pullulans不同于T.delbrueckii、K.thermotolerans、H.uvarum等引起发酵速率降低的情况,该研究未观察到对SC发酵动力学负面影响。何曼等[64]从葡萄酒庄的土样中筛选得到产果胶酶菌株H.anomala、P.kluyveri、P.membranifaciens、C.zemplinina等,其中C.zemplinina还同时产淀粉酶、纤维素酶。卢晓华等[65]对囊酵母(Zygoascus sp.)液体发酵培养基成分进行优化,其果胶酶产量可达23.91 U/mL。
3.4 脂肪酶
脂肪酶可以降解来自葡萄自身的和酵母菌自溶产生的脂质,释放脂肪酸作为合成脂肪酸脂的前体。H.uvarum、H.opuntiae、T.delbrueckii、P.kluyveri被报道具有脂肪酶生产能力,其中H.uvarum产脂肪酶活性可达184.68 U/mL[66]。葡萄酒生产中常用的脂肪酶主要为细菌或者霉菌产生的酶混合物,可能对葡萄酒存在不利影响。关于这些生物转化反应的多样性和复杂性目前仍在研究阶段。
4 非酿酒酵母对葡萄酒风味物质的影响
葡萄酒的风味包括香气和口感。与香气有关的物质主要包括酯类、萜类、挥发性硫醇、高级醇等。与口感有关的物质除了酒精和水的基本味,主要为多糖、甘油(甜度)、有机酸(酸度)、单宁(苦味)等。NS在发酵过程中会因适应性改变而发生自溶,细胞蛋白、核酸和脂类通过酶促反应被分解成氨基酸、肽、脂肪酸和核苷酸等合成高级醇和酯类的前体物质;细胞上的可溶性甘露糖蛋白与乙酸异戊酯、己醇、乙酸乙酯、萜烯等挥发性物质结合,避免香气成分的散失而增加葡萄酒香气的持久度[67-68]。促进葡萄酒风味物质主要由半发酵型酵母促进增产。
4.1 产酯能力
挥发性酯类是构成葡萄酒水果香、花草香的主要物质。NS可使自然发酵的葡萄酒中乙酸酯含量比SC纯发酵更为丰富(约高44~48倍)[69]。Hanseniaspora有助于提高乙酸酯含量,如具有香蕉和草莓香气的乙酸异戊酯和乙酸异丁酯;具有玫瑰、蜂蜜、水果和花朵的芳香的2-苯乙基乙酸酯与乙酸己酯[70]。M.pulcherrima高产具有苹果香气的己酸乙酯和辛酸乙酯,也能增加乙酸异戊酯和2-乙酸甲基丁酯的产量;L.thermotolerans高产有乳香和水果风味的乙酯[71-72]。混合接种的顺序和比例的调整将改变葡萄酒中酯类物质的产量。H.uvarum与SC以1∶1同时接种的葡萄酒酯类成分比SC纯发酵葡萄酒增加30.77%;I.orientalis与SC以3∶1同时接种所得葡萄酒中乙酸乙酯含量增长27.51%,以1∶1同时接种所得葡萄酒辛酸乙酯含量增长34.93%,以1∶3同时接种所得葡萄酒中癸酸乙酯含量增加200.83%[73]。分别接种M.pulcherrima、T. delbrueckii和L. thermotolerans 24 h后接入SC所得3种葡萄酒中,乙酸乙酯含量分别提高9.4倍、7.3倍和7.4倍;前两种混合发酵的葡萄酒中丁酸乙酯、2-甲基丁酸乙酯和乙酸异戊酯等果香味成分浓度得到提升[74]。这可能和这些菌种的降醇能力相关,能将乙醇转化为酯类物质。发酵过程中积累的乙酸乙酯可能通过水解/酯化作用转化为其他酯类物质,也能改变葡萄酒酯类物质的结构[75]。因此,高产乙酸乙酯的NS也能充当葡萄酒脂肪酸酯和高级醇酯的储备库来源。
通过分析报道频率较高的葡萄酒NS及其积极代谢物发现,高产酯类物质的NS主要为活跃于发酵前2~3 d的Candida、Hanseniaspora、Metschnikowia、Pichia等半发酵型酵母,表明葡萄酒酯类物质的结构化与氧气含量、底物浓度等早期丰度较高的物质高度相关。这也解释了葡萄的种类为发酵提供的环境底物差异性对发酵产品成分的影响。该阶段乙醇的限制较小,微生物的代谢活动更为活跃。此外,NS在发酵后期被SC取代,营养竞争和环境拮抗物浓度的升高导致NS的细胞死亡并裂解释放脂质。SC因此可以获得一个脂质环境,以供乙醇发酵过程中产生脂肪酸乙酯的合成前体。这或许也可以解释为什么NS和SC的协同作用可以促进脂肪酸乙酯的大量形成。
4.2 产高级醇能力
高级醇是由氨基酸经过Ehrlich途径分解代谢得到的,其产量与相应氨基酸浓度正相关。罗来庆等[76]以SC纯发酵的葡萄酒为对照,将P.kluyveri、长孢洛德酵母(Lodderomyces elongiporus)、T.debrueckii接种至葡萄醪中48 h后接入SC进行发酵,结果表明,3种NS/SC混合发酵的葡萄酒中异戊醇和苯乙醇等高级醇含量显著增加,其中异戊醇的含量增长24%~32%。GAMERO A等[77]研究不同酵母菌发酵香气特征,结果表明,Metschnikowia、Hanseniaspora、Kluyveromyces、Lachancea、Pichia等半发酵型酵母的一些菌株产生高级醇的量是SC的3~26倍,说明在NS细胞中Ehrlich通路支链氨基酸表达量更高。而葡萄表面所含的氧化型酵母与发酵后期与SC协同的部分发酵型酵母几乎未被报道具有增产高级醇能力,这可能与该类型酵母的较低的氨基酸代谢能力有关。另外有研究显示,即使发酵环境相似,不同种酵母菌产生的高级醇种类和产量存在差异[78]。这说明NS调节Ehrlich通路的机制比SC更加多样。
4.3 产有机酸能力
葡萄酒中与风味相关的有机酸主要为酒石酸、苹果酸、乳酸和乙酸。较高浓度的乙酸表现出明显的醋酸味,也会降低微生物的稳定性,增加酒体变质和感官品质退化的风险。过量的有机酸不仅影响酵母菌发酵,也会导致葡萄酒的几种感官特性的不平衡。因此维持乙酸正常水平,同时使苹果酸降解,是协调葡萄酒风味的目的之一。葡萄酒有机酸的增加与大量半发酵型酵母交替主导的发酵早期阶段有关。其他类型的酵母菌虽然具有一定的产酸能力,但主要承担发酵后期的苹果酸-乳酸发酵过程以达到降酸协调的目的。
SC对苹果酸利用能力很弱,因此需要依靠苹果酸降解酵母菌株和相应酶的释放以达到降酸作用[79]。研究表明,异常汉逊酵母(Hanseniaspora anomala)、I.orientalis、S.pombe、拜耳接合酵母(Zygosaccharomyces bailii)都具有降解苹果酸的能力[80]。L.thermotolerans/SC混合发酵可以提高葡萄酒酸度,将pH值由4.0降低至3.5[81]。该菌种可能适用于气候炎热、葡萄酸度不足地区的葡萄酒生产。S.pombe在与SC共同发酵过程中,SC几乎利用了底物中所有的糖分,而S.pombe可以利用苹果酸作为唯一碳源并将其降解为二氧化碳和乙醇,二者互不干扰[82]。值得注意的是,T.delbrueckii/SC的混合发酵经过苹果酸-乳酸发酵阶段之后,体系中乳酸含量皆明显增长;Z.rouxii可以产生高达75 g/L的苹果酸[83]。因此基于控制葡萄酒苹果酸含量目的的生产需要控制这两种酵母菌的生长。
4.4 产甘油能力
甘油有助于调节细胞氧化还原电位,增加酒体黏稠度,形成柔和圆润的口感。相比SC,NS耐渗透压能力较弱,需要合成甘油来辅助保护细胞,且其3-磷酸甘油脱氢酶的活性更强,因而具有更优越的产甘油能力[84-85]。甘油的促产主要与Candida、Lachancea两类酵母菌有关。C.stellata产甘油能力最高可达到10 g/L[86]。这表明大量的糖被甘油丙酮发酵途径代谢。它通常只代谢果糖,与SC混合发酵可使体系残糖量大大降低。利用C.stellata可以解决发酵早期阶段果糖/葡萄糖比值升高的问题,代谢消耗葡萄中的果糖产生甘油,使发酵动力学增长,发酵时间有效缩短。L.thermotolerans与C.zemplinina相似,也可以产生高浓度的甘油。L.thermotolerans高产甘油的同时不伴随乙酸的增加,是相较于Candida的菌株更适用于控酸的菌株[4]。研究表明,L.thermotolerans/SC混合发酵的葡萄酒甘油含量比SC纯发酵高约0.69~3.30 g/L[87]。
4.5 产多糖能力
多糖可以增加酒体的黏性和饱满度,柔化涩感。葡萄酒中的多糖主要是来源于葡萄的阿拉伯半乳糖蛋白,其次为来源于酵母菌在乙醇发酵中的分泌和细胞自溶[88]。一些NS(如L. thermotolerans、H. osmophila、M. pulcherrima、P.fermentans、S.ludwigii、T.delbrueckii、Z.bailii)在无多糖葡萄汁中释放甘露糖蛋白的能力高于SC,且混合发酵的环境促进了甘露糖蛋白的分泌,发酵环境中多糖含量有所增长[89-91]。甘露糖蛋白是一类被普遍认可具有稳定葡萄酒酒体、改善葡萄酒色泽和香气功能的酵母多糖。SC替代NS成为主导发酵的微生物后,NS自溶释放的甘露糖蛋白及时与发酵早期释放的挥发性物质结合可以有效减少该阶段香气物质的散失。
4.6 其他
葡萄酒中还有一些少量、微量或痕量的物质。这些物质浓度过高会引起感官不良,但微量或痕量有利于葡萄酒的品种香气。如痕量级挥发性硫醇可以表现出令人愉悦的味道[92]。去甲异戊二烯类物质有益于果脯香味、焙烤香和花香味[93]。酵母菌可使挥发性硫醇从与半胱氨酸结合的前体物中被释放出来。T.delbrueckii/SC混合发酵可使3-巯基己醇含量提高[94-95],P.kluyveri/SC混合发酵下3-巯基己基乙酸盐含量得到显著提高[96]。目前报道频率较高的NS中,去甲异戊二烯类香气物质紫罗兰酮和大马士革酮与A.pullulans呈唯一对应关系。这可能与A.pullulans果胶溶解系统(果胶酶、纤维素酶和半纤维素酶)的酶促作用有关。这些酶可使细胞壁溶解更彻底,从而释放更多芳香前体物质供上述香气物质合成。C.zemplinina、L.thermotolerans、M.pulcherrima、P.kluyveri、T.delbrueckii均能产生较为丰富的萜类物质,C.zemplinina还是内酯强生产者[97-99]。这可能与他们具有较高的β-葡萄糖苷酶活性有关,能将橙花醇转化为香叶醇、芳樟醇和α-松果醇等单萜醇。醛类物质可以有效地平衡游离态和结合态的SO2,其产量也因菌种而异。高浓度的SO2一定程度上会促进酵母菌积累乙醛。醛的增产与L.thermotolerans和P.kluyveri两种NS具有相关性。这可能与这两种酵母SO2的结合能力有关。低浓度的乙醛使葡萄酒具有令人愉快的苹果、柑橘、坚果类风味,但过量的乙醛会形成青草、苹果般异味[100]。
5 总结与展望
近年来大量的NS/SC混合发酵研究揭示了NS具有部分优良的发酵潜力,其中许多酵母菌已经商业化。长期以来,乙醇耐受性低使得NS在酿造学上的应用受到限制。但从整个发酵过程来看,NS的作用受发酵时长的影响微弱,而是只作用于发酵早期阶段即能产生良好的成分贡献。除此之外,同时接种与顺序接种两种不同的发酵方式,在一定程度上对代谢物的形成有影响,这使葡萄酒的发酵过程需要更为科学化的管理。
为了实现混合发酵的有效应用,混合发酵条件的控制需要精细到具体的酿造工艺环节。根据产品特性如口感、香气、色泽等目的,选育具有相应作用效力的NS,或能缩短启动发酵的时间以及从生物化学角度调控相关的代谢途径把握葡萄酒成品结构成分。此外,许多的NS对发酵环境具有依赖性。因此,分离和鉴定新的物种和菌株仍然是葡萄酒酵母研究的一个持续目标。开发新的商用菌剂将为酿酒师提供进一步的工具,以开发风格和生产香气不同的葡萄酒。最后,在基因组学层面研究NS酿造特性、多菌种相互作用机制是从根本上认识和调控NS/SC混合发酵葡萄酒品质的基础。
[1]CIANI M,COMITINI F,MANNAZZU I,et al.Controlled mixed culture fermentation:a new perspective on the use of non-Saccharomyces yeasts in winemaking[J].FEMS Yeast Res,2010,10(2):123-133.
[2] CONTRERAS A, HIDALGO C, HENSCHKE P A, et al.Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J].Appl Environ Microbiol,2014,80(5):1670-1678.
[3]HU K,JIN G J,XU Y H,et al.Wine aroma response to different participation of selected Hanseniaspora uvarum in mixed fermentation with Saccharomyces cerevisiae[J].Food Res Int,2018,108:119-127.
[4] GOBBI M, COMITINI F, DOMIZIO P, et al. Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation:a strategy to enhance acidity and improve the overall quality of wine[J].Food Microbiol,2013,33(2):271-281.
[5]VARELA C,SENGLER F,SOLOMOM M,et al.Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J].Food Chem,2016,209:57-64.
[6]LOIRA I,MORATA A,COMUZZO P,et al.Use of Schizosaccharomyces pombe and Torulaspora delbrueckii strains in mixed and sequential fermentations to improve red wine sensory quality[J].Food Res Int,2015,76:325-333.
[7]SUN Y,LIU Y.Investigating of yeast species in wine fermentation using terminal restriction fragment length polymorphism method[J].Food Microbiol,2014,38:201-207.
[8]LI S S,CHENG C,LI Z,et al.Yeast species associated with wine grapes in China[J].Int J Food Microbiol,2010,138(1-2):85-90.
[9] SCHINCA C, GONZALEA M N, CARRAU F, et al.Biodiversity and brewing attitude of non-Saccharomyces strains isolated from Uruguayan vineyards and other ecosystems[J].Int J Food Microbiol, 2024, 412:110529.
[10] LORENZINI M, ZAPPAROLI G.Yeast-like fungi and yeasts in withered grape carposphere: Characterization of Aureobasidium pullulans population and species diversity[J].Int J Food Microbiol,2019,289:223-230.
[11]XU W,LIU B,WANG C,et al.Organic cultivation of grape affects yeast succession and wine sensory quality during spontaneous fermentation[J].LWT-Food Sci Technol,2019,120:108894.
[12]BARATA A,MALFEITO-FERREIRA M,LOUREIRO V.The microbial ecology of wine grape berries[J].Int J Food Microbiol,2012,15(3):243-259.
[13]HERNÁNDEZ A,PÉREZ-NEVADO F,RUIZ-MOYANO S,et al.Spoilage yeasts: What are the sources of contamination of foods and beverages?[J].Int J Food Microbiol,2018,286:98-110.
[14]RENOUF V,CLAISSE O,LONVAUD-FUNEL A.Inventory and monitoring of wine microbial consortia[J].Appl Environ Microbiol,2007,75(1):149-164.
[15] DI MARO E, ERCOLINI D, COPPOLA S.Yeast dynamics during spontaneous wine fermentation of the Catalanesca grape[J].Int J Food Microbiol,2007,117(2),201-210.
[16]BORREN E,TIAN B.The important contribution of non-Saccharomyces yeasts to the aroma complexity of wine:A review[J].Food,2020,10:13.
[17]王春晓,俞俊竹,周文亚,等.非酿酒酵母属酵母的葡萄酒发酵应用研究进展[J].中国农业科学,2023,56(3):529-548.
[18] WINDHOLTZ S, REDON P, LACAMPAGNE S, et al.Non-Saccharomyces yeasts as bioprotection in the composition of red wine and in the reduction of sulfur dioxide[J].LWT-Food Sci Technol,2021,149:111781.
[19]ZHANG J,PLOWMAN J E,TIAN B,et al.Application of MALDI-TOF analysis to reveal diversity and dynamics of winemaking yeast species in wild-fermented,organically produced,New Zealand Pinot Noir wine[J].Food Microbiol,2021,99:103824.
[20] GRANGETEAU C, GERHARDS D, ROUSSEAUX S, et al.Diversity of yeast strains of the genus Hanseniaspora in the winery environment:What is their involvement in grape must fermentation?[J].Food Microbiol,2015,50:70-77.
[21]PORTILLO M D C,MAS A.Analysis of microbial diversityand dynamics during wine fermentation of Grenache grape variety by high-throughput barcoding sequencing[J].LWT-Food Sci Technol,2016,72:317-321.
[22]FLEET G H,LAFO-LAFOURCADE S,RIBEREAU-GAYON P.Evolution of yeasts and lactic acid bacteria during fermentation and storage of Bordeaux wines[J].Appl Environ Microbiol,1984,48:1034-1038.
[23] PRETORIUS I S.Tailoring wine yeast for the new millennium: novel approaches to the ancient art of wine making[J].Yeast,2000,16:675-729.
[24]FLEET G H.Yeast interactions and wine flavour[J].Int J Food Microbiol,2003,86:11-22.
[25]战吉宬,曹梦竹,游义琳,等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学,2020,53(19):4057-4069.
[26]POWELL C D,QUAIN D E,SMART K A.The impact of sedimentation on cone yeast heterogeneity[J].J Am Soc Brewing Chem,2018,62(1):8-17.
[27] MAIO S D, GENNA G, GANDOLFO V, et al.Presence of Candida zemplinina in Sicilian Musts and selection of a strain for wine mixed fermentations[J].S Afr J Enol Vitic,2016,33:80-87.
[28]刘茜.两种酵母菌混合培养生长行为影响因素研究及其在白葡萄酒发酵中的应用[D].宁波:宁波大学,2016.
[29] WANG C, GARCIA-FERNANDEZ D, MAS A, et al.Fungal diversity in grape must and wine fermentation assessed by massive sequencing,quantitative PCR and DGGE[J].Front Microbiol,2015,6:1156.
[30]PEREZ-NEVADO F,ALBERGARIA H,HOGG T,et al.Cellular death of two non-Saccharomyces wine-related yeasts during mixed fermentations with Saccharomyces cerevisiae[J].Int J Food Microbiol,2006,108(3):336-345.
[31]COMITINI F,GOBBI M,DOMIZIO P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food Microbiol,2011,28(5):873-882.
[32]PRIOR K J,BAUER F F,DIVOL B.The utilisation of nitrogenous compounds by commercial non-Saccharomyces yeasts associated with wine[J].Food Microbiol,2018,12:2.
[33]MORATA A,LOIRA I,ESCOTT C,et al.Applications of Metschnikowia pulcherrima in wine biotechnology[J].Fermentation,2019,5(3):63.
[34]VILLENA M A,IRANZO J F U′,PEREZ A I B.β-Glucosidase activity in wine yeasts:Application in enology[J].Enzyme Microb Tech,2007,40(3):420-425.
[35] HONG M, LI J, CHEN Y, et al.Impact of mixed non-Saccharomyces yeast during fermentation on volatile aroma compounds of Vidal blanc icewine[J].LWT-Food Sci Technol,2021,145:111342.
[36] LUDOVICO P,SOUSA M,SILVA M,et al. Saccharomyces cerevisiae commits to a programmed cell death process in response to acetic acid[J].Microbiol,2001,147:2409-2415.
[37] RENAULT P E, ALBERTIN W, BELY M.An innovative tool reveals interaction mechanisms among yeast populations under oenological conditions[J].Appl Microbiol Biot,2013,97(9):4105-4119.
[38] TAILLANDIER P,LAI Q P,JULIEN-ORTIZ A,BRANDAM C.Interactions between Torulaspora delbrueckii and Saccharomyces cerevisiae in wine fermentation: Influence of inoculation and nitrogen content[J].World J Microbiol Biotechnol,2014,30(7):1959-1967.
[39]郭风君.海洋嗜杀酵母Wickerhamomyces anomalus YF07b菌株新型嗜杀因子的研究[D].青岛:中国海洋大学,2013.
[40]JOLLY N P,VARELA C,PRETORIUS I S.Not your ordinary yeast:non-Saccharomyces yeasts in wine production uncovered[J].FEMS Yeast Res,2014,14(2):215-237.
[41]LOPEZ S,MATEO J J,MAICAS S.Characterisation of Hanseniaspora isolates with potential aroma enhancing properties in Muscat wines[J].S Afr J Enol Vitic,2014,35:292-303.
[42]刘宇,张军强,何晓丽,等.优选本土Hanseniaspora uvarum在干红葡萄酒酿造中的中试应用研究[J].食品与发酵工业,2023,49(12):62-71.
[43]MORTATA A,LOIRA I,ESCOTT C,et al.Applications of Metschnikowia pulcherrima in wine biotechnology[J].Fermentation,2019,5(3):63.
[44] HAMON M P, BULTEAU A L, FRIGUET B.Mitochondrial proteases and protein quality control in ageing and longevity[J].Ageing Res Rev,2015,23:56-66.
[45]CIANI M,COMITINI F.Yeast interactions in multi-starter wine fermentation[J].Curr Opin Food Sci,2015,1:1-6.
[46]ENGLEZOS V,RANTSIOU K,TORCHIO F,et al.Exploitation of the non-Saccharomyces yeast Starmerella bacillaris(synonym Candida zemplinina)in wine fermentation:physiological and molecular characterizations[J].Int J Food Microbiol,2015,199:33-40.
[47]BOLUMAR T,SANZ Y,ARISTOY M,et al.Purification and characterisation of proteases A and D from Debaryomyces hansenii[J].Int J Food Microbiol,2008,124(2):135-141.
[48] ROMANO P, CAPECE A, JESPERSEN L.Taxonomic and ecological diversity of food and beverage yeasts[J].Yeasts in Food and Beverages,2006,2:13-53.
[49] FERNANDEZ M, U′ BEDA J, BRIONES A.Typing of non-Saccharomyces yeasts with enzymatic activities of interest in wine-making[J].Int J Food Microbiol,2000,59(1-2):29-36.
[50]ENGLEZOS V,RANTSIOU K,TORCHIO F,et al.Exploitation of the non-Saccharomyces yeast Starmerella bacillaris(synonym Candida zemplinina)in wine fermentation:physiological and molecular characterizations[J].Int J Food Microbiol,2015,199:33-40.
[51]LIANG Z J,FANG Z X,PAI A,et al.Glycosidically bound aroma precursors in fruits:A comprehensive review[J].Crit Rev Food Sci Nutr,2022,62(1):215-243.
[52]LI S,BI P,SUN N,et al.Characterization of different non-Saccharomyces yeasts via mono-fermentation to produce polyphenol-enriched and fragrant kiwi wine[J].Food Microbiol,2022,103:103867.
[53]BASSO R F,ALCARDE A R,PORTUGAL C B.Could non-Saccharomyces yeasts contribute on innovative brewing fermentations?[J].Food Res Int,2016,86:112-120.
[54] HALL H, ZHOU Q, QIAN M C, et al.Impact of yeasts present during prefermentation cold maceration of pinot noir grapes on wine volatile aromas[J].Am J Enol Viticult,2017,68(1):81-90.
[55]HAN X,QING X,YANG S,et al.Study on the diversity of non-Saccharomyces yeasts in Chinese wine regions and their potential in improving wine aroma by beta-glucosidase activity analyses[J].Food Chem,2021,360:129886.
[56]ZHANG P,ZHANG R,SIRISENA S,et al.Beta-glucosidase activity of wine yeasts and its impacts on wine volatiles and phenolics:A mini-review[J].Food Microbiol,2021,100:103859.
[57]VILLENA M A,IRANZO J F U′,PEREZ A I B.β-Glucosidase activity in wine yeasts:Application in enology[J].Enzyme Microb Tech,2007,40(3):420-425.
[58]姚红红,任学梅,严幻汝,等.甘肃河西走廊葡萄酒产区高产糖苷酶非酿酒酵母菌株筛选及其酿酒适应性分析[J].食品与发酵工业,2023,49(16):49-58.
[59]任学梅.高产风味酶非酿酒酵母筛选、鉴定及其在葡萄酒增香酿造中的应用[D].兰州:甘肃农业大学,2022.
[60]BELDA I,CONCHILLO L B,RUIZ J,et al.Selection and use of pectinolytic yeasts for improving clarification and phenolic extraction in winemaking[J].Int J Food Microbiol,2016,223:1-8.
[61]MARTÍN M C,MORATA DE AMBROSINI V I.Effect of a cold-active pectinolytic system on color development of Malbec red wines elaborated at low temperature[J].Int J Food Sci Technol,2014,49(8):1893-1901.
[62] ALIMARDANI-THEUIL P, GAINVORS-CLAISSE A, DUCHIRON F.Yeasts:An attractive source of pectinases-From gene expression to potential applications: A review[J].Process Biochem, 2011, 46(8): 1525-1537.
[63] MERIN M G,MORATA DE AMBROSINI V I.Kinetic and metabolic behaviour of the pectinolytic strain Aureobasidium pullulans GM-R-22 during pre-fermentative cold maceration and its effect on red wine quality[J].Int J Food Microbiol,2018,285:18-26.
[64]何曼,刘畅,朱凤妹,等.昌黎产区产酶酵母多样性及其应用潜力分析[J].食品与发酵工业,2020,46(5):59-67.
[65]卢晓华,蔡俊,林建国,等.响应面法优化囊酵母XHV25产果胶酶发酵培养基的研究[J].食品工业,2016,37(12):29-33.
[66]马延琴,徐晓裕,李甜,等.酿酒葡萄表皮产酶非酿酒酵母的筛选及其产酶特性研究[J].中国酿造,2021,40(12):149-154.
[67]JUEGA M,NUNEZ Y P,CARRASCOSA A V,et al.Influence of yeast mannoproteins in the aroma improvement of white wines[J].J Food Sci,2012,77(8):499-504.
[68] COSTA G, NICOLLI K, WELKE J, et al.Volatile profile of sparkling wines produced with the addition of mannoproteins or lees before second fermentation performed with free and immobilized yeasts[J].J Brazil Chem Soc,2018,29:1866-1875.
[69]GAMERO A,QUINTILLA R,GROENEWALD M,et al.High-throughput screening of a large collection of non-conventional yeasts reveals their potential for aroma formation in food fermentation[J].Food Microbiol,2016,60:147-159.
[70] MOREIRA N,PINA C,MENDES F, et al.Volatile compounds contribution of Hanseniaspora guilliermondii and Hanseniaspora uvarum during red wine vinifications[J].Food Control,2011,22(5):662-667.
[71] DUTRAIVE O, BENITO S, FRITSCH S, et al.Effect of sequential inoculation with non-Saccharomyces and Saccharomyces yeasts on riesling wine chemical composition[J].Fermentation,2019,5(3):79.
[72] HALL H, ZHOU Q, QIAN M C, et al.Impact of yeasts present during prefermentation cold maceration of pinot noir grapes on wine volatile aromas[J].Am J Enol Vitic,2017,68(1):81-90.
[73]李毅丽,李红玉,贺艳楠,等.混菌发酵对昌黎赤霞珠葡萄酒品质的影响[J].食品与发酵工业,2022,48(21):54-60.
[74]周洪江,姜文广,阮仕立,等.三种非酿酒酵母对贵人香白葡萄酒发酵进程及挥发性组分的影响[J].食品工业科技,2022,43(20):163-172.
[75] PORTARO L, MAIOLI F, CANUTI V, et al. Schizosaccharomyces japonicus/Saccharomyces cerevisiae mixed starter cultures:New perspectives for the improvement of Sangiovese aroma,taste,and color stability[J].LWT-Food Sci Technol,2022,156:113009.
[76]罗来庆,林海明,焦宇知,等.非酿酒酵母与酿酒酵母混合发酵对葡萄酒香气的影响[J].中国酿造,2022,41(10):89-94.
[77] GAMERO A, QUINNTILLA R, GROENEWALD M, et al.Highthroughput screening of a large collection of non-conventional yeasts reveals their potential for aroma formation in food fermentation[J].Food Microbiol,2016,60:147-159.
[78]BELDA I,RUIZ J,ESTEBAN-FERNANDEZ A,et al.Microbial contribution to wine aroma and its intended use for wine quality improvement[J].Molecules,2017,22(2):189.
[79] SCHUMANN C, MICHLMAYR H, EDER R, et al.Heterologous expression of Oenococcus oeni malolactic enzyme in Lactobacillus plantarum for improved malolactic fermentation[J].AMB Express,2012,2:19.
[80]SU J,WANG T,WANG Y,et al.The use of lactic acid-producing,malic acid-producing,or malic acid-degrading yeast strains for acidity adjustment in the wine industry[J].Appl Microbiol Biot,2014,98(6):2395-2413.
[81] BENITO S.The impacts of Lachancea thermotolerans yeast strains on winemaking[J].Appl Environ Microbiol,2018,102(16):6775-6790.
[82]SU J,WANG T,WANG Y,et al.The use of lactic acid-producing,malic acid-producing,or malic acid-degrading yeast strains for acidity adjustment in the wine industry[J].Appl Environ Microbiol, 2014, 98(6):2395-2413.
[83]TAING O,TAING K.Production of malic and succinic acids by sugartolerant yeast Zygosaccharomyces rouxii[J].Eur Food Res Technol,2006,224(3):343-347.
[84] APLIN J J, WHITE K P, EDWARDS C G.Growth and metabolism of non-Saccharomyces yeasts isolated from Washington state vineyards in media and high sugar grape musts[J].Food Microbiol,2019,77: 158-165.
[85]GIARAMIDA P,PONTICELLO G,MAIO S D,et al.Candida zemplinina for production of wines with less alcohol and more glycerol[J].S Afr J Enol Vitic,2013,34:204-211.
[86] CIANI M, PICCIOTTI G.The growth kinetics and fermentation behaviour of some non-Saccharomyces yeasts associated with wine-making[J].Biotechnol Lett,1995,17:1247-1250.
[87]VAQUERO C,LOIRA I,BANUELOS MA,et al.Industrial performance of several Lachancea thermotolerans strains for pH control in white wines from warm areas[J].Microorganisms,2020,8(6):830.
[88]VIDAL S,WILLIAMS P,DOCO T,et al.The polysaccharides of red wine:total fractionation and characterization[J].Carbohyd Polym, 2003, 54(4):439-447.
[89] DOMIZIO P, LIU Y, BISSON L F, et al.Use of non-Saccharomyces wine yeasts as novel sources of mannoproteins in wine[J].Food Microbiol,2014,43:5-15.
[90] PEREZ-TRAVES L, QUEROL A, PEREZ-TORRADO R.Increased mannoprotein content in wines produced by Saccharomyces kudriavzevii×Saccharomyces cerevisiae hybrids[J].Int J Food Microbiol,2016,237:35-38.
[91] DOMIZIO P, ROMANI C, LENCIONI L, et al.Outlining a future for non-Saccharomyces yeasts:selection of putative spoilage wine strains to be used in association with Saccharomyces cerevisiae for grape juice fermentation[J].Int J Food Microbiol,2011,147(3):170-180.
[92] COETZEE C, DU TOIT W J.A comprehensive review on Sauvignon blanc aroma with a focus on certain positive volatile thiols[J].Food Res Int,2012,45(1):287-298.
[93] FERREIRA V,SAENZ-NAVAJAS M P, CAMPO E, et al.Sensory interactions between six common aroma vectors explain four main red wine aroma nuances[J].Food Chem,2016,199:447-456.
[94] RENAULT P, COULON J, MOINE V, et al.Enhanced 3-Sulfanylhexan-1-ol production in sequential mixed fermentation with Torulaspora delbrueckii/Saccharomyces cerevisiae reveals a situation of synergistic interaction between two industrial strains[J].Front Microbiol,2016,7:293.
[95]PUERTAS B,JIMENEZ M J,CANTOS-VILLARIE,et al.Use of Torulaspora delbrueckii and Saccharomyces cerevisiae in semi-industrial sequential inoculation to improve quality of Palomino and Chardonnay wines in warm climates[J].J Appl Microbiol,2017,122(3):733-746.
[96] ANFANG N, BRAJKOVICH M, GODDARD M R.Co-fermentation with Pichia kluyveriincreases varietal thiol concentrations in Sauvignon Blanc[J].Aust J Grape Wine R,2009,15(1):1-8.
[97] DUTRAIVE O, BENITO S, FRITSCH S, et al.Effect of sequential inoculation with non-Saccharomyces and Saccharomyces yeasts on riesling wine chemical composition[J].Fermentation,2019,5(3):79.
[98] SADOUDI M, TOURDOT-MARECHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J].Food Microbiol,2012,32(2):243-253.
[99]张鸣宇,罗莉莎,高特,等.本土美极梅奇酵母对玫瑰香葡萄酒降醇及香气的影响[J].中国酿造,2023,42(1):133-141.
[100]LIU S Q,PILONE G.An overview of formation and roles of acetaldehyde in winemaking with emphasis on microbiological implications[J].Int J Food Sci Technol,2000,35:49-61.