氯酸盐和高氯酸盐具有高稳定、高溶解和快速迁移等特性[1],可通过自然水系的迁移,给地表水、土壤、植物带来污染,再通过食物链逐级富集于食品中。植物种植过程中使用的农药、化肥、灌溉用水,食品加工过程中含氯消毒剂的使用以及包装材料的迁移都可能成为植物氯酸盐和高氯酸盐的污染来源。经毒性测试表明,氯酸盐和高氯酸盐会对碘缺乏的年轻群体及碘缺乏症母乳喂养的婴儿甲状腺功能有严重影响[2-3]。目前,我国对氯酸盐、高氯酸盐的监测主要针对各类水体[4-7]、茶叶[8-11]、蔬菜水果[12-13]、肉类[13]、粮食作物[14-16]、牛奶及乳制品[17]、海产品[13]等,其质量浓度水平为0.3~115 μg/kg。欧盟食品科学委员会(European scientific committee on food,SCF)建议食品中的限量为0.05 mg/kg[18]。欧盟(European union,EU)委员会发布2020/685号条例规定了茶叶中高氯酸盐的最大残留量为0.75 mg/kg[19],我国颁布的GB 5749—2022《生活饮用水卫生标准》规定了氯酸盐和高氯酸盐的的限量分别为0.7 mg/L和0.07 mg/L[20]。我国尚未制定食品中氯酸盐与高氯酸盐的限值标准,因此对食品中该物质残留量的监测非常必要。
氯酸盐、高氯酸盐的检测受基质影响大,要求检测方法灵敏度更高,选择性强。随着高分辨色谱质谱联用技术的发展,对于这种痕量离子含量分析测定已成功的解决了“未检出”、“假阳性”等问题。氯酸盐和高氯酸盐的主要检测方法以离子色谱(ion chromatography,IC)法[21]、离子色谱-串联质谱(ionchromatography-tandemmassspectrometry,IC-MS/MS)法[22-25]和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[26-31]居多。其中IC-MS/MS和LC-MS/MS方法灵敏度高、干扰小,能够在较短的时间内同时测定。我国现行的标准有BJS201706《食品中氯酸盐和高氯酸盐的测定》补充方法[32]和SN/T 4089—2015《进出口食品中高氯酸盐的测定》[33]。两个标准均不涵盖枸杞产品,前处理方法也不完全适用于枸杞产品,且方法成本较高。枸杞作为宁夏特色产品,在种植、采收运输、生产加工、包装流通环节中都有可能被高氯酸盐和氯酸盐污染,由于标准的缺失,导致枸杞中氯酸盐和高氯酸盐检测技术缺乏,风险监测缺失,给枸杞质量安全带来了隐患。
本研究建立了热水浴提取-分散固相萃取(dispersive solid phase extraction,DSPE)净化-超高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)测定枸杞干果、鲜果中氯酸盐和高氯酸盐含量的方法,以期解决无枸杞中氯酸盐和高氯酸盐检测方法的问题,为枸杞质量安全控制提供技术保障。
1 材料与方法
1.1 材料与试剂
枸杞鲜果和枸杞干果:2021年银川枸杞基地。
氯酸钠标准溶液(1 000 mg/L)、高氯酸钠标准溶液(1 000 mg/L)(纯度均>99%):上海安谱璀世标准技术服务有限公司;甲醇、乙腈(均为色谱纯):德国Merck公司;甲酸、甲酸铵(均为色谱纯):美国Fisher Scientic公司;CNWBOND石墨化碳黑(graphitized carbon black,GCB)、C18净化材料(40~63μm):ANPLELaboratoryTechnologies(Shanghai)Inc.。
1.2 仪器与设备
AB SCIEX QTRAP 5500超高效液相色谱-三重四级杆质谱联用仪:美国应用生物系统公司;ZWF-110X50恒温水浴振荡器:上海智城分析仪器制造有限公司;LD5-2A型高速冷冻离心机:北京医用离心机厂;KQ5200DE数控超声波清洗器:昆山市超生仪器有限工司;VG3 S025涡旋混合器:德国IKA公司。
1.3 方法
1.3.1 标准溶液的配制
混合标准中间液:分别准确量取1 000 mg/L的氯酸钠和高氯酸钠标准溶液0.25 mL,于25 mL容量瓶中,用超纯水稀释至刻度,摇匀,制成10.0 mg/L氯酸盐、高氯酸盐混合标准中间液,4 ℃保存。
混合标准工作溶液:分别准确量取混合标准中间液2.50 mL,用超纯水稀释至刻度,摇匀,制成1.0 mg/L的氯酸盐、高氯酸盐混合标准工作液,4 ℃保存。
1.3.2 样品及样品供试液的制备
枸杞鲜果、干果样品于-18 ℃冰箱中冷冻保存,试验时鲜样用高速组织捣碎机打浆,干样用高速万能粉碎机(可加少量的液氮)粉碎,分别置于样品瓶中,-18 ℃冷冻备用。
鲜果样品供试液的制备:准确称取5.00 g(精确至0.01 g)枸杞鲜果置于50 mL具塞离心管中,准确加入7 mL超纯水,在60 ℃恒温水浴振荡器中振荡30 min,冷却后再准确加入13 mL甲醇,涡旋5 min,4 000 r/min常温离心5 min,取1 mL上清液于15 mL离心管中(提前称50 mg C18和20 mg GCB)涡旋净化后离心5 min,过滤,上清液过0.20 μm微孔滤膜,用超高效液相色谱-质谱/质谱测定。
干果样品供试液的制备:准确称取2.50 g(精确至0.01 g)枸杞干果置于50 mL具塞离心管中,准确加入7 mL超纯水,在60 ℃恒温水浴振荡器中振荡30 min,冷却后再准确加入13 mL甲醇,涡旋5 min,4 000 r/min常温离心5 min,取1 mL上清液于15mL离心管中(提前称150 mg C18和40 mg GCB)涡旋净化后离心5 min,过滤,上清液过0.20 μm微孔滤膜,用液相色谱-质谱/质谱测定。
1.3.3 基质混合标准溶液
分别准确量取0、25 μL、50 μL、125 μL、200 μL、500 μL、700 μL、1 000 μL质量浓度为1.0 mg/L混合标准工作液,使用方法1.3.2处理的空白基质枸杞样品溶液稀释并定容至10.0 mL。氯酸盐、高氯酸盐系列基质标准溶液质量浓度依次为:0、2.50 ng/mL、5.00 ng/mL、12.5 ng/mL、20.0 ng/mL、50.0 ng/mL、70.0 ng/mL、100 ng/mL。
1.3.4 超高效液相色谱-串联质谱条件
液相色谱条件:AcclaimTRINITY P1复合离子交换柱(100 mm×2.1mm,3 μm);流动相A为乙腈,B为20 mmol/L甲酸铵溶液。梯度洗脱:0.2~3.0 min,30%B线性降到10%B;3.0~7.0 min,10%B;7.0~8.0 min,10%B升至30%B;8.0~10.0 min,30%B;流速:0.4 mL/min;柱温:35 ℃;进样量:2 μL。
三重四级杆质谱条件:电喷雾离子(electrospray ionization,ESI)源;确定氯酸盐和高氯酸盐母离子均为[M-H]-。再以各化合物的分子离子峰为母离子,进行子离子全扫描,得到碎片离子信息,选择离子对83.0/67.0与85.0/69.0作为氯酸盐的定性离子对,离子对83.0/67.0为定量离子对;99.0/83.0与101.0/85.0作为高氯酸盐的定性离子对,99.0/83.0作为高氯酸盐的定量离子对;离子源温度:500 ℃;离子化电压:-4 500 V;雾化气压力:20 psi;气帘气压力:40 psi;去簇电压DP均为-120 V,氯酸盐、高氯酸盐碰撞能量分别为-22 eV、-25 eV、-25 eV、-30 eV;多反应监测(multiple reaction monitoring,MRM)模式采集数据。
定性、定量方法:采用保留时间和离子对定性;基质外标法定量。
1.3.5 提取条件优化
分别考察不同提取溶剂(水-甲醇、水-乙腈)、提取剂水-甲醇体积(mL)(5+15、7+13、8+12、10+10)、提取温度(20 ℃(室温)、40℃、50℃、60℃)、提取时间(20min、30min、40min)、提取方式(超声、涡旋、振荡)、称样量(枸杞干果:1.0 g、1.5 g、2.0 g、2.5 g、3.0 g;枸杞鲜果:2.0 g、5.0 g、10.0 g)、净化材料(枸杞干果:C18(50 mg、100 mg、150 mg、200 mg),GCB(20 mg、40 mg、60 mg、100 mg),C18 150 mg与GCB 40 mg组合;枸杞鲜果:C18(50 mg、70 mg、100 mg、200 mg),GCB(10 mg、20 mg、40 mg),C18 50 mg与GCB 20 mg组合)。
2 结果与分析
2.1 提取条件优化
2.1.1 提取溶剂对提取效率的影响
枸杞属于高糖、高蛋白的物质,甲醇和乙腈能较好地沉淀蛋白质去除基质干扰。氯酸盐和高氯酸盐在水中具有高溶解性,故试验采用水和有机相相结合提取。结果表明,采用水-甲醇和水-乙腈作为提取剂,其回收率无显著差别。水-乙腈提取沉淀蛋白效果好,但离心后提取液会出现分层,上下层氯酸盐和高氯酸盐含量有差别。采用水-甲醇提取,离心后提取液不存在分层现象,待测样液中氯酸盐和高氯酸盐的峰型尖锐,基质干扰小,灵敏度高,氯酸盐和高氯酸盐的平均回收率分别为80.1%~91.3%、79.1%~89.3%。因此,确定水-甲醇作为最佳提取剂。
2.1.2 提取剂体积对提取效率的影响
由表1可知,提取剂为水+甲醇=7+13(mL)时氯酸盐和高氯酸盐回收率较高,分别为105.3%~108.1%、79.1%~89.3%。因此,确定最佳提取剂为水+甲醇体积为7+13(mL)。
表1 水+甲醇体积对氯酸根离子和高氯酸根离子回收率的影响
Table 1 Effect of water and methanol volume on chlorate ion and perchlorate ion recovery rates
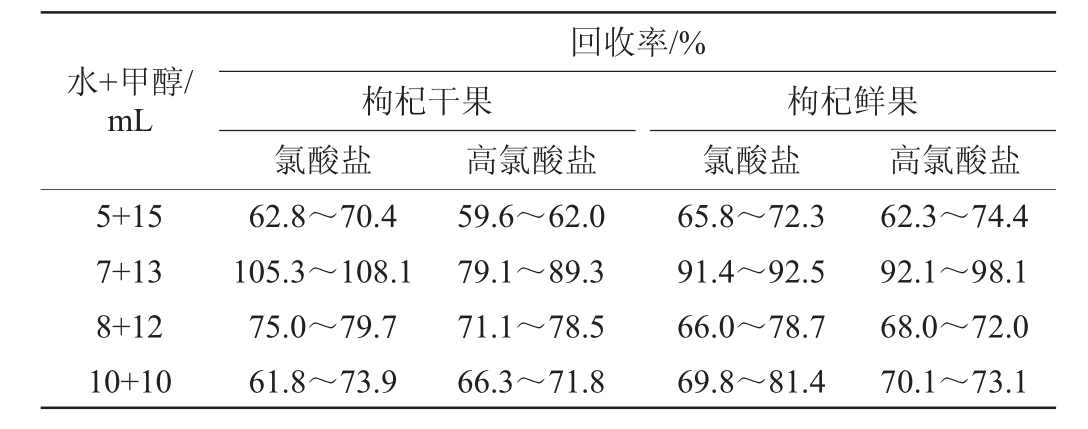
水+甲醇/mL回收率/%枸杞干果氯酸盐高氯酸盐枸杞鲜果氯酸盐 高氯酸盐5+15 7+13 8+12 10+10 62.8~70.4 105.3~108.1 75.0~79.7 61.8~73.9 59.6~62.0 79.1~89.3 71.1~78.5 66.3~71.8 65.8~72.3 91.4~92.5 66.0~78.7 69.8~81.4 62.3~74.4 92.1~98.1 68.0~72.0 70.1~73.1
2.1.3 水浴温度对提取效率的影响
由图1可知,随着水溶提取温度在20~60 ℃范围内的升高,氯酸盐和高氯酸盐的提取率增加,当水溶提取温度达60 ℃时,枸杞干果、鲜果中氯酸盐和高氯酸盐的平均回收率达最高值,枸杞干果的平均回收率分别为106.7%和91.6%;枸杞鲜果的平均回收率分别为96.0%和102.0%,满足分析要求。因此,确定最佳水溶提取温度为60 ℃。
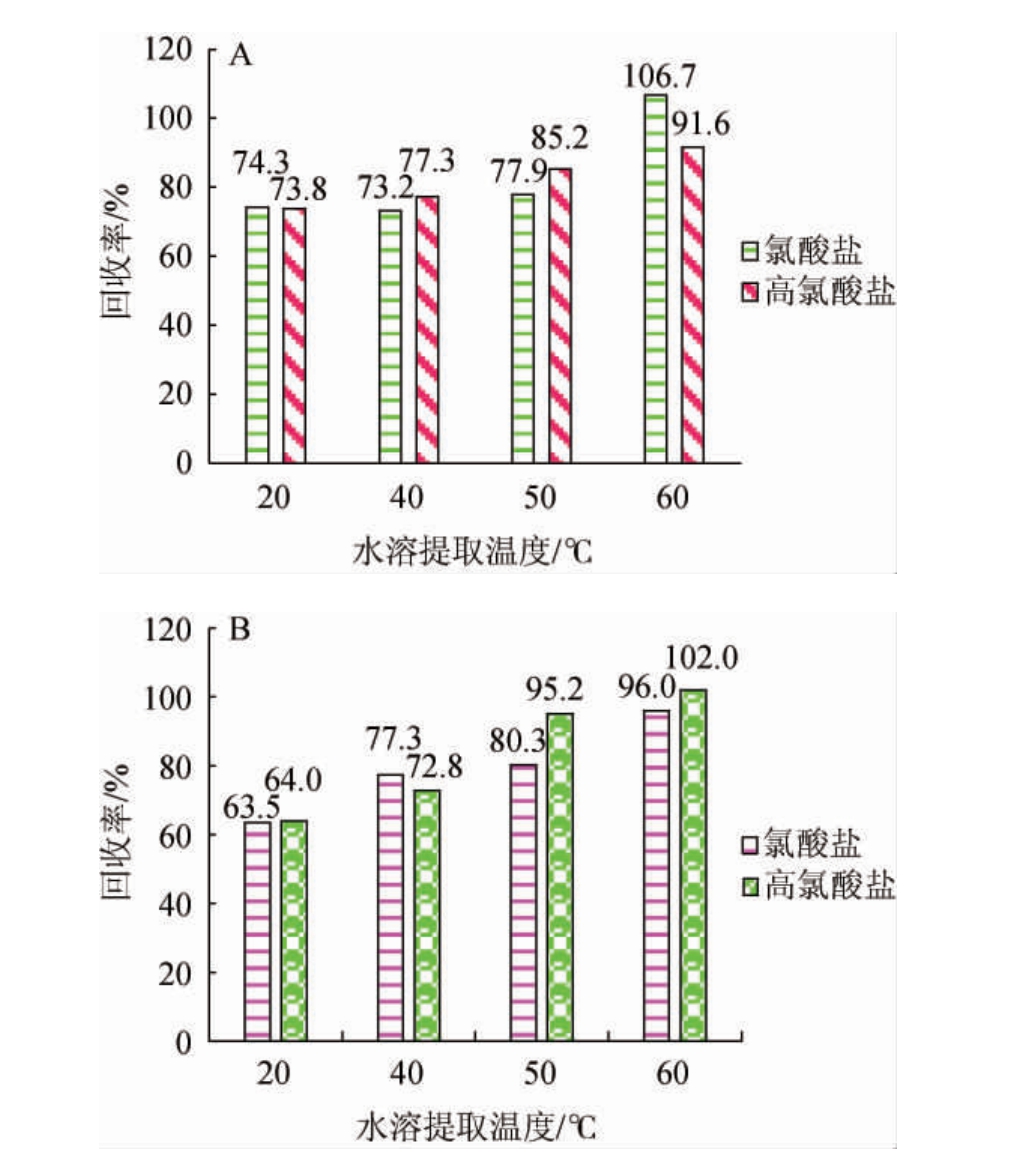
图1 水浴温度对枸杞干果(A)、鲜果(B)中氯酸盐和高氯酸盐回收率的影响
Fig.1 Effect of water bath temperature on recovery rates of chlorate and perchlorate in dried (A) and fresh (B) wolfberry
2.1.4 水浴时间对提取效率的影响
由图2可知,当水浴提取时间为20~30 min时,枸杞干果、鲜果中氯酸盐和高氯酸盐的提取率均增加;当水浴提取时间为30 min时,枸杞干果、鲜果中氯酸盐和高氯酸盐的平均回收率达最高值,枸杞干果中氯酸盐和高氯酸盐的平均回收率为92.6%和96.8%;枸杞鲜果中氯酸盐和高氯酸盐的平均回收率为93.3%和101.6%,满足分析要求。因此,确定最佳水浴提取时间为30 min。

图2 水浴时间对枸杞干果(A)、鲜果(B)中氯酸盐和高氯酸盐回收率的影响
Fig.2 Effect of water bath time on recovery rates of chlorate and perchlorate in dried (A) and fresh (B) wolfberry
2.1.5 水浴提取后不同提取方式和提取时间对提取效率的影响
由图3可知,与振荡和超声提取相比,涡旋提取时间较短。涡旋提取5 min时,枸杞干果中氯酸盐和高氯酸盐的平均回收率为86.1%和93.8%;鲜果中氯酸盐和高氯酸盐的平均回收率为88.8%和87.4%。超声提取时,随着提取时间增加,提取率先增加后下降,提取20 min时,干果和鲜果的氯酸盐和高氯酸盐提取率最高。振荡提取时,随提取时间增加,提取率先增加后降低,在提取时间为20 min时,干果和鲜果中氯酸盐和高氯酸盐的提取效率最大。综合考虑,实验选取涡旋提取5 min。

图3 超声(A)、涡旋(B)、振荡(C)提取时间对枸杞干果、鲜果中氯酸盐和高氯酸盐回收率的影响
Fig.3 Effect of ultrasound (A), vortex (B), and oscillation (C) on recovery rates of chlorate and perchlorate in dried and fresh wolfberry
2.1.6 称样量对提取效率的影响
当干果称样量在1.0~3.0 g范围内增加时,回收率先增加后降低,当称样量为2.5 g时,氯酸盐和高氯酸盐的平均回收率最高,为96.1%和101.0%;鲜果称样量为2.0~10.0 g时,回收率增加,鲜果称样量为5.0 g时,氯酸盐和高氯酸盐的回收率最高,分别达到93.0%和102.0%;当鲜果称样量为10.0 g时,样品量太大导致回收率下降,且样品杂质对色谱柱有一定污染。因此,确定干果称样量为2.5 g、鲜果为5.0 g。
2.1.7 净化材料对提取效率的影响
枸杞含糖量高、色素重,基质干扰严重。净化材料C18可以吸附脂质和糖类等非极性杂质[34],GCB作为弱极性或非极性吸附剂,能有效去除色素、类胡萝卜素和甾醇等非极性化合物[35]。不同净化材料用量对枸杞干果、鲜果中氯酸盐和高氯酸盐提取率的影响见图4。

图4 不同净化材料用量对枸杞干果(A)、鲜果(B)中氯酸盐和高氯酸盐回收率的影响
Fig.4 Effect of different purification materials dosages on recovery rates of chlorate and perchlorate in dried (A) and fresh (B) wolfberry
由图4A可知,以枸杞干果为样品,当C18添加量为50~200 mg时,氯酸盐回收率为52.8%~98.8%,高氯酸盐的回收率为51.2%~85.1%,当C18添加量为150 mg时,氯酸盐和高氯酸盐的回收率最高,分别为98.8%和85.1%。当GCB添加量为20~100 mg时,氯酸盐回收率为68.4%~94.4%,高氯酸盐的回收率为51.8%~89.5%,当GCB添加量为40 mg时,氯酸盐和高氯酸盐的回收率最高,分别为94.4%和89.5%。选择C18和GCB联合使用作为净化吸附剂,当C18 150 mg和GCB 40 mg组合使用时,氯酸盐和高氯酸盐的回收率达到最大值,分别为98.3%、89.5%,满足分析要求。
由图4B可知,以枸杞鲜果为样品,当C18添加量为50~200 mg时,两种离子的回收率随C18用量增加而降低,C18用量分别为70 mg和50 mg时,氯酸盐、高氯酸盐的回收率最高,两种离子回收率分别为85.5%和98.8%及86.0%和95.0%,综合考虑,确定C18添加量为50 mg。当GCB添加量为10~40 mg时,两种离子回收率呈先增加后降低的趋势,当GCB添加量为20 mg时,氯酸盐和高氯酸盐回收率最高,分别为86.9%和100.3%。选择C18和GCB联合使用作为净化吸附剂,组合使用C18 50 mg和GCB 20 mg组合使用效果好,氯酸盐和高氯酸盐的回收率达到最大值,分别为96.0%、102.0%,满足分析要求。
2.2 方法学考察
2.2.1 工作曲线、检出限和定量限
配制两种离子的基质混合标准溶液,以定量离子峰面积(y)为纵坐标,基质标准溶液质量浓度(x)为横坐标,绘制标准曲线,得到标准曲线回归方程,结果见表2。
表2 氯酸盐和高氯酸盐线性回归方程、线性范围、检出限和定量限
Table 2 Linear regression equation, linear range, detection limit and quantitation limit of chlorate and perchlorate

化合物 基质 线性范围/(ng·mL-1) 线性方程 相关系数r 检出限/(μg·kg-1) 定量限/(μg·kg-1)氯酸盐高氯酸盐枸杞干果枸杞鲜果枸杞干果枸杞鲜果1.0~100 1.0~100 0.5~100 0.5~100 y=20 462x-207 568 y=775 017x-858 500 y=1 932 166x-1 753 250 y=4 995 940x-4 748 357 0.998 9 0.999 2 0.998 4 0.999 0 1.0 1.0 0.5 0.5 10.0 10.0 5.0 5.0
由表2可知,氯酸盐在1.0~100.0 ng/mL范围内线性关系良好,回归方程分别为y=20 462x-207 568和y=775 017x-858 500,相关系数r为0.998 9和0.999 2;高氯酸盐在0.5~100.0 ng/mL范围内线性良好,回归方程分别为y=1 932 166x-1 753 250和y=4 995 940x-4 748 357,相关系数r为0.998 4和0.999 0。方法检出限(limitof detection,LOD)(S/N=3)、定量限(limit of quantitation,LOQ)通过加标回收的方法确定。当试样量为2.5 g,定容体积20.0 mL时,干果中氯酸盐的检出限为1.0 μg/kg、定量限为10.0 μg/kg;高氯酸盐的检出限为0.5 μg/kg、定量限为5.0 μg/kg。鲜果称样量为5.0 g,定容体积20.0 mL时,氯酸盐的检出限为1.0 μg/kg,定量限10.0 μg/kg;高氯酸盐的检出限为0.5 μg/kg,定量限为5.0 μg/kg。
2.2.2 回收率及精密度试验
干果中分别加入20 μg/kg、50 μg/kg、100 μg/kg氯酸盐和高氯酸盐标准溶液,鲜果中分别加入10 μg/kg、40 μg/kg、50 μg/kg的氯酸盐和高氯酸盐标准溶液,按本方法条件测定并计算回收率,平行制备样品溶液5份,检测结果见表3。由表3可知,在不同添加浓度下,干果中氯酸盐和高氯酸盐平均回收率分别为89.9%、93.4%、90.5%和76.8%、93.6%、91.4%,精密度实验结果的相对标准偏差(relative standard deviation,RSD)值分别小于11.0%和12.0%;鲜果中氯酸盐和高氯酸盐平均回收率分别为73.8%、94.9%、85.8%和61.2%、90.5%、88.9%,精密度实验结果的RSD值分别小于11.0%和17.0%。方法准确度和精密度良好。与BJS201706补充方法[32]比较,该方法专属性强、准确度高、节约成本。
表3 加标回收率及精密度试验结果
Table 3 Results of adding standard recovery and precision tests
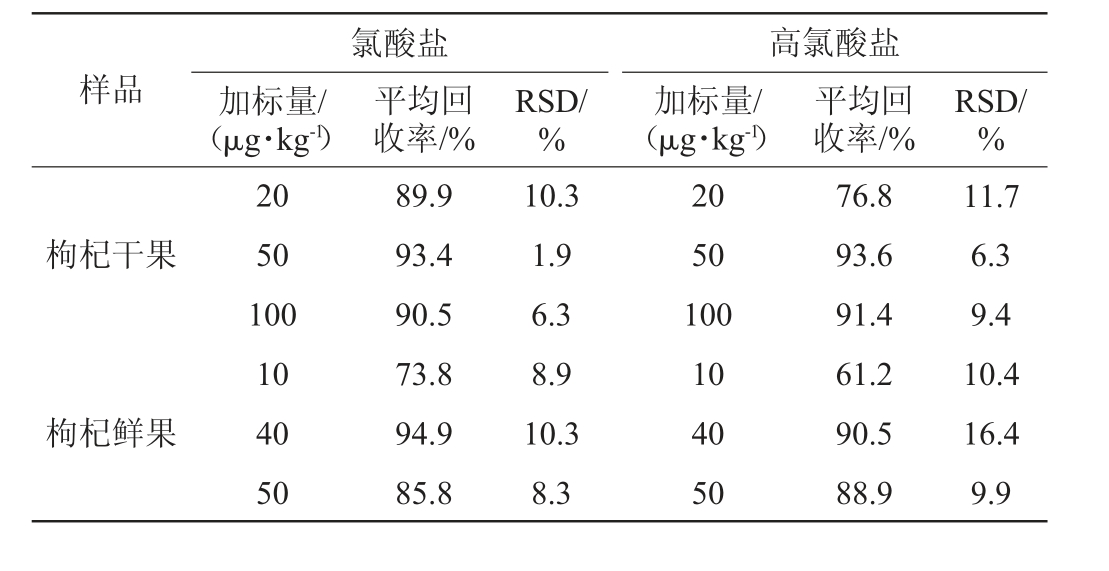
样品氯酸盐加标量/(μg·kg-1)平均回收率/%RSD/%高氯酸盐加标量/(μg·kg-1)平均回收率/%RSD/%枸杞干果枸杞鲜果20 50 100 10 40 50 89.9 93.4 90.5 73.8 94.9 85.8 10.3 1.9 6.3 8.9 10.3 8.3 20 50 100 10 40 50 76.8 93.6 91.4 61.2 90.5 88.9 11.7 6.3 9.4 10.4 16.4 9.9
2.2.3 实际样品测定
采用本方法测定了10 份基地采摘的枸杞样品,样品中检出了一定量的氯酸盐和高氯酸盐,其含量分别为0~6.45 μg/kg和2.70~10.2 μg/kg,与欧盟规定的干茶叶中高氯酸盐限量值0.75 mg/kg相比[19]不存在超限量值问题。
3 结论
本研究建立了枸杞干果、鲜果中氯酸盐和高氯酸盐含量测定的热水浴提取-分散固相萃取净化-超高效液相色谱-串联质谱分析方法。结果表明,枸杞干果、鲜果中氯酸盐和高氯酸盐均分别在1.0~100.0 ng/mL、0.5~100.0 ng/mL范围内线性关系良好,相关系数r分别为0.998 9和0.999 2及0.998 4和0.999 0。氯酸盐检出限(LOD)为1.0 μg/kg、定量限(LOQ)为10.0 μg/kg;高氯酸盐LOD为0.5 μg/kg、LOQ为5.0 μg/kg。干果中氯酸盐和高氯酸盐平均加标回收率分别为89.9%~93.4%和76.8%~93.6%,相对标准偏差(RSD)分别小于11.0%和12.0%;鲜果中氯酸盐和高氯酸盐平均加标回收率分别为73.8%~94.9%和61.2%~90.5%,RSD分别小于11.0%和17.0%。方法用于实际样品检测,氯酸盐和高氯酸盐均检出。方法准确度和精密度良好,可满足枸杞中氯酸盐和高氯酸盐含量测定要求。研究结果在枸杞氯酸盐、高氯酸盐风险监测中可广泛应用,有望为枸杞质量安全控制提供技术保障。
[1] MILLER M D, CROFTON K M, RICE D C, et al.Thyroid-disrupting chemicals:interpreting upstream biomarkers of adverse outcomes[J].Environ Health Perspect,2009,117(7):1033-1041.
[2]宋正规,沈坚,张爱芝,等.高氯酸盐毒性及其检测方法研究进展[J].食品工业科技,2018,39(8):341-347,351.
[3]田一媚,宫智勇.食品中高氯酸盐的污染现状及毒理作用研究进展[J].食品科学,2020,41(5):276-281.
[4]陈文秀,何纳轮,史亚利,等.我国人群高氯酸盐暴露途径及贡献率分析[J].科学通报,2020,65(14):1387-1394.
[5]史亚利,高健民,李鑫,等.浏阳河水、底泥和土壤中高氯酸盐的污染[J].环境化学,2010,29(3):388-391.
[6]刘勇建,牟世芬,林爱武,等.北京市饮用水中溴酸盐、卤代乙酸及高氯酸盐研究[J].环境科学,2004(2):51-55.
[7]WU Q,ZHANG T,SUN H,et al.Perchlorate in tap water,groundwater,surface waters,and bottled water from China and its association with other inorganin anions and disinfection by products[J].Arch Environ Contatin Toxicol,2010,58(3):543-550.
[8]华永有,李宇翔,林宏琳,等.茶叶中高氯酸盐检测与污染情况分析[J].海峡预防医学杂志,2018,24(1):4-6,12.
[9] LIU Y, SUN H Z, ZHOU L, et al.Quantitative determination and contamination pattern of perchlorate in tea by ultra performance liquid chromatography and tandem mass spectrometry[J].Food Chem, 2019, 274:180-186.
[10]邓家军,张莉,廖健,等.茶叶中高氯酸盐健康风险研究[J].乡村科技,2016(36):42.
[11]邓家军,潘华,张富生,等.茶叶高氯酸盐污染及分析技术[J].茶叶科学,2019,39(4):372-381.
[12]董晶晶,王英杰,方敏,等.武汉市多种食品高氯酸盐的检测与暴露评估[C]//中国食品科学技术学会,中国食品科学技术学会第十六届年会暨第十届中美食品业高层论坛论文摘要集,2019:68-69.
[13]宇盛好,李亦奇,张旭晟,等.上海市市售食品中高氯酸盐污染的暴露评估[J].上海预防医学,2017,29(6):426-430.
[14]刘恋.粮食主产区谷物中高氯酸盐的暴露水平及其在稻谷中分布规律[D].武汉:武汉轻工大学,2019.
[15]杨佳佳.中国居民膳食高氯酸盐和溴酸盐暴露水平研究[D].武汉:武汉工业学院,2012.
[16]YE L,YOU H,YAO J,et al.Seasonal variation and factors influencing perchlorate in water, snow, soil and corns in Northeastern China[J].Chemosphere,2013,90(10):2493-2498.
[17]许浩.高氯酸盐在婴幼儿食品中的暴露评估及其体外生物利用率[D].武汉:武汉轻工大学,2019.
[18] Scientific Committee on Food.Opinion of the Scientfic Committee on Food on the 23th additional list of monomers and additives for food contact materials[EB/OL](2002-09-2)[2022-11-01].https://cdn.shopify.com/s/files/1/2234/2707/files/iodine-ul-upper-intake-limit.pdf?1912130-360668524537.
[19]欧盟委员会.欧盟委员会发布(EU)2020/685 号条例[EB/OL].(2020-7-1)[2022-11-01].https://www.puercn.com/news/69609.
[20]国家市场监督管理总局,国家标准化管理委员会.GB 5749—2022 生活饮用水卫生标准[S].北京:中国标准出版社,2022.
[21]张振城,于雪荣,单晓梅,等.饮用水中高氯酸盐的离子色谱测定法[J].职业与健康,2018,34(1):40-43.
[22]刘小芳,方从容,刘慧,等.离子色谱-串联质谱法检测茶叶中的高氯酸盐[J].色谱,2016,34(10):986-988.
[23]孙文闪,诸骏杰,余鹏飞,等.分散固相萃取净化离子色谱-串联质谱测定茶叶中高氯酸盐[J].食品安全质量检测学报,2019,10(20):6927-6932.
[24]张萍,史亚利,蔡亚岐,等.离子色谱-质谱联用测定牛奶中的高氯酸盐、溴酸盐和碘离子[J].分析测试学报,2007(5):690-693.
[25]孙文闪,周敏,刘芯成,等.同位素稀释离子色谱-串联质谱法同时测定食品中的氯酸盐和高氯酸盐[J].食品安全质量检测学报,2018,9(14):3679-3685.
[26]邵琳智,吴映璇,欧阳少伦,等.离子交换高效液相色谱-串联质谱法测定鸡肉和鸡肝中的高氯酸盐[J].食品科学,2016,37(20):167-171.
[27]吴映璇,林峰,姚仰勋,等.固相萃取/18O标记高氯酸根稀释高效液相色谱-串联质谱法测定水果中的高氯酸盐[J].分析测试学报,2016,35(3):355-358.
[28]刘艳英,吴敏,林立毅,等.高效液相色谱串联质谱法测定牛奶中的高氯酸盐[J].分析测试学报,2011,30(7):821-824.
[29]彭西甜,夏珍珍,胡西洲,等.分散固相萃取-超高效液相色谱-串联质谱法测定茶叶中的高氯酸盐[J].分析科学学报,2020,36(2):275-279.
[30]韩超,吴娟,楼成杰,等.TurboFlow在线净化-液相色谱-串联质谱法测定茶叶中的高氯酸盐残留量[J].分析科学学报,2022,38(1):129-132.
[31]王骏,胡梅,张卉,等.液相色谱-质谱测定饮用水中的溴酸盐和高氯酸盐[J].食品科学,2010,31(10):244-246.
[32]国家食品药品监督管理总局.BJS 201706 食品中氯酸盐和高氯酸盐的测定[EB/OL].(2020-12-02).http://down.foodmate.net/wap/index.php?itemid=58642&moduleid=24.
[33]中华人民共和国国家质量监督检验检疫总局.SN/T 4089—2015 出口食品中高氯酸盐的测定液相色谱-质谱/质谱法[S].北京:中国标准出版社,2015.
[34] XIAO Y P, DONG H, WU Y L, et al.Qu ECh ERS-based purification method coupled to ultrahigh performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) to determine six quaternary ammonium compounds(QACs)in dairy products[J].Food Chem,2016,212:96-103.
[35] DONG H, XIAO K J.Modified QuEChERS combined with ultra high performance liquid chromatography tandem mass spectrometry to determine seven biogenic amines in Chinese traditional condiment soy sauce[J].Food Chem,2017,229:502-508.